-
Medical journals
- Career
Laryngotracheoezofageální rozštěp
Authors: P. Dytrych 1; R. Katra 1; M. Jurovčík 1; D. Karmanová 2; J. Šnajdauf 3; Z. Kabelka 1
Authors‘ workplace: Klinika ušní, nosní a krční 2. LF UK a FN v Motole, Praha, přednosta doc. MUDr. Z. Kabelka, Ph. D. 1; Klinika anesteziologie a resuscitace 2. LF UK a FN v Motole, Praha, přednosta prof. MUDr. K. Cvachovec, CSc., MBA 2; Klinika dětské chirurgie 2. LF UK a FN v Motole, Praha, přednosta prof. MUDr. J. Šnajdauf, DrSc. 3
Published in: Otorinolaryngol Foniatr, 60, 2011, No. 1, pp. 8-11.
Category: Original Article
Overview
Laryngotracheoezofageální rozštěp (LTER) je vzácná vrozená anomálie, při které nedojde k oddělení dýchacích a polykacích cest a ve střední čáře vzniká v různém rozsahu defekt v oblasti zadní stěny hrtanu, průdušnice a přední stěny hltanu a jícnu. Cílem chirurgického výkonu je rozdělení aerodigestivního kompartmentu do dvou fungujících traktů bez nutnosti závislosti na tracheostomii, s možností normální fonace a prevencí polykacích obtíží. V letech 1999 - 2009 jsme na Klinice ušní, nosní a krční 2. LF UK v Praze ve spolupráci s Klinikou dětské chirugie 2. LF UK FNM operovali 4 děti s LTER III. typu klasifikace dle Benjamina a Iglise. Ve většině případů jsme volili zevní přední krční přístup s interpozicí štěpu. V pooperačním období jsme zaznamenali komplikaci u jednoho pacienta, a to respirační insuficienci způsobenou tracheomalácií. Úspěšná léčba LTER závisí na včasné diagnóze, prevenci aspirace a gastroezofageálního refluxu, adekvátní výživě a včasném chirugickém výkonu.
Klíčová slova:
laryngotracheoezofageální rozštěp, endoskopie, přední krční přístup.ÚVOD
Laryngotracheoezofageální rozštěp (LTER) je vzácná vrozená anomálie, při které nedojde k oddělení dýchacích a polykacích cest a ve střední čáře vzniká v různém rozsahu defekt v oblasti zadní stěny hrtanu, průdušnice a přední stěny hltanu a jícnu. V počátcích embryonálního vývoje je primitivní trávicí trubice rozdělena na přední, střední a zadní střevo. Přibližně ve 3. gestačním týdnu se kaudokraniálně v oblasti předního střeva vyvíjí trachozeofageální septum, které rozdělí přední střevo na budoucí jícen a základ respirační trubice. Laryngeální chrupavky a svaly hrtanu se vyvíjejí z mezenchymu 4.-6. žaberního oblouku, krikoidní chrupavka vzniká oboustrannou kalcifikací 6. žaberního oblouku, které se v přibližně 40. dni gestace spojují ventrálně a o týden později dorzálně. Dle některých hypotéz porucha růstu tracheoezofageálního septa kraniálním směrem způsobí, že nedojde k dorzálnímu spojení krikoidních lamin a v důsledku toho vznikne LTER.
Poprvé se o LTER zmínil Richter v roce 1792, první úspěšný chirurgický výkon byl proveden v roce 1955 Pettersonem. K popisu rozsahu rozštěpu se nejčastěji používá klasifikace dle Benjamina a Iglise, která rozlišuje 4 typy LTER – I. typ interarytenoidní rozštěp s absencí interarytenoidní svaloviny; II. typ rozštěp zadní stěny hrtanu zasahující částečně krikoidní chrupavku; III. typ rozštěp krikoidní chrupavky a krční části průdušnice a jícnu; IV. typ rozštěp v celém rozsahu hrtanu a průdušnice, zasahující po jeden nebo oba bronchy (obr. 1).
Image 1. Klasifikace LTER dle Benjamina a Iglise (převzato z www.nature.com). 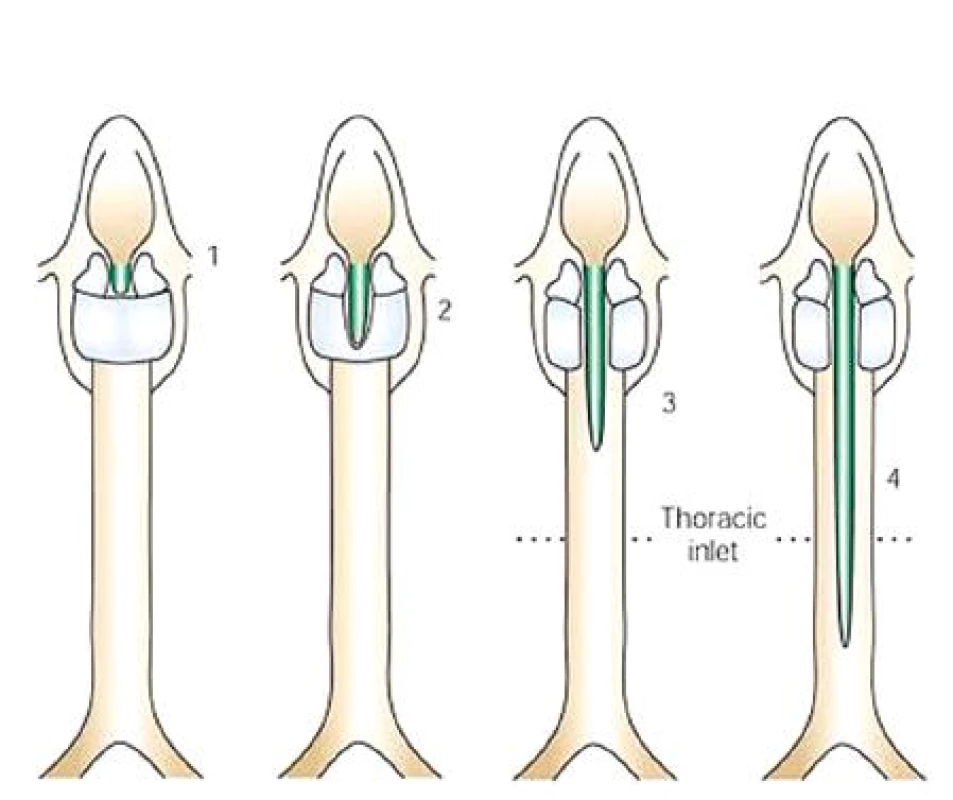
Incidence kongenitálních anomálií hrtanu se udává 1 na 2000 novorozenců, z toho méně než 0,3 % připadá na LTER (15). K přidruženým anomáliím, zejména u dětí s kompletním rozštěpem, patří anorektální malformace (21 %), malrotace (13 %), hypospádie (7-13%), kardiovaskulární anomálie (16-33 %), ezofageální atrézie nebo fistula (20-37 %) (2). LTER se také často vyskytuje u pacientů s Opitzovým syndromem. Většinu LTER tvoří rozštěpy menšího rozsahu. Mortalita dosahuje 43 % u I. a II. typu LTER, 42 % u III. typu, 50 - 100 % u IV. typu (14, 16). Čím větší rozsah rozštěpu, tím horší prognóza (12).
Klinický obraz je podmíněn rozsahem rozštěpu. Objevuje se stridor, cyanóza, kašel, zejména při krmení, recidivující aspirační pneumonie, u rozštěpů většího rozsahu respirační insuficience. RTG diagnostika nemusí odlišit LTER od aspirace, proto je nutné diagnózu potvrdit a stanovit rozsah rozštěpu endoskopicky. Po stanovení diagnózy je cílem prevence aspirace a příprava pacienta k chirurgickému výkonu. Charakter chirurgického výkonu u LTER závisí na délce a lokalizaci rozštěpu, přidružených anomáliích a souběžně probíhajících onemocnění.
METODIKA A VÝSLEDKY
V letech 1999 - 2009 jsme na ORL klinice 2. LF UK ve spolupráci s Klinikou dětské chirugie 2. LF UK FNM operovali celkem 4 děti s diagnózou LTER (tab. 1). U všech pacientů se jednalo o III. typ klasifikace dle Benjamina a Iglise. Všechny děti byly donošené, těhotenství probíhalo bez komplikací. U 1 pacienta byly po porodu zjištěny rozštěp rtu, patra a hypospadie, ostatní pacienti byli bez přidružených vrozených anomálií. Diagnóza byla potvrzena endoskopicky pomocí rigidní optiky, vyšetření byla provedena u pacientů v celkové anestezii. U 2 pacientů se jednalo o revizní výkon po předchozích operacích LTER na jiném pracovišti, 3 pacienti byli operováni z předního krčního přístupu, 4. pacient byl operován z laterálního krčního přístupu; jednalo se již o pátou revizi pro tracheoezofageální píštěl po předchozích čtyřech revizích na jiném pracovišti. U 3 pacientů byla z důvodů respirační insuficience založena již před rekonstrukčním výkonem tracheostomie, u 2 gastrostomie. Výkon zpravidla začínal laryngotracheobronchoskopií, kdy byla zdokumentována hloubka rozštěpu. Při vlastní operaci samotného rozštěpu pokládáme za důležité přesné oddělení vrstvy jícnu a zadní stěny průdušnice bez zhmoždění okrajů. Po sutuře stěny jícnu byl mezi rekonstruované vrstvy interponován štěp z fascie z páskových svalů nebo perichondrium ze zadní stěny boltce a uzavřena zadní stěna průdušnice. Nazogastrická sonda byla odstraněna v souvislosti s řešením dalších obtíží, poté byl proveden RTG polykacího aktu, první kontrolní endoskopie v celkové anestezii byla provedena přibližně v rozmezí 7 - 14 dní po operaci (obr. 2). V pooperačním období jsme zaznamenali komplikaci u 1 pacienta, u kterého byla 4 dny po výkonu nutná retracheostomie pro respirační insuficienci způsobenou tracheomalácií. Jednalo se již o 2. revizní výkon. Operace rozštěpu a 1. revizní výkon pro dehiscenci v oblasti hrtanu proběhly z předního krčního přístupu na jiném pracovišti. U téhož pacienta byla o 4 roky později při endoskopii indikované pro parastomální krvácení zjištěna tracheozofageální píštěl, která byla úspěšně vyřešena reoperací. U 1 pacienta bylo nutné 4 měsíce po operaci LTER pro neúspěšnou rehabilitaci polykacího aktu a gastroezofageální reflux provést gastrostomii a fundoplikaci. Doba zavedení tracheostomické kanyly se pohybovala v rozsahu od půl roku do pěti let po operaci.
Table 1. LTER v letech 1999-2009. Klinika ORL 2. LF UK a Klinika dětské chirugie 2. LF UK FNM. 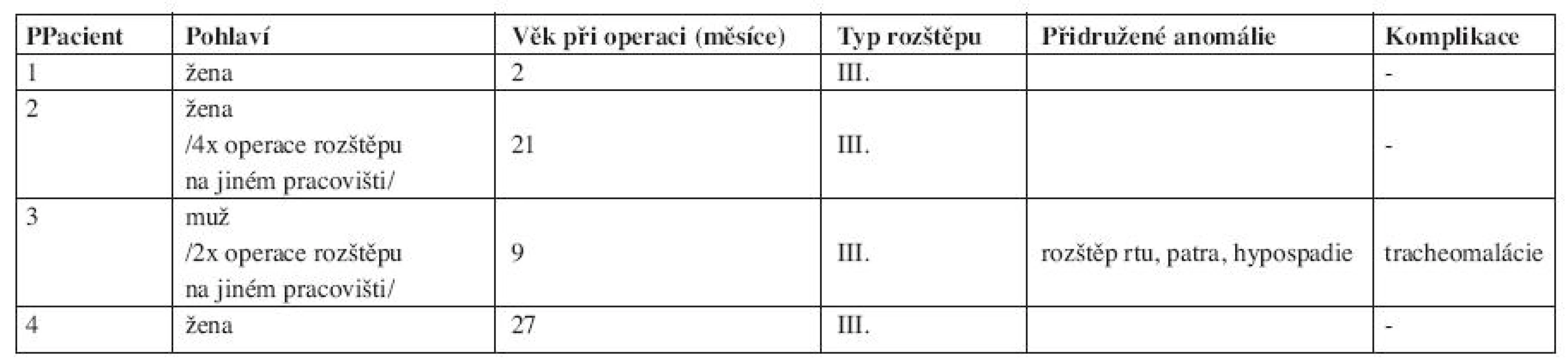
Image 2. LTER–endoskopie po operaci – před odstraněním uvolněných vrcholků jícnové vrstvy (funkčně bez potíží). 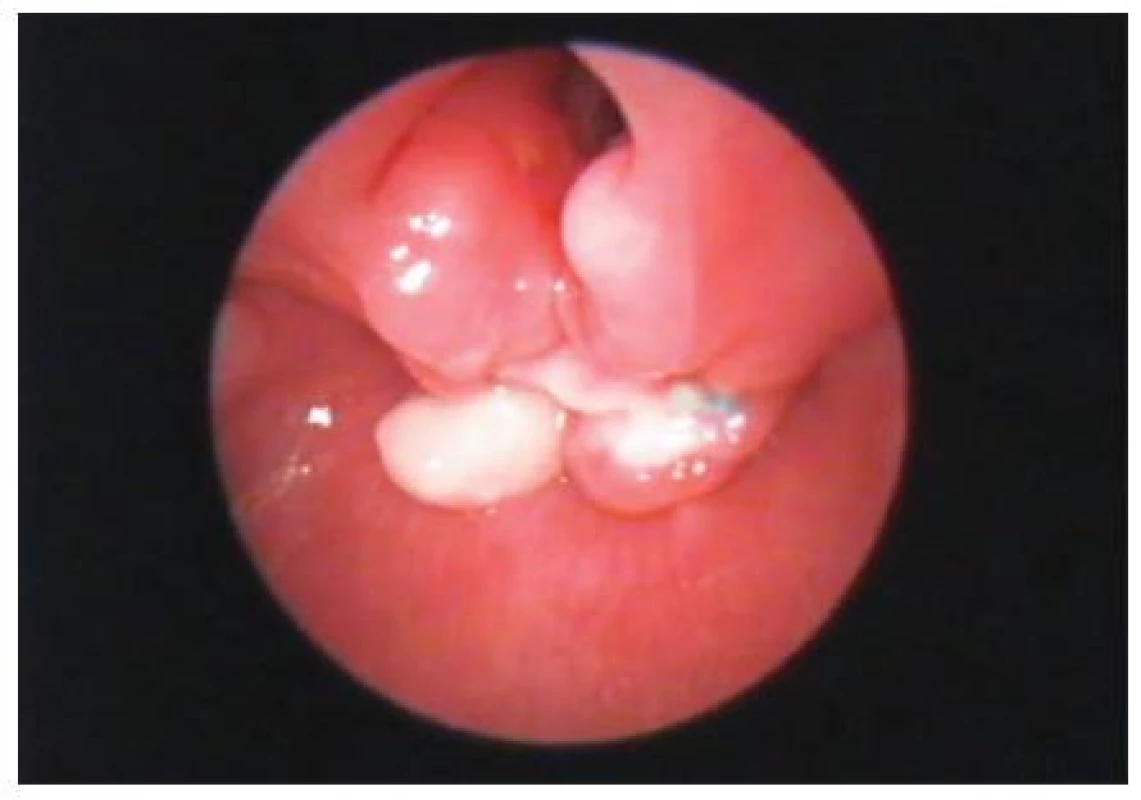
DISKUSE
LTER je vzácná vrozená anomálie a soubory pacientů z jednotlivých pracovišť jsou malé a neexistuje jednotný terapeutický algoritmus. Doposud se vedou diskuse jaký typ výkonu je nejvhodnější pro jednotlivé typy rozštěpu, v kolika vrstvách provádět suturu a zda je vhodné interponovat štěp. I., II. a III. typ LTER se obvykle operují z předního krčního přístupu, IV. typ pak většinou dvoufázově z pravostranné thorakotomie s následným dokončením rekonstrukce z předního nebo laterálního krčního přístupu (17). Nicméně na některých pracovištích u LTER I. a II. typu preferují endoskopické řešení (2, 15). Kennedy úspěšně aplikoval Gelfoamovou injekci do interarytenoidního prostoru u I. typu rozštěpu (10). Byly již i popsány terapeutické endoskopické výkony u III. typu LTER bez nutnosti tracheostomie či intubace (15), nicméně soubory těchto pacientů jsou velmi malé a někteří autoři považují u III. a IV. typu LTER potenciální endoskopické řešení pro technickou náročnost a možnost vzniku pooperační fistuly za nereálné (7). Pro III. typ rozštěpu, se kterými jsme se na našem pracovišti setkali, jsme ve shodě s pracovišti s největšími soubory pacientů volili ve většině případů zevní přední krční přístup, mezi jehož hlavní výhody se uvádí přehledné operační pole a nižší riziko poranění rekurentních nervů (7, 11, 12, 13). Mezi nevýhody tohoto přístupu se řadí zvýšené riziko tracheomalácie v případě revizních výkonů. Někteří autoři dokonce udávají u souboru svých pacientů 100% pooperační výskyt tracheomalácie u III. a IV. typu LTER (9).
Ani v technice sutury nepanuje názorová shoda. Někteří autoři doporučují interpozici různých typů štěpu ke snížení rizika vzniku pooperační tracheoezofageální píštěle (6, 7, 12), dle jiných autorů postačuje tzv. TEP-TOF technika (tracheoesophagoplasty with two overlapping flaps), kdy se ze sešitých vrstev vytvoří 2 překrývající se laloky bez nutnosti použití štěpu (13).
Mezi postoperační komplikace se udávají dehiscence, poranění neurovaskulárních struktur, infekce, tracheoezofageální píštěl, postoperační supraglotická stenóza či naopak ęponecháníę rozštěpu I. typu. Mezi časté obtíže provázející operace LTER patří závislost na tracheostomii, tracheomalácie, chronické plicní změny vyvolané opakovanými aspiracemi. Rozštěpová vada bývá sdružena s dalšími poruchami ve střední čáře. Pacienti mívají dlouhodobě dyskoordinaci polykacího aktu, proto se k výživě obvykle zakládá gastrostomie, v případě gastroezofageálního refluxu se provádí fundoplikace.
ZÁVĚR
Laryngotracheoezofageální rozštěp je vzácná vrozená anomálie, kdy úspěšná léčba závisí na včasné diagnóze, prevenci aspirace a gastroezofageálního refluxu, adekvátní výživě a včasném chirugickém řešení. Cílem výkonu je rozdělení aerodigestivního kompartmentu do dvou fungujících traktů, s možností normální fonace a polykání. Chirurg by měl mít zkušenosti s operacemi jícnu u novorozenců. I když dosavadní hodnocený soubor není velký, volba operačního přístupu a techniky se v souladu se zkušenostmi z jiných pracovišť ukazuje vzhledem k nulové mortalitě a malému počtu komplikací jako efektivní a bezpečná.
MUDr. Petra Dytrych
Klinika ušní, nosní a krční 2. LF UK a FNM
V Úvalu 84
150 06 Praha 5
Sources
1. Alabdulgader A., Patten D.: Laryngotracheoesofageal cleft type 3 and double outlet right venticle: unique combination. Annals of Diagnostic Pathology, 2005, 9, s. 323-326.
2. Antao, B., Soccorso, G.: H-type tracheosophageal fistula with type III laryngotracheoesofageal cleft. Eur Arch. Otorhinolaryngol, 264, 2007, s. 1373-1376.
3. Carr, M. M, Clarke, K. D.: Congenital laryngotracheoesophageal cleft. The Journal of Otolaryngology, 28, 1999, 2.
4. Delank, K. W., Stoll, W.: Congenital laryngotracheo - esofageal cleft: diagnosis and surgical treatment by anterior, translaryngeal approach. Laryngorhinootolgie, 78, 1999, 7, s. 401-404.
5. Dietz, H. G: Type IV Laryngotracheoesophageal cleft associated with microgastria and left lung hypoplasia: Report of a long-term survivor. Eur J. Pediatr. Surg., 19, 2009, s. 120-121.
6. Garabedian, E. N., Ducroz, V.: Posterior laryngeal clefts: preliminary report of a new surgical procedure using tibial periostem as an interposition graft, Laryngoscope, 108, 1998, s. 899-902.
7. Geller, K., Kim, Y.: Surgical management of type III and IV laryngotracheoesofageal clefts: the treee layer approach. International Journal of Pediatric Otorhinolaryngology, 74, 2010, s. 652-657.
8. Jackson, J. R., Viayasekaran, S.: Exomphalos and Type IV laryngeal cleft: A surgical challenge. Eur J. Pediatr. Surg., 19, 2009, s. 124-125.
9. Kawaguchi, A., Donahoe, P. K.: Management and long-term follow-up of patients with types III and IV laryngotracheoesophageal clefts. Journal of Pediatric Surgery, 40, 2005, s. 158-165.
10. Kennedy, C. A., Heimbach, M.: Diagnosis and determinativ of the clinical signifikance of type Ia laryngeal clefts by gelfoam ijnection. Ann. Otol. Rhinol. Laryngol., 109, 2000, s. 991-995.
11. Kubba, H., Gilbson, D.: Techniques and outcomes of laryngeal cleft repair: an update to the Great Ormond Street Hospital Series. Ann. Otol. Rhinol. Laryngol., 114, 2005, s. 309-313.
12. Mathur, N., Peek, G. J.: Strategies for managing type IV laryngotracheoesofageal clefts at Great Ormond Street hospital for Children. International Journal of Pediatric Otorhinolaryngology, 70, 2006, s. 1901-1910.
13. Nicollas, R., Sudre-Levillain, I.: Surgical repair of laryngotracheoesofageal clefts by tracheoesophagoplasty with two overlapping flaps. Annals of Otology, Rhinology and Laryngology, 115, 5, s. 346-349.
14. Roth, B., Rose, K. G.: Laryngotracheoesophageal cleft. Eur J. Pediatr., 140, 1983, s. 41-46.
15. Sandu, K., Monnier, P: Endoscopic laryngotracheal cleft repair without tracheotomy or intubation. Laryngoscope, 16, 2006, s. 630-634.
16. Simpson, B. B., Ryan, D. P.: Type IV laryngotracheoesophageal clefts: surgical management for long-term survival. J. Pediatr. Surg., 31, 1996, s. 1128-1133.
17. Šnajdauf, J., Škába, R.: Dětská chirurgie. Galén, 2005, s. 158-159.
18. http://www.nature.com/gimo/contents/pt1/fig_tab/gimo36_F1.html (McCulloch T. M., Jaffe D.)
Labels
Audiology Paediatric ENT ENT (Otorhinolaryngology)
Article was published inOtorhinolaryngology and Phoniatrics

2011 Issue 1-
All articles in this issue
- Nádory truncus sympathicus cervicalis
- Laryngotracheoezofageální rozštěp
- Chirurgické řešení retinovaných cizích těles v očnici
- Perkutánna endoskopická gastrostómia v liečbe pacientov s pokročilými nádormi hlavy a krku
- Incidencia regionálnych okultných mikrometastáz pri karcinómoch hlavy a krku
- Funkčné výsledky rekonštrukcie blany bubienka na Klinike ORL a chirurgie hlavy a krku v Košiciach
- Výskyt komplikácií po rekonštrukcii blany bubienka
- Endonazální endoskopická koagulace a. sphenopalatina v léčbě závažné epistaxe ze zadních oddílů nosní dutiny
- Porucha sluchu vzniklá po zasažení bleskem
- Inhalační trauma – historie, současnost a budoucnost
- Otorhinolaryngology and Phoniatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Inhalační trauma – historie, současnost a budoucnost
- Výskyt komplikácií po rekonštrukcii blany bubienka
- Laryngotracheoezofageální rozštěp
- Perkutánna endoskopická gastrostómia v liečbe pacientov s pokročilými nádormi hlavy a krku
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

