-
Medical journals
- Career
Možnosti scintigrafických metod u pacientů se srdečním selháním a zachovanou ejekční frakcí
Authors: Otto Lang
Authors‘ workplace: Oddělení nukleární medicíny, Oblastní nemocnice Příbram, a. s. ; Oddělení nukleární medicíny, PMCD s. r. o., Praha 6, ČR ; Klinika nukleární medicíny, 3. LF UK a FN Královské Vinohrady, Praha 10
Published in: NuklMed 2020;9:49-58
Category: Review Article
Overview
Úvod: Srdeční selhání se zachovanou ejekční frakcí (HFpEF) představuje přibližně polovinu všech případů srdečního selhání a jeho frekvence stále narůstá. Patofyziologické změny jsou velmi komplexní. Patří sem maladaptace, remodeling a hypertrofie, apoptóza, smrt a regenerace svalových buněk myokardu. Porucha funkce myokardu může mít různé příčiny, obvykle se jedná o kombinaci více příčin. Významná je zejména ischemie, porucha metabolizmu, porucha sympatiku a některé další, kvantitativně méně významné příčiny (zánět, restriktivní kardiomyopatie).
Metoda: Protože metody nukleární medicíny jsou založené na patofyziologických změnách, mohou se v diagnostice srdečního selhání tohoto typu dobře uplatnit. Z rutinně používaných metod se jedná o radionuklidovou ventrikulografii (RNV), scintigrafii perfuze myokardu (MPI), zobrazení poruch metabolizmu glukózy (FDG), detekce autonomní neuropatie a podíl na diagnostice srdeční sarkoidózy a amyloidózy.
Výsledky: RNV slouží zejména k hodnocení funkce levé komory srdeční při zátěži, MPI k detekci ischemie i při nezužující ateroskleróze věnčitých tepen, FDG se používá hlavně pro detekci viability myokardu u pacientů po infarktu myokardu. Autonomní neuropatii detekujeme jako sympatickou dysfunkci. Poměrně významnou roli hrají scintigrafické metody v diagnostice restriktivní kardiomyopatie, pokud je její příčinou sarkoidóza nebo amyloidóza. Scintigrafická diagnostika amyloidózy může dokonce za určitých okolností nahradit endomyokardiální biopsii.
Závěr: Scintigrafické metody se mohou v diagnostice HFpEF uplatnit velkou měrou. Musí však být správně indikované, profesionálně provedené a jejich výsledky dobře interpretované.
Klíčová slova:
HFpEF – scintigrafie – SPECT – PET
Úvod
Srdeční selhání se zachovanou ejekční frakcí (Heart Failure with preserved Ejection Fraction, HFpEF) je svým způsobem contradictio in adjecto. Srdeční selhání je totiž tradičně definováno jako stav, kdy srdeční výdej nestačí uspokojit metabolické potřeby orgánů a tkání, přitom hlavní mírou srdečního výdeje je právě ejekční frakce. 1 HFpEF představuje přibližně polovinu všech případů srdečního selhání a jeho frekvence stále narůstá. 2 Nárůst je přibližně 1 % za rok a lze předpokládat, že se stárnutím populace a vysokou prevalencí rizikových faktorů, jako je cukrovka, obezita a hypertenze, se HFpEF stane v blízké budoucnosti nejčastějším typem srdečního selhání. Odhaduje se, že v současné době je 65 % všech srdečních selhání typu HFpEF. 3
Pacienti s HFpEF jsou převážně ženy a senioři s vysokou prevalencí chronických komplikujících onemocnění, jako je obezita, cukrovka, hypertenze, chronické onemocnění ledvin, anemie, ischemická choroba srdeční, dyslipidemie a fibrilace síní. 2,4,5 Pacienti s HFpEF mají podobné funkční omezení jako pacienti s HFrEF (Heart Failure with reduced Ejection Fraction), vyžadují časté hospitalizace a mají nízkou kvalitu života. Rovněž jejich prognóza není dobrá, 5 let přežívá pouze 35–40 % pacientů po první hospitalizaci pro srdeční selhání. 3,6 Diagnostika HFpEF není snadná, rovněž neexistuje žádné léčebné schéma. HFpEF není jednoduchý klinický syndrom charakterizovaný koncentrickou hypertrofií levé komory (na rozdíl od HFrEF, kde je hypertrofie LK excentrická), normální EF a diastolickou dysfunkcí se sníženou poddajností levé komory. Jedná se o multiorgánové systémové onemocnění, které postihuje nejen srdce, ale také plíce, kosterní svaly, ledviny a tukovou tkáň. 7 K dalším typickým znakům patří hypertenzní remodelace levé komory, sedavý způsob života se sníženou fyzickou výkonností, snížená poddajnost srdce i cév, obezita s oxidativním stresem, vyšší věk a endoteliální dysfunkce se ztrátou srdeční i pohybové rezervy. 8
Terminologie
Srdeční selhání je celosvětově hlavní a stále rostoucí příčinou morbidity i mortality bez ohledu na pokroky v oblasti prevence a léčby. Může být výsledkem poruchy perikardu, myokardu, endokardu, srdečních chlopní, velkých cév nebo některých metabolických poruch. 1 Podle velikosti ejekční frakce (EF) dělíme srdeční selhání na tři typy: se sníženou EF (HFrEF, EF pod 40 %), se zachovanou EF (HFpEF, EF nad 50 %) a se střední EF (Heart Failure with mid-range Ejection Fraction, HFmrEF, EF mezi 40 a 50 %).
Historicky i terminologicky je zajímavý vztah HFpEF a diastolické srdeční dysfunkce. 2 Mnoho let je známo, že existuje skupina pacientů, kteří mají příznaky srdečního selhání, ale jejich ejekční frakce je normální. 9 Zpočátku se předpokládalo, že jelikož je systolická funkce (EF) normální, příčinou potíží pacientů musí být porucha plnění srdce, tedy porucha diastolické funkce. Pro tuto situaci se tedy zavedl termín diastolické srdeční selhání (diastolic heart failure – DHF). Postupně se však objevily metody, které podrobněji vyšetřily mechaniku levé komory srdeční, a zjistilo se, že ani systolická funkce těchto pacientů není úplně normální. 9 Jedná se zejména o přítomnost zkrácení svaloviny levé komory v dlouhé ose, která se zvýrazňuje při zátěži, o poruchu rotace komory, snížené intramyokardiání napětí, torzní dysynchronii a sníženou systolickou rezervu. Termínem diastolická dysfunkce se označuje porucha relaxace nebo snížená poddajnost svaloviny levé komory srdeční, což má za následek poruchu plnění komory v diastole a vede ke zvýšení plnícího tlaku komory. 10 Tato porucha odkazuje na klasickou kombinaci známek plicního a/nebo periferního žilního městnání způsobeného sníženou schopností srdce plnit se a/nebo vypuzovat krev podle potřeb organizmu. 4,11 Také se zjistilo, že tito pacienti mají obecně vyšší tuhost nejen srdečních stěn, ale také cévní stěny (tepen i žil). Proto byl místo DHF zaveden termín srdeční selhání s normální ejekční frakcí (Heart Failure with a Normal Ejection Fraction – HFNEF).12 Postupně se, hlavně v USA a později i v Evropě, objevil nový termín – HFpEF, který se užívá i v současné době. Není pro to moc důvodů, protože u těchto pacientů dochází postupně ke snižování EF (až o 6 % za 5 let), takže po 5 letech má téměř 40 % pacientů EF pod 50 %. 13 Na rozdíl od pacientů s HFrEF ne všichni pacienti s HFpEF diastolickou dysfunkci mají. 1 Termín HFpEF je tedy širší než diastolická dysfunkce a vyjadřuje komplexnější problematiku tohoto syndromu. Anglicky se někdy používá výslovnost „haf paf“ (huff, puff – funět, odfukovat) odkazující na nejčastější klinické příznaky pacientů s HFpEF (dušnost a námahová intolerance). 2
Patofyziologie
Patofyziologické změny HFpEF jsou velmi komplexní, a protože metody nukleární medicíny jsou založené na patofyziologických změnách, mohou se v diagnostice srdečního selhání tohoto typu dobře uplatnit. Jedná se zejména o aktivaci neurohumorálních, buněčných a molekulárních mechanismů, jejichž cílem je udržet funkci srdce. Patří sem maladaptace, remodeling a hypertrofie, apoptóza, smrt a regenerace svalových buněk myokardu. 14 Pacienti s HFpEF mívají sníženou vazodilatační rezervu, chronotropní inkompetenci, plicní hypertenzi i dysfunkci pravé komory srdeční. 15 HFpEF aktivuje neurohumorální systém za účelem udržení perfuze životně důležitých orgánů. Jedná se o aktivaci sympatiku, systému renin-angiotenzin-aldosteron (RAAS), antidiuretického hormonu i dalších vazoaktivních látek (natriuretický peptid B (BNP), oxid dusný a endotelin). Aktivace sympatiku způsobí zvýšení srdeční kontraktility a tepové frekvence a periferní vazokonstrikci se zvýšením afterloadu. RAAS, aktivovaný v důsledku hypoperfuze ledvin při srdečním selhání, vede k retenci sodíku a vody a tím ke zvýšení preloadu. Angiotenzin dále zvýší retenci sodíku a vody a vede k další vazokonstrikci, nadále tak zvyšuje zátěž stěny myokradu, což má za následek její remodelaci, zhoršení funkce a prohloubení selhání. Všechny tyto mechanismy vedou k negativní remodelaci levé srdeční komory (zánět, apoptóza, hypertrofie a fibróza) a dalšímu zhoršení její funkce. 1,16
Porucha funkce myokardu může mít různé příčiny, obvykle se jedná o kombinaci více příčin. Významná je zejména ischemie, porucha metabolizmu, porucha sympatiku a některé další, kvantitativně méně významné příčiny (zánět, restriktivní kardiomyopatie).
Koronární ateroskleróza je sice u pacientů s HFpEF méně častá než u pacientů s HFrEF, její přítomnost je však stále poměrně vysoká, udává se kolem 50 %. 17 Ischemická choroba srdeční se na rozvoji diastolické dysfunkce podílí jednak poruchou aktivní relaxace, což je energeticky závislá fáze diastoly, jednak poruchou pasivní relaxace v důsledku fibrózy či jizvení, dlouhodobě může vést k rozvoji hypertrofie myokardu se stejnými důsledky. 2 Výhodou koronární aterosklerózy je, že je léčitelná.
K poruše metabolizmu myokardu dochází zejména u pacientů s cukrovkou. 18 Srdeční svalová buňka musí trvale vytvářet dostatek energie pro mechanickou práci srdce. K tomu potřebuje dostatek krevního zásobení, správnou skladbu energetických substrátů v krvi a správnou funkci různých bílkovin, které se podílejí jednak na přenosu chemické energie, jednak na kontraktilitě a vedení vzruchu. U cukrovky je však situace srdeční svalové buňky zhoršena, protože v důsledku metabolických změn se mění koncentrace energetických substrátů v krvi. Jedná se o zejména o zvýšenou hladinu glukózy, inzulínu a mastných kyselin. Do buňky se tak dostává méně glukózy a více mastných kyselin, jejichž oxidace vyžaduje více kyslíku. Může také dojít k rozpojení dýchacího řetězce v mitochondriích (kyslík není využit k tvorbě ATP, ale tvoří se kyslíkové radikály, které narušují metabolizmus vápníku) s následnou poruchou svalové kontrakce. Z hlediska strukturálních změn je pro cukrovku typická hypertrofie myokardu. Kromě toho je zde přítomné vyšší množství kolagenu jak v intersticiu (kolem cév i mezi svalovými buňkami), tak ve stěně cév, což dále zhoršuje zásobení svalových buněk krví a zhoršuje poddajnost srdeční stěny, přispívá tedy k rozvoji diastolického srdečního selhání.
Úloha zánětu není zcela jasná. Zánět hraje důležitou roli při rozvoji hypertrofie levé komory srdeční zejména tvorbou perivaskulární fibrózy, může být tedy významný v časné preklinické fázi. 19 U pacientů se srdečním selháním nacházíme zvýšenou plazmatickou hladinu různých markerů zánětu, je však nejasné, zda příslušný marker je známkou příčiny remodelace myokardu, zda je známkou kompenzačních mechanizmů či zda je pouhou známkou katabolických změn ve tkáních při srdečním selhání. Důležitou roli při zánětu v myokardu hraje endoteliální dysfunkce a oxidativní stres 20, přitom za hlavního hráče při rozvoji endoteliální dysfunkce je považován oxid dusnatý (NO). Ten také podporuje relaxaci svaloviny levé komory srdeční prostřednictvím cyklického guanosinmonofosfátu, jehož koncentrace je u pacientů s HFpEF v myokardu snížená. Endoteliální dysfunkce je také přítomná v plicních tepnách, plicní arteriální hypertenze je u pacientů s HFpEF častá.
Restriktivní kardiomyopatie patří k vzácným příčinám HFpEF, jejich včasná diagnóza a příslušná léčba však mohou u pacienta rozvoji srdečního selhání zabránit nebo ho alespoň oddálit. 2 Z pohledu nukleární medicíny se jedná zejména o srdeční amyloidózu a sarkoidózu.
Klinický obraz
Vzhledem k různorodým potížím pacientů s HFpEF je nezbytná pečlivá anamnéza a fyzikální vyšetření. V anamnéze je nutné se kromě současných potíží zaměřit také na přítomnost rizikových faktorů. Z klinických příznaků pátráme hlavně po potížích způsobených pravostranným srdečním selháním a retencí tekutin, jako je dušnost, orthopnea, periferní otoky, břišní dyskomfort způsobený překrvením jater a ascitem, otok skróta. Dále zjišťujeme známky sníženého srdečního výdeje, jako je únava, snížená fyzická výkonnost, nechutenství a slabost. K méně častým příznakům patří noční kašel, palpitace, sípání, deprese nebo synkopy a závratě. 1 Problém je v tom, že stejné příznaky mají i pacienti s HFrEF. 2 Zdá se tedy, že nejlepší diagnostickou metodou je echokardiografie, která je široce dostupná a je schopná podat informace o srdeční anatomii, chlopenním aparátu, tloušťce srdečních stěn i o plnícím tlaku komor. Pro diagnostiku HFpEF je tedy nezbytná přítomnost symptomů srdečního selhání, EF nad 50 % a přítomnost známek zvýšeného plnícího tlaku levé komory (zvětšený objem levé síně, zvýšená hladina BNP nebo NT-proBNP (N-terminální prohormon natriuretického peptidu B) nebo zvýšený plnící tlak změřený invazivně). Na druhou stranu absence diastolické dysfunkce diagnózu HFpEF nevylučuje.
Léčba pacientů s HFpEF vyžaduje správnou diagnózu a klinickou klasifikaci. Z hlediska klinické prezentace choroby je možno rozdělit pacienty do tří skupin: pacienti se syndromem nízkého BNP, obézní pacienti s kardiometabolickým syndromem a pacienti se selháním pravé komory srdeční a kardiorenálním syndromem. 6
Pacienti s nízkou hladinou BNP mají zvýšenou retenci sodíku, a tedy zvýšený krevní tlak, větší plazmatický volum a zvýšený tlak v pravé komoře srdeční. Pokud jsou obézní, mají centrální typ obezity, který spolu se zvýšeným objemem plazmy vede k větší excentricitě levé komory srdeční. Tito pacienti profitují zejména z léčby diuretiky a ACE inhibitory případně blokátory receptoru pro angiotenzin (ARB) ev. z redukce váhy.
Kardiometabolický syndrom zahrnuje hypertenzi, obezitu, inzulinovou rezistenci a metabolický syndrom. V této skupině pacientů je nejvíce diabetiků, mají největší poruchu relaxace myokardu. Ta je způsobená poruchou metabolizmu vápníku (porucha T-tubulů), která vede k poruše longitudinální mechaniky kontrakce levé komory a k rozvoji HFpEF. 21 Tito pacienti nejvíce profitují z léčby inhibitory SGLT-2 (glifloziny) a z redukce váhy.
Třetí skupina pacientů má nejhorší prognózu. Pacienti s chronickou renální insuficiencí trpí objemovým přetížením, které vede k plicní arteriální hypertenzi, tedy k pravostrannému srdečnímu selhání, a to zase k žilnímu překrvení ledvin, a tedy ke zhoršení jejich funkce. Tato sestupná spirála pak vede k úmrtí. Léčba takových pacientů je svízelná, mnohdy je nezbytná hemodialýza, zkoušejí se inhibitory fosfodiesterázy (sildenafil).
Možnosti scintigrafických metod
Hodnocení funkce a perfuze myokardu levé komory srdeční
Nejstarší scintigrafickou metodou pro hodnocení mechanické funkce srdce je radionuklidová ventrikulografie (RNV). 22 Sleduje změny objemu náplně komor v průběhu srdečního cyklu tím, že měří změnu radioaktivity radiofarmaka (RF) v srdečních komorách. Jako radiofarmakum je nutno použít medium, které je rovnoměrně rozptýleno v krvi a neuniká z cévního systému. Nejčastěji se používají 99mTc značené erytrocyty nebo albumin. Nutný je synchronizovaný záznam, srdeční cyklus se obvykle dělí na 24 časových úseků. Snímá se buď planárně, nebo tomograficky. Metoda je technicky velmi propracovaná. Kromě základních parametrů globální mechanické funkce levé komory srdeční umožňuje hodnotit také regionální ejekční frakci a rychlosti plnění a vyprazdňování komory v průběhu srdečního cyklu. (Obr. 1) Výpočtem parametrických obrazů je možno posuzovat velikost pohybu srdečních stěn a kvantifikovat jejich synchronii jak v prostoru, tak v čase. (Obr. 2) Základní výhodou této metody ve srovnání např. s echokardiografií je vysoká přesnost a reprodukovatelnost výsledků. Pomocí této metody již v roce 1984 prokázal Vered poruchu kontraktilní rezervy u pacientů s cukrovkou. 23 Vyšetřil soubor 30 mladých asymptomatických diabetiků a 20 zdravých stejně starých dobrovolníků. Všichni měli normální klidovou EF a neměli anamnézu kardiovaskulárního onemocnění. Měřil u nich změnu EF při zátěži. Zjistil, že v souboru diabetiků došlo při zátěži u 17 % k poklesu EF, u 27 % pacientů se EF nezměnila a u 56 % se zvýšila o 6 %. V souboru zdravých dobrovolníků došlo u všech k vzestupu EF o 10 %. U pacientů s poklesem EF neprokázal pomocí perfuzní scintigrafie myokardu přítomnost ischemie.
Image 1. Příklad výpočtu rychlosti, s jakou se levá komora v průběhu srdečního cyklu plní a vyprazdňuje. Využívá se první derivace objemové křivky levé komory srdeční. Vlevo objemová křivka, vpravo křivka její první derivace. 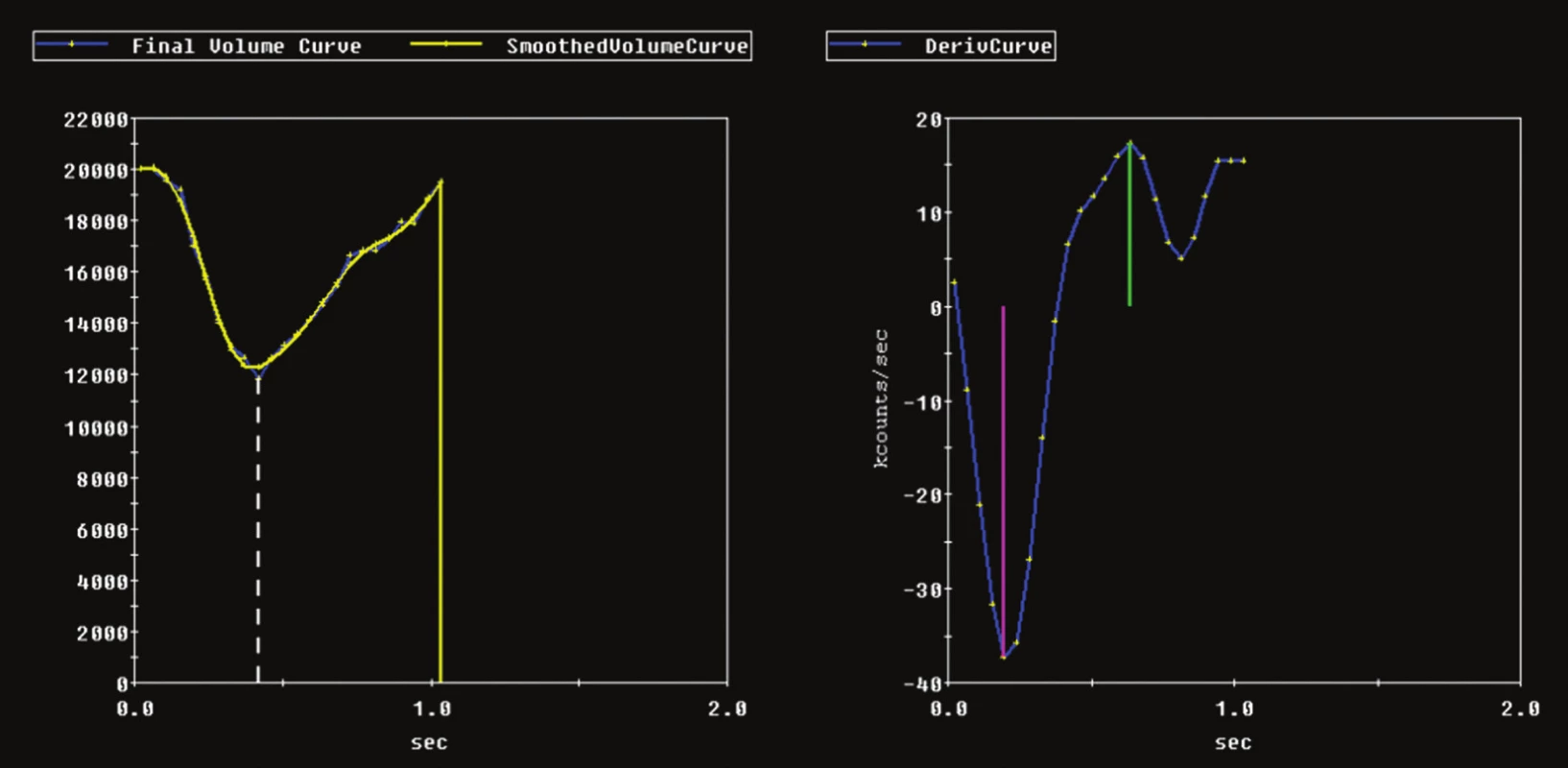
Image 2. Příklad výsledného reportu RNV pacienta se srdečním selháním, vyšetření provedeno s 99mTc značenými erytrocyty. Zobrazeny jsou obrazy distribuce radiofarmaka, parametrické obrazy a fázový histogram. 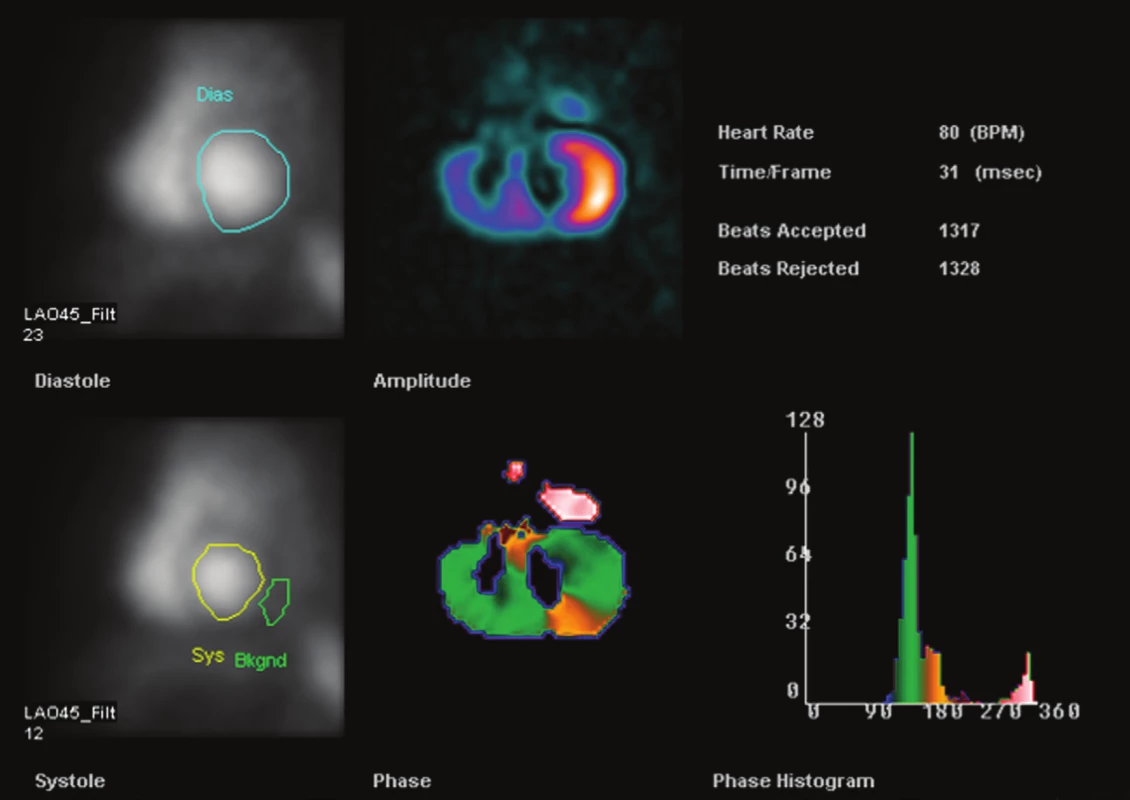
Pro hodnocení perfuze myokardu se stále nejvíce používá zátěžová scintigrafie pomocí SPECT. 24 Na rozdíl od RNV se používají radiofarmaka akumulovaná v buňkách myokardu. Nejvíce se používají RF značená 99mTc (MIBI, Myoview), největší klinické zkušenosti jsou s 201Tl-chloridem. Porovnáním distribuce v klidu a při zátěži se hodnotí velikost koronární rezervy. Její porucha signalizuje přítomnost endoteliální dysfunkce. Rutinně se hodnotí pouze semikvantitativně, ale komerčně jsou dostupné i specializované kamery se softwarem, který je schopen určit koronární rezervu také kvantitativně. Kvantitativní hodnocení koronární rezervy je možné pomocí PET 25, tato metoda ale stále není v ČR dostupná. Základním požadavkem je možnost dynamického záznamu tomografických dat. Z RF se používá buď generátorový 82Rb-chlorid nebo cyklotronový 13N-amoniak. 18F značený indikátor perfuze myokardu zatím není komerčně dostupný.
Koronární ateroskleróza vedoucí k ischemii myokardu je stále významným rizikovým faktorem rozvoje HFpEF a její přítomnost zhoršuje prognózu pacientů. 1,26,27 Proto je doporučována revaskularizace myokardu, pokud je prokázaná ischemie a je to technicky proveditelné. Rovněž je doporučovaná chirurgická léčba pacientů po transmurálním infarktu myokardu (IM) k odstranění velké jizvy či aneurysmatu, aby se zabránilo remodelaci levé komory z eliptického na kulový tvar, i když nebyl prokázaný statisticky významný vliv na frekvenci potíží, toleranci zátěže, mortalitu nebo četnost hospitalizace. 28 Scintigrafické metody jsou však schopné hodnotit poruchu perfuze i na mikrovaskulární úrovni, kdy anatomická ateroskleróza věnčitých tepen není prokázána. To má význam zejména u asymptomatických diabetiků (intenzifikovaná farmakologická léčba anopyrinem, statiny a ACE inhibitory vede k ústupu ischemie) 29, u žen s INOCA (Ischemia and No Obstructive Coronary Artery Disease) 30 nebo u pacientů s amyloidózou. 31
Detekce metabolických poruch myokardu
Scintigrafické metody jsou vhodné pro sledování metabolizmu glukózy a mastných kyselin a pro měření spotřeby kyslíku. Máme k dispozici radiofarmaka pro měření vstupu substrátů do buňky a jejich intracelulární retence (substrátová analoga), pro měření výkonnosti celého metabolického řetězce (substráty) a pro měření aktivity Krebsova cyklu. Základní výhodou je, že je zde jednoduchý přenos poznatků z laboratoře do kliniky i naopak (stejný přístroj, stejné radiofarmakum). 18
Pro sledování metabolizmu glukózy můžeme použít buď přímo molekulu glukózy značenou 11C (substrát) nebo modifikovanou molekulu glukózy značenou 18F (fluorodeoxyglukóza, FDG) (substrátový analog). Rutinně se FDG používá pro detekci viability myokardu u pacientů po IM. (Obr. 3) Vzhledem k tomu, že ischemický myokard využívá přednostně jako energetický zdroj glukózu, nabízí se možnost detekce ischemického myokardu, který se zobrazí jako zvýšeně akumulující oblast. Hodnocení je však problematické, protože akumulace FDG v myokardu není konstantní a mění se v závislosti na metabolickém stavu pacienta. 18
Image 3. Scintigrafické vyšetření pro detekci viability myokardu u pacienta po IM. Horní řada je obraz perfuze (99mTc-MIBI), dolní řada obraz metabolizmu glukózy (18F-FDG), vpravo příslušné polární mapy. Je patrný perfuzně metabolický mismatch (defekt perfuze a zachovaný metabolizmus) – obraz viabilního myokardu spodní stěny levé komory srdeční 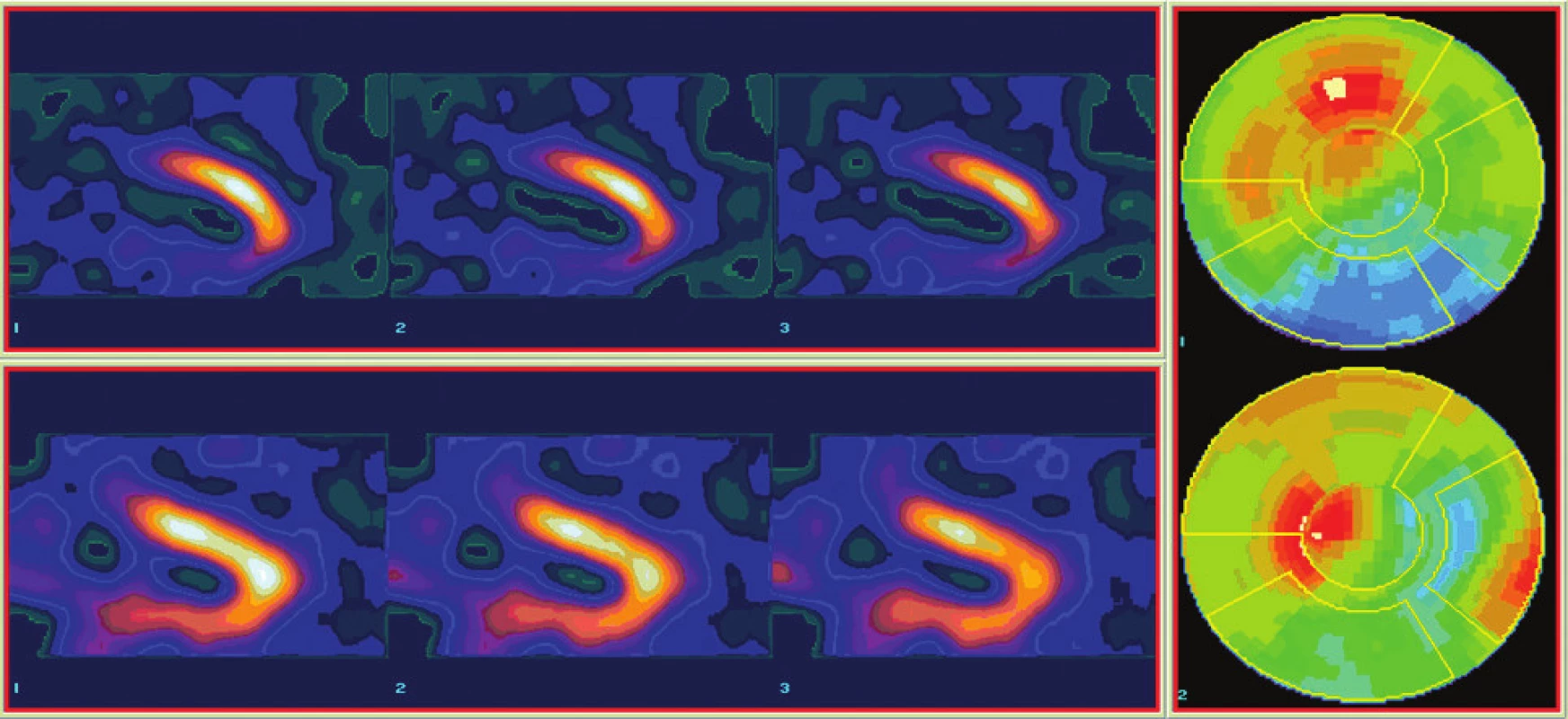
Pro sledování metabolizmu mastných kyselin máme k dispozici několik radiofarmak. Především je to 123I-β-metyl-p-jodofenyl-pentadekanová kyselina (BMIPP), která je komerčně dostupná a zobrazuje se technikou SPECT. Má rozvětvený řetězec s metylovou skupinou, což způsobí, že po vstupu do buňky není dále metabolizovaná, ale v buňce se hromadí. Její buněčná retence je ukazatelem produkce ATP z mastných kyselin. Oxidace mastných kyselin však vyžaduje velké množství kyslíku, je proto při ischemii snížená. Ischemický myokard se tedy vyznačuje sníženou akumulací BMIPP. U pacientů s chronickým renálním selháním dochází k difuzní ischemii myocytů a k přesunu energetických substrátů z mastných kyselin na glukózu. BMIPP tedy potenciálně může v této skupině identifikovat pacienty se zvýšeným rizikem srdeční smrti. K experimentálním účelům se nejvíce používá 11C-palmitát, jeho distribuce se zobrazuje technikou PET. Pacienti s diabetem 1. typu a obézní pacienti mají vyšší úroveň vychytávání a oxidace mastných kyselin v myokardu. 32
Detekce autonomní neuropatie
Autonomní neuropatie hraje při rozvoji srdečního selhání centrální roli. 33 Pro její sledování máme k dispozici falešné mediátory sloužící k hodnocení presynaptické sympatické inervace. Jsou to jednak 123I-MIBG (metaiodobenzylguanidin) pro zobrazení technikou SPECT (Obr. 4), jednak 11C-HED (hydroxyefedrin) pro zobrazení technikou PET. 18 Scintigrafické zobrazování umožňuje in vivo hodnocení presynaptického zpětného vychytávání a uskladnění mediátoru jakož i regionální distribuci a aktivitu postsynaptických receptorů. Přítomnost autonomní neuropatie se projeví sníženou akumulací radiofarmaka. Sympatická dysfunkce v myokardu má za následek zhoršení krevního průtoku (pokles koronární rezervy), pokles kontraktility, větší náchylnost k arytmiím a k náhlé smrti. Denervace postihuje nejčastěji oblast hrotu, spodní a boční stěny, bývá spojena s ostrůvky hyperinervace. 34 Přitom zvýšená aktivita sympatiku může přispívat k rozvoji diastolické dysfunkce. Aikawa a spol. vyšetřili 41 pacientů s HFpEF a 12 stejně starých dobrovolníků bez známek srdečního selhání. 35 Pro měření aktivity sympatiku použili 11C HED, pro její kvantifikaci pak retenční index (RI) a jeho rozptyl (pro hodnocení regionální inervace). Pacienti před aplikací 11C-HED lačnili nejméně 4 hodiny a 24 hodin před vyšetřením neužívali léky obsahující theophyllin a nepili nápoje obsahující kofein. Aplikovali 185 MBq 11C-HED s následným 40minutovým snímáním dat v list modu. Data zpracovali vlastním softwarem. Retenční index vypočetli jako poměr akumulované aktivity v myokardu a aktivity v krvi, jeho variační koeficient v 17segmentovém modelu vyjadřoval heterogenitu inervace levé komory. Pacienti s horší diastolickou dysfunkcí měli nižší RI a větší heterogenitu než pacienti bez diastolické dysfunkce, tedy u pacientů s HFpEF prokázali poruchu sympatické inervace. K podobným závěrům dospěl i Kiuchi a spol. 36
Restriktivní kardiomyopatie
Typickým znakem restriktivní kardiomyopatie (KMP) je infiltrace myokardu (buněčným nebo nebuněčným materiálem), která má za následek poruchu diastolické relaxace. 37 Z hlediska nukleární kardiologie jsou v této skupině chorob nejdůležitější sarkoidóza a amyloidóza.
Sarkoidóza je chronické systémové zánětlivé onemocnění charakterizované tvorbou nekazeifikujících granulomů. Postižení srdce znamená zvýšené riziko úmrtí. Vzhledem k tomu, že protizánětlivá léčba pomocí glukokortikoidů je efektivní, má správná diagnóza postižení srdce pro pacienta zásadní význam. 38 Základním RF pro detekci srdeční sarkoidózy je 18F-FDG. 39 Jednou z výhod FDG je, že umožňuje velmi dobře hodnotit léčebnou odpověď pacienta, významnou nevýhodou je poměrně náročná příprava pacienta, aby byla potlačena fyziologická akumulace FDG v myokardu. Pacient musí 12–24 hodin před vyšetřením jíst pouze stravu s nízkým obsahem sacharidů a s vysokým obsahem bílkovin a tuků nebo poměrně dlouho (12 až 18 hodin) lačnit nebo lze podat heparin v dávce 50 jednotek/kg 15 minut před aplikací FDG, aby se zvýšila plazmatická hladina volných mastných kyselin. 40–42 Podání heparinu však může vzácně způsobit trombocytopenii (riziko 0,2–3 %). 42 Výhodou scintigrafie s FDG je vysoká senzitivita i specificita pro detekci srdeční sarkoidózy. Metaanalýza udává senzitivitu 89 % a specificitu 78 %. 43 Někteří doporučují doplnit k obrazu distribuce FDG také perfuzní scan. 42 Perfuzní defekt je přítomný jak ve fázi zánětu, tak ve fázi fibrózy, zatímco zvýšená akumulace FDG je přítomná pouze ve fázi zánětu jako odraz aktivity zánětlivého procesu.
Kromě FDG lze pro diagnózu srdeční sarkoidózy použít také 68Ga citrát 37, který nemá výše zmíněné metabolické nevýhody. 44
Amyloidóza je porucha, při níž v důsledku nestabilní terciární struktury dochází ke shlukování bílkovin. Tyto agregáty pak tvoří nerozpustná vlákna, která infiltrují extracelulární prostor orgánů a tkání. 45 Bylo identifikováno více než 30 bílkovin s amyloidogenním potenciálem, za srdeční amyloidózu jsou však v drtivé většině případů zodpovědné dvě. 46 Jednou je transportní bílkovina transthyretin produkovaná v játrech (transthyretinová amyloidóza, ATTR), druhou jsou lehké řetězce amyloidogenního monoklonálního imunoglobulinu, za jehož nadprodukci je zodpovědná porucha funkce plazmatických buněk (AL amyloidóza, AAL). Poškození srdce amyloidem u systémové amyloidózy je hlavním faktorem prognózy pacienta a je spojeno s vysokou mortalitou. Srdeční amyloidóza byla dlouho považovaná za raritní onemocnění, avšak rozvoj zobrazovacích možností a zavedení efektivní léčby ATTR vedly k identifikaci této nemoci jako poddiagnostikované příčiny srdečního selhání. 47 Nejčastější manifestací srdeční amyloidózy je HFpEF a hypertrofie levé komory srdeční, k dalším příznakům patří únava, hubnutí a svalová slabost. Správná diagnóza vyžaduje především vysoký stupeň klinického podezření, protože choroba napodobuje řadu srdečních i systémových chorob. Definitivní diagnóza vyžaduje endomyokardiální biopsii (EMB), pokud ji nelze stanovit na základě extrakardiální biopsie. V poslední době je však možné určit diagnózu ATTR pomocí kostní scintigrafie, která může za určitých okolností nahradit EMB. 48 Akumulace značených fosfátů v depozitech srdeční amyloidózy byla poprvé popsána již v roce 1977, kdy byla prokázaná vazba na kalcifikace v amyloidu. 49 To pak vedlo k vytvoření několika fosfátových derivátů značených 99mTc. Dnes se nejvíce využívá pyrofosfát (PYP, zejména v USA), 3,3-diphosphono-1,2-propanodicarboxylová kyselina (DPD, zejména v Evropě) a oxidronát disodný, všechny značené 99mTc.
Největší klinické zkušenosti jsou s DPD. Známá je zejména studie Peruginiho, který vyšetřil soubor 25 pacientů s histologicky ověřenou srdeční amyoidózou a 10 kontrol. 50 15 pacientů mělo TTR a 10 pacientů AL amyloidózu. Všichni pacienti s ATTR měli statisticky významně vyšší akumulaci DPD v srdci než pacienti s AAL a kontroly (senzitivita i specificita 100 %). Perugini a spol. také testovali použití jiného kostního radiofarmaka methyledifosfonátu (MDP), ale žádný pacient s akumulací DPD neměl akumulaci MDP. Někteří autoři však pro detekci srdeční amyloidózy MDP úspěšně použili. 51 Perugini a spol. při vyšetření pacientů aplikovali 740 MBq 99mTc-DPD, snímali celotělové obrazy 5 minut a 3 hodiny po aplikaci. V případě zobrazení srdce ještě zaznamenali tomografii hrudníku (SPECT) po skončení pozdního snímání. Akumulaci RF hodnotili jednak vizuálně (4bodová škála), jednak semikvantitativně. Vizuální skóre 0 znamená žádnou akumulaci v srdci a normální akumulaci ve skeletu, 1 znamená mírnou akumulaci v srdci nižší než ve skeletu, 2 znamená střední akumulaci v srdci a sníženou akumulaci ve skeletu (akumulace v srdci a skeletu je na podobné úrovni) a 3 znamená vysokou akumulaci v srdci a žádnou nebo nízkou akumulaci ve skeletu. Semikvantitativní analýza je poměrně komplikovaná a její rozbor přesahuje zaměření tohoto textu. Ve větší studii 79 pacientů (45 ATTR, 34 AAL) již nebyly výsledky tak dobré, až jedna třetina pacientů s AAL také vykazovala mírnou akumulaci DPD. 52 Při použití vizuálního skóre byly pozitivní a negativní předpovědní hodnoty (PPV a NPV) pro skóre větší než jedna 80 a 100 % a pro skóre větší než tři 100 % a 68 %. Vizuální skóre větší než dvě mělo NPV pro vyloučení AAL 100 % a PPV pro potvrzení ATTR 88 %. Hlavní význam DPD scintigrafie spočívá v odlišení ATTR a AAL, pokud je výsledek buď jasně pozitivní, nebo jasně negativní. 53 U pacientů se střední akumulací DPD je prevalence AAL 18 % a ATTR 36 %. (Obr. 5)
Image 4. Zobrazení sympatické inervace myokardu pomocí 123I-MIBG, přední planární snímky hrudníku. Vlevo (A) je obraz 15 minut po aplikaci, vpravo (B) 4 hodiny po aplikaci. Je patrná nízká akumulace MIBG při autonomní neuropatii. 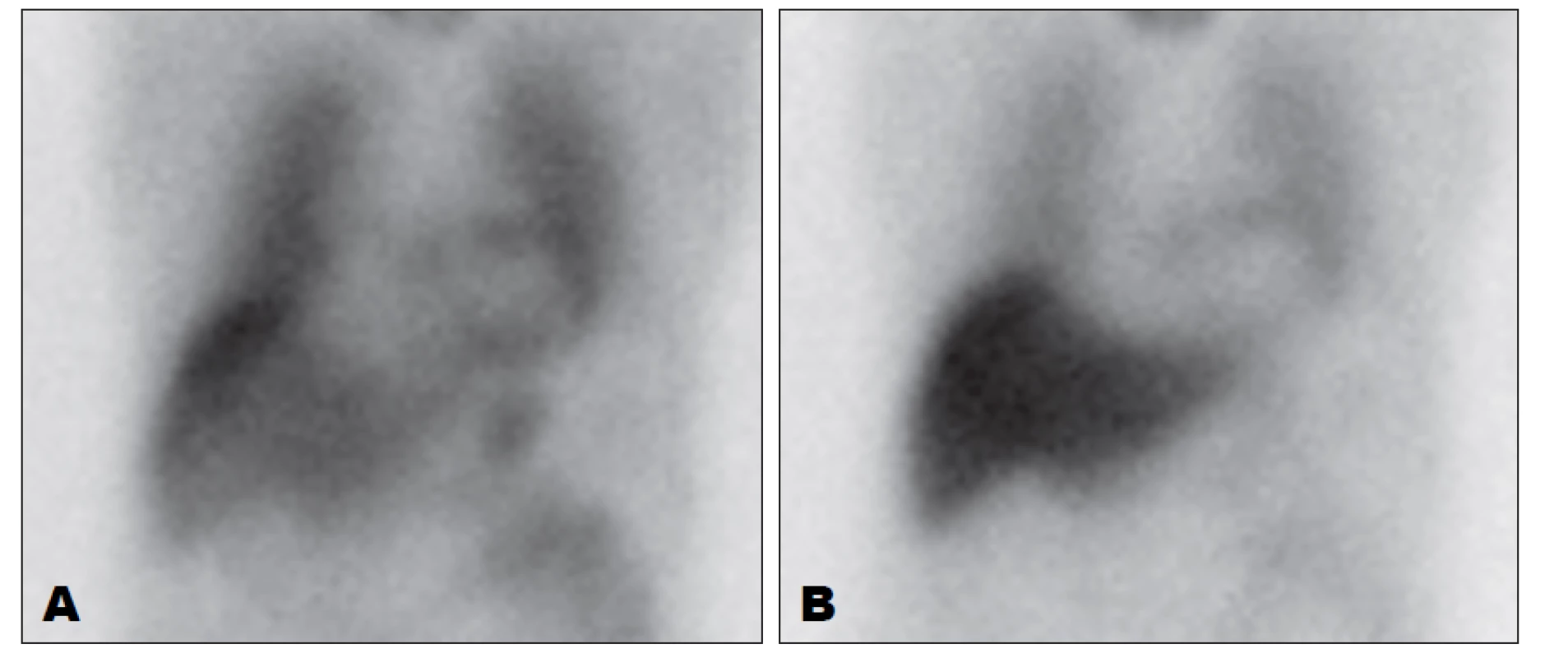
Image 5. Scintigrafie s 99mTc-DPD, přední planární snímky hrudníku (levý sloupec) a transverzální řezy hrudníkem (pravý sloupec). Obrázky A a B mají vizuální skóre 0, TTR amyloidózu tedy můžeme vyloučit. Obrázky E a F jsou se skóre 3, amyloidózu TTR typu tedy můžeme potvrdit. Na obrázcích C a D je vizuální skóre 1–2, nález tedy nemá pro určení typu amyloidózy dostatečnou váhu – viz text. 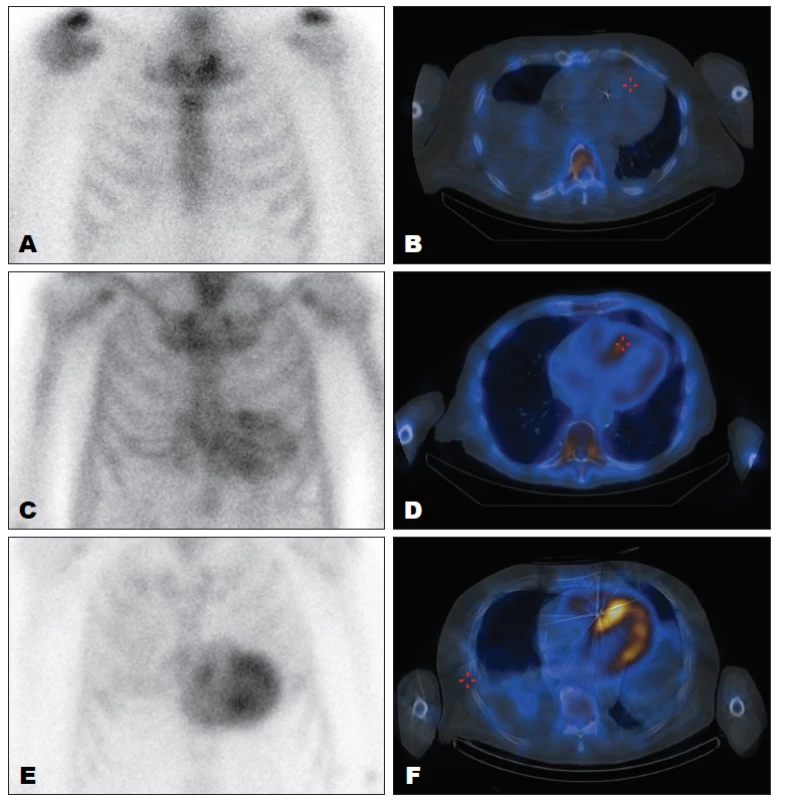
Použití 99mTc-PYP bylo publikováno v řadě kazuistik již od roku 1980, diagnostická studie však nebyla v minulosti provedena. Nebylo tedy jasné, zda je schopen odlišit typ srdeční amyloidózy a nebyla také vypracovaná kvantifikace, proto tato metoda nebyla pro diagnostiku srdeční amyloidózy validovaná. V roce 2013 provedl takovou studii Bokhari a spol. 54 Vyšetřili soubor 45 pacientů (12 AAL, 33 ATTR) s histologicky ověřeným typem srdeční amyloidózy. Použili také vizuální skóre stejné jako Perugini, pro kvantifikaci počítali poměr akumulace PYP v srdci a stejné oblasti na protilehlé straně hrudníku (H/CL). Při hodnotě H/CL větší než 1,5 (vysoká akumulace v myokardu) byla senzitivita a specificita pro detekci ATTR 97 % a 100 %. Uzavírají tedy, že scintigrafie s 99mTc-PYP je vhodná a široce dostupná metoda pro detekci ATTR.
Z dalších metod použitelných pro detekci srdeční amyloidózy je dostupné vyšetření inervace myokardu pomocí 123I-MIBG. Tato metoda je však vhodná pouze u pacientů s autonomní dysfunkcí sympatiku v myokardu. Na druhou stranu je schopná detekovat ATTR dříve, než se objeví echokardiografické známky. 55
Metody nukleární medicíny se léta používají pro detekci amyloidových plaků v mozku u pacientů s podezřením na demenci Alzheimerova typu. 56 Původně se používala Pittsburgská sloučenina značená 11C (11C-PIB), dnes jsou k dispozici tři radiofarmaka značená18F: 18F-florbetaben (Neuraceq), 18F-flutemetamol (Vizamyl) a 18F-florbetapir (Amyvid). Ve studii Antoniho a spol. vyšetřili 10 pacientů se systémovou amyloidózou (7 AAL, 3 ATTR) a postižením srdce (5 ověřeno biopsií). U všech pacientů byla zjištěna akumulace 11C-PIB za 15–25 minut po podání RF na rozdíl od žádné akumulace u 5 kontrol. 57 V současné době se zdá, že by nová radiofarmaka značená 18F mohla být vhodná pro detekci srdeční AAL. 58
Restriktivní kardiomyopatie jako příčiny HFpEF jsou sice vzácné, ale jejich vyloučení může soustředit diagnostické úsilí jiným směrem. V tomto ohledu jsou scintigrafické metody velmi vhodné zejména proto, že jsou široce dostupné a mají vysokou senzitivitu.
Závěr
Srdeční selhání se zachovanou ejekční frakcí je častým klinickým syndromem a jeho prevalence narůstá se stárnutím populace. Navíc je spojeno s vysokou morbiditou i mortalitou. Správná diagnóza těchto pacientů je klíčová pro včasné zahájení cílené terapie. A v tomto ohledu může scintigrafická diagnostika významně přispět ostatním diagnostickým metodám. Musí však být správně indikovaná, profesionálně provedená a její výsledky dobře interpretované.
Sources
-
Hajouli S, Ludhwani D. Heart Failure And Ejection Fraction. [Updated 2020 Jun 25]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2020 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK553115/
-
Oktay AA, Shah SJ. Diagnosis and management of heart failure with preserved ejection fraction: 10 key lessons. Curr Cardiol Rev. 2015;11(1):42-52. doi:10.2174/1573403x09666131117131217
-
Owan TE, Hodge DO, Herges RM, Jacobsen SJ, Roger VL, Redfield MM. Trends in prevalence and outcome of heart failure with preserved ejection fraction. N Engl J Med 2006;355 : 251-9, DOI: 10.1056/NEJMoa052256
-
Lam CS, Donal E, Kraigher-Krainer E, Vasan RS. Epidemiology and clinical course of heart failure with preserved ejection fraction. Eur J Heart Fail 2011;13 : 18-28
-
Lam CS, Carson PE, Anand IS, et al. Sex differences in clinical characteristics and outcomes in elderly patients with heart failureand preserved ejection fraction: the Irbesartan in Heart Failure with Preserved Ejection Fraction (I-PRESERVE) trial. Circ Heart Fail 2012;5 : 571-578
-
Shah SJ. Precision Medicine for Heart Failure with Preserved Ejection Fraction: An Overview. J Cardiovasc Transl Res. 2017 June;10 : 233–244. doi:10.1007/s12265-017-9756-y.
-
Sharma K, Kass DA. Heart failure with preserved ejection fraction: mechanisms, clinical features, and therapies. Circ Res. 2014;115 : 79–96
-
Borlaug BA. The pathophysiology of heart failure with preserved ejection fraction. Nat Rev Cardiol. 2014; 11(9):507–515.
-
Sanderson JE. HFNEF, HFpEF, HF-PEF, or DHF. What Is in an Acronym? JACC HF 2014;2 : 93-94
-
Nagueh SF, Appleton CP, Gillebert TC, et al. Recommendations for the evaluation of left ventricular diastolic function by echocardiography. J Am Soc Echocardiogr 2009;22 : 107-133
-
Jessup M, Brozena S. Heart failure. N Engl J Med 2003; 348 : 2007-2018
-
Paulus WJ, Tschope C, Sanderson JE, et al. How to diagnose diastolic heart failure: a consensus statement on the diagnosis of heart failure with normal left ventricular ejection fraction by the Heart Failure and Echocardiography Association of the European Society of Cardiology. Eur Heart J 2007;28 : 2539–2550
-
Dunlay SM, Roger VL, Weston SA, Jiang R, Redfield MM. Longitudinal changes in ejection fraction in heart failure patients with preserved and reduced ejection fraction. Circ Heart Fail 2012;5 : 720–726
-
Tanai E, Frantz S. Pathophysiology of Heart Failure. Compr Physiol. 2015;6 : 187-214 Published 2015 Dec 15. doi:10.1002/cphy.c140055
-
van Heerebeek L. Understanding heart failure with preserved ejection fraction: where are we today? Neth Heart J 2016;24 : 227–236
-
Carsten T, et al. Latent ischaemia as a trigger for a circulus vitiosus of inflammation, fibrosis, and stiffness in HFPEF. European Journal of Heart Failure (2015);17 : 1210–1212
-
Steinberg BA, Zhao X, Heidenreich PA, et al. Trends in patients hospitalized with heart failure and preserved left ventricular ejection fraction: prevalence, therapies, and outcomes. Circulation 2012;126 : 65-75
-
Lang O. Scintigrafie u diabetické kardiomyopatie. NuklMed 2013;4 : 62-67
-
van Empel V, Brunner-La Rocca HP. Inflammation in HFpEF: Key or circumstantial?. Int J Cardiol. 2015;189 : 259-263 doi:10.1016/j.ijcard.2015.04.110
-
Paulus WJ, Tschope C. A novel paradigm for heart failure with preserved ejection fraction: comorbidities drive myocardial dysfunction and remodeling through coronary microvascular endothelial inflammation, J. Am. Coll. Cardiol. 2013;62 : 263–271
-
Shah SJ, Wasserstrom JA. Increased arterial wave reflection magnitude: a novel form of stage B heart failure? J Am Coll Cardiol. 2012; 60 : 2178–2181
-
Farrell MB, Galt JR, Georgoulias P et al. SNMMI Procedure Standard/EANM Guideline for Gated Equilibrium Radionuclide Angiography. J Nucl Med Technol. 2020 Jun;48 : 126-135 doi: 10.2967/jnmt.120.246405.
-
Vered A, Battler A, Segal P, et al. Exercise-induced left ventricular dysfunction in young men with asymptomatic diabetes mellitus (diabetic cardiomyopathy). Am J Cardiol 1984;54 : 633-637
-
Strauss HW, Miller DD, Wittry MD et al. Procedure guideline for myocardial perfusion imaging 3.3. J Nucl Med Technol. 2008 Sep;36 : 155-161 doi: 10.2967/jnmt.108.056465.
-
Dorbala S, Di Carli MF, Delbeke D et al. SNMMI/ASNC/SCCT guideline for cardiac SPECT/CT and PET/CT 1.0. J Nucl Med. 2013 Aug;54 : 1485-1507 doi: 10.2967/jnumed.112.105155.
-
Tschope C, Post H. Latent ischaemia as a trigger for a circulus vitiosus of inflammation, fibrosis, and stiffness in HFPEF. European Journal of Heart Failure 2015;17 : 1210–1212 doi:10.1002/ejhf.439
-
Xu M, Yan L, Xu J et al. Predictors and prognosis for incident in-hospital heart failure in patients with preserved ejection fraction after first acute myocardial infarction. An observational study. Medicine 2018;97 : 24(e11093). doi: 10.1097/MD.0000000000011093
-
Jones RH, Velazquez EJ, Michler RE et al. STICH Hypothesis 2 Investigators. Coronary bypass surgery with or without surgical ventricular reconstruction. N. Engl. J. Med. 2009 Apr 23;360 : 1705-1717
-
Wackers FJT, Chyun DA, Young LH, et al. Resolution of asymptomatic myocardial ischemia in patients with type 2 diabetes in the Detection of Ischemia in Asymptomatic Diabetics (DIAD) study. Diabetes Care 2007;30 : 2892-2898
-
Bairey Merz CN, Shaw LJ, Reis SE, et al. Insights from the NHLBISponsored Women‘s Ischemia Syndrome Evaluation (WISE) Study: Part II: gender differences in presentation, diagnosis, and outcome with regard to gender-based pathophysiology of atherosclerosis and macrovascular and microvascular coronary disease. J Am Coll Cardiol 2006;47:S21-S29
-
Dorbala S, Vangala D, Bruyere J Jr, et al. Coronary microvascular dysfunction is related to abnormalities in myocardial structure and function in cardiac amyloidosis. JACC Heart Fail. 2014;2 : 358-367 doi:10.1016/j.jchf.2014.03.009
-
Bashir A, Gropler RJ. Translation of Myocardial Metabolic Imaging Concepts into the Clinics. Cardiol Clin 2009;27 : 291-319
-
Kaye DM, Lambert GW, Lefkovits J et al. Neurochemical evidence of cardiac sympathetic activation and increased central nervous system norepinephrine turnover in severe congestive heart failure. J Am Coll Cardiol. 1994;23 : 570–578
-
Voulgari C, Papadogiannis D, Tentolouris N. Diabetic cardiomyopathy: from the pathophysiology of the cardiac myocytes to current diagnosis and management strategies. Vasc Health Risk Manag 2010;6 : 883-903
-
Aikawa T, Naya M, Obara M et al. Impaired Myocardial Sympathetic Innervation Is Associated with Diastolic Dysfunction in Heart Failure with Preserved Ejection Fraction: 11C-Hydroxyephedrine PET Study. J Nucl Med 2017;58 : 784–790 DOI: 10.2967/jnumed.116.178558
-
Kiuchi S, Hisatake S, Kabuki T et al. Effect of Switching from Cilnidipine to Azelnidipine on Cardiac Sympathetic Nerve Function in Patients with Heart Failure Preserved Ejection Fraction. Int Heart J 2018;59 : 120-125
-
Lee WW. Recent Advances in Nuclear Cardiology. Nucl Med Mol Imaging (2016) 50 : 196–206 DOI 10.1007/s13139-016-0433-x
-
Yazaki Y, Isobe M, Hiroe M et al. Prognostic determinants of long-term survival in Japanese patients with cardiac sarcoidosis treated with prednisone. Am J Cardiol. 2001;88 : 1006–1010
-
BirnieDH, SauerWH, Bogun F et al. HRS expert consensus statement on the diagnosis and management of arrhythmias associated with cardiac sarcoidosis. Heart Rhythm. 2014;11 : 1305–1323
-
Lu Y, Grant C, Xie K et al. Suppres-sion of myocardial 18F-FDG uptake through prolonged high-fat, high-protein, and very-low-carbohydrate diet before FDG-PET/CT for eval-uation of patients with suspected cardiac sar-coidosis. Clin Nucl Med 2017; 42 : 88-94
-
Slart RHJA, Glaudemans AWJM, Lancellotti P, et al. A joint procedural position statement on imaging in cardiac sarcoidosis: from the Cardiovascular and Inflammation & Infection Committees of the European Association of Nuclear Medicine, the European Association of Cardiovascular Imaging, and the American Society of Nuclear Cardiology. J Nucl Cardiol. 2018;25 : 298-319 doi:10.1007/s12350-017-1043-4
-
Keijsers RGM, Grutters JC. In Which Patients with Sarcoidosis Is FDG PET/CT Indicated?. J Clin Med. 2020;9 : 890 Published 2020 Mar 24. doi:10.3390/jcm9030890
-
Youssef, G, Leung, E, Mylonas, I et al. The use of 18F-FDG PET in the diagnosis of cardiac sarcoidosis: A systematic review and metaanalysis including the Ontario experience. J. Nucl. Med. 2012;53 : 241–248
-
Tetikkurt C, Sayman H, Dedeoglu SE, Kubat B, Tetikkurt S. Simultaneous use of FDG-18 and 68Ga-citrate PET/CT for the differential diagnosis of sarcoidosis and malignant disease. Monaldi Arch Chest Dis. 2020;90 : 10.4081/monaldi.2020.1320. Published 2020 Jul 29. doi:10.4081/monaldi.2020.1320
-
Benson MD, Buxbaum JN, Eisenberg DS et al. Amyloid nomenclature 2018: recommendations by the International Society of Amyloidosis (ISA) nomenclature committee, Amyloid 2018;25 : 215–219
-
Papathanasiou M, Carpinteiro A, Rischpler C et al. Diagnosing cardiac amyloidosis in every-day practice: A practical guide for the cardiologist. IJC Heart & Vasculature 28 (2020) 100519
-
Wechalekar AD, Gillmore JD, Hawkins PN. Systemic amyloidosis, Lancet 2016;387 : 2641–2654
-
Gillmore JD, Maurer MS, Falk RH et al., Nonbiopsy diagnosis of cardiac transthyretin amyloidosis. Circulation 2016;133 : 2404–2412
-
Kula RW, Engel WK, Line BR. Scanning for soft-tissue amyloid. Lancet. 1977;1 : 92–93
-
Perugini E, Guidalotti PL, Salvi F et al. Noninvasive etiologic diagnosis of cardiac amyloidosis using 99mTc-3,3-diphosphono-1,2-propanodicarboxylic acid scintigraphy. J Am Coll Cardiol 2005;46 : 1076-1084. doi:10.1016/j.jacc.2005.05.073
-
Fathala A. Incidentally detected cardiac amyloidosis on 99mTc-MDP bone scintigraphy. Radiol Case Rep. 2020;15 : 705-708. Published 2020 Apr 7. doi:10.1016/j.radcr.2020.03.010
-
Rapezzi C, Quarta CC, Guidalotti PL et al. Usefulness and limitations of 99mTc-3,3-diphosphono-1,2-propanodicarboxylic acid scintigraphy in the aetiological diagnosis of amyloidotic cardiomyopathy. Eur J Nucl Med Mol Imaging 2011;38 : 470–478
-
Bokhari S, Shahzad R, Castaño A et al. Nuclear imaging modalities for cardiac amyloidosis. J Nucl Cardiol. 2014;21 : 175–184 doi:10.1007/s12350-013-9803-2.
-
Bokhari S, Castaño A, Pozniakoff T et al. 99mTc-pyrophosphate scintigraphy for differentiating light-chain cardiac amyloidosis from the transthyretin-related familial and senile cardiac amyloidoses. Circ Cardiovasc Imaging 2013;6 : 195–201
-
Noordzij W, Glaudemans AW, Rheenen RW et al. (123)I-Labelled metaiodobenzylguanidine for the evaluation of cardiac sympathetic denervation in early stage amyloidosis. Eur J Nucl Med Mol Imaging 2012;39 : 1609–1617
-
Fink HA, Hemmy LS, Linskens EJ, et al. Diagnosis and Treatment of Clinical Alzheimer’s-Type Dementia: A Systematic Review. Rockville (MD): Agency for Healthcare Research and Quality (US); April 2020.
-
Antoni G, Lubberink M, Estrada S, Axelsson J, Carlson K, Lindsjö L, et al. In vivo visualization of amyloid deposits in the heart with 11C-PIB and PET. J Nucl Med. 2012;54 : 213–220.
-
Ehman EC, El-Sady MS, Kijewski MF, et al. Early Detection of Multiorgan Light-Chain Amyloidosis by Whole-Body 18F-Florbetapir PET/CT. J Nucl Med. 2019;60 : 1234-1239 doi:10.2967/jnumed.118.221770
Labels
Nuclear medicine Radiodiagnostics Radiotherapy
Article was published inNuclear Medicine

2020 Issue 3
Most read in this issue- Role of scintigraphic procedures in patients with heart failure and preserved ejection fraction
- The value of FDG PET/CT in the thromboembolic disease: review of the literature
- What can you see on the image?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

