-
Medical journals
- Career
Porovnanie celotelovej scintigrafie skeletu so sérovou koncentráciou ľudského epididymálneho proteínu 4 u pacientov s malígnym melanómom
Authors: Jaroslav Weissensteiner 1; Eva Babušíková 2
Authors‘ workplace: Oddelenie nukleárnej medicíny, Nemocnica Poprad, a. s., SR 1; Ústav lekárskej biochémie, Jesseniova lekárska fakulta v Martine, Univerzita Komenského v Bratislave, SR 2
Published in: NuklMed 2015;4:8-12
Category: Original Article
Overview
Úvod:
Melanóm je jedným z najmalígnejších nádorov kože a je najčastejšou príčinou úmrtia u kožných ochorení. V ostatných desaťročiach sa jeho výskyt výrazne zvýšil. Cieľom našej práce bolo porovnať hladinu onkomarkera ľudský epididymálny proteín 4 (HE4) v korelácii s nálezom kostných metastáz zistených pri celotelovej scintigrafii skeletu u pacientov s malígnym melanómom a posúdiť jeho význam v diagnostike malígneho melanómu.Materiál a metódy:
U 14 pacientov (4 muži, 10 žien) s malígnym melanómom sme stanovili hladinu HE4 v sére z krvnej vzorky odobratej pred aplikáciou rádiofarmaka v rámci vyšetrenia celotelovej scintigrafie skeletu za použitia hybridnej gamakamery SPECT/CT (single photon emission computed tomography/computed tomography, jednofotónová emisná počítačová tomografia/počítačová tomografia). Výsledky sme porovnali s hodnotami 10 ľudí bez prítomného nádorového ochorenia, ktorí tvorili kontrolnú skupinu.Výsledky:
Kostné metastázy zistené pri celotelovej scintigrafii skeletu boli prítomné v 5 prípadoch (35,71 %), pravdepodobné v 3 prípadoch (21,43 %) a 6 pacienti (42,86 %) boli bez nálezu kostných metastáz. Koncentrácia HE4 bola u pacientov signifikantne vyššia ako u kontrolnej skupiny. Nad rozsah referenčných hodnôt bola koncentrácia HE4 zvýšená len u jedného pacienta s melanómom. Koncentrácie HE4 sa u pacientov nelíšili v závislosti od kostných metastáz.Záver:
V našej pilotnej štúdii sme u pacientov s malígnym melanómom pozorovali vyššie koncentrácie HE4 v porovnaní s kontrolnou skupinou. Sérové hladiny HE4 nekorelovali s nálezom pri celotelovej scintigrafii skeletu.Kľúčové slová:
melanóm, ľudský epididymálny proteín 4, scintigrafia skeletuÚvod
Malígny melanóm (MM, melanoma malignum) je najzhubnejší nádor kože a vo všeobecnosti patrí k najmalígnejším nádorom vôbec. Podkladom vzniku malígneho melanómu je malígna transformácia melanocytov, neuroektodermálnych buniek produkujúcich melanín. 1, 2 Najčastejšie sa vyskytuje v koži, oku, zriedkavejšie na slizniciach ústnej a nosovej dutiny, pažeráka, konečníka, penisu, vulvy, vagíny a očných spojoviek. 3 Toto nádorové ochorenie postihuje obe pohlavia (u žienje častejší v pomere 3 : 2) a prevažujúce lokalizácie sú u mužov trup (61 %) a u žien dolné končatiny (37,7 %). Incidencia v Slovenskej republike je 12,7 prípadov u mužov a 11,7 prípadov ochorenia u žien na 100 000 obyvateľov. 4
Melanóm sa môže šíriť krvnou alebo lymfatickou cestou, pozdĺž lymfatických a krvných ciev, nervových štruktúr alebo priamo lokálnou inváziou. 5 Najčastejšie metastázuje do oblasti kože, podkožných tkanív, spádových lymfatických uzlín, do pľúc, pečene, mozgu, menej do kostí a tenkého čreva. 6,7
Kostné metastázy vznikajú pri malígnom melanóme v kostnej dreni. 8 Metastázy v kostnej dreni sú pri malígnom melanóme zriedkavé a vyskytujú sa u 5–7 % pacientov s diseminovaným ochorením, ale pri zameraní sa na vyšetrenie kostnej drene sa ich výskyt zistil až v 45 % prípadov. 9 Kostné metastázy sa vo všeobecnosti vyskytujú u pacientov s pokročilým metastatickým ochorením. Častejšie sa vyskytujú v axiálnom skelete ako v apendikulárnom a hlavne v stavcoch chrbtice. Typické kostné metastázy pri MM sú osteolytické s pôvodom v kostnej dreni. Lézie svojím rastom zapríčiňujú eróziu a deštrukciu kostného tkaniva so vznikom patologických fraktúr. Atypické kostné metastázy sa prejavujú ako osteolyticko-osteoblastické alebo zriedkavo ako kompletne osteoblastické. 10 Na vylúčenie mikrometastáz v regionálnych lymfatických uzlinách sa využíva detekcia a extirpácia sentinelovej, tzv. strážnej lymfatickej uzliny (SLU). Primárne ložisko malígneho melanómu a jeho metastázy sa vyznačujú vysokým metabolizmom glukózy, čo má za následok vysokú akumuláciu 2-[18F]-fluoro-2-deoxy-D-glukózy (18F-FDG) a možnosť celotelového vyšetrenia pozitrónovou emisnou tomografiou/počítačovou tomografiou (positron emission tomography/computed tomography, PET/CT). 11,12,13 Celotelová pozitrónová emisná tomografia/magnetická rezonancia (positron emission tomography/magnetic resonance, PET/MR) je metabolicko-anatomická zobrazovacia metóda, ktorá umožňuje detekciu podkožných metastáz, metastáz v kostnej dreni, v pečeni a v mozgu u pacientov s malígnym melanómom v rámci jedného vyšetrenia. 14 Pri podozrení na kostné metastázy u pacientov s malígnym melanómom sa môže využiť celotelová scintigrafia skeletu a pre upresnenie nálezu aj hybridné SPECT/CT vyšetrenie.
Ľudský epididymálny proteín 4 (HE4, human epididymal protein 4) je kódovaný génom srvátková kyslá 4-disulfidová jadrová doména 2 (WFDC2, whey acidic 4-disulfide core domain 2), ktorý sa nachádza na chromozóme 20q12-13.1. Tento gén je členom rodiny bielkovín, ktoré obsahujú srvátkovú kyslú bielkovinovú doménu (WAP, whey acidic protein). Srvátkové kyslé bielkoviny boli identifikované ako hlavné zložky mlieka hlodavcov i cicavcov, dôležité regulátory v proliferácii cicavčích epiteliálnych buniek a proteázové inhibítory. Ľudský epididymálny proteín 4 je glykozylovaná bielkovina (veľkosť 20–25 kDa) s podobnou štruktúrou, ako majú proteinázové inhibítory, pričom jej funkcia nie je presne známa. Predpokladá sa, že inhibuje trypsín a mohla by participovať na dozrievaní spermií. Táto bielkovina je produkovaná tkanivom nadsemenníkov. Prvýkrát HE4 identifikoval a popísal Kirchhoff a kol. 15,16,17 Zvýšená hladina HE4 bola pozorovaná v sére u karcinómov vaječníkov a má u tohto ochorenia senzitivitu 67–76 % a špecificitu 95–96 %, preto sa predpokladá, že HE4 by mohol hrať úlohu v karcinogenéze a progresii nádoru. 18,19,20,21
Stanovenie hodnôt onkomarkera HE4 možno využiť na sledovanie priebehu ochorenia, hodnotenie progresie a sledovanie účinnosti liečby u pacientok s epiteliálnym karcinómom ovária a na diferenciálnu diagnostiku tumoru ovária (suspektná malignita). Navyše jeho stanovenie je vhodné aj pri sledovaní pacientok s karcinómom endometria. V poslednom období sa ukazuje, že stanovenie koncentrácie HE4 by mohlo mať význam aj u pacientov s inými malígnymi nádorovými ochoreniami.
Naším cieľom bolo porovnať sérovú koncentráciu ľudského epididymálneho proteínu 4 v korelácii s nálezom zisteným pri celotelovej scintigrafii skeletu u pacientov s malígnym melanómom a posúdiť jeho význam v diagnostike malígneho melanómu.
Materiál a metódy
U 14 pacientov (4 muži, 10 žien, vekový priemer 60, rozsah 41–79 rokov) s malígnym melanómom sme stanovili koncentráciu HE4 v sére z krvnej vzorky odobratej pred aplikáciou rádiofarmaka 99mTc-metyléndifosfonát (99mTc-MDP) o aktivite 500–700 MBq v rámci vyšetrenia celotelovej scintigrafie skeletu ako celotelový záznam v prednej a zadnej projekcii za použitia hybridnej gamakamery SPECT/CT typu BrightView XCT, Philips. Vyšetrenie celotelovej scintigrafie skeletu sa realizovalo v rozmedzí 2–4 hodín od aplikácie rádiofarmaka posunom vyšetrovacieho lôžka s pacientom medzi dvoma stacionárnymi detektormi uloženými nad a pod pacientom s rýchlosťou posunu lôžka 10–12 cm za minútu s použitím nízkoenergetických kolimátorov s paralelnými otvormi typu LEGP (low energy general purpose). Pri presnejšej lokalizácii ložiska alebo jeho odlíšení od iného ochorenia podobajúceho sa nálezom na kostnú metastázu sme realizovali hybridné SPECT/CT vyšetrenie. Výsledky sme porovnali s hodnotami 10 ľudí bez prítomného nádorového ochorenia – kontrolná skupina (2 muži, 8 žien, vekový priemer 52,3, rozsah 34–67 rokov), u ktorých sa realizovalo vyšetrenie celotelovej scintigrafie skeletu z iných dôvodov (nejasné bolesti chrbtice, nejasné bolesti kĺbov). Odobratú krv v sterilnej skúmavke o objeme 5–6 ml sme centrifugovali v odstredivke pri otáčkach 4000 za minútu v trvaní 5 minút. Po centrifugácii sme získané sérum uskladnili pri teplote – 20 °C, neskôr pri teplote – 50 a – 70 °C. Po skompletizovaní sme vzorky séra vyšetrili na oddelení klinickej biochémie elektrochemiluminiscenčnou imunoanalýzou (ECLIA) na imunoanalyzátore typu Cobas e 411 (ROCHE Diagnostics).
Výsledky
Kostné metastázy (mts) zistené pri celotelovej scintigrafii skeletu boli prítomné v 5 prípadoch (35,71 %), pravdepodobné v 3 prípadoch (21,43 %) a 6 pacienti (42,86 %) boli bez nálezu kostných metastáz. (Tab. 1) Pravdepodobné mts sú charakterizované ako lézie, ktoré sú podozrivé z kostných metastáz a nepravdepodobné pre iné lézie. Pacientov sme rozdelili aj podľa veku v závislosti od nálezu pri celotelovej scintigrafii skeletu. (Tab. 2) V čase vyšetrenia celotelovou scintigrafiou skeletu boli 4 pacienti po liečbe a u jedného pacienta nebola ešte v čase vyšetrenia liečba chemoterapiou ukončená. Zo 4 pacientov po liečbe dostávali 2 pacienti interferón, jeden pacient bol po rádioterapii a jeden po rádioterapii aj chemoterapii. U 8 pacientov bolo v minulosti realizované aj scintigrafické vyšetrenie a peroperačná detekcia SLU. (Tab. 3) Pozitívna SLU bola u 4 pacientov, pričom u 3 týchto pacientov sa rozvinuli aj mts. V jednom prípade sa u pacienta s negatívnou SLU (Clark II-III, Breslow 6 mm) objavili mts v skelete do 3,5 roka.
Table 1. Nález celotelovej scintigrafie skeletu u pacientov s malígnym melanómom (mts – kostné metastázy, n – počet pacientov). 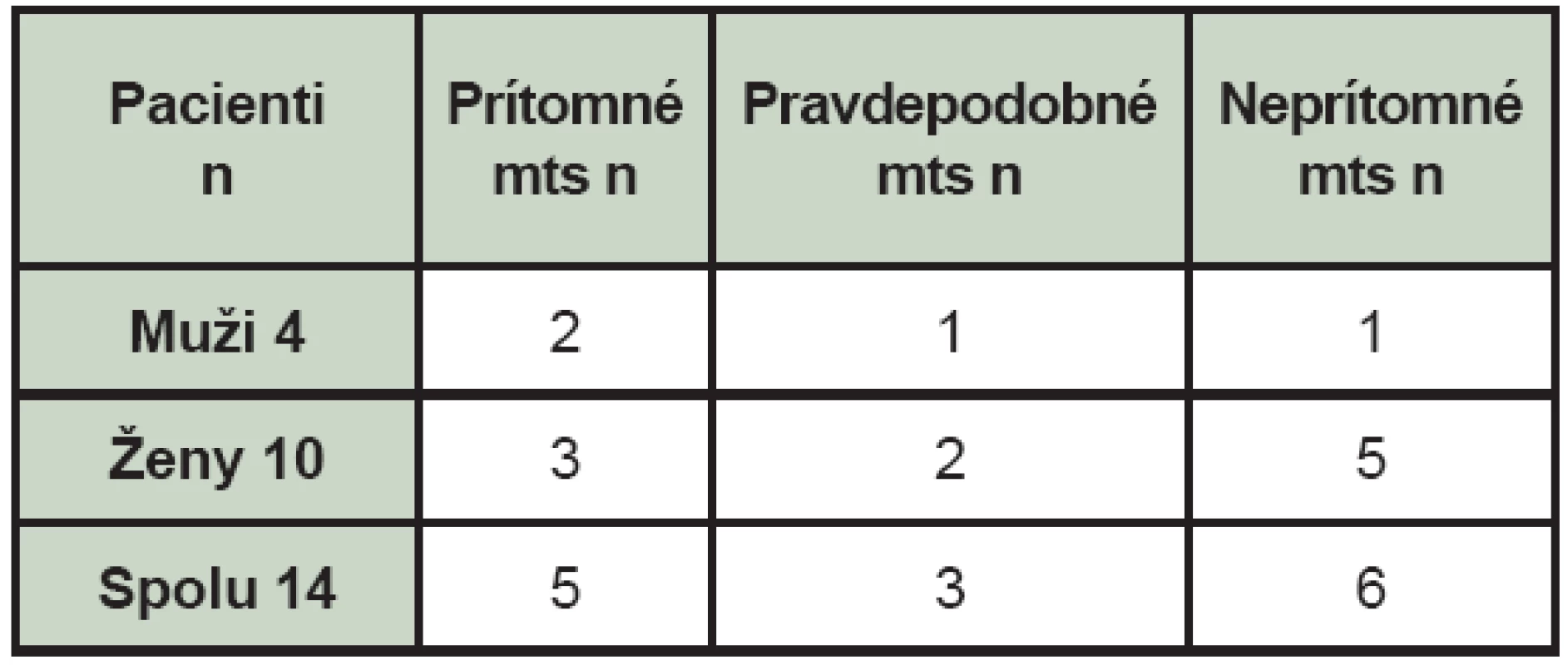
Table 2. Nález celotelovej scintigrafie skeletu u pacientov s malígnym melanómom – rozdelenie podľa veku (mts – kostné metastázy, n – počet pacientov). 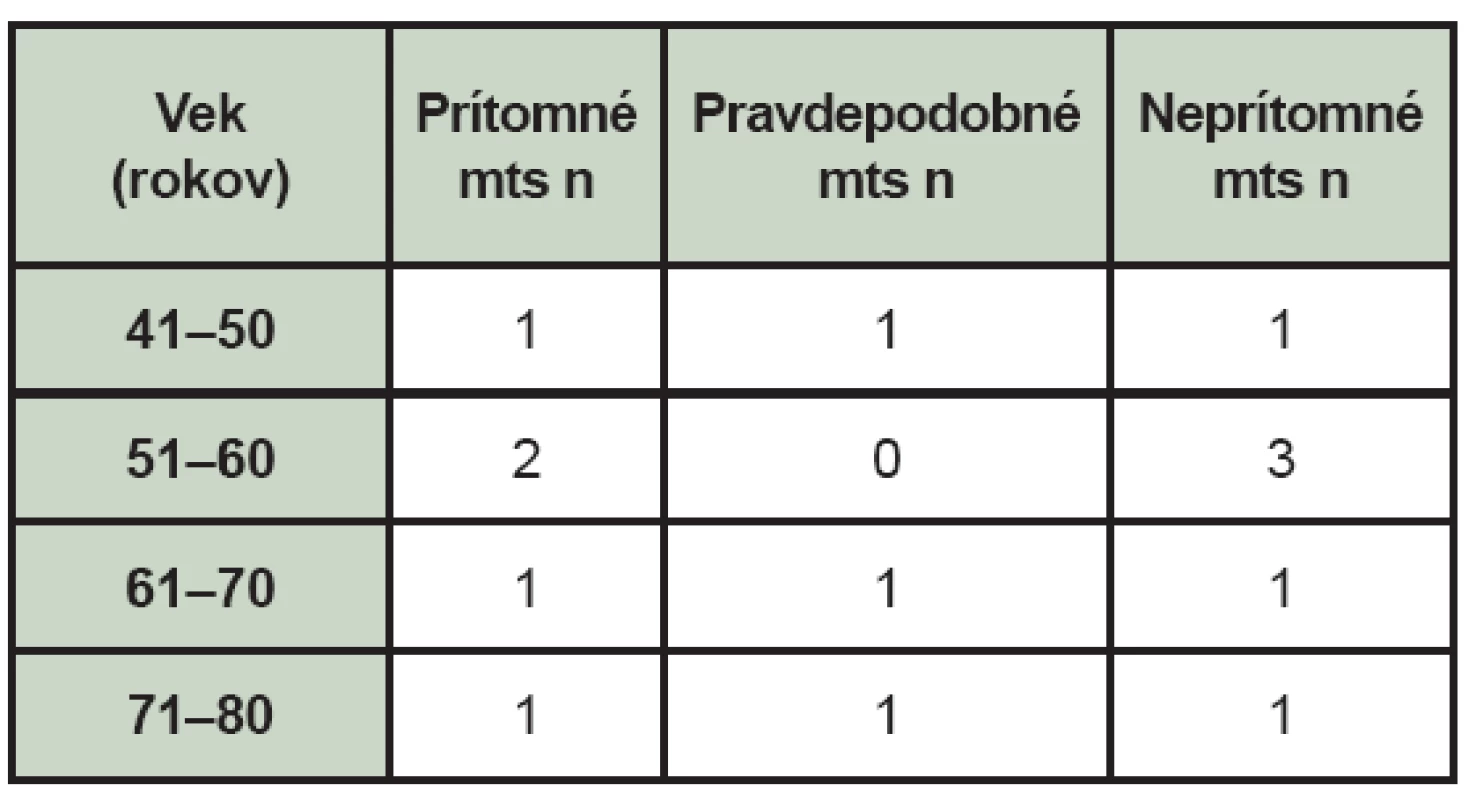
Table 3. Nález celotelovej scintigrafie skeletu, SLU, využitie hybridného vyšetrenia SPECT/CT v rámci celotelotelovej scintigrafie skeletu (mts – kostné metastázy, n – počet pacientov, SLU – sentinelová lymfatická uzlina, SPECT/CT – jednofotónová emisná počítačová tomografia/počítačová tomografia). 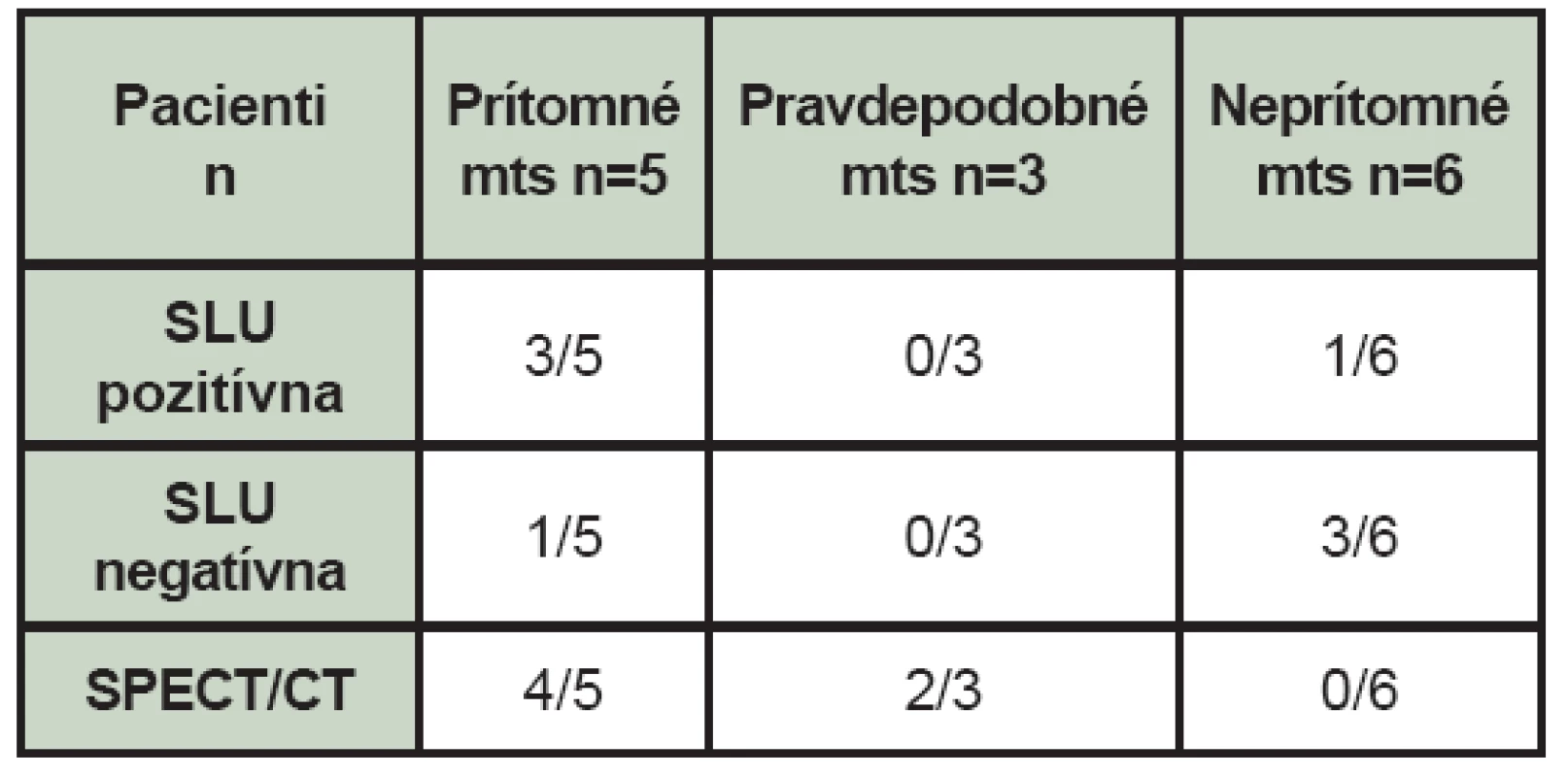
Hybridné SPECT/CT vyšetrenie v rámci celotelovej scintigrafie skeletu sme zo 14 pacientov s melanómom použili v 6 prípadoch a to v 4 prípadoch u pacientov s nálezom kostných metastáz, (Tab. 3) čím sa upresnila diagnostika kostných metastáz. V 2 prípadoch pravdepodobných kostných metastáz však použitie SPECT/CT neprinieslo očakávané upresnenie nálezu.
Malígny melanóm bol lokalizovaný v 3 prípadoch v oblasti chrbta, v 4 prípadoch na ramene, v 3 prípadoch na hlave, v jednom na predlaktí, päte, v oku a v jednom prípade nebola lokalizácia malígneho melanómu známa. (Tab. 4) Najčastejšie boli lokalizované kostné metastázy v oblasti stavcov chrbtice, v panvových kostiach a menej často v stehenných kostiach, v rebrách a v ramenných kostiach. (Tab. 5)
Table 4. Nález celotelovej scintigrafie skeletu pri jednotlivých lokalizáciách melanómu (mts – kostné metastázy, n – počet pacientov). 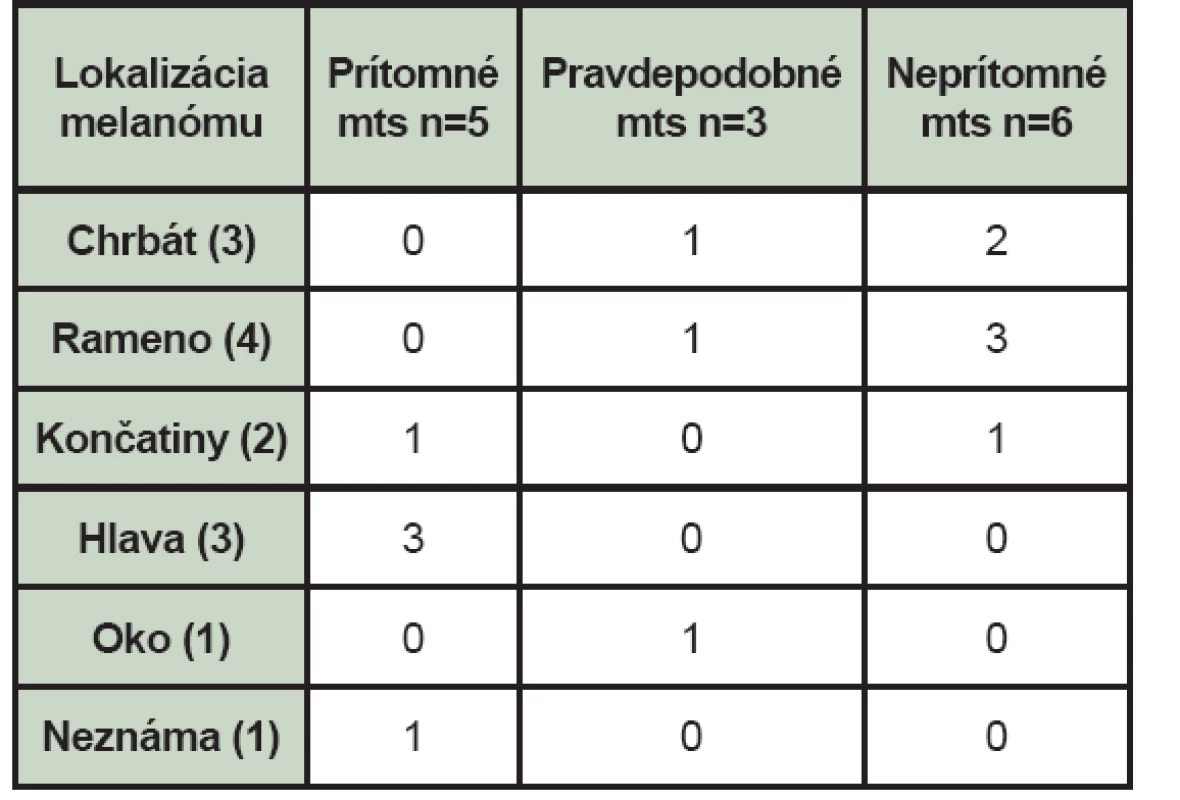
Table 5. Lokalizácia kostných metastáz u pacientov s malígnym melanómom na základe nálezu zistenom pri celotelovej scintigrafii skeletu (mts – kostné metastázy, n – počet pacientov s daným nálezom lokalizácie kostnej metastázy). 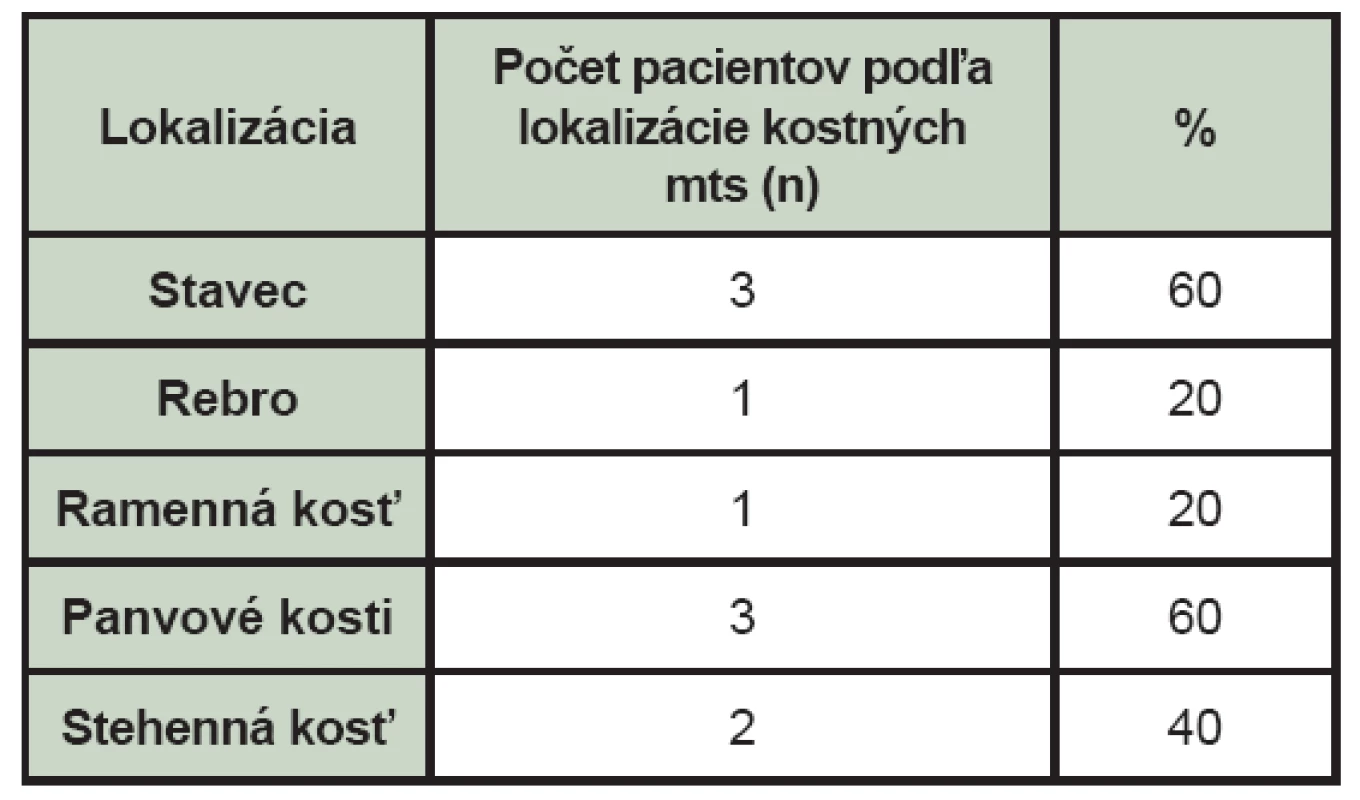
U pacientov s malígnym melanómom a u kontrolnej skupiny sme stanovili koncentrácie HE4 v sére (Graf 1) a následne sme výsledky porovnali s nálezom pri celotelovej scintigrafii skeletu. (Graf 2)
Graph 1. Porovnanie sérovej koncentrácie HE4 (priemerná hodnota) u jedincov bez prítomného malígneho ochorenia a u pacientov s malígnym melanómom (HE4 – ľudský epididymálny proteín 4, KS – kontrolná skupina, M – pacienti s malígnym melanómom); referenčné hodnoty HE4: ≤ 140 pmol/l). 
Graph 2. Priemerná hodnota HE4 v sére u jedincov bez prítomného nádorového ochorenia a u pacientov s malígnym melanómom s nálezom prítomných, pravdepodobných a neprítomných kostných metastáz na celotelovej scintigrafii skeletu (HE4 – ľudský epididymálny proteín 4, KS – kontrolná skupina, PM – prítomné kostné metastázy, PrM – pravdepodobné kostné metastázy, N – neprítomné kostné metastázy). 
Koncentrácia HE4 bola u pacientov s malígnym melanómom signifikantne vyššia (43,6 %) ako u kontrolnej skupiny. Nad rozsah referenčných hodnôt bola koncentrácia HE4 v sére zvýšená len u jedného pacienta s melanómom s nálezom pravdepodobných kostných metastáz na celotelovej scintigrafii skeletu. V kontrolnej skupine boli koncentrácie HE4 v rozsahu referenčných hodnôt. Koncentrácie HE4 sa u pacientov s mts nelíšili od koncentrácie HE4 u pacientov bez mts.
Diskusia
V našej pilotnej štúdii sme u 14 pacientov s malígnym melanómom detekovali kostné metastázy a stanovovali koncentráciu HE4. Kostné metastázy sme zistili u 5 pacientov, u ďalších troch sme pozorovali pravdepodobné metastázy. U týchto troch pacientov bude vhodné zopakovať vyšetrenie celotelovej scintigrafie o 4–5 mesiacov. Vyšetrenie sentinelovej lymfatickej uzliny sa realizovalo u 8 pacientov. U 3 pacientov s pozitívnou SLU boli neskôr na celotelovej scintigrafii skeletu prítomné aj kostné metastázy, v jednom prípade aj pri negatívnej SLU u pacienta s malígnym melanómom (Clark II–III, Breslow 6 mm) sa do 3,5 roka objavili mts. Pozitivita SLU alebo neskoršie stanovenie diagnózy malígneho melanómu a tým jeho neskoršej liečby môže mať za následok zvýšené riziko vzniku metastáz v kostiach.
V tkanive kože zdravých jedincov s neprítomným nádorovým ochorením sa expresia HE4 nezistila. Galgano a kol. nezistili prítomnosť expresie HE4 v karcinómoch z bazálnych buniek kože. 22 Zvýšená expresia HE4 bola nájdená v bunkách označovaných ako MALME-3M. Bunky MALME-3M sú fibroblasty získané z metastáz malígneho melanómu lokalizovaných v pľúcach. 23 Predpokladáme, že zvýšená expresia HE4 v bunkách MALME-3M z metastáz malígneho melanómu v pľúcach môže byť dôsledok obranných mechanizmov a reakcie tkaniva respiračného systému na prítomnosť metastáz malígneho melanómu v pľúcach. Produkcia HE4 by mohla zároveň odzrkadľovať progresiu nádorového ochorenia v pľúcnom tkanive. Iná lokalizácia metastáz mimo kostných tkanív sa tým môže tiež podieľať na zvyšovaní koncentrácie HE4. V našej skupine 14 pacientov s malígnym melanómom bola zvýšená hladina HE4 nad rozsah referenčných hodnôt v jednom prípade s nálezom pravdepodobných kostných mts na celotelovej scintigrafii skeletu. Zmeny sérovej koncentrácie HE4 sme u pacientov s kostnými metastázami prítomnými pri celotelovej scintigrafii skeletu nezistili, hoci koncentrácie HE4 boli vyššie u pacientov ako v kontrolnej skupine. Escudero a kol. vo svojej práci udávajú zvýšenú hodnotu HE4 v sére v jednom prípade v skupine 9 pacientov s malígnym melanómom. 24 Ľudský epididymálny proteín 4 sa v súčasnosti používa ako nádorový marker pri karcinóme ovária, kde má význam pri stanovení diagnózy, prognózy, sledovanie pacientky po operácii a v rámci diferenciálnej diagnostiky u pacientky s tumoróznou masou v oblasti panvy. V ostatnom období nadobúda HE4 ako nádorový marker význam aj pri karcinóme endometria a neustále sa objavujú nové poznatky o jeho expresii aj pri iných druhoch nádorových ochorení. 25,26 Ukazuje sa, že HE4 by mohol byť špecifickým markerom pre viaceré nádorové ochorenia, ale sú potrebné ďalšie štúdie a najmä rozšíriť súbor vyšetrovaných pacientov. Na presnejšie hodnotenie významu tohto onkomarkera by bolo potrebné vyšetriť väčší počet pacientov.
Záver
U pacientov s malígnym melanómom sme pozorovali vyššie koncentrácie ľudského epididymálneho proteínu 4 v porovnaní s kontrolnou skupinou. Sérové hladiny ľudského epididymálneho proteínu 4 nekorelovali s nálezom zisteným pri celotelovej scintigrafii skeletu. Na presnejšie posúdenie sérových koncentrácií ľudského epididymálneho proteínu 4 u pacientov s malígnym melanómom by však bolo vhodné porovnať väčší súbor pacientov a prípadne porovnať koncentrácie aj s nálezom zisteným pri celotelovom PET/CT eventuálne PET/MR vyšetrení s 18F-FDG so zameraním sa aj na metastázy v kostnej dreni.
Jaroslav Weissensteiner 1, Eva Babušíková 2
1 Oddelenie nukleárnej medicíny, Nemocnica Poprad, a.s., SR
2 Ústav lekárskej biochémie, Jesseniova lekárska fakulta v Martine, Univerzita Komenského v Bratislave, SR
jaroslav.weissensteiner@gmail.com
Sources
1. Bayraktutan U, Kantarci M, Pirimoglu B et al. Utility of diffusion-weighted imaging in the diagnosis of inguinal lymph node metastasis with malignant melanoma. World J Clin Cases 2014;2 : 42-44
2. Maire C, Vercambre-Darras S, Desmedt E. Diagnosis of melanoma. Rev Prat 2014;64 : 61-68
3. Bandarchii B, Jabbari CA, Vedadi A et al. Molecular biology of normal melanocytes and melanoma cells. J Clin Pathol 2013;66 : 644-648
4. Diba CS, Pleško I, Hlava P. Incidencia zhubných nádorov v Slovenskej republike 2007. Bratislava, NCZI, 2012, 135 s
5. Aladovicz E, Ferro L, Vitali GC et al. Molecular networks in melanoma invasion and metastasis. Future Oncol 2013;9 : 713-726
6. Zbytek B, Carlson JA, Granese J et al. Current concepts of metastasis in melanoma. Expert Rev Dermatol 2008;3 : 569-585
7. Bobrovská M, Minariková E, Plank L. Diagnostika malígneho melanómu. Onkológia 2009;4 : 144-148
8. Jain D, Singh T, Kumar N et al. Metastatic malignant melanoma in bone marrow with occult primary site – a case report with review of literature. Diagnostic Pathology 2007;2 : 38-41
9. Serrier C, Lesesve JF. Metastatic malignant melanoma in the bone marrow. Blood 2013;121 : 721
10. Potepan P, Spagnoli I, Danesini GM et al. The radiodiagnosis of bone metastases from melanoma. Radiol Med 1994;87 : 741-746
11. Votrubová J. Melanom. In: Votrubová J et al. Klinické PET a PET/CT. Praha, Galén, 2009; 159-162
12. Bastiaannet E, Wobbes T, Hoekstra OS et al. Prospective comparison of [18F] fluorodeoxyglucose positron emission tomography and computed tomography in patients with melanoma with palpable lymph node metastases: diagnostic accuracy and impact on treatment. J Clin Oncol 2009;27 : 4774-4780
13. Barsky M, Cherkassky L, Vezederis M et al. The role of preoperative positron emission tomography/computed tomography (PET/CT) in patients with high-risk melanoma. J Surg Oncol 2014;109 : 726-729
14. Buchbender C, Heusner TA, Lauenstein TC et al. Oncologic PET/MRI, part 2: bone tumors, soft-tissue tumors, melanoma, and lymphoma. J Nucl Med 2012;53 : 1244-1252
15. Kirchhoff C, Habben I, Ivell R et al. A major human epididymis-specific cDNA encodes a protein with sequence homology to extracellular proteinase inhibitors. Biol Reprod 1991;45 : 350-357
16. Kirchhoff C. Molecular characterization of epididymal proteins. Rev Reprod 1998;3 : 86-95
17. Bingle L, Cross SS, High AS et al. WFDC2 (HE4): a potential role in the innate imunity of the oral cavity and respiratory tract and the development of adenocarcinomas of the lung. Respir Res 2006;7 : 61-70
18. Clauss A, Lilja H, Lundwall A. A locus on human chromosome 20 contains several genes expressing protease inhibitor domains with homology to whey acidic protein. Biochem J 2002;368 : 233-242
19. Hellström I, Raycraft J, Hayden-Ledbetter M et al. The HE4 (WFDC2) protein is a biomarker for ovarian carcinoma. Cancer Res 2003;63 : 3695-3700
20. Li J, Dowdy S, Tipton T et al. HE4 as a biomarker for ovarian and endometrial cancer management. Expert Rev Mol Diagn 2009;9 : 555-566
21. Moore RG, Hill EK, Horan T et al. HE4 (WFDC2) gene overexpression promotes ovarian tumor growth. Sci Rep 2014;4 : 3574-3580
22. Galgano MT, Hampton GM, Frierson HF Jr. Comprehensive analysis of HE4 expression in normal and malignant human tissues. Mod. Pathol 2006;19 : 847-853
23. Speeckaert MM, Speeckaert R, Delanghe JR. Human epididymis protein 4 in cancer diagnostics: a promising and reliable tumor marker. Adv Clin Chem 2013;59 : 1-21
24. Escudero JM, Auge JM, Filella X et al. Comparison of serum human epididymis protein 4 with cancer antigen 125 as a tumor marker in patients with malignant and nonmalignant diseases. Clin Chem 2011;57 : 1534-1544
25. Li J, Chen H, Mariani A et al. HE4 (WFDC2) Promotes Tumor Growth in Endometrial Cancer Cell Lines. Int J Mol Sci 2013;14 : 6026-6043
26. Karlsen NS, Karlsen MA, Hogdall CK et al. HE4 tissue expression and serum HE4 levels in healthy individuals and patients with benign or malignant tumours – a systematic review. Cancer Epidemiol Biomarkers Prev 2014;23 : 2285-2295
Labels
Nuclear medicine Radiodiagnostics Radiotherapy
Article was published inNuclear Medicine

2015 Issue 1-
All articles in this issue
- Význam sentinelové uzliny u karcinomu prsu
- Indikace axilární disekce uzlin při nálezu mikrometastatického postižení sentinelové uzliny u karcinomu prsu
- Porovnanie celotelovej scintigrafie skeletu so sérovou koncentráciou ľudského epididymálneho proteínu 4 u pacientov s malígnym melanómom
- Interní a externí klinický audit v nukleární medicíně
- Co je na obrázku?
- Nuclear Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Indikace axilární disekce uzlin při nálezu mikrometastatického postižení sentinelové uzliny u karcinomu prsu
- Význam sentinelové uzliny u karcinomu prsu
- Interní a externí klinický audit v nukleární medicíně
- Porovnanie celotelovej scintigrafie skeletu so sérovou koncentráciou ľudského epididymálneho proteínu 4 u pacientov s malígnym melanómom
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

