-
Medical journals
- Career
Hemodialyzovaný pacient s karcinomem štítné žlázy léčený 131I
: Pavel Širůček () 1; Lubomír Mrhač () 2; Martin Havel () 2; Gabriela Havlová () 2; Otakar Kraft () 1; Šárka Dočkalová () 2; Renata Olšanská () 3
: Klinika nukleární medicíny, FN Ostrava, Lékařská fakulta Ostravské univerzity 1; Klinika nukleární medicíny FN Ostrava 2; Hemodialyzační centrum FN Ostrava 3
: NuklMed 2012;1:48-52
: Casuistry
Pro hemodialyzované pacienty, u kterých byl diagnostikován diferencovaný karcinom štítné žlázy, může mít zásadní význam léčba 131I. Diagnóza nádorového onemocnění tyto pacienty vyřazuje z registru čekatelů pro transplantaci ledviny do doby, než bude prokázána 3-5letá remise. Jelikož je 131I vylučován z těla převážně ledvinami, je efektivní poločas 131I u pacientů s renálním selháním prodloužen. To je důvod, proč by měla být redukována podávaná léčebná aktivita, aby došlo ke snížení radiační zátěže především pro krvetvornou kostní dřeň. Prezentujeme kazuistiku 48letého muže v terminálním renálním selhání, léčeného 131I pro papilární karcinom štítné žlázy. Terapeutické aktivity jsme snížili o 30 %. Hemodialýza byla prováděna po podání léčebné aktivity 131I na lůžkové části kliniky nukleární medicíny. 131I je dialyzovatelný a po každé dialýze klesla zbytková aktivita o 33-67 %. Radiační zátěž personálu hemodialyzačního centra byla minimální. Dialýza pacienta léčeného 131I nezpůsobila kontaminaci dialyzačního přístroje.
Klíčová slova:
hemodialýza, karcinom štítné žlázy, léčba jódem 131IÚvod
Do komplexní péče o pacienty s diferencovaným karcinomem štítné žlázy patří po totální tyreoidektomii následné celoživotní sledování na pracovištích nukleární medicíny. V úvodu dispenzarizace je nutná tyreoeliminace reziduí štítné žlázy radionuklidem 131I, který se selektivně vychytává ve zbytkovém parenchymu štítné žlázy a zásadním způsobem spolu se supresní terapií tyreoideálními hormony snižuje riziko recidivy tumorózního onemocnění v následujících letech. Tuto léčbu je možné uskutečnit pouze na lůžkových odděleních nukleární medicíny se zvláštním izolačním režimem.
Naše klinika byla oslovena endokrinologem, aby provedla tyreoeliminaci u 48letého muže s papilárním karcinomem štítné žlázy, který byl v důsledku progredující renální insuficience chronicky hemodialyzován. Diagnóza tumoru štítné žlázy pacienta vyřadila z čekací listiny k transplantaci ledviny. Zpětná registrace by byla možná až po absolvování všech doporučených léčebných postupů a dále v případě, že by nedošlo k recidivě tumoru v následujících 3-5 letech.
Jelikož jsme do té doby neměli zkušenost s podáním terapeutické aktivity radijódu pacientovi v terminálním renálním selhání, bylo nutné navázat spolupráci s hemodialyzačním centrem a zjistit ještě před přijetím pacienta, zda jsme schopni tento problém společně řešit.
Kazuistika
Spádový endokrinolog na základě nodózní strumy indikoval bioptické vyšetření, jehož výsledek byl suspektní z přítomnosti tumorózního procesu. Proto byla indikována a provedena totální tyreoidektomie. Patolog diagnostikoval papilární karcinom štítné žlázy v obou lalocích, s největším ložiskem 15 mm, v terénu Hashimotovy tyreoiditidy. Nejzásadnější komorbiditou byla chronická renální insuficience, která vznikla jako důsledek polycystózy ledvin a progredující chronické glomerulonefritidy. Pacientova denní diuréza byla cca 100 – 500 ml a k hemodialýze nemocný začal docházel 3x týdně asi 8 měsíců před první hospitalizací na naší klinice. Dalšími uváděnými diagnózami v osobní anamnéze pacienta byly renovaskulární hypertenze, sekundární hyperparatyreóza a sekundární hyperurikémie.
Po návštěvě technika hemodialyzačního centra na našem oddělení byla provedena jednoduchá úprava vodovodní baterie přímo na stíněném pokoji. Tato úprava umožňovala napojení přívodu vody na hemodialyzační přístroj. Bylo předpokládáno, že radioaktivní kontaminace přístroje bude minimální a jeho dočasné vyřazení z provozu nebude nutné.
První hospitalizace na klinice nukleární medicíny se uskutečnila 3 měsíce po provedené tyreoidektomii. Byla provedena scintigrafie krku po podání 30 MBq 131I, při které byla zjištěna dvě drobná rezidua štítné žlázy - jedno v oblasti jugula a druhé v lůžku pravého laloku. Hladina TSH byla >99,5 mU/l, hladina tyreoglobulinu 14,5 μg/l, hladina antityreoglobulinu <50 U/ml. Vzhledem k renální insuficienci a na základě již publikovaných zkušeností jsme se rozhodli zredukovat plánovanou tyreoeliminační aktivitu 3700 MBq 131I o cca 30 %, tj. na aktivitu 2600 MBq. Za 5 dní jsme provedli celotělovou a statickou scintigrafii krku (Obr. 1).
1. Celotělová a statická scintigrafie krku po téměř totální tyreoidektomii provedená 5 dní po aplikaci 2600 MBq <sup>131</sup>I 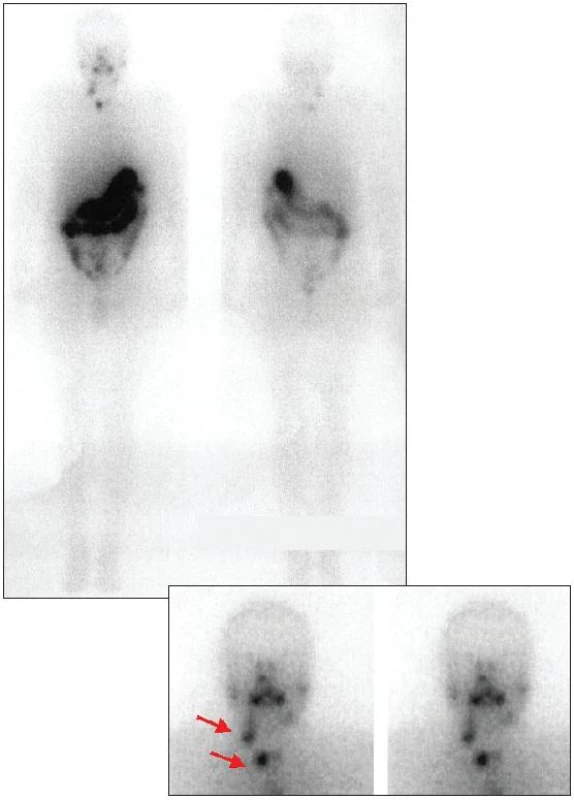
První hemodialýza byla provedena 41 hodin po podání léčebné aktivity 131I a to přímo na lůžkovém oddělení nukleární medicíny za pomoci personálu hemodialyzačního centra. Sestra vybavená osobním dozimetrem po napojení pacienta na hemodialyzační přístroj setrvala po dobu 4 hodin za olověným stíněním v jeho blízkosti, aby mohla reagovat na jakýkoli technický či osobní problém dialyzovaného a monitorovat jeho krevní tlak. Druhá dialýza byla provedena za 113 a třetí za 167 hodin po podání léčebné dávky 131I. Při poklesu celotělové aktivity pacienta pod 390 MBq byl nemocný odeslán k další dialýze již na hemodialyzační centrum.
Při druhé hospitalizaci, která se uskutečnila 6 měsíců po podání tyreoeliminační aktivity 131I, jsme vzhledem ke dvěma reziduím a vyšší vstupní hladině tyreoglobulinu naplánovali podání léčebné aktivity 131I. Nevysazovali jsme tyreoideální substituci, ale tentokrát jsme pacienta premedikovali intramuskulárně podaným rekombinantním TSH (preparát THYROGEN firmy Genzyme Ltd. Haverhill, Suffolk, Velká Británie). Po laboratorním ověření vzestupu TSH jsme za 3 dny podali perorálně léčebnou aktivitu 131I, kterou jsme redukovali opět o cca 30 % na 5000 MBq. Hladina tyreoglobulinu byla 6,3 μg/l, antityreoglobulinu <50 U/ml. Na celotělovém scintigramu provedeném 5 dní po aplikaci jsme pozorovali eliminaci rezidua na krku vpravo, ložisko v jugulu zregredovalo částečně (Obr. 2). První dialýza byla provedena na oddělení nukleární medicíny za 41 hodin, druhá za 113 hodin, třetí byla uskutečněna již na hemodialyzačním oddělení za 167 hodin po podání léčebné dávky 131I.
2. Celotělová a statická scintigrafie krku po téměř totální tyreoidektomii provedená 5 dní po aplikaci 5 000 MBq <sup>131</sup>I 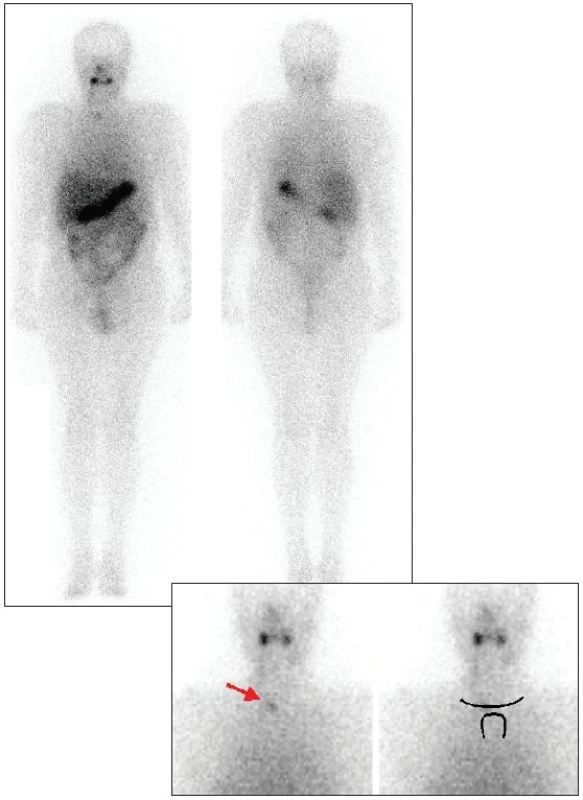
Třetí hospitalizace byla uskutečněna za dalších 6 měsíců. Byla podána diagnostická aktivita 300 MBq 131I opět po podání rekombinantního TSH. Scintigraficky jsme prokázali úplnou eliminaci reziduální funkční thyreoideální tkáně na krku, ani celotělově ložiska patologické akumulace radiojódu nebyla patrná. Hladina tyreoglobulinu klesla na 3,5 μg/l. Podání pouze diagnostické aktivity radiojódu nevyžadovalo provádět hemodialýzu přímo na stíněném pokoji na naší klinice, ale umožnilo pacientovi hned navštěvovat hemodialyzační středisko.
Během prvních dvou hospitalizací jsme současně měřili efektivní poločas 131I, a to jak ze zevního měření, tak z krevních vzorků. Na eliminaci 131I z těla se fyziologicky podílejí největší měrou ledviny. Předpokládali jsme, že v důsledku renální insuficience bude efektivní poločas u našeho pacienta i při probíhajících hemodialýzách prodloužen. Aby bylo možno posoudit do jaké míry, provedli jsme výpočet efektivního poločasu stejným způsobem také u 9 pacientů po totální tyreoidektomii s normální kreatininémií. U těchto pacientů byl efektivní poločas radiojódu stanovený na základě zevního měření 12,6 hod, z krevních vzorků 13,8 hod.
U našeho hemodialyzovaného pacienta byl efektivní poločas ze zevního měření u první hospitalizace 39,1 hod, u druhé hospitalizace 30,2 hod, průměrně tedy 34,8 hod, tj. 2,8x delší než u pacientů s normální hladinou kreatininu v séru.
Obdobně efektivní poločas změřený z krevních vzorků byl u první hospitalizace 49,3 hod a u druhé hospitalizace 39,9 hod, průměrně 44,6 hod, tj. 3,2x delší.
Terapeutická aktivita by tak měla být u podobného pacienta s renálním selháním redukována přibližně o 60-70 %. Chceme-li tedy použít aktivitu 3,7 GBq, je vhodné ji snížit na 1,3 GBq, obdobně aktivitu 7,4 GBq snížit na 2,6 GBq.
Ke zhodnocení možné myelosuprese v souvislosti s aplikovanými aktivitami jsme použili porovnání výsledků krevního obrazu mezi hospitalizacemi. K zásadní změně krevního obrazu nedošlo (Tab. 1).
1. Porovnání vybraných parametrů krevního obrazu z 1., 2. a 3. hospitalizace 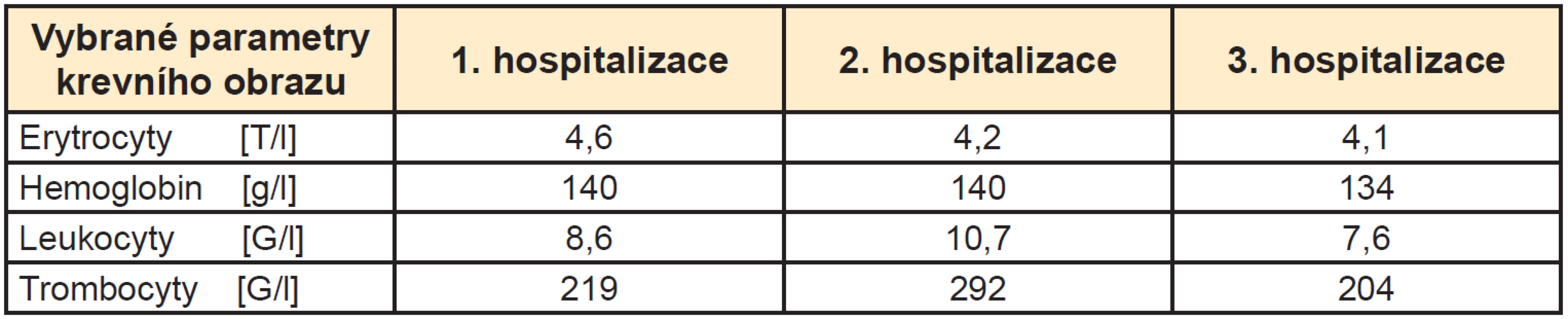
Aby bylo možno porovnat radiační zátěž sester asistujících při dialýze, byla také změřena aktivita pozadí na lůžkové části nukleární medicíny. U obou hospitalizací byla 0,17 μSv/4 hod. Jak plyne z tabulky, radiační zátěž sester byla minimální, nejvyšší pak vždy během první dialýzy (Tab. 2).
2. Radiační zátěž sester asistujících při dialýze 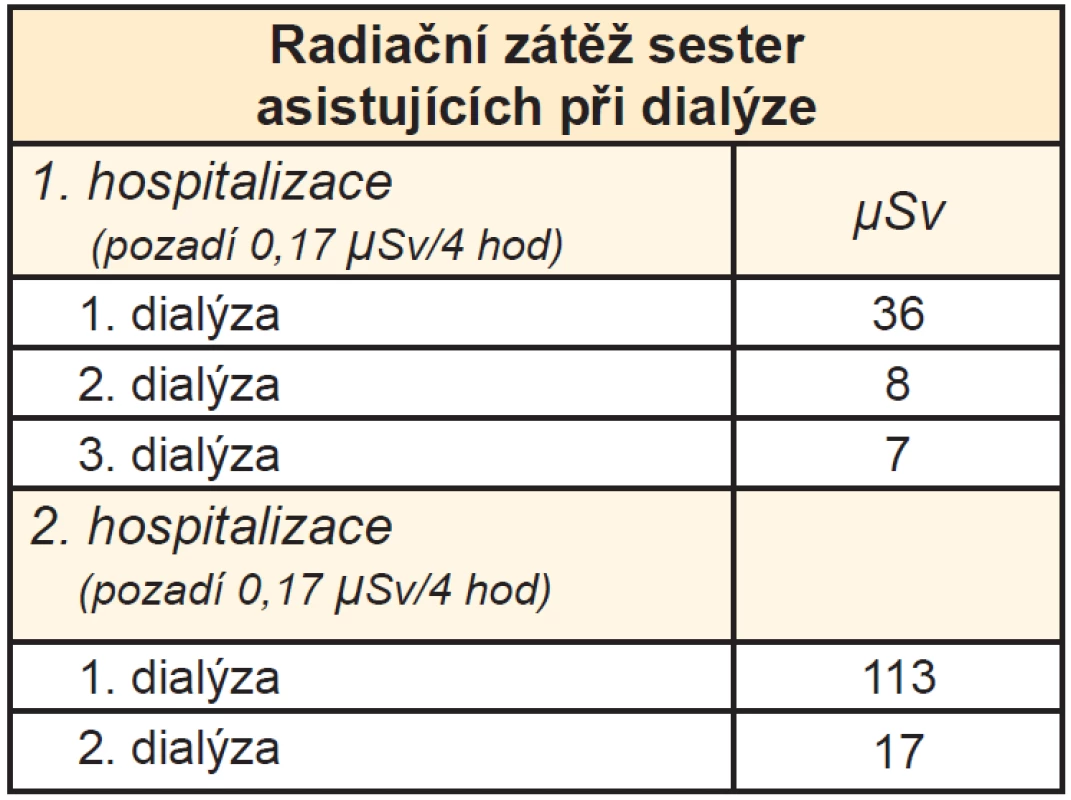
Pokles celotělové aktivity pacienta po jednotlivých dialýzách nebyl vždy identický a kolísal mezi 33-67 % (Graf 1, 2).
1. Celotělová aktivita pacienta stanovená ze zevních měření 
2. Aktivita krevních vzorků odebraných pacientovi 
K hemodialýze byl použit dialyzační přístroj AK 100 firmy Gambro s vlastní úpravnou vody a s dialyzátorem F7 o ploše 1,6 m2. Po skončení dialýzy a výměně dílů na jedno použití byla proměřena zbytková radioaktivita ze vzdálenosti 1 m. Ta byla na úrovni pozadí, ke kontaminaci přístroje nedošlo.
Laboratorní hladiny hormonů štítné žlázy včetně hladin tyreoglobulinu a antityreoglobulinu byly v průběhu hospitalizace opakovaně sledovány. Po dialýze, když došlo ke snížení distribučního objemu, byl laboratorně zachycen jejich vzestup o 20 – 50 %.
Diskuze
V dostupné literatuře nejsou zpracovány velké soubory pacientů. Většinou se jedná pouze o ojedinělé případy, které mají charakter kazuistických sdělení.
Andres 1 ve své práci uvádí, že redukovali tyreoeliminační aktivitu 131I u hemodialyzovaného pacienta o 20 %, což umožnilo dostatečný léčebný účinek. Před podáním 131I využili rekombinantní TSH a hemodialýzu prováděli na pokoji pacienta. Jimenéz 2 upozorňuje na individuální dávkování 131I a individuální přístup k pacientům s karcinomem štítné žlázy v konečné fázi renálního selhání. Navrhuje terapeutický model, který umožňuje podání nejvyšší ablační aktivity a minimalizaci ozáření ostatních orgánů tak, že pacient absolvuje denní hemodialýzy v průběhu prvních 5 dnů po podání identické aktivity 131I, která je podávána pacientům, kteří mají normální funkci ledvin.
Mello 3 ve své kazuistice uvádí případ 42leté ženy s karcinomem štítné žlázy a s metastatickým postižením uzlin v terminálním stadiu renálního selhání. Před podáním léčebné aktivity provedl se svými kolegy studii po podání 74 MBq 131I, která prokázala, že při každé hemodialýze je odstraněno z těla přibližně 60 % z původního množství aktivity. Vypočítal, že smysluplná aktivita pro eliminaci reziduí a léčbu metastáz je 3,7 GBq 131I, která byla podána dvakrát v průběhu dvou hospitalizací. Po terapii dle klinického hodnocení, celotělové scintigrafie a hladiny tyreoglobulinu nebyly shledány známky perzistujícího onemocnění.
Modarresifar 4 s kolektivem popisuje kazuistiku 53letého muže s papilárním karcinomem štítné žlázy v chronickém renálním selhání, který byl hemodialyzován obden a u něhož bylo nutné podání vysoké aktivity 131I. Opatření na ochranu pacienta zahrnovala hemodialýzu za 48 a 96 hodin po podání léčebné aktivity 3607 MBq. Ochrana okolí zahrnovala umístění dvou stínících stěn mezi pacientem a personálem a střídání dvou sester v průběhu hemodialýzy. Tato opatření se jevila autorům jako účinná dle vyhodnocených dozimetrických údajů.
Sinsakul 5 připomíná ve svých dvou kazuistických sděleních, že pacienti v konečné fázi renálního selhání jsou z důvodu jeho exkrece ledvinami ohroženi vyšší expozicí záření po podání 131I. 131I je dialyzovatelný a zbytkové množství v těle je možné sledovat jednoduše zevním měřením. Dva pacienti byli léčeni 131I a hemodialyzováni za 3 a 20 hodin po podání 131I, což vedlo k poklesu celotělové aktivity o 80 % a 70 %. Postdialyzační monitorování neodhalilo žádnou zbytkovou radioaktivitu použitého hemodialyzačního přístroje. Hemodialýzu považuje za stěžejní prvek léčby pacientů s karcinomem štítné žlázy v chronickém dialyzačním programu. Terapie je možná ve spolupráci s personálem dialyzačního centra a s oddělením radiační ochrany.
Holst 6 ve své práci popisuje matematický model, pomocí něhož odhaduje, že léčebná aktivita 131I pro hemodialyzovaného pacienta s rakovinou štítné žlázy by měla být přibližně 13 % až 28 % aktivity empiricky podávané pacientům s normální funkcí ledvin.
Pahlka 7 uvádí, že pro pacienty s onemocněním ledvin je vhodné snížení aktivity 131I z důvodu působení radiace na červenou kostní dřen. Existují rozdílné názory na doporučené dávkování jak ve smyslu snížení, tak zvýšení aktivity ve srovnání s aktivitami konvenčními. Stanovení vhodné aktivity musí brát v úvahu různé dialyzační protokoly a absorbovanou dávku pro rezidua štítné žlázy a tkáně citlivé k radiaci, především červenou kostní dřeň. Ve své studii vytvořil jednoduchý komplexní kompartmentový model kinetiky 131I u pacientů s karcinomem štítné žlázy v terminálním stádiu onemocnění ledvin. Pomocí softwarového programu Stella sestavil model, který zahrnuje kinetiku krevního řečiště, štítné žlázy, gastrointestinálního traktu, ledvin, močového měchýře a konvenčního dialyzačního přístroje. Kinetika jódu byla simulována pro běžné pacienty, pacienty s karcinomem štítné žlázy a pacienty s karcinomem štítné žlázy se selháním ledvin podstupující dva standardní typy dialýzy - hemodialýzu a kontinuální ambulantní peritoneální dialýzu (CAPD). Výsledky naznačují, že dávka pro červenou kostní dřeň u dialyzovaných pacientů se selháním ledvin a rakovinou štítné žlázy může být značně vyšší ve srovnání s pacienty s normální funkcí ledvin. Tito pacienti mohou mít prospěch ze snížení podané aktivity. Absorbované dávky pro štítnou žlázu a červenou kostní dřen u hemodialyzovaných pacientů závisí jak na dialyzační frekvenci, tak na časovém intervalu mezi podáním 131I a první dialýzou.
Podobný názor na danou problematiku má i Kaptein 8. U pacientů s pokročilým onemocněním ledvin léčených pro karcinom štítné žlázy musí být aktivita 131I snížena, aby se zabránilo nadměrné dávce záření na červenou kostní dřeň, jelikož je 131I primárně vylučován ledvinami. U pacientů v konečném stadiu renálního selhání léčených kontinuální ambulantní peritoneální dialýzou je clearance kreatininu a také clearance 131I snížená. Kaptein s kolektivem provedl kinetické studie u dvou hypotyroidních pacientů na CAPD s karcinomem štítné žlázy, u osmi pacientů eutyreoidních na CAPD a u osmi pacientů s karcinomem štítné žlázy s normální funkcí ledvin. Ve vzorcích krve, moče a dialyzátu odebraných za 24–70 hod byla stanovena aktivita 131I. Dozimetrické výpočty byly provedeny pomocí počítačového programu MIRDOSE 3. U pacientů na CAPD byl v séru efektivní poločas radiojódu 5x delší. Aktivity 131I pro dva pacienty na CAPD s karcinomem štítné žlázy byly redukovány z 5,6 GBq na 0,98 GBq a 1,11 GBq. Toto vyplynulo z celotělové dávky záření a dávky získané červenou kostní dření ve srovnání s pacienty s normální funkcí ledvin, kteří by obdrželi průměrně 5,5 GBq 131I. U pacientů léčených kontinuální ambulantní peritoneální dialýzou je 5x prodloužen poločas a 5x redukována clearance, proto by měla být aktivita 131I snížena 5x, abychom se vyhnuli nadměrné radiační zátěži.
Výpočty u našeho pacienta jsou podobné jako Holstovy 6. Považujeme za nejvhodnější provést před podáním první léčebné aktivity měření biologického poločasu u konkrétního pacienta pomocí aplikace diagnostické aktivity 131I a dle něj vypočítat, o kolik je vhodné redukovat léčebnou aktivitu. Biologický poločas může být u jednotlivých hemodialyzovaných pacientů rozdílně prodloužen dle reziduální funkce ledvin, typu a frekvence dialýzy. Předmětem diskuse je taktéž časový interval mezi podáním 131I a první dialýzou. Modarresifar 4 prováděl první dialýzu podobně jako my u našeho pacienta za 48 hod., naopak Sinsakul 5 časový interval zkrátil na 3 hodiny. Za rozumný se nám jeví kompromis - provést první dialýzu za 24 hod., což je doba, za kterou již došlo k maximální akumulaci 131I v tyreoideálních buňkách.
Závěr
U našeho pacienta bylo vhodné redukovat léčebnou aktivitu 131I o cca 60-70 % z důvodu prodloužení efektivního poločasu 131I, tj. při nutnosti podání aktivity 7,4 GBq ji redukovat na 2,6 GBq. Léčba 131I u pacientů s karcinomem štítné žlázy v hemodialyzačním programu je uskutečnitelná v nemocnicích, kde je současně umístěno hemodialyzační oddělení, které je ochotno spolupracovat. Hemodialýzy po podání terapeutických aktivit 131I je nutné vzhledem k zevní radiaci provádět na oddělení nukleární medicíny. Kontaminace hemodialyzačního přístroje je minimální a nebrání dalšímu použití přístroje. Radiační zátěž personálu obsluhujícího dialyzační přístroje je nízká.
Adresa pro korespondenci:
Pavel Širůček
Klinika nukleární medicíny, FN Ostrava, Lékařská fakulta Ostravské univerzity
pavel.sirucek@fnspo.cz
Sources
1. Andres A, Tardín L, Santapau A et al. Treatment with (131)I of thyroid remnants in a patient with papillary thyroid carcinoma and end-stage chronic renal failure. Rev Esp Med Nucl 2010;29 : 32-5
2. Jiménez RG, Moreno AS, Gonzalez EN et al. Iodine-131 treatment of thyroid papillary carcinoma in patients undergoing dialysis for chronic renal failure: a dosimetric method. Thyroid 2001;11 : 1031-4
3. Mello AM, Isaacs R, Petersen J et al. Management of thyroid papillary carcinoma with radioiodine in a patient with end stage renal disease on hemodialysis, Clin Nucl Med 1994;19 : 776-81
4. Modarresifar H, Almodovar S, Bass WB et al. Radiation safety protocol for high dose 131I therapy of thyroid carcinoma in patients on hemodialysis for chronic renal failure. Health Phys 2007;92 : 45-9
5. Sinsakul M, Ali A., Radioactive 131I use in end-stage renal disease: nightmare or nuisance? Semin Dial 2004;17 : 53-6
6. Holst JP, Burman KD, Atkins F et al. Radioiodine therapy for thyroid cancer and hyperthyroidism in patients with end-stage renal disease on hemodialysis. Thyroid 2005;15 : 1321-31
7. Pahlka RB, Sonnad JR. The effects of dialysis on 131I kinetics and dosimetry in thyroid cancer patients a pharmacokinetic model. Health Phys 2006;91 : 227-37
8. Kaptein EM, Levenson H, Siegel ME et al. Radioiodine dosimetry in patients with end-stage renal disease receiving continuous ambulatory peritoneal dialysis therapy. J Clin Endocrinol Metab 2000;85 : 3058-64
Labels
Nuclear medicine Radiodiagnostics Radiotherapy
Article was published inNuclear Medicine

2012 Issue 3
Most read in this issue- Determination of brain death
- Spektrum požadovaných vyšetrení nukleárnej medicíny pri karcinóme prostaty po registrácii 18F fluorocholínu: dvojročné sledovanie v nemocnici Tenon
- Hemodialyzovaný pacient s karcinomem štítné žlázy léčený 131I
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

