-
Medical journals
- Career
Antiobezitika před bariatrickou operací a po ní – jak je využít co nejlépe
Authors: Petra Šrámková; Martin Fried
Authors‘ workplace: OB klinika Praha
Published in: Čas. Lék. čes. 2022; 161: 107-113
Category: Review Article
Overview
Obezita jako chronické, závažné a progredující celoživotní onemocnění vyžaduje aktivní přístup k léčbě. Léčbou se rozumí zejména nutná úprava životního stylu s vhodnou pravidelnou fyzickou aktivitou a v indikovaných případech medikamentózní či bariatrická podpora. Současná farmakoterapie může být účinným pomocníkem v přípravě na chirurgické řešení obezity (bariatrické a metabolické operace), a to k větší adherenci nemocného k nutným změnám stravovacího a pohybového režimu i v předoperační redukci hmotnosti. V řadě případů indikujeme zahájení medikamentózní léčby s odstupem od operace, pokud váha opět narůstá. Zatím neznáme vhodné typy pacientů a přesné indikace pro jednotlivá antiobezitika či typ bariatrické operace. Nejlepší dlouhodobé výsledky přináší kombinace obou způsobů spolu se změnou životního stylu. Z moderních antiobezitik jsou k dispozici naltrexon-bupropion a liraglutid, ze starších orlistat.
Klíčová slova:
obezita – liraglutid – set point – bariatrická operace – předoperační redukce hmotnosti – nárůst hmotnosti po bariatrické operaci – naltrexon-bupropion
ÚVOD
Trvalo řadu let, než odborná veřejnost přijala obezitu jako chronické, závažné a progredující onemocnění, mnohdy celoživotní s možnými mnohočetnými komplikacemi (1). Lege artis léčba, zejména obezity vyšších stupňů (BMI ≥ 35 kg/m2), vyžaduje dlouhodobý komplexní, multidisciplinární přístup. Na základě současných znalostí se domníváme, že obezita je důsledkem narušení hypotalamického set pointu, a je proto vhodné na toto regulační centrum hmotnosti trvale působit (2, 3). Většina antiobezitik – a bariatrická chirurgie také – vede k dlouhodobému váhovému úbytku právě změnou signálů mířících do hypotalamu, zejména navozením fyziologického pocitu sytosti.
Před bariatrickou/metabolickou operací je vhodná redukce hmotnosti jednak z důvodů chirurgických (lepší přístup k operovaným orgánům), ale i psychologických – pochopení a akceptace pravidelného režimu, volba vhodných potravin. Snížení váhy před plánovanou bariatrickou operací a také nápodobu pooperačních změn v pocitech hladu a chutí lze navodit použitím analog glukagonu podobného peptidu 1 (GLP-1). Pooperačně používáme medikaci zejména při předčasném zastavení či zpomalení reálně očekávaných váhových úbytků (fáze plateau) nebo při opětovném nárůstu hmotnosti. Fáze plateau nebo opětovné přibývání hmotností mohou být způsobeny řadou vlivů vedoucích z různých důvodů k porušení režimu. Jako nejčastější příklady lze uvést stresové životní situace (rozvod, změna zaměstnání na směnný režim, dlouhodobá péče o osobu blízkou, úmrtí v rodině), onemocnění pohybového aparátu s omezením mobility (úraz, artróza nosných kloubů), užívání léků s vlivem na hmotnost (některá antidepresiva a antipsychotika, kortikoidy), hormonální změny (gravidita) a další. V neposlední řadě musíme brát v úvahu i pokles klidového metabolismu v souvislosti s věkem (4). Působení vnějších vlivů spolu s individuálním genetickým nastavením může vést k návratu hypotalamického set pointu do předoperačního „nastavení“, a tím k opětovnému nárůstu hmotnosti.
Regulace příjmu potravy probíhá na několika metabolicko-hormonálních úrovních a má dvě hlavní složky – homeostatickou a hédonickou, která u většiny populace převažuje. Dráhy metabolické regulace hmotnosti jsou velmi složité, vzájemně propojené silnými vazbami. Mimo jiné i proto neexistuje jeden jediný, nejvhodnější a dlouhodobě nejúčinnější terapeutický postup, až již medikamentózní či chirurgický, použitelný univerzálně pro všechny nemocné. Za nejvhodnější považujeme multimodální přístup, kombinaci farmakoterapie a bariatrické léčby spolu se změnou životního stylu. Jde o podobné přístupy, které se používají v léčbě jiných onemocnění, například hypertenze či hyperlipoproteinémie. Také léčba obezity, závažného chronického onemocnění, je celoživotní.
V uváděném přehledu jsou použity jak dlouhodobé zkušenosti z bariatricko-metabolického centra za několik desetiletí, tak i data ze světové literatury, která korespondují s naší praxí. Přehledných publikací a článků o použití antiobezitik před a po bariatrických operacích však není mnoho. Navíc se o této problematice často referuje z relativně úzkého pohledu, odrážejícího preskripční či výzkumné možnosti publikujících pracovišť.
POUŽITÍ ANTIOBEZITIK PŘED BARIATRICKOU OPERACÍ
U nemocného indikovaného k bariatrické operaci je potřebná komplexní, multidisciplinární příprava k zákroku. Ta u části nemocných zahrnuje doporučení k předoperační redukci hmotnosti. Jde zejména o nemocné s BMI > 50 kg/m2 a také s výraznou abdominální obezitou, u nichž úbytek hmotnosti vede k žádoucímu snížení objemu nitrobřišního tuku, zmenšení velikosti jater a s tím spojeným zkrácením doby operace a k celkově snížené perioperační zátěži a také zlepšení plicních funkcí (5).
U všech nemocných předoperační edukace a interakce s jednotlivými odborníky vede k lepšímu osvojení základních a nutných úprav ve stravovacím i pohybovém režimu, pomáhá při psychologické přípravě na ně a také objasňuje nemocnému, jaké změny přinese samotný operační zákrok. Standardizovaná a efektivní předoperační příprava vede k hladšímu překlenutí bezprostředního pooperačního období a k celkovému urychlení pooperační mobilizace a rekonvalescence (6–8). Ve svém důsledku vede ke zkrácení celkové doby hospitalizace.
Švédští autoři ze Skandinávského registru obezity (SOReg) hodnotili 2leté výsledky operační léčby obezity gastrickým bypassem Roux-en-Y (RYGB) u 9570 pacientů. Ti, kteří předoperačně zhubli více než 8,6 % vstupní hmotnosti, vykazovali po 2 letech pooperační redukci o 10,1 % větší než ti, kteří předoperačně nezhubli (p < 0,001). Ještě větší efekt byl pozorován u pacientů, kteří měli vyšší výchozí BMI (> 45,7 kg/m2). Ti měli po 2 letech hmotnost o 13,6 % menší (9). Jsou však i publikace, ve kterých nebyla prokázána spojitost mezi předoperační redukcí váhy a mírou pooperačního hubnutí (10).
V 2015 publikovali španělští autoři výsledky prospektivní studie o předoperační redukci hmotnosti u 100 diabetiků s BMI ≥ 35 kg/m2. K léčbě použili exenatid 10 μg s.c. 2× denně a půlroční výsledky byly výborné – došlo ke statisticky významné redukci (−12,5 kg) a zmenšení obvodu pasu (−13 cm). Samozřejmě se signifikantně zlepšila i hladina glykovaného hemoglobinu (HbA1c) (11).
Arya Sharma publikoval 5 výstižných kazuistik s efektivním předoperačním užitím liraglutidu – 3 pacienti v dávce 3,0 ml, 1 pacient v dávce 1,8 ml (nižší z finančních důvodů) a 1 pacientka nebyla před bariatrickou operací, ale před procedurou fertilizace in vitro (IVF) (12). Níže shrnujeme první 4 kazuistiky:
- V jedné byl prezentován případ 29leté ženy v přípravě na bariatrii s BMI 45 kg/m2, která zhubla s použitím liraglutidu v dávce 3,0 mg denně na BMI 31 kg/m2. Následně byla provedena sleeve gastrektomie s výbornou redukcí hmotnosti na BMI 25,3 kg/m2.
- Ve druhé se jednalo o 39letou ženu s extrémní hmotností (BMI 89 kg/m2), která v tu dobu znemožňovala plánovaný operační výkon. Opět za použití liraglutidu v dávce 3,0 mg denně spolu s redukční dietou kombinovanou s velmi nízkokalorickou dietou (VLCD – very low calory diet) se pacientce podařil postupný úbytek na předoperační BMI 57,4 kg/m2 a mohl jí být úspěšně proveden gastrický bypass.
- V dalším publikovaném případu se jedná o 31letého muže s předoperačním BMI 39,4 kg/m2. Pacient též zahájil užívání 3,0 mg liraglutidu denně, po 9 měsících aplikace zhubl na BMI 28,2 kg/m2. Vzhledem k výbornému efektu léčby se rozhodl dále pokračovat konzervativní cestou.
- Poslední je případ opět 29leté ženy. Při BMI 65,7 kg/m2 začala také předoperačně užívat 3,0 mg liraglutidu denně. Efekt na snížení BMI byl dobrý, pro velkou finanční náročnost však byla dávka redukována na 1,8 mg denně. Spolu s VLCD pokračovala v hubnutí na BMI 54,6 kg/m2, kdy byl následně proveden RYGB.
O použití naltrexonu-bupropionu před bariatrií jsou v literatuře k dispozici pouze obecné informace, nejde o výsledky studií (13).
Článek Wanga z roku 2015 modeluje nákladovou efektivitu použití lorkaserinu u pacientů, kterým je plánováno provedení bariatrické operace. Teoreticky se zabývá tezí, že pokud dotyční zhubnou při podávání (levného) lorkaserinu na BMI ˂ 35 kg/m2, pak by nemuseli být v horizontu následujících několika let indikováni k bariatrii, a tím by teoreticky bylo možné ušetřit výdaje plátcům zdravotní péče (14).
Důvodem malého rozšíření používání antiobezitik před bariatrii může být i fakt, že bariatrický chirurg požaduje předoperační redukci relativně rychle. Nástup účinku antiobezitik trvá 4–5 týdnů, vlastní efekt – tedy redukci alespoň o 5 % – vidíme až okolo 12. týdne od zahájení léčby. V případě nutnosti rychlejšího úbytku hmotnosti lze pacientovi doporučit i VLCD na 2–3 týdny, kdy zhubnutí bude rychlejší, ale krátkodobé. Zvážit v této předoperační indikaci můžeme i zavedení intragastrického balonu (15).
Dalším nezanedbatelných úkolem je zhodnocení a úprava (racionalizace) současné pacientovy medikace v předoperačním období – často již malá úprava chronické medikace může vést k mírnému zhubnutí. V těchto případech je vhodná konzultace s ošetřujícími lékaři nemocného se snahou o redukci medikace – zejména těch léků, které mají vliv na hmotnost. Důležitá je vhodná antidiabetická léčba, například výměna za analog GLP-1 či po úvaze nasazení gliflozinů. Vysoké dávky prandiálních inzulinů upravujeme, snižujeme po důrazné edukaci pacienta ohledně diety a selfmonitoringu.
Možnost bariatrické operace je pro diabetika velkou motivací, a tak příprava na ni včetně pravidelného režimu a vybírání vhodných potravin s důrazem na bílkoviny bývá pacientem celkem dobře akceptovaná. Do předoperační přípravy zcela jistě patří i edukace nutričními terapeuty. Vysvětlením potřeby požadované předoperační redukce hmotnosti, zejména u diabetiků, je možné dosáhnout silnější motivace pro dodržování redukční diabetické diety. Jako lékaři si musíme upřímně přiznat, že naprostá většina diabetiků diabetickou dietu dlouhodobě nedodržuje, a když předoperačně opět začnou, často lze snížit dávky prandiálního inzulinu i z 20–30 jednotek denně na minimum a pacient začne hubnout. V předoperačním čase řešíme i komorbidity dýchacích cest, které mají vliv na hladký průběh operace a pooperačního období – kuřákům doporučujeme zanechat kouření a u indikovaných nemocných zajistíme vyšetření spánkové apnoe (16).
Kromě předoperační přípravy bariatrických pacientů může být podávání antiobezitik vhodné i u některých jiných plánovaných výkonů, kde je žádoucí předoperační redukce hmotnosti, například u ortopedických operací (náhrad velkých kloubů). Operatér oprávněně požaduje redukci na určitou hmotnost z řady důvodů – nosnosti operačního stolu, vedení anestezie, umělé plicní ventilace, ale i následné pooperační rehabilitace.
POUŽITÍ ANTIOBEZITIK PO BARIATRICKÉ OPERACI
Největší redukce hmotnosti po bariatrické operaci probíhá obvykle první dva roky po výkonu s maximem v prvních 6–8 měsících. Pacient zhubne podle našich zkušeností o 15 až 50 % původní hmotnosti. Vývoj redukce a její velikost závisí na mnoha faktorech, například na druhu bariatrické operace, pooperační spolupráci a schopnosti nemocného změnit jídelníček a způsob života, včetně navýšení pohybové aktivity, a mnoha dalších faktorech. Graficky lze redukci nejčastěji zobrazit jako křivku ve tvaru písmene J, kdy pacient po dosažení největší redukce mírně přibírá. K tomuto obecnému fenoménu dochází nejspíše proto, že i po dosažení (a udržení) individuálně nejlepšího reálného výsledku bariatrického výkonu (tj. ve fázi plateau) se prosazuje původní tendence zvyšování hmotnosti (17, obr. 1, studie SOS).
Image 1. Vývoj hmotnosti po bariatrické operaci, studie SOS 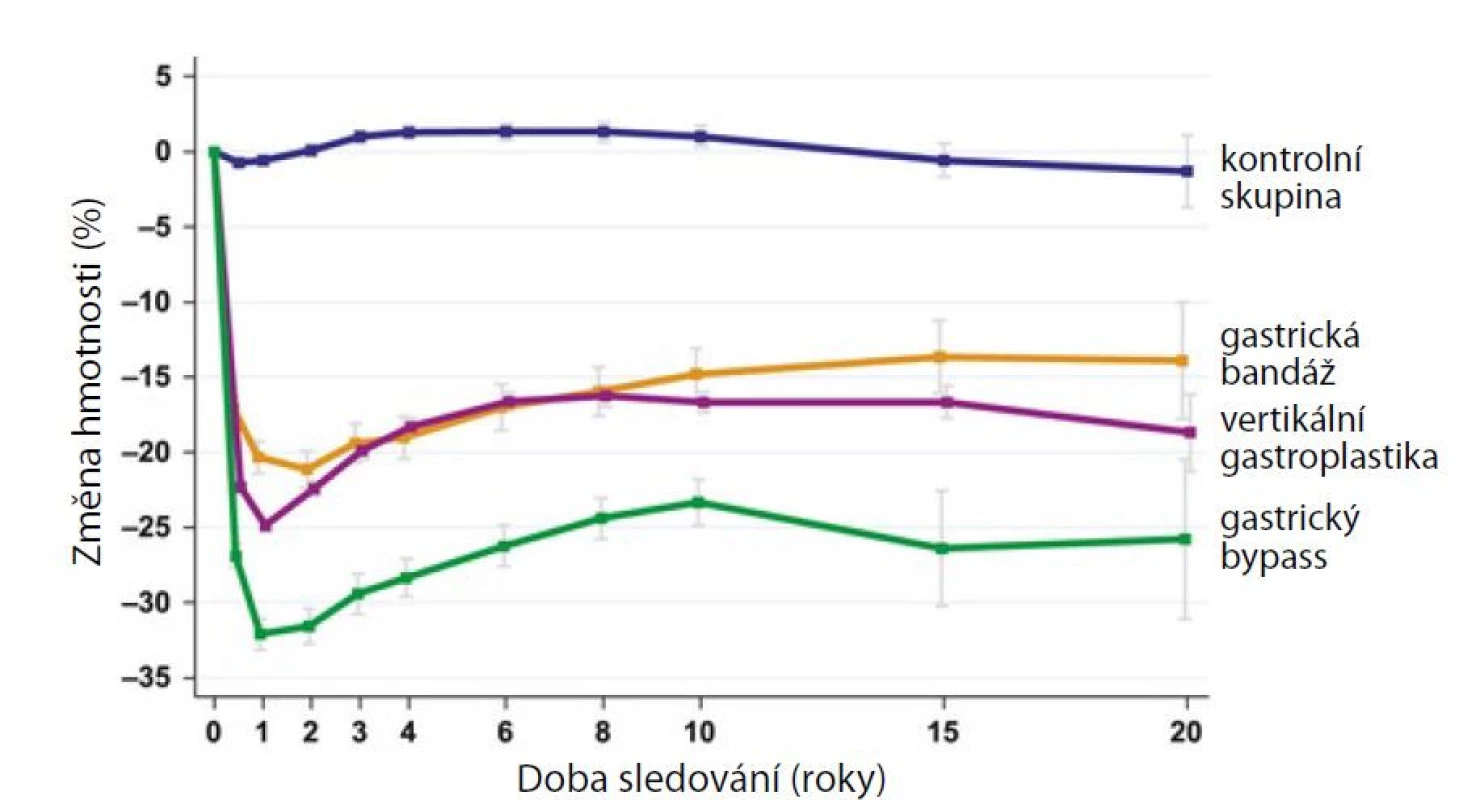
V tuto chvíli je vhodná včasná odborná intervence, od posílení pozitivní motivace k návratu žádoucího životního stylu, změnám v jídelníčku, až po zvážení možného nasazení antiobezitik. Použité intervence by měly být co nejvíce individualizovány. Adamsovo 12leté sledování pacientů po žaludečním bypassu ukazuje, že 418 operovaných pacientů si po 2, 6 i 12 letech od operace udržuje sníženou hmotnost (v průměru o 26,9 %), nicméně vidíme výrazné interindividuální rozdíly (18, obr. 2).
Image 2. Míra redukce hmotnosti po bariatrické operaci je velmi individuální 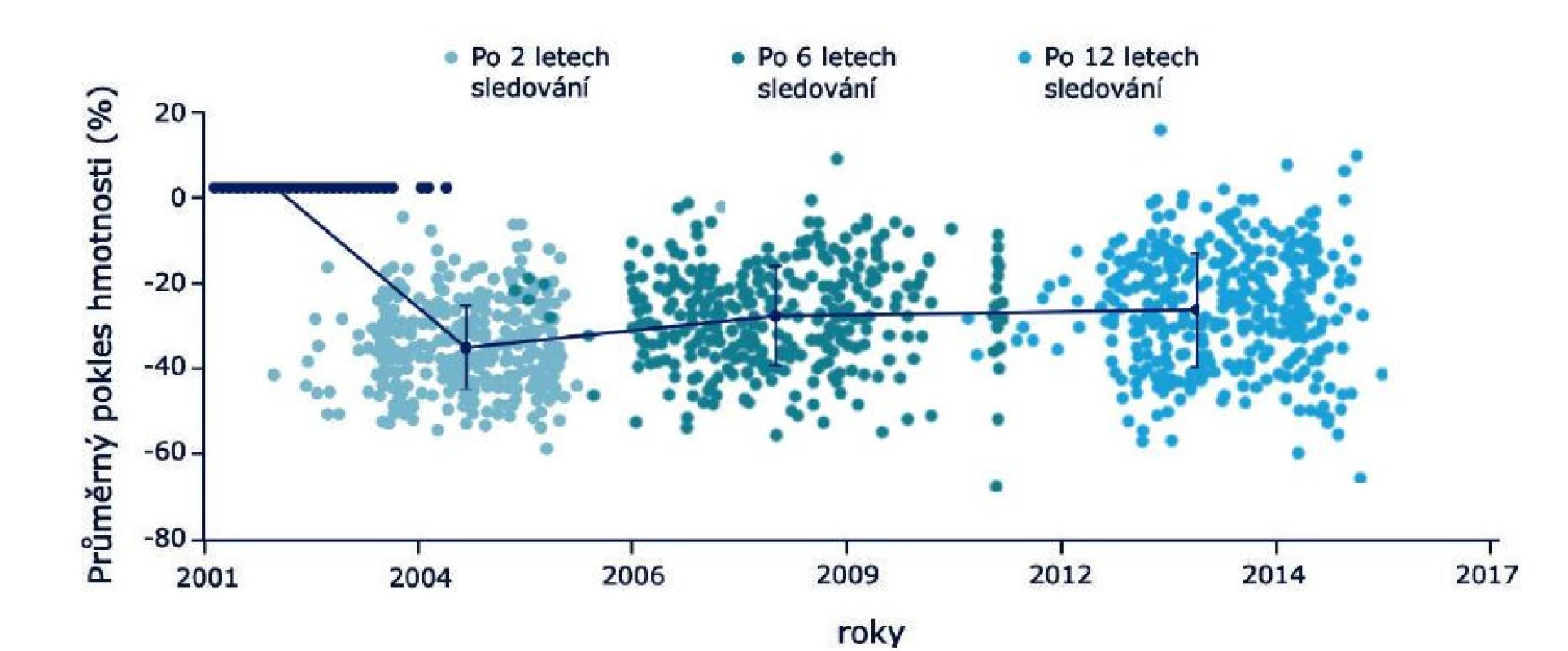
ukázka na příkladu gastrického bypassu Zahájení farmakoterapie antiobezitiky po bariatrii lze také zvážit při časnějším nástupu fáze plateau, při nedostatečné redukci již v prvním roce po operaci. Jejich použití se v takových případech ukazuje jako účinné a bezpečné. Současná závazná doporučení pro léčbu obezity explicitně neřeší otázku podávání antiobezitik v časném pooperačním období. Nicméně empiricky se jeví jako žádoucí.
Prof. Schauer z Clevelandu publikoval v roce 2018 výsledky studie provedené na souboru 209 pacientů, kteří byli sledováni 3 až 6 let po různých typech operací a dostávali antiobezitika dostupná v USA (fentermin, kombinaci fentermin + topiramát, lorkaserin, kombinaci naltrexon + bupropion) po dobu až 1 roku. Z nich 37 % zhublo o více než 5 % hmotnosti, kterou měli na počátku podávání. Zajímavé je, že statisticky větší redukce dosáhli pacienti s AGB oproti těm, kteří podstoupili rukávovou resekci žaludku (SG), resp. RYGB oproti SG (4,6 vs. 0,3 %, p = 0,02; 2,8 vs. 0,3 %, p = 0,01). Vyšší počáteční BMI vedlo k větším celkovým úbytkům (p = 0,25). Autor uzavírá, že riziko podávání antiobezitik po bariatrickém výkonu je obecně nízké a menší, než případná nutnost bariatrické reoperace při nedostatečné pooperační redukci (19).
Kolektiv autorů z Bostonu, Stanfordu, New Yorku a italské Pavie publikoval v roce 2018 multicentrickou retrospektivní kohortovou studii mladých dospělých ve věku 21 až 30 let po RYGB (n = 258) a SG (n = 61), operovaných v letech 2000 až 2014. Nemocní užívali topiramát, fentermin nebo metformin a 54,1 % ztratilo alespoň 5 %, 34,3 % minimálně 10 %, a dokonce 22,9 % více než 15 % hmotnosti, které dosáhli po operaci ve fázi plateau. Po RYGB zhubli více než po SG (-8,1 % vs. -3,3 %, p = 0,0515) (20).
Dvě práce zkoumaly účinek analogu GLP-1 liraglutidu. Skupinu 20 pacientů po bariatrii (SG, RYGB) prezentovali kanadští autoři. Cílem bylo zjistit, zda je liraglutid 3,0 mg účinný u pacientů, u nichž došlo: a) k pooperačnímu nárůstu hmotnosti (o > 10 % od nejnižší postbariatrické hmotnosti), b) celkově nedostatečné redukci váhy (o < 20 % předoperační hmotnosti), c) jsou ve fázi plateau (pacient si přeje další hubnutí, ale nespadá do žádné jiné kategorie). Za 16 týdnů po přidání farmakoterapie byl medián hmotnosti nižší o 7,1 % (IQR 5,1–12,2 %) a v 28. týdnu o 9,7 % (IQR 7,8–13,9 %). Medián BMI byl nižší o 3,5 kg/m2 v 16. týdnu (IQR 2,2–4,6 kg/m2) a o 4,7 kg/m2 v 28. týdnu (IQR 3,7–5,6 kg/m2). Nebyly zjištěny žádné závažné nežádoucí účinky (21).
Práce Whartona et al. z roku 2019 dokumentuje dobrý účinek 3,0 mg liraglutidu 1× denně u 53 pacientů po RYGB, u 50 po AGB a u 14 po SG. Vstupní BMI bylo 42,5 ± 9,6 kg/m2, pacienti byli v průměru 7,8 ± 5,7 roku po operaci. Po zahájení léčby liraglutidem došlo za první měsíc u všech sledovaných skupin ke stejnému úbytku 5,5 ± 6,2 % hmotnosti nezávisle na typu předchozí operace. Po 16 týdnech 45 % pacientů z celé sledované skupiny nedosáhlo alespoň 5% zhubnutí (požadovaného dle SPC), proto byla u nich léčba ukončena. Ani u této skupiny nemocných nebyla nalezena vazba na typ předchozí operace. Liraglutid obézní užívali v průměru 7,6 měsíce, zhubli 6,3 ± 7,7 kg (p < 0,05) nezávisle na typu předchozí operace (p > 0,05). Maxima redukce bylo dosaženo na konci 7. měsíce léčby, tedy shodně, jak tomu bývá u běžných pacientů na terapii antiobezitiky. Také výskyt i typ nežádoucích účinků byly stejné jako u obézních na liraglutidu bez předchozí bariatrie (22, obr. 3).
Image 3. Redukce hmotnosti po bariatrické operaci s použitím liraglutidu 3,0 ml 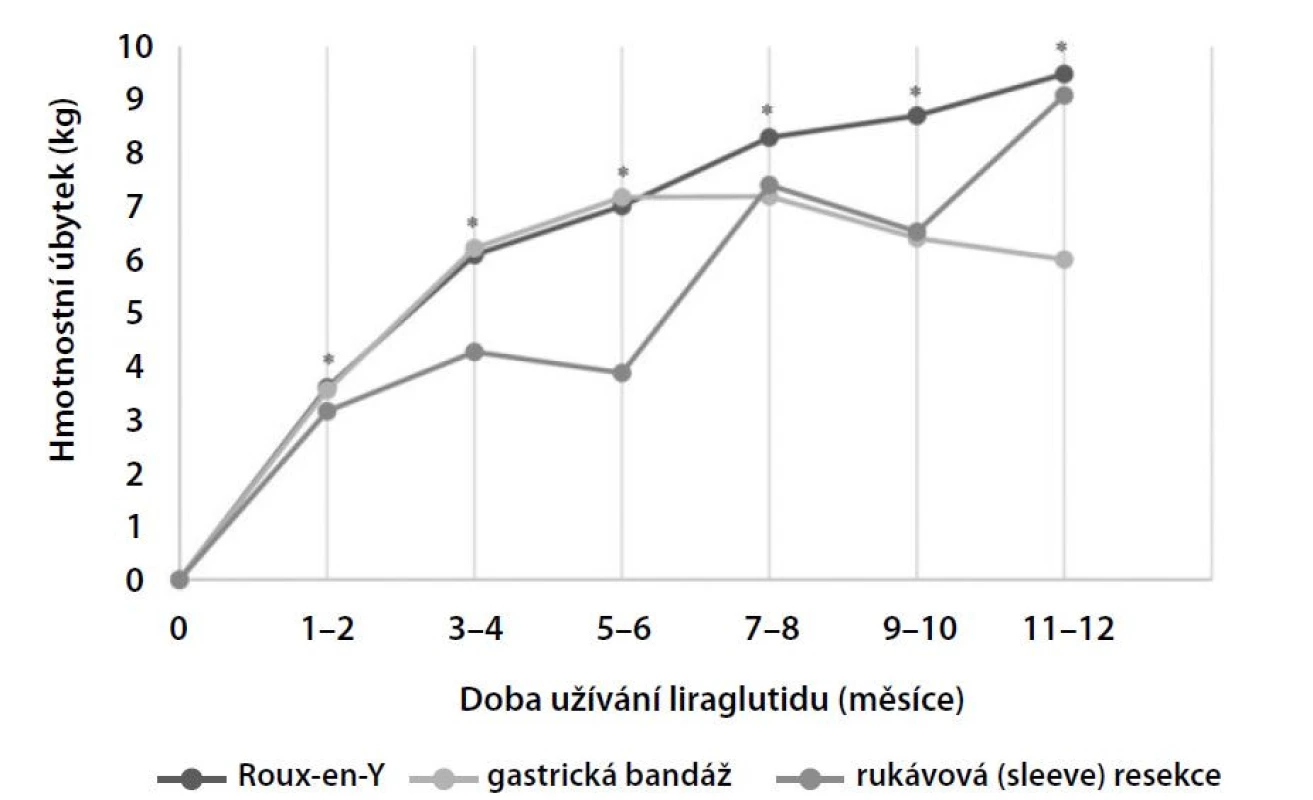
V kanadském Ontariu běží od roku 2020 placebem kontrolovaná studie fáze IV zaměřená na účinek kombinace naltrexon + bupropion u pacientů po bariatrii (RYGB, SG). Zahrnuto je 200 pacientů, ukončení se plánuje na rok 2023. Vstupní kritéria tvoří redukce o < 10 % celkové tělesné hmotnosti za 6 měsíců po operaci nebo o ˂ 20 % celkové tělesné hmotnosti za 12 měsíců po operaci anebo přírůstek 25 % ze zredukované váhy. Studijní medikace je podávána po dobu jednoho roku (23). Podobná měla být placebem kontrolovaná 7měsíční studie v norském Oslu, bohužel nebyla zahájena v důsledku proticovidových opatření.
MECHANISMUS PŮSOBENÍ ANTIOBEZITIK DOSTUPNÝCH V ČESKU
V Česku lze indikovat následující přípravky: kombinaci naltrexon+ bupropion (Mysimba) a liraglutid (Saxenda). Stále je dostupný i orlistat. Pro úplnost uvádíme i magistraliter Elsinorské prášky a Adipex ret. na opioidní recept.
Naltrexon s bupropionem
Jedná se o kombinované působení bupropionu jako antidepresiva, pozitivně ovlivňujícího proopiomelanokortinovou osu, spolu s naltrexonem, antagonistou opioidních receptorů. Antiobezitický efekt bupropionu je způsoben snížením příjmu potravy: inhibuje zpětné vychytávání dopaminu a noradrenalinu a aktivuje hypotalamickou POMC anorexigenní osu, potlačuje chuť k jídlu, zvyšuje kontrolu nad jídlem a snižuje bažení po jídle (craving). Naltrexon také snižuje příjem potravy, a to tím, že inhibuje opioidní neurony, které tlumí hypotalamickou melanokortinovou anorexigenní osu, a „odměňovací“ (reward) systém v CNS. Kromě pozitivního vlivu na snížení hmotnosti (v COR-BMOD Trial 55 % pacientů zredukovalo ≥ 10 % své původní váhy) lze pozorovat i další metabolické efekty – zmenšení obvodu pasu, snížení hladin triglyceridů, LDL, HbA1c, glykémie, diastolického TK a zvýšení HDL cholesterolu (24, 25, obr. 4).
Image 4. Redukce obvodu pasu při léčbě kombinací naltrexon-bupropion. 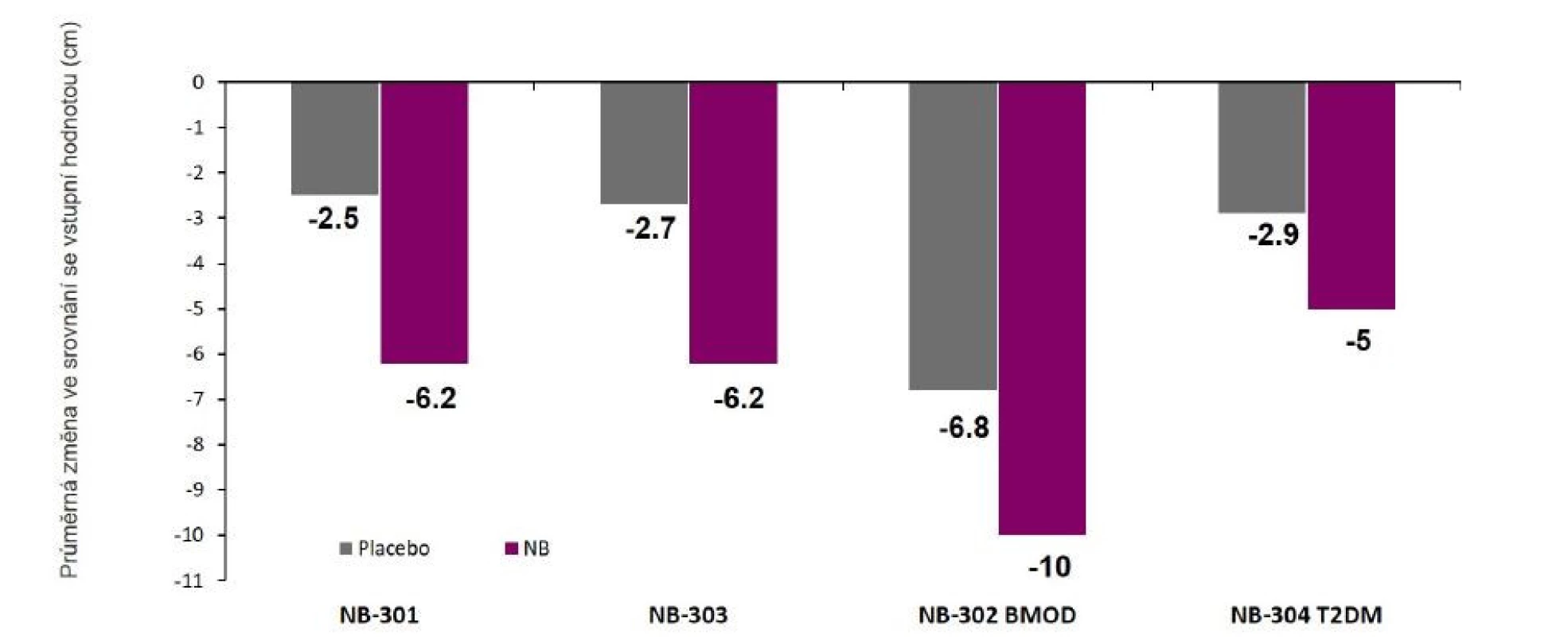
Změna v obvodu pasu (v 56. týdnu – NB-301, NB-302, NB-304, resp. v 28. týdnu – NB-303) ve srovnání se vstupní hodnotou. Kombinace naltrexonu s bupropionem nemá vliv na tepovou frekvenci. Její bezpečnost byla ověřována v 5 dvojitě zaslepených, placebem kontrolovaných studiích u 4754 pacientů s nadváhou nebo obezitou (1515 z nich dostávalo placebo), sledování trvalo 56 týdnů. Nissen et al. zkoumali kardiovaskulární bezpečnost a do své studie zařadili 4456 pacientů na naltrexonu s bupropionem a 4454 pacientů na placebu (26). Další systematický přehled a metaanalýzu představil kolektiv brazilských a mexických autorů v únoru 2021, kteří pracovali s daty 6980 účastníků studií. Jak zjistili, rozdíl ve výskytu závažných nežádoucích kardiovaskulárních příhod (MACE) mezi rameny nebyl statisticky významný (27). Terapie je schválena pro pacienty starší 18 let.
Liraglutid
Jedná se o první dostupný lék k léčbě obezity z řady analogů GLP-1. Podává se jednou denně subkutánně. Můžeme ho považovat za fyziologický regulátor sytosti. Tlumí zvýšenou sekreci glukagonu, zvyšuje sekreci inzulinu v endokrinních buňkách pankreatu, potlačuje apoptózu beta buněk pankreatu a zároveň navozuje pocit sytosti v mozku, snižuje chuť k jídlu, zpomaluje vyprazdňování žaludku, zvyšuje pocit plnosti a snižuje příjem potravy. V bílé tukové tkáni snižuje ukládání tuku stimulací lipolýzy a inhibicí lipogeneze. Má komplexní, centrální i periferní efekt. Agonisté GLP-1 jsou efektivní v navozování a udržování váhového úbytku s dobrou tolerancí a bezpečností. U nediabetiků/respondérů je průměrný váhový úbytek 10,3 kg za první rok a 9,7 kg za 2 roky aplikace (28).
Pokud kromě redukční stravy obnášející příjem 4200–5000 kJ/den (1000–1200 kcal) poskytneme obéznímu k léčbě liraglutidem ještě intenzivní kognitivně behaviorální terapii, dochází ke zvýšení průměrné redukce váhy až na 11,8 % původní hmotnosti za rok (29). Léčba snižuje krevní tlak, v ročním sledování systolický (sTK) o 4,2 mmHg a diastolický (dTK) o 2,6 mmHg, a má pozitivní vliv na lipidové parametry. Dochází ke zmenšení obvodu pasu, což může být i vhodnou indikací k použití liraglutidu před bariatrickou operací (30, obr. 5). V některých studiích též snižuje subklinickou zánětlivou reakci.
Image 5. Redukce viscerálního tuku při léčbě liraglutidem 3,0 ml 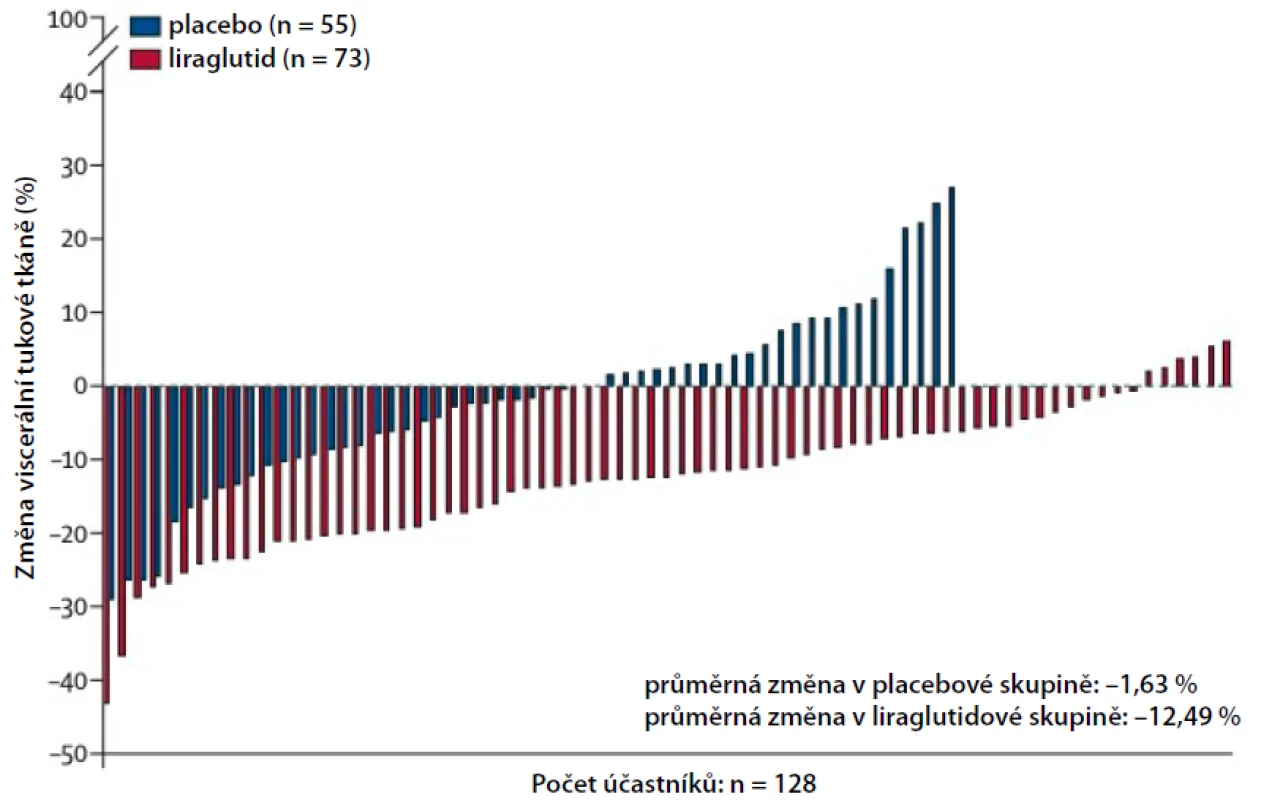
Kardiovaskulární bezpečnost liraglutidu je potvrzena studií LEADER s dobou sledování 3,5 až 5 let. Byli zařazeni diabetici 2. typu ve vysokém kardiovaskulárním riziku nebo již s anamnézou kardiovaskulární příhody, kteří aplikovali liraglutid v dávce 1,8 mg. Došlo k významnému snížení výskytu MACE (o 13 %) oproti placebu. Samotné riziko úmrtí z kardiovaskulárních příčin kleslo až o 22 %, významně sníženo (o 15 %) bylo i riziko celkové mortality. Metaanalýza SCALE prokázala, že léčba liraglutidem v dávce 3 mg je bezpečná (31). Terapie je schválena pro pacienty starší 12 let.
Orlistat
Orlistat je inhibitor střevních lipáz. Redukce hmotnosti se dosahuje sníženým vstřebáváním tuků z tenkého střeva, a to asi o 30 % při dávce 120 mg. Tímto mechanismem se dosahuje snížení energetického příjmu až o 600 kJ/den. U některých pacientů po zahájení terapie, někdy i déle, ale zvláště při nedodržení diety ve smyslu zvýšeného příjmu tuků má pacient pocity nadýmání, stolice odchází spolu s nevstřebaným tukem a mohou se vyskytovat mastné až imperativní průjmy. Průměrný pokles hmotnosti je 5,5 kg za rok. Dochází k významnému zlepšení lipidového spektra, zlepšení citlivosti na inzulin, poklesu hladiny HbA1c. U obézních nediabetiků významně klesá riziko vzniku diabetu 2. typu (až o 37 %). Orlistat je vhodný ke komplexní léčbě metabolického syndromu. Po 4 letech užívání je pokles hmotnosti o 2,8 kg větší ve srovnání s placebem (32).
ZÁVĚR
Prací o účincích antiobezitik před a po bariatrické operaci je zatím málo. Z hlediska efektu léků a jejich bezpečnosti je jejich využití nejen možné, ale i žádoucí. Při nedostatečné redukci hmotnosti či opětovném přibírání po bariatrii je důležité nemocnému s relapsy co nejúčinněji a nejrychleji pomoci. Konzervativní postupy (podpora omezení energetického příjmu, zvýšení pohybové aktivity a psychologické intervence) nebývají dostatečně účinné. Případná konverze (revizní operace) již provedené bariatrické operace v jinou je ve většině případů zatížena větší pravděpodobností komplikací než primooperace. I proto se přidání medikamentózní terapie k bariatrické léčbě jeví jako vhodná a bezpečná cesta.
Seznam použitých zkratek
AGB adjustabilní gastrická bandáž
BMI body mass index
dTK diastolický krevní tlak
GLP-1 glukagonu podobný peptid 1
HbA1c glykovaný hemoglobin
HDL lipoprotein s vysokou denzitou
IQR mezikvartilové rozpětí
IVF fertilizace in vitro
LDL lipoprotein s nízkou denzitou
MACE závažná nežádoucí kardiovaskulární příhoda
RYGB gastrický bypass Roux-en-Y
SG rukávová resekce žaludku (sleeve gastrectomy)
SOReg Skandinávský registr obezity
SOS study studie The Swedish Obese Subject
SPC souhrn údajů o léčivém přípravku
sTK systolický krevní tlak
TK krevní tlak
VLCD velmi nízkokalorická dieta
Adresa pro korespondenci:
MUDr. Petra Šrámková
OB klinika, a. s.
Pod Krejcárkem 975/2, 130 00 Praha 3
Tel.: 255 725 110/111
e-mail: petra.sramkova@obklinika.cz
Sources
- Harrison P. Obesity is a disease, not a choice, experts advise. Medscape, 2018. Dostupné na: www.medscape.com/viewarticle/896444
- Svačina Š. Obezitologie a teorie metabolického syndromu. Triton, Praha, 2013 : 33–40.
- Apovian CM. The obesity epidemic – understanding the disease and the treatment. N Engl J Med 2016; 374 : 177–179.
- James W, Ralph A, Ferro-Luzzi A. Energy needs of the elderly. A new approach. In: Munro HN, Dunford DE (ed.). Nutrition, ageing and the elderly. Plenum Press, New York, London, 1989 : 129–150.
- Lin CK, Lin CC. Work of breathing and respiratory drive in obesity. Respirology 2012; 17 : 402–411.
- Cassie S, Menezes C, Birch DW et al. Effect of preoperative weight loss in bariatric surgical patients: a systematic review. Surg Obes Relat Dis 2011; 7 : 760–767.
- Van Nieuwenhove Y, Dambrauskas Z, Campillo-Soto A et al. Preoperative very low-calorie diet and operative outcome after laparoscopic gastric bypass: a randomized multicenter study. Arch Surg 2011; 146 : 1300–1305.
- Thorell A, MacCormick AD, Awad S et al. Guidelines for perioperative care in bariatric surgery: Enhanced Recovery After Surgery (ERAS) Society Recommendations. World J Surg 2016; 40 : 2065–2083.
- Gerber P, Anderin C, Gustafsson UO, Thorell A. Weight loss immediately prior to gastric bypass and postoperative weight change. Surg Obes Relat Dis 2016; 12 : 556–562.
- Chinaka U, Fultang J, Ali A et al. Pre-specified weight loss before bariatric surgery and postoperative outcomes. Cureus 2020; 12: e12406.
- Iglesias P, Civantos S, Vega B et al. Clinical effectiveness of exenatide in diabetic patients waiting for bariatric surgery. Obes Surg 2015; 25 : 575–578.
- Ta D, Dang JT, Sharma AM et al. Use of Liraglutide in a tertiary bariatric clinic: a case series. J Obes Chronic Dis 2019; 3 : 36–39.
- Tek C. Naltrexone HCI/bupropion HCI for chronic weight management in obese adults: patient selection and perspectives. Patient Prefer Adherence 2016; 10 : 751–759.
- Wang Z, Li X, Knoth R et al. Cost implication of using lorcaserin in weight management prior to bariatric surgery. Value Health 2015; 18: A295.
- Abu Dayyeh BK, Maselli DB, Rapaka B et al. Adjustable intragastric balloon for treatment of obesity: a multicentre, open-label, randomised clinical trial. Lancet 2021; 398 : 1965–1973.
- Bariatric Surgery: Selection & Pre-Operative Work Up. Obesity Canada, 2022. Dostupné na: https://obesitycanada.ca/guidelines/preop
- Sjöström L, Peltonen M, Jacobson P et al. Bariatric surgery and long-term cardiovascular events. JAMA 2012; 307 : 56–65.
- Adams TD, Davidson LE, Litwin SE et al. Weight and metabolic outcomes 12 years after gastric bypass. N Engl J Med 2017; 377 : 1143–1155.
- Nor Hanipah Z, Nasr EC, Bucak E et al. Efficacy of adjuvant weight loss medication after bariatric surgery. Surg Obes Relat Dis 2018; 14 : 93–98.
- Toth AT, Gomez G, Shukla AP et al. Weight loss medications in young adults after bariatric surgery for weight regain or inadequate weight loss: a multi-center study. Children (Basel) 2018; 5 : 116.
- Rye P, Modi R, Cawsey S et al. Efficacy of high-dose liraglutide as an adjunct for weight loss in patients with prior bariatric surgery. Obes Surg 2018; 28 : 3553–3558.
- Wharton S, Kuk JL, Luszczynski M et al. Liraglutide 3.0 mg for the management of insufficient weight loss or excessive weight regain post-bariatric surgery. Clin Obes 2019; 9: e12323.
- A Trial Evaluating the Effectiveness of Contrave in Patients Who Have Weight Recidivism Following Bariatric Surgery (COR-WR). ClinicalTrials.gov, 2020. Dostupné na: https://clinicaltrials.gov/ct2/show/record/NCT04587843?view=record
- Waden TA, Foreyt JP, Foster GD et al. Weight loss with naltrexone SR/bupropion SR combination therapy as an adjunct to behavior modification: the COR-BMOD Trial. Obesity (Silver Spring) 2011; 19 : 110–120.
- Hollander P, Gupta AK, Plodkowski R et al. Effects of naltrexone sustained – release/bupropion sustained-release combination therapy on body weight and glycemic parameters in overweight and obese patients with type 2 diabetes. Diabetes Care 2013; 36 : 4022–4029.
- Nissen SE, Wolski KE, Prcela L et al. Effect of naltrexone-bupropion on major adverse cardiovascular events in overweight and obese patients with cardiovascular risk factors: a randomized clinical trial. JAMA 2016; 315 : 990–1004.
- Sposito AC, Bonilha I, Luchiari B et al. Cardiovascular safety of naltrexone and bupropion therapy: Systematic review and meta-analyses. Obes Rev 2021; 22: e13224.
- Astrup A, Carraro R, Finer N et al. Safety, tolerability and sustained weight loss over 2 years with the once-daily human GLP-1 analog, liraglutide. Int J Obes (London) 2012; 36 : 843–854.
- Waden TA, Walsh OA, Berkowitz RI et al. Intensive behavioral therapy for obesity combined with liraglutide 3.0 mg: A randomized controlled trial. Obesity (Silver Spring) 2019; 27 : 75–86.
- Pi-Sunyer X, Astrup A, Fujioka K et al. A randomized, controlled trial of 3.0 mg of liraglutide in weight management. N Engl J Med 2015; 373 : 11–22.
- Marso SP, Daniels GH, Brown-Frandsen K et al. Liraglutide and cardiovascular outcomes in type 2 diabetes. N Engl J Med 2016; 375 : 311–322.
- Torgerson JS, Hauptman J, Boldrin MN et al. Xenical in the prevention of diabetes in obese subject (XENDOS) study: randomized study of orlistat as an adjunct to lifestyle changes for prevention of type 2 diabetes in obese patients. Diabetes Care 2004; 27 : 155–161.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

2022 Issue 3-4-
All articles in this issue
- Úvodem
- Současnost a perspektivy léčby obezity: Co již víme a co můžeme očekávat?
- Současná bariatrická/metabolická chirurgie
- Antiobezitika před bariatrickou operací a po ní – jak je využít co nejlépe
- Nutriční péče o bariatrické pacienty
- Doporučení k psychologickému vyšetření před bariatrickou operací
- Fekální bakterioterapie v léčbě recidivující střevní infekce bakterií Clostridioides difficile – 10leté zkušenosti gastroenterologického pracoviště
- Bartterův a Gitelmanův syndrom
- Myokarditida jako projev onemocnění COVID-19 a po očkování proti této nemoci
- Anesteziologická péče pro nekardiochirurgické výkony u pacientů po transplantaci srdce
- Torakoskopický přístup v terapii poranění hrudního mízovodu – kazuistiky a revize literatury
- Využití autonomních leteckých systémů ve zdravotnictví
- Současná problematika dárcovství těl pro výukové a výzkumné účely a jejich využití v Česku
- Islámská republika Írán – překvapivě progresivní centrum zdravotního turismu
- Horizont Evropa, rámcový program Evropské komise na období 2021–2027 – novinky ve srovnání s programem Horizont 2020
- Veřejné zdravotnictví v průběhu času – vývoj a současnost
- Jakub Hron Metánovský a jeho stopy v medicíně
- Harold Eliot Varmus (*1939)
- 64. Purkyňův den – rozloučení s prof. MUDr. Otto Hrodkem, DrSc.
- Karel Lukáš, Josef Kautzner, Jiří Hoch a kol. Bolest na hrudi (Grada Publishing, Praha, 2022, 642 s.)
- Přednáškové večery Spolku českých lékařů v Praze (září - říjen 2022)
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Bartterův a Gitelmanův syndrom
- Současná bariatrická/metabolická chirurgie
- Fekální bakterioterapie v léčbě recidivující střevní infekce bakterií Clostridioides difficile – 10leté zkušenosti gastroenterologického pracoviště
- Doporučení k psychologickému vyšetření před bariatrickou operací
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

