-
Medical journals
- Career
Současné možnosti léčby monogenních syndromů periodických horeček – úloha inhibitorů interleukinu 1
Authors: Tomáš Milota 1,2; Hana Malcová 1; Zuzana Střížová 1,2; Dita Cebecauerová 1; Rudolf Horváth 1
Authors‘ workplace: Oddělení revmatologie dětí a dospělých, FN Motol, Praha 1; Ústav imunologie 2. LF UK a FN Motol, Praha 2
Published in: Čas. Lék. čes. 2022; 161: 3-10
Category: Review Article
Overview
Monogenní syndromy periodických horeček představují heterogenní skupinu autoinflamatorních onemocnění zahrnující syndromy, jako jsou periodické horečky asociované s kryopyrinem (CAPS), receptorem pro tumor nekrotizující faktor (TRAPS), deficitem mevalonátkinázy (MKD/HIDS) a familiární středomořská horečka (FMF). Navzájem se odlišují patogenezí, klinickými projevy a závažností. Klíčovou roli u všech těchto syndromů ovšem hrají cytokiny z rodiny interleukinu 1 (IL-1). Inhibice zmíněných cytokinů, především IL-1, tak hraje zásadní roli v jejich léčbě.
V současnosti je k dispozici řada léčivých přípravků, které se liší strukturou, mechanismem působení, účinností a spektrem nežádoucích účinků. Mezi nejdostupnější patří anakinra, kanakinumab a rilonacept. Zároveň však probíhá řada klinických hodnocení s jinými velmi nadějnými léčivy, například gevokizumabem, tadekinigem alfa či tranilastem. V následujícím přehledu přinášíme nový pohled na účinnost a bezpečnost inhibitorů IL-1, který poskytly výsledky recentních klinických studií.
Klíčová slova:
kanakinumab – anakinra – interleukin-1 – monogenní syndromy periodických horeček – CAPS – rilonacept
ÚVOD
Autoinflamatorní onemocnění (AIO) představují heterogenní skupinu vzácných chorob, která je charakterizovaná chronickými nebo recidivujícími zánětlivými stavy. Na rozdíl od autoimunitních chorob dochází k dysregulaci imunitního systému na úrovni vrozené imunity (1). AIO se typicky projevují v časném dětství, ale mohou se manifestovat i s opožděným nástupem. Vzhledem k raritnímu výskytu a široké diferenciální diagnostice může docházet k významnému zpoždění stanovení správné diagnózy s následným negativním dopadem na prognózu onemocnění (2).
Etiologie AIO může být monogenní, ale i multifaktoriální s polygenní dědičností. Monogenní AIO zahrnují především syndromy periodických horeček – syndromy periodických horeček asociovaných s kryopyrinem (CAPS – cryopyrine-associated periodic fever), s receptorem pro tumor nekrotizující faktor (TRAPS – tumor necrosis factor receptor-associated periodic fever), deficitem mevalonátkinázy (MKD/HIDS – mevalonat kinase deficiency/hyper IgD syndrome) a familiární středomořskou horečku (FMF – familial mediterranean fever). CAPS a TRAPS jsou typicky autosomálně dominantně dědičná onemocnění, zatímco MKD/HIDS a FMF vykazují autosomálně recesivní způsob dědičnosti.
Klinické projevy zahrnují vedle recidivujících horeček také zánětlivé postižení kůže, synovie, perikardu, ale i postižení gastrointestinálního traktu (GIT) či centrálního nervového systému (CNS) (3, 4). K nejzávažnějším komplikacím pak patří sekundární amyloidóza, která se rozvíjí ve 2–25 % případů (5). Monogenní AIO sdílejí řadu patofyziologických rysů i klinických projevů s polygenními AIO, zahrnující např. systémovou juvenilní idiopatickou artritidu nebo Stillovu chorobu s manifestací v dospělosti. Pro všechna tato onemocnění je typická nadprodukce prozánětlivých cytokinů z rodiny IL-1. Inhibitory IL-1 proto představují racionální a velmi efektivní léčebnou modalitu (6, 7).
CYTOKINY RODINY IL-1
Cytokiny IL-1 jsou klíčové pro správnou funkci imunitního systému. Jednotlivé cytokiny se vážou na specifické receptory, čímž spouštějí kaskádu dějů zahrnující aktivaci a regulaci širokého spektra buněk imunitního systému. Dosud bylo identifikováno celkem 11 cytokinů patřících do rodiny IL-1 (IL-1α, IL-1β, IL-1Ra, IL-18, IL-33, IL-36α, IL-36β, IL-36Ra, IL-37, IL-38). Většinu z nich aktivuje systém kaspáz 1, 3 a 7, které štěpí jejich neaktivní prekurzory na biologicky aktivní formy. Samotné kaspázy jsou pak aktivovány multiproteinovými oligomerickými komplexy, tzv. inflamasomy (v případě kaspázy 1) a apoptosomy (kaspáza 3 a 7), v odpovědi na širokou škálu stimulů (obr. 1). Hlavním efektorovým mechanismem těchto cytokinů je výrazná prozánětlivá odpověď zprostředkovaná adaptorovým proteinem MyD88 (myeloid differentiation factor 88) a transkripčním faktorem NFkB (nuclear factor kappa-light-chain-enhancer of activated B cells) (8, 9) (obr. 2). Nicméně některé cytokiny z rodiny IL-1 (IL-1Ra, IL-36Ra, IL-37, IL-38) vykazují i protizánětlivý účinek (obr. 3). Úloha prozánětlivého účinku IL-1 jako klíčového patogenetického mechanismu byla potvrzena u řady onemocnění včetně AIO (10).
Image 1. Aktivace kaspáz inflamasomy a apoptosomy 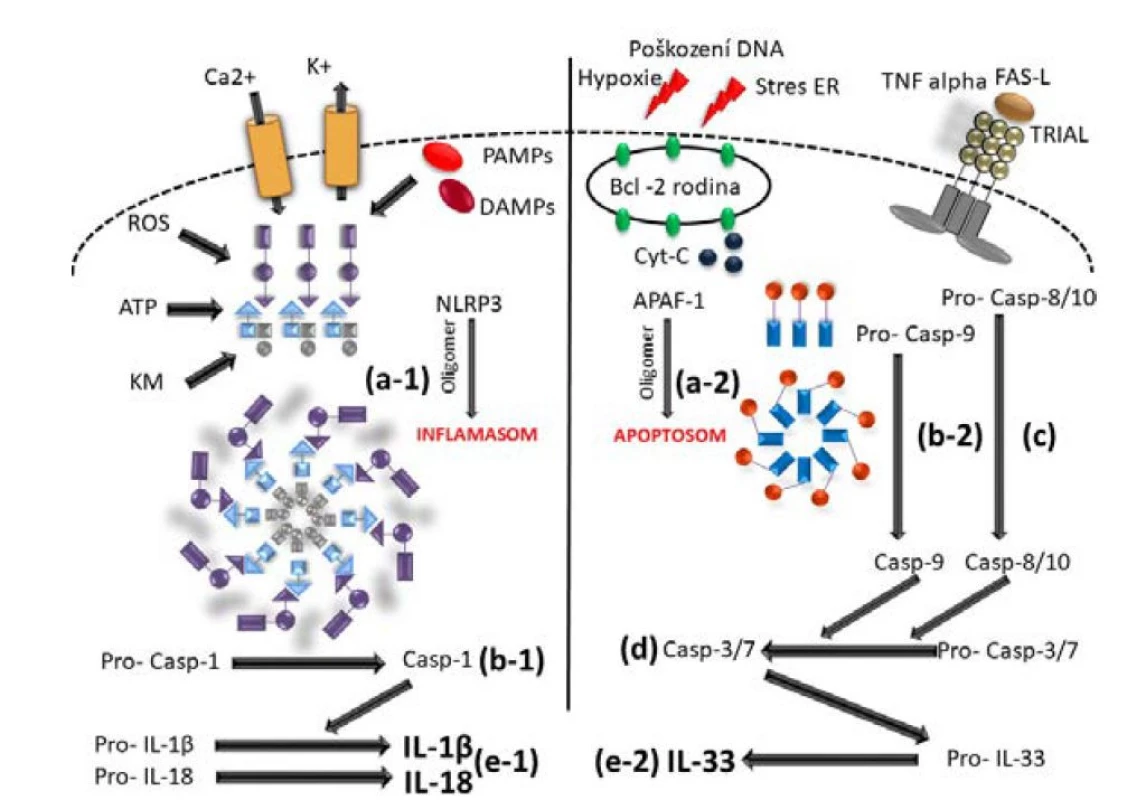
Image 2. Prozánětlivá odpověď zprostředkovaná adaptorovým proteinem MyD88 a transkripčním faktorem NFkB 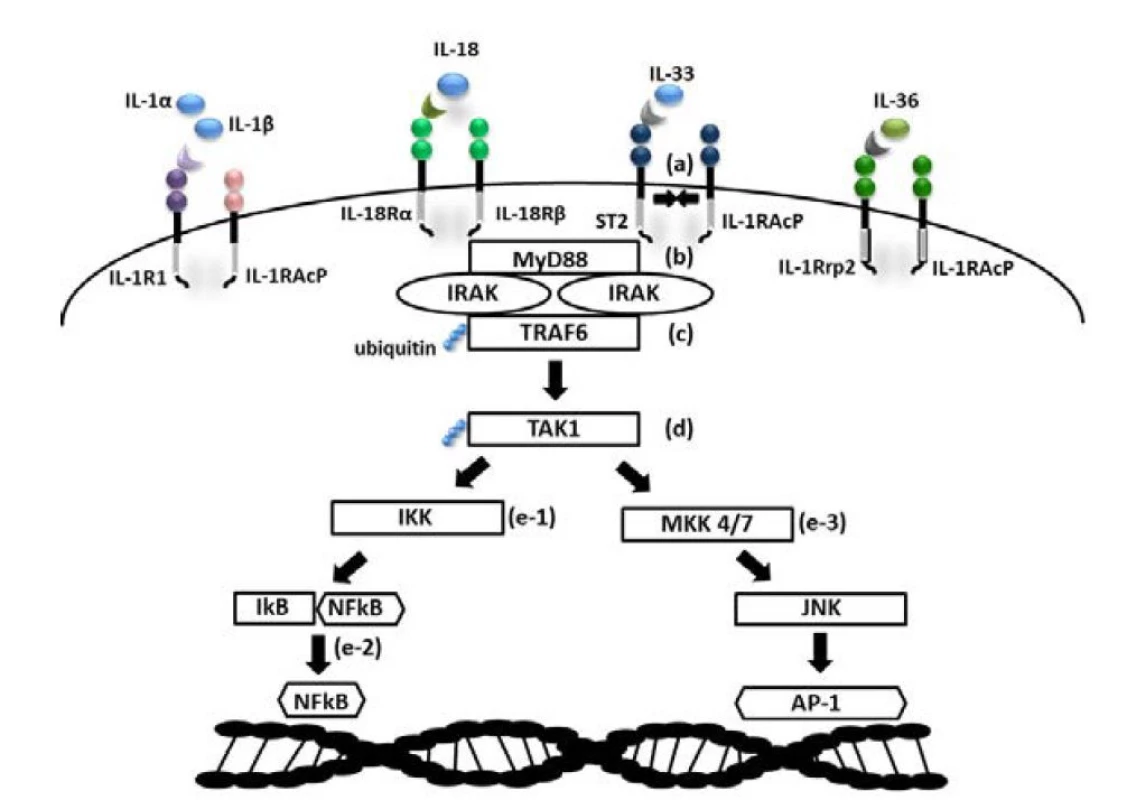
Image 3. Protizánětlivý účinek cytokinů z rodiny IL-1 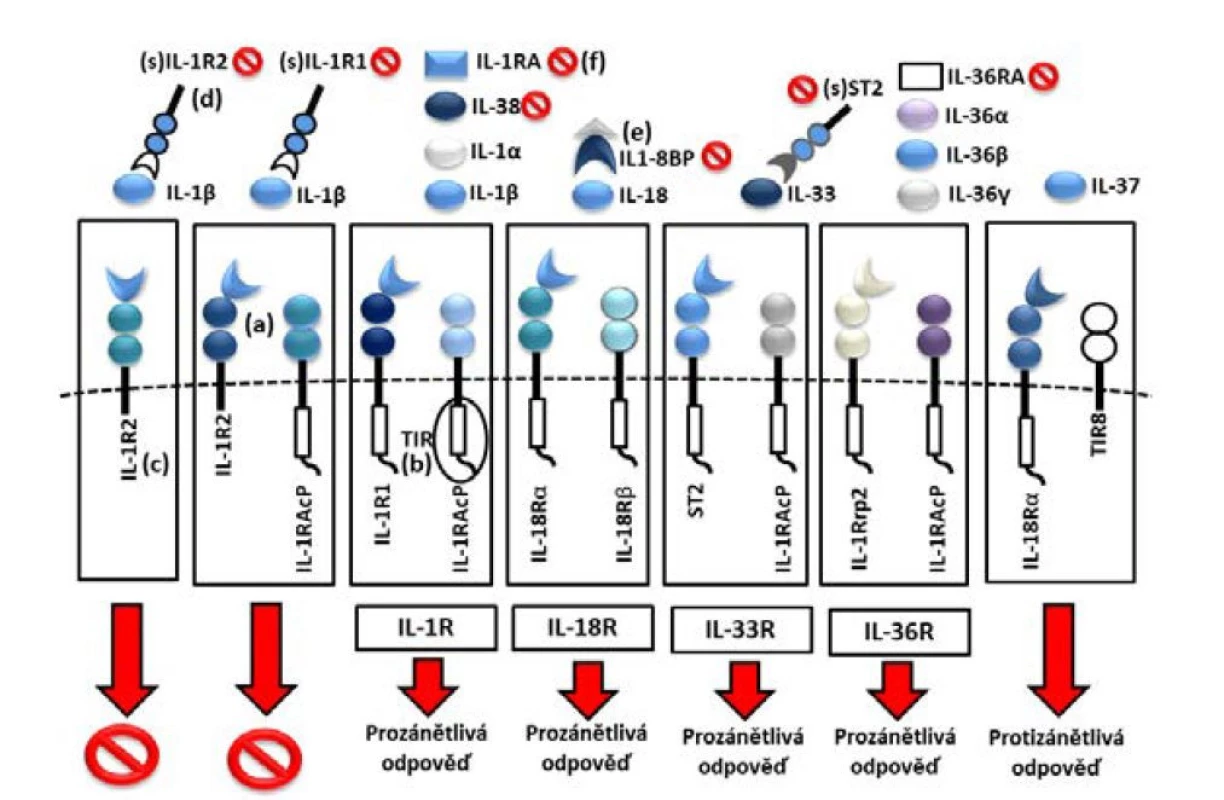
INHIBITORY CYTOKINŮ IL-1
V současnosti jsou ke klinickému použití schváleny tři inhibitory IL-1, liší se strukturou, mechanismem účinku, efektivitou v léčbě jednotlivých AIO i spektrem nežádoucích účinků (NÚ). Anakinra (ANA) je strukturálně rekombinantní forma IL-1Ra (receptorový antagonista). Hlavním mechanismem účinku je zabránění vazbě IL-1α a IL-1β na receptor IL-1. ANA tak má úlohu kompetitivního antagonisty. Kanakinumab (CAN) je monoklonální protilátka, která specificky váže IL-1β, čímž brání jeho vazbě na receptor IL-1. Rilonacept (RILO) má úlohu solubilního receptoru, který preferenčně váže IL-1β, ale má schopnost snižovat účinek i IL-1α. Všechny 3 mechanismy účinku vedou k snížení prozánětlivé odpovědi u chorob s dominantní úlohou cytokinů IL-1. Zatímco ANA a CAN byly schváleny k terapeutickému použití Evropskou lékovou agenturou (EMA), RILO je dostupný pouze ve Spojených státech amerických (11, 12). Inhibice IL-1 u monogenních AIO byla doporučena jako stěžejní terapeutický přístup i evropskou iniciativou SHARE (Single Hub and Access Point for Pediatric Rheumatology in Europe) (13, 14).
Probíhá ale i řada klinických hodnocení s jinými velmi nadějnými léčivy. Gevokizumab, blokující monoklonální protilátka, která snižuje afinitu IL-1β k signálnímu komplexu IL-1RI/IL-1RAcP (15). Tadekinig alfa je lidský rekombinantní protein, který aktivně váže IL-18, a tím zabraňuje jeho vazbě na receptor. Použití tadekinigu alfa se předpokládá především u život ohrožujících stavů, jako je makrofágy aktivující syndrom (MAS) (16). Tranilast, který působí jako inhibitor histaminoliberace mediované IgE, má významný vliv i na NLRP3 (nucleotide-binding oligomerization domain, leucine rich repeat and pyrin domain containing 3) – strukturální součást inflamasomu, jež má zásadní úlohu v aktivaci kaspázy 1, a tedy i IL-1β (17). Dapansutril patří k nejnovějším přímým inhibitorům NLRP3 k perorálnímu použití a v současnosti je klinicky testován v léčbě dny a autoimunitní encefalitidy. Předpokládá se ale i jeho potenciál v terapii AIO (18, 19). Mezi další slibné molekuly s přímými inhibičními účinky na NLRP3 inflamasom patří diacerein, inzomelid nebo molekula MCC950 (20–22).
V následujícím přehledu uvádíme výsledky klíčových a nejnovějších klinických hodnocení sledujících účinnost a bezpečnost léčby inhibitory IL-1 zahrnující ANA, RILO a CAN u onemocnění CAPS, TRAPS, FMF a MKD/HIDS. Zahrnuty byly pouze písemné a recenzované zprávy publikované v angličtině v indexovaných mezinárodních časopisech a databázích Medline/PubMed, Scopus a Web of Science. Autoři postupovali podle navrhovaných pokynů pro přípravu biomedicínského narativního přehledu (23).
CAPS
CAPS představují celkem 3 klinické jednotky lišící se navzájem klinickými projevy a závažností: FCAS (familial cold autoinflammatory syndrome), MWS (Muckle-Wells syndrome) a nejzávažnější forma CINCA/NOMID (chronic infantile neurological cutaneous and articular syndrome/neonatal onset multisystem inflammatory disease).
FCAS je typicky spojen s horečkou, kožními projevy, muskuloskeletálními projevy zahrnující myalgie a artralgie, konjunktivitidou. Tyto symptomy obvykle spouští expozice chladu. MWS je vzácné onemocnění charakterizované též výskytem periodických horeček a urtikariálním exantémem. Typická je pro něj ale i progresivní senzorineurální hluchota a renální amyloidóza (24, 25).
CINCA/NOMID se pojí s nejzávažnějším fenotypem, který představuje triáda symptomů: urtikariální exantém, artropatie a postižení CNS zahrnující chronickou aseptickou meningitidu, která může vést až k atrofii mozkové tkáně a senzorineurální hluchotě (26). K typickým projevům patří i kraniofaciální dysmorfie – prominující čelo a sedlovitý nos. Patofyziologicky jsou syndromy ze skupiny CAPS asociovány s mutací v genu NLRP3 vedoucí k nadprodukci IL-1β (27).
Anakinra
Ačkoliv použití ANA u syndromů CAPS nebylo na rozdíl od CAN a RILO posuzováno v randomizovaném klinickém hodnocení, několik otevřených studií potvrdilo její účinnost i bezpečnost jak u nejtěžších forem CAPS (CINCA/NOMID), tak u MWS. Goldbach-Mansky et al. popsali ústup nebo zmírnění všech sledovaných symptomů (horečka, vyrážka, bolest hlavy, kloubů a zvracení) u všech pacientů (n = 18). Odpověď na léčbu byla patrná již v průběhu několika dní od jejího zahájení. U šesti pacientů došlo i ke zlepšení sluchu, u devíti pak užívání ANA progresi sluchového postižení zastavilo (hodnoceno po 6 měsících léčby). V průběhu studie byla u 11 pacientů terapie ANA přerušena. U 10 z nich došlo k relapsu onemocnění v intervalu 2,5–7 dnů (medián 5 dní). Po znovuzahájení terapie bylo opět rychle dosaženo klinické odpovědi, která přetrvávala i po 6 měsících (28).
Podobně slibných výsledků bylo docíleno i v klinické studii s 12 pacienty s MWS. Pokles klinické aktivity (DAS-MWS < 10, disease activity score) byl pozorován u všech. Významný dopad měla terapie i na normalizaci sledovaných laboratorních parametrů – FW (11 z 12), CRP (5 z 11), krevní obraz (11 z 12). Jako slibný marker aktivity onemocnění byl hodnocen i sérový protein S100A12. Efekt terapie u naprosté většiny pacientů přetrvával po celou dobu studie (5–14 měsíců, medián 11) (29).
Na bezpečnost ANA u CAPS se soustředila studie sledující kohortu 43 pacientů po dobu 5 let. Celková incidence nežádoucích příhod činila 7,7 pacientoroků. Žádný jednotlivý typ nežádoucí příhody nepřesáhl 0,8 pacientoroků. Nejčastěji uváděné nežádoucí příhody (bolesti hlavy nebo kloubů) souvisely s aktivitou základního onemocnění. Z ostatních dominovaly především lokální reakce v místě aplikace, které se objevovaly v prvních měsících léčby. Incidence nežádoucích příhod nebyla ovlivněna eskalací léčby. Závažné nežádoucí příhody byly popsány u 14 pacientů, jednalo se především o infekční komplikace (např. pneumonie či gastroenteritida). Všechny tyto příhody odezněly v průběhu sledování a žádná z nich nevedla k permanentnímu ukončení léčby (30).
Kanakinumab
Efektivita a bezpečnost použití CAN v léčbě pacientů s CAPS již byla potvrzena v rámci randomizované, dvojitě zaslepené, placebem kontrolované studie. Koné-Paut et al. hodnotili účinek CAN u 35 osob s CAPS. U 89 % (31) nemocných došlo v 8. týdnu otevřené fáze (1. část) k vymizení příznaků nebo alespoň dosažení minimální aktivity onemocnění (hodnoceno PGA – physician global assessment) a současně normalizaci zánětlivých parametrů (C-reaktivní protein [CRP] a/nebo sérový amyloid A [SAA]). V následující dvojitě zaslepené placebem kontrolované fázi (2. část) tato odpověď přetrvávala u všech, kteří pokračovali v léčbě (15 z 15). Naopak ve skupině s placebem došlo ke ztrátě účinnosti u 75 % (12 z 16). Odpovědi však tito pacientů znovu dosáhli krátce po obnovení léčby (3. část). Celkově bylo docíleno minimální aktivity onemocnění nebo remise u téměř 97 % pacientů (30 ze 31). Terapie měla také významný dopad na kvalitu života pacientů. Mimo tradičních parametrů zánětlivé odpovědi, jako jsou CRP a SAA, odrážela úroveň aktivity onemocnění i hladina IL-6. Závažné nežádoucí účinky byly pozorovány pouze u dvou pacientů (31).
Podobné výsledky získali v jiné randomizované studii Lachman et al. V počáteční otevřené fázi (část 1) dosáhlo okamžité odpovědi, definované jako minimální aktivita onemocnění nebo remise (hodnoceno pomocí PGA) a normální hodnoty zánětlivých parametrů (CRP a SAA), 97 % (34 z 35) pacientů již po jedné dávce CAN do 24 hodin. Ve dvojitě zaslepené fázi (2. část) pak všech 15 pacientů pokračujících v léčbě zůstalo v remisi (24. týden). Naopak ve skupině s placebem došlo k relapsu onemocnění u 81 % (13 ze 16), ke vzplanutí onemocnění došlo v průběhu 100 dnů (medián) po vysazení léčby. Následně všichni pacienti vstoupili do otevřené fáze (3. část), na jejímž konci (48. týden) remise přetrvávala u 97 % všech pacientů (30 ze 31). Během studie nebyly, překvapivě, hlášeny žádné reakce v místě aplikace (32).
Rilonacept
Jednu z prvních randomizovaných, placebem kontrolovaných klinických studií s RILO v léčbě CAPS provedli Hoffman et al. Zařazeno bylo celkem 47 pacientů s CAPS. Na konci 1. části (6. týden) došlo u 84 % pacientů v aktivně léčené skupině k signifikantnímu zlepšení klinických projevů (hodnoceno pomocí DHAF) ve srovnání s placebem (pokles o 2,6 bodu/84 % vs. 0,3 bodu/13 %; p < 0,0001) spolu s normalizací laboratorních zánětlivých parametrů (CRP a SAA). Účinnost doložily i výsledky 2. části studie, kde odpověď přetrvávala ve skupině léčené RILO, zatímco u většiny pacientů ve skupině s placebem došlo ke zhoršení příznaků onemocnění. Nejčastějšími nežádoucími příhodami byly lokální reakce a infekce dýchacích cest (33).
TRAPS
TRAPS je autosomálně dominantní onemocnění způsobené mutací genu TNFRSF1A kódujícího receptor 1 pro tumor nekrotizující faktor (TNF-R1). Onemocnění se typicky manifestuje ve 3 letech života, přesto byly hlášeny případy nástupu i v 6. dekádě. Klinicky je TRAPS charakterizován dlouhotrvajícími a opakovanými epizodami horečky a zánětu, které postihují většinou kůži, GIT, serózy, klouby, svaly a oči (34).
Ataky choroby zpočátku dobře reagují na systémové glukokortikoidy (GK), odpověď však v průběhu času rychle klesá. Pokud není onemocnění dlouhodobě pod kontrolou, může vést k rozvoji sekundární amyloidózy (35). Podobně jako u CAPS byla v patogenezi tohoto onemocnění popsána významná role IL-1, a proto se blokáda IL-1 stala důležitou možností léčby TRAPS (36, 37).
Anakinra
První důkazy o účinnosti ANA u pacientů s TRAPS pocházejí již z roku 2008. V pilotní otevřené studii Gattorno et al. hodnotili účinnost a bezpečnost ANA u 5 pacientů s TRAPS. Léčba byla podávána všem po dobu 15 dnů, poté byla ukončena. Po podání ANA se dostavila promptní reakce na terapii a úplně vymizely projevy onemocnění, též poklesly zánětlivé parametry. Po ukončení léčby došlo u všech pacientů ke vzplanutí nemoci do několika dnů (3–8), opětovným nasazením bylo ihned znovu dosaženo adekvátní kontroly, která trvala po celou dobu klinického hodnocení (4–20 měsíců, medián 11,4). Jedinými pozorovanými nežádoucími příhodami byly kožní projevy (vyrážka, bolest a svědění), které se objevily během 1. týdne léčby (38).
Kanakinumab
Jediná randomizovaná, dvojitě zaslepená, placebem kontrolovaná klinická studie zaměřená na hodnocení účinnosti kanakinumabu u pacientů s TRAPS byla dokončena v červenci 2017. Do studie byly zařazeny i další skupiny pacientů, viz dále de Benedetti et al. (39). V současnosti neexistují žádné jiné randomizované klinické studie s inhibitory IL-1 u pacientů s TRAPS.
FMF
Jedná se o dědičné autoinflamatorní onemocnění s nejvyšší prevalencí mezi monogenními AIO, převážně autosomálně recesivní. Charakterizují ho opakované epizody horečky a polyserozitidy. Epizody horečky často doprovázejí bolesti břicha v důsledku peritoneálního dráždění a muskuloskeletální postižení včetně artritidy a myalgií. Artritida je obvykle přítomna u přibližně 70 % pacientů, a to ve formě přechodné neerozivní monoartritidy postihující velké klouby. Přechod do chronicity je pozorován pouze u omezeného počtu pacientů (40, 41). Intervaly mezi epizodami horečky se u každého jednotlivce liší a mohou trvat týdny až roky. Velmi často dochází k rozvoji dlouhodobých komplikací. Mezi nejzávažnější patří především sekundární amyloidóza, která v některých případech může vést až k selhání ledvin (42).
Patogeneze FMF zůstává do značné míry neznámá. Gen MEFV asociovaný s FMF kóduje pyrin, mutace v MEFV tak vede k nekontrolované aktivaci inflamasomu a produkci IL-1 (43).
Terapie FMF sleduje především dva hlavní cíle: prevenci atak a potlačení chronického zánětu doprovázeného zvýšením SAA. Podle doporučení Evropské ligy proti revmatismu (EULAR) je blokáda IL-1 indikována zejména u pacientů, kteří dostatečně nereagují na léčbu kolchicinem. Přes vysokou účinnost byla rezistence vůči kolchicinu popsána přibližně u 5–10 % pacientů s FMF. Mechanismy, které k ní vedou, zatím nejsou známy. Další problém omezující užívání kolchicinu představuje také intolerance, hlášená u 2–5 % pacientů, zejména v důsledku gastrointestinálních NÚ (44, 45). Neadekvátní odpověď na kolchicin byla popsána u různých autoinflamatorních poruch (46, 47), a proto léčba pacientů s FMF rezistentních na kolchicin zůstává výzvou, přičemž blokáda IL-1 představuje slibnou možnost managementu této choroby.
Anakinra
Na hodnocení efektivity ANA u pacientů rezistentních vůči kolchicinu byla zaměřena randomizovaná, placebem kontrolovaná studie, již provedli Ben-Zvi et al. ANA byla dobře snášena a projevila větší účinnost než placebo. Pacienti na aktivní léčbě udávali menší počet atak ve srovnání s pacienty na placebu (1,7 vs. 3,5 za měsíc; p = 0,037), terapie významně ovlivňovala i aktivitu v kloubní doméně (0,8 vs. 2,1 ataky za měsíc; p = 0,005) a kvalitu života (VAS 7,7 vs. 4,2; p = 0,045). V žádné skupině nebyly hlášeny závažné nežádoucí příhody. Jejich incidence se mezi skupinami významně nelišila. Převládaly především gastrointestinální (66 %), muskuloskeletální (41,7 %) a lokální (41,7 %) komplikace spolu s bolestmi hlavy (50 %) (48).
Kanakinumab
CLUSTER je jedna z nejvýznamnějších studií prokazující efektivitu u pacientů s FMF rezistentní na kolchicin. Studie byla rozdělena do 4 částí (1. screeningová, 2. randomizovaná, dvojitě zaslepená, placebem kontrolovaná, 3. otevřená, 4. extenze studie). Recentně byly publikovány výsledky 4. části, do níž bylo zahrnuto celkem 60 pacientů. Po dobu studie (72 týdnů) se u většiny pacientů (58 %, 35 z 60) neobjevila žádná ataka onemocnění, případně se vyskytla nejvýše jedna (38 %, 23 z 60). Incidence vzplanutí onemocnění (59 %, 26 z 44 vs. 57 %, 9 z 16) se mezi jednotlivými dávkovacími režimy významně nelišila (kumulativní dávka CAN < 2700 mg vs. ≥ 2700 mg). Léčba byla spojena i se snížením hladin CRP a SAA. Incidence nežádoucích příhod dosáhla 1,53/100 pacientodnů, přibývalo jich s kumulativní dávkou. K nejvýznamněji zastoupeným nežádoucím příhodám patřily především infekce a symptomy spojené s aktivitou onemocnění. Závažné nežádoucí příhody byly popsány u 25 % pacientů (11 z 44) (49).
Nejnovější údaje týkající se anti-IL-1 léčby reflektující reálnou klinickou praxi poskytla analýza dat z registru HELIOS. Hodnotila výsledky u 40 pediatrických pacientů s FMF rezistentních na kolchicin, kteří byli léčeni ANA a CAN. ANA byla použita jako 1. linie při inhibici IL-1 u všech pacientů. U 85 % (34 z 40) byla podávána nepřetržitě, u 15 % (6 z 40) pouze při relapsu (on demand). Přes polovinu (55 %, 22 z 40) nemocných však bylo nutné z důvodu intolerance nebo nízké účinnosti ANA převést na CAN (medián 9,5 měsíce od zahájení terapie). Celkově na konci sledování 6 pacientů užívalo ANA a 28 osob CAN. Anti-IL-1 léčba vedla k významnému poklesu hladin CRP a snížení frekvence vzplanutí. Nejčastějšími nežádoucími příhodami byly lokální reakce. Vyskytly se u 11 pacientů léčených ANA, což odpovídá vyššímu výskytu pozorovanému také v jiných studiích bez ohledu na indikaci. Všichni tito pacienti museli být převedeni na CAN. Další hlášené nežádoucí příhody zahrnovaly infekce, leukopenie a trombocytopenie (50).
Rilonacept
První randomizovanou, placebem kontrolovanou studii hodnotící účinnost a snášenlivost RILO u pacientů s FMF provedli Hashkes et al. V jejím rámci bylo 14 pacientů s FMF rezistentních na kolchicin nebo s intolerancí kolchicinu rozděleno do 4 skupin s různými sekvencemi podávání RILO – placebo. Celkově více než polovina pacientů reagovala na aktivní léčbu, u těchto pacientů počet atak onemocnění za měsíc významně poklesl z 3,3 na 0,77 na rozdíl od skupiny užívající placebo (2,0). Délka trvání atak však zůstala nezměněna. Rovněž nebyly zjištěny žádné rozdíly mezi základními charakteristikami respondérů a nonrespondérů. Celkem bylo hlášeno 9 závažných nežádoucích příhod, 7 z nich souviselo s aktivitou onemocnění a vyskytlo se u nonrespondérů. Zbývající dvě události představovaly infekce dýchacích cest. Většina nežádoucích příhod měla charakter lokálních reakcí (51).
MKD/HIDS
Autosomálně recesivní onemocnění označované MKD/HIDS souvisí s mutacemi v genu MVK kódujícím mevalonátkinázu a přímo spojeném s biosyntézou cholesterolu a izoprenoidů. Nástup onemocnění přichází typicky během prvního roku života a je charakterizován opakujícími se horečkami (každých 4–6 týdnů), obvykle trvajícími od 3 do 7 dnů. Klinické příznaky mohou sahat od mírnějších až po nejzávažnější projev zvaný mevalonová acidurie, která je spojena s mentálním postižením. Febrilní epizody doprovázejí například bolesti břicha, průjem, zvracení, artralgie, lymfadenopatie, kožní léze a aftózní ulcerace v ústech. Relapsy jsou často vyvolány očkováním, infekcemi, emočním stresem, traumatem nebo chirurgickým zákrokem. Patofyziologicky dochází ke zvýšené produkci kyseliny mevalonové a aktivaci malých GTPáz, což vede k nadměrné expresi IL-1. Proto může být krátkodobá blokáda IL-1 užitečná pro prevenci vzplanutí choroby (52, 53).
Anakinra
Van der Hilst et al. analyzovali odpověď na různé terapeutické modality na souboru 103 pacientů z mezinárodního registru HIDS. U pacientů léčených konvenčními terapeutiky, jako jsou methotrexát, azathioprin, sulfasalazin, takrolimus, dapson, intravenózní imunoglobuliny, cimetidin, ranitidin a kolchicin, nebyla pozorována žádná odpověď, případně se dostavila velmi omezená. Větší míra odpovědi byla zjištěna u pacientů léčených vysokými dávkami glukokortikoidů (24,4 %), nicméně na podávání ANA nebo etanercept odpovědělo až 80 % užívajících tyto látky. Při nedostatečné účinnosti ANA byla zaznamenána dobrá odpověď na etanercept a naopak (54).
Kanakinumab
Randomizovaná placebem kontrolovaná klinická studie, kterou provedli de Benedetti et al., tvořila jednu z klíčových studií hodnotících účinnost a bezpečnost CAN u širokého spektra autoinflamatorních onemocnění: 63 pacientů mělo FMF, 72 MKD a 46 TRAPS. Byla rozdělena do několika částí (1. fáze – screeningová, 2. a 3. fáze – randomizované, placebem kontrolované). V 16. týdnu (2. fáze) byl podíl pacientů vystavených CAN v dávce 150 mg každé 4 týdny, kteří dosáhli úplné odpovědi, významně větší než ve skupině s placebem (při FMF: 61 vs. 6 %, p < 0,001; při MKD: 35 vs. 6 %, p = 0,003; při TRAPS: 45 vs. 8 %, p = 0,006). Míra odpovědi u pacientů, kteří plně nereagovali na nižší dávce CAN, narůstala po zvýšení (300 mg každé 4 týdny). Eskalace dávky vedla k úplné odpovědi u 71 % pacientů s FMF, 53 % pacientů s MKD a 73 % pacientů s TRAPS. Všichni respondéři ve skupině s FMF, 82 % respondérů s MKD a 83 % respondérů s TRAPS si dále udržovali odpověď na CAN i v prodloužených intervalech až 8 týdnů (3. fáze). Nejčastější hlášené nežádoucí příhody tvořily infekce, 12 z nich bylo hodnoceno jako závažné, ale všechny vymizely bez následků. Nebyly zaznamenány žádné oportunní infekce, případy tuberkulózy ani úmrtí (39). Na základě těchto významných a přesvědčivých výsledků byl CAN schválen pro léčbu FMF, MKD a TRAPS.
ZÁVĚR
Dysregulace rodiny cytokinů IL-1 vede k rozvoji mnoha poruch, jako jsou monogenní formy AIO zahrnující syndromy periodických horeček – CAPS, FMF, TRAPS a MKD/HIDS. Významný terapeutický účinek inhibitorů IL-1 při léčbě AIO podtrhuje klíčovou roli cytokinů IL-1 v patogenezi těchto chorob. V poslední době se tak inhibitory IL-1 staly průlomovou součástí léčby AIO. V tomto přehledu shrnujeme recentně publikované dostupné důkazy o účinnosti blokády IL-1 u monogenních AIO. Zahrnuty byly především randomizované klinické studie a studie založené na analýze registrů reflektující reálnou klinickou praxi.
Terapie inhibitory IL-1 vede ke snížení aktivity onemocnění a přispívá ke snížení nebo vysazení jiné léčby (např. nesteroidních antirevmatik, glukokortikoidů nebo kolchicinu), jejíž dlouhodobé užívání je limitováno především výskytem nežádoucích příhod. Většina výše zmíněných studií prokázala, že časná blokáda IL-1 může dramaticky změnit průběh onemocnění, zlepšit kvalitu života pacientů s AIO a zabránit relapsům. Kromě dosažení klinické odpovědi bylo ve většině studií patrné snížení laboratorních zánětlivých parametrů, jako jsou CRP, FW a SAA, spolu s dalšími nadějnými markery, např. proteiny S100 (S100A12, kalprotektin), jež představují cenný nástroj pro sledování aktivity onemocnění. Inhibitory IL-1 tak patří k terapii první volby u CAPS. Při FMF, TRAPS a MKD/HIDS je tato terapie indikovaná u pacientů s nedostatečnou odpovědí na 1. linii léčby. Jednou z limitací inhibice IL-1 je omezená účinnost při léčbě sekundární amyloidózy a artikulárního postižení. Aby se zabránilo opětovnému vzplanutí nemoci a rozvoji závažných komplikací, je navíc obvykle nutné dlouhodobé podávání inhibitorů IL-1. Jejich vysazení bývá spojeno s časnými relapsy aktivity choroby. Na druhé straně inhibitory TNF alfa účinně ovlivňují artikulární projevy, ale mnohdy nedokážou dostatečně ovlivnit systémové rysy AIO.
Ukázalo se, že inhibitory IL-1 mají dobrý bezpečnostní profil jak v randomizovaných klinických studiích, tak při analýzách registrů reflektujících reálnou klinickou praxi. Nejčastějšími nežádoucími účinky byly infekce a lokální reakce v místě aplikace, zejména u pacientů léčených ANA. Tyto nežádoucí příhody často představovaly důvod k přerušení léčby nebo přechodu na léčbu CAN.
Přestože ANA i CAN jsou v současné době nejúčinnější léčbou AIO, neexistují dosud žádné prospektivní ani kontrolované studie, které by přímo porovnávaly jednotlivé modality a vedly k závěru o nadřazenosti jedné anti-IL-1 léčby nad druhou. Dalším aspektem jsou vysoké náklady na léčbu CAN, které vzbuzují obavy týkající se upřednostnění ANA v léčbě dospělých pacientů s AIO. Současné důkazy naopak naznačují, že CAN je lépe tolerován kvůli nižší frekvenci podávání léčby i nižšímu výskytu především lokálních reakcí. RILO také představuje možnost volby u vybraných onemocnění; aktuálně je však pro léčbu CAPS schválen pouze americkým Úřadem pro potraviny a léčiva (FDA). V současné době probíhá několik dalších klinických studií s hodnocením inhibitorů IL-1 a léků s odlišnými mechanismy účinku, jako jsou tadekinig alfa, dapansutril či tranilast. Kromě toho bylo prokázáno, že nové sloučeniny, jako jsou peptidy a nízkomolekulární inhibitory NLRP3, mohou sloužit jako modulátory zánětu zprostředkovaného IL-1. Řada těchto molekul je v současné době testována na úrovni preklinických studií a představuje terapeutický potenciál dalších možností zaměřených na inhibici IL-1.
Čestné prohlášení
Autoři prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Seznam použitých zkratek
AIO autoinflamatorní onemocnění
ANA anakinra
CAN kanakinumab
CAPS periodický syndrom asociovaný s kryopyrinem
CINCA chronický infantilní neurologický, kožní a kloubní syndrom
CNS centrální nervový systém
CRP C-reaktivní protein
EULAR Evropská liga proti revmatismu
FCAS familiární autoinflamatorní syndrom vyvolaný chladem
FDA americký Úřad pro potraviny a léčiva
FMF familiární středomořská horečka
FW Fahræusova-Westergrenova metoda (sedimentace erytrocytů)
GIT gastrointestinální trakt
HIDS hyper-IgD syndrom
IL interleukin
MAS makrofágy aktivující syndrom
MKD deficit mevalonátkinázy
MWS Muckleův-Wellsův syndrom
NFκB jaderný faktor kappa B
NLRP3 nucleotide-binding domain and leucine-rich repeat pyrin-3-domain
NOMID novorozenecké multisystémové zánětlivé onemocnění
NÚ nežádoucí účinek
PGA celkové hodnocení lékařem
RILO rilonacept
SAA sérový amyloid A
TNF tumor nekrotizující faktor
TRAPS periodický syndrom asociovaný s receptorem pro TNF alfa
Adresa pro korespondenci:
MUDr. Tomáš Milota, Ph.D.
Oddělení revmatologie dětí a dospělých FN Motol
V Úvalu 84, 150 06 Praha 5
e-mail: tomas.milota@fnmotol.cz
Sources
- Georgin-Lavialle S, Fayand A, Rodrigues F et al. Autoinflammatory diseases: state of the art. Presse Med 2019; 48 (1 Pt 2): e25–e48.
- Cantarini L, Vitale A, Lucherini OM et al. The labyrinth of autoinflammatory disorders: A snapshot on the activity of a third-level center in Italy. Clinical Rheumatology 2015; 34(1): 17–28.
- Cattalini M, Soliani M, Lopalco G et al. Systemic and organ involvement in monogenic autoinflammatory disorders: a global review filtered through internists' lens. Intern Emerg Med 2016; 11(6): 781–791.
- Cantarini L, Lopalco G, Selmi C et al. Autoimmunity and autoinflammation as the yin and yang of idiopathic recurrent acute pericarditis. Autoimmu Rev 2015; 14(2): 90–97.
- Obici L, Merlini G. Amyloidosis in autoinflammatory syndromes. Autoimmun Rev 2012; 12(1): 14–17.
- Feist E, Mitrovic S, Fautrel B. Mechanisms, biomarkers and targets for adult-onset Still's disease. Nat R Rheumatol 2018; 14(10): 603–618.
- Lee JJY, Schneider R. Systemic juvenile idiopathic arthritis. Pediatr Clin North Am 2018; 65(4): 691–709.
- Dinarello CA. Overview of the IL-1 family in innate inflammation and acquired immunity. Immunol Rev 2018; 281(1): 8–27.
- Dinarello CA. The IL-1 family of cytokines and receptors in rheumatic diseases. Nature reviews. Rheumatology 2019; 15(10): 612–632.
- Dinarello CA. Interleukin-1 in the pathogenesis and treatment of inflammatory diseases. Blood 2011; 117(14): 3720–32.
- Junge G, Mason J, Feist E. Adult-onset Still's disease – the evidence that anti-interleukin-1 treatment is effective and well-tolerated (a comprehensive literature review). Semin Arthritis Rheum 2017; 47(2): 295–302.
- Tarp S, Amarilyo G, Foeldvari I et al. Efficacy and safety of biological agents for systemic juvenile idiopathic arthritis: a systematic review and meta-analysis of randomized trials. Rheumatology 2016; 55(4): 669–679.
- Gattorno M, Hofer M, Federici S et al. Classification criteria for autoinflammatory recurrent fevers. Ann Rheum Dis 2019; 78(8): 1025–1032.
- Ter Haar NM, Oswald M, Jeyaratnam J et al. Recommendations for the management of autoinflammatory diseases. Ann Rheum Dis 2015; 74(9): 1636–1644.
- Owyang AM, Issafras H, Corbin J et al. XOMA 052, a potent, high-affinity monoclonal antibody for the treatment of IL-1beta-mediated diseases. mAbs 2011; 3(1): 49–60.
- Gabay C, Fautrel B, Rech J et al. Open-label, multicentre, dose-escalating phase II clinical trial on the safety and efficacy of tadekinig alfa (IL-18BP) in adult-onset Still's disease. Ann Rheum Dis 2018; 77(6): 840–7.
- Huang Y, Jiang H, Chen Y et al. Tranilast directly targets NLRP3 to treat inflammasome-driven diseases. EMBO Mol Med 2018; 10(4): e8689.
- Sanchez-Fernandez A, Skouras DB, Dinarello CA, Lopez-Vales R. OLT1177 (dapansutrile), a selective NLRP3 inflammasome inhibitor, ameliorates experimental autoimmune encephalomyelitis pathogenesis. Front Immunol 2019; 10 : 2578.
- Kluck V, Jansen T, Janssen M et al. Dapansutrile, an oral selective NLRP3 inflammasome inhibitor, for treatment of gout flares: an open-label, dose-adaptive, proof-of-concept, phase 2a trial. Lancet Rheumatol 2020; 2(5): e270–e280.
- McKee CM, Coll RC. NLRP3 inflammasome priming: A riddle wrapped in a mystery inside an enigma. J Leukoc Biol 2020; 108(3): 937–952.
- La Manna S, Di Natale C, Florio D, Marasco D. Peptides as therapeutic agents for inflammatory-related diseases. Int J Mol Sci 2018; 19(9): 2714.
- Caseley EA, Poulter JA, Rodrigues F et al. Inflammasome inhibition under physiological and pharmacological conditions. Genes Immun 2020; 21(4): 211–223.
- Gasparyan AY, Ayvazyan L, Blackmore H, Kitas GD. Writing a narrative biomedical review: Considerations for authors, peer reviewers, and editors. Rheumatol Int 2011; 31(11): 1409–1417.
- Kuemmerle-Deschner JB, Dembi Samba S, Tyrrell PN et al. Challenges in diagnosing Muckle-Wells syndrome: Identifying two distinct phenotypes. Arthritis Care Res 2014; 66(5): 765–772.
- Tran TA. Muckle-Wells syndrome: Clinical perspectives. Open Access Rheumatol 2017; 9 : 123–129.
- Finetti M, Omenetti A, Federici S et al. Chronic infantile neurological cutaneous and articular (CINCA) syndrome: A review. Orphanet Journal Rare Dis 2016; 11(1): 167.
- Cantarini L, Lucherini OM, Frediani B et al. Bridging the gap between the clinician and the patient with cryopyrin-associated periodic syndromes. Int J Immunopathol Pharmacol 2011; 24(4): 827–836.
- Goldbach-Mansky R, Dailey NJ, Canna SW et al. Neonatal-onset multisystem inflammatory disease responsive to interleukin-1beta inhibition. New Engl J Med 2006; 355(6): 581–592.
- Kuemmerle-Deschner JB, Tyrrell PN, Koetter I et al. Efficacy and safety of anakinra therapy in pediatric and adult patients with the autoinflammatory Muckle-Wells syndrome. Arthritis Rheum 2011; 63(3): 840–849.
- Kullenberg T, Lofqvist M, Leinonen M et al. Long-term safety profile of anakinra in patients with severe cryopyrin-associated periodic syndromes. Rheumatology 2016; 55(8): 1499–1506.
- Kone-Paut I, Lachmann HJ, Kuemmerle-Deschner JB et al. Sustained remission of symptoms and improved health-related quality of life in patients with cryopyrin-associated periodic syndrome treated with canakinumab: results of a double-blind placebo-controlled randomized withdrawal study. Arthritis Res Ther 2011; 13(6): R202.
- Lachmann HJ, Kone-Paut I, Kuemmerle-Deschner JB et al. Use of canakinumab in the cryopyrin-associated periodic syndrome. New Engl J Med 2009; 360(23): 2416–2425.
- Hoffman HM, Throne ML, Amar NJ et al. Efficacy and safety of rilonacept (interleukin-1 Trap) in patients with cryopyrin-associated periodic syndromes: Results from two sequential placebo-controlled studies. Arthritis Rheum 2008; 58(8): 2443–2452.
- Rigante D, Lopalco G, Vitale A et al. Key facts and hot spots on tumor necrosis factor receptor-associated periodic syndrome. Clin Rheumatol 2014; 33(9): 1197–1207.
- Magnotti F, Vitale A, Rigante D et al. The most recent advances in pathophysiology and management of tumour necrosis factor receptor-associated periodic syndrome (TRAPS): Personal experience and literature review. Clin Exp Rheumatol 2013; 31(3 Suppl. 77): 141–149.
- Cantarini L, Lopalco G, Vitale A et al. Delights and let-downs in the management of tumor necrosis factor receptor-associated periodic syndrome: The canakinumab experience in a patient with a high-penetrance T50M TNFRSF1A variant. Int J Rheum Dis 2015; 18(4): 473–475.
- Lopalco G, Rigante D, Vitale A et al. Tumor necrosis factor receptor-associated periodic syndrome managed with the couple canakinumab-alendronate. Clin Rheumatol 2015; 34(4): 807–809.
- Gattorno M, Pelagatti MA, Meini A et al. Persistent efficacy of anakinra in patients with tumor necrosis factor receptor-associated periodic syndrome. Arthritis Rheum 2008; 58(5): 1516–1520.
- de Benedetti F, Gattorno M, Anton J et al. Canakinumab for the treatment of autoinflammatory recurrent fever syndromes. New Engl J Med 2018; 378(20): 1908–1919.
- Brik R, Shinawi M, Kasinetz L, Gershoni-Baruch R. The musculoskeletal manifestations of familial Mediterranean fever in children genetically diagnosed with the disease. Arthritis Rheum 2001; 44(6): 1416–1419.
- Uthman I, Hajj-Ali RA, Arayssi T et al. Arthritis in familial Mediterranean fever. Rheumatol Int 2001; 20(4): 145–148.
- Rigante D, Lopalco G, Tarantino G et al. Non-canonical manifestations of familial Mediterranean fever: A changing paradigm. Clin Rheumatol 2015; 34(9): 1503–11.
- Alghamdi M. Familial Mediterranean fever, review of the literature. Clin Rheumatol 2017; 36(8): 1707–1713.
- El Hasbani G, Jawad A, Uthman I. Update on the management of colchicine resistant Familial Mediterranean Fever (FMF). Orphanet Journal Rare Dis 2019; 14(1): 224.
- Ozen S, Kone-Paut I, Gul A. Colchicine resistance and intolerance in familial Mediterranean fever: definition, causes, and alternative treatments. Semin Arthritis Rheum 2017; 47(1): 115–120.
- Tombetti E, Mule A, Tamanini S et al. Novel pharmacotherapies for recurrent pericarditis: Current options in 2020. Curr Cardiol Rep 2020; 22(8): 59.
- Lazaros G, Antonopoulos AS, Antonatou K et al. Hydroxychloroquine for colchicine-resistant glucocorticoid-dependent idiopathic recurrent pericarditis: A pilot observational prospective study. Int J Cardiol 2020; 311 : 77–82.
- Ben-Zvi I, Kukuy O, Giat E et al. Anakinra for colchicine-resistant familial Mediterranean fever: A randomized, double-blind, placebo-controlled trial. Arthritis Rheumatol 2017; 69(4): 854–862.
- Ozen S, Ben-Cherit E, Foeldvari I et al. Long-term efficacy and safety of canakinumab in patients with colchicine-resistant familial Mediterranean fever: results from the randomised phase III CLUSTER trial. Ann Rheum Dis 2020; 79(10): 1362–1369.
- Sag E, Akal F, Atalay E et al. Anti-IL1 treatment in colchicine-resistant paediatric FMF patients: real life data from the HELIOS registry. Rheumatology 2020; 59(11): 3324–3329.
- Hashkes PJ, Spalding SJ, Giannini EH et al. Rilonacept for colchicine-resistant or -intolerant familial Mediterranean fever: a randomized trial. Ann Inter Med 2012; 157(8): 533–541.
- Houten SM, Kuis W, Duran M et al. Mutations in MVK, encoding mevalonate kinase, cause hyperimmunoglobulinaemia D and periodic fever syndrome. Nature Genet 1999; 22(2): 175–177.
- Haar NM ter, Jeyaratnam J, Lachmann HJ et al. The phenotype and genotype of mevalonate kinase deficiency: a series of 114 cases from the Eurofever registry. Arthritis Rheumatol 2016; 68(11): 2795–2805.
- van der Hilst JC, Bodar EJ, Barron KS et al. Long-term follow-up, clinical features, and quality of life in a series of 103 patients with hyperimmunoglobulinemia D syndrome. Medicine 2008; 87(6): 301–310.
- Malcová H, Milota T, Střížová Z et al. Interleukin-1 blockade in polygenic autoinflammatory disorders: Where are we now? Front Pharmacol 2020; 11 : 619273.
- Malcová H, Střížová Z, Milota T et al. IL-1 Inhibitors in the treatment of monogenic periodic fever syndromes: from the past to the future perspectives. Front Immunol 2020; 11 : 619257.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

2022 Issue 1-
All articles in this issue
- Současné možnosti léčby monogenních syndromů periodických horeček – úloha inhibitorů interleukinu 1
- Fyziologie stárnutí
- Přispívají kliničtí farmaceuti k minimalizaci pádů pacientů ve zdravotnických zařízeních i v Česku? 10leté sledování a zkušenosti z ÚVN Praha
- Multioborová spolupráce při záchytu prvního českého případu varianty SARS-CoV-2 omikron
- Domácí transfuze v kontextu poskytování paliativní péče v Česku
- Doporučení pro léčbu závislosti na tabáku
- 17. Šonkův den
- Ohlédnutí za konferencí IZS Karlovy Vary 2021
- Odešel nestor české geriatrie docent Jiří Neuwirth
- PŘEDNÁŠKOVÉ VEČERY SPOLKU ČESKÝCH LÉKAŘŮ V PRAZE (DUBEN – ČERVEN 2022)
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Fyziologie stárnutí
- Doporučení pro léčbu závislosti na tabáku
- Přispívají kliničtí farmaceuti k minimalizaci pádů pacientů ve zdravotnických zařízeních i v Česku? 10leté sledování a zkušenosti z ÚVN Praha
- Multioborová spolupráce při záchytu prvního českého případu varianty SARS-CoV-2 omikron
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

