-
Medical journals
- Career
Diagnostika neplodnosti mužů v 21. století – tradiční pojetí, či moderní přístup?
Authors: Jan Novák 1,2; Viktor Vik 2,3; Zuzana Krátká 4
Authors‘ workplace: Urologická klinika 1. LF UK a VFN v Praze 1; Oddělení urologie a andrologie, GENNET, s. r. o., Praha 2; Klinika transplantační chirurgie IKEM, Praha 3; Oddělení alergologie a klinické imunologie, GENNET, s. r. o., Praha 4
Published in: Čas. Lék. čes. 2021; 160: 20-26
Category: Review Article
Overview
S neplodností, tedy s neschopností otěhotnět v průběhu jednoho roku pravidelného nechráněného pohlavního styku, se potýká cca 15 % párů ve vyspělých zemích. Jelikož se jedná o diagnózu konkrétního páru, a nikoli jedince, je namístě přistupovat k páru jako celku, ne odděleně k ženě či muži. Pro posouzení fertilního potenciálu muže je za zlatý standard již několik desetiletí považován spermiogram, tedy nativní vyšetření ejakulátu. Spermiogram je ve své základní podobě pouze morfologickým, nikoli funkčním vyšetřením, proto nemusí vždy spolehlivě informovat o skutečném fertilním potenciálu daného muže. Z tohoto důvodu jsou do praxe zaváděny nové metody pro zlepšení diagnostiky a následné terapie. Uvádíme možnosti vyšetření ejakulátu průtokovou cytometrií a vliv asymptomatických urogenitálních infekcí na plodnost.
Klíčová slova:
mužská neplodnost – diagnostika – spermiogram – průtoková cytometrie – antispermatické protilátky – apoptóza – fragmentace spermatické DNA – asymptomatické urogenitální infekce
ÚVOD
Světová zdravotnická organizace definuje neplodnost (infertilitu) jako stav, kdy pár není schopen dosáhnout koncepce v průběhu jednoho roku při pravidelném nechráněném pohlavním styku (1).
Pro úplnost doplňme, že v českém písemnictví se tradičně vedle infertility rozlišuje ještě pojem sterilita, přičemž infertilita znamená neschopnost donosit vitální plod, kdežto sterilita neschopnost otěhotnět. Byla-li žena již v minulosti těhotná, bez ohledu na to, zda porodila vitální plod či potratila, rozdělujeme sterilitu a infertilitu na primární a sekundární.
V porovnání s ostatními diagnózami je neplodnost unikátní tím, že se vždy jedná o diagnózu páru, tedy konkrétního muže a konkrétní ženy. Důvodem, proč je nutné posuzovat celý pár jako celek, je skutečnost, že dobrý fertilní status jednoho z partnerů může do určité míry kompenzovat subnormální hodnoty parametrů druhého z partnerů, takže se neplodnost u takového páru nemusí vůbec projevit. Mezinárodní klasifikace nemocí (MKN) nicméně navzdory výše uvedeným skutečnostem vymezuje poněkud nepřesně ženskou (N97.0, N97.1, N97.2, N97.4, N97.8 a N97.9 podle příčiny) a mužskou (N46) neplodnost (2).
Hodnocení efektu léčby neplodnosti je – na rozdíl od onkologických diagnóz, jejichž léčba se hodnotí pomocí jasně definovaných funkčních či morfologických outcome parametrů, jako jsou doba do symptomatické či radiologické progrese, 5leté, 10leté či celkové přežití atd. – komplikováno následujícími skutečnostmi:
- Základním vyšetřením k posouzení mužského fertilního potenciálu je spermiogram, jehož parametry v čase mohou značně kolísat, a to i u zdravých mužů – nemusí být tedy zřejmé, zda nastalé změny způsobila námi posuzovaná intervence, nebo se jedná o přirozenou fluktuaci hodnot.
- Až u 44 % mužů není zjištěna příčina snížené kvality ejakulátu (idiopatická infertilita) – lze tedy předpokládat vliv dosud nepoznaných faktorů ovlivňujících mužský fertilní potenciál.
- Výsledek jakýchkoli intervencí lze posuzovat po dozrání nové generace spermií, tedy nejdříve za 74 dní, což je jejich generační doba. Lze přitom předpokládat, že během tohoto časového úseku se mohly dostavit další, obtížně definovatelné faktory.
- Parametry spermiogramu nemusejí vždy korelovat s pravděpodobností, že se ženě podaří otěhotnět. Cílem léčby neplodnosti tedy v konečném důsledku není zlepšení parametrů spermiogramu, ale úspěšné otěhotnění partnerky.
- Nehomogenita výsledných dat může být zaviněna nedůsledným rozlišováním preklinické gravidity verifikované na základě pozitivního těhotenského testu (tzv. biochemická gravidita – až 30 % žen spontánně potratí), klinické gravidity na základě ultrasonograficky verifikovaného gestačního váčku (až 25 % potratí do 12. týdne gravidity) a konečně porodem vitálního plodu (2).
- Velmi zásadním a interindividuálně značně proměnlivým faktorem je charakteristika partnerky – její věk, gynekologický nález a kvalita jejích oocytů.
- Jelikož pohlavní styk je ve vztahu ke graviditě conditio sine qua non, nesmíme opomínat ani tento významný faktor, především ve smyslu frekvence.
Výše uvedené skutečnosti komplikují provedení randomizovaných dvojitě zaslepených kontrolních studií, proto jsou množství a síla důkazů (level of evidence) uvedených v doporučených postupech Evropské urologické společnosti (EAU guidelines) (1) menší v porovnání např. s výše zmíněnými onkologickými diagnózami.
S neplodností se potýká až 15 % párů ve vyspělých zemích. Každý osmý pár má problém s početím prvního potomka, ale s početím druhého a dalšího potomka má problém již každý šestý pár. 3 % žen zůstávají nedobrovolně bezdětnými (1).
Mezi prediktivní faktory mužského faktoru neplodnosti páru patří:
- délka trvání neplodnosti,
- typ neplodnosti, ve smyslu primární × sekundární,
- hodnoty spermiogramu,
- věk partnerky.
Posledně jmenovaná okolnost, věk partnerky, je tím nejdůležitějším prediktivním faktorem neplodnosti páru. Dokládá to fyziologický pokles implantation rate, k jejímuž progresivnímu snížení dochází po 35. roce věku ženy (2). Fertilní potenciál 35leté ženy je snížený na polovinu, 38leté na čtvrtinu a 40leté přibližně na 5 procent oproti ženě 25leté (1).
Současný demografický trend, kdy páry z různých důvodů odkládají svůj reprodukční záměr, dokládají data Ústavu zdravotnických informací a statistiky ČR (ÚZIS), podle nichž podíl rodiček starších 35 let stoupl za posledních 25 let ze 4 na 20 % (3). Přibližně 3 % dětí se rodí po užití metody IVF (fertilizace in vitro). Přesná data, kolik dětí se rodí po jakékoli asistované reprodukci, tedy včetně použití méně invazivních metod, například intrauterinní inseminace (IUI) či stimulace ovulace klomifen-citrátem, nejsou k dispozici, neboť metody mohou provádět i ambulantní gynekologové, kteří nemají povinnost data hlásit.
Je uváděno, že mužský (tzv. andrologický) faktor, buď sám či v kombinaci s jinými, se vyskytuje až u poloviny neplodných párů (1). Z tohoto důvodu je role urologa-androloga v péči o takové páry nezastupitelná a jeho úkol spočívá v diagnostice, případné terapii a následné dispenzarizaci subfertilních mužů s cílem snížit náročnost metod asistované reprodukce. Tomu odpovídá i současný trend reprodukční medicíny. Na muže již není nahlíženo jako na pouhý zdroj spermií, jak tomu bylo především po příchodu techniky ICSI (intracytoplasmic sperm injection), kdy ke koncepci nově stačila, obrazně řečeno, jediná spermie.
V současné době je péče o neplodné páry jako celek soustředěna do center asistované reprodukce, kde vzájemně spolupracují reprodukční gynekologové, andrologové, embryologové, genetici, imunologové, případně další odborníci. Činnost jednotlivých pracovišť a výsledky cyklů asistované reprodukce jsou monitorovány Národním registrem asistované reprodukce (NRAR) (2).
SPERMIOGRAM
Základním andrologickým vyšetřením je nativní mikroskopické vyšetření ejakulátu získaného nejčastěji masturbací po 2–7denní sexuální abstinenci – tzv. spermiogram – provedené podle 5. vydání manuálu WHO pro vyšetření a zpracování lidského spermatu z roku 2010 (4). I přes vědecký pokrok je při vyšetření spermiogramu za zlatý standard stále považován manuální odečet nativního preparátu ve světelném mikroskopu, přestože již byl vytvořen počítačový systém zvaný CASA (computer-aided sperm analysis), jehož nevýhodou je vysoká pořizovací cena (5).
Při vyšetření, které je prováděno 30 minut po odběru materiálu, jsou hodnoceny nejprve fyzikální vlastnosti ejakulátu ve smyslu jeho vzhledu, objemu, pH, viskozity a doby do zkapalnění, a dále jsou pomocí kalibrované (nejčastěji Maklerovy) komůrky mikroskopicky stanoveny koncentrace, potažmo také celkový počet po vynásobení objemem ejakulátu, dále motilita, vitalita a zastoupení morfologicky abnormálních spermií a tzv. kulatých buněk (tab. 1).
Table 1. Fyziologické hodnoty spermiogramu podle WHO (4) 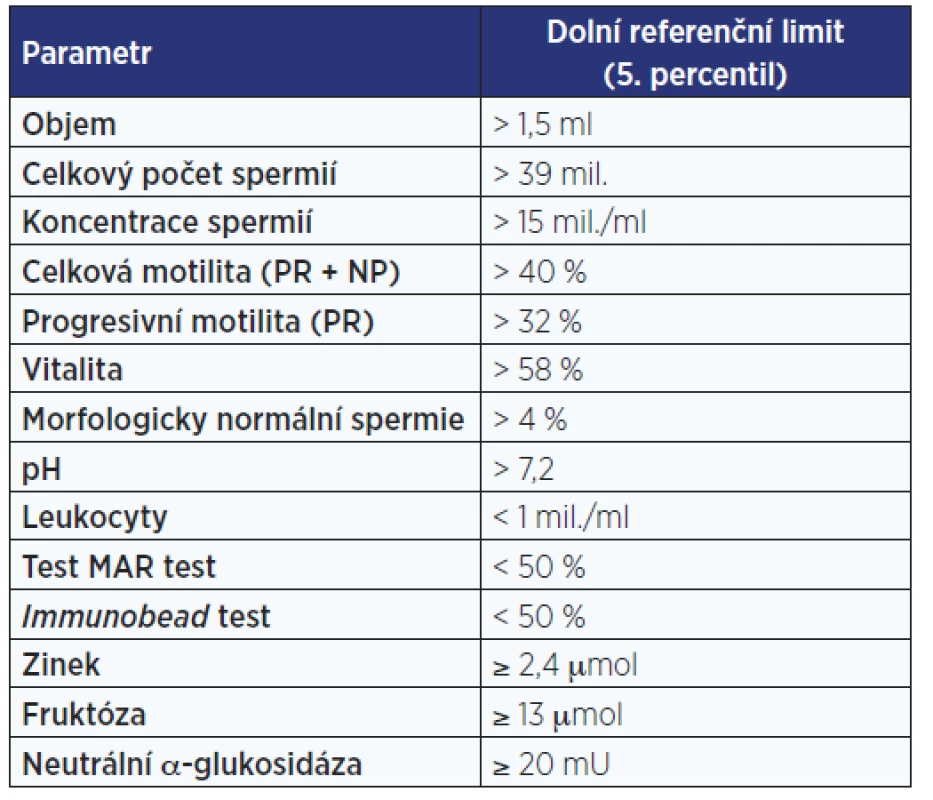
K popisu spermiogramu se používá semikvantitativní hodnocení pomocí řeckých předpon oligo- (< 15 mil. spermií v 1 ml), asteno- (< 32 % progresivně motilních spermií) a terato- (< 4 % morfologicky normálních spermií), vzájemně kombinovatelných, za nimiž následuje koncovka -zoospermia. Jedná se o relikt z 17. století, kdy nizozemský obchodník s textiliemi Antoni van Leeuwenhoek, považovaný za vynálezce mikroskopu, pozoroval svým jednočočkovým mikroskopem ejakulát a spermie mylně považoval za živočichy žijící v seminální plasmě – původně tedy spermatozoa (5).
Je nutné důsledně terminologicky rozlišovat stavy, jejichž názvy mají koncovku -zoospermia (týká se spermií) a pouze -spermia (týká se ejakulátu), aby nedocházelo k záměně pojmů azoospermia označující absenci spermií v ejakulátu a aspermia označující absenci ejakulátu jako takového. Dalšími pojmy charakterizujícími nález v ejakulátu jsou kryptozoospermia (přítomnost spermií až po centrifugaci ejakulátu) a nekrozoospermia (přítomnost pouze neživých spermií). Přítomnost erytrocytů v ejakulátu je označována jako hem(at)ospermia. Černé zabarvení ejakulátu – melanospermia – je anekdoticky popisováno u melanomu hrdla močového měchýře (6). Jsou-li v ejakulátu zjištěny leukocyty, hovoříme o leuko- či pyospermii – je nutné mít na paměti, že mikroskopicky jsou leukocyty obtížně odlišitelné od spermatogonií (společně popisované jako tzv. kulaté buňky). Pro jejich přesné určení je nutné využít buď barvení při mikroskopické analýze (např. průkaz myeloperoxidázy, enzymu vyskytujícího se v leukocytech), nebo označení specifickými markery (např. detekce leukocytů označených monoklonální protilátkou anti-CD45) (5).
Referenční hodnoty spermiogramu byly získávány a aktualizovány (naposledy v roce 2010) na základě dat z populační studie čítající přibližně 1500 mužů různých etnik, kteří se během posledního roku v době jejího trvání stali otci. Jako limit byl pak určen 5. dolní percentil změřených hodnot. Je tedy zřejmé, že referenční meze jsou pouze arbitrárně určené hodnoty a že i subnormální hodnoty některého z parametrů nevylučují možnost spontánní koncepce, neboť je nutné brát v potaz i fertilní potenciál partnerky a posuzovat pár jako celek, jak již bylo uvedeno. Naopak hodnoty spermiogramu, které splňují všechny limity (normozoospermia), automaticky neznamenají, že muž je opravdu fertilní, protože problémem může být patologie spermií, kterou klasický spermiogram nezachytí (např. kvalita spermatické DNA). Jelikož hodnoty spermiogramu mohou značně kolísat, a to i u zdravých mužů, je nutné vyšetření s časovým odstupem minimálně jednou opakovat k přesnějšímu posouzení skutečného fertilního potenciálu muže.
HEMATOTESTIKULÁRNÍ BARIÉRA A ANTISPERMATICKÉ PROTILÁTKY
Spermiogeneze (vývoj spermií) probíhá v semenotvorných kanálcích varlete vystlaných Sertoliho buňkami. Po obvodu kanálků, při bázi Sertoliho buněk, jsou uložené spermatogonie, které se při své diferenciaci posouvají mezi záhyby Sertoliho buněk směrem do lumenu kanálků. V procesu spermiogeneze dochází k meiotickému dělení, během nějž vznikají buňky geneticky odlišné od somatických buněk. Aby tyto buňky s odlišnými HLA antigeny I. třídy na svém povrchu nebyly nekompromisně eliminovány cytotoxickými T lymfocyty, jsou Sertoliho buňky při svých bázích po obvodu spojeny těsnými mezibuněčnými kontakty typu tight junctions (zonula occludens). Tato tzv. hematotestikulární bariéra vytváří uvnitř lumenu semenotvorných kanálků imunologicky privilegované prostředí, které je pro imunokompetentní buňky nedostupné. Narušením hematotestikulární bariéry může dojít ke kontaktu imunokompetentních buněk se spermiemi a k následnému rozvoji imunitní reakce včetně tvorby antispermatických protilátek tříd IgG a IgA (7).
Jako možné příčiny narušení hematotestikulární bariéry, potažmo tvorby antispermatických protilátek bývají tradičně uváděny chronická obstrukce vývodných cest pohlavních, infekce, varikokéla, kryptorchismus, dále úraz, operace, nádor či torze varlete. Jasná příčinná souvislost však byla prokázána pouze u chronické obstrukce vývodných pohlavních cest, k níž může dojít v důsledku prodělaných infekcí způsobených bakteriemi Neisseria gonorrhoeae či Chlamydia trachomatis. Nejčastěji však jsou protilátky prokazovány po vazektomii (8), což vznáší otázku, do jaké míry mají smysl rekonstrukční výkony typu vazo-vazoanastomóza (vasectomy reversal), když i navzdory obnovené kontinuitě chámovodu bude z důvodu výskytu antispermatických protilátek v ejakulátu (až 70‒100 %) nutné využít metod asistované reprodukce.
Antispermatické protilátky významně snižují fertilní potenciál muže dvěma mechanismy. Prvním je aglutinace (shlukování) spermií znemožňující jejich motilitu, druhým navázání protilátek na povrchové molekuly hlavičky spermie, které vede k narušení interakce mezi spermií a zona pellucida oocytu. Antispermatické protilátky navíc po navázání na povrch spermií iniciují efektorové mechanismy vrozené i adaptivní imunity, tedy opsonizaci, aktivaci komplementu klasickou cestou a cytotoxickou reakci závislou na protilátkách (ADCC – antibody-dependent cellular cytotoxicity) zprostředkovanou NK buňkami (9).
V rámci léčby neplodnosti způsobené antispermatickými protilátkami je za zlatý standard považována IVF + ICSI. Někteří autoři sice popisují snížení titru protilátek po kortikoterapii, ale data nejsou přesvědčivá (8).
K navázání protilátek na spermie většinou dochází v nadvarleti, ale antispermatické protilátky mohou být produkovány také plazmatickými buňkami ženy, mohou se tedy vyskytovat v ženském genitálním traktu, konkrétně v cervikálním hlenu. Přítomnost antispermatických protilátek v cervikálním hlenu se tradičně prokazuje pomocí postkoitálního testu, kdy je mikroskopicky vyšetřen hlen následující den po nechráněném pohlavním styku v periovulačním období (jindy během cyklu je hlen pro spermie prakticky neprostupný), přičemž nález progresivně motilních spermií nesvědčí pro přítomnost cervikálního faktoru neplodnosti páru (4).
Přítomnost antispermatických protilátek je prokazována přímými a nepřímými testy. Přímé zjišťují přítomnost protilátek na spermiích, nepřímé informují o protilátkách v tekutině, tedy v seminální plasmě, krvi či cervikálním hlenu. Nejdostupnějším přímým testem je tzv. MAR (mixed antiglobulin reaction) test, kdy se k nativnímu ejakulátu přidají latexové partikule (kuličky) pokryté protilátkami IgG nebo IgA. Jsou-li na spermiích navázány protilátky, dojde po přidání protilátek anti-IgG či anti-IgA k vytvoření shluků spermií s partikulemi. Další možností detekce antispermatických protilátek je IB (immunobead) test, při němž se buď k promytým spermiím (přímý IB test), nebo k vyšetřované tekutině smíchané se spermiemi dárce (nepřímý IB test) přidají partikule s navázanými protilátkami anti-IgG či anti-IgA a stejně jako u MAR testu se zjišťuje shlukování spermií s partikulemi (4).
Vyšetření koncentrace zinku, fruktózy a α-glukosidázy v ejakulátu slouží coby specifické markery jednotlivých orgánů (prostata, semenné váčky a nadvarlata – v uvedeném pořadí) podílejících se na tvorbě ejakulátu a informují o jejich sekreční kapacitě (4). V praxi se však využívají jen raritně.
CYTOMETRICKÁ ANALÝZA KVALITY SPERMIÍ
Poslední, 5. vydání manuálu WHO pro vyšetření a zpracování lidského spermatu z roku 2010 (4) čítá bezmála 300 stran a popisuje celý proces do nejmenšího detailu. Spermiogram ve své klasické podobě je však pouze morfologickým, nikoli funkčním vyšetřením, nemusí tedy vždy spolehlivě informovat o fertilním potenciálu konkrétního muže – až 15 % normozoospermiků má sníženou fertilitu projevující se menší kvalitou embryí (10). Ve snaze zpřesnit diagnostiku, respektive následnou léčbu se proto do klinické praxe postupně zařazují metody převzaté z výzkumných laboratoří, které lépe informují o důležitých funkčních vlastnostech spermií. Slibně se v tomto ohledu jeví cytometrická vyšetření apoptózy spermií, integrity akrosomového váčku a fragmentace DNA ve spermiích (11).
Apoptóza spermií
Přirozeným jevem, jímž končí svůj životní cyklus většiny somatických buněk a také spermií, je apoptóza. Vyvolávajícími faktory mohou být kromě prostého stáří nejrůznější typy stresů, od vysoké teploty přes infekce po volné kyslíkové radikály (ROS – reactive oxygen species). Spermie, u nichž je tento ireverzibilní proces teprve zahájen (časně apoptotické spermie), se morfologicky neodlišují od plně vitálních, což může způsobovat problémy při jejich použití v rámci oplození oocytu in vitro při ICSI.
Markerem apoptózy je fosfatidylserin, který se po zahájení procesu přesune z vnitřního povrchu membrány na vnější, kde je také cytometricky detekovatelný po navázání proteinu annexinu V-FITC (fluorescein isothiocyanate) (obr. 1). Mrtvé spermie jsou při této metodě značeny propidium jodidem, látkou volně prostupující jejich membránou. Po změření ejakulátu tedy lze zjistit procentuální zastoupení živých (negativně značené buňky), časně apoptotických (buňky značené pouze annexinem V-FITC) a pozdně apoptotických či mrtvých spermií (buňky značené propidium jodidem, případně i annexinem V-FITC) (11).
Image 1. Stanovení apoptózy spermií pomocí průtokové cytometrie 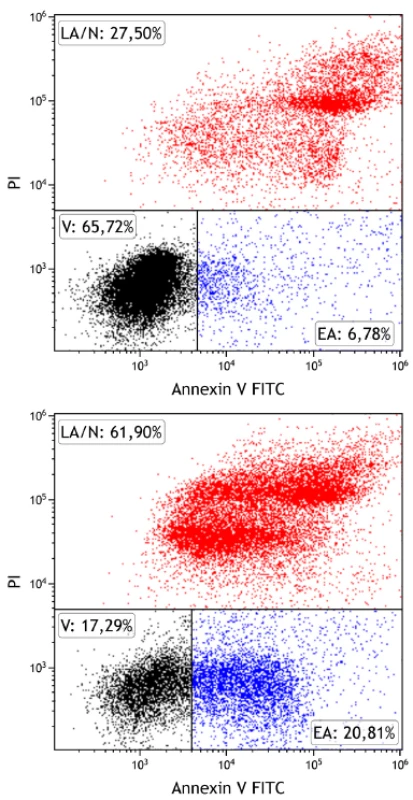
Detekce živých (V – viable, označeno černě), časně apoptotických (EA – early apoptotic, označeno modře) a pozdně apoptotických/ nekrotických (LA/N – late apoptotic/necrotic, označeno červeně) spermií ve 2 vzorcích ejakulátu u normozoospermie (vlevo) s vysokým zastoupením živých spermií a astenoteratozoospermie (vpravo) s vysokým zastoupením apoptotických spermií. Ke značení byly použity annexin V-FITC (osa x), který se váže na apoptotické buňky, a propidium iodid (osa y), který proniká do mrtvých buněk.
Fyziologická norma: > 50 % živých spermií, < 20 % časně apoptotických spermií, < 40 % pozdně apoptotických/nekrotických spermií.Jednou z charakteristických vlastností apoptózy obecně je fragmentace (štěpení) DNA, k níž dochází působením enzymu, jenž se nazývá kaspázou aktivovaná DNáza (CAD – caspase-activated DNase). Ke stejnému procesu dochází i v případě spermií, přičemž jejichž kvalita s rostoucí fragmentací DNA klesá. Oocyt sice disponuje určitými mechanismy, které dokážou zmíněné defekty DNA reparovat, avšak tato schopnost s věkem postupně klesá (12). Není-li DNA kvalitní (a celistvá), dochází k zastavení vývoje embrya či spontánnímu potratu (13, 14). Stanovení fragmentace DNA spermií se tedy považuje za nadějný marker plodnosti mužů (15).
Test integrity akrosomu
Podmínkou správného průběhu interakce mezi spermií a zona pellucida, a tedy v konečném důsledku fertilizace, je mimo jiné přítomnost funkčních povrchových receptorů a integrita akrosomového váčku zajišťující jeho kompletní enzymovou výbavu. V ejakulátu proto musí být dostatek spermií s kvalitním akrosomem. Při testu integrity akrosomu se používá protilátka proti intraakrosomovému proteinu. Je-li membrána akrosomu permeabilizovaná, pak protilátky prostoupí do akrosomu a takové spermie označí. Integrita akrosomu se stanovuje těsně po ejakulaci. Později se vlivem aktivace a kapacitace spermií akrosomová membrána přirozeně rozvolňuje, k čemuž má fyziologicky docházet až těsně před interakcí spermie s oocytem (11).
Fragmentace DNA v doporučeních EAU
Z hlediska dat je z výše uvedených „nových“ vyšetření kvality spermií nejpodloženější stanovení fragmentace DNA, které je v aktuálním vydání doporučených postupů Evropské urologické společnosti (EAU guidelines) zastoupeno větší měrou (1):
- Nově je doporučováno stanovení fragmentace spermatické DNA u párů s opakovanými potraty po spontánní koncepci či po metodách asistované reprodukce a u mužů s jinak nevysvětlitelnou neplodností (strength rating: strong) (13).
- Dále se rozšířila indikace operačního řešení varikokély právě o skupinu mužů s vyšší fragmentací spermatické DNA, mají-li normální hodnoty konvenčního spermiogramu (normozoospermie) a není-li známa jiná příčina neplodnosti (level of evidence: 2a) (16, 17). Dosud představovaly indikace u dospělých mužů pouze symptomatická varikokéla či abnormální hodnoty konvenčního spermiogramu, nebyla-li zřejmá jiná příčina než klinická varikokéla a měla-li partnerka dostatečnou ovariální rezervu.
- A konečně, párům po opakovaně neúspěšných cyklech metod asistované reprodukce na podkladě vyšší fragmentace spermatické DNA lze nabídnout chirurgický výkon k získání spermií přímo z varlete (TESE – testicular sperm extraction) následovaný ICSI s použitím čerstvých spermií (tedy nikoli po kryoprezervaci ejakulátu), což vychází z předpokladu, že spermie ve varleti mohou mít nižší fragmentaci DNA než spermie přítomné v ejakulátu (18).
Obecně přijímanou fyziologickou hodnotou je méně než 20 % spermií s fragmentovanou DNA při použití metody TUNEL (terminal deoxynucleotidyl transferase dUTP nick end labeling) (11). Dalšími modalitami používanými ke stanovení fragmentace spermatické DNA jsou COMET (alkaline comet test), SCSA (sperm chromatin structure assay) a SCD (sperm chromatic dispersion test). TUNEL a COMET přitom detekují přímo samotné zlomy DNA a jsou označovány jako tzv. přímé metody, zatímco SCSA a SCD detekují nepřímé známky fragmentované DNA, a jsou tedy označovány za metody nepřímé. Z dosud publikovaných studií, v jejichž většině byla používána SCSA, vyplynulo, že hodnoty DFI (DNA fragmentation index) > 30 % snižují pravděpodobnost spontánní koncepce či koncepce po IUI a že hodnoty DFI > 50 % zhoršují výsledky IVF (1). V případě metody TUNEL, která se jeví přesnější než SCSA, byl jako hranice stanoven výskyt 20 % spermií s fragmentací DNA (11). Je tedy zřejmé, že referenční hodnoty závisejí na použité metodě, na což je třeba pamatovat při hodnocení výsledků.
V případě apoptózy spermií nebyly dosud publikovány referenční hodnoty. Manuál WHO pro vyšetření a zpracování lidského spermatu z roku 2010 sice uvádí více než 58 % vitálních spermií, ale jedná se o hodnotu získanou na základě barvení spermií eosinem, jenž sice obarví mrtvé spermie, ale již neodliší vitální spermie od časně apoptotických (4). V naší praxi v případě cytometrického vyšetření užíváme hodnotu >50 % plně vitálních (tedy bez časně apoptotických) spermií, kterou jsme stanovili arbitrárně po odečtení 8 %, což je námi změřené průměrné zastoupení časně apoptotických spermií v souboru zdravých dárců spermií, od 58 % vitálních spermií uváděných v manuálu WHO (11). Vzhledem k tomu, že cytometrické vyšetření apoptózy spermií je rychlé a levné, používáme jej coby screeningové vyšetření u mužů společně se spermiogramem, a až v případě vysokého výskytu apoptotických spermií doplňujeme cíleně cytometrické vyšetření fragmentace spermatické DNA metodou TUNEL, které je výrazně laboratorně náročnější, a není tudíž vhodné jako screeningová metoda.
Je-li zjištěna vysoká fragmentace spermatické DNA, je vhodné pátrat po možných reverzibilních příčinách, kterými vedle výše uvedené klinické varikokély mohou být hormonální anomálie, profesní či environmentální expozice endokrinním disruptorům, nevhodný životní styl, ve smyslu především abúzu nejrůznějších návykových látek, či urogenitální infekce (19). Příčinou vysoké fragmentace však bývají i různé genetické mutace či vysoký věk. Mnohdy však ani po podrobném vyšetření není jasná příčina vysoké fragmentace spermatické DNA zjištěna. U mužů zahajujeme empirickou kúru antioxidanty (inositol, kys. listová, koenzym Q10, vitamin C, vitaminy skupiny B) (20) ve snaze snížit negativní vliv ROS, jelikož se předpokládá jejich etiopatogenetická souvislost se zvýšenou fragmentací spermatické DNA (21).
UROGENITÁLNÍ INFEKCE
V souvislosti s vlivem urogenitálních infekcí (MAGI – male accessory gland infection, striktně vzato je však označení zavádějící, protože např. epididymis není žlázou v pravém slova smyslu) na fertilní potenciál muže jsou v rámci odborné veřejnosti patrné dva zcela odlišné přístupy.
Doporučené postupy EAU zaujímají rezervovaný až skeptický postoj k antibiotické terapii a zahrnují předpoklad, že přítomnost infekce nesnižuje schopnost spontánní koncepce (level of evidence: 3), že antibiotická terapie vede pouze k eradikaci patogenu, přičemž nedochází k normalizaci zánětlivého prostředí (level of evidence: 2a), a konečně že terapie může zlepšit parametry spermiogramu, ale nevede ke zvýšení pravděpodobnosti spontánní koncepce (level of evidence: 2a). Ve světle nepříliš přesvědčivé síly důkazů nabízejí guidelines EAU jediný postup, a sice doporučit pacientům s epididymitidou také vyšetření sexuálního partnera, protože pravděpodobným patogenem je buď Neisseria gonorrhoeae, či Chlamydia trachomatis (1).
Druhý přístup naopak přisuzuje asymptomatickým infekcím detrimentální vliv na mužskou fertilitu (22). Jedná se o infekce způsobené bakterií Chlamydia trachomatis a skupinou bakterií patřících do třídy Mollicutes (Ureaplasma urealyticum, Mycoplasma hominis a Mycoplasma genitalium). Postinfekční změny způsobené bakterií Chlamydia trachomatis jsou dobře dokumentované u obou pohlaví: u žen je tato bakterie příčinou cervicitidy, která se může šířit ascendentně a působit endometritidu, salpingitidu či hluboký pánevní zánět s následnými srůsty (23), u mužů působí uretritidu s možností ascendentního šíření se vznikem vezikulitidy, prostatitidy a epididymitidy s následným jizvením postižených orgánů.
V případě ureaplazmat a mykoplazmat se očekává obdobný efekt, avšak méně vyjádřený. Na rozdíl od chlamydií, jejichž prevalence v sexuálně aktivní evropské populaci je v řádu jednotek procent (22), u ureaplazmat je uváděna prevalence v řádu desítek procent (24). Někteří autoři proto tedy považují genitální ureaplazmata za přirozenou mikroflóru mužského i ženského genitálu (ve smyslu „co je časté, je normální“), ačkoli zároveň uvádějí, že bakterie je příčinou nongonoroické nonchlamydiové uretritidy u muže a že u žen bývá často zjištěna při předčasném odtoku plodové vody (25). Domníváme se, že v případě páru, který nemá problém s fertilitou ani projevy urogenitálního onemocnění, není třeba po infekcích pátrat, potažmo je léčit. Mezi mikroflórou a organismem existuje soulad a imunitní systém mikroflóru toleruje. Pokud ale léčíme neplodný pár, pak narušená rovnováha mezi mikroflórou a imunitním systémem a rozvíjející se zánět může být jednou z příčin neplodnosti a diagnostika patogenu s následnou léčbou je vhodná.
Bakterie jsou typicky diagnostikovány z moči pomocí kombinace kultivačních a molekulárně genetických metod (PCR). Molekulárně genetické metody mají obecně vyšší senzitivitu, avšak neposkytují informaci o citlivosti na antibiotika. Ačkoli u genitálních mykoplazmat dominuje sexuální přenos, je bakterií kolonizováno až 10 % sexuálně neaktivních jedinců a 5 % dětí. Je-li bakterie zjištěna u muže či u ženy, automaticky simultánně léčíme i druhého z páru bez ohledu na jeho mikrobiologický výsledek. Lékem volby v takovém případě je doxycyklin (nejčastěji doporučovaná dávka je 100 mg 2× denně po 10 dní). Při kontraindikaci tetracyklinů je možné léčit azithromycinem či fluorochinolony, ale u těch je až 80% rezistence (pozn.: urology oblíbené aminopeniciliny coby zástupci betalaktamů blokujících syntézu bakteriální stěny nemohou na intracelulární bakterii bez bakteriální stěny mít žádný efekt).
Předpokládá se, že kvalitu spermií nezhoršuje pouze přítomnost samotné bakterie, ale také probíhající zánětlivá imunitní reakce, v jejímž důsledku vznikají ROS. Mnohdy nacházíme leukospermii, která napovídá možný zánět, avšak při negativním mikrobiologickém vyšetření. Schuppe et al. proto v takovém případě doporučují doplnit ve vyšetřovacím algoritmu zjištění hodnot prozánětlivých cytokinů (např. TNF-α, IL-6) či chemotaktických faktorů (např. IL-8) v seminální tekutině a v případě průkazu probíhající zánětlivé reakce (samotná bakterie tedy již nemusí být přítomná) zahajuje terapii nesteroidními antiflogistiky (22).
ZÁVĚR
Cílem článku bylo seznámit čtenáře s aktuálními trendy v diagnostice u muže z neplodného páru a demonstrovat, že hodnocení fertilního potenciálu pouze na základě spermiogramu může být nepřesné a přináší řadu úskalí. Jako nadějné se v tomto ohledu jeví cytometrické metody, a sice vyšetření fragmentace spermatické DNA a apoptózy spermií. Tyto metody více odrážejí funkční vlastnosti spermií a mohou zlepšit diagnostiku a následnou léčbu neplodných párů. S ohledem na heterogenitu příčin mužské neplodnosti je však nutné mít na paměti, že vedle zmíněných vyšetření ejakulátu zaujímají nezastupitelnou roli pečlivý odběr anamnézy, fyzikální a ultrazvukové vyšetření, stanovení hormonálního profilu a v indikovaných případech i genetické vyšetření, ale jejich podrobný popis je již nad rámec sdělení.
Poděkování
Vývoj metod stanovení apoptózy spermií a fragmentace DNA ve spermiích byl finančně podpořen IVF klinikou GENNET, s. r. o, členem společnosti FutureLife.
Jan Novák děkuje také MZ ČR za podporu v rámci projektu RVO VFN64165.
Čestné prohlášení
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou ani žádným zadavatelem studie.
Seznam zkratek
ADCC buněčná cytotoxicita závislá na protilátkách (antigen-dependent cellular cytotoxicity)
CAD kaspázou aktivovaná DNáza (caspase-activated DNase)
CASA počítačová analýza spermatu (computer-aided sperm analysis)
CD diferenciační skupina (cluster of differentiation)
COMET kometový test
DNA deoxyribonukleová kyselina
EAU European Association of Urology
FITC fluorescein izothiokyanát
HLA lidský leukocytový antigen (human leucocyte antigen)
IB immunobead
ICSI intracytoplazmatická injekce spermií (intracytoplasmic sperm injection)
IL interleukin
IUI intrauterinní inseminace
IVF fertilizace in vitro
MAGI infekce mužských přídatných žláz (male accessory gland infection)
MAR smíšená antiglobulinová reakce (mixed antiglobulin reaction)
NK přirozený zabíječ (natural killer cell)
NRAR Národní registr asistované reprodukce
PCR polymerázová řetězová reakce (polymerase chain reaction)
ROS reaktivní formy kyslíku (reactive oxygen species)
SCD test disperze chromatinu ve spermiích (sperm chromatic dispersion test)
SCSA test integrity chromatinu ve spermiích (sperm chromatin structure assay)
TNF tumor nekrotizující faktor
TUNEL metoda, při níž jsou fluorescenčně značené nukleotidy dUTP inkorporovány terminální deoxynukleotidyltransferázou na 3' konce zlomů DNA (terminal deoxynucleotidyl transferase dUTP nick end labeling)
WHO Světová zdravotnická organizace (World Health Organization)
Adresa pro korespondenci
MUDr. Jan Novák, FEBU, FECSM
Urologická klinika 1. LF UK a VFN
Ke Karlovu 6, 128 00 Praha 2
Tel.: 224 967 857
e-mail: jan.novak3@vfn.cz
Sources
- Salonia A, Bettocchi C, Carvalho J et al. EAU guidelines on sexual and reproductive health. EAU Guidelines Office, 2020.
- Řežábek K. Asistovaná reprodukce. Maxdorf, Praha, 2014.
- Úzis ČR. Rodička a novorozenec 2014–2015. ÚZIS ČR. Dostupné na: www.uzis.cz/publikace/rodicka-novorozenec-2014-2015
- World Health Organization. WHO laboratory manual for the examination and processing of human sperm (5th ed.). WHO, 2010.
- Novák J, Vik V. Domácí vyšetření spermiogramu pomocí chytrého mobilního telefonu? Vítejte v éře telespermatologie. Česká urologie 2017; 21(4): 280–283.
- Smith GW, Griffith DP, Pranke DW. Melanospermia: an unusual presentation of malignant melanoma. J Urol 1973; 110(3): 314–316.
- Madar J, Ulčová-Gallová Z. Imunologie a imunopatologie lidské reprodukce – vybrané kapitoly. Mladá fronta, Praha, 2016.
- Marconi M, Weidner W. Site and risk factors of antisperm antibodies production in the male population. In: Krause WKH, Naz RK (eds.). Immune Infertility: Impact of Immune Reactions on Human Fertility. Springer International Publishing 2017 : 133–147.
- Hořejší V. Základy imunologie (6., aktualizované vyd.). Triton, Praha, 2017.
- Agarwal A, Mulgund A, Hamada A, Chyatte MR. A unique view on male infertility around the globe. Reprod Biol Endocrinol 2015; 13 : 37.
- Krátká Z, Luxová Š, Vik V. Využití průtokové cytometrie pro stanovení kvality ejakulátu u mužů s poruchou reprodukce. Česká urologie 2017; 21(4): 289–298.
- Cho C-L, Agarwal A. Role of sperm DNA fragmentation in male factor infertility: a systematic review. Arab J Urol 2018; 16(1): 21–34.
- Simon L, Emery B, Carrell DT. Sperm DNA fragmentation: consequences for reproduction. Adv Exp Med Biol 2019; 1166 : 87–105.
- Tan J, Taskin O, Albert A, Bedaiwy MA. Association between sperm DNA fragmentation and idiopathic recurrent pregnancy loss: a systematic review and meta-analysis. Reprod Biomed Online 2019; 38(6): 951–960.
- Cissen M, van Wely M, Scholten I et al. Measuring sperm dna fragmentation and clinical outcomes of medically assisted reproduction: a systematic review and meta-analysis. PLoS One 2016; 11: e0165125.
- Ding H, Tian J, Du W et al. Open non-microsurgical, laparoscopic or open microsurgical varicocelectomy for male infertility: a meta-analysis of randomized controlled trials. BJU Int 2012; 110(10): 1536–1542.
- Yan S, Shabbir M, Yap T et al. Should the current guidelines for the treatment of varicoceles in infertile men be re-evaluated? Hum Fertil 2019; 1–15, doi: 10.1080/14647273.2019.1582807.
- Esteves SC, Roque M, Bradley CK, Garrido N. Reproductive outcomes of testicular versus ejaculated sperm for intracytoplasmic sperm injection among men with high levels of DNA fragmentation in semen: systematic review and meta-analysis. Fertil Steril 2017; 108(3): 456–467.e1.
- Nicopoullos J, Vicens-Morton A, Lewis SEM et al. Novel use of COMET parameters of sperm DNA damage may increase its utility to diagnose male infertility and predict live births following both IVF and ICSI. Hum Reprod 2019; 34(10): 1915–1923.
- Bittner L. Vliv myo-inositolu a antioxidantů na fertilitu muže. Urologie pro praxi 2015; 16(3): 109–112.
- Bisht S, Faiq M, Tolahunase M, Dada R. Oxidative stress and male infertility. Nat Rev Urol 2017; 14(8): 470–485.
- Schuppe H-C, Pilatz A, Hossain H et al. Urogenital Infection as a risk factor for male infertility. Dtsch Arztebl Int 2017; 114(19): 339–346.
- Ljubin-Sternak S, Meštrović T. Chlamydia trachomatis and genital mycoplasmas: pathogens with an impact on human reproductive health. J Pathog 2014; 2014 : 183167.
- Novák J, Vik V, Langerová A, Krátká Z. Výskyt asymptomatických urogenitálních infekcí u párů se sníženou plodností (abstrakt). Česká urologie 2019; 23(Suppl. A): 58.
- Záhumenský J, Jilich D, Vaňousová D. Základy moderní venerologie: učebnice pro mezioborové postgraduální vzdělávání. Maxdorf, Praha, 2015.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

2021 Issue 1-
All articles in this issue
- ÚVODEM
- Imunologie – inspirativní přítelkyně materno-fetální medicíny
-
Proměny času, proměny zdraví
100 let české populace z pohledu klinika, patologa a reprezentantů medicínských specializací -
Lékařský dům
1931–2021 -
Vzpomínka na profesora
Přemysla Strejce - Zesnul profesor Jan Evangelista Dyr
- Current possibilities of diagnostics and treatment of immunological causes of female infertility
- The management of care for a pregnant woman with recurrent pregnancy losses and proven immunodeficiency from the obstetrician’s point of view
- Diagnostics of infertile males in the 21st century – a traditional concept or a modern approach?
- Circulating NK and NKT cells in the diagnosis and treatment of immunological causes of female infertility – retrospective data analysis from the tertiary clinical center
- COVID-19 and immunomodulation treatment for women with reproductive failures
- Conspiracy theories as a natural part of pandemics
- PŘEDNÁŠKOVÉ VEČERY SPOLKU ČESKÝCH LÉKAŘŮ V PRAZE (DUBEN – ČERVEN 2021)
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Circulating NK and NKT cells in the diagnosis and treatment of immunological causes of female infertility – retrospective data analysis from the tertiary clinical center
- Current possibilities of diagnostics and treatment of immunological causes of female infertility
- Diagnostics of infertile males in the 21st century – a traditional concept or a modern approach?
- The management of care for a pregnant woman with recurrent pregnancy losses and proven immunodeficiency from the obstetrician’s point of view
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

