-
Medical journals
- Career
Reparace DNA v buňkách nádorů hlavy a krku a možnosti využití monitorování tohoto procesu pro odhad radiorezistence jednotlivých nádorů a výběr optimální primární léčby
Authors: Zuzana Horáková 1; MUDr. Jaromír Gumulec 2,3; Olga Kopečná 4; Eva Pagáčová 4; Michal Masařík 2,3; Alena Bačíková 4; Iva Falková 4; Martina Raudenská 2,3; Tomáš Vičar 5; Hana Binková 6; Martin Falk 4
Authors‘ workplace: Klinika otorinolaryngologie a chirurgie hlavy a krku LF UP a FN Olomouc 1; Ústav patologické fyziologie LF MU v Brně 2; Fyziologický ústav LF MU v Brně 3; Oddělení buněčné biologie a radiobiologie, Biofyzikální ústav AV ČR, Brno 4; Ústav biomedicínského inženýrství, FEKT VUT v Brně 5; Oddělení ORL, Vojenská nemocnice Brno 6
Published in: Čas. Lék. čes. 2020; 159: 268-274
Category: Review Article
Overview
V léčbě nádorů hlavy a krku (NHK) zaznamenáváme odklon od chirurgie směrem k radioterapii, respektive chemoradioterapii, s důrazem na poléčebnou kvalitu života. Volba léčebné modality však vychází pouze z klinických zkušeností a preferencí pacienta, protože neznáme marker radiosenzitivity jednotlivých nádorů. Nové možnosti rozhodování o nejvhodnější primární terapii, směřující k personalizované medicíně založené na kvantifikovatelných biomarkerech, by mohlo nabídnout studium radiačního poškození a reparace DNA u jednotlivých nádorů.
V předloženém článku diskutujeme, společně s významem radioterapie v léčbě NHK, své předběžné výsledky odhalující existenci několika skupin NHK s ohledem na stabilitu genomu a reparační schopnosti nádorových buněk po ozáření. Monitorování kinetiky tvorby a zániku reparačních ohnisek γH2AX/53BP1 v buněčných primokulturách nádorových tkání získaných od jednotlivých pacientů naznačuje, že specifické odchylky v reparaci DNA, charakteristické pro identifikované skupiny, korelují se zvýšenou nebo sníženou radiosenzitivitou nádorových buněk. Naše zjištění tak přispívají k lepšímu pochopení vzniku a progrese NHK. Souvislost reparačních skupin s odpovědí nádorů na radioterapii in vivo však zůstává předmětem výzkumu. Jelikož velká část NHK netrpí reparačními defekty, a přitom se jejich viabilita po ozáření vzájemně diametrálně liší, preterapeutické testy pokrývající celé spektrum příčin radiosenzitivity NHK budou muset využívat kombinaci více biomarkerů, jež však stále čekají na své odhalení.
Klíčová slova:
nádory hlavy a krku – dilema primární léčby – radioterapie – prediktivní markery radiorezistence – poškození a reparace DNA
ÚVOD
Zhoubné nádory hlavy a krku (NHK) zahrnují zhruba 5 % všech malignit a celkem představují 6. nejčastější nádorové onemocnění. Celosvětově ročně se diagnostikuje cca 650 tisíc NHK a zaznamenává 350 tisíc úmrtí na tyto nádory. V Česku dle údajů webového portálu SVOD (www.svod.cz) evidujeme každým rokem přibližně 1100 nových případů a 600 úmrtí na tuto diagnózu (1). Incidence NHK navíc v posledních dekádách stoupá, a to v naší zemi i celosvětově. Ještě strměji pak roste prevalence.
NHK se nezřídka vyskytují v blízkosti kritických anatomicko-funkčních struktur, což činí operační zákrok často nemožný nebo značně devastující. Zásadní zlepšení terapeutických vyhlídek zatím nepřináší ani konzervativní léčba, z velké části založená na radioterapii (RT), jelikož přibližně polovina NHK neodpovídá na ozáření. Velký důraz je proto kladen na výzkum preterapeutických markerů radiorezistence NHK (2) a zároveň vývoj účinnější RT (3–5) spolu se zlepšováním mikrochirurgických metod.
NHK tvoří geneticky i klinicky heterogenní skupinu onemocnění, postihující více lokalit horního aerodigestivního traktu. Nejčastěji vznikají v hltanu, dutině ústní a hrtanu, histologicky se v naprosté většině případů jedná o spinocelulární karcinom. NHK se chovají povětšinou agresivně a mají špatnou prognózu, jednou z nejhorších, s tendencí k časným recidivám a vysoké mortalitě (až 50 %). Prognóza se nicméně diametrálně liší dle pokročilosti onemocnění v době diagnózy. Většina NHK bývá bohužel odhalena až v lokálně pokročilém stadiu (III+IV). Kvůli této skutečnosti a agresivnímu růstu nepřesahuje 5leté přežití celkově pro všechny NHK 50 %. U časných stadií (I a II) 5leté přežití po adekvátní chirurgické nebo i nechirurgické léčbě vzrůstá na 60–95 %, s velmi dobrou perspektivou. Zcela odlišných terapeutických úspěchů potom logicky dosahujeme u lokálně pokročilých nádorů stadia III a IV, kde i přes radikální a dnes již standardně aplikovanou multimodální léčbu přežívá 5 let pouze 40–50 % pacientů. Recidiva dále zhoršuje prognózu přibližně o 25 % a metastázy do krčních uzlin také o cca 25 %. Navzdory veškerému úsilí zaměřenému na prevenci, pokrokům v diagnostice a zavedení nejnovějších postupů v chirurgii a chemo/radioterapii se v průběhu posledních dekád nepodařilo zásadně zlepšit žádný ze sledovaných parametrů lokální kontroly onemocnění ani přežití (6).
Etiopatogeneticky i klinicky musíme podle asociace nádoru s infekcí vysoce rizikovými typy viru lidského papilomaviru (HPV) rozlišovat 2 skupiny, které vykazují zcela odlišné biologické chování, senzitivitu k léčbě, a tudíž i terapeutické výsledky a prognostické vyhlídky (7). Zatímco incidence „etiologicky tradičních“ NHK díky prevenci postupně klesá, byť jen velice zvolna, zcela opačný trend registrujeme u nádorů (spolu)vyprovokovaných virovými vlivy (HPV+), kde můžeme dokonce hovořit o celosvětové epidemii. Zopakujme, že HPV+ nádory lépe odpovídají na radioterapii a lze u nich očekávat příznivější vyhlídky. Začíná se nicméně vyčleňovat i třetí skupina NHK, představovaná kuřáky s nádory asociovanými s HPV, která prognosticky spadá někam mezi HPV+ nádory u nekuřáků a HPV– nádory.
V poslední době se stále silněji prosazuje důraz na maximalizaci kvality života pacientů po proběhnuvší léčbě. Minimalizace sekundárních účinků terapie se tak stává integrální součástí přípravy terapeutického plánu spolu s požadavkem na výsledky léčby samotné (přežití pacientů). Zásadní roli v tomto ohledu hraje správný výběr primární terapeutické strategie. Současné možnosti a problémy jednotlivých léčebných alternativ srovnáváme v následujícím textu.
CHIRURGICKÁ LÉČBA NHK
Radikální chirurgická resekce s potřebnou bezpečnostní linií dostatečnou z onkologického hlediska představuje historicky ověřenou léčebnou modalitu. Vzhledem k anatomické blízkosti životně důležitých struktur se však ve většině případů pojí s podstatnou mutilací pacienta, zásadně zhoršující jeho poléčebnou kvalitu života. Operaci komplikuje zejména skutečnost, že se na anatomicky malém prostoru potkávají významné struktury dýchacích a polykacích cest, klíčové z hlediska funkčního a zároveň estetického. Chirurgické řešení proto často ústí v dlouhodobou až trvalou závislost na tracheostomii, případně gastrostomii. Vždy tak proti sobě stojí onkologická radikalita a rozsah mutilace pacienta.
Akcentace poléčebné kvality života v současnosti vede ke stále preferovanější konzervativní léčbě, tj. radioterapii nebo chemoradioterapii, případně v kombinaci s biologickou léčbou (8). Pokroky v chirurgii představované endoskopickou resekcí s využitím laseru nebo robotické chirurgie, hojně využívanou v posledních letech, zásadně přispívají ke zlepšení funkčních pooperačních výsledků. Zdá se tedy, zejména vzhledem k níže diskutovaným nedořešeným problémům souvisejícím s konzervativní léčbou (zejména ~50 % radiorezistence NHK), že jsme potenciál chirurgie ještě zcela nevyčerpali a operace tak zůstává v řadě případů nenahraditelná (9).
NECHIRURGICKÁ LÉČBA
Radioterapie (RT) reprezentuje nejúčinnější, a tudíž i nejčastěji aplikovaný nechirurgický léčebný přístup, u NHK užívaný v indikaci kurativní, adjuvantní nebo paliativní. Princip RT spočívá v poškození DNA nádorových buněk, jež zároveň trpí častými defekty v reparačních mechanismech této molekuly, a navíc se ze samotné podstaty svého stavu dělí rychleji než buňky normální (10). Nádorové buňky tak ve srovnání s buňkami netransformovanými opravují DNA méně efektivně a mají na tyto opravy i méně času. Kvůli narušené funkci kontrolních bodů buněčného cyklu potom neregulovaně proliferující nádorové buňky vstupují do mitózy s nedoreparovanou DNA, což obvykle končí jejich přechodem do senescence nebo smrtí kvůli neschopnosti dokončit mitózu (mitotická smrt).
Prakticky ovšem musíme počítat hned s několika zásadními komplikacemi zhoršujícími terapeutické vyhlídky. Radiosenzitivita nádorových buněk se i přes jejich sníženou reparační kapacitu neliší od buněk nádoru přiléhajících normálních tkání až tak dramaticky, aby šlo účinek záření principiálně považovat za selektivní. Vždy proto existuje riziko vážných vedlejších účinků RT, jako například indukce sekundárních malignit i při malých absorbovaných dávkách (viz níže). Při standardních radioterapeutických přístupech chráníme normální tkáně frakcionací celkové dávky záření do většího počtu časově separovaných subfrakcí. Tato procedura však podporuje selekci radiorezistentních klonů buněk a zvyšování radiorezistence nádoru následkem terapie (obdobně vzniku chemorezistence). Některé tumory (obecně) jsou navíc v důsledku svých genetických charakteristik a priori vysoce radiorezistentní. Z NHK na záření špatně odpovídá asi polovina případů (11), příčiny této rezistence nicméně čekají na své zmapování.
Radiorezistenci nádoru dále významně zvyšuje různě rozsáhlá a intenzivní, avšak téměř vždy přítomná hypoxie. Ionizující záření poškozuje DNA nádorových buněk buď přímo, nebo nepřímo prostřednictvím volných radikálů vznikajících radiolýzou vody. Pro fotonové záření gama nebo rtg, nejčastěji používané v radioterapii, nepřímý efekt značně dominuje. Dostatečná oxygenace je proto nezbytná pro stabilizaci (zafixování) radikálového poškození DNA, a tudíž manifestaci efektu RT (10).
Radioterapii tedy i přes její neinvazivní charakter doprovázejí výrazné projevy toxicity. Kromě akutního poškození (mukozitida, dermatitida) trpí ozářené tkáně a orgány rovněž toxicitou pozdní (xerostomie, fibroindurace, dysfagie, dysfonie), přičemž vždy hrozí riziko indukce sekundárních nádorů. Všechny tyto faktory významně snižují poléčebnou kvalitu života a v případě lokalizace nádoru v blízkosti kriticky důležitých anatomicko-funkčních struktur i použitelnost RT. Principiálně můžeme vedlejší účinky RT omezit radiosenzitizací nádorových buněk nebo radioprotekcí buněk zdravé tkáně. Lze toho docílit cestou fyzikální (hadronová terapie [3, 5, 12, 13], kovové nanočástice [4, 14] apod.), chemickou (amifostin a další chemická agens [15–17]), biologickou (siRNA, specifické protilátky apod.) nebo technologickou (zpřesňující a maximalizující depozici dávky ionizujícího záření v objemu nádoru [18]).
Dva klinicky realizovatelné způsoby snížení toxicity RT v současnosti nabízejí nové technologie lépe zacilující ozáření na nádor samotný (18) a hadronová terapie pomocí urychlených protonů (5) nebo těžkých (zejména uhlíkových) iontů (19). Ozařování těžkými ionty představuje v současnosti patrně jedinou dostupnou léčebnou modalitu v případech, kdy standardní (fotonová) terapie selže a chirurgické řešení není myslitelné (záchranná RT) (19). Z progresívních radioterapeutických technik jmenujme radioterapii s modulovanou intenzitou (IMRT) nebo řízenou obrazem (IGRT), jež díky zpřesnění ozařovaného pole a jeho zaměření na nádor minimalizují radiační zátěž normálních tkání, především nejcitlivějších neurologických struktur, bez nutnosti redukovat aplikovanou dávku, respektive účinnost léčby. Moderním radioterapeutickým technikám se podrobně a v širším měřítku věnuje článek profesora Pavla Šlampy v tomto vydání ČLČ.
Urychlené protony a těžké ionty interagují s hmotou v důsledku přítomnosti náboje jinak než záření fotonového typu. Většina energie záření je okolnímu prostředí předána v oblasti tzv. Braggova maxima (peaku), jež se objevuje těsně před koncem dráhy letu částice a jehož hloubku v těle pacienta nastavujeme volbou výchozí energie částic tak, aby došlo k překrytí s pozicí tumoru. Hadronová terapie tím při stejné aplikované dávce šetří normální tkáně před a zejména za nádorem mnohem lépe než fotonová záření. Urychlené těžké ionty navíc poskytují výhodu vysokého lineárního přenosu energie (LET), a tudíž i radiobiologické efektivity (RBE) a terapeutického účinku (3). DNA přitom poškozují zejména přímo, takže výsledek terapie mnohem méně závisí na hypoxii a genetickém pozadí nádoru (20). Vzhledem k extrémní finanční náročnosti a dosud ne zcela probádaným biologickým rizikům se však klinické využití těžkých iontů omezuje celosvětově na několik málo center. Na současné technologické úrovni je navíc přínos hadronové terapie pro některé typy nádorů stále diskutabilní (21).
Jeden z kritických problémů aplikace RT v onkologii NHK spočívá v neznalosti markerů radiosenzitivity či radiorezistence jednotlivých nádorů (ačkoliv existují nesčetné genetické i negenetické změny již dříve obecně korelované s rezistencí nádorů k RT, jejich relevance pro NHK není známa, stejně jako způsob stanovení integrálního účinku jejich konkrétních kombinací na terapeutickou odpověď daného nádoru – viz dále). RT je tudíž vždy aplikována zcela neselektovaně a – protože zhruba polovina NHK na záření nereaguje – s významným rizikem selhání terapie. K tomuto tématu se detailněji vrátíme později.
Chemoterapie, zejména na bázi platiny, bývá zařazována především jako součást konzervativní chemoradioterapie (22). Pro doposud nejvyšší účinnost ji považujeme za zlatý standard v onkologii NHK, současně však působí značně toxicky. Při intoleranci nebo v paliativní indikaci se nabízí i možnost aplikace dalších modalit, případně kombinovaných s RT.
Rozvojem prochází i biologická léčba, např. na principu protilátek proti receptorům epidermálního růstového faktoru (EGFR), které NHK často vytvářejí v nadměrném množství (23). Nově se spektrum možností biologické léčby NHK rozrostlo o imunoterapii na bázi protilátek proti povrchovým receptorům PD1 (membránovému proteinu programované buněčné smrti 1) nebo ligandům tohoto receptoru – PD-L1 (24).
STRATEGIE LÉČBY, ZÁCHOVNÝ PROTOKOL
V posledních letech se termín „léčebný protokol zachovávající orgán“ (OPP – organ preservation protocol) skloňuje stále častěji i v léčbě pokročilých NHK. Myšlenka OPP vznikla v 90. letech 20. století (25), nejprve v kontextu lokálně pokročilých nádorů hrtanu, které v případě chirurgického řešení vyžadují totální laryngektomii spojenou s trvalou tracheostomií. Přestože OPP spoléhá na konzervativní léčbu nahrazující mutilující operaci, benefity s ohledem na zachování funkce postižených orgánů bohužel nejsou jednoznačné (25).
Neopominutelné bývají zejména vedlejší účinky radioterapie, zvláště v případě jejich další akcentace současně aplikovanou chemoterapií. Registrujeme toxicitu akutní, jež často limituje dokončení plánované terapie (především mukozitida a dermatitida v akutním stadiu), i chronickou, s dlouhodobými komplikacemi. Kombinací modalit, nejčastěji chemo - a radioterapie, se tak sice podařilo nahradit radikální chirurgickou léčbu a fyzicky „zachránit” hrtan, metaanalýzy ovšem odhalily dramatické následky pozdní toxicity, nezřídka funkčně devastující. Tíživě se manifestuje zejména dysfonie a dysfagie doprovázená aspirací (respektive tzv. tichou aspirací) potravy, ústící v recidivující pneumonie. V závislosti na rozsahu nádoru je 30–60 % pacientů odkázáno na gastrostomii či tracheostomii déle než 1 rok po ukončení léčby. Striktury polykacích cest s funkčními problémy se objevují až u 40 % jedinců. Při chemoterapii se dále vyskytují komplikace metabolické a při biologické léčbě dermatologické. Na základě pozdní toxicity se rozvíjí i značně limitující a kvalitu života snižující xerostomie, mandibulární osteoradionekrózy, trismus, kožní hyperpigmentace, fibroindurace podkoží a závažné kosmetické defekty.
Analýze funkčních výsledků nechirurgické léčby se retrospektivně věnovalo mnoho studií (26). Ukázalo se přitom, že kromě kvantitativních výsledků kontroly nádoru a zachování postiženého orgánu musíme dopady hodnotit v širším kontextu. Nepoškození samotné anatomické struktury totiž neznamená zároveň nepozbytí její funkce. Ta může být primárně a nezvratně narušena již samotným nádorem před léčbou nebo posléze toxicitou terapie. Ani po úspěšné eliminaci nádoru nelze automaticky očekávat restituci funkce zasaženého orgánu, byť anatomicky intaktního. Ve skutečnosti jsou výsledky s ohledem na funkčnost orgánů nad původní očekávání špatné, bohužel i dlouhodobě. Při již zmíněné nechirurgické léčbě pokročilých nádorů hrtanu se podařilo orgán zachránit u více než 2/3 pacientů; přesto však 30–50 % z nich zůstává po mnoho měsíců nebo i trvale závislých na gastrostomii/tracheostomii, pro nezvladatelnou dysfagii a obstrukci dýchacích cest se současnou dysfonií. Neodstraněný, avšak nefunkční orgán v těchto případech představuje pro pacienta často přítěž pro riziko aspirací a recidivujících pneumonií.
Souhrnně tedy nezbývá než konstatovat, že s ohledem na terapeutickou efektivitu a restituci kvality života prokazuje záchovný (OPP) přístup v léčbě NHK obdobné výsledky jako chirurgické řešení (např. 27). Aktuální trendy v onkologii NHK se proto dynamicky mění v závislosti na aktuálních pokrocích v konkrétním směru. Po období dominující chirurgické resekce docházelo od 90. let 20. století k rozvoji RT, chemoterapie a biologické terapie a silnému příklonu ke konzervativní léčbě. V posledních letech po zavedení šetrných endoskopických a robo-chirurgických metod pozorujeme naopak renesanci chirurgie. Například Tang et al. (28) na základě dlouhodobého sledování 6288 pacientů poukazují na lepší lokální kontrolu a přežití pacientů po chirurgické excizi dokonce i v případě velmi pokročilých (T4) nádorů.
Konzervativní léčba s sebou navíc přináší po svém selhání u radiorezistentních typů nádorů i riziko persistence, či dokonce progrese nádoru. Toto riziko není u NHK rozhodně zanedbatelné, protože doposud neznáme spolehlivé a klinicky použitelné markery radiorezistence. Na ozáření přitom odpovídá jen asi 50 % nádorů HK. Toto nebezpečí potvrdily rovněž naše monocentrické studie retrospektivně hodnotící výsledky léčby (29–31). Následná záchranná chirurgie může být velmi náročná, při zásadní progresi onemocnění potom již i nemožná. Často vyžaduje komplikované plastické rekonstrukce, podmíněné nejen rozsahem zákroku, ale také sekundárním hojením v terénu radiačně změněných tkání. Asociované dehiscence ran a tvorba píštělí (referovaná až u 30 % pacientů) dále snižují kvalitu života po neúspěšné RT.
Roste tak tlak na včasné a přesné zhodnocení léčebné odpovědi a případně odhalení reziduálního či recidivujícího nádoru pomocí správně zvolených a spolehlivých zobrazovacích metod. Pro odlišení nádoru od léčbou indukovaných tkáňových změn lze velmi efektivně využít magnetické rezonance (MRI), vykazující senzitivitu > 90 % a specificitu > 80 %. Významný přínos slibuje nová difuzně vážená MRI (32). Ještě lepší výsledky poskytuje funkční zobrazování na bázi PET/CT, kombinující pozitronovou emisní tomografii (PET) s výpočetní tomografií (CT). Při této hybridní metodě se již blížíme 100% senzitivitě a > 90% negativní prediktivní hodnotě (pozitivní prediktivní hodnota dosahuje 100 %) (33).
PRETERAPEUTICKÁ PREDIKCE ODPOVĚDI NA PRIMÁRNÍ LÉČBU
Předpokládalo se, že mutilaci pacienta následkem chirurgické excize nádoru se budeme moci vyhnout upřednostněním konzervativní léčby. RT a chemoterapie však představují obdobně agresivní léčebné metody doprovázené řadou závažných vedlejších efektů a významným rizikem terapeutického selhání a indukce sekundárních malignit. Uvážíme-li přibližně 50% necitlivost NHK k RT a nepovzbudivé vyhlídky záchranné chirurgie po neúspěšné RT, vynořuje se před námi dilema výběru primární terapie (obr. 1). Velmi zjednodušeně – rozhodneme-li se pro chirurgické řešení, s přibližně 50% pravděpodobností zbytečně a významným způsobem snížíme poterapeutickou kvalitu života pacienta. Přikloníme-li se naopak k RT, léčba se stejně vysokým rizikem a významně zhoršenou budoucí prognózou vývoje onemocnění selže. Kterou modalitu tedy zvolit v 1. linii, chceme-li maximalizovat efekt léčby, a přitom nevíme, jak na ni nádor zareaguje? Bohužel doposud nemáme žádný biomarker preterapeutické predikce radiorezistence NHK, respektive senzitivity NHK k jednotlivým výše popsaným léčebným alternativám. Za této situace musejí být všechny terapeutické přístupy považovány v uvedeném smyslu slova za necílené.
Image 1. Dilema výběru nejúčinnější primární léčby 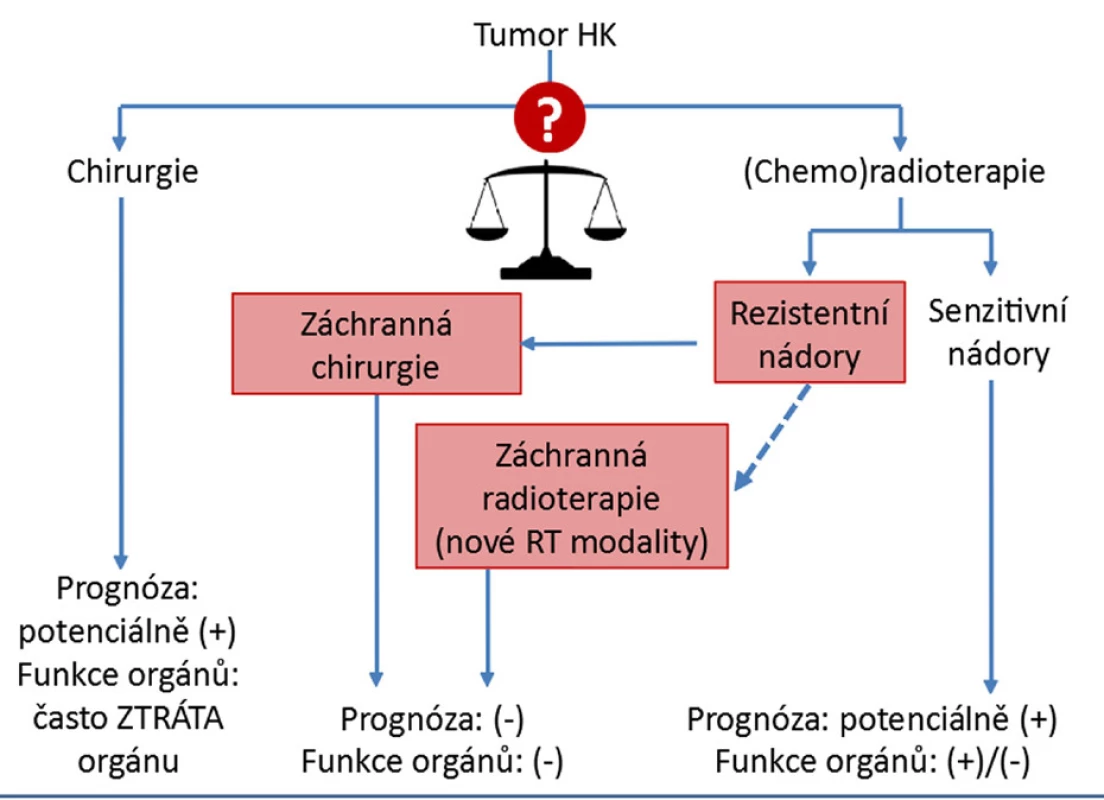
(Chemo)radioterapie je doposud aplikována převážně na základě klinických parametrů nádoru, preferencí pacienta a zkušeností chirurga. Prognóza a stratifikace léčby se tak řídí zejména stadiem pokročilosti nádoru definovaným klasifikací TNM, jež se dlouhodobě zakládá mj. na velikosti nádoru a infiltraci okolních struktur (34). Poznamenejme však, že souvislost mezi objemem nádoru v době stanovení diagnózy a úspěchem aplikované léčby (zde sekvenční RT a chemoterapie a poindukční terapie) se nepodařilo všeobecně prokázat; přežívání pacientů totiž obvykle korelovalo pouze s objemem nádoru po definitivní radioterapii (35).
Nově se do poslední, 8. aktualizace TNM klasifikace prosadily i další parametry: tloušťka nádoru dle hloubky invaze u nádorů dutiny ústní, extrakapsulární šíření metastáz mimo pouzdro lymfatických uzlin a u orofaryngeálních nádorů pak především status nádoru s ohledem na infekci HPV. Tento status, definovaný nejčastěji stále diskutabilní expresí proteinu p16 (36), můžeme považovat za jediný biologický parametr nádoru, který odráží jeho etiopatogenezi a který má natolik silný vliv na prognózu onemocnění, že si zasloužil zařazení do poslední verze klasifikace (37). Při jinak srovnatelném rozsahu nádoru přiřazujeme HPV-pozitivním nádorům hltanu nižší klasifikační stupeň než HPV-negativním a v brzké budoucnosti lze patrně očekávat i návrh deeskalace terapie u tohoto prognosticky příznivějšího typu NHK.
Přestože HPV status (protein p16) prokázal svůj zásadní význam jako důležitý prognostický faktor (36), stále postrádáme další spolehlivé biomarkery, které by umožnily preterapeutickou kategorizaci pacientů s ohledem na nejefektivnější primární léčbu. V minulosti se za nepřímý prediktivní marker radiosenzitivity pokládala efektivita odpovědi nádoru na neoadjuvantní chemoterapii. Očekávaná korelace mezi chemosenzitivitou a radiosenzitivitou NHK se však bohužel nepotvrdila (38). Ani měření metabolické aktivity jednotlivých ložisek nádorové tkáně pomocí PET, jakožto parametru úměrného riziku jejich recidivy, nepřineslo informaci umožňující dávkovou a intenzitní stratifikaci RT pro tato ložiska (nebo případně nádory) (39).
Přestože jsme značně pokročili v identifikaci typických změn NHK na úrovni genomu, transkriptomu, proteomu i metabolomu (40) a pronikáme stále hlouběji k molekulární podstatě příčin agresivního chování a špatné kurability NHK, prediktivní markery jejich odpovědi na jednotlivé léčebné modality se stále nedaří odhalit. Ačkoliv existují jisté dílčí úspěchy v naší honbě za biomarkery na úrovni výzkumu (viz níže), dosud nedošlo k jejich transformaci do podoby klinických studií, natož pak aplikací. Tento neúspěch jen zdůrazňuje komplexnost dějů zodpovědných za reakce nádorů in vivo.
POTENCIÁLNÍ GENETICKÉ MARKERY RADIOSENZITIVITY/RADIOREZISTENCE NHK
Vzhledem k zaměření článku se zde omezíme pouze na markery vztahující se k radiosenzitivitě. Radiosenzitivitu a reálnou terapeutickou odpověď NHK navíc kromě vnitrobuněčných charakteristik nádorových buněk významně ovlivňují také komplexní, těžko vyhodnotitelné vlivy vzájemně se potencující nebo naopak negující. Jmenujme zejména faktory související se složením nádoru (např. zastoupení radiorezistentních nádorových kmenových buněk a heterogenita klonů) (41), hypoxii (42), vzájemné interakce mezi buňkami (6,43) a extracelulární nádorové mikroprostředí (6, 43). Vynořuje se tak zásadní otázka, do jaké míry analýzy radiosenzitivity nádoru provedené na buněčné úrovni (in vitro) predikují odpověď nádoru na terapii in vivo.
Jako zatím jediný významný ukazatel radiosenzitivity NHK se jeví jejich asociace s infekcí HPV (44). Klinicky je vyšší senzitivita HPV pozitivních nádorů k chemo - i radioterapii nesporná.
Dosud odhalené genetické změny sice ve specifických případech korelují s radiosenzitivitou/rezistencí nádorových buněk, či dokonce nádorů, jednotlivé defekty se však – až na výjimky – vzhledem ke klinické i genetické heterogenitě NHK vyskytují jen u malých frakcí pacientů, a těžko tedy mohou sloužit jako samostatné obecně uplatnitelné markery pro screening radiorezistence.
V našich studiích jsme testovali, zda lze jako marker radiosenzitivity/radiorezistence NHK využít monitorování kinetiky reparace dvouřetězcových zlomů DNA (DSB) (obr. 2) (2), jež reprezentují nejzávažnější typ lézí DNA efektivně indukovaných IR (10), případně radiomimetiky (45). Efektivitu reparace jsme sledovali na buněčných primokulturách izolovaných z NHK jednotlivých pacientů a následně exponovaných záření gama in vitro (2). V různých časových intervalech (5 minut až 24 hodin) po ozáření (PO) jsme pomocí imunofluorescenční mikroskopie (metodika popsána v citaci 2) kvantifikovali počty reparačních ohnisek tvořených fosforylovaným histonem H2AX (γH2AX) a proteinem 53BP1, jež jsou obecně považovány za markery DSB (46).
Image 2. Hledání biomarkerů radiorezistence NHK (2). Experimentální postup ukazují modré šipky. Neznámé korelace/souvislosti jsou vyznačeny otazníky 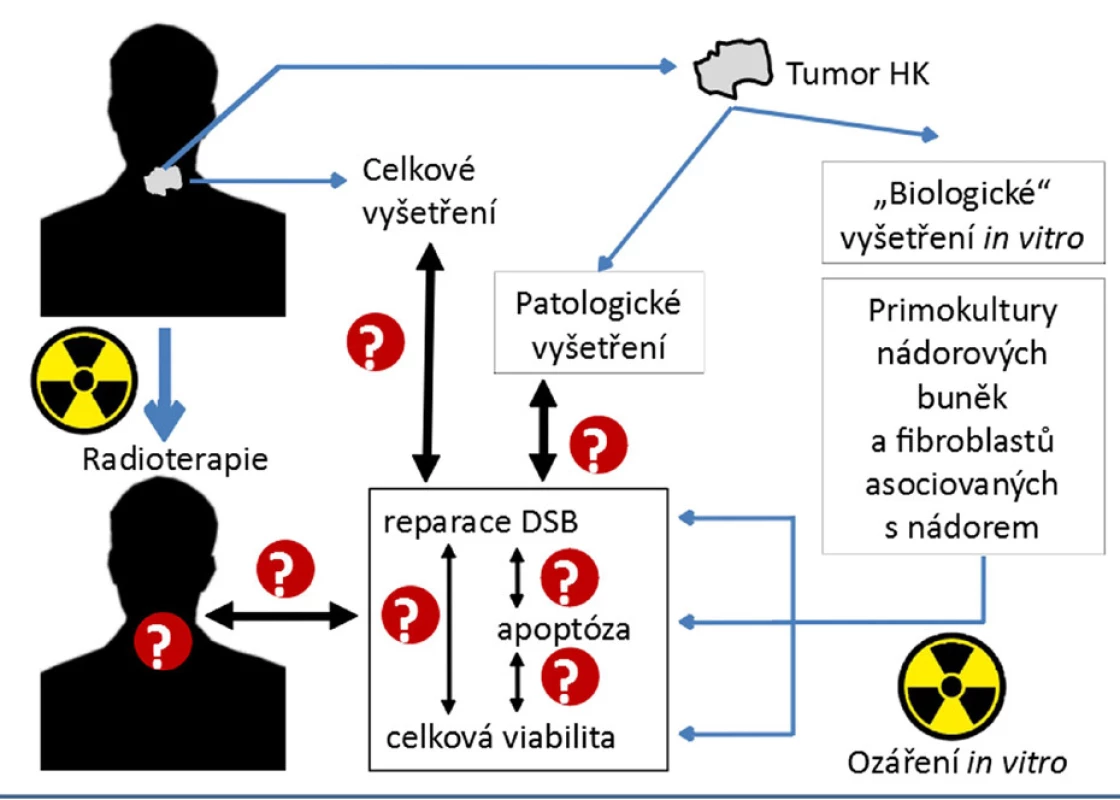
Experimentální postup ukazují modré šipky. Neznámé korelace/souvislosti jsou vyznačeny otazníky.
Tento postup se může zdát klinicky problematický, protože vyžaduje kultivaci buněk odebraných z nádoru (případně i separaci jednotlivých buněčných typů), jejich ozařování simulující účinky radioterapie a následné více či méně složité a několik dní trvající získávání a vyhodnocování dat. Přesto jsme se kvůli omezením end-point měření (tj. v jednom časovém bodě) a dosavadnímu neúspěchu s hledáním jednoduchých markerů vydali touto o poznání složitější cestou. Nelze vyloučit, že dlouhodobější a komplexnější in vitro analýzy kultivovaných a v různých časech po aplikaci terapeutických činidel fixovaných buněk, nebo dokonce kontinuální monitorování živých buněk budou nakonec i přes svou „nepraktičnost“ představovat perspektivní, ne-li jediný směr vedoucí k preterapeutické předpovědi léčebné odpovědi nádorů hlavy a krku. Obdobným vývojem si prošla například klinická mikrobiologie, kde byly metody spojené s kultivací mikroorganismů nejprve též zcela zatracovány.
Výhodou zde využitého přístupu je jednak v současnosti nejvyšší možná citlivost detekce DSB (3, 15, 46), jednak možnost v rámci jednoho experimentu a na omezeném množství dostupného biologického materiálu vyhodnotit integrovaný funkční dopad nejrůznějších mutací a případných dalších faktorů na reparaci DNA. Vzhledem k provedení studií na primokulturách složených z vlastních nádorových buněk a fibroblastů asociovaných s tumorem naše experimenty zahrnují také potenciální vlivy vzájemného působení mezi těmito buněčnými typy důležitými z hlediska vlastností nádoru (43, 47). Úspěšně proběhly též prvotní analýzy pro nádorové buňky a nádorové fibroblasty v separovaných kulturách. Zavedený systém tak reprezentuje mnohem obecněji využitelný model pro výzkum a monitorování odpovědi nádorů na léčbu (47), který lze kombinovat například s nastolením podmínek hypoxie různého stupně.
Vybrané parametry reparace DSB zjištěné výše popsaným způsobem jsme následně korelovali s viabilitou buněčných kultur po ozáření a aktivací apoptózy kvantifikovanou pomocí průtokové cytometrie (metodika popsána v citaci 48).
Právě vyhodnocované výsledky a naše předchozí studie (2, 49) naznačují existenci několika skupin NHK s různými typy odchylek od typické kinetiky a efektivity reparace DSB. Genetické změny asociované s pozorovanými odchylkami zatím neznáme, tyto odchylky však specificky poukazují na sníženou nebo zvýšenou viabilitu nádorových buněk po ozáření (nepublikovaná data). Zdá se, že jeden typ identifikovaných reparačních defektů se pojí s HPV pozitivitou NHK, zatímco zbývající typy postihují určité frakce HPV-negativních nádorů. K obdobným závěrům s ohledem na rozdíly reparace DSB mezi HPV-negativními a pozitivními NHK dospěli s využitím podobného experimentálního designu, avšak pouze na permanentních nádorových liniích rovněž Nicksonová et al. (44). V této práci i v naší studii na nádorových primokulturách měly HPV-pozitivní buňky oproti těm negativním zvýšený počet ohnisek DSB perzistujících v buněčných jádrech ještě 24 hodin po ozáření. Zatímco Nicksonová et al. však u žádné z buněčných linií (HPV+ ani HPV–) nezaznamenali nadpočetná ohniska DSB v době před ozářením, naše pozorování odhalila tento fenomén u významné frakce HPV+ primokultur. Mechanismy radiosenzitivity HPV-pozitivních NHK tak patrně alespoň v některých případech zahrnují nejen pomalejší reparaci DSB, ale i existenci permanentní genomické nestability.
Na závěr budiž ještě zdůrazněno, že defekty v reparaci DSB se týkají jen určité frakce NHK. Značná část nádorů se tak chová radiosenzitivně, nebo naopak radiorezistentně, aniž by toto bylo doprovázeno odchylkami v efektivitě reparace DSB. Radiorezistence NHK je tak evidentně multifaktoriálním fenoménem.
ZÁVĚR
NHK představují agresivní, geneticky komplexní a vůči léčbě rezistentní skupinu malignit. I přes zásadní rozvoj terapeutických možností za poslední dekády se však tento pokrok nedaří transformovat do očekávaného zlepšení léčebných výsledků. Z velké části lze tento nepovzbudivý stav připsat neznalosti příhodných biomarkerů, jež by umožňovaly racionální výběr optimální primární terapie NHK, respektive nejúčinnější kombinace současně dostupných modalit (chirurgie, radioterapie, chemoterapie a imunoterapie nebo dalších biologických metod). Léčba je tak doposud aplikována necíleně, s významným rizikem jejího selhání, značného poklesu poléčebné kvality života a vysoké morbidity.
Výsledky našich studií ukazují na existenci několika skupin NHK charakterizovaných různými typy odchylek efektivity reparace dvouřetězcových zlomů DNA ve srovnání s normálními buňkami. Pozorované odchylky korelovaly se sníženou (nebo naopak zvýšenou) viabilitou nádorových buněk po ozáření. Předléčebná kvantifikace efektivity reparace DNA a přežívání ozářených buněk in vitro, provedená na buněčných primokulturách derivovaných z nádorů jednotlivých pacientů, by tak mohla odhalit neopominutelnou část radiosenzitivních a radiorezistentních nádorů. Většina NHK však bohužel nevykazuje signifikantní změny v reparaci DNA, respektive jejích dvouřetězcových zlomů.
Preterapeutické testy radiosenzitivity individuálních nádorů, jež by měly pokrývat celé spektrum mechanismů radiosenzitivity/radiorezistence NHK, tak budou muset zcela jistě zahrnovat kombinaci většího množství vhodných markerů (50), jež zatím čekají na své objevení. Podaří-li se však tyto markery v budoucnu identifikovat, bude vynaložené úsilí více než vyváženo terapeutickými benefity – možností racionálního výběru nejúčinnější primární terapie a zároveň optimalizace ozařovacích schémat. Již dnes se nacházíme na cestě vedoucí k efektivnější a šetrnější personalizované medicíně založené na kvantifikovatelných parametrech (40). Potrvá jistě určitý čas, než se podaří nakumulovat dostatečné znalosti o velmi komplexní odpovědi NHK na různé léčebné modality a bezpečně je přenést do klinické praxe. Zdá se však, že již v brzké budoucnosti lze očekávat alespoň parciální zlepšení terapie NHK díky rozvoji robotické mikrochirurgie a významnému technologickému pokroku na poli radioterapie.
Čestné prohlášení
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Poděkování
Výzkum uvedený v článku byl podpořen projekty GAČR 20-04109J, DAAD-19-03, GAČR 19-09212S, 17-08066Y, MZČR AZV 16-29835A a projekty Vládního zmocněnce a 3+3 pro spolupráci se SÚJV Dubna.
Seznam zkratek
BER bázová excizní reparace
DSB dvouřetězcový zlom DNA
HPV lidský papilomavirus
HPV+, HPV– nádory HPV-pozitivní a HPV-negativní
HR homologní rekombinace
NHK nádory hlavy a krku
OPP léčebný protokol zachovávající orgán
PD1 povrchový receptor programované buněčné smrti 1
PD-L1 ligand receptoru PD1
RBE radiobiologická efektivita
RT radioterapie
γH2AX histon H2AX fosforylovaný na serinu 139
γH2AX/53BP1 vzájemně kolokalizující jaderná ohniska histonu γH2AX a reparačního proteinu 53BP1 představují marker DSB
Adresa pro korespondenci:
RNDr. Martin Falk, Ph.D.
Biofyzikální ústav AV ČR, v. v. i.
Královopolská 135, 612 65 Brno
Tel.: 728 084 060
e-mail: falk@ibp.cz
Sources
- Dušek L, Mužík J, Kubásek M a kol. Webový portál SVOD: Epidemiologie zhoubných nádorů v České republice. Masarykova univerzita, Brno 2005. Dostupné na: www.svod.cz
- Falk M, Horáková Z, Svobodová M et al. γH2AX/53BP1 foci as a potential pre-treatment marker of HNSCC tumors radiosensitivity – preliminary methodological study and discussion. EPJD 2017; 71 : 241.
- Ježková L, Zadneprianetc M, Kulikova E et al. Particles with similar LET values generate DNA breaks of different complexity and reparability: A high-resolution microscopy analysis of γh2AX/53BP1 foci. Nanoscale 2018; 10 : 1162–1179.
- Štefančíková L, Lacombe S, Salado D et al. Effect of gadolinium-based nanoparticles on nuclear DNA damage and repair in glioblastoma tumor cells. J Nanobiotechnology 2016; 14 : 63.
- Michaelidesová A, Vachelová J, Puchalská M et al. Relative biological effectiveness in a proton spread-out Bragg peak formed by pencil beam scanning mode. Australas Phys Eng Sci Med 2017; 40 : 359–368.
- Alsahafi E, Begg K, Amelio I et al. Clinical update on head and neck cancer: molecular biology and ongoing challenges. Cell Death Dis 2019; 10 : 540.
- Kobayashi K, Hisamatsu K, Suzui N et al. Review of HPV-Related Head and Neck Cancer. J Clin Med 2018; 7 : 241.
- Rogers SN, Semple C, Babb M, Humphris G. Quality of life considerations in head and neck cancer: United Kingdom National Multidisciplinary Guidelines. J Laryngol Otol 2016; 130(S2): S49–S52.
- Golusiński W. Functional organ preservation surgery in head and neck cancer: transoral robotic surgery and beyond. Front Oncol 2019; 9 : 293.
- Falk M, Falková I. Účinky ionizujícího záření na subcelulární a celulární úrovni, mechanizmy reparace DNA. In: Havránková R (ed.). Klinická radiobiologie. Grada, Praha, 2020 : 67–102.
- Ganci F, Sacconi A, Manciocco V et al. Radioresistance in head and neck squamous cell carcinoma – possible molecular markers for local recurrence and new putative therapeutic strategies. In: Marcu LG (ed.). Contemporary Issues in Head and Neck Cancer Management. InTech, 2015.
- Falk M, Hausmann M, Lukášová E et al. Determining omics spatiotemporal dimensions using exciting new nanoscopy techniques to assess complex cell responses to DNA damage: part A – radiomics. Crit Rev Eukaryot Gene Expr 2014; 24 : 205–223.
- Falk M, Hausmann M, Lukášová E et al. Determining omics spatiotemporal dimensions using exciting new nanoscopy techniques to assess complex cell responses to DNA damage: part B – structuromics. Crit Rev Eukaryot Gene Expr 2014; 24 : 225–247.
- Pagáčová E, Štefančíková L, Schmidt-Kaler F et al. Challenges and contradictions of metal nano-particle applications for radio-sensitivity enhancement in cancer therapy. Int J Mol Sci 2019; 20 : 588.
- Hofer M, Falk M, Komůrková D et al. Two new faces of amifostine: protector from DNA damage in normal cells and inhibitor of DNA repair in cancer cells. J Med Chem 2016; 59 : 3003–3017.
- Hofer M, Hoferová Z, Falk M. Pharmacological modulation of radiation damage. Does it exist a chance for other substances than hematopoietic growth factors and cytokines? Int J Mol Sci 2017; 18 : 1385.
- Hofer M, Hoferová Z, Falk M. Brief story on prostaglandins, inhibitors of their synthesis, hematopoiesis, and acute radiation syndrome. Molecules 2019; 24 : 4019.
- Meyer JL, Kavanagh BD, Purdy JA, Timmerman R (eds.). IMRT, IGRT, SBRT – advances in the treatment planning and delivery of radiotherapy. Front Radiat Ther Oncol 2007; 40.
- Gao J, Hu J, Guan X et al. Salvage carbon-ion radiation therapy for locoregionally recurrent head and neck malignancies. Sci Rep 2019; 9 : 4259.
- Wang H, Jiang H, Van De Gucht M, De Ridder M. Hypoxic radioresistance: can ROS be the key to overcome it? Cancers (Basel) 2019; 11 : 112.
- Brenner DJ. Proton radiotherapy: the good, the bad, and the uncertain. Oncology (Williston Park) 2012; 26 : 168241.
- Chen YH, Lu HI, Chien CY et al. Efficacy of different chemotherapy regimens in patients with locally advanced synchronous esophageal and head/neck squamous cell carcinoma receiving curative concurrent chemoradiotherapy. J Clin Med 2020; 9 : 197.
- Bossi P, Resteghini C, Paielli N et al. Prognostic and predictive value of EGFR in head and neck squamous cell carcinoma. Oncotarget 2016; 7(45): 74362–74379.
- Forster MD, Devlin MJ. Immune checkpoint inhibition in head and neck cancer. Front Oncol 2018; 8 : 310.
- Dandekar M, D’Cruz A. Organ preservation strategies: review of literature and their applicability in developing nations. South Asian J Cancer 2014; 3 : 147–150.
- Trivedi NP, Swaminathan DK, Thankappan K et al. Comparison of quality of life in advanced laryngeal cancer patients after concurrent chemoradiotherapy vs total laryngectomy. Otolaryngol Head Neck Surg. 2008; 139 : 702–707.
- Hutcheson KA, Lewin JS. Functional outcomes after chemoradiotherapy of laryngeal and pharyngeal cancers. Curr Oncol Rep. 2012; 14 : 158–165.
- Tang Z-X, Gong J-L, Wang Y-H et al. Efficacy comparison between primary total laryngectomy and nonsurgical organ-preservation strategies in treatment of advanced stage laryngeal cancer: a meta-analysis. Medicine 2018; 97: e10625.
- Binková H, Horáková Z, Tóthová E, Kostřica R. Organ preservation protocol in oropharyngeal cancer. Otorinolaryngol Foniatr 2010; 59 : 114–121.
- Horáková Z, Binková H, Tóthová E. Results of surgical and nonsurgical treatment in patients with laryngeal cancer. Otorinolaryngol Foniatr 2010; 59 : 107–113.
- Binková H, Šmardová J, Krpenský A, Kšicová K. Prognóza nádorů hlavy a krku se zaměřením na nádorový supresor p53. Otorinolaryngologie a foniatrie 2004; 53 : 189–195.
- Jajodia A, Aggarwal D, Chaturvedi AK et al. Value of diffusion MR imaging in differentiation of recurrent head and neck malignancies from post treatment changes. Oral Oncol 2019; 96 : 89–96.
- de Ridder M, Gouw ZAR, Navran A et al. FDG-PET/CT improves detection of residual disease and reduces the need for examination under anaesthesia in oropharyngeal cancer patients treated with (chemo-)radiation. Eur Arch Otorhinolaryngol. 2019; 276 : 1447–1455.
- Brierley J, Gospodarowicz MK, Wittekind C et al. TNM: klasifikace zhoubných novotvarů. Grada, Praha, 2020.
- Bohlen M, Busch C-J, Sehner S et al. Tumor volume as a predictive parameter in the sequential therapy (induction chemotherapy) of head and neck squamous cell carcinomas. Eur Arch Otorhinolaryngol 2019; 276 : 1183–1189.
- Gurín D, Slávik M, Shatokhina T et al. Současný pohled na HPV asociované karcinomy orofaryngu a roli p16 jako surogátního markeru high-risk HPV. Klinická onkologie 2019; 32 : 252–260.
- Tumban EA. Current update on human papillomavirus-associated head and neck cancers. Viruses 2019; 11 : 922.
- Wolf GT. Options for preserving the larynx in patients with advanced laryngeal and hypopharyngeal cancer. Ear Nose Throat J 2001; 80 : 897–901.
- Chaput A, Calais J, Robin P et al. Correlation between fluorodeoxyglucose hotspots on pretreatment positron emission tomography/CT and preferential sites of local relapse after chemoradiotherapy for head and neck squamous cell carcinoma. Head Neck 2017; 39 : 1155–1165.
- Polverini PJ, Lingen MW. A history of innovations in the diagnosis and treatment of oral and head and neck cancer. J Dent Res 2019; 98 : 489–497.
- Schulz A, Meyer F, Dubrovska A, Borgmann K. Cancer stem cells and radioresistance: DNA repair and beyond. Cancers 2019; 11 : 862.
- You GR, Cheng AJ, Lee LY et al. Prognostic signature associated with radioresistance in head and neck cancer via transcriptomic and bioinformatic analyses. BMC Cancer 2019; 19 : 64.
- Raudenská M, Svobodová M, Gumulec J et al. Význam fibroblastů asociovaných s nádorem při patogenezi karcinomů v oblasti hlavy a krku. Klinická onkologie 2020; 33 : 39–48.
- Nickson CM, Moori P, Carter RJ et al. Misregulation of DNA damage repair pathways in HPV-positive head and neck squamous cell carcinoma contributes to cellular radiosensitivity. Oncotarget 2017; 8 : 29963–29975.
- Rittich B, Španová A, Falk M et al. Cleavage of double stranded plasmid DNA by lanthanide complexes. J Chromatogr B Analyt Technol Biomed Life Sci 2004; 800 : 169–173.
- Falk M, Lukášová E, Kozubek S. Higher-order chromatin structure in DSB induction, repair and misrepair. Mutat Res 2010; 704 : 88–100.
- Svobodová M, Raudenská M, Gumulec J et al. Establishment of oral squamous cell carcinoma cell line and magnetic bead-based isolation and characterization of its CD90/ CD44 subpopulations. Oncotarget 2017; 8 : 66254–66269.
- Falk M, Falková I, Kopečná O et al. Chromatin architecture changes and DNA replication fork collapse are critical features in cryopreserved cells that are differentially controlled by cryoprotectants. Sci Rep 2018; 8 : 14694.
- Bobková E, Depeš D, Lee JH et al. Recruitment of 53BP1 proteins for DNA repair and persistence of repair clusters differ for cell types as detected by single molecule localization microscopy. Int J Mol Sci 2018; 19 : 3713.
- Foy J-P, Bazire L, Ortiz-Cuaran S et al. A 13-gene expression-based radioresistance score highlights the heterogeneity in the response to radiation therapy across HPV-negative HNSCC molecular subtypes. BMC Medicine 2017; 15 : 165.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- Klíčové momenty v historii československé radiobiologie
- Biologické účinky ionizujícího záření
- Moderní trendy v radioterapii
- Reparace DNA v buňkách nádorů hlavy a krku a možnosti využití monitorování tohoto procesu pro odhad radiorezistence jednotlivých nádorů a výběr optimální primární léčby
- Trendy ve farmakologické stimulaci regenerace ionizujícím zářením poškozeného savčího organismu
- Biologická dozimetrie a moderní (-omické) metody
- Pokroky ve výzkumu poškození a reparace DNA v buňkách vystavených různým druhům ionizujícího záření v éře superrozlišovací optické mikroskopie
- Principy a výhledy vakcinace proti viru SARS-CoV-2
- Stáří není nemoc: Vývoj hladiny ochranných protilátek proti koronaviru SARS-CoV-2 u seniorů z Domova Břevnice
- Úvodem
- Editorial
- Roční období, vitamin D a COVID-19
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Principy a výhledy vakcinace proti viru SARS-CoV-2
- Roční období, vitamin D a COVID-19
- Stáří není nemoc: Vývoj hladiny ochranných protilátek proti koronaviru SARS-CoV-2 u seniorů z Domova Břevnice
- Biologické účinky ionizujícího záření
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

