-
Medical journals
- Career
Role single-operator cholangioskopie (SpyGlass) v intraoperační diagnostice intraduktálního šíření cholangiokarcinomu – pilotní studie
Authors: Jan Hajer 1; Lukáš Havlůj 2; Adam Whitley 2; Martin Oliverius 2; Robert Gürlich 2
Authors‘ workplace: 2. interní klinika 3. LF UK a FN Královské Vinohrady, Praha 1; Chirurgická klinika 3. LF UK a FN Královské Vinohrady, Praha 2
Published in: Čas. Lék. čes. 2019; 158: 68-72
Category: Original Articles
Overview
Cholangiokarcinom je poměrně vzácný vysoce fatální novotvar vycházející z biliárního epitelu. Jedinou potenciálně kurabilní možností léčby je radikální chirurgické řešení. Cílem naší práce bylo zhodnocení proveditelnosti a bezpečnosti intraoperační endoskopické retrográdní cholangiopankreatikografie (ERCP) a přímé cholangioskopie (SpyGlass) k posouzení intraduktální hranice šíření cholangiokarcinomu.
Studie probíhala od listopadu 2015 do ledna 2018. Do souboru byli zařazeni pacienti s histologicky verifikovaným cholangiokarcinomem, na základě dostupných vyšetření byla multidisciplinárním týmem posouzena resekabilita nádoru. V případě indikace k chirurgickému výkonu jsme u všech pacientů peroperačně provedli ERCP s cholangioskopií SpyGlass a pomocí „diafanoskopie“. Resekabilita byla posouzena na základě těchto vyšetření a peroperačního chirurgického nálezu. Vlastní resekční výkon jsme provedli pouze u 2 z celkového počtu 14 pacientů, ostatní byli indikováni k implantaci SEMS (samoexpandibilního metalického stentu) v rámci ERCP provedené na operačním sále. Pro validizaci cholangioskopických nálezů jsme použili vlastní kritéria vycházející jak z Monackých, tak i dalších kritérií. Nálezy jsme rozdělili dle přítomnosti či nepřítomnosti ulcerace, prominujících polypózních hmot, patologické vaskularizace (4 typy), otlakového defektu s koagulem v přítomnosti předchozí implantace stentu, papilomatózních změn a barevných změn sliznice.
Z celkového počtu 14 pacientů byla pouze u dvou indikovaná resekce, která byla v obou případech R0. Ostatní pacienti byli na základě shodného neresekabilního nálezu při cholangioskopii a laparotomii intraoperačně indikovaní k paliativní implantaci SEMS.
Ve studii jsme prokázali technickou proveditelnost a bezpečnost přímé peroperační cholangioskopie. Naše výsledky ukazují, že přímá peroperační cholangioskopie je jednou z metod, které mohou přispět k přesnějšímu určení hranice šíření nádoru.
Klíčová slova:
cholangiogenní karcinom – přímá cholangioskopie – ERCP – intraduktální ultrasonografie
ÚVOD
Zúžení nebo obstrukce žlučových cest může být různé etiologie. Nejběžnější jsou žlučové a pankreatické konkrementy, zánětlivá onemocnění žlučníku, nádory pankreatu, chronická pankreatitida, zánětlivá onemocnění jako primární sklerotizující cholangitida a mnohé další.
Převážná většina biliárních stenóz je maligní etiologie, a to především na podkladě pankreatického duktálního adenokarcinomu a cholangiokarcinomu. Na druhou stranu studie prokazují, že až 30 % biliárních stenóz má benigní etiologii (1). Zásadním problémem je pak správná předoperační diagnostika a staging – z chirurgické literatury vyplývá, že přibližně 15–24 % pacientů podstupujících chirurgickou resekci pro podezření na biliární malignitu má benigní etiologii, jelikož doposud neexistují žádné klinické ani radiologické znaky, které spolehlivě odliší benigní od maligních biliárních striktur (2).
Endoskopická retrográdní cholangiopankreatografie (ERCP) je metoda používaná k diagnostice patologií biliárního a pankreatického systému. Provádí se pod rentgenovou kontrolou pomocí duodenoskopu (endoskopu s laterální optikou určeného k vyšetření dvanáctníku). Žlučové cesty a pankreatický vývod se plní kontrastní látkou, což umožňuje jejich zobrazení. ERCP je modalita jak diagnostická (umožňuje diagnostiku stenóz ve žlučových cestách), tak i terapeutická (umožňuje terapii základního onemocnění, např. litiázy pomocí litotrypse, nebo paliativní léčbu – terapii maligních stenóz žlučového stromu pomocí implantace stentu) (3).
Jako každá z endoskopických technik má i ERCP své limity. Jedná se především o nemožnost přímé vizualizace vývodných žlučových cest. Toto zobrazení je podstatné například v případech, kdy není známá etiologie biliárních stenóz, nebo při objemné komplikované litiáze, např. intrahepatálně lokalizované, což může vyžadovat elektrohydraulickou či laserovou litotrypsi. V těchto případech, kdy je nutná přímá vizualizace žlučovodů, se používá cholangioskopie. Pro provedení standardní cholangioskopie je nutné pracovním kanálem duodenoskopu zavést ultratenký endoskop, kterým pak přímo vizualizujeme žlučové cesty.
V současnosti je cholangioskopie již zavedenou metodou v diagnostice a léčbě onemocnění žlučových cest. V poslední době dochází k jejímu výraznému rozvoji především díky možnostem nových technologií. Historie přímé endoskopické vizualizace žlučových cest sahá do roku 1941, kdy byl vyvinut první optický choledochoskop pro peroperační přístup. Perorální přístup byl poprvé popsán v roce 1976, zpočátku přes prototyp duodenoskopu, jehož pracovním kanálem byl následně zaveden ultratenký endoskop do choledochu. Tento systém, který vyžaduje součinnost dvou endoskopistů, byl později znám jako mother-baby. Využití této cholangioskopické techniky bylo výrazně omezené kvůli vysokým pořizovacím nákladům, křehkosti a nutné kooperaci dvou zkušených endoskopistů. Od poloviny 80. let došlo k jejímu postupnému rozšíření, ale cholangioskopie byla stále okrajovou metodou prováděnou pouze ve vysoce specializovaných centrech (4).
V roce 2007 byla zavedena první jednooperátorová cholangioskopická platforma SpyGlass, což vedlo k dramatickému rozvoji a rozšíření možností využití této metody. V roce 2014 byla představena druhá generace cholangioskopů s digitálním obrazem s výrazně (4×) vyšší kvalitou obrazu, ergonomií, stabilitou a větší šíří pracovního kanálu. Popsaný vývoj obnovil zájem o tuto metodu. Postupně dochází k výraznému rozšíření indikací a následných terapeutických postupů, např. litotrypse, extrakce stentů, navigované drenáže, diagnostiky striktur, ablativní techniky k odstranění malignit (RFA) a řady dalších (5).
CHOLANGIOSKOPIE A JEJÍ VÝZNAM PŘI OVLIVNĚNÍ STRATEGIE CHIRURGICKÉHO VÝKONU
Hlavním přínosem cholangioskopie pro následnou strategii chirurgického výkonu je přesné určení lokalizace patologie ve vztahu k průběhu choledochu, jeho intrapankreatické části, vztah k odstupu cystiku, délce stenózy nebo infiltraci a jejímu typu. Dalším příkladem přínosu cholangioskopie je určení rozsahu postižení žlučovodu papilomatózou, což hraje významnou roli pro plánování rozsahu resekce. V případě endoskopicky neřešitelných benigních ampulárních neoplazií hraje cholangioskopický nález roli v přesném rozlišení rozsahu léze a v korelaci s EUS ovlivňuje následnou strategii a proveditelnost lokálního chirurgického výkonu (chirurgické excize papily a reinzerce pankreatického vývodu a žlučovodu).
Z našeho pohledu spočívá nejvýznamnější přínos cholangioskopie ve zhodnocení hilových tumorů (Klatskinova tumoru). V tomto případě je zásadní posouzení vztahu tumoru k junkci hepatiků. Pokud patologická léze dosahuje k větvení segmentálních žlučovodů obou hepatiků, je z důvodů perineurálního a periduktálního šíření prakticky vyloučena možnost radikálního (R0) výkonu, a to zejména při dosahu tumoru na pravý žlučovod. V případě postižení pravého žlučovodu je zásadní přesné posouzení rozsahu tumoru ve vztahu k levému žlučovodu. Pokud je dostatečný funkční objem levého laloku (FLRV), je možné uvažovat o radikálním řešení – pravostranné či rozšířené pravostranné hepatektomii s resekcí extrahepatálních žlučových cest, lymfadenektomií a rekonstrukcí na levý žlučovod hepatikojejunoanastomózou. V případech nedostatečného FLRV lze provést etapový výkon s využitím embolizace pravé portální žíly.
Makroskopické posouzení rozsahu tumoru, jeho vztahu k junkci hepatiků a zhodnocení charakteru růstu může v kombinaci s dalšími metodami (ERCP, CTAG, MRI, EUS) pomoci zvolit vhodnou chirurgickou taktiku. Vzhledem k perineurálnímu a periduktálnímu šíření cholangiocelulárního karcinomu je však nutno počítat s tím, že mikroskopická infiltrace nádorem je obvykle významně rozsáhlejší než makroskopický nález (6, 7).
CÍLE PILOTNÍ STUDIE
Primárním cílem pilotní studie bylo zhodnocení proveditelnosti a bezpečnosti intraoperační ERCP a přímé cholangioskopie (SpyGlass) k posouzení intraduktální hranice šíření cholangiokarcinomu. Na základě provedené intraoperační cholangioskopie lze pomocí „diafanoskopie“, tj. prosvícením žlučovodu cholangioskopem a zevní palpací, která je vizualizována zevnitř žlučovodu, určit bezpečnou hranici resekční linie.
Sekundárním cílem bylo navržení cholangioskopické klasifikace pro validizaci jednoznačně maligních cholangioskopických nálezů vzhledem k tomu, že dostupné klasifikace nedosáhly obecného použití.
METODIKA A PRŮBĚH
Pilotní studie probíhala od listopadu 2015 do ledna 2018 ve Fakultní nemocnici Královské Vinohrady. Do studie byli zařazeni pacienti s histologicky verifikovaným cholangiokarcinomem. Na základě dostupných vyšetření (ERCP, CTAG, MRI, EUS) byla multidisciplinárním týmem posuzována resekabilita nádoru. V případech indikace k chirurgického výkonu jsme u těchto pacientů peroperačně provedli ERCP s cholangioskopií SpyGlass a pomocí „diafanoskopie“ a palpace operatérem byla zhodnocena resekabilita nálezu. Dále byla provedena peroperační histologie resekční linie společného hepatiku. Pacienti, u kterých nebylo možné provést resekci, byli indikovaní k implantaci samoexpandibilního metalického stentu (SEMS) v rámci ERCP provedené přímo na operačním sále.
SPECIFIKACE SYSTÉMU SPYGLASS DS (BOSTON SCIENTIFIC)
SpyGlass DS se skládá ze zařízení SpyScope DS a SpyGlass DS Digital Controller. Specifikace pro SpyGlass DS jsou následující: zorné pole 120°; hloubka výhledu: vnější průměr katétru 3,46 mm (flexibilního konce) a 3,56 mm (vlastního katétru); délka 2140 mm; průměr pracovního kanálu 1,2 mm.
Klasifikace maligních nálezů
Pro potřeby dalších studií a pro klinickou praxi je nezbytná terminologická standardizace, jak ji známe z jiných oblastí digestivní endoskopie. Dosud bylo na tomto poli učiněno několik pokusů, ale zatím nebylo dosaženo žádného společného konsenzu. Podle tzv. Monackých kritérií Sethi et al. rozlišili celkem 8 cholangioskopických morfologických znaků a dosáhli diagnostické přesnosti pro odlišení benigní a maligní etiologie stenózy v 70 % případů. V multivariační analýze byly s maligní etiologií signifikantně asociovány pouze ulcerace (poměr šancí [OR] 10,3; p = 0,01) a papilární výběžky (OR 7,2; p = 0,02). Jiné práce zdůrazňují vysokou specificitu abnormální vaskularizace, především přítomnosti spirálovitých cév (později prokázaných rovněž u IgG4 cholangitidy) (8–11).
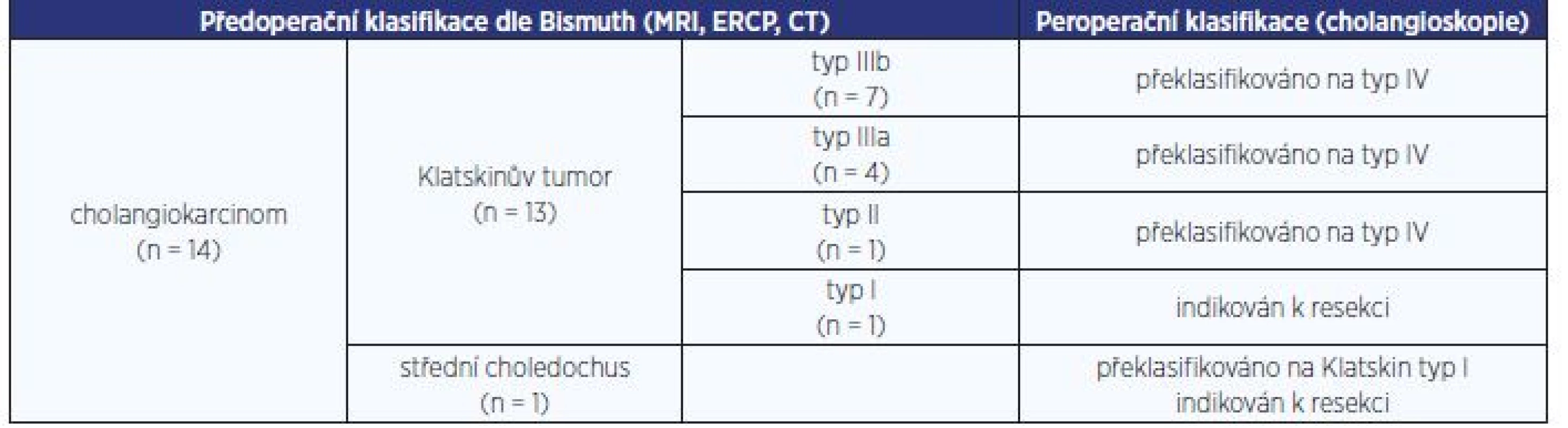
Vzhledem k tomu, že dostupné klasifikace nedosáhly obecného použití, pokusili jsme se navrhnout vlastní klasifikaci pro validizaci jednoznačně maligních cholangioskopických nálezů. Základně rozdělujeme malignity podle přítomnosti či nepřítomnosti ulcerace (ulcerující typ) a dále dle přítomnosti protrudujících mas s patologickou vaskularizací (prominující typ) (obr. 1). Rozsah postižení pak dokládáme subklasifikací patologické vaskularizace, kterou dělíme na 4 subtypy (obr. 2). V posuzování této patologické vaskularizace nás inspirovaly různé druhy pavoučích sítí a jejich základní klasifikace, která makroskopicky připomínala charakteristickou patologickou vaskularizaci u cholangiokarcinomu.
- Typ I – vychází z nepravidelných sítí snovaček (Theridiidae), přičemž vlákna sítě jsou napnuta chaoticky různými směry.
- Typ II – vychází z charakteru sítí plachetnatek (Linyphiidae), základem jejich sítě je vodorovná pavučinová hustě utkaná plachetka (sheet).
- Typ III – je inspirován nálevkovitým tvarem sítí pokoutníků (Agelenidae) nebo sklípkanů (funnel-web spiders).
- Typ IV – kruhová síť vytvářená např. křižáky (Araneidae).
Dále je nutné brát v potaz vliv předchozí stentáže na morfologii stenózy, který popisujeme ve shodě s jinými autory jako adherující koagulum a nekrózu v místě kontaktu stentu se stěnou žlučovodu (obr. 3) (12, 13).
Image 1. Klasifikace maligních nálezů: A – prominující typ; B – ulcerující typ 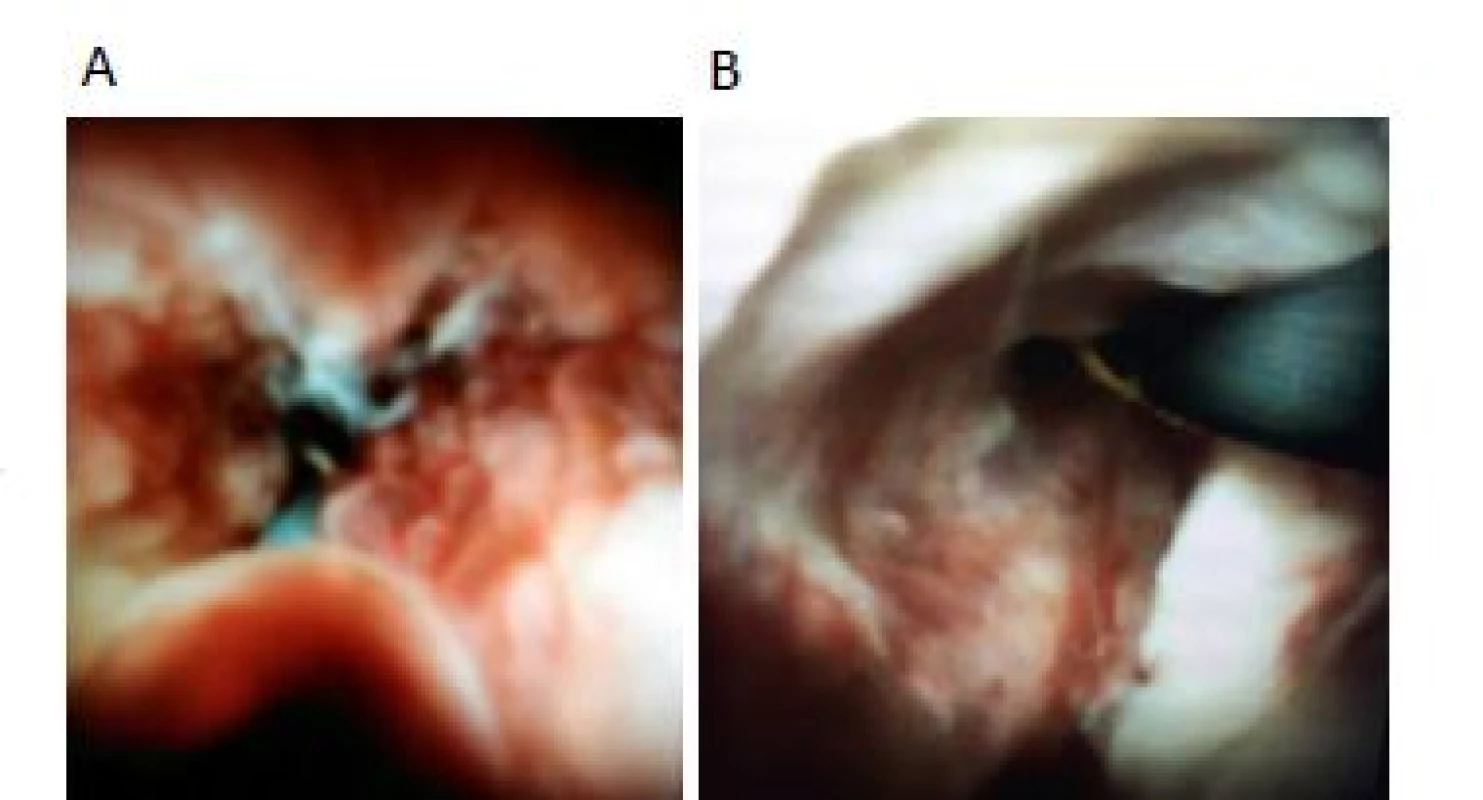
Image 2. Klasifikace maligních nálezů – patologická vaskularizace: A – typ I; B – typ II; C – typ III; D – typ IV 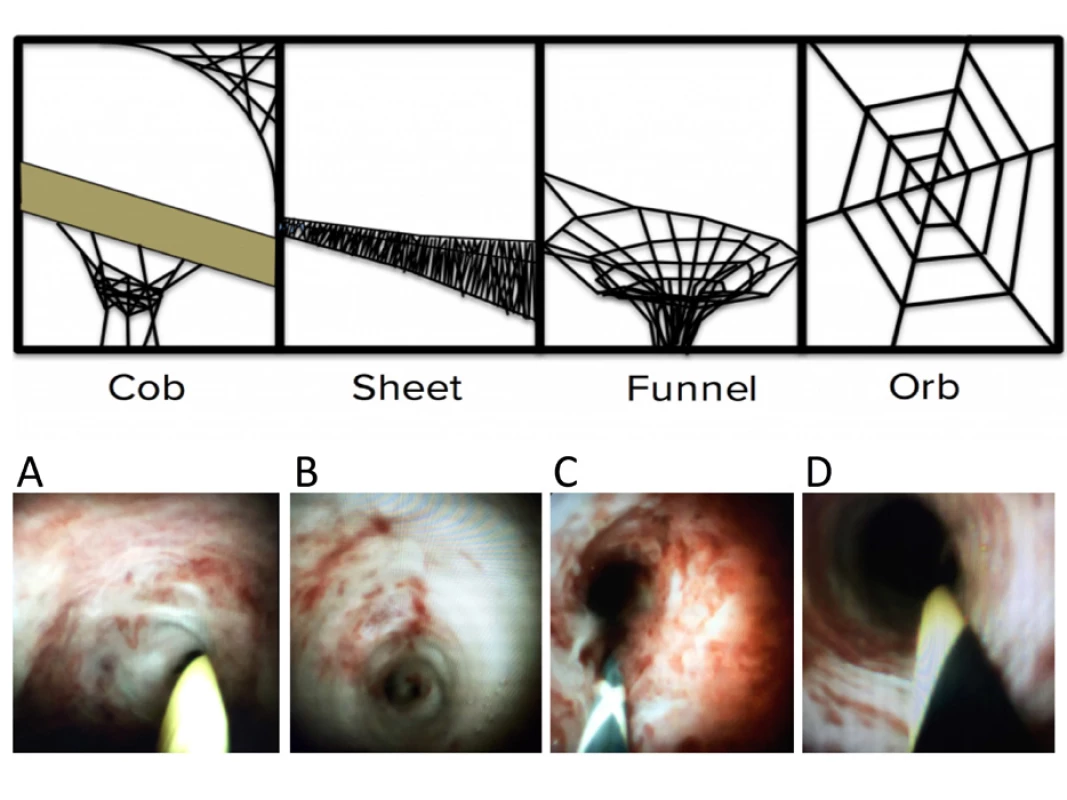
Image 3. Normální cholangioskopický nález: A – normální nález; B – adeherující koagulum a nekróza po předchozí stentáži 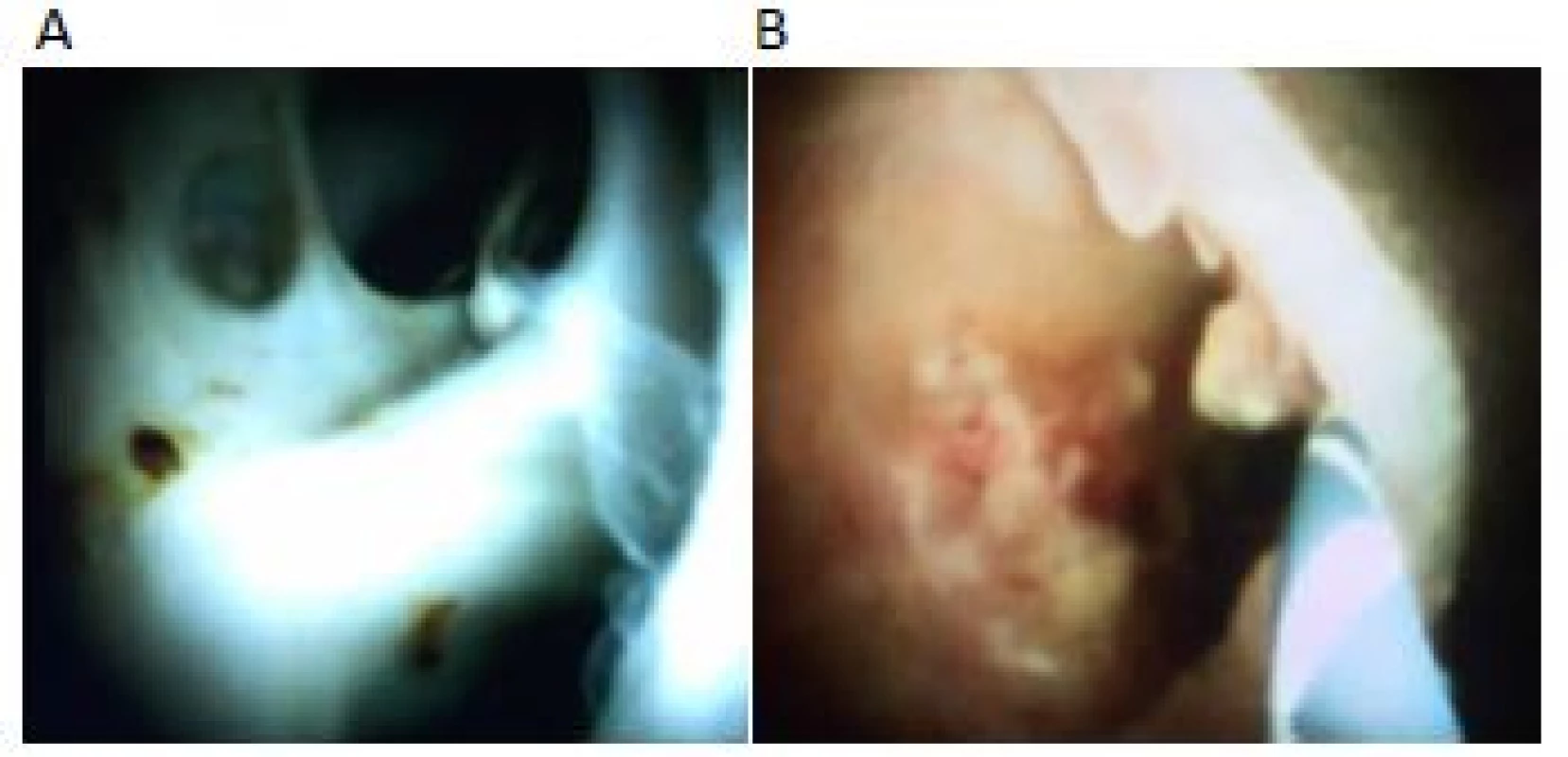
VÝSLEDKY
Do studie bylo zařazeno 14 pacientů s histologicky verifikovaným cholangiogenním karcinomem. Na základě dostupných vyšetřeních (ERCP, MRCP) byli pacienti rozděleni dle Bismuthovy klasifikace na jednotlivé typy. Ve skupině typu IIIb bylo 7 pacientů, IIIa 4 pacienti, II 1 pacient a typ I byl rovněž nalezen u 1 pacienta. Nález dalšího pacienta byl peroperačně klasifikován jako cholangiokarcinom středního choledochu (tab. 1). U všech pacientů byla provedena peroperační cholangioskopie, která ve všech případech proběhla úspěšně, bez peroperačních či pooperačních komplikací.
V průběhu provedené intraoperační cholangioskopie byly nálezy většiny pacientů překlasifikovány na typ IV. Pacient s nálezem cholangiokarcinomu středního choledochu byl překlasifikován na typ I. Pouze u jednoho pacienta se předoperační a intraoperační staging shodovaly (tab. 1, obr. 4).
Image 4. Rozdíl ve výsledku intraoperačního a předoperačního stagingu: A – předoperační ERCP; B – předoperační MRCP; C – intraoperační cholangioskopie s postižením odstupu segmentálních žlučovodů; D – implantace SEMS v rámci peroperačního ERCP 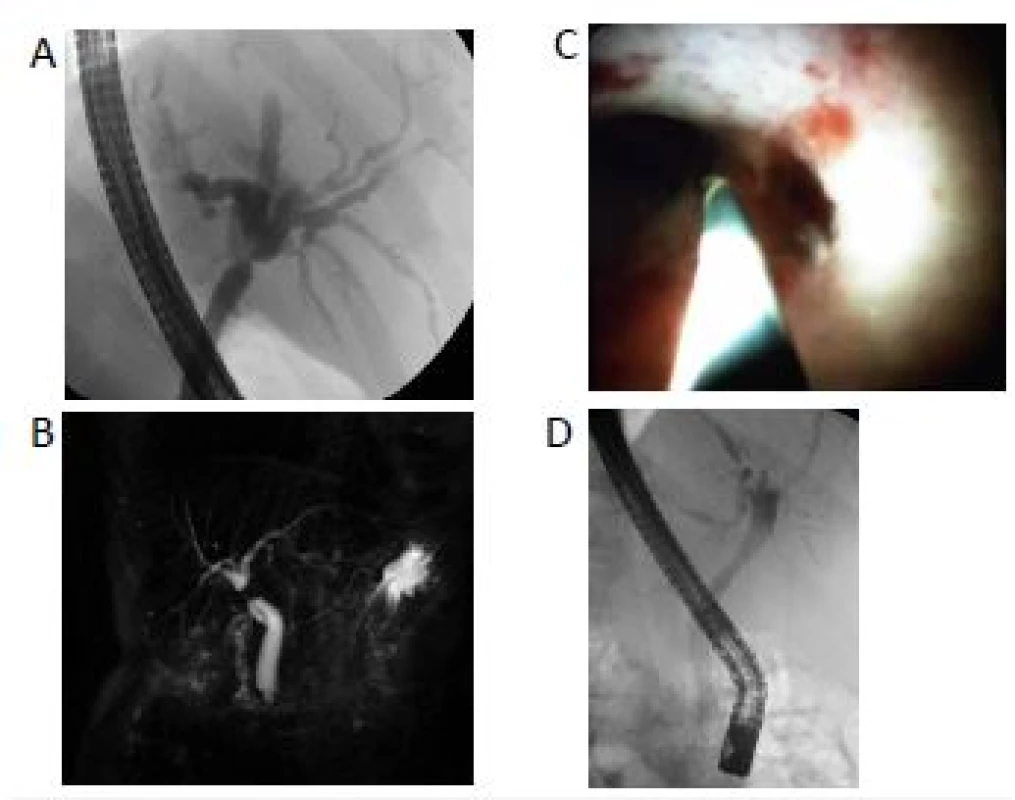
U dvou pacientů byla indikována resekce s následnou hepatikojejunoanastomózou. Negativita resekční linie byla ověřena peroperační histologií. Definitivní výsledek histologie prokázal u obou pacientů resekci R0. Ostatní byli na základě shodného neresekabilního nálezu při cholangioskopii a laparotomii intraoperačně indikováni k paliativní implantaci SEMS.
DISKUSE
Touto pilotní studií jsme prokázali technickou proveditelnost a bezpečnost přímé intraoperační cholangioskopie. V průběhu vlastního operačního výkonu jsme nezaznamenali žádnou komplikaci, stejně jako v pooperačním období. Je však nutné upozornit na značnou technickou náročnost této metody, kterou zvyšuje skutečnost, že se provádí v poloze na zádech při celkové anestezii pacienta s otevřením břišní dutiny. Dalším problémem je náročnost na technické vybavení a personální obsazení, včetně rtg zařízení na operačním sále a nutnosti zajistit přítomnost dvou endoskopických věží (ERCP, cholangioskopie).
Z výsledků jednoznačně vyplývá, že přímá intraoperační cholangioskopie je jednou z metod, která může přispět k přesnějšímu určení hranice šíření nádoru. Dále jsme na našem limitovaném souboru pacientů prokázali, že předoperační diagnostika obvykle neodpovídá peroperačnímu cholangioskopickému nálezu. Pouze u jednoho pacienta z celého souboru, tj. u méně než desetiny (7,14 %), se shodoval předoperační a intraoperační staging. U některých intraoperačních nálezů byla překvapením progrese, což může být dáno odlišným cholangioskopickým nálezem, na němž je patrné intraduktální šíření nádoru bez toho, aby vedlo k viditelné stenóze duktu, což je patrné prostřednictvím ostatních zobrazovacích metod (ERCP, MRCP). Dále bude zřejmě hrát roli grading tumoru. U pacienta překlasifikovaného z typu II na typ IV byl grading G3 a nejdelší doba (5 týdnů) od stanovení diagnózy do vlastního operačního řešení. Zbytek souboru byl operován v rozmezí 14–24 dnů od stanovení diagnózy.
Vzhledem k absenci jednotné klasifikace jsme se pokusili o vytvoření klasifikace cholangioskopických nálezů maligních struktur vycházející z podobnosti charakteristických tvarů a seskupení cévních struktur u maligních nálezů s pavoučími sítěmi. Klasifikace vychází z našich několikaletých zkušeností s prováděním diagnostických cholangioskopií, přičemž makroskopické nálezy byly ověřovány biopsiemi pod cholangioskopickou kontrolou s následnou histologickou verifikací.
Jako hlavní slabinu cholangioskopie vnímáme nemožnost vizualizace periduktálního a extramurálního šíření nádoru. Řešením tohoto problému může být intraduktální ultrasonografie (IDUS), pomocí které můžeme zobrazit rozsah infiltrace ve vztahu k okolním strukturám. IDUS a 3D-IDUS jsou spolehlivou metodou pro hodnocení cholangiokarcinomu a jeho přesného stagingu, posouzení šíření nádoru a jeho vztahu k okolním orgánovým strukturám (14–16).
Nález je suspektní, jestliže IDUS vykazuje hypoechogenní infiltraci s nepravidelnými okraji šířícími se do okolní tkáně. Vnitřní hypoechogenní vrstva US obrazu odpovídá nejen fibromuskulární vrstvě, ale také části perimuskulární pojivové tkáně, což může být obtížné při hodnocení invaze nádoru perimuskulárně či fibromuskulárně. Vymizení hyperechogenní vrstvy mezi nádorem a cévou je považováno za pozitivní příznak cévní invaze. Při použití tohoto kritéria dosahovala přesnost IDUS při hodnocení invaze nádorů na pravou jaterní tepnu a portální žílu 93–100 %. IDUS je však s ohledem na detekci metastáz lymfatických uzlin signifikantně méně citlivý než konvenční endoskopická ultrasonografie (EUS) (16–19).
Pomocí 3D-IDUS je možné identifikovat zejména invazi do portální žíly a pankreatu, a to lépe než při využití jiných zobrazovacích metod jako CT či angiografie (11). IDUS žlučovodu umožňuje vynikající zobrazení žlučovodů a periduktálních struktur a může být provedeno v jedné době v rámci ERCP a cholangioskopie. Tato technika se v současnosti používá k diferenciální diagnostice benigních a maligních chorob žlučníku a žlučových cest. Jako jeho největší výhodu ovšem vnímáme možnost hodnocení longitudinálního šíření cholangiokarcinomu. Kombinace cholangioskopie a IDUS by mohla zásadním způsobem zpřesnit předoperační, eventuálně intraoperační staging cholangiokarcinomu.
Poděkování
Práce byla podpořena výzkumným projektem Univerzity Karlovy PROGRES Q28 (Onkologie).
Seznam zkratek
3D trojrozměrný
CT výpočetní tomografie
CTAG CT angiografie
ERCP endoskopická retrográdní cholangiopankreatikografie
EUS endoskopická ultrasonografie
FLRV objem ponechaného jaterního parenchymu
IDUS intraduktální ultrasonografie
MRCP cholangiopankreatikografie provedená na magnetické rezonanci
MRI magnetická rezonance
OR poměr šancí
SEMS samoexpandibilní metalický stent
Adresa pro korespondenci:
MUDr. Jan Hajer, Ph.D.
2. interní klinika 3. LF UK a FNKV
Šrobárova 50, 100 34 Praha 10
Tel.: 267 162 719
e-mail: jan.hajer@fnkv.cz
Sources
- Singh A, Gelrud A, Agarwal B. Biliary strictures: diagnostic considerations and approach. Gastroenterology report 2014; 3(1): 22–31.
- Wakai T, Shirai Y, Sakata J et al. Clinicopathological features of benign biliary strictures masquerading as biliary malignancy. Am Surg 2012; 78 : 1388–1391.
- Rauws EAJ, Kloek JJ, Gouma DJ, Van Gulik TM. Staging of cholangiocarcinoma: the role of endoscopy. HPB 2008; 10(2): 110–112.
- Voaklander R, Kim E, Brown WH et al. An Overview of the evolution of direct cholangioscopy techniques for diagnosis and therapy. Gastroenterol Hepatol 2016; 12(7): 433–437.
- Franzini TA, Moura RN, de Moura EG. Advances in therapeutic cholangioscopy. Gastroenterol Res Pract 2016 : 5249152.
- Ogawa T, Ito K, Koshita S et al. Usefulness of cholangioscopic-guided mapping biopsy using SpyGlass DS for preoperative evaluation of extrahepatic cholangiocarcinoma: a pilot study. Endosc Int Open 2018; 6(2): e199–e204.
- Vítek P, Urban O, Hucl T a kol. Cholangiopankreatikoskopie – doporučený postup České gastroenterologické společnosti ČLS JEP. Gastroenterologie a hepatologie 2018; 72(3): 199–204.
- Sethi A, Shah R, Itoi T et al. Defining imaging criteria for indeterminate biliary strictures utilizing video cholangioscopy: the Monaco classification. Gastrointest Endosc 2015; 81(Suppl. 5): AB188–AB189.
- Siddiqui AA, Mehendiratta V, Jackson W et al. Identification of cholangiocarcinoma by using the Spyglass Spyscope system for peroral cholangioscopy and biopsy collection. Clin Gastroenterol Hepatol 2012; 10 : 466–471.
- Urban O, Fojtík P, Mikolajek O, Arnelo U. Renesance cholangiopankreatoskopie a nové možnosti intraduktální endoskopické terapie. Gastroent Hepatol 2016; 70 : 203–207.
- Moon JH, Terheggen G, Choi HJ et al. Peroral cholangioscopy: diagnostic and therapeutic applications. Gastroenterology 2013; 144 : 276–228.
- Meister T, Heinzow HS, Woestmeyer C et al. Intraductal ultrasound substantiates diagnostics of bile duct strictures of uncertain etiology. World J Gastroenterol 2013; 19(6): 874–881.
- Nakazawa T, Naitoh I, Hayashi K. Usefulness of intraductal ultrasonography in the diagnosis of cholangiocarcinoma and IgG4-related sclerosing cholangitis. Clin Endosc 2012; 45(3): 331–336.
- Urban O, Arnelo U, Fojtík P et al. Cholangiopankreatikoskopie pomocí SpyGlass direct visualisation system: seznámení s metodou a první vlastní zkušenosti. Gastroenterologie a hepatologie 2013; 67(2): 124–126.
- Parsi MA. Direct peroral cholangioscopy. World J Gastrointest Endosc 2014; 6(1): 1–5.
- Tamada K, Ido K., Ueno N., et al. Assessment of portal vein invasion by bile duct cancer using intraductal ultrasonography. Endoscopy 1995; 27: 573–578.
- Van Beers BE. Diagnosis of cholangiocarcinoma. HPB 2008; 10(2): 87–93.
- Sun B, Hu B. The role of intraductal ultrasonography in pancreatobilliary diseases. Endosc Ultrasound 2016; 5 : 291–299.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

2019 Issue 2-
All articles in this issue
- Epidemiologie zhoubných nádorů žlučníku a žlučových cest v České republice
- Patologie cholangiocelulárního karcinomu
- Molekulární patologie cholangiocelulárních nádorů
- Role single-operator cholangioskopie (SpyGlass) v intraoperační diagnostice intraduktálního šíření cholangiokarcinomu – pilotní studie
- Chirurgická léčba cholangiocelulárního karcinomu
- Současná úloha radioterapie a systémové terapie v multidisciplinární léčbě cholangiokarcinomu
- Surveillance chronických neinfekčních nemocí
- Umělá inteligence a moderní informační a komunikační technologie vstupují do medicíny
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Chirurgická léčba cholangiocelulárního karcinomu
- Patologie cholangiocelulárního karcinomu
- Epidemiologie zhoubných nádorů žlučníku a žlučových cest v České republice
- Umělá inteligence a moderní informační a komunikační technologie vstupují do medicíny
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career