-
Medical journals
- Career
Patologie cholangiocelulárního karcinomu
Authors: Jan Hrudka 1; Martin Oliverius 2; Robert Gürlich 2
Authors‘ workplace: Ústav patologie 3. LF UK a FN Královské Vinohrady, Praha 1; Chirurgická klinika 3. LF UK a FN Královské Vinohrady, Praha 2
Published in: Čas. Lék. čes. 2019; 158: 57-63
Category: Review Article
Overview
Cholangiocelulární karcinom (CCC) je prognosticky nepříznivým zhoubným nádorem jater, jaterních i mimojaterních žlučovodů a žlučníku. Článek představuje shrnutí problematiky CCC z pohledu patologa; kromě klasického popisu makroskopické a mikroskopické morfologie se věnuje rozdělení CCC na intrahepatální (periferní) a hilový či extrahepatální subtyp, přičemž tyto typy nádorů mají odlišné morfologické a molekulární vlastnosti i rozdílnou prognózu, mj. s ohledem na rozdílné možnosti chirurgického odstranění. Hilový a extrahepatální CCC pak sdílejí biologické vlastnosti s duktálním adenokarcinomem pankreatu.
Článek dále obsahuje přehled různých typů prekancerózních lézí žlučových cest, představuje novinky v 8. vydání klasifikace TNM týkající se nádorů žlučových cest a shrnuje problematiku praxe histopatologické diagnostiky CCC včetně přehledu imunohistochemických metod a tématu peroperační histologické diagnosticky CCC ve zmraženém řezu.
Klíčová slova:
cholangiocelulární karcinom – intrahepatální – hilový – extrahepatální – patologie
ANATOMIE ŽLUČOVÉHO STROMU
Cholangiocelulární karcinom (CCC) může být podle klasifikace nádorů trávicího traktu WHO primární nádor jater či intrahepatálních žlučovodů (intrahepatální cholangiokarcinom) nebo se může vyskytovat ve žlučníku či extrahepatálních žlučových cestách. Žlučový strom můžeme anatomicky rozdělit na intrahepatální a extrahepatální žlučovody. Levý a pravý ductus hepaticus a jeho první až třetí větve nazýváme hilové a perihilární žlučovody. Intrahepatální žlučovody proximálně od obou hepatiků lze klasifikovat na intrahepatální velké a malé žlučovody. Velké jsou viditelné makroskopicky, sestávají z prvních až třetích větví hepatiků a obsahují ve své stěně peribiliární žlázky, které vyúsťují do lumen žlučovodů. Malé intrahepatální žlučovody jsou vidět jen mikroskopicky a zahrnují septální a interlobulární žlučovody. Septální žlučovody jsou obklopeny vrstvou vaziva a mají průměr >100 µm. Interlobulární žlučovody mají kalibr < 100 µm a jsou napojeny na duktuly. Duktuly neboli Heringovy kanálky jsou mikroskopické prostory na periferii portálního pole. Septální a interlobulární žlučovody probíhají spolu s arteriemi a jejich větvemi. Biliární trakt je vystlán jednovrstevným kubickým nebo cylindrickým epitelem (cholangiocyty), který má rozdílný mikroskopický vzhled podle kalibru žlučovodu: vysoký cylindrický hlenotvorný epitel nacházíme ve velkých žlučovodech, kubický epitel bez produkce hlenu můžeme najít v duktulech. Duktuly obsahují bipotentní hepatální progenitorové buňky, které mohou být prekurzorem cholangiocytu či hepatocytu.
ZÁKLADNÍ ROZDĚLENÍ CCC
Intrahepatální CCC je podle definice WHO z roku 2010 maligní nádor jater s diferenciací směrem k epitelu žlučovodů, který může vznikat ve kterékoliv části intrahepatálního žlučového stromu, od velkých žlučovodů včetně peribiliárních žlázek až po nejmenší duktuly. Intrahepatální CCC lze dále rozdělit na periferní CCC vznikající z malých intrahepatálních žlučovodů a hilový CCC vznikající z levého či pravého ductus hepaticus nebo v oblasti jejich junkce, známý též pod eponymním názvem Klatskinův tumor (1). Intrahepatální CCC je tedy definován cholangiocelulární morfologií a jaterní lokalizací, zatímco karcinom žlučníku a extrahepatálních žlučových cest je určený svou primární lokalizací. Mezi vzácné varianty intrahepatálního CCC podle klasifikace WHO patří dlaždicobuněčný, adenoskvamózní, mucinózní, světlobuněčný, mukoepidermoidní, sarkomatoidní a lymphoepithelioma-like karcinom a CCC z prstenčitých buněk (1).
Ve žlučníku a extrahepatálních žlučovodech je zdaleka nejčastější adenokarcinom biliárního typu (extrahepatální CCC), dále se zde vzácně může vyskytovat adenokarcinom gastrického či intestinálního typu, světlobuněčný adenokarcinom, mucinózní adenokarcinom, karcinom z prstenčitých buněk, adenoskvamózní karcinom, dlaždicobuněčný karcinom nebo nediferencovaný karcinom (2).
V literatuře lze najít řadu nejasností týkajících se klasifikace CCC v oblasti jaterního hilu, které jsou někdy klasifikovány jako intrahepatální a jindy jako extrahepatální nádory. Hilový intrahepatální CCC (Klatskinův tumor) nicméně sdílí morfologické, prognostické i molekulární znaky s extrahepatálním CCC (3) a také s duktálním adenokarcinomem pankreatu (4, 5). Naopak periferní intrahepatální CCC má podobné molekulární vlastnosti jako kombinovaný hepatocelulární-cholangiocelulární karcinom (5, 6).
Samostatnou kapitolou jsou prekancerózní a in situ léze, tedy biliární intraepitelové neoplazie (BiIN) a intraduktální papilární neoplazie žlučovodů (IPNB). Jde o prekurzorové léze extrahepatálního CCC i hilového intrahepatálního CCC, které jsou analogické obdobným lézím ve vývodech pankreatu (PanIN a IPMN).
MORFOLOGIE CCC
Periferní intrahepatální CCC se klinicky projevuje bolestmi břicha a váhovým úbytkem a dosahuje v době diagnózy často značné velikosti, zatímco hilové CCC či extrahepatální karcinomy se projevují obstrukčním ikterem již při menších rozměrech. Makroskopicky jde o tuhou až vysloveně tvrdou masu bílé až žlutavé či žlutohnědé barvy (obr. 1) (7).
Image 1. Sagitální řez játry, kdy byla značná část periferie jaterního parenchymu spotřebovaná bílým tuhým nádorem, dále jsou patrná dvě metastatická ložiska. Makroskopická fotografie z pitvy. 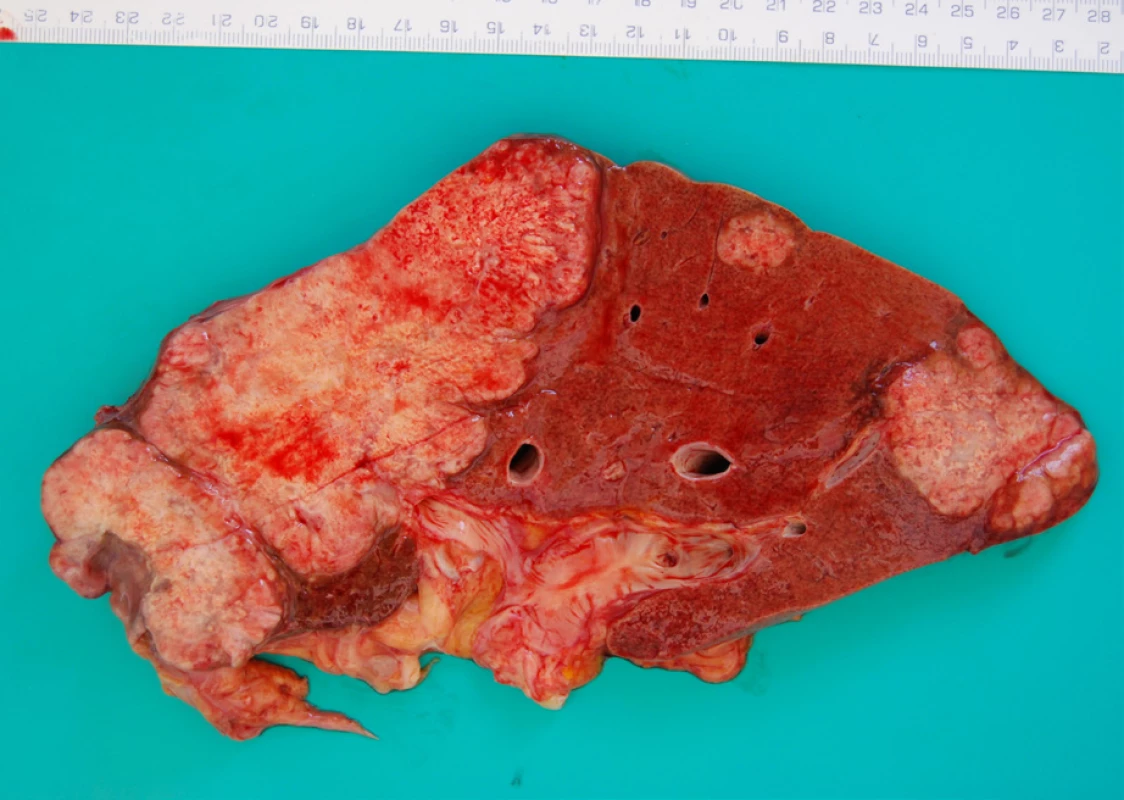
CCC se typicky šíří přímou invazí do okolních struktur s infiltrací lymfatických i krevních kapilár (8). Při pitvě nacházíme extrahepatální metastázy přibližně ve třech čtvrtinách případů CCC, přičemž nejčastějšími lokalizacemi metastáz jsou mízní uzliny, plíce, peritoneum, nadledviny, ledviny a kosti (8).
Hilový intrahepatální CCC i karcinom extrahepatálních žlučových cest má podobnou histomorfologii jako duktální adenokarcinom pankreatu. Jedná se o adenokarcinomy s dobře formovanými žlázkami se širokými luminy, které jsou vystlány kubickým či cylindrickým epitelem s nápadnými cytonukleárními atypiemi. Častá je dobrá diferenciace na architektonické úrovni, ale výrazná atypie jader (9). Žlázky jsou nezřídka obklopeny buněčným (desmoplastickým) stromatem s koncentricky uspořádanými kolagenními vlákny. Kromě popsané tubulární stavby můžeme najít také papilární či kribriformní architektoniku (obr. 2). Fokální nález pohárkových buněk je běžný, vzácněji vykazuje celý karcinom extrahepatálních žlučových cest morfologii intestinálního adenokarcinomu (10).
Image 2. Cholangiocelulární karcinom extrahepatálních žlučovodů s charakteristickou tubulární stavbou. Nádor je tvořen angulovanými žlázkami, které jsou vystlány jednovrstevným cylindrickým epitelem s hlenotvorbou a výraznými jadernými atypiemi. Ve stromatu je desmoplazie a četné leukocyty při peritumorózním zánětu. Histologický řez z chirurgického resekátu, hematoxylin-eozin, 20×. 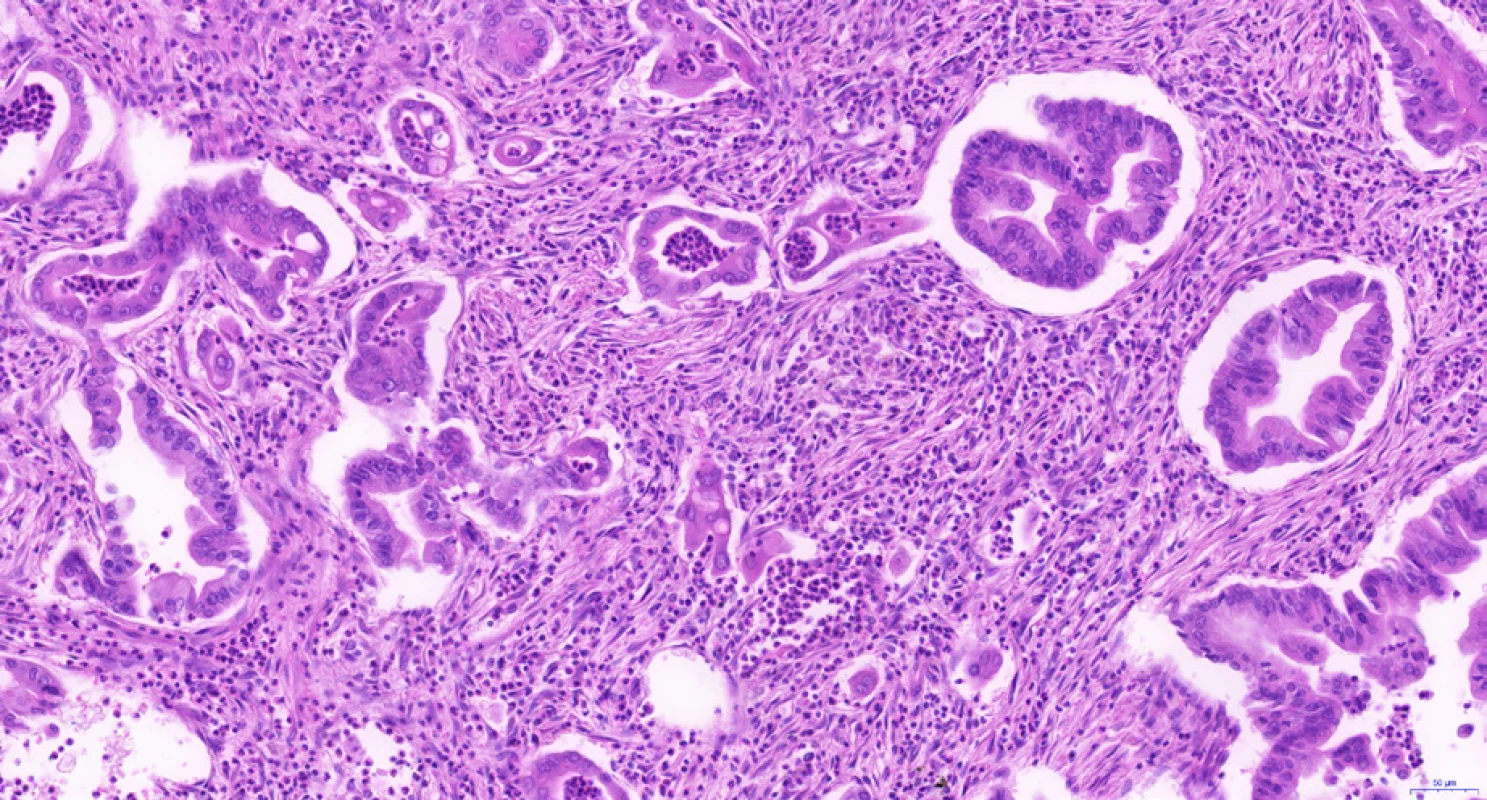
CCC vzniká z progenitorových buněk a diferencuje se směrem k cholangiocytům, tedy epitelovým buňkám vystýlajícím žlučovody a peribiliární žlázky. Cholangiocyty na různých anatomických úrovních vykazují charakteristickou morfologii a fenotyp – tyto rozdíly odrážejí rozdílný morfologický, molekulární i klinický fenotyp intrahepatálního, hilového a extrahepatálního CCC (1). Hilový a extrahepatální CCC a duktální adenokarcinom pankreatu postihují spíše starší osoby, jsou často diagnostikovány v pokročilém neresekabilním stadiu a mají obecně špatnou prognózu. Duktální adenokarcinom pankreatu i hilové a extrahepatální CCC jsou charakterizovány častějším výskytem tubulární architektoniky s cylindrickým epitelem a imunohistochemickou pozitivitou S100P a AGR2, zatímco NCAM je spíše negativní, častější je u nich perineurální (obr. 3) a lymfovaskulární šíření. Naopak intrahepatální CCC (a cholangiocelulární komponenta kombinovaného cholangiocelulárního-hepatocelulárního karcinomu) se vyskytují spíše v periferii jater (ne v hilu) s větší nádorovou masou, mikroskopicky v nich nacházíme častěji kubický nádorový epitel s trabekulárním uspořádáním a anastomozováním nádorových trámců (obr. 4). Často v iCCC (periferních CCC jater) chybí produkce mucinu, imunohistochemicky jsou pozitivní v průkazu NCAM a EMA. Je však třeba dodat, že spolehlivé odlišení periferního a hilového CCC na základě mikroskopického obrazu a imunohistochemických vyšetření v současné době není možné.
Image 3. Perineurální šíření cholangiocelulárního karcinomu. Adenokarcinomové žlázky rozsáhle vrůstají do větve nemyelinizovaného periferního nervu v jaterním hilu. Histologický řez z chirurgického resekátu, hematoxylin-eozin, 10×. 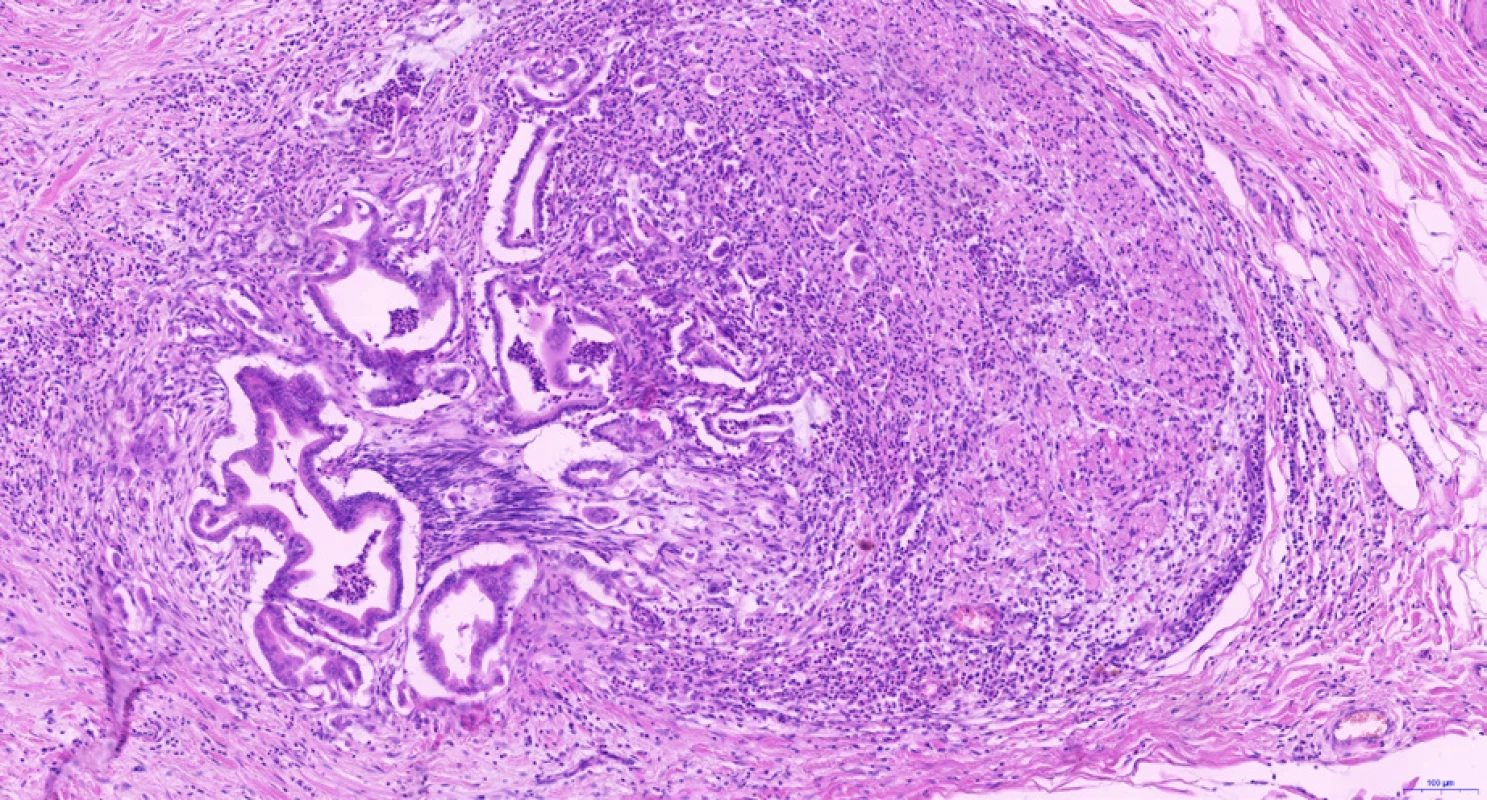
Image 4. Periferní typ intrahepatálního cholangiocelulárního karcinomu. Na rozdíl od nádoru na obr. 2 je zde patrné rozsáhlé anastomozování, adenokarcinomové žlázky jsou vzájemně propojené. Nádorový epitel je spíše kubický. Množství nádorového stromatu je minimální. Histologický řez z chirurgického resekátu, hematoxylin-eozin, 20×. 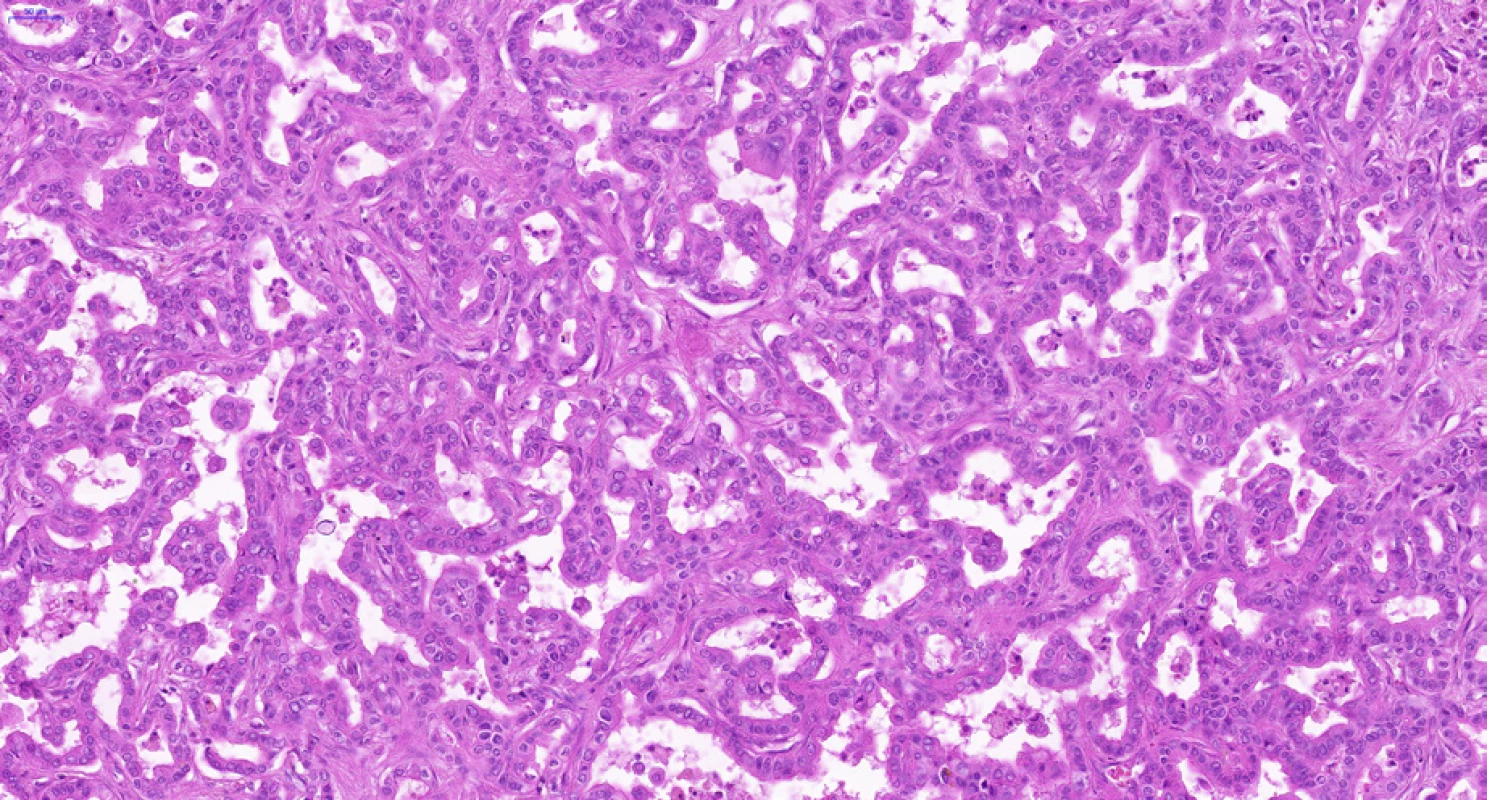
Hilové, extrahepatální CCC a adenokarcinomy pankreatu mají horší prognózu než periferní intrahepatální CCC a kombinované cholangiocelulární-hepatocelulární karcinomy (4). Rozdíly v morfologii, molekulárních vlastnostech a prognóze těchto skupin nádorů lze vysvětlit v pravděpodobném odlišném původu kmenových buněk, ze kterých nádory vznikají. Velké žlučovody a pankreatické vývody mají odlišný embryonální původ než malé intrahepatální žlučovody: velké žlučovody a pankreas jsou si embryologicky blízce příbuzné (11), peribiliární žlázky obsahují kmenové buňky schopné diferencovat se v cholangiocyty i v pankreatické aciny (12). Naopak intrahepatální CCC (a kombinované CCC-HCC) pravděpodobně vznikají podobně jako malé intrahepatální žlučovody z jaterních progenitorových buněk (HPC) přítomných na distálním konci Heringových kanálků (13).
PREKANCERÓZY BILIÁRNÍHO TRAKTU
Koncept intraepitelové neoplazie poprvé zavedl Ralph Richart v 60. letech 20. století za účelem popisu dysplastických změn děložního čípku, později se toto pojetí rozšířilo i na jiné orgány a systémy. Termín intraepitelová neoplazie zároveň naznačuje naše chápání, jak vzniká zhoubný epitelový nádor – nádorové buňky vznikají a proliferují nejprve v epitelu, teprve s postupem času pronikají skrze bazální membránu do stromatu a z in situ léze vzniká invazivní karcinom.
Histologicky rozlišujeme tři hlavní typy premaligních lézí žlučových cest. Jedná se o intraduktální papilární neoplazii žlučovodu (IPNB – intraductal papillary neoplasm of the bile duct), mucinózní cystickou neoplazii (MCN), což jsou léze analogické cystickým tumorům v pankreatu, a biliární intraepitelovou neoplazii (BiIN), jež popisuje dysplastické změny cylindrického epitelu žlučovodů s kvantifikací tíže dysplazie na škále od 1 do 3 (BiIN1 pro lehkou dysplazii, BiIN2 pro střední dysplazii, BiIN3 pro těžkou dysplazii).
IPNB je v podstatě obdobou intraduktální papilární mucinózní léze pankreatu (IPMN). IPNB je charakterizována papilárně či klkovitě utvářenou proliferací nádorových buněk s jemným fibrovaskulárním stromatem, papily jsou kryté cylindrickým epitelem s tvorbou hlenu gastrointestinálního typu (imunohistochemicky MUC2+/CK20+). Epitel papilárních IPNB vždy vykazuje dysplastické změny různé tíže, charakterizované podle kritérií BiIN1–3. Podobně jako pankreatické IPMN lze IPNB rozdělit do 4 subtypů podle morfologie a imunofenotypu: pankreatobiliární (nejčastější ve žlučovodech), intestinální, onkocytární a gastrický. IPNB často progreduje do mucinózního karcinomu (14). Mnohočetný výskyt IPNB ve žlučovém stromu odpovídá entitě dříve nazývané biliární papilomatóza, tento stav je charakterizován mnohočetnými recidivujícími IPNB s nejčastějším výskytem v extrahepatálních žlučovodech, přičemž nádory se mohou šířit i do intrahepatálních žlučovodů a žlučníku (15, 16). Mnohočetné IPNB jsou často (až v 85 % případů) sdruženy s invazivním CCC (16), pak lze lézi nazvat intraduktální papilární neoplazii s invazivním adenokarcinomem. Prognóza závisí na gradingu a stagingu invazivního nádoru.
Biliární intraepitelová neoplazie (BiIN) je sama o sobě (mimo IPNB) plošnou lézí definovanou mikroskopicky bez jednoznačného makroskopického korelátu, snad kromě zhrubělé sliznice nebo případné dilatace žlučovodů při cholelitiáze, případně při infekci motolicemi v endemických lokalitách, které jsou spolu s chronickým zánětem často asociovány právě s BiIN. BiIN rozdělujeme do 3 stupňů podle tíže histologických změn, jež popsali Zen et al. (17): 1. buněčné a jaderné atypie (variace tvarů a velikosti jader, vysoký nukleocytoplazmatický poměr, nepravidelná a ztluštělá jaderná membrána), 2. ztráta či porušení buněčné polarity (není zřetelná apikobazální orientace cylindrického epitelu), 3. architektonické změny ve smyslu víceřadého epitelu či přítomnosti mikropapilárních výrůstků (obr. 5).
Image 5. Biliární intraepitelová neoplazie stupně 3 (BiIN 3) v extrahepatálním žlučovodu. V levé části snímku je vidět víceřadý epitel s variací velikosti a tvaru jader s mikropapilárními prominencemi a se ztrátou polarity epitelu (jádra jsou i v apikální části epitelu). Pro srovnání je vpravo včetně slizničního záhybu patrný normální biliární epitel bez dysplazie, tzn. jednořadý cylindrický epitel s malými kulatými stejnoměrnými jádry situovanými při bazi epitelu. Pod dysplastickým epitelem je patrné desmoplastické stroma a drobné žlázky invazivního adenokarcinomu. V lumen žlučovodu je nekrotické debris a neutrofily. Histologický řez z chirurgického resekátu, hematoxylin-eozin, 20×. 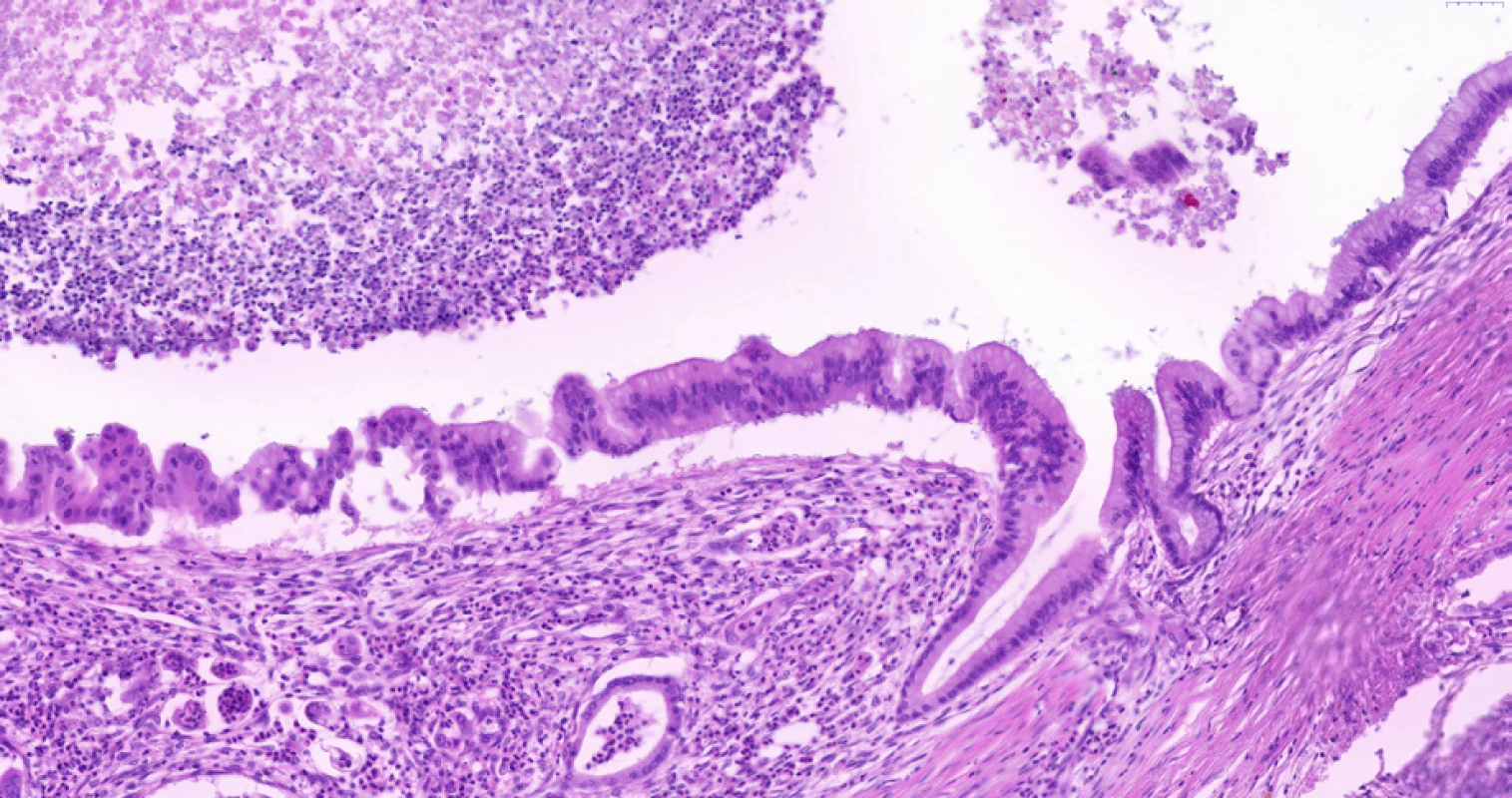
Mikropapilární BiIN spíše odpovídá těžké dysplazii než čistě plochá léze, i při stejné morfologii jader, architektonické rysy lze chápat jako rozlišovací kritérium mezi BiIN2 a BiIN3. Vysoká mitotická aktivita je také pomocným kritériem pro diagnózu high-grade dysplazie (BiIN3). Diagnóza a grading BiIN1–3 stojí na kvalifikovaném morfologickém posouzení, z imunohistochemických metod může v diagnostice BiIN pomoci vysoká proliferační aktivita (Ki67) nebo exprese antiapoptotického proteinu Bcl-2, který je v normálním či reaktivně změněném biliárním epitelu negativní. Podstatné je histopatologické odlišení BiIN od reaktivních změn, které jsou podobně jako BiIN přítomny při chronickém zánětu. Reaktivní změny biliárního epitelu charakterizuje normální polarita buněk, spíše světlá (tzv. vezikulární) jádra kulovitého tvaru bez jednoznačné hyperchromazie. Dále může být BiIN zaměněn za benigní nádory (adenom či fibroadenom žlučovodu), které však mají odlišnou architektoniku (zpravidla se jedná o ohraničené léze) a nemají cytonukleární atypie. Diagnostickou svízelí zejména v limitovaných vzorcích z punkčních biopsií může být invazivní cholangiocelulární karcinom šířící se podél žlučovodů, přičemž se v jejich stěně nacházejí atypické žlázky. Pomoci může nález řídkého proliferující desmoplastického stromatu nebo perineurální invaze. V případě nejistoty může patolog uvést diferenciálně diagnostickou rozvahu.
Mucinózní cystická neoplazie (MCN) je známější spíše z oblasti pankreatu, vzácně se může vyskytnout i v játrech (18). Tento nádor se vyskytuje téměř výhradně u žen, makroskopicky se jedná o různě velké cystické útvary vyplněné tekutým obsahem, cysty zpravidla nekomunikují s velkými žlučovody. V případě přítomnosti asociovaného adenokarcinomu nacházíme ve stěně šedobělavé tuhé úseky, které mohou prominovat dovnitř cysty. MCN sama o sobě je vystlaná kubickým až cylindrickým epitelem s variabilní přítomností mucinových vakuol, subepitelově pravidelně nacházíme vřetenobuněčné stroma tzv. ovariálního typu, pomocí v diagnostice může být imunohistochemický průkaz přítomnosti estrogenového receptoru ve stromálních buňkách. Bez přítomnosti stromatu ovariálního typu nelze diagnózu MCN stanovit. Podobně jako IPNB jsou v MCN vždy přítomné nejméně lehké dysplastické změny (BiIN). MCN v části případů (podle zdroje č. 18 v 25 %) dává během let vzniknout invazivnímu CCC. Je-li invazivní nádor přítomen pouze v ohraničené cystě, je kompletní chirurgické odstranění snadnější než u klasického CCC. Šíří-li se invazivní adenokarcinom do parenchymu jater, platí stejný TNM staging jako u intrahepatálního CCC (19).
PATOLOGICKÁ KLASIFIKACE TNM
V 7. vydání klasifikace TNM (2009, česky 2011, zdroj č. 20) i ve vydání 8. (2017, česky 2018, zdroj č. 21) figuruje cholangiocelulární karcinom mezi nádory trávicího traktu v kapitolách intrahepatální žlučové cesty, žlučník (včetně nádorů ductus cysticus), mimojaterní žlučové cesty – perihilární (levý, pravý a společný hepatikus) a mimojaterní žlučové cesty – distální (choledochus).
U nádorů intrahepatálních žlučových cest je hlavní novinkou v 8. vydání subklasifikace kategorie T1 na T1a a T1b podle velikosti (hranice 5 cm) a dále rozdělení T2 na T2a a T2b podle toho, zda je nádor solitární, či vícečetný. U nádorů žlučníku je novinkou rozdělení T2 (postižení perimuskulární pojivové tkáně) na T2a a T2b podle toho, zda se jedná o postižení subserózy (T2a), nebo postižení na jaterní straně (T2b), ovšem bez prorůstání do jater či na serózu. Nová je též kategorie N2 při metastatickém postižení ≥ 4 regionálních mízních uzlin.
Klasifikace nádorů mimojaterních perihilárních žlučových cest zůstává v kategorii T beze změny, obdobně jako u žlučníku přibývá kategorie N2 pro stadium nádorového postižení ≥ 4 mízních uzlin.
Největší změny se týkají nádorů mimojaterních distálních žlučovodů (ductus choledochus), přičemž ve starším, 7. vydání se kategorie T1–4 řídila anatomickou vrstvou, do níž vrůstá nádor, zatímco v aktuálním, 8. vydání se T řídí hloubkou nádorové invaze ve stěně žlučovodu v milimetrech. T1 odpovídá hloubce < 5 mm, T2 mezi 5 a 12 mm a T3 > 12 mm. Stadium T4 je stejně jako v 7. vydání definováno postižením truncus coeliacus, a. mesenterica superior nebo a. hepatica communis. Podobně jako u předchozích skupin přibyla nová kategorie N2 pro nádory postihující ≥ 4 mízní uzliny. U nádorů mimojaterních žlučovodů se řídí zejména kategorie T3 a T4 pohledem onkochirurga z hlediska možné resekability nádoru.
Kompletní nová TNM klasifikace je shrnuta v tabulce.
Table 1. TNM klasifikace zhoubných novotvarů, 8. vydání, kapitoly týkající se CCC 
IMUNOHISTOCHEMIE V DIFERENCIÁLNÍ DIAGNOSTICE ADENOKARCINOMŮ JATER
Pro patologa je častým problémem odlišení primárního cholangiocelulárního adenokarcinomu jater od metastázy adenokarcinomu jiného původu, a to i v punkčních jehlových biopsiích jaterních ložisek a resekátech jater. Odlišení od adenokarcinomu kolorekta, plic, prsu, prostaty či gynekologické oblasti je možné pomocí imunohistochemického vyšetření. Jako ve všech epitelech a epitelových nádorech vykazuje CCC pozitivní průkaz cytokeratinů (CK), zejména CK7 (obr. 6 a 7). Obvyklý imunoprofil v hilovém a extrahepatálním CCC je CK7+/CK20+, zatímco periferní intrahepatální CCC je obvykle CK7+/CK20– (22). Oba typy CCC jsou běžně pozitivní v průkazu CK19 (obr. 8), některé práce pak hodnotí silnou expresi CK19 u intrahepatálních CCC jako nepříznivý prognostický znak (23).
Image 6. Periferní typ intrahepatálního cholangiocelulárního karcinomu. Hnědě jsou zbarveny buňky CCC při imunohistochemickém průkazu cytokeratinu 7, vpravo jsou negativní jaterní buňky. Dále je patrná trabekulární stavba s anastomozováním nádorových trámců typická pro periferní intrahepatální CCC. Histologický řez z punkční biopsie, imunohistochemie CK7, 20×. 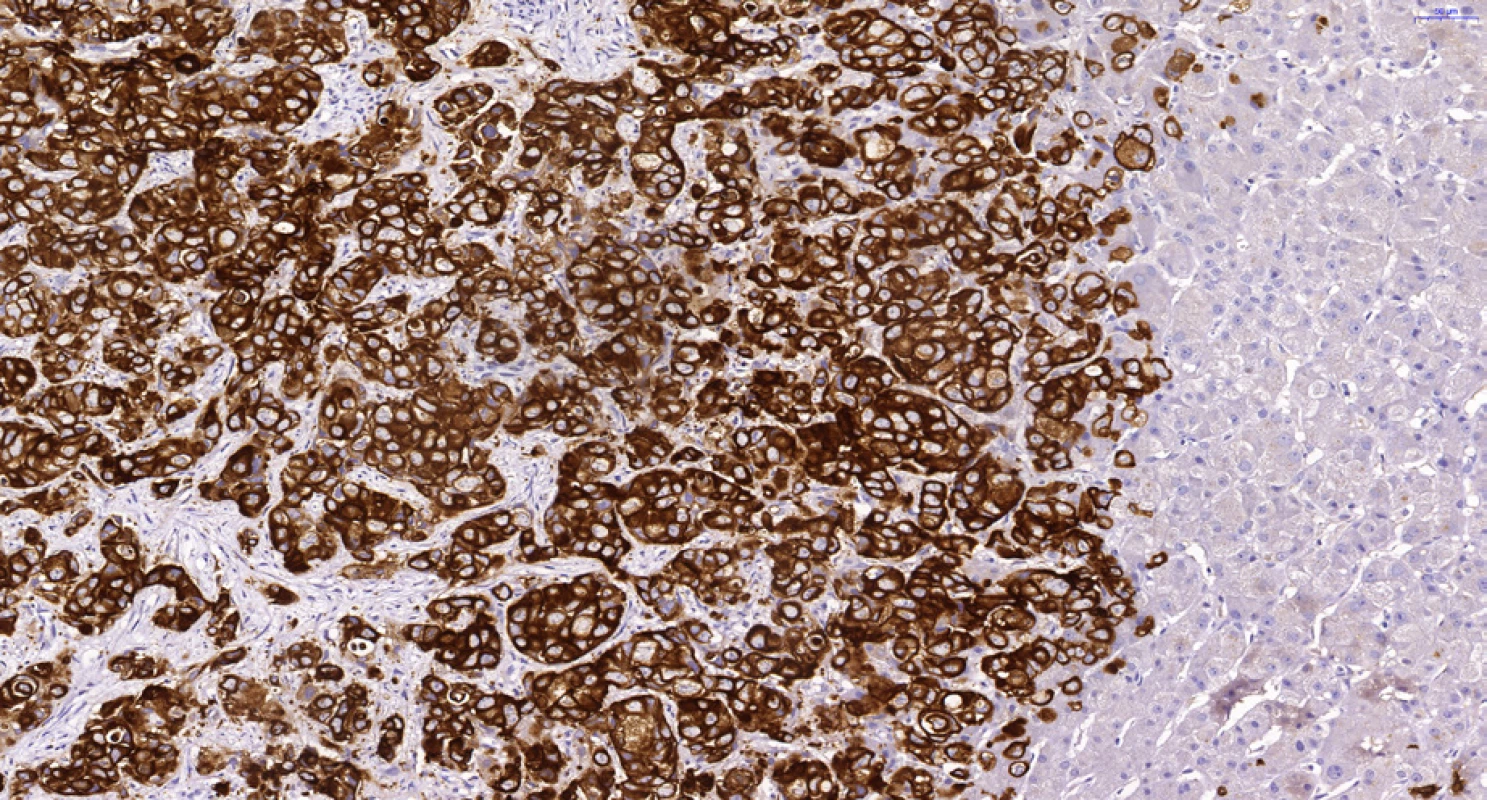
Image 7. Periferní typ intrahepatálního cholangiocelulárního karcinomu, stejná biopsie jako na obr. 6. Nádorové buňky (vlevo) jsou imunohistochemicky negativní v průkazu HSA, zatímco hepatocyty (vpravo) se pozitivně barví hnědě. Histologický řez z punkční biopsie, imunohistochemie HSA, 20×. 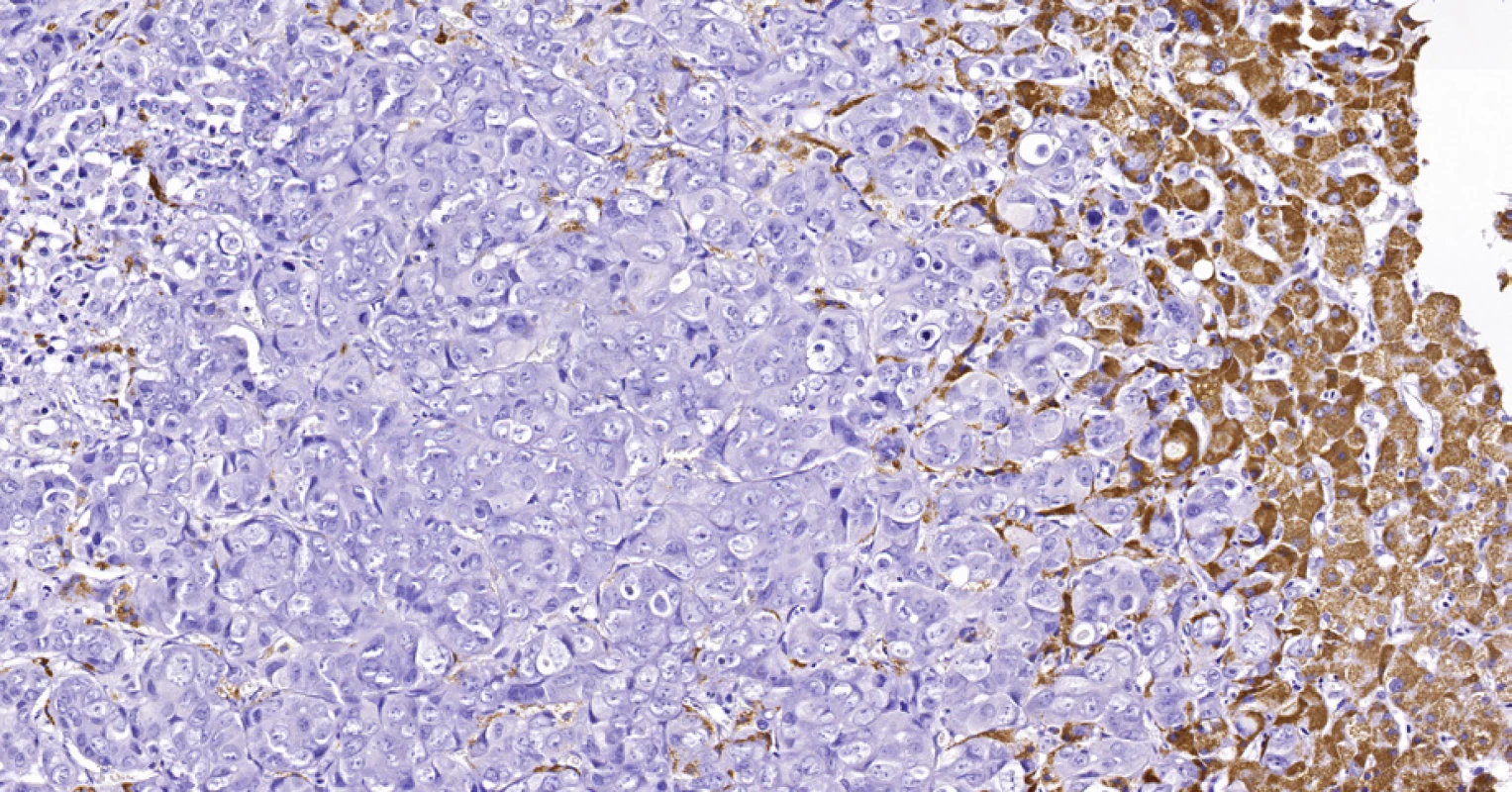
Image 8. Periferní typ intrahepatálního cholangiocelulárního karcinomu, stejná biopsie jako na obr. 6 a 7. Adenokarcinom (vlevo nahoře) roste v těsné blízkosti (v terénu?) von Meyenburgova komplexu (uprostřed dole), který je tvořen angulovanými žlázkami vystlanými plochým až kubickým biliárním epitelem bez atypií. Vpravo je nenádorový parenchym jater. Histologický řez z punkční biopsie, hematoxylin-eozin, 20×. 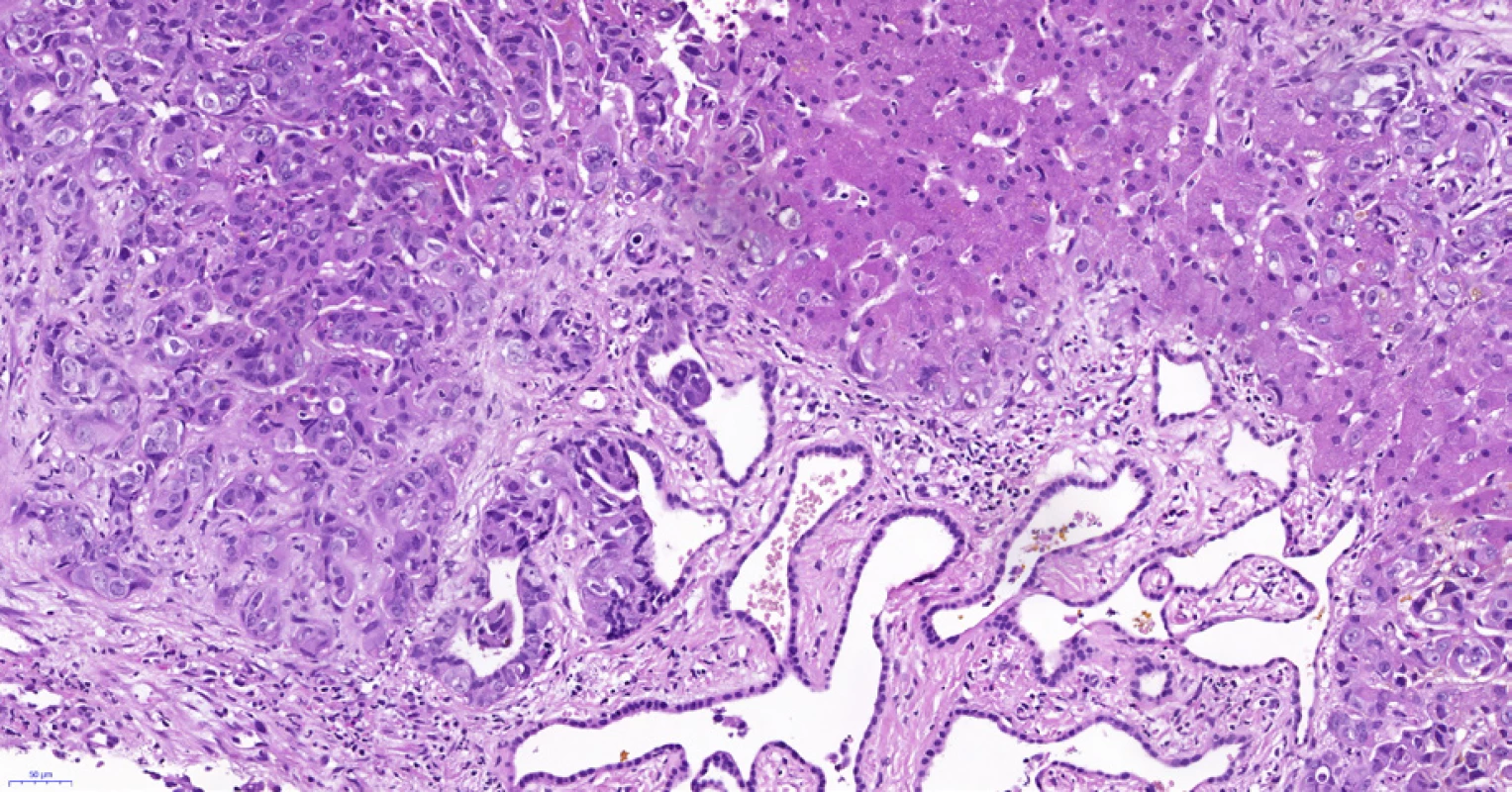
Dalšími markery běžně prokazovanými u CCC jsou epitelový membránový antigen (EMA) a karcinoembryonální antigen (CEA). CCC na rozdíl od HCC neexprimuje hepatální superficiální antigen (HSA). Část případů CCC vykazuje expresi intestinálního transkripčního faktoru CDX2 (29 % u karcinomů žlučníku, 22 % u karcinomů extrahepatálních žlučovodů a 5 % u intrahepatálních CCC), ale ne tak často a intenzivně jako kolorektální karcinom (24), který je CDX2-pozitivní v 86 % případů (25). Toho lze využít k odlišení pankreatobiliárních adenokarcinomů od jaterních metastáz adenokarcinomů tlustého střeva. Kolorektální karcinomy jsou pak nejčastěji CK7–, CK20+, CK19+ a CDX2+.
Metastázy adenokarcinomů s primárním původem mimo GIT pak lze nejsnáze vyloučit nejen jejich obvyklou negativitou CK19 a CK20, ale zejména pozitivitou „orgánově specifických“ markerů – např. plicní adenokarcinom je v 79 % případů pozitivní v průkazu TTF1 a napsinu A (26). V metastáze adenokarcinomu prostaty nepřekvapí silná senzitivita i specificita protilátky proti prostatickému superficiálnímu antigenu (PSA). V případě metastatického karcinomu prsu může být pozitivní průkaz estrogenového receptoru; užitečnými markery v odlišení od CCC jsou také GATA3 a mamaglobin.
PEROPERAČNÍ HISTOPATOLOGICKÉ VYŠETŘENÍ
Peroperační vyšetření extrahepatálních žlučových cest metodou zmraženého řezu je ve většině případů prováděno za účelem potvrzení klinicky suspektní malignity, velmi často se jedná o nádory v pokročilém stadiu, kdy už radikální resekce není možná (27). Pokud je nádor resekabilní, je mimořádně důležité vyšetření resekčních okrajů k vyloučení přítomnosti invazivního karcinomu; pozitivní okraj může být v cca 10 % falešně negativní (28). Pozitivní okraj souvisí se zkráceným přežitím nemocného (28–30), přítomnost biliární intraepitelové neoplazie v resekčním okraji nemá klinický význam (30–32).
Ve zmraženém histologickém řezu může být při vyšetřování žlučníku a extrahepatálních žlučových cest včetně resekčních okrajů obtížné odlišení intramurálních výběžků sliznice (tzv. Aschoffových-Rokitanského sinusů) od žlázek invazivního adenokarcinomu (33), jednoznačná diagnóza může být svízelná i v definitivních parafinových řezech (27) – sinusy zpravidla komunikují s lumen žlučovodu, jsou orientovány kolmo na slizniční povrch, ostře ohraničené a vykazují symetricky větvenou architektoniku s okrouhlými žlázkami. Naproti tomu jsou adenokarcinomové žlázky nahodile rozmístěné, často paralelní se slizničním povrchem a mají angulovaný tvar. Nezřídka můžeme karcinomové žlázky najít v těsné komunikaci s nervovými vlákny nebo v blízkosti muskulárních arterií, což svědčí pro diagnózu maligního procesu. Karcinom také zpravidla dosahuje i mimo stěnu žlučovodu či žlučníku – zde mohou však představovat diagnostickou past aberantní Luschkeho biliární kanálky. Diagnózu karcinomu může usnadnit desmoplastické stroma okolo karcinomových žlázek, splývání žlázek, disociace jednotlivých nádorových buněk a samozřejmě ztráta polarity žlázového epitelu, cytonukleární atypie se zvýšeným nukleocytoplazmatickým poměrem, výraznou variabilitou velikosti či tvaru jader a jadernou hyperchromazií. V karcinomu můžeme najít apoptotická tělíska a mitózy včetně těch atypických (27). Cytologické hodnocení je však ve zmraženém řezu často nespolehlivé, zejména v terénu chronického zánětu a reaktivních změn.
Obtížnost peroperačního histologického vyšetření ve zmraženém řezu demonstrují závěry příslušných studií – někteří autoři uvádějí neshodu mezi peroperačním a definitivním parafinovým histopatologickým vyšetřením resekčních okrajů žlučových cest u 25 % případů (34). Okazaki et al. zaznamenali při resekcích hilových intrahepatálních CCC pouze 56% shodu (tedy neshodu dokonce ve 44 % případů) peroperačního a parafinového zpracování vzorků z resekčních okrajů, při 75% senzitivitě a 56% specificitě (35).
Co se týká peroperačního vyšetření nádorů v resekátech jater, nejčastější lézi v necirhotických játrech je karcinomová metastáza, jejíž diagnóza je v převážné většině případů jednoduchá, přičemž může být obtížné určení origa – zde je třeba histopatologický nález korelovat s výsledkem klinických vyšetření (imunohistochemické vyšetření peroperačně zpravidla dostupné není). Relativně snadná je identifikace metastázy kolorektálního karcinomu, který má charakteristickou morfologii. Odlišení primárního intrahepatálního CCC od metastázy adenokarcinomu extrahepatálních žlučových cest či duktálního adenokarcinomu pankreatu není ve zmraženém řezu – a často ani v definitivní biopsii – možné (viz výše). Klinicky mohou imitovat metastázy také benigní léze – biliární adenom (bile duct adenoma) nebo biliární hamartom/von Meyenburgův komplex. Von Meyenburgovy komplexy se vyskytují u cca 5 % dospělé populace – jedná se o klinicky němé bělavé subkapsulárně uložené a často mnohočetné léze jater (36). Von Meyenburgovy komplexy podle současného názoru nevyžadují léčbu, některé recentní práce však ukazují, že se patrně jedná o prekurzorovou lézi intrahepatálního CCC (37) (obr. 8). Peroperační histologické vyšetření v rukách zkušeného patologa odliší benigní lézi jater od maligní s 97% senzitivitou a 99% specificitou (38).
ZÁVĚR
Patolog se v bioptické diagnostice setkává s CCC v resekátech jater a žlučových cest, v endoskopických a jehlových biopsiích ze žlučovodů a v punkčních biopsiích z jater. V resekátech je úkolem patologa potvrzení/stanovení diagnózy CCC spolu se stanovením gradingu, stagingu a posouzení kompletnosti odstranění nádoru (případně určení jeho vzdálenosti od resekčního okraje). Peroperační histopatologická diagnostika ve zmražených řezech je obtížná a zatížená nízkou senzitivitou i specificitou.
Poděkování
Práce byla podpořena z výzkumného programu Univerzity Karlovy PROGRES Q 28 (Onkologie).
Seznam zkratek
BiIN biliární intraepitelová neoplazie
CCC cholangiocelulární karcinom
CK cytokeratin
EMA epitelový membránový antigen
HCC hepatocelulární karcinom
HPC jaterní progenitorová buňka
HSA hepatální superficiální antigen
IPMN intraduktální papilární mucinózní léze pankreatu
IPNB intraduktální papilární neoplazie žlučovodů
MCN mucinózní cystická neoplazie
NCAM adhezní molekula nervových buněk
PanIN pankreatická intraepitelová neoplazie
TNM klasifikace zhoubných novotvarů (tumor – node – metastasis)
WHO Světová zdravotnická organizace
Adresa pro korespondenci:
MUDr. Jan Hrudka, Ph.D.
Ústav patologie 3. LF UK a FNKV
Šrobárova 1150/50, 100 34 Praha 10
Tel.: 724 579 183
e-mail: jan.hrudka@lf3.cuni.cz
Sources
- Nakanuma Y, Curado MP, Franceschi S et al. Intrahepatic cholangiocarcinoma. In: Bosman FT, Carneiro F, Hruban RH, Theise ND (eds.). WHO Classification of Tumours of the Digestive system. IARC, Lyon, 2010 : 217–224.
- Albores-Saavedra J, Adsay NV, Crawford JM et al. Carcinoma of the gallbladder and extrahepatic bile ducts. In: Bosman FT, Carneiro F, Hruban RH, Theise ND (eds.). WHO Classification of Tumours of the Digestive system. IARC, Lyon, 2010 : 266–272.
- Guedj N, Bedossa P, Paradis V. Pathology of cholangiocarcinoma. Ann Pathol 2010; 30(6): 455–463.
- Gandou C, Harada K, Sato Y et al. Hilar cholangiocarcinoma and pancreatic ductal adenocarcinoma share similar histopathologies, immunophenotypes, and development-related molecules. Hum Pathol 2013; 44(5): 811–821.
- Nakanuma Y, Sato Y. Hilar cholangiocarcinoma is pathologically similar to pancreatic duct adenocarcinoma: suggestions of similar background and development. J Hepatobiliary Pancreat Sci 2014; 21(7): 441–447.
- Theise ND, Nakashima O, Park YN, Nakanuma Y. Combined hepatocellular-cholangiocarcinoma. In: Bosman FT, Carneiro F, Hruban RH, Theise ND (eds.): WHO Classification of Tumours of the Digestive system. IARC, Lyon, 2010.
- Goodman Z, Terracciano LM. Tumours and tumour-like lesions of the liver. In: Burt AD, Portmann BC, Ferrell LD (eds.). MacSween’s Pathology of the Liver (5th ed.). Elsevier, Amsterdam, 2007 : 791–795.
- Ishak KG, Goodman ZD, Stocker JT. Tumors of the liver and intrahepatic bile ducts. Atlas of Tumor Pathology (3rd series, Fascicle 31). Armed Forces Institute of Pathology, Washington, 2001.
- Longnecker DS, Terhune PG. The case for parallel classification of biliary tract and pancreatic neoplasm. Mod Pathol 1996; 9(8): 828–837.
- Rosai J. Rosai and Ackerman’s Surgical Pathology (10th ed.). Mosby Elsevier, Missouri, 2011 : 955–996.
- Sumazaki R, Shiojiri N, Isoyama S. Conversion of biliary system to pancreatic tissue in Hes1-deficient mice. Nat Genet 2004; 36 : 83–87.
- Nakanuma Y, Sato Y, Harada K et al. Pathological classification of intrahepatic cholangiocarcinoma based on a new koncept. World J Hepatol 2010; 2(12): 419–427.
- Komuta M, Govaere O, Vandecaveye V et al. Histological diversity in cholangiocellular carcinoma reflects the different cholangiocyte phenotypes. Hepatology 2012; 55(6): 1876–1888.
- Teng X. Intraepithelial neoplasia of pancreas, billiary tract and gallbladder. In: Lai M (ed.). Intraepithelial Neoplasia. Higher Education Press. Springer-Verlag, Beijing, Berlin, Heidelberg, 2009.
- Abraham SC, Lee JH, Boitnott JK et al. Microsatellite instability in intraductal papillary neoplasms of the biliary tract. Mod Pathol 2002; 15(12): 1309–1317.
- Lee TY, Lee SS, Jung SW et al. Clinicopathologic review of 58 patients with biliary papillomatosis. Cancer 2004; 100(4): 783–793.
- Zen Y, Aishima S, Ajioka Y et al. Proposal of histological criteria for intraepithelial atypical/proliferative biliary epithelial lesions of the bile duct in hepatolithiasis with respect to cholangiocarcinoma: preliminary report based on interobserver agreement. Pathol Int 2005; 55 : 180–188.
- Devaney K, Goodman ZD, Ishak KG. Hepatobiliary cystadenoma and cystadenocarcinoma. A light microscopic and immunohistochemical study of 70 patients. Am J Surg Pathol 1994; 18(11): 1078–1091.
- Tsui WMS, Adsay NV, Crawford JM et al. Mucinous cystic neoplasms of the liver. In: Bosman FT, Carneiro F, Hruban RH, Theise ND (eds.): WHO Classification of Tumours of the Digestive system. IARC, Lyon, 2010 : 236–238.
- Sobin LH, Gospodarowitz MK, Wittekind C. TNM klasifikace zhoubných novotvarů, sedmé vydání. ÚZIS, Praha, 2011 : 99–109.
- Brierley JD, Gospodarowitz MK, Wittekind C. TNM klasifikace zhoubných novotvarů, osmé vydání. ÚZIS, Praha, 2018 : 97–104.
- Rullier A, Le Bail B, Fawaz R et al. Cytokeratin 7 and 20 expression in cholangiocarcinomas varies along the biliary tract but still differs from that in colorectal carcinoma metastasis. Am J Surg Pathol 2000; 24(6): 870–876.
- Liu LZ, Yang LX, Zheng BH et al. CK7/CK19 index: a potential prognostic factor for postoperative intrahepatic cholangiocarcinoma patients. J Surg Oncol 2018; 117(7): 1531–1539.
- Chang YT, Hsu C, Jeng YM et al. Expression of the caudal-type homeodomain transcription factor CDX2 is related to clinical outcome in biliary tract carcinoma. J Gastroenterol Hepatol 2007; 22(3): 389–394.
- Kaimaktchiev V, Terracciano L, Tornillo L et al. The homeobox intestinal differentiation factor CDX2 is selectively expressed in gastrointestinal adenocarcinomas. Mod Pathol 2004; 17(11): 1392–1399.
- Ye J, Findeis-Hosey JJ, Yang Q et al. Combination of napsin A and TTF-1 immunohistochemistry helps in differentiating primary lung adenocarcinoma from metastatic carcinoma in the lung. Appl Immunohistochem Mol Morphol 2011; 19(4): 313–317.
- Švajdler P, Daum O, Dubová M. Peroperačné vyšetrenie pankreasu, žlčníka, extrahepatálnych žlčových ciest, pečene a gastrointestinálneho traktu. ČS Patol 2018; 54(2): 63–71.
- Endo I, House MG, Klimstra DS et al. Clinical significance of intraoperative bile duct margin assessment for hilar cholangiocarcinoma. Ann Surg Oncol 2008; 15(8): 2104–2112.
- Ribero D, Amisano M, Lo Tesoriere R et al. Additional resection of an intraoperative margin-positive proximal bile duct improves survival in patients with hilar cholangiocarcinoma. Ann Surg 2011; 254(5): 776–781.
- Wakai T, Shirai Y, Moroda T et al. Impact of ductal resection margin status on long-term survival in patiens undergoing resection for extrahepatic cholangiocarcinoma. Cancer 2005; 103(6): 1210–1216.
- Igami T, Nagino M, Oda K et al. Clinicopathologic study of cholangiocarcinoma with superficial spread. Ann Surg 2009; 249(2): 296–302.
- Matthaei H, Lingohr P, Strässer A. Biliary intraepithelial neoplasia (BilIN) is frequently found in surgical margins of biliary tract cancer resection specimens but has no clinical implications. Virchows Arch 2015; 466(2): 133–141.
- Aoki T, Tsuchida A, Kasuya A et al. Is frozen section effective for diagnosis of unsuspected gallbladder cancer during laparoscopic cholecystectomy? Surg endosc 2002; 16(1): 197–200.
- Yamaguchi K, Shirahane K, Nakamura M et al. Frozen section and permanent diagnoses of the bile duct margin in gallbladder and bile duct cancer. HPB (Oxford). 2005; 7(2): 135–138.
- Okazaki Y, Horimi T, Kotaka M et al. Study of the intrahepatic surgical margin of hilar bile duct carcinoma. Hepatogastroenterology 2002; 49(45): 625–627.
- Baardewijk LJ, Idenburg FJ, Clahsen PC, Möllers MJ. Von Meyenburg complexes in the liver: not metastases. Ned Tijdschr Geneeskd 2010; 154: A1674.
- Bhalla A, Mann SA, Chen S et al. Histopathological evidence of neoplastic progression of von Meyenburg complex to intrahepatic cholangiocarcinoma. Hum Pathol 2017; 67 : 217–224.
- Rakha E, Ramaih S, McGregor A. Accuracy of frozen section in the diagnosis of liver mass lesions. J Clin Pathol 2006; 59(4): 352–354.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

2019 Issue 2-
All articles in this issue
- Epidemiologie zhoubných nádorů žlučníku a žlučových cest v České republice
- Patologie cholangiocelulárního karcinomu
- Molekulární patologie cholangiocelulárních nádorů
- Role single-operator cholangioskopie (SpyGlass) v intraoperační diagnostice intraduktálního šíření cholangiokarcinomu – pilotní studie
- Chirurgická léčba cholangiocelulárního karcinomu
- Současná úloha radioterapie a systémové terapie v multidisciplinární léčbě cholangiokarcinomu
- Surveillance chronických neinfekčních nemocí
- Umělá inteligence a moderní informační a komunikační technologie vstupují do medicíny
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Chirurgická léčba cholangiocelulárního karcinomu
- Patologie cholangiocelulárního karcinomu
- Epidemiologie zhoubných nádorů žlučníku a žlučových cest v České republice
- Umělá inteligence a moderní informační a komunikační technologie vstupují do medicíny
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

