-
Medical journals
- Career
Moderní pohled na převodní systém srdeční
Authors: David Sedmera 1,2; František Vostárek 2
Authors‘ workplace: Anatomický ústav 1. LF UK, Praha 1; Fyziologický ústav AV ČR, Praha 2
Published in: Čas. Lék. čes. 2017; 156: 417-421
Category: Review Articles
Overview
Převodní systém srdeční byl ve formě přítomné u teplokrevných obratlovců úplně popsán před 110 lety. Navzdory tomu bylo v poslední době získáno množství poznatků o jeho specifikaci a vývoji, jež mají význam pro jeho funkci při tvorbě a vedení vzruchu srdcem. Poruchy převodního systému jsou spojovány s arytmiemi, z nichž některé mají vývojový podklad. Evoluční pohled na tuto problematiku je užitečný zejména pro lepší pochopení přestavby síňokomorového kanálu.
Klíčová slova:
Purkyňova vlákna, Tawarova raménka, Hisův svazek, AV uzel, SA uzelÚVOD
Od našeho přehledového článku (1), shodou okolností publikovaného v době 100. výročí popisu poslední známé komponenty převodního systému srdečního – sinoatriálního (SA) uzlu Keithem a Flackem, uplynulo právě deset let. Není zde tedy na místě znovu opakovat historické skutečnosti související s jeho objeviteli, počínaje Janem Evangelistou Purkyněm (2), ale spíše poskytnout přehled o současném pohledu na tuto strukturu klíčovou pro funkci srdce a shrnout poznatky o jeho vývoji za poslední desetiletí. Náš výzkum je v současnosti zaměřen na jeho pravděpodobnou evoluční historii, což představuje nový úhel pohledu a rovněž nové otázky, jež jsou zásadní pro pokrok v této vědní oblasti.
Zjednodušující Haeckelův náhled, že ontogeneze je rekapitulací fylogeneze, je v současnosti postupně opouštěn, přesto nám tento přístup umožňuje pohlédnout na některé otázky kardiogeneze z nového úhlu. Jako vždy ďábel vězí v detailech. Dnešní zástupci ryb, obojživelníků i plazů reprezentují značně derivovaný stav ve srovnání s hypotetickými společnými předchůdci, a tak nelze očekávat, že embryogeneze ptáků a savců bude věrně rekapitulovat stav u současných dospělých nižších (poikilotermních) obratlovců. Navzdory tomu má příroda tendenci řešit opakující se problémy podobným způsobem, a tak trabekulární embryonální srdce ptačích a savčích zárodků opravdu připomíná houbovité srdce žab (3). To je však diktováno tím, že funguje za podobných podmínek: není zde ještě vytvořena koronární cirkulace (u dospělých žab je naopak druhotně potlačena, neboť u paryb a ryb je přítomna), není oddělen systémový a plicní oběh. Navzdory této povrchní podobnosti jsou již na relativně časných stadiích vývoje vyšších obratlovců vytvořeny molekulárně odlišné prekurzory budoucího převodního systému (4).
VÝVOJ SRDCE
Srdce je u obratlovců prvním orgánem, který začne plně vykonávat svou funkci. Pro rychlý a správný embryonální vývoj je nutná velmi efektivní distribuce kyslíku, živin a metabolitů. U člověka začíná srdce bít mezi 21. a 22. dnem vývoje. Prvním krokem při vývoji srdce je gastrulace, po které dochází ke zformování jednoduché srdeční trubice fúzí bilaterálních plotének prekardiálního mezodermu.
Buňky při vývoji srdce pocházejí ze dvou hlavních skupin progenitorů, prvního a druhého kardiogenního pole. Srdeční trubice má původ v prvním kardiogenním poli a je v této fázi složena ze dvou vrstev – vnitřní vrstvu tvoří endokard, vnější je tvořena myokardem a prostor mezi nimi vyplňuje tzv. srdeční rosol. Po jejím zformování buňky z prvního kardiogenního pole zpomalí proliferaci a růst srdce pokračuje hlavně v oblasti vtokové a výtokové části inkorporací mezenchymových buněk z přilehlého druhého kardiogenního pole. Z rovné trubice se jejím zakřivením následně stává srdeční klička, což je prvním vnějším projevem asymetrie ve vývoji srdce i celého zárodku.
V pozdějším vývoji je savčí a ptačí srdce pomocí septace rozděleno na 4 oddíly – 2 síně a 2 komory. Síně a levá komora mají svůj původ hlavně v prvním kardiogenním poli a pravá komora s výtokovou částí ve druhém kardiogenním poli (5–7). Méně známé, ovšem ne méně důležité, je třetí kardiogenní pole, které hraje zásadní roli při formování sinoatriálního uzlu (8). Při tvorbě aortikopulmonárního septa se svou imigrací zapojují buňky, které mají svůj původ v srdeční neurální liště (9). Další extrakardiální populací je pak proepikardový orgán, uložený v blízkosti základu jater, z něhož vzniká epikard a perikard a z nich odvozené deriváty – srdeční fibroblasty, adipocyty a koronární cévy.
PŘEVODNÍ SYSTÉM SRDEČNÍ A ELEKTROFYZIOLOGIE SRDCE
Převodní systém srdeční je specializovaná část srdeční svalové tkáně, která má schopnost generovat elektrické impulzy a díky své vysoké elektrické vodivosti umožňuje koordinovaně a efektivně rozvádět elektrické vzruchy nutné ke kontrakci srdce. Na elektrické impulzy generované a rozváděné převodním systémem reaguje svými stahy pracovní myokard, čímž je udáván vlastní autonomní rytmus kontrakcí srdeční svaloviny (tzv. srdeční automacie), který má uspořádanou aktivační sekvenci, a zajišťuje tak velmi efektivní pumpování krve. Funkce převodního systému je u dospělého srdce modulována vegetativním nervovým systémem.
Převodní systém srdeční je složen z několika segmentů, které jsou schopné tvořit a koordinovaně převádět elektrický vzruch. Rytmus je udáván prvním oddílem převodního systému, tzv. sinoatriálním (SA) uzlem. Generovaný vzruch je rychle převeden internodálními síňovými spoji a Bachmanovým svazkem skrze síně a poté do atrioventrikulárního uzlu. V atrioventrikulárním uzlu je vedení mezi síněmi a komorami zpomaleno. Následuje Hisův svazek, který představuje jediný vodivý spoj ve vazivové elektrické izolaci mezi myokardem síní a komor. Dále pokračuje levé a pravé Tawarovo raménko, Purkyňova vlákna a nakonec je aktivován pracovní myokard komor.
SINOATRIÁLNÍ UZEL
U dospělého lidského srdce se jedná o kapkovitý útvar o velikosti cca 15 × 3 mm složený ze specializovaných buněk, který se nachází v oblasti ústí horní duté žíly do pravé síně asi 1 mm pod povrchem epikardu. SA uzel zastává roli hlavního srdečního pacemakeru a je místem, kde dochází k tvorbě elektrických impulsů, čímž je udáván srdeční rytmus. Za normálních podmínek je rytmus o frekvenci 60–100/min udáván tímto hlavním pacemakerem, který je přirozeným zdrojem srdeční automacie.
Tento fenomén je umožněn díky přítomnosti speciálních iontových kanálů – HCN (zejména HCN4), které jsou netradičně aktivovány během hyperpolarizace membrány. Během ní se tyto kanály otevírají a způsobují pomalou depolarizaci, jež překročením prahového potenciálu vyústí rychlou depolarizací v akční potenciál a celý cyklus se poté opakuje (10). SA uzel tvoří tzv. pacemakerové buňky, které se vyznačují právě expresí HCN4, což je všeobecně uznávaný pacemakerový marker (11–13).
ATRIOVENTRIKULÁRNÍ UZEL A KOMOROVÝ PŘEVODNÍ SYSTÉM
Atrioventrikulární uzel je po dominantním SA uzlu druhým pacemakerem s pomalejší spontánní frekvencí 40–50/min. Během normálních podmínek je jeho pomalejší pacemakerová aktivita zastiňována rychlejším SA uzlem. Pokud však dojde k pozastavení funkce hlavního pacemakeru nebo k blokádě převodu jím generovaných vzruchů, AV uzel přebere úlohu pacemakeru. V AV uzlu dochází po převodu vzruchu síněmi ke zpomalení vedení vzruchu, které se nazývá atrioventrikulární zpoždění. Toto zpoždění má své fyziologické opodstatnění, protože díky němu srdce pumpuje krev s vysokou efektivitou.
Na AV uzel navazuje Hisův svazek, což je fyziologicky jediné vodivé propojení mezi myokardem síní a komor. Pokud by neexistovala elektrická izolace mezi síněmi a komorami, nemohlo by srdce efektivně pumpovat (14). Dále v mezikomorovém septu navazují pravé a levé Tawarovo raménko, která jsou od pracovního myokardu elektricky odizolována (15). Nakonec se komorový převodní systém větví na Purkyňova vlákna, jež jsou elektricky napojena na pracovní myokard komor a elektricky ho aktivují dospělým způsobem aktivace od hrotu směrem k bázi srdce. Tento způsob aktivace je dalším přizpůsobením funkce srdce pro vysokou efektivitu pumpování krve. V rámci srdeční tkáně probíhá transmurální aktivace směrem od endokardu přes myokard až do epikardu.
U většiny popsaných savců je kromě subendokardiální komponenty Purkyňových vláken (obr. 1) přítomná ještě složka transmurální (16), jež u ptáků probíhá podél větviček koronárních tepen. Tato složka však u některých druhů, konkrétně u člověka a myši, není detekovatelná.
Image 1. Purkyňova vlákna v levé komoře prasete v obrazu konfokální mikroskopie. 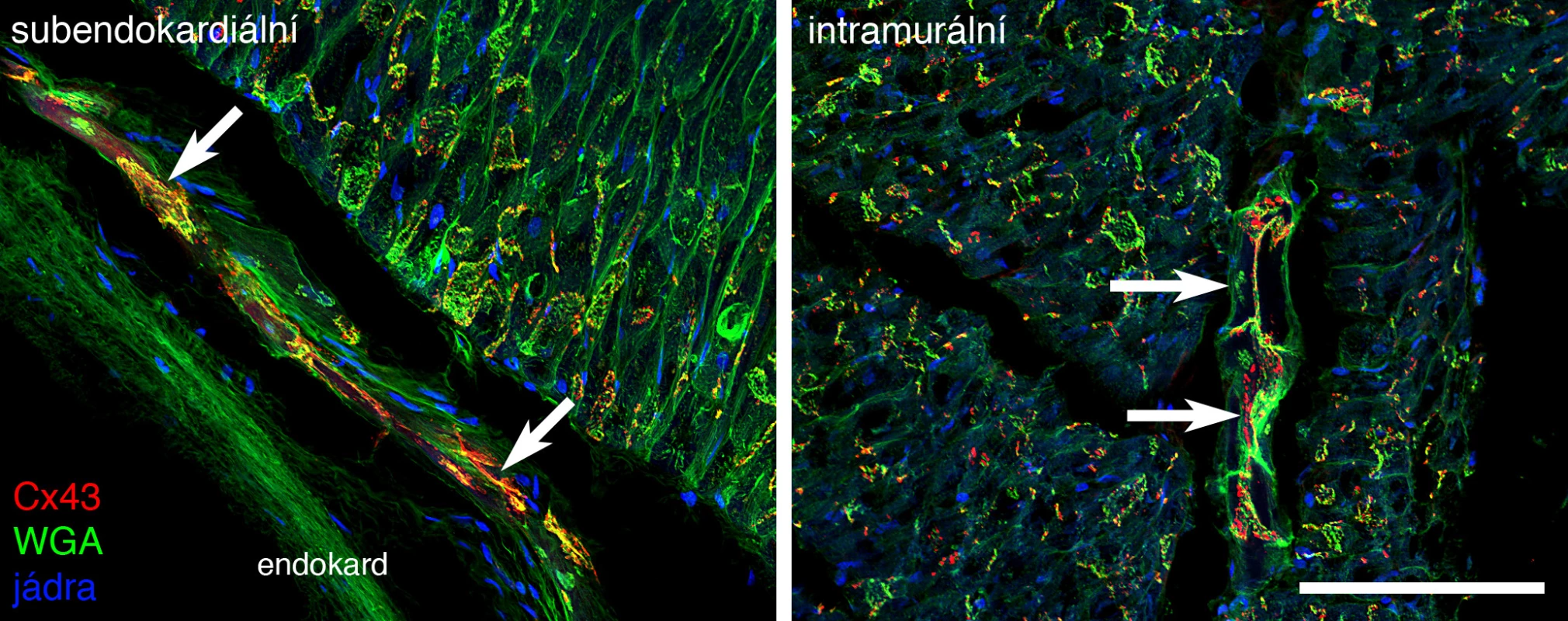
V trojím barvení pomocí protilátky proti konexinu 43 (červené tečky), aglutininu z pšeničných klíčků značícího bazální membrány a vláknitou mimobuněčnou hmotu (zelená) a jaderného barvení pomocí DNA interkalačního barviva Hoechst 33342 (modrá) je patrná vysoká hustota proteinu mezibuněčných spojení na povrchu Purkyňových buněk. Měřítko 100 µm. VÝVOJ PŘEVODNÍHO SYSTÉMU
Během vývoje srdce od primitivní srdeční trubice až ke čtyřdutinovému srdci je nutné, aby v každém okamžiku bylo schopno dostatečně efektivně pumpovat krev. V případě primitivní srdeční trubice je řešení tohoto úkolu v celku snadné, protože celý myokard je elektricky propojen. S postupem vývoje srdce je však nutné zajistit čím dál koordinovanější elektrickou aktivaci, aby byla zachována dostatečná efektivita pumpování.
U čtyřdutinového srdce je, kromě udávání rytmu pacemakerem, hlavním úkolem převodního systému po rychlé aktivaci síní nechat dostatek času pro jejich kontrakci a vypuzení krve do komor, což je zajištěno zpomalením vedení vzruchu v AV uzlu, a potom rychle aktivovat komory směrem od hrotu k bázi. K tomuto cíli vývoj převodního systému spěje skrze různá vývojová stadia srdce, kdy směr aktivační sekvence vždy odpovídá směru toku krve. Vývoj převodního sytému jde tedy ruku v ruce s morfogenezí srdce a následuje nároky na zachování efektivního pumpování krve v každé fázi jeho vývoje.
MECHANISMY VÝVOJE PŘEVODNÍHO SYSTÉMU
Během prvních peristaltoidních kontrakcí a počátku funkce primitivního trubicovitého embryonálního srdce není vyvinut žádný převodní systém. Jakmile se vývoj posune do stadia srdeční kličky, dochází ke vzniku přechodových zón mezi rychle a pomalu vedoucím myokardem, což lze považovat za počátek vývoje převodního systému. Buňky převodního systému se od pracovních kardiomyocytů liší zejména expresí HNK-1, Tbx3 a dalších faktorů (17, 18). Přechodové zóny se nacházejí v oblasti sinus venosus, kde dochází k formování budoucího SA uzlu, dále v oblasti AV kanálu, v oblasti primárního prstence, ze kterého se po dokončení septace formuje Hisův svazek a Tawarova raménka, a myokardiálního svěrače v oblasti výtokové části srdce. V této fázi již díky rozdílu v rychlosti vedení jednotlivých zón vzniká v AV kanálu primitivní atrioventrikulární zpoždění (19).
Pomocí retrovirových studií buněčných linií na kuřecím zárodku byla vyvrácena hypotéza, že převodní systém má svůj původ v buňkách neurální lišty. Bylo prokázáno, že AV uzel, Hisův svazek, Tawarova raménka a Purkyňova vlákna se diferencují výhradně z myocytů (20). Diferenciace buněk převodního systému spočívá v zablokování programu pro vývoj v pracovní kardiomyocyty a zachování „primitivního“ fenotypu převodního systému (21), který se potom dále specializuje (22). Nejdříve se diferencuje a začíná fungovat SA uzel (8). Později dochází k vývoji AV uzlu a nejpozději se diferencuje komorový převodní systém (4). S maturací komorového převodního systému související s vývojem trabekularizace se mění nezralý typ aktivace komor od báze k hrotu směrem ke zralé aktivaci od hrotu k bázi (23–25).
Sinoatriální uzel je výjimečný jak svou funkcí, tak svým vývojem. Je prvním oddílem převodního systému, a dokonce i prvním oddílem srdce, který se začíná specifikovat. Pacemakerové buňky jsou totiž ještě před tím, než započne samotná morfogeneze srdce, fyzicky formovány a molekulárně programovány ve třetím kardiogenním poli procesem řízeným Wnt signalizací (8). Pro správnou diferenciaci a konečný osud pacemakerových buněk je zásadní přítomnost transkripčního faktoru Shox2. Hlavní oblasti exprese tohoto faktoru byly pozorovány v myokardu sinus venosus včetně oblasti sinoatriálního uzlu a žilních chlopní (12). Pro správnou funkci pacemakeru během vývoje je u savců důležitá také endotelinová signalizace, která ovlivňuje frekvenci jeho rytmu (26).
Lokalizace prvního místa aktivace pacemakeru byla zkoumána již před delší dobou na potkaních embryích (27). Při úplném počátku funkce embryonálního srdce bylo místo první aktivace lokalizováno na levé straně v oblasti sinus venosus, během několika hodin se však přesunulo na pravou stranu, kde byl posléze lokalizován i definitivní pacemaker. Podobná situace byla popsána u ptačích embryí, kde byly zbytky levostranné aktivity pozorovány za normálních podmínek u malého zlomku pozdějších vývojových stadií (28). Žádná levostranná aktivace však u rozsáhlých skupin testovaných normálních myších embryí pozorována nebyla (29–31).
O mechanismech regulujících specifikaci ostatních segmentů převodního systému během jeho vývoje je známo výrazně méně než o vývoji pacemakeru. Jedním z popsaných mechanismů, které ovlivňují diferenciaci komorových kardiomyocytů směrem k fenotypu převodního systému, je působení neuregulinu. Tato molekula však má pro embryonální kardiomyocyty i mnoho dalších důležitých funkcí a její působení je zásadní pro přežití této buněčné populace (32). Důležitým mechanismem, který ovlivňuje diferenciaci Purkyňových vláken u kuřete, je signalizační kaskáda neuregulin/Erb společně s endotelinovou signalizací (22, 33–35). Dalšími významnými faktory, které se podílejí konkrétně na formování Hisova svazku a Tawarových ramének, jsou transkripční faktory T-box, Nkx2.5 a Irx3 (36–42).
EPIGENETICKÁ DETERMINACE PŘEVODNÍHO SYSTÉMU
Diferenciace embryonálních myocytů směrem k převodnímu fenotypu je řízena také epigenetickými faktory, ze kterých je nejdůležitější mechanické zatížení. Experimenty s nezatíženými embryonálními srdci in vitro ukázaly, že komorový převodní systém u nezatížených srdcí podstoupil dediferenciaci směrem k méně zralému fenotypu. Tomuto fenoménu bylo možné zabránit zatížením komor pomocí kapičky silikonového oleje injikovaného do komory (43). Tyto experimenty pomohly odpovědět na otázku, která vzešla z předchozích studií v prostředí in vivo. Bylo totiž zjištěno, že zvýšené hemodynamické zatížení vedlo ke zrychlení, zatímco snížené zatížení vedlo k inhibici diferenciace převodního systému. Hlavním mechanismem bylo přímé působení na napětí myocytů spíše než signalizace z endokardu indukovaná smykovým napětím (24, 44).
Další studie na kuřecích embryích in vivo ukázala, že hypoxie může přispět k maturaci atrioventrikulárního kanálu a vést k dřívějšímu přechodu ke zralému typu komorové aktivace od hrotu k bázi. Jedním z možných vysvětlení těchto jevů může být pozorované zvýšení apoptózy v oblasti myokardu AV kanálu (45). Dalším faktorem ovlivňujícím správný vývoj vazivové izolace AV spojení je vývoj epikardu a jeho invaze do oblasti mezi síněmi a komorami přispívající k formování vazivového srdečního skeletu. Poruchy v jeho vývoji mohou vést až k preexcitaci komor (14, 46). Elektrická izolace Hisova svazku je také závislá na imigraci buněk srdeční neurální lišty (47).
Je pozoruhodné, že u homeotermních obratlovců došlo k takto významné přestavbě myokardu AV kanálu, jež oproti výchozímu stavu, spojujícímu síně a komory solidním prstencem myokardu, vede k relativně úzkému Hisovu svazku jako jedinému vodivému spojení. Toto uspořádání v sobě nese riziko v podobě vrozeného srdečního bloku, například u dětí matek s lupus erythematodes (48), zajde-li tento proces příliš daleko. Lze předpokládat, že toto riziko je vyváženo nějakými významnými výhodami, které jsou zásadní pro srdce operující za vyšší teploty a frekvence. Jednou z možností je prevence arytmií podmíněných reentry mechanismem, které pozorujeme v případě perzistujících akcesorních spojek u pacientů i během embryonálního vývoje savců (49) a ptáků (50).
PŘEVODNÍ SYSTÉM JAKO PŮVODCE ARYTMIÍ BĚHEM FETÁLNÍHO VÝVOJE
V klinické praxi bylo pozorováno, že převodní systém srdeční může být původcem poruch srdečního rytmu (51). Tato náchylnost v souvislosti s vývojem převodního systému byla zkoumána na myším transgenním modelu. Detailní analýza vyvíjejícího se převodního systému byla provedena na srdcích embryonálních stadií ED 9,5–15,5 pomocí speciálního barvení a následné 3D rekonstrukce. Přítomnost vyvíjejícího se převodního systému byla pozorována v sinoatriálním uzlu, levé a pravé žilní chlopni, nepravém septu, levém a pravém AV prstenci, Hisově svazku, Tawarových raménkách, trabecula septomarginalis, Bachmanově svazku, zadní stěně levé síně v okolí ústí plicních žil a u pozdějších stadií i ve stěnách plicních žil (52). Tato pozorování podporují hypotézu, že struktury odvozené během vývoje z převodního systému mohou později sloužit jako substrát pro vznik arytmií u dospělého srdce. Důležité pozorování přinesla srovnávací studie mezi skupinou pacientů s levostrannou síňovou tachykardií pramenící z oblasti, kde se spojuje mitrální prstenec s aortálním, a skupinou myších embryí. Bylo zjištěno, že k vývoji specializovaného převodního systému v této arytmogenní oblasti dochází 11. den embryonálního vývoje (53).
Výjimečnou pozornost si z vývojového hlediska však zasluhuje původ myokardu plicních žil v oblasti jejich napojení na levou síň. Tato oblast má z pohledu vývoje svůj původ ve druhém kardiogenním poli (11). Oblast okolo ústí plicních žil je u člověka velmi frekventovaným zdrojem fibrilace síní, a proto bývá často proveden zákrok, kterým je tato oblast zavedeným ablačním katétrem elektricky izolována od okolního myokardu. Tento zákrok (katetrizační ablace) je čím dál častější, protože výskyt fibrilace síní v populaci stále narůstá.
Další studie na myších detailně popsala, jak buněčné linie prvního a druhého kardiogenního pole přispívají k formování převodního systému. V nejčasnějších fázích exprese byl HCN4 popsán jako marker prvního kardiogenního pole. Během pozdního prenatálního a časného postnatálního vývoje již HCN4 vystupoval jako marker celého převodního sytému (54). Pokud dojde k narušení programu udržujícího přirozený fenotyp myokardu plicních žil (např. snížení exprese transkripčních faktorů Pitx2c, Nkx2.5 nebo zvýšení exprese Shox2), začne se v této oblasti projevovat pacemakerový fenotyp (Cx40-negativní, HCN4-pozitivní). Právě abnormální exprese HCN4 v oblasti ústí plicních žil může mít poté za následek tvorbu ektopických vzruchů vedoucích až k fibrilaci síní (11, 55). Podobně je normální pravostranná lateralizace srdečního pacemakeru porušena v případě izomerismu podmíněného mutací genu PITX2 (56), kde dochází k vytvoření bilaterálních sinoatriálních uzlů, jež jsou plně funkční. Nedávno byl publikován přehledný článek o původu, diagnostice a léčbě prenatálně detekovaných arytmií v experimentu i klinice (50).
Adresa pro korespondenci:
prof. MUDr. David Sedmera, DSc.
Anatomický ústav 1. LF UK
U Nemocnice 3
128 00 Praha 2
Tel.: 224 965 941
e-mail: david.sedmera@lf1.cuni.cz
Sources
1. Sedmera D, Kurková D. Funkční a vývojový pohled na systém Purkyňových vláken. Časopis lékařů českých 2007; 146 : 673–676.
2. Eliška O. Purkyňova vlákna převodního systému srdce – historie a současnost Purkyňových objevů. Časopis lékařů českých 2006; 145 : 329–335.
3. Sedmera D, Pexieder T, Vuillemin M et al. Developmental patterning of the myocardium. Anat Rec 2000; 258 : 319–337.
4. Christoffels VM, Hoogaars WM, Moorman AF. Patterning and development of the conduction system of the heart: origins of the conduction system in development. In: Rosenthal N, Harvey RP (eds.). Heart Development and Regeneration. Elsevier, London, 2010 : 171–194.
5. Buckingham M, Meilhac S, Zaffran S. Building the mammalian heart from two sources of myocardial cells. Nat Rev Genet 2005; 6 : 826–835.
6. Christoffels VM, Mommersteeg MT, Trowe MO et al. Formation of the venous pole of the heart from an Nkx2-5-negative precursor population requires Tbx18. Circ Res 2006; 98 : 1555–1563.
7. Snarr BS, O’Neal JL, Chintalapudi MR et al. Isl1 expression at the venous pole identifies a novel role for the second heart field in cardiac development. Circ Res 2007; 101 : 971–974.
8. Bressan M, Liu G, Mikawa T. Early mesodermal cues assign avian cardiac pacemaker fate potential in a tertiary heart field. Science 2013; 340 : 744–748.
9. Kirby ML, Gale TF, Stewart DE. Neural crest cells contribute to normal aorticopulmonary septation. Science 1983; 220 : 1059–1061.
10. DiFrancesco D. Pacemaker mechanisms in cardiac tissue. Annu Rev Physiol 1993; 55 : 455–472.
11. Mommersteeg MT, Brown NA, Prall OW et al. Pitx2c and Nkx2-5 are required for the formation and identity of the pulmonary myocardium. Circ Res 2007; 101 : 902–909.
12. Mommersteeg MT, Hoogaars WM, Prall OW et al. Molecular pathway for the localized formation of the sinoatrial node. Circ Res 2007; 100 : 354–362.
13. DiFrancesco D. The role of the funny current in pacemaker activity. Circ Res 2010; 106 : 434–446.
14. Kolditz DP, Wijffels MC, Blom NA et al. Persistence of functional atrioventricular accessory pathways in postseptated embryonic avian hearts: implications for morphogenesis and functional maturation of the cardiac conduction system. Circulation 2007; 115 : 17–26.
15. Suma K. Sunao Tawara: a father of modern cardiology. Pacing Clin Electrophysiol 2001; 24 : 88–96.
16. Sedmera D, Gourdie RG. Why do we have Purkinje fibers deep in our heart? Physiol Res 2014; 63(Suppl. 1): S9–S18.
17. Blom NA, Gittenberger-de Groot AC, DeRuiter MC et al. Development of the cardiac conduction tissue in human embryos using HNK-1 antigen expression: possible relevance for understanding of abnormal atrial automaticity. Circulation 1999; 99 : 800–806.
18. Hoogaars WM, Tessari A, Moorman AF et al. The transcriptional repressor Tbx3 delineates the developing central conduction system of the heart. Cardiovasc Res 2004; 62 : 489–499.
19. Moorman AF, de Jong F, Denyn MM et al. Development of the cardiac conduction system. Circ Res 1998; 82 : 629–644.
20. Gourdie RG. A map of the heart: gap junctions, connexin diversity and retroviral studies of conduction myocyte lineage. Clin Sci (Lond) 1995; 88 : 257–262.
21. Bakker ML, Christoffels VM, Moorman AF. The cardiac pacemaker and conduction system develops from embryonic myocardium that retains its primitive phenotype. J Cardiovasc Pharmacol 2010; 56 : 6–15.
22. Gourdie RG, Wei Y, Kim D et al. Endothelin-induced conversion of embryonic heart muscle cells into impulse-conducting Purkinje fibers. Proc Natl Acad Sci U S A 1998; 95 : 6815–6818.
23. Chuck ET, Freeman DM, Watanabe M et al. Changing activation sequence in the embryonic chick heart. Implications for the development of the His-Purkinje system. Circ Res 1997; 81 : 470–476.
24. Rečková M, Rosengarten C, deAlmeida A et al. Hemodynamics is a key epigenetic factor in development of the cardiac conduction system. Circ Res 2003; 93 : 77–85.
25. Sedmera D, Rečková M, Bigelow MR et al. Developmental transitions in electrical activation patterns in chick embryonic heart. Anat Rec A Discov Mol Cell Evol Biol 2004; 280 : 1001–1009.
26. Karppinen S, Rapila R, Makikallio K et al. Endothelin-1 signalling controls early embryonic heart rate in vitro and in vivo. Acta Physiol (Oxf) 2014; 210 : 369–380.
27. Hirota A, Kamino K, Komuro H et al. Early events in development of electrical activity and contraction in embryonic rat heart assessed by optical recording. J Physiol 1985; 369 : 209–227.
28. Sedmera D, Wessels A, Trusk TC et al. Changes in activation sequence of embryonic chick atria correlate with developing myocardial architecture. Am J Physiol Heart Circ Physiol 2006; 291: H1646–H1652.
29. Leaf DE, Feig JE, Vasquez C et al. Connexin40 imparts conduction heterogeneity to atrial tissue. Circ Res 2008; 103 : 1001–1008.
30. Ammirabile G, Tessari A, Pignataro V et al. Pitx2 confers left morphological, molecular, and functional identity to the sinus venosus myocardium. Cardiovasc Res 2012; 93 : 291–301.
31. Beneš J Jr, Ammirabil G, Šanková B et al. The role of connexin40 in developing atrial conduction. FEBS Lett 2014; 588 : 1465–1469.
32. Liu J, Bressan M, Hassel D et al. A dual role for ErbB2 signaling in cardiac trabeculation. Development 2010; 137 : 3867–3875.
33. Gourdie RG, Harris BS, Bond J et al. Development of the cardiac pacemaking and conduction system. Birth Defects Res C Embryo Today 2003; 69 : 46–57.
34. Takebayashi-Suzuki K, Yanagisawa M, Gourdie RG et al. In vivo induction of cardiac Purkinje fiber differentiation by coexpression of preproendothelin-1 and endothelin converting enzyme-1. Development 2000; 127 : 3523–3532.
35. Sedmera D, Harris BS, Grant E et al. Cardiac expression patterns of endothelin-converting enzyme (ECE): implications for conduction system development. Dev Dyn 2008; 237 : 1746–1753.
36. Jay PY, Harri BS, Maguire CT et al. Nkx2-5 mutation causes anatomic hypoplasia of the cardiac conduction system. J Clin Invest 2004; 113(8): 1130–1137.
37. Jerome LA, Papaioannou VE. DiGeorge syndrome phenotype in mice mutant for the T-box gene, Tbx1. Nat Genet 2001; 27(3): 286–291.
38. Moskowitz IP, Pizard A, Patel VV et al. The T-box transcription factor Tbx5 is required for the patterning and maturation of the murine cardiac conduction system. Development 2004; 131 : 4107–4116.
39. Hoogaars WM, Engel A, Brons JF et al. Tbx3 controls the sinoatrial node gene program and imposes pacemaker function on the atria. Genes Dev 2007; 21 : 1098–1112.
40. Aanhaanen WT, Brons JF, Dominguez JN et al. The Tbx2+ primary myocardium of the atrioventricular canal forms the atrioventricular node and the base of the left ventricle. Circ Res 2009; 104 : 1267–1274.
41. Zhang SS, Kim KH, Rosen A et al. Iroquois homeobox gene 3 establishes fast conduction in the cardiac His-Purkinje network. Proc Natl Acad Sci U S A 2011; 108 : 13576–13581.
42. Frank DU, Carter KL, Thomas KR et al. Lethal arrhythmias in Tbx3-deficient mice reveal extreme dosage sensitivity of cardiac conduction system function and homeostasis. Proc Natl Acad Sci U S A 2012; 109: E154–E163.
43. Šanková B, Machálek J, Sedmera D. Effects of mechanical loading on early conduction system differentiation in the chick. Am J Physiol Heart Circ Physiol 2010; 298: H1571–H1576.
44. Hall CE, Hurtado R, Hewett KW et al. Hemodynamic-dependent patterning of endothelin converting enzyme 1 expression and differentiation of impulse-conducting Purkinje fibers in the embryonic heart. Development 2004; 131 : 581–592.
45. Naňka O, Křížová P, Fikrle M et al. Abnormal myocardial and coronary vasculature development in experimental hypoxia. Anat Rec (Hoboken) 2008; 291 : 1187–1199.
46. Kolditz DP, Wijffels MC, Blom NA et al. Epicardium-derived cells in development of annulus fibrosis and persistence of accessory pathways. Circulation 2008; 117 : 1508–1517.
47. Gurjarpadhye A, Hewett KW, Justus C et al. Cardiac neural crest ablation inhibits compaction and electrical function of conduction system bundles. Am J Physiol Heart Circ Physiol 2007; 292: H1291–H1300.
48. Buyon JP, Clancy RM. Neonatal lupus: review of proposed pathogenesis and clinical data from the US-based Research Registry for Neonatal Lupus. Autoimmunity 2003; 36 : 41–50.
49. Valderrabano M, Chen F, Dave AS et al. Atrioventricular ring reentry in embryonic mouse hearts. Circulation 2006. 114 : 543–549.
50. Sedmera D, Kočková R, Vostárek F et al. Arrhythmias in the developing heart. Acta Physiol (Oxf) 2015; 213 : 303–320.
51. Braunwald E, Zipes DP, Libbt P. Heart Disease: A Textbook of Cardiovascular Medicine (6th ed.). Saunders, Philadelphia, 2001 : 2281.
52. Jongbloed MR, Schalij MJ, Poelmann RE et al. Embryonic conduction tissue: a spatial correlation with adult arrhythmogenic areas. J Cardiovasc Electrophysiol 2004; 15 : 349–355.
53. Gonzalez MD, Contreras LJ, Jongbloed MR et al. Left atrial tachycardia originating from the mitral annulus-aorta junction. Circulation 2004; 110 : 3187–3192.
54. Liang X, Wang G, Lin L et al. HCN4 dynamically marks the first heart field and conduction system precursors. Circ Res 2013; 113 : 399–407.
55. Ye W, Wang J, Song Y et al. A common Shox2–Nkx2-5 antagonistic mechanism primes the pacemaker cell fate in the pulmonary vein myocardium and sinoatrial node. Development 2015; 142(14): 2521–2532.
56. Ammirabile G, Tessari A, Pignataro V et al. Pitx2 confers left morphological, molecular, and functional identity to the sinus venosus myocardium. Cardiovasc Res 2012; 93 : 291–301.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- Proměny patologie od dob Purkyňových
- Moderní pohled na převodní systém srdeční
- Analýza dat: výzvy a specifika v neurovědách a psychiatrii
- Sekundární příznaky zdravotního postižení v mezinárodních studiích
- Nové cesty pro zlepšení zdravotní gramotnosti seniorů
- Tradiční medicína a současnost: terapie dny
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Sekundární příznaky zdravotního postižení v mezinárodních studiích
- Moderní pohled na převodní systém srdeční
- Tradiční medicína a současnost: terapie dny
- Nové cesty pro zlepšení zdravotní gramotnosti seniorů
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

