-
Medical journals
- Career
Glykemická variabilita a mikrovaskulární komplikace diabetu
Authors: Martin Prázný; Jan Škrha; Jan Šoupal; Jan Škrha jr.
Authors‘ workplace: 3. interní klinika 1. LF UK a VFN v Praze
Published in: Čas. Lék. čes. 2017; 156: 308-313
Category: Review Articles
Overview
Cévní komplikace diabetu vznikají jako následek neuspokojivé kompenzace diabetu v delším časovém horizontu. Kompenzaci diabetu a riziko komplikací obvykle hodnotíme podle hodnoty glykovaného hemoglobinu HbA1c, která ovšem nic nevypovídá o krátkodobém kolísání glykemie. Díky rozvíjejícím se možnostem kontinuálního monitorování glykemie máme nyní možnost podrobně hodnotit změny v koncentraci glukózy a vypočítat krátkodobou glykemickou variabilitu. V souvislosti s výzkumem krátkodobé glykemické variability je však nyní více zkoumáno i dlouhodobé kolísání kompenzace diabetu, které je hodnoceno podle variability HbA1c.
Glykemická variabilita může mít vztah k oxidačnímu stresu, endotelové dysfunkci a zánětu, což jsou faktory podle současných názorů spojené s cévním poškozením. Tento přehledový článek shrnuje nedávné poznatky na poli glykemické variability a její možný vztah k mikrovaskulárním komplikacím u pacientů s diabetem 1. i 2. typu.Klíčová slova:
glykemická variabilita, variabilita HbA1c, mikrovaskulární komplikace, diabetes 1. a 2. typuÚVOD
Diabetes je spojen s častým výskytem cévního poškození, které vede k selhání orgánů a předčasné smrti. Obrovský dopad komplikací diabetu spustil rozsáhlý výzkum, který se v posledních letech významně zrychlil s tím, jak narůstá epidemie diabetu. Mikro - i makrovaskulární komplikace jsou u pacientů s diabetem významně urychleny následkem metabolických změn způsobených hyperglykemií. Nedávná analýza studie DCCT/EDIC potvrdila již dlouho známé pravidlo, že lepší krátkodobá a dlouhodobá kompenzace diabetu je spojena s nižším výskytem mikrovaskulárních komplikací (1).
Průměrná kompenzace diabetu podle hodnoty HbA1c je v současnosti hlavním parametrem, na jehož základě odhadujeme riziko diabetických komplikací. Zavedení kontinuální monitorace glukózy do klinické praxe přináší nové pohledy na hodnocení kompenzace diabetu a ukazuje, že musíme jít patrně daleko za rámec možností nyní běžně používaných glukometrů a HbA1c. Glykemická variabilita je důležitým dynamickým parametrem kompenzace diabetu, ačkoli ještě nevíme, jak moc je klinicky významná. Následující přehled shrnuje výsledky publikací z posledních 2 let, které hodnotily glykemickou variabilitu ve vztahu k mikrovaskulárním komplikacím.
PATOGENEZE CÉVNÍCH KOMPLIKACÍ VE VZTAHU KE GLYKEMICKÉ VARIABILITĚ
Vysoká koncentrace glukózy vede k aktivaci oxidačního stresu. Ke zvýšené produkci superoxidového radikálu dochází zejména v mitochondriích (2). Přechodně zvýšené koncentrace glukózy mohou prostřednictvím vyšší míry oxidačního stresu způsobovat i epigenetické změny (3) (obr. 1). Endotelová dysfunkce je následkem oxidačního stresu vyvolaného vysokou intracelulární koncentrací glukózy (4, 5). Nad rámec prosté setrvalé hyperglykemie se může na rozvoji endotelové dysfunkce v cévním řečišti podílet rovněž kolísání glykemie (6, 7). Oscilující hodnoty glukózy vedou k vyšší oxidační zátěži buněk a způsobují větší poškození endotelu než pouhá setrvalá hyperglykemie (8, 9). Je zajímavé, že hypoglykemie (často spojená s vyšší mírou kolísání glukózy) může mít dokonce větší vliv na dysfunkci endotelu než samotná kolísající glykemie bez hypoglykemií (10). V experimentu byl tento vliv ještě větší, když hypoglykemie následovala po hyperglykemii (11). Na cévním poškození se podílejí i další faktory. Kombinace lipotoxicity a glukotoxicity vedla ke zvýšené produkci reaktivních forem kyslíku v mitochondriích a k dalšímu zhoršení funkce endotelu (12). Tento nález je klinicky zajímavý a důležitý u pacientů s DM 2. typu, kde běžně nacházíme vyšší koncentraci volných lipidů.
Image 1. Schéma patogenního vlivu glykemické variability na mikrovaskulární poškození 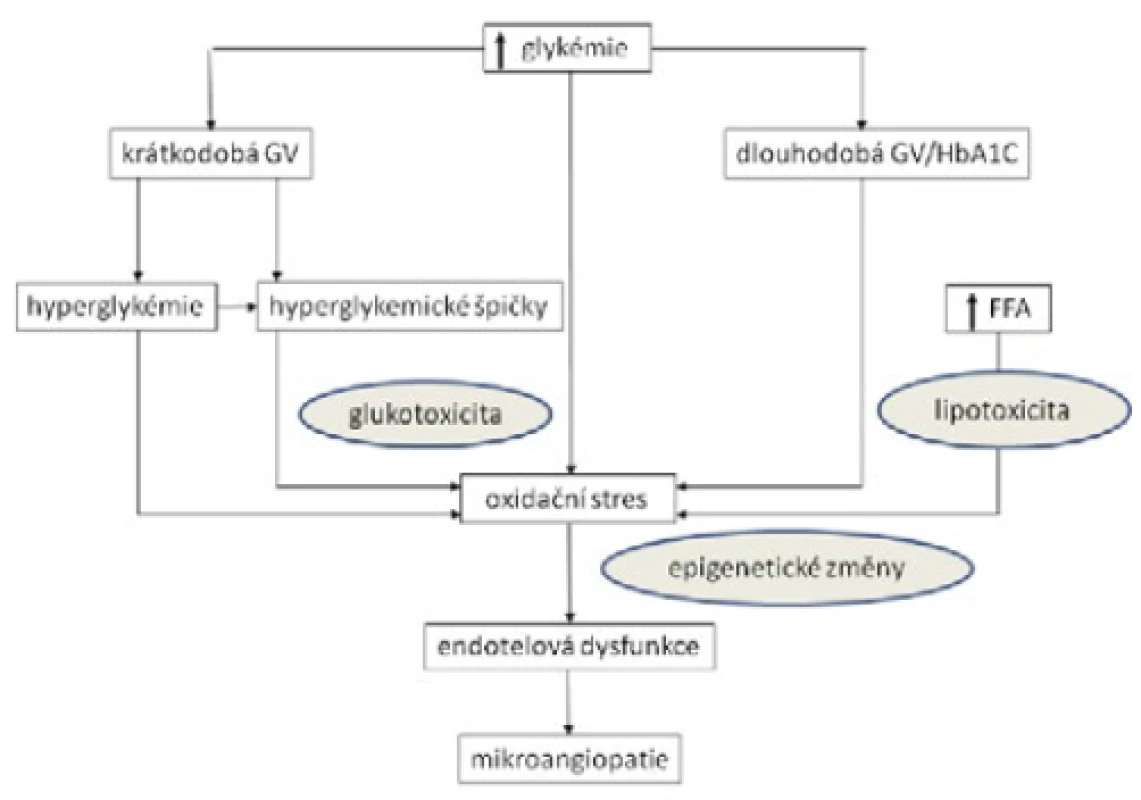
Významnou terapeutickou výzvu představují postprandiální hyperglykemie. Ačkoli se názory na postprandiální glykemické fluktuace různí, jeden z konceptů naznačuje, že jsou patrně významnější, než se doposud soudilo. I krátká, rychle odeznívající postprandiální hyperglykemie dostačuje k aktivaci oxidačního stresu. Možný vliv postprandiální hyperglykemie na rozvoji chronických komplikací diabetu nedávno ve své práci diskutovali Ceriello et al. (13).
Glykemická variabilita má patrně významný přídavný efekt nad rámec působení setrvale vysoké glykemie, protože vede k vyšší oxidační zátěži organismu. Je považována za klíčový faktor v rozvoji endotelové dysfunkce a následných morfologických změn cévní stěny. Následně se otevírá otázka, zda je glykemická variabilita také nezávislým rizikovým faktorem pro rozvoj mikrovaskulárních komplikací.
PARAMETRY POUŽÍVANÉ K HODNOCENÍ GLYKEMICKÉ VARIABILITY
Pro hodnocení dlouhodobé variability glykemie je v současnosti nejlepším parametrem HbA1c. Směrodatná odchylka (SD – standard deviation) nebo variační koeficient (CV – coefficient of variation) hodnot HbA1c určují míru kolísání dlouhodobé kompenzace diabetu, ať už se jedná o periodické (např. sezónní) nebo jiné oscilace. Vyšší dlouhodobá variabilita kompenzace DM byla nalezena u pacientů s progredující aterosklerózou, retinopatií či nefropatií (14–16).
K hodnocení krátkodobé glykemické variability lze užít řadu parametrů. Při jejich výběru je nutné zohlednit i zdroj dat a informační význam, který poskytují. Některé parametry (např. MAGE a CONGA) jsou přímo koncipovány pro použití s daty získanými pomocí kontinuálního monitorování glukózy (CGM – continuous glucose monitoring) (17, 18). Vztah mezi jednotlivými parametry glykemické variability (GV) kalkulovanými z hodnot CGM byl nedávno analyzován u pacientů s DM 1. i 2. typu a byla nalezena silná korelace mezi SD glukózy a výskytem hypoglykemií, což poukazuje na užitečnost hodnocení směrodatné odchylky v klinické praxi (19). SD a CV přináší pro běžnou klinickou praxi srozumitelnější informaci, navíc jsou to parametry, které lze jednoduše implementovat i do běžných glukometrů nebo softwaru, který s nimi pracuje.
Z klinického hlediska je důležité, že vysoké hodnoty SD a CV spolu s nízkou průměrnou glykemií naznačují vysoké riziko výskytu hypoglykemií. Současná data ukazují, že parametry krátkodobé i dlouhodobé GV je nutno dále zkoumat a že tyto parametry mohou být důležité pro výběr optimální léčebné strategie a také pro posouzení rizika chronických komplikací diabetu.
GLYKEMICKÁ VARIABILITA A HYPOGLYKEMIE
Vysoká GV zvyšuje riziko hypoglykemie zvláště tehdy, je-li průměrná glykemie blízko normálu či v normě. Pokud je kompenzace diabetu vyjádřená výbornou hodnotou HbA1c spojenou s vysokou GV, může to pro pacienta představovat nebezpečnou situaci z hlediska rizika zvýšeného výskytu hypoglykemie. Riziko komplikací při nízké glykemii nemusí být založené jen na akutních následcích hypoglykemických epizod, ale může spočívat i v aktivaci mechanismů, které mohou vést až k cévním komplikacím.
Zvýšená glykemická variabilita může být také spojena s autonomní kardiovaskulární neuropatií a opakované hypoglykemické příhody představují důležitý rizikový faktor kardiovaskulárních příhod. I u pacientů s DM 1. typu je hypoglykemie významně spojená s poruchou variability srdečního rytmu, navíc i u pacientů bez kardiovaskulárního onemocnění (20). V běžné klinické praxi by mělo být hodnocení rizika hypoglykemií vnímáno jako další parametr kompenzace diabetu a v případě, že je toto riziko vysoké, mělo by se zároveň neodkladně stát i terapeutickým cílem (21, 22).
Je známo, že pokles GV může vést rovněž k poklesu výskytu hypoglykemií (23). Zahrnout krátkodobou glykemickou variabilitu jako jeden z parametrů kompenzace diabetu a zároveň jako terapeutický cíl (spolu s rutinně zavedenou glykemií a HbA1c) při běžné péči o pacienty s DM může být relativně jednoduché. Hlavním argumentem pro tuto změnu klinického přístupu může být i fakt, že vysoká glykemická variabilita prakticky znemožňuje (kvůli vyššímu riziku hypoglykemie) dosáhnout optimálního cílového pásma glykemie (24).
KLINICKÁ DATA
Experimentální a klinická data jasně potvrzují spojení mezi hyperglykemií a endotelovou dysfunkcí, která je považována za první krok k rozvoji chronických cévních komplikací. Význam glykemické variability v procesu rozvoje komplikací diabetu je v současnosti předmětem výzkumu. Výsledky tohoto zkoumání se však u pacientů s DM 1. a 2. typu liší a stejně tak jsou prezentována různá data při výzkumu dlouhodobé variability glykemie (HbA1c) a krátkodobé glykemické variability (25). Proto jsou tyto výsledky diskutovány zvlášť pro krátkodobou a dlouhodobou GV a také pro DM 1. a 2. typu. Přehled diskutovaných publikací je uveden v tab. 1.
Table 1. Publikace potvrzující možný význam krátkodobé a dlouhodobé glykemické variability na rozvoj cévních komplikací 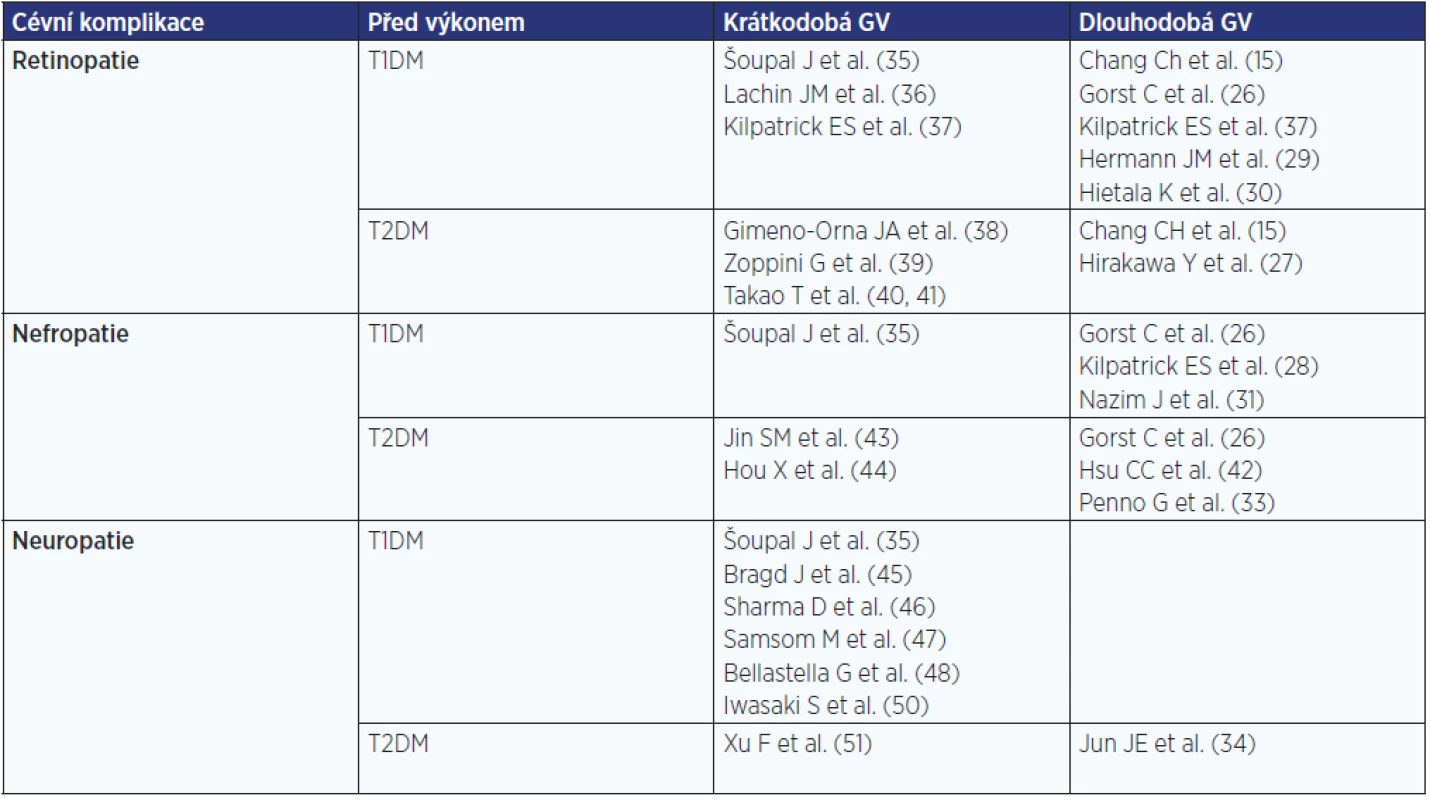
1. Dlouhodobá glykemická variabilita (variabilita HbA1c)
Nedávno publikovaná metaanalýza hodnotila vliv dlouhodobé GV na retinopatii, nefropatii, makrovaskulární příhody a mortalitu (26). Sedm studií u pacientů s DM 1. typu ukázalo asociaci variability HbA1c s progresí renálního postižení a kardiovaskulárními příhodami. Analýza 13 studií u pacientů DM 2. typu (26) ukázala, že variabilita HbA1c je spojená s vyšším výskytem jak renálního postižení, tak i makrovaskulárních příhod. Podobný vztah byl nalezen mezi dlouhodobou GV a makrovaskulárními komplikacemi u pacientů s DM 2. typu ve studii ADVANCE (27), zatímco pro krátkodobou GV byl ve stejné studii nalezen vztah s mikro - i makrovaskulárními komplikacemi.
Diabetická retinopatie a dlouhodobá GV
DM 1. typu
U pacientů s DM 1. typu ve studii DCCT Kilpatrick et al. (28) popsali významné zvýšení rizika retinopatie nejen s vyšší průměrnou hodnotou HbA1c, ale také s jeho vyšší variabilitou. Zvýšení směrodatné odchylky HbA1c o každé 1 % znamenalo více než dvojnásobné zvýšení rizika vývoje nebo progrese retinopatie. Velká německo-rakouská multicentrická analýza u 35 891 pacientů pak ukázala, že variabilita HbA1c je rizikovým faktorem pro diabetickou retinopatii nezávisle na průměrné kompenzaci diabetu (29).
Hietala et al. publikovali data ukazující, že riziko progrese diabetické retinopatie do stadia, kdy je nutné její laserové ošetření, závisí na variabilitě HbA1c (30). Ve studii FinnDiane tito autoři odhadli 5letou kumulativní incidenci laserového ošetření na 19 % pacientů v nejvyšším kvartilu dlouhodobé GV, zatímco v nejnižším kvartilu jen desetinu, což představuje o 60 % vyšší riziko. Podobně měli nemocní v nejvyšším kvartilu dlouhodobé GV zvýšené riziko proliferativní retinopatie ve srovnání s těmi s nízkou dlouhodobou GV (asi o 70 %).
DM 2. typu
U pacientů s DM 2. typu jsme nenalezli další publikace ukazující na možné spojení mezi dlouhodobou GV a retinopatií kromě již zmiňované studie ADVANCE (27). V té byla popsána pouze významná lineární závislost SD HbA1c s kombinovanými mikro - a makrovaskulárními příhodami, což jakékoli hodnocení asociace dlouhodobé GV a retinopatie velmi komplikuje.
Diabetická nefropatie a dlouhodobá GV
DM 1. typu
Podobně jako u retinopatie byl ve studii DCCT popsán také významně vyšší výskyt nefropatie se stoupající variabilitou HbA1c. Pro každé zvýšení SD HbA1c o 1 absolutní % riziko nefropatie stoupá o 80 % (28). U dětských pacientů s DM 1. typu byl v prospektivní studii o délce trvání 9 let nalezen významný vztah mezi rozvojem albuminurie a neuspokojivou a variabilní kompenzací DM hodnocenou podle variačního koeficientu HbA1c (31).
DM 2. typu
U nemocných s DM 2. typu byla v prospektivní studii trvající 6,2 roku a zahrnující 821 pacientů nalezena progredující albuminurie u těch s vyšší dlouhodobou GV (32). SD HbA1c byla nezávislým rizikovým faktorem spojeným s rozvojem albuminurie již po 2 letech sledování.
Ve velké kohortě pacientů v průřezové studii Penno et al. (33) popsali negativní ovlivnění albuminurie vysokou dlouhodobou GV nezávisle na průměrné hodnotě HbA1c. Variabilita HbA1c predikovala rozvoj makroalbuminurie a sníženou glomerulární filtraci u pacientů v pokročilých stadiích diabetické nefropatie.
Diabetická neuropatie a dlouhodobá GV
Periferní polyneuropatie a autonomní diabetická neuropatie jsou častými komplikacemi DM a nezřídka se objevují již časně v jeho průběhu. Tyto komplikace však relativně často zůstávají nerozpoznané, někdy dokonce není ani proveden pokus je diagnostikovat a ani v klinických studiích obvykle neuropatie nebývá zahrnuta jako klinický cíl mezi mikrovaskulární komplikace. Se stoupajícím zájmem o výzkum kardiovaskulární autonomní neuropatie (KAN) jakožto potenciální komplikace přispívající k náhlé smrti ovšem můžeme v budoucnu očekávat více dat o GV a diabetické neuropatii.
Pro současný přehled jsme nalezli pouze jednu studii týkající se KAN a variability HbA1c u pacientů s DM 2. typu; pro DM 1. typu nejsou k dispozici žádná data. V této studii byla zkoumána krátkodobá i dlouhodobá GV u 110 pacientů, variabilita HbA1c ze 2 předcházejících let byla posouzena pomocí SD a CV a ukázala se významná asociace obou parametrů variability HbA1c s přítomností KAN a s její závažností (34).
2. Krátkodobá glykemická variabilita
Na našem pracovišti jsme zkoumali krátkodobou GV u pacientů s DM 1. typu z dat získaných při 2týdenní CGM. Zjistili jsme, že glykemická variabilita hodnocená podle SD, CV a MAGE byla u pacientů s mikroangiopatií vyšší než u pacientů bez cévních změn (obr. 2) (35).
Image 2. Porovnání krátkodobé glykemické variability u pacientů s DM 1. typu bez komplikací (NE, bílé sloupce) a s mikrovaskulárními komplikacemi (ANO, černé sloupce). 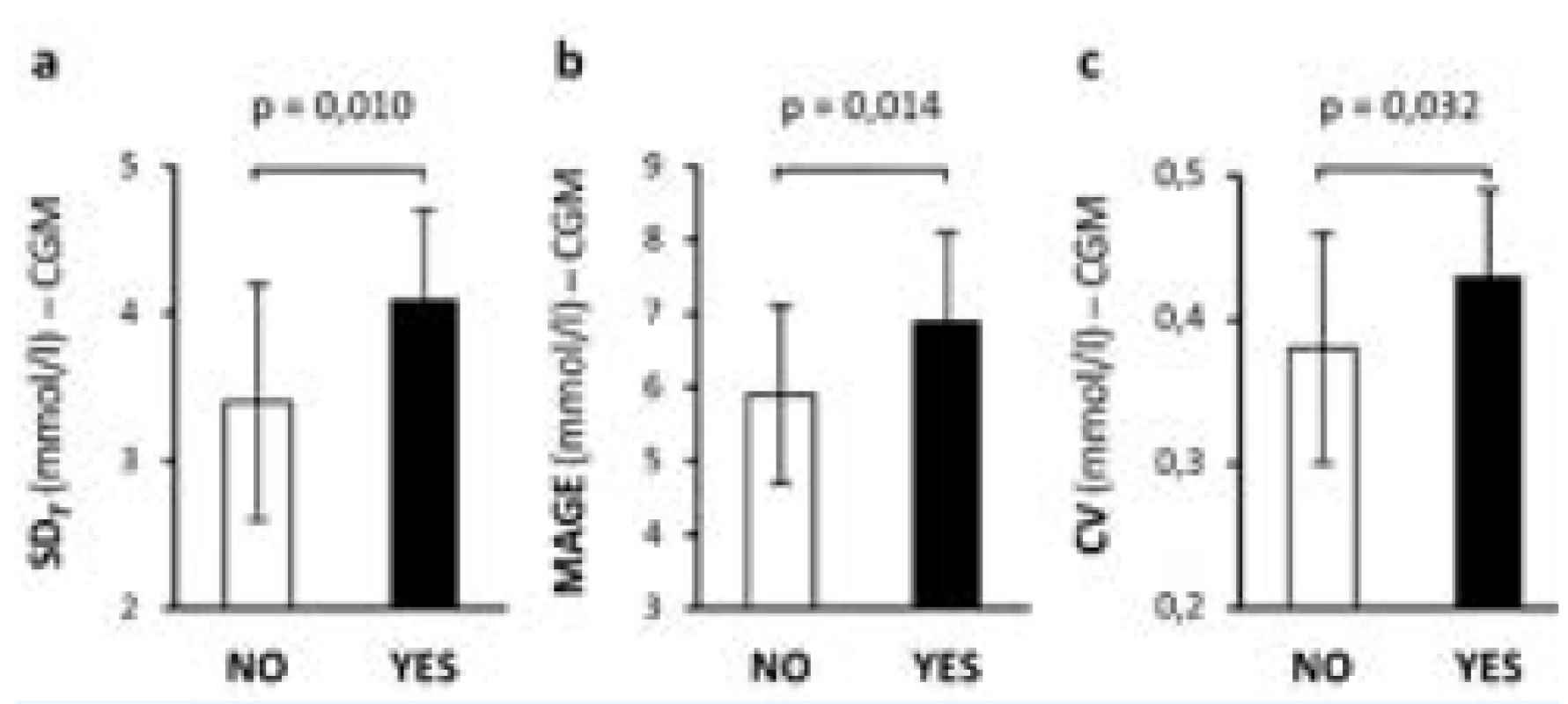
Upraveno podle (35). a) SDT – celková směrodatná odchylka koncentrace glukózy z CGM b) MAGE – mean amplitude of glycemic excursions c) CV – variační koeficient Diabetická retinopatie a krátkodobá GV
DM 1. typu
U pacientů s DM 1. typu ukazuje analýza studie DCCT, že ačkoli intenzifikovaná léčba inzulinem snížila riziko rozvoje diabetické retinopatie o 73 % ve srovnání se standardní léčbou, vyšší hodnoty HbA1c a délka trvání DM vysvětlují pouze 11 % rizika diabetické retinopatie. To znamená, že musejí existovat ještě další faktory nezávislé na HbA1c, které vysvětlí zbývajících 89 % (36).
Kilpatrick et al. (37) nenalezli žádné spojení mezi retinopatií a krátkodobou GV ve studii DCCT, nicméně tehdy byla GV vypočítána z 5–7bodových glykemických profilů, jež pacienti stanovovali každé 3 měsíce, což je dnes zjevně nedostačující. V námi publikované recentní observační průřezové studii u pacientů s DM 1. typu (35) měla skupina pacientů s diabetickou retinopatií významně vyšší GV počítanou z dat CGM ve srovnání s pacienty bez retinopatie. Podobně to platilo i pro ostatní mikrovaskulární komplikace.
DM 2. typu
U pacientů s DM 2. typu byla variabilita glykemie nalačno prediktorem rozvoje retinopatie ve studii, kterou provedli Gimeno-Orna et al. (38), zatímco ve studii VERONA nebyla nalezena žádná asociace glykemie nalačno s rozvojem či progresí retinopatie (39). Dvě japonské studie z jednoho pracoviště nicméně potvrdily asociaci mezi variabilitou glykemie nalačno a proliferativní i neproliferativní retinopatií u nemocných s DM 2. typu (40, 41). Tyto závěry jsou v souladu se závěry práce, kterou publikovali Hsu et al. (42).
Diabetická nefropatie a krátkodobá GV
DM 1. typu
U DM 1. typu neexistuje dostatek dat týkajících se GV a diabetických komplikací. V naší již dříve zmiňované průřezové studii byla popsána vyšší krátkodobá GV (SD, CV, MAGE) u nemocných s mikroalbuminurií ve srovnání s pacienty s normální exkrecí albuminu, přestože průměrná hodnota HbA1c byla v obou skupinách srovnatelná (35).
DM 2. typu
V případě DM 2. typu byla popsána významně zvýšená albuminurie u nemocných s vyšší GV hodnocenou podle SD a MAGE, nicméně při použití CV nebyl nalezen významný rozdíl. V této studii také nebyl prokázán nezávislý vztah mezi GV a albuminurií u pacientů s neuspokojivě kompenzovaným DM (43).
Postprandiální kolísání glykemie a jeho vztah ke glomerulární hyperfiltraci u pacientů s nově zjištěným diabetem převážně 2. typu ve věku nad 40 let zkoumali Hou et al. (44). Autoři nalezli významnou korelaci mezi glomerulární hyperfiltrací a GV pouze u dobře kompenzovaných pacientů s HbA1c < 7 %, ale nikoli u osob s horší kompenzací.
Diabetická neuropatie a krátkodobá GV
DM 1. typu
V případě DM 1. typu pozorovali během 11letého sledování Bragd et al. (45) ve své observační studii, že krátkodobá GV hodnocená z dat získaných pomocí selfmonitoringu byla prediktorem prevalence periferní neuropatie. Zároveň byla GV hraničně významným prediktorem incidence neuropatie. V naší průřezové studii u pacientů s DM 1. typu byla vyšší krátkodobá GV ve vztahu s porušeným vibračním čitím (VPT) měřeným pomocí bioteziometru. Ve stejné studii byl nalezen pozitivní vztah mezi porušeným VPT a vyšší GV (35).
Autonomní diabetická neuropatie je častou a podceňovanou komplikací DM. Je známo, že prodloužené vyprazdňování žaludku může u pacientů s diabetickou gastroparézou zvýšit GV (46) a naopak akutní kolísání glykemie může u pacientů s DM 1. typu ovlivňovat motilitu žaludku (47). Zvýšená GV v pásmu hypoglykemie hodnocená podle CGM, rovněž u pacientů s DM 1. typu, byla nezávisle asociovaná s předčasnou ejakulací (48). Mechanismus tohoto jevu je nejasný, ale může být spojen se změnami v serotoninergní signalizaci (49). Jako nepřímý ukazatel kardiovaskulární autonomní neuropatie byla studována variabilita srdečního rytmu u 31 pacientů s DM. Mezi variabilitou intervalu R-R a různými parametry GV byl nalezen významný vztah jak ve dne, tak i v noci (50).
DM 2. typu
Diabetická neuropatie je velmi častou komplikací DM 2. typu a pacienti často mívají porušené vibrační čití již v době diagnózy DM, ačkoli jsou u nich hodnoty HbA1c pouze mírně zvýšené. Krátkodobá GV byla zkoumána u pacientů s dobře kompenzovaným DM 2. typu (HbA1c < 7 %), přičemž nemocní se známou neuropatií měli významně vyšší GV hodnocenou podle SD a MAGE ve srovnání s těmi bez neuropatie (51). V této studii byl MAGE pro diabetickou polyneuropatii nezávislým rizikovým faktorem.
V jiné studii byla u pacientů s DM 2. typu zkoumána krátkodobá GV ze 3 dnů CGM a dlouhodobá variabilita HbA1c ve vztahu ke KAN. Multivariační analýza ukázala významnou nezávislou asociaci krátkodobé GV s přítomností autonomní neuropatie (34).
ZÁVĚR
Riziko mikrovaskulárních komplikací DM souvisí s kompenzací diabetu a je ovlivněno také faktory genetickými, epigenetickými a zevními vlivy. Výsledky experimentálních a klinických studií naznačují, že na mechanismech vedoucích k rozvoji cévního poškození se může podílet rovněž kolísání glykemie. Prospektivní randomizovaná klinická studie potvrzující GV jako nezávislý rizikový faktor diabetické mikroangiopatie však zatím chybí.
Z námi zpracovaného přehledu vyplývá, že existují poměrně významná data, jež potvrzují vztah mezi zvýšenou variabilitou HbA1c a rozvojem a progresí diabetické retinopatie u pacientů s DM 1. typu. U pacientů s DM 2. typu dostupná data neumožňují tento nález potvrdit, na druhou stranu zde některé studie naznačují možné spojení mezi retinopatií a zvýšenou variabilitou glykemie nalačno.
Několik studií ukazuje na určité spojení mezi variabilitou HbA1c a diabetickou nefropatií u pacientů s DM 1. i 2. typu, a to již velmi časně v průběhu jejich sledování. U pacientů s diabetem 1. typu bylo toto spojení potvrzeno i u pediatrické populace. Data týkající se krátkodobé GV a nefropatie jsou však nedostačující a opět chybí zejména jakákoli prospektivní studie u pacientů s DM 1. typu.
Nenalezli jsme žádné studie porovnávající dlouhodobou GV a diabetickou neuropatii u pacientů s DM 1. typu. U DM 2. typu byla variabilita HbA1c asociovaná s přítomností a závažností KAN. Naopak krátkodobá glykemická variabilita byla ve vztahu s různými formami diabetické neuropatie u pacientů s DM 1. i 2. typu, což naznačuje, že nervový systém může být k rychlému kolísání glykemie a k hypoglykemii obzvlášť citlivý. Stejně jako v předchozích případech však nejsou k dispozici žádná prospektivní data založená na hodnocení CGM.
Významný přínos ve výzkumu krátkodobé glykemické variability budou mít prospektivní randomizované klinické studie. FLAT-SUGAR je pilotní studií, která měla za cíl porovnání dvou terapeutických strategií ke snížení krátkodobé GV u pacientů s DM 2. typu. Výsledky této pilotní studie ukázaly, že léčba agonistou receptoru pro GLP-1 snížila hmotnost a GV. Dalšími cílovými ukazateli byly kardiovaskulární rizikové faktory, albuminurie a změny na EKG (52). Tyto výsledky by měly pomoci naplánovat rozsáhlejší prospektivní studii zaměřenou na redukci GV a taková studie je z etického hlediska proveditelná, protože extrémně vysoká GV a velmi časté hypoglykemie se u moderně léčených pacientů s DM 2. typu nevyskytují příliš často. Zároveň s klinickými studiemi jsou vyvíjeny nové experimentální postupy k hodnocení důsledků glykemické variability (53).
Hodnocení krátkodobé GV a jejího možného vztahu k mikrovaskulárním komplikacím je u pacientů s DM 1. typu výrazně komplikovanější. Jakýkoli dlouhodobý výzkum vlivu krátkodobé GV u pacientů s DM 1. typu by vyžadoval design tvořený dvěma větvemi pacientů s podobnou kompenzací, ale odlišnou GV (vysokou a nízkou). Vysoká glykemická variabilita a extrémní kumulace hypoglykemií není u pacientů s DM 1. typu nijak vzácná. Protože je dnes jasné, že následky hypoglykemií mohou být fatální, může být z etických důvodů jen těžko akceptovatelné vysokou GV neintervenovat a nesnažit se snížit výskyt hypoglykemií, i kdyby měla tato intervence proběhnout pouze pomocí cílené edukace a reedukace. Je tedy možné, že tento typ studie nebude u pacientů s diabetem 1. typu nikdy proveden.
Poděkování
Publikace byla podpořena grantem AZV MZ ČR č. 15-26705A a výzkumným projektem P25/LF1/2 Univerzity Karlovy v Praze.
Adresa pro korespondenci:
doc. MUDr. Martin Prázný, CSc., Ph.D.
3. interní klinika 1. LF UK a VFN v Praze
U Nemocnice 1
120 00 Praha 2
Tel.: 224 966 692
e-mail: mpra@lf1.cuni.cz
Sources
1. Nathan DM, McGee P, Steffes MW, Lachin JM. Relationship of glycated albumin to blood glucose and HbA1c values and to retinopathy, nephropathy and cardiovascular outcomes in the DCCT/EDIC study. Diabetes 2014; 63 : 282–290.
2. Brownlee M. The pathobiology of diabetic complications – a unifying mechanism. Diabetes 2005; 54 : 1615–1625.
3. El-Osta A, Brasacchio D, Yao DC et al. Transient high glucose causes persistent epigenetic changes and altered gene expression during subsequent normoglycemia. J Exp Med 2008; 205 : 2409–2417.
4. Wang L, Wang J, Fang J et al. High glucose induces and activates Toll-like receptor 4 in endothelial cells of diabetic retinopathy. Diabetol Metab Syndr 2015; 7 : 89.
5. De NigrisV, Pujadas G, La Sala L et al. Short-term high glucose exposure impairs insulin signaling in endothelial cells. Cardiovasc Diabetol 2015; 14 : 114.
6. Monnier L, Mas E, Ginet C et al. Activation of oxidative stress by acute glucose fluctuations compared with sustained chronic hyperglycemia in patients with type 2 diabetes. JAMA 2006; 295 : 1681–1687.
7. Zhang XG, Zhang YQ, Zhao DK et al. Relationship between blood glucose fluctuation and macrovascular endothelial dysfunction in type 2 diabetic patients with coronary heart disease. Eur Rev Med Pharmacol Sci 2014; 18 : 3593–3600.
8. Ceriello A, Esposito K, Piconi L et al. Oscillating glucose is more deleterious to endothelial function and oxidative stress than mean glucose in normal and type 2 diabetic patients. Diabetes 2008; 57 : 1349–1354.
9. Schisano B, Tripathi G, McGee K et al. Glucose oscillations, more than constant high glucose, induce p53 activation and a metabolic memory in human endothelial cells. Diabetologia 2011; 54 : 1219–1226.
10. Pena AS, Couper JJ, Harrington J et al. Hypoglycemia, but not glucose variability, relates to vascular function in children with type 1 diabetes. Diabetes Technol Ther 2012; 14 : 457–462.
11. Ceriello A, Novials A, Ortega E et al. Hyperglycemia following recovery from hypoglycemia worsens endothelial damage and thrombosis activation in type 1 diabetes and in healthy controls. Nutr Metab Cardiovasc Dis 2014; 24 : 116–123.
12. Kumar B, Kowluru A, Kowluru RA. Lipotoxicity augments glucotoxicity-induced mitochondrial damage in the development of diabetic retinopathy. Invest Ophthalmol Vis Sci 2015; 56 : 2985–2992.
13. Ceriello A, Kilpatrick ES. Glycemic variability: both sides of the story. Diabetes Care 2013; 36(Suppl. 2): S272–S275.
14. Yang HK, Kang B, Lee SH et al. Association between hemoglobin A1c variability and subclinical coronary atherosclerosis in subjects with type 2 diabetes. J Diabetes Complicat 2015; 29 : 776–782.
15. Chang CH, Chuang LM. Glycated hemoglobin variability and retinopathy progression in type 1 diabetes: is month-to-month instability a better predictor? J Diabetes Investig 2014; 5 : 149–151.
16. Cheng DS, Fei Y, Liu Y et al. HbA1c variability and the risk of renal status progression in diabetes mellitus: a meta-analysis. PLoS One 2014; 9: e115509.
17. Kohnert KD, Heinke P, Vogt L, Salzsieder E. Utility of different glycemic control metrics for optimizing management of diabetes. World J Diabetes 2015; 6 : 17–29.
18. Service FJ. Glucose variability. Diabetes 2013; 62 : 1398–1404.
19. Saisho Y, Tanaka C, Tanaka K et al. Relationships among different glycemic variability indices obtained by continuous glucose monitoring. Primary Care Diabetes 2015; 9 : 290–296.
20. Jaiswal M, McKeon K, Comment N et al. Association between impaired cardiovascular autonomic function and hypoglycemia in patients with type 1 diabetes. Diabetes Care 2014; 37 : 2616–2621.
21. Hirsch IB. Glycemic variability and diabetes complications: does it matter? Of course it does! Diabetes Care 2015; 38 : 1610–1614.
22. Rodbard D. Evaluating quality of glycemic control: graphical displays of hypo - and hyper-glycemia, time in target range, and mean glucose. J Diabetes Sci Technol 2015; 9 : 56–62.
23. Niskanen L, Virkamäki A, Hansen JB, Saukkonen T. Fasting plasma glucose variability as a marker of nocturnal hypoglycemia in diabetes: evidence from the PREDICTIVE study. Diabetes Res Clin Pract 2009; 86: e15–e18.
24. Cryer PE. Hypoglycemia: still the limiting factor in the glycemic management of diabetes. Endocr Pract 2008; 14 : 750–756.
25. Smith-Palmer J, Brändle M, Trevisan R et al. Assessment of the association between glycemic variability and diabetes-related complications in type 1 and type 2 diabetes. Diabetes Res Clin Pract 2014; 105 : 273–284.
26. Gorst C, Kwak CS, Aslam S et al. Long-term glycemic variability and risk of adverse outcomes: a systematic review and meta-analysis. Diabetes Care 2015; 38 : 2354–2369.
27. Hirakawa Y, Arima H, Zoungas S et al. Impact of visit-to-visit glycemic variability on the risks of macrovascular and microvascular events and all-cause mortality in type 2 diabetes: the ADVANCE trial. Diabetes Care 2014; 37 : 2359–2365.
28. Kilpatrick ES, Rigby AS, Atkin SL. A1C variability and the risk of microvascular complications in type 1 diabetes: data from the Diabetes Control and Complications Trial. Diabetes Care 2008; 31 : 2198–2202.
29. Hermann JM, Hammes HP, Rami-Mehar B et al. HbA1c variability as an independent risk factor for diabetic retinopathy in type 1 diabetes: a German/Austrian multicenter analysis on 35,891 patients. PLoS One 2014; 9: e91137.
30. Hietala K, Waden J, Forsblom C et al. HbA1c variability is associated with an increased risk of retinopathy requiring laser treatment in type 1 diabetes. Diabetologia 2013; 56 : 737–745.
31. Nazim J, Fendler W, Starzyk J. Metabolic control and its variability are major risk factors for microalbuminuria in children with type 1 diabetes. Endokrynol Pol 2014; 65 : 83–89.
32. Hsu CC, Chang HY, Huang MC et al. HbA1c variability is associated with microalbuminuria development in type 2 diabetes: a 7-year prospective cohort study. Diabetologia 2012; 55 : 3163–3172.
33. Penno G, Solini A, Bonora E et al. HbA1c variability as an independent correlate of nephropathy, but not retinopathy, in patients with type 2 diabetes. The Renal Insufficiency And Cardiovascular Events (RIACE) Italian multicenter study. Diabetes Care 2013; 36 : 2301–2310.
34. Jun JE, Jin SM, Baek J et al. The association between glycemic variability and diabetic cardiovascular autonomic neuropathy in patients with type 2 diabetes. Cardiovasc Diabetol 2015; 14 : 70–78.
35. Šoupal J, Škrha Jr J, Fajmon M et al. Glycemic variability is higher in type 1 diabetes patients with microvascular complications irrespective of glycemic control. Diabetes Technol Ther 2014; 16 : 198–203.
36. Lachin JM, Genuth S, Nathan DM et al. Effect of glycemic exposure on the risk of microvascular complications in the diabetes control and complications trial revisited. Diabetes 2008; 57 : 995–1001.
37. Kilpatrick ES, Rigby AS, Atkin SL. The effect of glucose variability on the risk of microvascular complications in type 1 diabetes. Diabetes Care 2006; 29 : 1486–1490.
38. Gimeno-Orna JA, Castro-Alonso FJ, Boned-Juliani B, Lou-Arnal LM. Fasting plasma glucose variability as a risk factor of retinopathy in type 2 diabetic patients. J Diabetes Complicat 2003; 17 : 78–81.
39. Zoppini G, Verlato G, Targher G et al. Is fasting glucose variability a risk factor for retinopathy in people with type 2 diabetes? Nutr Metab Cardiovasc Dis 2009; 19 : 334–339.
40. Takao T, Ide T, Yanagisawa H et al. The effect of fasting plasma glucose variability on the risk of retinopathy in type 2 diabetic patients: retrospective long-term follow-up. Diabetes Res Clin Pract 2010; 89 : 296–302.
41. Takao T, Ide T, Yanagisawa H et al. The effects of fasting plasma glucose variability and time dependent glycemic control on the long-term risk of retinopathy in type 2 diabetic patients. Diabetes Res Clin Pract 2011; 91: e40–e42.
42. Hsu CR, Chen YT, Sheu WHH. Glycemic variability and diabetes retinopathy: a missing link. J Diabetes Complicat 2015; 29 : 302–306.
43. Jin SM, Kim TH, Baek SOJ et al. Association between the extent of urinary albumin excretion and glycaemic variability indices measured by continuous glucose monitoring. Diabet Med 2015; 32 : 274–279.
44. Hou X, Wang C, Wang S et al. Fluctuation between fasting and 2-H postload glucose state is associated with glomerular hyperfiltration in newly diagnosed diabetes patients with HbA1c < 7%. PLoS One 2014; 9: e111173.
45. Bragd J, Adamson U, Bäcklund LB et al. Can glycaemic variability, as calculated from blood glucose selfmonitoring, predict the development of complications in type 1 diabetes over a decade? Diabetes Metab 2008; 34 : 612–616.
46. Sharma D, Morrison G, Joseph F et al. The role of continuous subcutaneous insulin infusion therapy in patients with diabetic gastroparesis. Diabetologia 2011; 54 : 2768–2770.
47. Samsom M, Akkermans LM, Jebbink RJ et al. Gastrointestinal motor mechanisms in hyperglycaemia induced delayed gastric emptying in type I diabetes mellitus. Gut 1997; 40 : 641–646.
48. Bellastella G, Maiorino MI, Olita L et al. Premature ejaculation is associated with glycemic control in type 1 diabetes. J Sex Med 2015; 12(1): 93–99.
49. Martín-Cora FJ, Fornal CA, Metzler CW, Jacobs BL. Insulin induced hypoglycemia decreases single-unit activity of serotonergic medullary raphe neurons in freely moving cats: relationship to sympathetic and motor output. Eur J Neurosci 2002; 16 : 722–734.
50. Iwasaki S, Kozawa J, Fukui K et al. Coefficient of variation of R-R interval closely correlates with glycemic variability assessed by continuous glucose monitoring in insulin-depleted patients with type 1 diabetes. Diab Res Clin Pract 2015; 109 : 397–403.
51. Xu F, Zhao L, Su J et al. The relationship between glycemic variability and diabetic peripheral neuropathy in type 2 diabetes with well-controlled HbA1c. Diabet Metab Syndr 2014; 6 : 139–145.
52. Probstfield JL, Hirsch I, O'Brien K et al.; The FLAT-SUGAR Trial investigators. Design of FLAT-SUGAR: randomized trial of prandial insulin versus prandial GLP-1 receptor agonist together with basal insulin and metformin for high-risk type 2 diabetes. Diabetes Care 2015; 38 : 1558–1566.
53. Kuricová K, Pácal L, Šoupal J et al. Effect of glucose variability on pathways associated with glucotoxicity in diabetes: evaluation of a novel in vitro experimental approach. Diabetes Res Clin Pract 2016; 114 : 1–8.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- Glykemická variabilita a mikrovaskulární komplikace diabetu
- Nové směřování chirurgické léčby obezity a některých metabolických onemocnění
- Postavení farmakoterapie v současné péči o obézní
- Incidence diabetu z pohledu dávek systému sociálního zabezpečení
- Tzv. protikuřácký zákon a poskytovatelé zdravotních služeb
- Hyperlipoproteinemie a (nejen) ateroskleróza: střípky z historie i současnosti
- Kam míří technologie v diabetologii?
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Kam míří technologie v diabetologii?
- Nové směřování chirurgické léčby obezity a některých metabolických onemocnění
- Glykemická variabilita a mikrovaskulární komplikace diabetu
- Incidence diabetu z pohledu dávek systému sociálního zabezpečení
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

