-
Medical journals
- Career
Vyšetření mutace KRAS v EUS-FNA preparátech pacientů s tumorem pankreatu
Authors: MUDr. Bohuš Bunganič 1; Mgr. Tereza Hálková; RNDr. Ph.D. Lucie Benešová; Bc. Barbora Belšánová; MUDr. Martin Laclav; MUDr. Martina Hrůzová; MUDr. Eva Traboulsi; prof. MUDr. CSc. Přemysl Frič; MUDr. Ph.D. Štěpán Suchánek; RNDr. Ph.D. Marek Minárik; prof. MUDr. Ph.D. Miroslav Zavoral
Authors‘ workplace: Interní klinika 1. LF UK a ÚVN − Vojenské fakultní nemocnice Praha: U Vojenské nemocnice 1200, 160 00 Praha 1; Centrum aplikované genomiky solidních nádorů (CEGES), Genomac výzkumný ústav, s. r. o., Praha: Drnovská 1112/60, 161 00 Praha 6
Published in: Čas. Lék. čes. 2016; 155: 48-51
Category: Original Article
Overview
Diferenciální diagnostika pankreatických solidních tumorů pomocí EUS-FNA je asi v 10–15 % případů náročná. Slibnou metodou, která v těchto případech pomáhá rozlišit chronickou pankreatitidu a karcinom, je vyšetření bodové mutace proto-onkogenu KRAS. Doposud však není zavedená do klinické praxe.
Cílem zkoumání bylo stanovení senzitivity testu KRAS s použitím různých typů vzorků pacientů s tumory pankreatu a testování vlivu přítomnosti mutace KRAS na prognózu přežití těchto pacientů. 147 pacientů podstoupilo EUS-FNA vyšetření pankreatického tumoru doplněné o odběr vzorku krve s následnou separací plazmy pro detekci cirkulující tumorové DNA. Část bioptického vzorku byla ponechána nativní ve stabilizačním roztoku a část byla zpracována do cytologického nátěru. Vzorky (nativní aspiráty, cytologické nátěry, plazma) byly vyšetřeny na přítomnost mutace genu KRAS metodou heteroduplexní analýzy pomocí denaturační kapilární elektroforézy.
V souboru 147 pacientů s ložiskovým procesem pankreatu byl diagnostikován 118x karcinom, 26x chronická pankreatitida, 3x neuroendokrinní tumor. Celkem bylo vyšetřeno 147 nativních aspirátů, 118 cytologických nátěrů a 94 vzorků plazmy. Ve skupině pacientů s karcinomem pankreatu bylo nejvyšší senzitivity vyšetření mutace KRAS dosaženo při použití cytologických preparátů, kdy byla mutace detekována v 90 % (106/118) vzorků. Při použití nativních buněčných aspirátů byla mutace detekována v 78 % (92/118) a vyšetření plazmy bylo pozitivní ve 27 % (24/90) případů. U čtyř pacientů s chronickou pankreatitidou byla detekována mutace KRAS, ačkoliv u žádného z nich nebyl karcinom potvrzen cytologicky. U dvou z těchto pacientů byl v dalším průběhu potvrzen karcinom, jeden pacient zemřel předčasně na komplikace alkoholového deliria a poslední byl indikován k radikálnímu chirurgickému zákroku.
Vyšetření mutace KRAS lze provádět u všech pacientů podstupujících EUS-FNA, přičemž nejvhodnějším typem vzorků pro toto vyšetření jsou cytologické preparáty. Vyšetření KRAS je vhodné aplikovat ve skupině pacientů s nejasnou diferenciální diagnostikou, zvláště pak u nemocných s chronickou pankreatitidou, kde metoda umožňuje identifikovat časný karcinom pankreatu v nepřehledném terénu zánětlivých změn.Klíčová slova:
karcinom pankreatu, chronická pankreatitida, mutace KRAS , EUS-FNAÚvod
Tumory pankreatu přestavují diagnostické dilema asi v 10-15% případů (1-4). Zejména rozlišení benigní a maligní etiologie je pro další léčbu pacientů zcela zásadní. Pacienti s časně diagnostikovaným karcinomem pankreatu mají největší šanci na vyléčení (tab 1.) (5, 6). Přibližně v 90% případů, je diagnóza stanovena v pozdním stádiu, a tedy s minimální šancí na přežití (7). Hlavním důvodem pozdní diagnózy je absence časných příznaků tohoto onemocnění (8).
Table 1. Přežití pacientů s karcinomem pankreatu podle stadia TNM 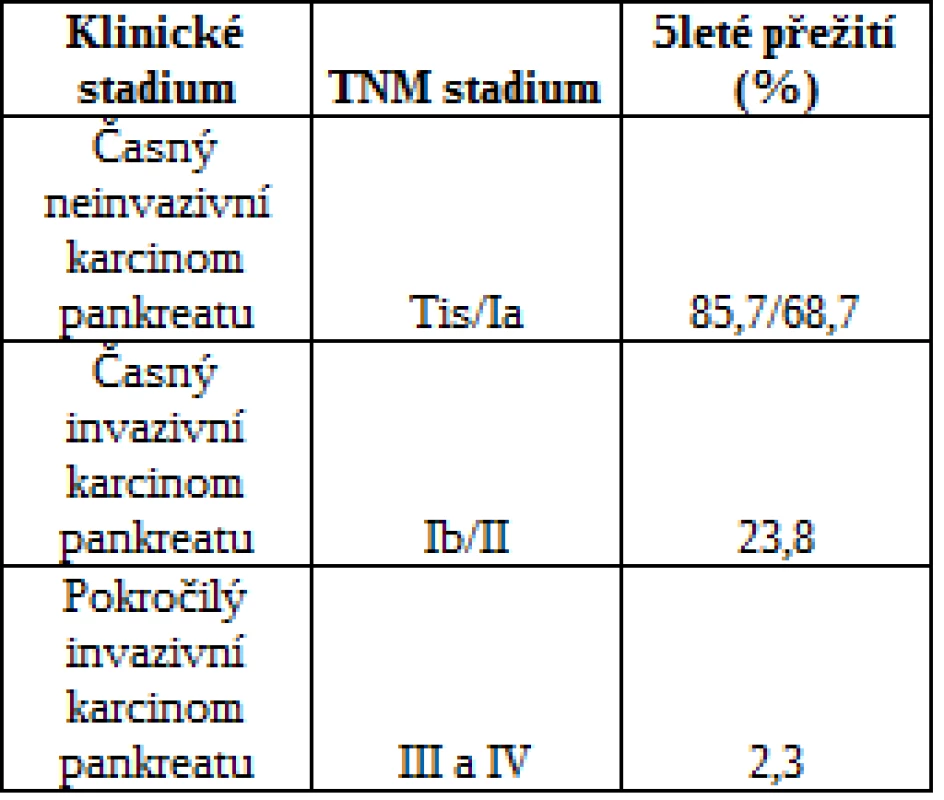
V časné fázi procesu karcinogeneze, ještě před morfologickými změnami pankreatického duktálního epitelu, bylo zjištěno několik genetických alterací včetně mutace protoonkogenu KRAS (9), která je nalézána až v 93% karcinomů pankreatu (10), zatímco v tkáni chronické pankretitidy přítomna nebývá (11). Stanovení mutace KRAS tedy může tedy v diagnostickém procesu pankreatických lézí pomoci odlišit chronickou pankreatitidu a karcinom. I přes značný pokrok v genetickém testování však nadále není vyšetření KRAS mutace zavedeno do běžné klinické praxe. Obzvlášť testování KRAS ze vzorků získaných endosonograficky tenkojehlovou aspirací (EUS-FNA) je výjimečné, což je dané pravděpodobně obavou z nedostatečné velikosti EUS-FNA vzorků pro genetické analýzy. Z tohoto důvodu jsme se rozhodli v rámci této studie otestovat využitelnost dvou typů bioptických vzorků, nativních aspirátů a cytologických preparátů, pro rutinní stanovení KRAS mutace. Nově se nabízí také možnost vyšetřování molekulárních markerů z cirkulující tumorové DNA (ctDNA) (8, 12), proto jsme možnost rutinního vyšetřování KRAS mutace testovali také ve vzorcích plazmy. Senzitivitu KRAS testu jsme stanovili ve všech třech typech použitých vzorků a zaměřili jsme se také na prověření často diskutované prognostické role KRAS mutace.
Materiál a metody
Pacienti
Do studie bylo zahrnuto celkem 147 pacientů s tumorem pankreatu, kteří podstoupili vyšetření EUS s FNA a následný odběr krve. V souboru bylo 118 pacientů s karcinomem pankreatu, 26 pacientů s chronickou pankreatitidou a 3 pacienti s neuroendokrinním tumorem. Skupinu pacientů s karcinomem tvořilo 64 mužů ve věku průměrně 69 ± 9 let (rozmezí 44–92 let) a 54 žen ve věku průměrně 66 ± 9 let (rozmezí 44–87 let) s PDAC ve stadiu II (n = 3), III (n = 53) a IV (n=58), u čtyř pacientů nebylo stadium onemocnění určeno. Studie byla provedena v souladu se zásadami uvedenými v Helsinské deklaraci a schválena Etickou komisí Ústřední vojenské nemocnice – Vojenské fakultní nemocnice v Praze. Všichni jedinci zařazení do studie podepsali informovaný souhlas s vyšetřením.
Metody
Endosonografické vyšetření prováděli dva endoskopisté. K vyšetření byl použit lineární elektronický echoendoskop GF-UCT 180 Olympus a ultrazvukový přístroj Aloka Prosound Alpha 10. K EUS-FNA byly použity jehly Pro-Core 19 G a 22 G (Cook Medical), Expect 19 G a 22 G (Boston Scientific) a standardní jehly Olympus 22 G. Při konvenčním EUS byla u každé léze popsána lokalizace, velikost, homogenita, echogenita a okraje. Jako karcinom bylo označeno ložisko hypoechogenní a nehomogenní a/nebo s nepravidelnými okraji (13). Pro diagnózu chronické pankreatitidy byla použita Rosemontská kritéria (14).
Část bioptického vzorku byla uchována nativní ve stabilizačním roztoku při -20 °C, část byla zpracována do cytologického nátěru. Suché cytologické nátěry byly doručeny na patologii, kde byly vzorky fixovány a barveny roztokem Giemsa Romanovski a cytolopatolog se specializací v pankreatobiliární diagnostice následně provedl jejich zhodnocení. Na cytologických preparátech byla cytopatologem vyznačena oblast s majoritním výskytem nádorových buněk (minimálně 80 %) a vzorky byly poté odeslány na genetickou analýzu.
Izolace DNA a detekce mutace KRAS
V případě aspirátů byl materiál ve stabilizačním roztoku rozmražen, centrifugován pro vytvoření pelety a peleta byla využita pro izolaci DNA. Z cytologických preparátů byl mikrodisekován materiál z vyznačené oblasti nádorových buněk a přenesen do mikrozkumavky. DNA pak byla z obou typů materiálu izolována kitem Recover All Total Nucleic Acid isolation (Ambion) podle pokynů výrobce, pouze 1. krok izolace (deparafinizace) byl vynechán. Ze vzorku krve byla nejprve dvojí centrifugací separována plazma a bezprostředně zmražena na -20 °C. Ve zmraženém stavu byla dopravena do genetické laboratoře, kde byla z plazmy izolována ctDNA kitem NucleoSpin Plasma XS (Macherey-Nagel, Dueren, Německo).
Detekce somatických mutací genu KRAS byla ve všech třech typech vzorků provedena metodou PCR s následnou heteroduplexní analýzou pomocí kapilární gelové elektroforézy při teplotním gradientu na přístroji ABI Prism 3100 (Applied Biosciences), stejně jako v předchozích studiích (15, 16). Výsledky heteroduplexní analýzy byly vizualizovány pomocí softwaru Gene Marker v2.4.2.
Test prognostické role mutace KRAS
K této analýze byly využity pouze cytologické preparáty,ve kterých bylo dosaženo nejvyšší senzitivity. Pacienti byli rozděleni do skupiny s mutací KRAS a bez této mutace. Byla stanovena korelace přítomnosti mutace KRAS s prognózou (celkovým přežitím) pomocí Kaplanovy-Meierovy metody a křivky přežití obou skupin pacientů byly porovnány pomocí log-rank testu. Za statisticky významné byly považovány hodnoty p ˂ 0,05.
Výsledky
Endosonografie
Endosonografie je považována za metodu s nejvyšší senzitivitou pro stanovení diagnózy fokální pankreatické léze i pro staging pankreatického karcinomu (13). Všichni pacienti podstoupili EUS vyšetření. Byla vypočtena senzitivita, specificita, pozitivní prediktivní hodnota a negativní prediktivní hodnota pro EUS, které dosahovali 82,9%, 45,5%, 82,9% a 45,5%.
Tenkojehlová aspirace (FNA)
Tenkojehlová aspirace je bezpečná metoda zavedená pro vyšetření všech pacientů s podezřením na karcinom při EUS vyšetření. V této studii dosahovala celková senzitivita FNA, bez přítomnosti patologa při EUS vyšetření, pro karcinom pankreatu 88 %, specificita 100 %, PPV 100 %, NPV 20 %. Jako nekonkluzivních bylo patologem označeno 13 % vzorků.
Genetická analýza
Celkem bylo na přítomnost mutace KRAS testováno 147 nativních aspirátů všech pacientů podstupujících EUS-FNA, 118 cytologických preparátů a 94 vzorků plazmy pacientů s karcinomem pankreatu. Úspěšnost stanovení mutace KRAS je shrnuta v tab. 2. U pacientů s NET a CHP byly k testu KRAS použity pouze nativní buněčné aspiráty se záchytem 0/3 (0 %), respektive 4/26 (15 %).
Table 2. Úspěšnost stanovení mutace KRAS 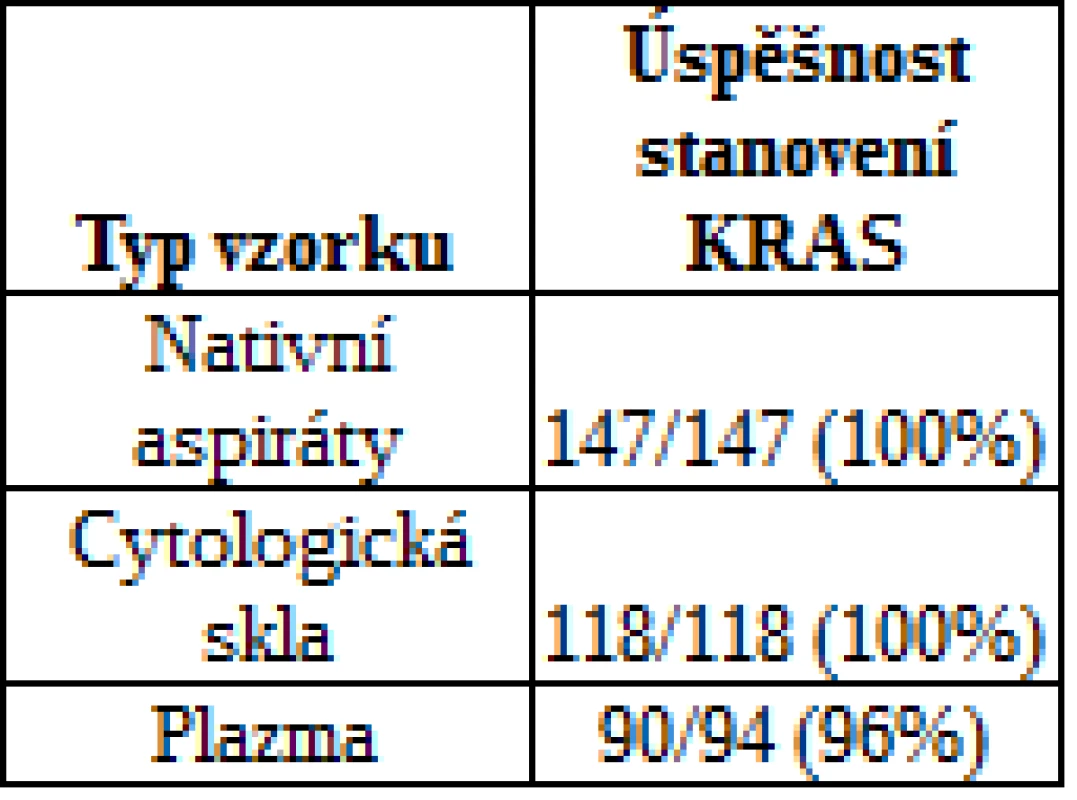
Pro skupinu pacientů s karcinomem pankreatu byly k dispozici všechny 3 typy vzorků, přičemž nejvyšší senzitivity detekce (záchytu) mutace KRAS bylo dosaženo při použití cytologických preparátů (90 %). V nativních aspirátech byla mutace detekována pouze v 78 % případů, výsledky vyšetření v těchto vzorcích tedy byly ve 12 % případů falešně negativní. Nejnižšího záchytu bylo dosaženo při detekci z plazmy, kde bývá DNA pocházející z nádoru (ctDNA) obecně přítomna ve velmi nízkých koncentracích. Výsledný záchyt mutace KRAS v ctDNA činil pouze 27 % (obr.1).
Image 1. Záchyt mutace genu KRAS ve třech typech vzorků 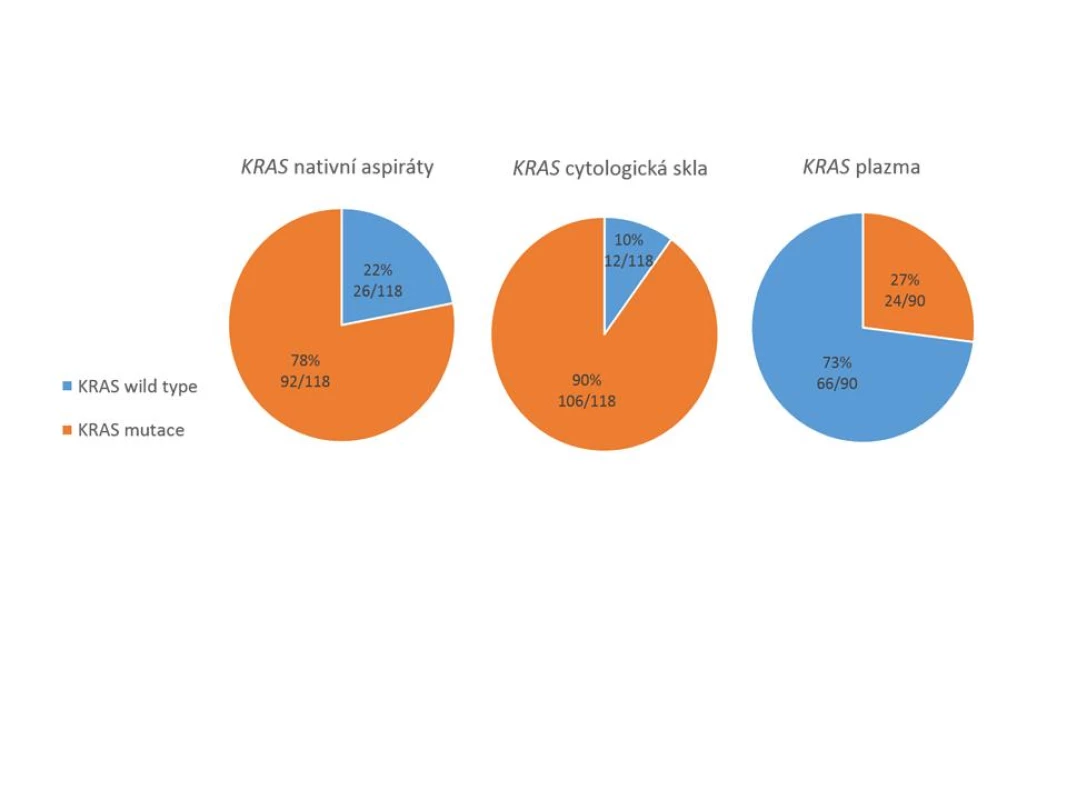
U 4 z 28 pacientů s CHP byla detekována mutace KRAS. U žádného nebyl karcinom iniciálně cytologicky diagnostikován. V průběhu klinického sledování byl potvrzen karcinom pankreatu u 2 pacientů, 1 pacient předčasně zemřel pro komplikace alkoholového deliria, 1 pacient byl aktuálně indikován k resekčnímu výkonu, který odmítl. Srovnání přežití pacientů s mutovaným KRAS oproti nemutovanému (wt) nepřineslo statisticky významný rozdíl v prognóze (obr. 2).
Image 2. Přežití pacientů v závislosti na přítomnosti mutace KRAS 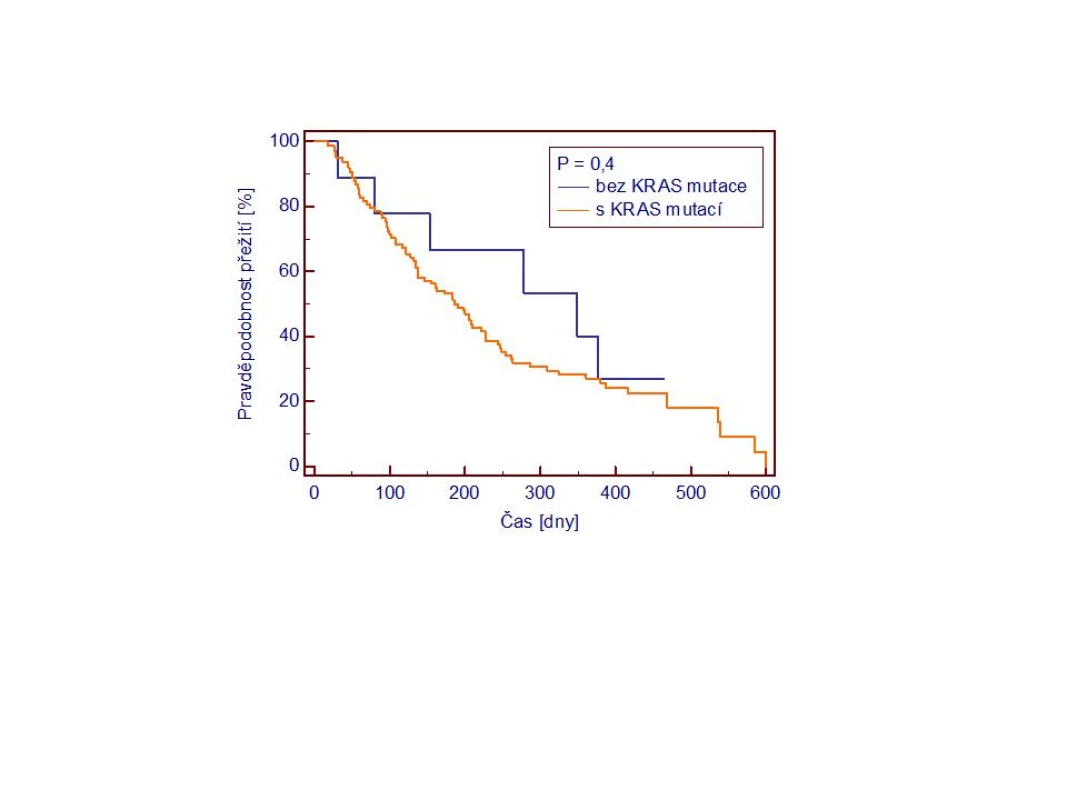
Diskuse
V diagnostice se genetické testování mutace KRAS a dalších testů včetně jejich kombinace uplatňuje již řadu let. Specificita samotného testu KRAS je natolik vysoká, že jeho pozitivita s vysokou přesností signalizuje malignitu (15, 17). Mutace KRAS byla opakovaně detekována u 74 % karcinomů pankreatu (18), 77 % (17), 70 % (16), 77–84 % (19) a 92 % (20). V našem souboru bylo nejvyšší senzitivity EUS-FNA detekce mutace KRAS dosaženo při použití cytologických preparátů (90 %); byla dokonce vyšší, než je doposud uvedeno ve většině recentních publikací. Kromě toho, že byly nádorové buňky na cytologických vzorcích před genetickou analýzou označeny cytopatologem, se na vysoké senzitivitě podílí jistě i metodika zpracování popsaná již v dřívějších pracích publikovaných naším pracovištěm (15, 16).
Samotný fakt, že v terénu chronické pankreatitidy byl v naší studii detekován KRAS bez náležité cytopatologické verifikace, je velmi zajímavý. V doposud publikovaných pracích byl zaznamenán pouze jeden případ pozitivity mutace KRAS v terénu chronického zánětu pankreatu. Bournet et al. (2014) doporučují zapojit do vyšetřovacího procesu nejasné pankreatické masy testování mutace KRAS. V případě klinické či radiologické prezentace pseudotumorózní formy chronické pankreatitidy (nebo nejistého závěru cytopatologa) může identifikace KRAS bez mutace vyloučit maligní transformaci (21). V praxi může indikace resekčního výkonu pouze na podkladě mutace KRAS činit jisté potíže, proto je doporučováno před definitivním rozhodnutím o chirurgické léčbě opakovat EUS s FNA (21).
Přehled studií vyšetření mutace KRAS u vzorků získaných pomocí EUS-FNA v rámci diferenciální diagnostiky karcinomu pankreatu a chronické pankreatitidy uvádí tab. 3.
Table 3. Přehled vyšetření mutace KRAS u vzorků získaných EUS-FNA v rámci diferenciální diagnostiky karcinomu pankreatu a chronické pankreatitidy 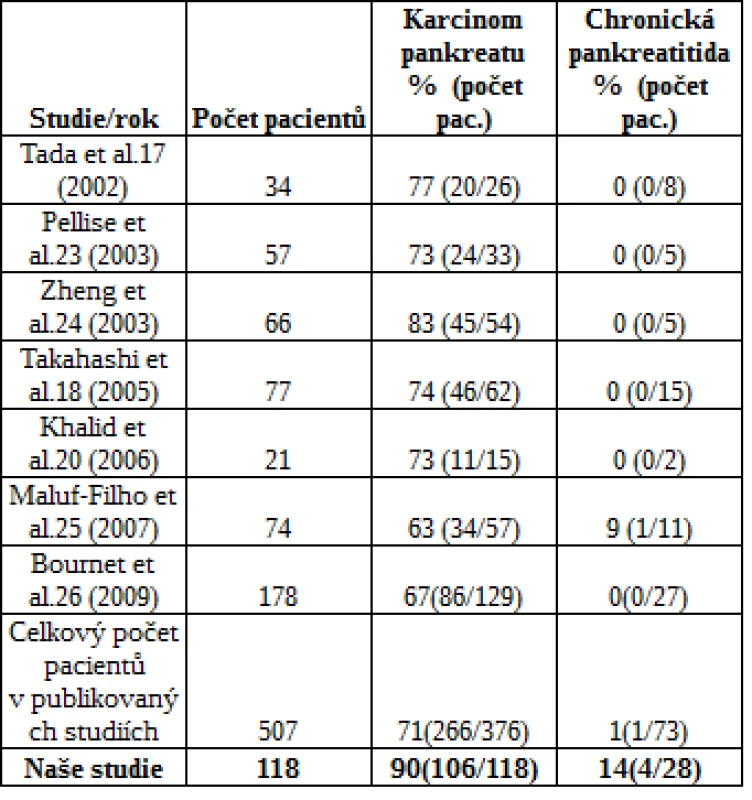
Prognostický význam KRAS byl hodnocen v několika recentních studiích, avšak výsledky jsou značně rozporuplné. Mutace KRAS je prokazatelně asociovaná s horším přežíváním ve srovnání s nemutovaným KRAS (wtKRAS), nicméně se jedná o statisticky hraničně významné asociace. Práce, které hodnotily prognostický význam mutace KRAS z EUS-FNA, neidentifikovaly studované molekulární markery jako prognostické ukazatele. Naproti tomu jsou známé závěry studií genetické analýzy resekátů karcinomu pankreatu, které naznačují, že obzvlášť některé typy mutací KRAS, např. G12D, jsou asociovány s horším přežíváním (22). Pravděpodobně proto jsou v současnosti většinou geneticky vyšetřovány zejména tkáně tumoru z resekátů, přestože jsou k dispozici jen u omezeného množství pacientů. V našem zkoumání korelací přežití pacientů s mutovaným KRAS a wtKRAS nebyl zjištěn významný rozdíl v prognóze. Do hodnocení ovšem nebyly zahrnuty výsledky mutací jednotlivých typů KRAS, které vyžadují podrobnější analýzu.
Závěr
Vyšetřování mutace KRAS z EUS-FNA preparátů je dostatečně senzitivní. Specificita testu KRAS je natolik vysoká, že jeho pozitivita s vysokou přesností signalizuje malignitu, naproti tomu negativní výsledek svědčí spíše pro benigní etiologii. Přínos je zaznamenán především u pacientů s chronickou pankreatitidou, kde nebyla na základě ostatních klinických faktorů indikována resekce. V případě průkazu přítomnosti KRAS by měla být resekce znovu zvážena vzhledem k vysokému riziku skrytého karcinomu pankreatu.
Pro využití KRAS jakožto prediktivního markeru nejsou dostatečné klinické důkazy.
Dedikace
Tato práce byla podpořena granty Ministerstva zdravotnictví ČR, projekty NT 13638 a NT 14 254-3, a Grantové agentury Ministerstva obrany ČR – projekt MO 1012.
Adresa pro korespondenci
MUDr. Bohuš Bunganič
Interní klinika 1. lékařské fakulty UK a Ústřední vojenské nemocnice − Vojenské fakultní nemocnice
U Vojenské nemocnice 1200
160 00 Praha 6
e-mail: bohus.bunganic@uvn.cz
Sources
1. Müller MF, Meyenberger C, Bertschinger P et al. Pancreatic tumors: evaluation with endoscopic US, CT, and MR imaging. Radiology 1994; 190(3): 745–751.
2. Rosewicz S, Wiedenmann B. Pancreatic carcinoma. Lancet 1997 Feb 15; 349(9050): 485–489.
3. Varadarajulu S, Tamhane A, Eloubeidi MA. Yield of EUS-guided FNA of pancreatic masses in the presence or the absence of chronic pancreatitis. Gastrointest Endosc 2005 Nov; 62(5): 728–736.
4. Pietryga JA, Morgan DE. Imaging preoperatively for pancreatic adenocarcinoma. J Gastrointest Oncol 2015 Aug; 6(4): 343–357.
5. Hanada K, Okazaki A, Hirano N et al. Diagnostic strategies for early pancreatic cancer. J Gastroenterol 2015 Feb; 50(2): 147–154.
6. Hanada K, Okazaki A, Hirano N et al. Effective screening for early diagnosis of pancreatic cancer. Best Pract Res Clin Gastroenterol 2015; 29(6): 929–939.
7. Chari ST, Kelly K, Hollingsworth MA et al. Early detection of sporadic pancreatic cancer: summative review. Pancreas 2015 Jul; 44(5): 693–712.
8. Kenner BJ, Chari ST, Cleeter DF, Go VL. Early detection of sporadic pancreatic cancer: strategic map for innovation––a white paper. Pancreas 2015 Jul; 44(5): 686–692.
9. Hruban RH, Goggins M, Parsons J, Kern SE. Progression model for pancreatic cancer. Clin Cancer Res 2000 Aug; 6(8): 2969–2972.
10. Biankin AV, Waddell N, Kassahn KS et al. Pancreatic cancer genomes reveal aberrations in axon guidance pathway genes. Nature 2012 Nov 15; 491(7424): 399–405.
11. Ginestà MM, Mora J, Mayor R et al. Genetic and epigenetic markers in the evaluation of pancreatic masses. J Clin Pathol 2013 Mar; 66(3): 192–197.
12. Majumder S, Chari ST, Ahlquist DA. Molecular detection of pancreatic neoplasia: current status and future promise. World J Gastroenterol 2015 Oct 28; 21(40): 11387–11395.
13. Kitano M, Kudo M, Yamao K et al. Characterization of small solid tumors in the pancreas: the value of contrast-enhanced harmonic endoscopicultrasonography. Am J Gastroenterol 2012 Feb; 107(2): 303–310.
14. Catalano MF, Sahai A, Levy M et al. EUS-based criteria for the diagnosis of chronic pancreatitis: the Rosemont classification. Gastrointest Endosc 2009 Jun; 69(7): 1251–1261.
15. Šálek C, Benešová L, Zavoral M et al. Evaluation of clinical relevance of examining K-ras, p16 and p53 mutations along with allelic losses at 9p and 18q in EUS-guided fine needle aspiration samples of patients with chronic pancreatitis and pancreatic cancer. World J Gastroenterol 2007 Jul 21; 13(27): 3714–3720.
16. Šálek C, Minaříková P, Benešová L et al. Mutation status of K-ras, p53 and allelic losses at 9p and 18q are not prognostic markers in patients with pancreatic cancer. Anticancer Res 2009 May; 29(5): 1803–1810.
17. Tada M, Komatsu Y, Kawabe T et al. Quantitative analysis of K-ras gene mutation in pancreatic tissue obtained by endoscopic ultrasonography-guided fine needle aspiration: clinical utility for diagnosis of pancreatic tumor. Am J Gastroenterol 2002 Sep; 97(9): 2263–2270.
18. Takahashi K, Yamao K, Okubo K et al. Differential diagnosis of pancreatic cancer and focal pancreatitis by using EUS-guided FNA. Gastrointest Endosc 2005 Jan; 61(1): 76–79.
19. Ginestà MM, Mora J, Mayor R et al. Genetic and epigenetic markers in the evaluation of pancreatic masses. J Clin Pathol 2013 Mar; 66(3): 192–197.
20. Khalid A, Dewitt J, Ohori NP et al. EUS-FNA mutational analysis in differentiating autoimmune pancreatitis and pancreatic cancer. Pancreatology 2011; 11(5): 482–486.
21. Bournet B, Gayral M, Torrisani J et al. Role of endoscopic ultrasound in the molecular diagnosis of pancreatic cancer. World J Gastroenterol 2014 Aug 21; 20(31): 10758–10768.
22. Rachakonda PS, Bauer AS, Xie H et al. Somatic mutations in exocrine pancreatic tumors: association with patient survival. PLoS One 2013; 8(4): e60870.
23. Pellisé M, Castells A, Ginès A et al. Clinical usefulness of KRAS mutational analysis in the diagnosis of pancreatic adenocarcinoma by means of endosonography-guided fine-needle aspiration biopsy. Aliment Pharmacol Ther 2003 May 15; 17(10): 1299–1307.
24. Zheng M, Liu LX, Zhu AL et al. K-ras gene mutation in the diagnosis of ultrasound guided fine-needle biopsy of pancreatic masses. World J Gastroenterol 2003 Jan; 9(1): 188–191.
25. Maluf-Filho F, Kumar A, Gerhardt R et al. Kras mutation analysis of fine needle aspirate under EUS guidance facilitates risk stratification of patients with pancreatic mass. J Clin Gastroenterol 2007 Nov-Dec; 41(10): 906–910.
26. Bournet B, Souque A, Senesse P et al. Endoscopic ultrasound-guided fine-needle aspiration biopsy coupled with KRAS mutation assay to distinguish pancreatic cancer from pseudotumoral chronic pancreatitis. Endoscopy 2009 Jun; 41(6): 552–557.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- Populační screening kolorektálního karcinomu v České republice
- Nové zobrazovací metody v endoskopické diagnostice nádorů trávicího ústrojí
- Onemocnění horní části trávicího traktu: zhoubná onemocnění foregutu
- Maligní biliární obstrukce
- Karcinom pankreatu – současný efektivní diagnosticko-terapeutický postup
- Časná detekce sporadického karcinomu pankreatu
- Vyšetření mutace KRAS v EUS-FNA preparátech pacientů s tumorem pankreatu
- Prognostický význam ART skóre u pacientů s intermediárním hepatocelulárním karcinomem
- Prof. MUDr. Josef Marek, DrSc., osmdesátiletý
- Za profesorem Vratislavem Schreiberem
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Karcinom pankreatu – současný efektivní diagnosticko-terapeutický postup
- Maligní biliární obstrukce
- Onemocnění horní části trávicího traktu: zhoubná onemocnění foregutu
- Populační screening kolorektálního karcinomu v České republice
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

