-
Medical journals
- Career
Vitamin D – jeho fyziologie, patofyziologie a význam v etiopatogenezi nádorových onemocnění
Authors: Klára Drábová 1; Julie Bienertová-Vašků 1,2; Petr Lokaj 1; Lenka Dubská 3,4; Radka Obermannová 5; Kristína Greplová 3; Regina Demlová 4,6; Dalibor Valík 3,4; Jaroslav Štěrba 1
Authors‘ workplace: Klinika dětské onkologie, Fakultní nemocnice, Brno 1; Ústav patologické fyziologie, Lékařská fakulta, Masarykova univerzita, Brno 2; Oddělení laboratorní medicíny, Masarykův onkologický ústav, Brno 3; Farmakologický ústav, Lékařská fakulta, Masarykova univerzita, Brno 4; Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno 5; Oddělení klinických hodnocení, Masarykův onkologický ústav, Brno 6
Published in: Čas. Lék. čes. 2013; 152: 20-30
Category: Review Article
Overview
Vitamin D je endogenní produkt savčích organismů, z něhož jsou syntetizovány vlastní účinné látky povahy steroidních hormonů, které se účastní celé řady klíčových metabolických dějů prakticky v každé jaderné buňce, ať už na endokrinní či subcelulární úrovni. Vitamin D tak představuje nesmírně zajímavou a pleiotropně působící molekulu. Účelem tohoto přehledu je shrnout některé poznatky o metabolismu vitaminu D s ohledem na patofyziologii nádorových onemocnění.
Klíčová slova:
vitamin D – nádorová onemocnění – metabolismus vitaminu D – protinádorové působení vitaminu DÚVOD
Vitaminy skupiny D jsou především endogenní produkty savčích organismů a některých rostlin resp. hub, z nichž jsou syntetizovány vlastní účinné látky povahy steroidních hormonů, které se účastní celé řady klíčových metabolických dějů prakticky v každé jaderné buňce, ať už na endokrinní či subcelulární úrovni. Vitamin D tak představuje nesmírně zajímavou a pleiotropně působící molekulu.
Účelem tohoto přehledu je shrnout poznatky o vitaminu D s ohledem na jeho úlohu v patofyziologii vzniku a vývoji nádorových onemocnění, na epidemiologii těchto onemocnění, i na jeho preventivní a terapeutické možnosti využití.
FYZIOLOGIE A PATOFYZIOLOGIE PŮSOBENÍ VITAMINU D
Pod pojmem vitamin D rozumíme dva ve vodě nerozpustné sekosteroidy – ergokalciferol (vitamin D2) a cholekalciferol (vitamin D3). Tyto dvě formy se vzájemně liší strukturou postranního řetězce, fyziologické účinky obou látek na lidský organismus se podle převažujících názorů významněji neliší, i když zatím není úplná jednota v názorech na působení těchto jednotlivých látek; koncentraci aktivního vitaminu v séru však více ovlivňuje cholekalciferol (1) (obr. 1).
Image 1. Schéma metabolismu a působení vitaminu D v těle<br> Vitamin D je ze střeva absorbován, zprvu je včleněn do chylomikronů a lymfatickým systémem přenášen do jater. Při potravě chudé na tuky nebo při jejich zhoršeném vstřebávání dochází i ke zpomalení vstřebávání vitaminu D. 25-OH vitamin D<sub>3</sub> i ostatní metabolity podléhají enterohepatálnímu oběhu. Lipofilní molekuly vitaminu v plazmě jsou přenášeny k cílovým tkáním transportními bílkovinami. Nejdůležitější z nich jsou alfa-1-globulin a vitamin D vázající protein – transkalciferin (D-binding protein, DBP), který je součástí frakce lipoproteinů VLDL (very-low-density lipoprotein) (8). DBP se vyznačuje vysokou afinitou zvláště pro 25-OH vitamin D<sub>3</sub> a 24,25(OH)<sub>2</sub> vitamin D<sub>3</sub>. Naopak poměrně slabě váže 1,25(OH)<sub>2</sub> vitamin D<sub>3</sub>, čímž se tento hormon stává biologicky snadno dostupným. Systém vazebných bílkovin umožňuje cirkulaci aktivních metabolitů vitaminu D v krevním oběhu, přičemž přibližně polovina 25-OH vitaminu D<sub>3</sub> je vázána na transkalciferin. Metabolity vitaminu D jsou ke tkáním přenášeny i albuminem a lipoproteiny (8), na něž se však vážou s nižší afinitou. Nehydroxylované formy vitaminu D jsou ukládány v tukové tkáni. DBP je syntetizován v játrech. Produkce proteinu je stimulována estrogeny (mj. také při užívání hormonální antikoncepce a během těhotenství) a klesá při onemocnění jater, nefrotickém syndromu a malnutrici. Za fyziologického stavu je obsazeno méně než 5 % celkového DBP. Koncentrace 1,25(OH)<sub>2</sub> vitaminu D<sub>3</sub> je zvýšena v těhotenství, a to nejen v důsledku vysokých hladin vazebných bílkovin, ale i proto, že je tento metabolit syntetizován v placentě konverzí prekurzoru 25-OH vitaminu D<sub>3</sub>, který prochází placentou (5). 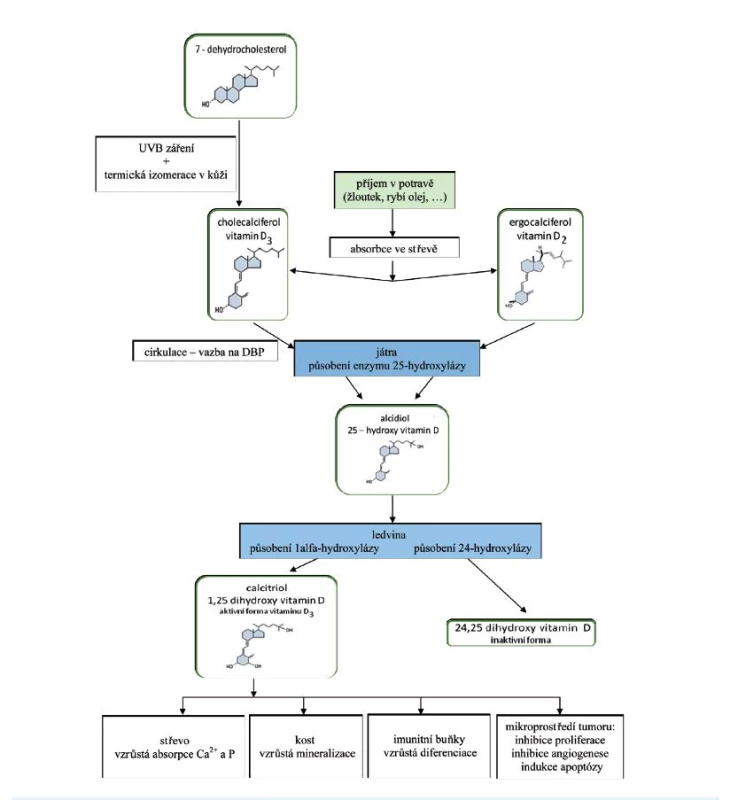
V kůži přítomný 7-dehydrocholesterol je konvertován působením UV-záření na 7-dehydrocholekalciferol (provitamin D3). Rychlou termickou izomerací je dále syntetizován vlastní vitamin D3, cholekalciferol. Účinnost pronikání světla je pod kontrolou kožního pigmentu, dalším působením UVB záření se mění provitamin D3 i vitamin D3 na inaktivní fotoprodukty. Cholekalciferol se za normálních podmínek z více než 50 % ukládá do tukové tkáně, která se tak stává fyziologicky významnou zásobárnou vitaminu D (2). Působením enzymu 25-hydroxylázy (mikrozomální enzym ze skupiny cytochromu P450 – CYP27A1) se podle potřeb organismu konvertuje (u člověka tedy převážně v játrech) na 25-OH vitamin D3 (25-OH vitamin D3 – kalcidiol), což je počátečním krokem aktivace vitaminu D. K dalšímu metabolickému kroku dochází v ledvinách, kde působením enzymu 1-alfa-hydroxylázy (CYP27B1) dochází ke konverzi 25-OH vitaminu D3 na hlavní metabolit1-alfa,25(OH)2 vitamin D3 (1,25(OH)2vitamin D3 – kalcitriol) (3). Podobně je aktivován i vitamin D2. Další metabolit cholekalciferolu, 24,25-(OH)2 cholekalciferol, vzniká také v ledvinách a je inaktivní. Tuto reakci zprostředkovává enzym 24-hydroxyláza (CYP24A1) (srov. 4, 5).
Aktivní metabolit vitaminu D je především produktem ledviny, může být však syntetizován i v ostatních tkáních (např. lymfatická tkáň, kůže, pankreas, prostata, mléčná žláza, placenta), ale i ve tkáních patologických (např. tuberkulózní granulomy a sarkoidóza) (2, 5, 6).
Metabolismus 25-OH vitaminu D3 je poměrně pomalý s méně těsnou zpětnovazebnou regulací. Proto se hladina 25-OH vitaminu D3 v séru zvyšuje úměrně s příjmem, a je tak dobrým ukazatelem nutričního stavu organismu a zásob vitaminu D v těle, nezávisle na hladinách 1,25(OH)2vitaminu D3. Zatímco dominantním aktivátorem 1-alfa-hydroxylázy je parathormon (PTH), nejvýraznějšími inhibitory jsou fosfatoniny, kalcium a fosfát a již vytvořený 1,25(OH)2 vitamin D3 (5, 7). Poslední ze jmenovaných faktorů je silným inhibitorem 1-alfa-hydroxylázy, že může potlačit transaktivaci parathormonem (5).
Vitamin D a jeho hydroxylované metabolity jsou lipofilní látky málo rozpustné ve vodě. Přibližně 60–90 % kalciferolu z potravy je vstřebáváno v tenkém střevě, převážně v jeho proximálním úseku, mechanismem podobným vstřebávání cholesterolu a jiných v tucích rozpustných sterolů. Absorpce je pozitivně ovlivněna žlučovými kyselinami, s nimiž vitamin D tvoří komplexy (5, 8). V plazmě jsou lipofilní molekuly vitaminu přenášeny k cílovým tkáním transportními bílkovinami (obr. 1).
Systémové řízení homeostázy vitaminu D je komplexní děj, který je kontrolován hlavními a vedlejšími mechanismy. Jedním z hlavních mechanismů kromě autoregulace 1,25(OH)2vitaminu D3 jsou sérové hladiny PTH, který zvyšuje koncentraci sekosteroidu v séru i tím, že zpomaluje jeho degradaci. Současně snižuje aktivitu 24-hydroxylázy, takže klesá podíl neaktivního metabolitu. Neméně významným mechanismem je i nepřímý stimulační vliv PTH zprostředkovaný poklesem hladin anorganického fosfátu (5, 7).
Další z hlavních regulátorů hladin 1,25(OH)2 vitaminu D3 – kalcium – tlumí aktivitu 1-alfa-hydroxylázy přímo, ale i nepřímo prostřednictvím PTH (hypokalcémie zvyšuje sekreci PTH). Vzestup kalcémie produkci 1,25(OH)2 vitaminu D3 snižuje. Mechanismus regulačního účinku fosfátu je nejasný, je však známo, že pokles sérové hladiny fosfátu zvyšuje aktivitu 1-alfa-hydroxylázy. I když vliv fosfátu není závislý na PTH, je podstatně slabší v porovnání s účinkem PTH. Aktivita 1-alfa-hydroxylázy je mimo to modulována také stavem acidobazické rovnováhy a hladinami některých hormonů (inzulin, somatotropin, IGF-I, prolaktin, kalcitonin a sexuální hormony) (5, 7, 9–11).
FYZIOLOGICKÉ FUNKCE AKTIVNÍHO VITAMINU D
Efekt vitaminu D ve střevě
1,25(OH)2vitamin D3 se podílí na řízení homeostázy minerálů, stimuluje frakční absorpci kalia (v menší míře i fosfátu a magnezia) v tenkém střevě, a to nezávisle na hladinách PTH. Stimuluje přímo transportní proces kalcia ve střevě pasivní difuzí, fosforylaci vazebného proteinu (CaBP – calcium-binding protein) prostřednictvím proteinkináz a aktivuje kalciovou pumpu na bazolaterálním pólu enterocytu (5).
Efekt vitaminu D v kosti
V kostech prostřednictvím osteoblastů indukuje zrání a mineralizaci kolagenní matrix. Efekt je provázen vzestupem produkce kostního izoenzymu alkalické fosfatázy a osteokalcinu a přestavbou kosti ve prospěch nově tvořené osifikované tkáně (12). Cílovou buňkou je také osteoklast, který je aktivován jednak přímo a jednak prostřednictvím humorálních mechanismů zprostředkovaných osteoblasty (13). Není-li zajištěn dostatečný příjem kalcia v dietě, 1,25(OH)2vitamin D3 za účelem udržení kalcémie zvyšuje tvorbu i aktivitu osteoklastů, stimuluje kostní resorpci a mobilizuje kalcium, a to zcela nezávisle na hladinách PTH. Nedostatek vitaminu D se v dětství projevuje křivicí, v dospělosti osteomalacií (srov. 3, 9).
Efekt vitaminu D v ledvině
Základním mechanismem působení v ledvině je útlum aktivity 1-alfa-hydroxylázy (CYP27B1) a vzestup aktivity 24-hydroxylázy. Zvyšuje se tak syntéza méně aktivního 24,25(OH)2vitaminu D3 a klesá produkce 1,25(OH)2 vitaminu D3. Mimo to 1,25(OH)2 vitamin D3 v této tkáni stimuluje expresi CaBP, jehož prostřednictvím za spolupůsobení PTH zvyšuje reabsorpci kalcia a fosforu v proximálním, ale především v distálním tubulu. Kontroluje tak ztráty kalcia močí (5).
Další působení 1,25(OH)2vitaminu D3
V příštítných tělíscích kalcitriol tlumí jejich růst a syntézu PTH (5). Vitamin D významně ovlivňuje reprodukční funkce, byl zaznamenán i jeho neuroprotektivní efekt, zasahuje i do řízení sekrečních procesů, inhibuje aktivitu systému renin-angiotenzin potlačením syntézy reninu a zasahuje příznivě do syntézy inzulinu (srov. 3, 9, 11, 14, 15).
Vitamin D a imunitní systém
Vitamin D má vliv imunomodulační (srov. historické úsloví „kam nechodí slunce, tam chodí lékař“), reguluje jak složky vrozené, tak adaptivní imunitní odpovědi. Cytokiny například modulují metabolismus vitaminu D v monocytech/makrofázích a dendritických buňkách; prozánětlivé působky interferon (IFN) γ (16) a TNF-α (17) stimulují produkci vitaminu D zvýšením exprese CYP27B1 v buňkách monocytární řady a zánětlivé cytokiny a agonisté Toll-like receptoru zvyšují expresi CYP27B1 a receptoru pro vitamin D (VDR) v dendritických buňkách (18).
Na úrovni adaptivní imunitní odpovědi řada subpopulací T-lymfocytů exprimuje VDR a je cílovou buňkou pro působení vitaminu D (19), byť bez klíčového vlivu na primární funkci T-lymfocytů. 1,25(OH)2vitamin D3 je spíše modulátorem imunitní odpovědi zprostředkované T-lymfocyty. V různých myších modelech autoimunitního onemocnění vedla absence VDR k horšímu průběhu nemoci (20, 21). V in vitro podmínkách potlačoval 1,25(OH)2 vitamin D3 signální dráhu NF-κB nezbytnou pro aktivaci Th-lymfocytů (22), zvyšoval aktivitu imunosupresivních T-regulačních lymfocytů (23) a blokoval vznik Th17 a Th9 buněk důležitých v patogenezi různých autoimunitních a zánětlivých onemocněních (24).
Obecně je tedy působení vitaminu D stimulující na vrozenou obranyschopnost a imunosupresivní na adaptivní složku imunitní odpovědi, především T-lymfocyty, což pouze z části vysvětluje pozorovaný protinádorový efekt vitaminu D.
EPIDEMIOLOGICKÉ SOUVISLOSTI VITAMINU D, VITAMIN D STATUS
Organismus je schopen získávat vitamin D jednak z potravy, jednak vlastní produkcí závislou na expozici kůže slunečnímu (UVB) záření (o délce 290–315 nm). Každodenní expozice slunečnímu záření v délce 15 minut v našich zeměpisných šířkách stačí pro dosažení dostatečných plazmatických koncentrací, přičemž intoxikace tímto mechanismem není v podstatě možná (světelná degradace nadbytečného vitaminu) (2, 3, 5). Ve významnějších koncentracích je obsažen v některých druzích ryb (makrela, tuňák, sleď), ve vaječném žloutku, játrech, mléku a másle, naopak ve vegetariánské dietě je jeho obsah nízký (5).
Nedostatek vitaminu D
Současná situace nedostatku vitaminu D u populace se historicky výrazně zhoršila oproti předcházejícím obdobím. Za rizikový faktor se považuje „moderní“ způsob života obyvatel od 40o severní i jižní šířky. Hladiny 25-OH vitaminu D3 v séru klesají se vzdáleností od rovníku, sérové koncentrace 1,25(OH)2 vitaminu D3 jsou však jemně regulované a nemění se s geografickou šířkou nebo rasou. S moderním způsobem života ve městech, používáním krémů s ochranným UV faktorem, klesla expozice slunečnímu záření (25). Riziko stoupá s věkem (ve stáří klesá schopnost syntézy vitaminu D v kůži až o 75 %), zejména ve zdravotnických zařízeních a v domovech důchodců. V USA se uvádí, že velmi výrazným nedostatkem vitaminu D na konci zimy trpí asi 85 % obyvatel, u skupiny seniorů je to až 95 % (26). Stejně jako v USA, tak i v evropských zemích se udává, že až 60 % populace není adekvátně zásobeno vitaminem D (27). Nedostatkem vitaminu D trpí také děti a ženy, výrazný je i u skupiny diabetiků (hypovitaminóza D je spojena s dysfunkcí beta-buněk pankreatu a inzulinovou rezistencí, 70 % diabetiček II. typu má deficit vitaminu D, terapie vitaminem D sníží inzulinovou rezistenci o 21 %). Nedostatek vitaminu D podporuje vznik metabolického syndromu, je spojen s nízkou porodní hmotností, zvyšuje riziko kardiovaskulárních chorob (11, 28).
Vztah nedostatku vitaminu D k nádorovým onemocněním
Ekologicko-geografické studie byly první, které popsaly vztah UV záření k riziku vzniku onkologického onemocnění (2, 14, 29).Z tohoto důvodu se výzkum začal zaměřovat na vitamin D; expozice slunečnímu UVB záření, jakožto index fotoprodukce vitaminu D3 v kůži, je nepřímo úměrná mortalitě některých nádorových onemocnění (30). Při nižší expozici slunečnímu záření, nebo-li nižší hladině vitaminu D v séru, je signifikantně vyšší výskyt kolorektálního karcinomu, karcinomu prsu, žaludku, endometria, ledviny, ovaria, prostaty, pankreatu (31–35). Stejně tak je signifikantně vyšší výskyt těchto druhů onemocnění u pacientů s nižším příjmem kalcia. Karcinom plic a endometria jsou považovány za kalcium a vitamin D senzitivní (30).
Výzkumy vedly k zjištění, že tkáňově specifická exprese geneticky kódované 1-alfa-hydroxylázy a receptoru pro extracelulární kalcium (CaR), tedy lokálně syntetizovaný 1,25(OH)2vitamin D3 a hladina extracelulárního kalcia jsou společně klíčovými regulátory buněčné proliferace, diferenciace, a tím funkce buňky (36). Zhoršení antimitogenního, proapoptotického a prodiferenciačního signálu z VDR aktivovaného vitaminu D3 a CaR při insuficienci vitaminu D3 a extracelulárního kalcia se účastní patogeneze výše uvedených typů malignit (30, 37, 38).
Vitamin D a extracelulární hladina kalcia interagují v modulaci buněčného růstu různými cestami. Jsou to:
- signály z obou receptorů (VDR a CaR), které se v buňce sbíhají na stejné úrovni,
- vyšší extracelulární hladina kalcia, která ovlivňuje extrarenální metabolismus vitaminu D ve prospěch ustálené vyšší koncentrace vitaminu D3,
- vitamin D3, který vede k up-regulaci exprese CaR a následně posiluje CaR-mediovanou antiproliferační odpověď na vyšší koncentraci kalcia (30).
Nejen ledvina, ale i jiné tkáně obsahují 1-alfa-hydroxylázu a mohou tak syntetizovat 1,25(OH)2vitamin D3. Výzkumy prokázaly autokrinní syntézu 1,25(OH)2 vitaminu D3, a to v mléčné žláze, pankreatu, prostatě, střevě, což předpokládá existenci mechanismu, pomocí kterého vitamin D nebo sluneční svit ovlivňují vznik karcinomu v těchto místech. Je však třeba zvažovat, zda zvýšená expozice slunečnímu záření může být prevencí vzniku malignit vzhledem k prokázané souvislosti s rizikem vzniku maligního melanomu (9, 39).
Nežádoucí účinky užívání vitaminu D, intoxikace vitaminem D
Nežádoucí účinky vitaminu D jsou určeny fyziologickým působením tohoto vitaminu. Nadměrná expozice slunečnímu záření nevede k intoxikaci vitaminem D díky fotodegradaci provitamu D v kůži. Příznaky z intoxikace se tedy vyskytují nejvíce při užívání potravinových doplňků, zejména samotného vitaminu D.
O samotném mechanismu toxicity vitaminu D se mnoho neví. Podle posledních výzkumů je však obava z předávkování vitaminem D neopodstatněná (40) vzhledem k všeobecné hypovitaminóze D a nízkému příjmu tohoto vitaminu v potravě. Zatím neznáme prahovou hodnotu příjmu vitaminu D, podle posledních výzkumů se předpokládá, že sérová hladina vitaminu D musí přerůst 750 nmol/l (41). Jako většina léků, je i cholekalciferol toxický při excesivním (jednorázovém) příjmu (proto je také používán jako jed na hlodavce – v zahraničí přípravek známý pod názvem Quintox), při dlouhodobějším (chronickém) podávání vitaminu D hrozí nežádoucí účinky z předávkování pravděpodobně až při dávce 40 000 UI denně. Maximální doporučená dávka při suplementaci vitaminu D je dnes 2000 UI denně (2, 9, 40).
Uvádí se, že předávkování vitaminem D má nespecifické symptomy – jako například nauzea, zvracení, nechutenství, zácpa, slabost, ztráta váhy.
Mezi specifické nežádoucí účinky vitaminu D patří především hyperkalciurie a hyperkalcémie, avšak rozdíly mezi klinickými příznaky u skupin lidí, kteří užívali vitamin D, a kontrolami nebyly statisticky významné (9).
Dalším specifickým nežádoucím účinkem je vznik nefrolitiázy. Samotné užívání vitaminu D nezaznamenalo signifikantně vyšší výskyt ledvinových kamenů, ovšem užívání vitaminu D (uvádí se 400 UI) spolu s kalciem (1000 mg/den) vede k vyššímu vzniku tohoto onemocnění než u kontrol (9). Proto bývá tento efekt připisován spíše na vrub užívání kalcia.
Popisované příznaky intoxikace mají své limitace. Důvodů je několik: převaha krátkodobých studií, nedostatek informací o potenciálních účincích vitaminu D mimo kostní tkáň (např. kalcifikace měkkých tkání – aorta), omezené množství dat vztahující se k jednotlivým obdobím života, rase, etniku (9).
Vitamin D a obezita, vitamin D a metabolický syndrom
Vitamin D status má rovněž vztah k tělesnému tuku a fyzické aktivitě (42). Více studií ukazuje, že obezita je spojena s nižší koncentrací cirkulujícího 25-OH vitaminu D3, zatím není znám mechanismus pro tento efekt, hypotézy zahrnují sekvestraci v tucích, negativní zpětnou vazbu z vyšší koncentrace cirkulujícího 1,25(OH)2vitaminu D3 při obezitě, a nižší expozici slunečnímu záření díky snížené venkovní aktivitě u obézních (43). Vyšší fyzická aktivita vede k vyšší koncentraci cirkulujícího 25-OH vitaminu D3, i když se neví, jak se toto odráží v přímém vztahu mezi fyzickou aktivitou a metabolismem vitaminu D, nebo zda to plyne z množství tělesného tuku nebo expozice slunečnímu záření (44). Navíc, vztah mezi vitamin D – statutem a obezitou a vitamin D – statutem a fyzickou aktivitou je jasnější u bílých než u černých Američanů. Tyto typy vztahů jsou velice důležité k porozumění biologických odpovědí na vitamin D (srov. 2, 31).
Obezita je jedním z rizikových faktorů metabolického syndromu (MS) (jinak známý také jako syndrom X, Reavenův syndrom), mezi jehož další rizikové faktory patří dyslipidémie, inzulinová rezistence a hyperglykémie. Deficit vitaminu D bývá v současnosti rovněž zmiňován jako jeden z rizikových faktorů pro rozvoj MS, podmiňující mimo jiné již zmíněná rizika (např. inzulinovou rezistenci) (45). Neléčený MS vede k závažným zdravotním komplikacím, jako je rozvoj aterosklerózy (angina pectoris a akutní infarkt myokardu, cévní mozková příhoda, ischemická choroba dolních končetin), hypertenze, diabetes mellitus II. typu aj.
PŮSOBENÍ VITAMINU D NA SUBCELULÁRNÍ ÚROVNI
Receptory pro vitamin D
Převážná většina biologických účinků 1,25(OH)2vitaminu D3 je zprostředkována specifickými vysoce afinitními jadernými receptory. Jde o vysoce homologní proteiny, velmi blízké receptorům pro steroidní a tyreoidální hormony a pro kyselinu retinovou. Proto tvorba a funkce receptorů pro 1,25(OH)2 vitamin D3 může být stimulována i glukokortikoidy nebo estrogeny (5, 9).
Receptory pro vitamin D (VDR) se nacházejí prakticky ve všech lidských buňkách obsahující buněčné jádro, v klasických cílových tkáních (účastnících se kalcium-fosfátového metabolismu) – ve střevě, kosti, v ledvinách a v příštítných tělíscích. Identifikovány byly také například v kůži, ve svalech, v pankreatu, reprodukčních orgánech, v hemopoetickém, imunitním a nervovém systému a v endokrinních tkáních (2, 3, 5, 9) (obr. 2). Mechanismus účinku vitaminu D/VDR systému tak může být v organismu autokrinní, parakrinní i endokrinní. Z některých studií (46, 47) plyne zajímavé zjištění, že exprese VDR receptorů je u nádorových buněk změněná, a to v některých případech statisticky významně tak, že se může jednat i o prognostický marker přežití (47, 48).
Image 2. Působení vitaminu D na subcellulární úrovni<br> Vitamin D patří spolu se steroidy, tyroidními hormony a retinoidy mezi hormony, které mohou procházet plazmatickou membránou. Jejich receptor je lokalizován v jádře nebo v cytosolu. Pozdní odpověď na hormonální signál prostřednictvím jaderných receptorů je podstatně pomalejší (řádově desítek minut) v porovnání s časnou odpovědí zprostředkovanou membránovými receptory (během několika minut) (5). Rychlý vzestup nitrobuněčného kalcia je po vazbě na membránové receptory navozen aktivací kalciových kanálů a také prostřednictvím guanosinmonofosfátu nebo proteinkinázy C. 1,25(OH)<sub>2</sub> vitamin D<sub>3</sub> tedy tímto způsobem zajišťuje krátkodobou i dlouhodobou regulaci homeostázy kalcia (95). Po vazbě na jaderný receptor cílových tkání 1,25(OH)<sub>2</sub> vitaminem D<sub>3</sub> dochází k fosforylaci a konformační změně molekuly VDR. VDR tak vytvoří heterodimerický komplex s receptorem X kyseliny retinové (RXR), který se naváže na specifickou část sekvence DNA, tzv. vitamin D – responsive elements (VDREs) (95, 96). VDREs jsou většinou umístěny v promotorových částech cílových genů (5). Komplex VDR/RXR se může navázat na řadu transkripčních faktorů, tyto transkripční faktory pak spolu s regulačními proteiny aktivují nebo inhibují transkripci tzv. vitaminu D-responzivních genů (96), např. pro CaBP, epiteliální kalciový kanál, ligand receptorového aktivátoru nukleárního faktoru kappa B (RANKL), alkalickou fosfatázu (AP), prostatický specifický antigen (PSA), parathormon (PTH). Kalcitriol tak přímo ovlivňuje transkripci asi 200 genů, jejichž produkty se účastní mnoha fyziologických pochodů v organismu (viz funkce vitaminu D) (srov. 3, 97, 98). Xenobiotika nebo některé složky potravy mohou rovněž ovlivňovat metabolismus vitaminu D, např. aktivací receptoru PXR (pregnane X receptor), který hraje významnou roli v detoxikaci xenobiotik a léků. Tento receptor rovněž může indukovat deficienci vitaminu D díky jeho schopnosti vázat se na VDR, a tím způsobit katabolismus 25-OH vitaminu D<sub>2</sub> a 1,25(OH)<sub>2</sub> vitaminu D<sub>3</sub>. Jeho vazbou na RXR může tento heterodimer aktivovat VDREs v různých tkáních, a vést tak k zatím neznámým zdravotním důsledkům (99). Extrarenální syntéza 1,25(OH)2 vitaminu D<sub>3</sub> ovlivňuje buněčnou proliferaci a diferenciaci – toto závisí na sérových hladinách 25-OH vitaminu D<sub>3</sub>, proto dostatek 25-OH vitaminu D<sub>3</sub> je nejvíce limitujícím faktorem pro extrarenální syntézu (84). Rovnováha mezi CYP27B1, který vede ke konverzi 25-OH vitaminu D<sub>3</sub> na 1,25(OH)<sub>2</sub> vitaminu D<sub>3</sub>, a CYP24A1, který inaktivuje oba, rozhoduje o buněčné expozici 1,25(OH)<sub>2</sub> vitaminu D<sub>3</sub>. Tato rovnováha se mění během tumorigeneze a je tkáňově specifická. Např., tumor prostaty (ale ne tumor kolorekta) ztratí-li svou 1-alfa-hydroxylázovou aktivitu, stává se více agresivním (84). Takto 25-OH vitamin D<sub>3</sub> může být méně účinný proti agresivním prostatickým tumorům. Kromě toho, androgeny mohou měnit rovnováhu mezi CYP27B1 a CYP24A1. Dihydrotestosteron inhibuje 1,25(OH)<sub>2</sub> vitaminem D<sub>3</sub> mediovanou indukci CYP24A1 a několik cílových molekul pro působení 1,25(OH)<sub>2</sub> vitaminu D<sub>3</sub>. Interakce se také vyskytují mezi receptory pro androgeny a signály zprostředkované VDR receptory (31). (staženo z www.google.cz [cit. 2012-02-08], Holick MF. J Clin Invest 2005; 115(1): 32. <a href="http://www.ncbi.nlm.nih.gov/pmc/articles/PMC539210/figure/F1/"target="_blank">http://www.ncbi.nlm.nih.gov/pmc/ articles/PMC539210/figure/F1</a>. ![Působení vitaminu D na subcellulární úrovni<br>
Vitamin D patří spolu se steroidy, tyroidními hormony a retinoidy mezi hormony, které mohou procházet plazmatickou membránou. Jejich receptor je lokalizován v jádře nebo v cytosolu. Pozdní odpověď na hormonální signál prostřednictvím jaderných receptorů je podstatně pomalejší (řádově desítek minut) v porovnání s časnou odpovědí zprostředkovanou membránovými receptory (během několika minut) (5). Rychlý vzestup nitrobuněčného kalcia je po vazbě na membránové receptory navozen aktivací kalciových kanálů a také prostřednictvím guanosinmonofosfátu nebo proteinkinázy C. 1,25(OH)<sub>2</sub> vitamin D<sub>3</sub> tedy tímto způsobem zajišťuje krátkodobou i dlouhodobou regulaci homeostázy kalcia (95). Po vazbě na jaderný receptor cílových tkání 1,25(OH)<sub>2</sub> vitaminem D<sub>3</sub> dochází k fosforylaci a konformační změně molekuly VDR. VDR tak vytvoří heterodimerický komplex s receptorem X kyseliny retinové (RXR), který se naváže na specifickou část sekvence DNA, tzv. vitamin D – responsive elements (VDREs) (95, 96). VDREs jsou většinou umístěny v promotorových částech cílových genů (5). Komplex VDR/RXR se může navázat na řadu transkripčních faktorů, tyto transkripční faktory pak spolu s regulačními proteiny aktivují nebo inhibují transkripci tzv. vitaminu D-responzivních genů (96), např. pro CaBP, epiteliální kalciový kanál, ligand receptorového aktivátoru nukleárního faktoru kappa B (RANKL), alkalickou fosfatázu (AP), prostatický specifický antigen (PSA), parathormon (PTH). Kalcitriol tak přímo ovlivňuje transkripci asi 200 genů, jejichž produkty se účastní mnoha fyziologických pochodů v organismu (viz funkce vitaminu D) (srov. 3, 97, 98). Xenobiotika nebo některé složky potravy mohou rovněž ovlivňovat metabolismus vitaminu D, např. aktivací receptoru PXR (pregnane X receptor), který hraje významnou roli v detoxikaci xenobiotik a léků. Tento receptor rovněž může indukovat deficienci vitaminu D díky jeho schopnosti vázat se na VDR, a tím způsobit katabolismus 25-OH vitaminu D<sub>2</sub> a 1,25(OH)<sub>2</sub> vitaminu D<sub>3</sub>. Jeho vazbou na RXR může tento heterodimer aktivovat VDREs v různých tkáních, a vést tak k zatím neznámým zdravotním důsledkům (99). Extrarenální syntéza 1,25(OH)2 vitaminu D<sub>3</sub> ovlivňuje buněčnou proliferaci a diferenciaci – toto závisí na sérových hladinách 25-OH vitaminu D<sub>3</sub>, proto dostatek 25-OH vitaminu D<sub>3</sub> je nejvíce limitujícím faktorem pro extrarenální syntézu (84). Rovnováha mezi CYP27B1, který vede ke konverzi 25-OH vitaminu D<sub>3</sub> na 1,25(OH)<sub>2</sub> vitaminu D<sub>3</sub>, a CYP24A1, který inaktivuje oba, rozhoduje o buněčné expozici 1,25(OH)<sub>2</sub> vitaminu D<sub>3</sub>. Tato rovnováha se mění během tumorigeneze a je tkáňově specifická. Např., tumor prostaty (ale ne tumor kolorekta) ztratí-li svou 1-alfa-hydroxylázovou aktivitu, stává se více agresivním (84). Takto 25-OH vitamin D<sub>3</sub> může být méně účinný proti agresivním prostatickým tumorům. Kromě toho, androgeny mohou měnit rovnováhu mezi CYP27B1 a CYP24A1. Dihydrotestosteron inhibuje 1,25(OH)<sub>2</sub> vitaminem D<sub>3</sub> mediovanou indukci CYP24A1 a několik cílových molekul pro působení 1,25(OH)<sub>2</sub> vitaminu D<sub>3</sub>. Interakce se také vyskytují mezi receptory pro androgeny a signály zprostředkované VDR receptory (31). (staženo z www.google.cz [cit. 2012-02-08], Holick MF. J Clin Invest 2005; 115(1): 32. <a href="http://www.ncbi.nlm.nih.gov/pmc/articles/PMC539210/figure/F1/"target="_blank">http://www.ncbi.nlm.nih.gov/pmc/ articles/PMC539210/figure/F1</a>.](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/5ba4a85de15e654a7c1df5cc1735ec49.jpg)
Polymorfismus receptoru pro vitamin D
Jak bylo zmíněno výše, biologický efekt vitaminu D je zprostředkován vazbou na VDR receptory. Bylo zjištěno, že lidský VDR má více než 470 různých jedno-nukleotidových polymorfismů, jejichž distribuce a frekvence se liší mezi jednotlivými etnickými skupinami. Začíná se studovat jejich vliv na riziko vzniku nádorů (31). Některé z nich jsou shrnuty v tabulce 1.
Table 1. Některé z polymorfismů receptoru pro vitamin D, u kterých je již znám funkční význam. Asociace polymorfismů VDR s některými druhy malignit je předmětem výzkumů 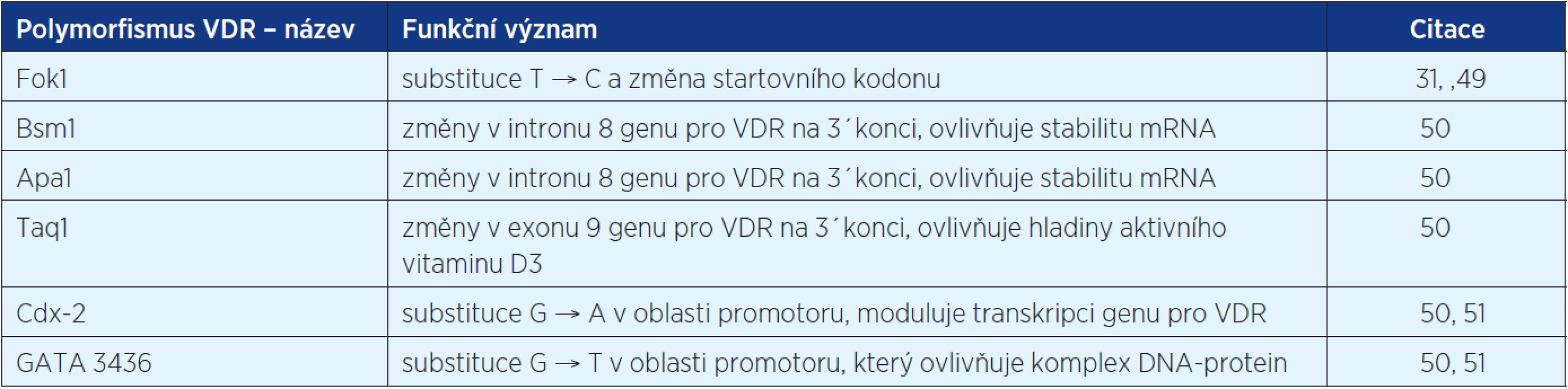
Byla vyslovena hypotéza, že VDR polymorfismy mohou nejen ovlivňovat riziko vzniku maligního onemocnění, ale také prognózu. Podle studie z roku 2009 (52), která systematicky přezkoumala dostupnou literaturu o důležitosti VDR polymorfismů ve vztahu k jednotlivým malignitám (karcinom kůže, prostaty, prsa, kolorekta, ovaria, ledvin, močového měchýře) nelze objektivně zaujmout definitivní postoj k důležitosti VDR genotypu a výskytu karcinomů. Zdá se pravděpodobné, že interakce s ostatními faktory, jako je příjem kalcia a vitaminu D, plazmatické hladiny 1,25(OH)2vitaminu D3 a expozice UV záření, hrají také významnou roli ve vzniku nádoru. Ostatní rizikové faktory, jako je obezita, kouření, parita, fyzická aktivita a další, jsou často zmiňované jako důležité pro karcinogenezi závislou na VDR genotypu (52). Navíc je často zmiňováno, že stejný VDR polymorfismus má různý efekt závislý na typu malignity, nebo může být jen rozhodující pro více nebo méně agresivní chování tumoru (31, 53).
Některé studie ukazují, že ne všechny polymorfismy mají stejnou asociaci s maligním onemocněním. Je však nutné poznamenat, že signifikantní asociace typu rakoviny s VDR polymorfismem byla zjištěna u karcinomu prsu (Fok1, Bsm1), karcinomu prostaty (Fok1) a maligního melanomu (Fok1). Data ukazující na spojitost VDR polymorfismu ve vztahu k prognóze jsou nejsignifikantnější u karcinomu prostaty (Fok1), karcinomu prsu (Bsm1, Taq1), maligního melanomu (Bsm1) a karcinomu ledviny (Taq1) (36, 52, 54).
Patofyziologické souvislosti působení vitaminu D nasubcelulární úrovni
Prokázané jsou antiproliferativní a diferenciační účinky vitaminu D, vitamin D kontroluje proliferaci (55) a diferenciaci normálních i nádorových buněk (55, 56), zasahuje do signálních drah pozitivních i negativních regulátorů buněčného cyklu (57–59).
Působení vitaminu D bylo objeveno na několika místech, např. působí v signální dráze zapříčiňující defosforylaci Rb proteinu (retinoblastoma-protein), což vede k bloku buňky v kontrolním bodu G1 a takto k inhibici proliferace (56).Kalcitriol rovněž inhibuje Src tyrosin kinázu v Ras/Raf signální dráze (cykliny a cyklin-dependentní kinázy – CDKs, které patří k pozitivním regulátorům buněčného cyklu), což vede ke snížení aktivity ERK1/2 (extracelulárně signál-regulovaná kináza 1 a 2) a MAP (mitogen activated protein), a tím k redukci tvorby cyklin/CDKs komplexů, což má za následek opět inhibici proliferace blokádou v G1 kontrolním uzlu (56).
Vitamin D-VDR komplex zapříčiňuje také zvýšení aktivity proteinu p21 a p27, čímž indukuje zastavení buňky v G1 kontrolním bodu. Kalcitriol hraje také významnou roli v signální dráze proteinu p53; v mnoha nádorových buňkách byl VDR díky p53 upregulován, čímž se zvýší citlivost nádorových buněk k vitaminu D, v jiných nádorových buňkách je naopak VDR downregulován, přesný mechanismus zatím není znám (60).
Vitamin D také interferuje v signálních drahách, které se u tumorů podílejí na schopnosti tvořit metastázy (61). Protein cystatin D je kódován genem CST5, jehož downregulace byla nalezena u kolorektálního karcinomu. Vitamin D-VDR komplex má schopnost aktivovat gen CST5, čímž se v buňce zvyšuje koncentrace cystatinu D, a tak dochází k inhibici proliferace, rovněž i u buněk karcinomu prsu (57, 62). Vitamin D interferuje v buňce s mnoha jinými signálními dráhami, např. s dráhami iniciovanými růstovým faktorem IGF, EGF1, TGF-β (56, 57, 63–65).
Antikancerogenní účinek vitaminu D je podpořen účinkem proapoptotickým (56, 57, 66) a antiangiogenním (56, 67). Audo et al. zjistili, že vitamin D a jeho analoga zvyšují apoptózu u buněk myšího retinoblastomu tím, že zvyšují koncentraci p21 a p53 v buňce (68). V jiných nádorových buňkách dochází působením vitaminu D k upregulaci BAX (protein, který má v buňce funkci proapoptotickou) a downregulaci bcl-2 (protein, který má v buňce funkci antiapoptotickou), čímž se indukuje apoptóza skrze signální dráhu proteinu p53 (69) (gliomové nádorové buňky, buňky karcinomu prsu (70). Kromě těchto prvně objevených mechanismů vědci nyní začínají objevovat i mechanismy jiné (srov. 57).
Kalcitriol inhibuje proliferaci endotelových buněk (Ecs), a to mimo jiné na základě zvýšení exprese VDR a hladiny apo-ptogenního proteinu p27 v ECs, jsou inhibovány signální kaskády systému Ras/Raf, ale také např ERK1/2 (viz výše). Dále vitamin D inhibuje v nádorových i v podpůrných buňkách sekreci interleukinu 8, který hraje důležitou roli v aktivování makrofágů a rozrušování bazální membrány u existujících cév (56). Na úrovni makrofágů inhibuje vitamin D také sekreci metaloproteáz, které pak bazální membránu přímo štěpí (57). Těmito a pravděpodobně i jinými mechanismy hraje vitamin D důležitou úlohu v inhibici vzniku metastáz, a snižuje tak invazivitu tumoru (71).
VITAMIN D A NÁDOROVÁ ONEMOCNĚNÍ
Většina výzkumů o účinku vitaminu D u malignit proběhla doposud u dospělých pacientů.
Vztah vitaminu D k výskytu nádorových onemocnění
Metaanalýza z roku 2007 ukázala (72), že u pacientů se sérovou hladinou vitaminu D > 82 nmol/l je o 50 % nižší výskyt kolorektálního karcinomu než u lidí s hladinou vitaminu D < 30 nmol/l. Podle jiné studie z bostonského Dana-Farber Cancer Institute (73) se ukázalo, že u pacientů s karcinomem tlustého střeva, kteří měli v době diagnózy vyšší hladinu vitaminu D v séru, byla o 50 % nižší pravděpodobnost úmrtí na toto onemocnění ve srovnání s pa-cienty, kteří měli tohoto vitaminu v séru méně (34, 73).
Méně těsný je tento vztah u karcinomu prsu a prostaty, např. u karcinomu prsu ženy s hladinami vitaminu D v séru vyššími než 130 nmol/l měly o 50 % nižší riziko vzniku tohoto onemocnění než ženy s hladinami pod 32,5 nmol/l (33). Zdá se tedy, že ne všechny tkáně reagují na vitamin D stejně. Spíše to ukazuje, že vitamin D hraje významnější roli v progresi rakoviny než v celkové incidenci (74).
Z dalších výzkumů vyplývá (35), že u pacientek s karcinomem prsu byly hladiny vitaminu D tím nižší, čím pokročilejší bylo nádorové onemocnění. Suplementace vitaminem D v dávce 50 000 UI týdně u těchto nemocných léčených inhibitory aromatáz vedla k normalizaci nízkých hladin vitaminu D bez výskytu nežádoucích účinků (75). Několik studií také prokazuje, že podávání vitaminu D snížilo tvorbu metastáz o 17 % (38) a u skupiny žen, které braly vitamin D preventivně, byl výskyt karcinomu prsu snížený o 30 % (35, 76).
Další studie ukazuje, že pacienti se zhoubným melanomem kůže, kteří měli v době diagnózy nejnižší hladinu vitaminu D v séru, měli až o 30 % vyšší pravděpodobnost relapsu onemocnění než pacienti s nejvyšší hladinou tohoto vitaminu. Zajímavé také bylo, že u pacientů s vyšší hladinou vitaminu D v době diagnózy nedosahoval nádor takové tloušťky jako u pacientů s nižšími hladinami vitaminu D (77). Podobný vztah byl objeven i u některých non-
-hodgkinských lymfomů (DLBCL – velkobuněčný B-lymfom, T-buněčný lymfom) nebo u nádorů hlavy a krku (78, 79).
Zatím však není známa optimální hladina vitaminu D v séru jako prevence vzniku onkologického onemocnění (30), není ani jasné, ve kterém časovém období lidského života je nejdůležitější podávat vitamin D (2), a zda pokračovat v běžné pediatrické suplementaci vitaminu D i ve vyšším věku u dětí, případně dospělých (srov. 9, 15, 32, 39, 80–82).
Vitamin D reguluje také mnoho genů zapojených v prostaglandinovém metabolismu. 1,25(OH)2 vitamin D3 inhibuje expresi a aktivitu COX-2, inhibuje expresi prostaglandinových receptorů a zapříčiňuje vzrůstající prostaglandinový katabolismus prostřednictvím zvýšené exprese 15-prostaglandin-dehydrogenázy (83). V kombinaci těchto tří mechanismů redukuje prostaglandinové hladiny a signály, tímto zmírňuje růstově-stimulační efekt prostaglandinů na karcinom prostaty. Dále 1,25(OH)2 vitamin D3 a naproxen (nesteroidní protizánětlivý lék) působí in vitro synergicky a inhibují růst buněk karcinomu prostaty efektivněji, než jsou-li podávány pacientům jednotlivě (31).
Různé složky potravy a rovnováha mezi příjmem a výdejem energie ovlivňují metabolismus vitaminu D (obr. 2). Ačkoliv výzkumy ukazují, že nízké sérové koncentrace kalcia stimulují syntézu 1,25(OH)2vitaminu D3 v ledvinách z jeho prekurzoru 25-OH vitaminu D3, existují přesvědčivé důkazy o tom, že genistein, důležitá bioaktivní součást např. sóji (jeden ze známějších izoflavonoidů), může také ovlivnit metabolismus vitaminu D a jeho biologické účinky. Genistein inhibuje aktivitu CYP24A1, a tak postupně vzrůstá jak produkce, tak sérový poločas rozpadu 1,25(OH)2 vitaminu D3 a exprese VDR. Dietní foláty mohou také inhibovat aktivitu CYP24A1, a to vzrůstající metylací oblasti promotoru a down-regulací exprese genů (84). Konsenzu o optimální koncentraci 25-OH vitaminu D3v séru bude tedy velmi obtížné dosáhnout, výzkumy musí vzít v úvahu i interakce nutrient-nutrient (56, 85).
Zajímavé však bylo zjištění, že vitamin D může snad podporovat vznik určitého druhu rakoviny u jisté skupiny lidí – např. u finských kuřáků bylo pozorováno, že vyšší vitamin D status je asociován s vyšší incidencí karcinomu pankreatu. Příčiny jsou předmětem výzkumů (86). Placebem kontrolované klinické studie nově ukazují, že kombinace per os příjmu vitaminu D a kalcia snižuje incidenci onkologických onemocnění až o více než 75 % (87). Ačkoliv se tyto závěry zdají ohromující, představují jen platformu pro další klinické výzkumy vztahu vitaminu D k nádorovým onemocněním. Můžeme se tedy domnívat, že lepším porozuměním funkce cílových molekul metabolismu vitaminu D lze definovat rámec pro vývoj efektivnějších strategií prevence a léčby onkologických onemocnění.
Úloha vitaminu D v terapii nádorových onemocnění
Vzhledem k prokázané souvislosti mezi nízkými sérovými hladinami vitaminu D a zvýšeným rizikem vzniku některých maligních onemocnění je nasnadě hovořit o pozitivním významu suplementace vitaminem D v prevenci vzniku těchto onemocnění (nejsignifikantnější u karcinomu kolorekta – viz výše). Není zcela jasné, jakou úlohu při vzniku a progresi maligních onemocnění vitamin D hraje, existují ovšem důkazy o pozitivním vlivu suplementace vitaminem D u nádorových chorob. Taková souvislost byla prokázána v léčbě karcinomu prsu – u skupiny žen s tímto onemocněním léčených vitaminem D byla snížena tvorba metastáz o 17 % (viz výše) (38). Pozitivní vliv podávání vitaminu D však můžeme předpokládat i ve zmírnění některých nežádoucích účinků současné léčby maligních onemocnění (chemoterapie, radioterapie), což je například snížení kostní denzity a vznik osteoporózy právě u karcinomu prsu (35).
V dnešní době probíhá řada klinických studií, které se zabývají působením kalcitriolu a jeho analogů při léčbě některých maligních nádorů. U některých typů těchto onemocnění je vitamin D již nedílnou součástí adjuvantní léčby (88).
U karcinomu prostaty a nemalobuněčného karcinomu plic byl pozitivní efekt podávání kalcitriolu potvrzen (89). Širšímu použití však brání jeho hyperkalcemický efekt, který nastává při překročení hladiny vitaminu D v séru nad 1000 nmol/l, k jejímž příznakům patří nechutenství, vysoký krevní tlak, nadměrné močení, zvracení a zvýšení hladiny vápníku v krvi, což zvyšuje riziko srdečního selhání.
Shabahang et al. (90) byli mezi prvními, kteří si všimli toho, že pokud v buňce došlo k mutaci, která pozměnila strukturu proteinu beta-kateninu, nemůže se tento protein navázat na molekulu vitaminu D a ten nedokáže způsobit uvolnění vápníku do krve, jako je tomu za fyziologických okolností. Přesto je zachována schopnost vitaminu navázat se na onkogen, což umožňuje zamezit malignímu zvrhnutí buňky. Objevili na molekule vitaminu D dvě vazebná místa, která zajišťují zcela rozdílné funkce. Nadějí se tedy stává pozměnění molekuly vitaminu D. Léčba modifikovaným vitaminem D by mohla být účinná nejen pro zvažované případy karcinomu kolorekta, ale i zmíněného karcinomu prostaty a prsu (59). V dnešní době se testují zejména syntetické deriváty, které mají nežádoucí hyperkalcemický efekt redukovaný (91–93).
Vliv podávání vitaminu D v léčbě jiných onkologických onemocnění je stále předmětem výzkumů (92, 94).
ZÁVĚR
Nedostatek vitaminu D je prokázaným rizikovým faktorem pro vznik různých onemocnění, např. hypertenze, diabetes mellitus, osteoporózy, některých infekčních (tuberkulóza) a autoimunitních chorob (roztroušená skleróza, revmatoidní artritida) včetně některých typů onkologických onemocnění. Protinádorové působení vitaminuD/VDR systému je založeno na ovlivnění buněčného cyklu maligních buněk na více úrovních. Výsledný biologický efekt působení vitaminu D je dán ovlivněním celé řady dějů. Vitamin D tak pravděpodobně hraje významnou roli v prevenci a snad i v léčbě několika typů rakoviny, nicméně přesné mechanismy účinků ani případná terapeutická dávka nejsou doposud známy.
Vitamin D je v současné době hitem vědeckých výzkumů v mnoha oblastech medicíny s rozsáhlými výstupy týkajících se lidského zdraví.
Zkratky
AP - alkalická fosfatáza
CaBP - calcium-binding protein
CaR - receptor pro extracelulární kalcium
CDKs - cyklin-dependentní kinázy
DBP - D-binding protein
ECs - endotelové buňky
ERK1/2 - extracelulárně signál-regulovaná kináza 1 a 2
IFN - interferon
MAP - mitogen activated protein
MS - metabolický syndrom
PSA - prostatický specifický antigen
PTH - parathormon
PXR - pregnane X receptor
RANKL - aktivátor nukleárního faktoru kappa B
Rb - retinoblastoma
TNF - tumor necrosis factor
UVB - ultrafialové záření B
VDR - receptor pro vitamin D
VDREs - vitamin D – responsive elements
VLDL - very-low-density lipoproteinPráce vznikla za podpory projektu RECAMO CZ.1.05/2.1.00/03.0101 a projektu LM2010004.
Adresa pro korespondenci:
MUDr. Klára Drábová
Klinika dětské onkologie FN
Černopolní 9, 613 00 Brno
e-mail: d.klarka@seznam.cz
Sources
1. Henaey, Robert P, et al. Vitamin D-3 Is More Potent Than Vitamin D–2 in Humans. Journal of Clinical Endocrinology & Metabolism 2011; 96 : 3: E447–E452.
2. Zhang, Ran; Naughton, Declan P. Vitamin D in health and disease: Current perspectives. Nutrition Journal [online] http://www.nutritionj.com/content/9/1/65.
3. Skácelová, S. Význam vitaminu D pro lidské zdraví. Česká revmatologie 2010; 18(1): 26–40.
4. Schuster I. Cytochromes P450 are essential players in the vitamin D signaling system. Biochimica et Biophysica Acta : Proteins and Proteomics 2011; 1814(1): 186–199.
5. Jabor A, et al. Vnitřní prostředí. Praha : Grada Publishing 2008.
6. Zehnder D, et al. Extrarenal expression of 25-hydroxyvitamin d(3)-1 alpha-hydroxylase. J Clin Endocrinol Metab 2001; 86(2): 888–894.
7. Silbernagl S, Lang F. Atlas patofyziologie člověka 1. Praha: Grada Publishing 2001.
8. Speeckaert MM, et al. Investigation of the potential association of vitamin D binding protein with lipoproteins. Annals of Clinical Biochemistry 2010; 47(2): 143–150.
9. Brannon PM, et al. Overview of the conference «Vitamin D and Health in the 21st Century: an Update». American Journal of Clinical Nutrition 2008; 88(2): 483S–490S.
10. Reis JP, et al. Serum vitamin D, parathyroid hormone levels, and carotid atherosclerosis. Atherosclerosis 2009; 207(2): 585–590.
11. Snijder M, et al. Vitamin D and diabetes. Diabetologia 2006; 49(1): 217–218.
12. Quarles LD. Endocrine functions of bone in mineral metabolism regulation. Journal of Clinical Investigation 2008; 118(12): 3820–3828.
13. St-Arnaud R. The direct role of vitamin D on bone homeostasis. Archives of Biochemistry and Biophysics 2008; 473(2): 225–230.
14. Mullin GE, Dobs A. Vitamin D and its role in cancer and immunity: A prescription for sunlight. Nutrition in Clinical Practice 2007; 22(3): 305–322.
15. Souberbielle J-C, et al. Vitamin D and musculoskeletal health, cardiovascular disease, autoimmunity and cancer: Recommendations for clinical practice. Autoimmunity Reviews 2010; 9(11): 709–715.
16. Edfeldt K, et al. T-cell cytokines differentially control human monocyte antimicrobial responses by regulating vitamin D metabolism. Proc Natl Acad Sci USA 2010; 107 : 22593–22598.
17. Pryke AM, et al. Tumor necrosis factor-α induces vitamin D-1-hydroxylase activity in normal human alveolar macrophages. J Cell Physiol 1990; 142 : 652–656.
18. Szeles L, et al. 1,25-dihydroxyvitamin D3 is an autonomous regulator of the transcriptional changes leading to a tolerogenic dendritic cell phenotype. J Immunol 2009; 182 : 2074–2083.
19. Cantorna MT. Why do T cells express the vitamin D receptor? Ann NY Acad Sci 2011; 1217 : 77–82.
20. Motrich RD, et al. Impact of vitamin D receptor activity on experimental autoimmune prostatitis. J Autoimmun 2009; 32 : 140–148.
21. Mayne CG, et al. 1,25-Dihydroxyvitamin D3 acts directly on the T lymphocyte vitamin D receptor to inhibit experimental autoimmune encephalomyelitis. Eur J Immunol 2011; 41 : 822–832.
22. Griffin MD, Dong X, Kumar R. Vitamin D receptor-mediated suppression of RelB in antigen presenting cells: a paradigm for ligand-augmented negative transcriptional regulation. Arch Biochem Biophys 2007; 460 : 218–226.
23. Cantorna MT, Mahon BD. Mounting evidence for vitamin D as an environmental factor affecting autoimmune disease prevalence. Exp Biol Med (Maywood) 2004; 229 : 1136–1142.
24. Palmer MT, et al. Lineage-specific effects of 1,25-dihydroxyvitamin D(3) on the development of effector CD4 T cells. J Biol Chem 2011; 286 : 997–1004.
25. Lips P. Worldwide status of vitamin D nutrition. Journal of Steroid Biochemistry and Molecular Biology 2010; 121, 1–2 : 297–300.
26. Holick MF. High prevalence of vitamin D inadequacy and implications for health. Mayo Clinic Proceedings 2006; 81(3): 353–373.
27. Ginter E, Simko V. Vitamin D deficiency, atherosclerosis and cancer. Bratislava Medical Journal – Bratislavské lékařské listy 2009; 110(12): 751–756.
28. Holick MF, Chen TC. Vitamin D deficiency: a worldwide problem with health consequences. ELT Journal 2010; 64(1): 1080S–1086S.
29. Hart GR, et al. Measurement of vitamin D status: background, clinical use, and methodologies. Clinical Laboratory 2006; 52(7–8): 335–343.
30. Peterlik M, Grant WB, Cross HS. Calcium, Vitamin D and cancer. Anticancer Research 2009; 29(9): 3687–3698.
31. Davis CD. Vitamin D and cancer: current dilemmas and future research needs. American Journal of Clinical Nutrition 2008; 88(2): 565S–569S.
32. Garland CF, et al. Vitamin D for cancer prevention: global perspective. Annals of Epidemiology 2009; 19(7): 468–483.
33. Garland CF, et al. Vitamin D and prevention of breast cancer: Pooled analysis. Journal of Steroid Biochemistry and Molecular Biology 2007; 103(3–5): 708–711.
34. Wu K, et al. A Nested case-control study of plasma 25-hydroxyvitamin d concentrations and risk of colorectal cancer. Journal of the National Cancer Institute 2007; 99(14): 1120–1129.
35. Napoli N, et al. High Prevalence of Low Vitamin D and Musculoskeletal Complaints in Women with Breast Cancer. The Breast Journal 2010; 16(6): 609–616.
36. McCullough ML, Bostick RM, Mayo TL. Vitamin D gene pathway polymorphisms and risk of colorectal, breast, and prostate cancer. Annual Review of Nutrition 2009; 29 : 111–132.
37. Kleibeuker JH, Vandermeer R, Devries EGE. Calcium and vitamin-D – possible protective agents against colorectal-cancer. European Journal of Cancer 1995; 31A(7–8): 1081–1084.
38. Cui Y, Rohan TE. Vitamin D, calcium, and breast cancer risk: a review. Cancer Epidemiology Biomarkers & Prevention 2006; 15(8): 1427–1437.
39. Greer FR. Issues in establishing vitamin D recommendations for infants and children. American Journal of Clinical Nutrition 2004; 80(6): 1759S–1762S.
40. Vieth R. Vitamin D and cancer mini-symposium: the risk of additional vitamin D. Annals of Epidemiology 2009; 19, 7 : 441–445.
41. Jones G. Pharmacokinetics of vitamin D toxicity. The American Journal of Clinical Nutrition 2008; 88, 2 : 582S–586S.
42. Brock K, et al. Low vitamin D status is associated with physical inactivity, obesity and low vitamin D intake in a large US sample of healthy middle-aged men and women. Journal of Steroid Biochemistry and Molecular Biology 2010; 121(1–2): 462–466.
43. Lagunova Z, et al. Obesity and increased risk of cancer: does decrease of serum 25-hydroxyvitamin D level with increasing body mass index explain some of the association? Molecular Nutrition & Food Research 2010; 54(8): 1127–1133.
44. Looker AC. Do body fat and exercise modulate vitamin D status? Nutrition Reviews 2007; 65(8): S124–S126.
45. Ford ES, Ajani UA, McGuire LS. Concentrations of serum vitamin D and the metabolic syndrome among U.S. adults. Diabetes Care 2005; 28(5): 1228–1230.
46. Silvagno F, et al. Analysis of vitamin D receptor expression and clinical correlations in patients with ovarian cancer. Gynecologic Oncology 2010; 119(1): 121–124.
47. Srinivasan M, et al. Nuclear vitamin D receptor expression is associated with improved survival in non–small cell lung cancer. Journal of Steroid Biochemistry and Molecular Biology 2011; 123(1–2): 30–36.
48. Lopes N, et al. Alterations in vitamin D signalling and metabolic pathways in breast cancer progression: a study of VDR, CYP27B1 and CYP24A1 expression in benign and malignant breast lesions. BMC Cancer 2010; 10 : 483–492.
49. Wong HL, et al. Vitamin D receptor start codon polymorphism and colorectal cancer risk: effect modification by dietary calcium and fat in Singapore Chinese. Carcinogenesis 2003; 24(6): 1091–1095.
50. Rukin NJ, Strange RC. What are the frequency, distribution, and functional effects of vitamin D receptor Polymorphisms as related to cancer risk? Nutrition Reviews 2007; 65(8): S96–S101.
51. Rukin NJ, et al. Prostate cancer susceptibility is mediated by interactions between exposure to ultraviolet radiation and polymorphisms in the 5‘ haplotype block of the vitamin D receptor gene. Cancer Letters 2007; 247(2): 328–335.
52. Koestner K, et al. The relevance of vitamin D receptor (VDR) gene polymorphisms for cancer: a review of the literature. Anticancer Research 2009; 29(9): 3511–3536.
53. Ingles SA. Can diet and/or sunlight modify the relationship between vitamin D receptor Polymorphisms and prostate cancer risk? Nutrition Reviews 2007; 65(8): S105–S107.
54. Raimondi S, et al. Review and meta-analysis on vitamin D receptor polymorphisms and cancer risk. Carcinogenesis 2009; 30(7): 1170–1180.
55. Fenton RG, Longo DL. Cancer cell biology and angiogenesis. Harrison's principles of internal medicine 2005; 16 : 453–464.
56. Chakraborti ChK. Vitamin D as a promising anticancer agent. Indian Journal of Pharmacology 2011; 43(2): 113–120.
57. Masuda S, Jones G. Promise of vitamin D analogues in the treatment of hyperproliferative conditions. Molecular Cancer Therapeutics 2006; 5(4): 797–808.
58. Wang QM, Jones JB, Studzinski GP. Cyclin-dependent kinase inhibitor p27 as a mediator of the G1-S phase block induced by 1,25-dihydroxyvitamin D3 in HL60 cells. Cancer Research 1996; 56 : 264–267.
59. May P, May E. Twenty years of p53 research: structural and functional aspects of the p53 protein. Oncogene 1999; 18(53): 7621–7636.
60. Maruyama R, et al. Comparative genome analysis identifies the vitamin D receptor gene as a direct target of p53-mediated transcriptional activation. Cancer Research 2006; 66(9): 4574–4583.
61. Thompson MD, Monga SPS. WNT/beta-catenin signaling in liver health and disease. Hepatology 2007; 45(5): 1298–1305.
62. Alvarez-Diaz S, et al. Cystatin D is a candidate tumor suppressor gene induced by vitamin D in human colon cancer cells. Journal of Clinical Investigation 2009; 119 : 2343–2358.
63. Yang L, et al. Autocrine TGF-β signaling mediates vitamin D3 analog-induced growth inhibition in breast cells. Journal of Cell Physiology 2001; 188 : 383–393.
64. Rozen F, et al. Anti-proliferative action of vitamin D-related compounds and insulin-like growth factor-binding protein 5 accumulation. Journal of the National Cancer Institute 1997; 89 : 652–656.
65. Haussler MR, et al. The nuclear vitamin D receptor controls the expression of genes encoding factors which feed the „Fountain of Youth“ to mediate healthful aging. Journal of Steroid Biochemistry and Molecular Biology 2010; 121 : 88–97.
66. Fesik SW, Shi YG. Structural biology - Controlling the caspases. Science 2001; 294(5546): 1477–1478.
67. Gupta MK, QIN R-Y. Mechanism and its regulation of tumor-induced angiogenesis. World Journal of Gastroenterology 2003; 9(6): 1144–1155.
68. Audo I, et al. Vitamin D analogues increase p53, p21, and apoptosis in a xenograft model of human retinoblastoma. Invest Ophthalmology & Visual Science 2003; 44(10): 4192–4199.
69. Wagner N, et al. 1,25-dihydroxyvitamin D-3-induced apoptosis of retinoblastoma cells is associated with reciprocal changes of Bcl-2 and bax. Experimental Eye Research 2003; 77(1): 1–9.
70. Sundaram S, et al. The combination of a potent Vitamin D3 analog, EB 1089, with ionizing radiation reduces tumor growth and induces apoptosis of MCF-7 breast tumor xenografts in nude mice. Clinical Cancer Research 2003; 9(6): 2350–2356.
71. Nakagawa K, et al. 22-Oxa-1α,25-dihydroxyvitaminD3 inhibits metastasis and angiogenesis in lung cancer. Carcinogenesis 2005; 26 : 1044–1054.
72. Gorham ED, et al. Optimal vitamin D status for colorectal cancer prevention: a quantitative meta analysis. American Journal of Preventive Medicine 2007; 32 : 210–216.
73. Ng K, et al. Prospective study of predictors of vitamin D status and survival in patients with colorectal cancer. British Journal of Cancer 2009; 101 : 916–923.
74. Giovannucci E. Strengths and limitations of current epidemiologic studies: vitamin D as a modifier of colon and prostate cancer risk. Nutrition Reviews 2007; 65: S77–79.
75. Khan QJ, et al. Effect of vitamin D supplementation on serum 25-hydroxy vitamin D levels, joint pain, and fatigue in women starting adjuvant letrozole treatment for breast cancer. Breast Cancer Research and Treatment 2010; 119(1): 111–118.
76. Rohan T. Epidemiological studies of vitamin D and breast cancer. Nutrition Reviews 2007; 65: S80–83.
77. Nürnberg B, et al. Reduced Serum 25-Hydroxyvitamin D Levels in Stage IV Melanoma Patients. Anticancer Research 2009; 29(9): 3669–3674.
78. Drake MT, et al. Vitamin D Insufficiency and Prognosis in Non-Hodgkin´s Lymphoma. Journal of Clinical Oncology 2010; 28(27): 4191–4198.
79. Meyer F, et al. Dietary vitamin D intake and serum 25-hydroxyvitamin D level in relation to disease outcomes in head and neck cancer patients. International Journal of Cancer 2011; 128(7): 1741–1746.
80. Holick MF. Vitamin D: Evolutionary, Physiological and Health Perspectives. Current Drug Targets 2011; 12(1): 4–18.
81. Stallings VA. Childhood cancer and vitamins: prevention and treatment. Pediatric Blood & Cancer 2008; 50, 2 : 442–444.
82. Kennedy DD, et al. Low antioxidant vitamin intakes are associated with increases in adverse effects of chemotherapy in children with acute lymphoblastic leukemia. American Journal of Clinical Nutrition 2004; 79(6): 1029–1036.
83. Feldman D, et al. Vitamin D inhibition of the prostaglandin pathway as therapy for prostate cancer. Nutrition Reviews 2007; 65(8): S113–S115.
84. Cross HS. Extrarenal vitamin D hydroxylase expression and activity in normal and malignant cells: Modification of expression by epigenetic mechanisms and dietary substances. Nutrition Reviews 2007; 65(8): S108–S112.
85. Krishnan AV, et al. Potentiation of the growth-inhibitory effects of vitamin D in prostate cancer by genistein. Nutrition Reviews 2007; 65(8): S121–S123.
86. Stolzenberg-Solomon RZ, et al. A prospective nested case-control study of vitamin D status and pancreatic cancer risk in male smokers. Cancer Research 2006; 66(20): 10213–10219.
87. Lappe JM, et al. Vitamin D and calcium supplementation reduces cancer risk: results of a randomized trial. American Journal of Clinical Nutrition 2007; 85(6): 1586–1591.
88. Zapletalova D, et al. Metronomic chemotherapy with the COMBAT regimen in advanced pediatric malignancies: a multicenter experience. Oncology 2012; 82(5): 249–260.
89. Zhou W, et al. Circulating 25-hydroxyvitamin D levels predict survival in early-stage non-small-cell lung cancer patients. Journal of Clinical Oncology 2007; 25(5): 479–485.
90. Shabahang M, et al. Growth-inhibition of ht-29 human colon-cancer cells by analogs of 1,25-dihydroxyvitamin D-3. Cancer Research 1994; 54(15): 4057–4064.
91. Spina CS, et al. Vitamin D and cancer. Anticancer Research 2006; 26(4A): 2515–2524.
92. Berkovich L, Ben-Shabat S, Sintov AC. Induction of apoptosis and inhibition of prostate and breast cancer growth by BGP-15, a new calcipotriene-derived vitamin D-3 analog. Anti-Cancer Drugs 2010; 21(6): 609–618.
93. Lange TS, et al. Effect of a Vitamin D-3 derivative (B3CD) with postulated anti-cancer activity in an ovarian cancer animal model. Investigational New Drugs 2010; 28(5): 543–553.
94. Edlich RF, et al. Scientific documentation of the relationship of vitamin d deficiency and the development of cancer. Journal of Environmental Pathology Toxicology and Oncology 2009; 28(2): 133–141.
95. Bikle D. Nonclassic actions of vitamin D. Journal of Clinical Endocrinology & Metabolism 2009; 94, 1 : 26–34.
96. Haussler MR, et al. The nuclear vitamin D receptor: biological and molecular regulatory properties revealed. Journal of Bone and Mineral Research 1998; 13(3): 325–349.
97. Ng KY, et al. Vitamin D and vitamin a receptor expression and the proliferative effects of ligand activation of these receptors on the development of pancreatic progenitor cells derived from human fetal pancreas. Stem Cell Reviews and Reports 2011; 7(1): 53–63.
98. Carlberg C. Current understanding of the function of the nuclear vitamin D receptor in response to its natural and synthetic Ligands. Recent Results in Cancer Research 2003; 164 : 29–42.
99. Holick MF. Stay tuned to PXR: an orphan actor that may not be D-structive only to bone. The Journal of Clinical Investigation 2005; 115(1): 32–34.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- Diferenciální diagnostika onemocnění ilea*
- Význam infekcí způsobených lidskými papilomaviry
- Vitamin D – jeho fyziologie, patofyziologie a význam v etiopatogenezi nádorových onemocnění
- Úloha kouření v epigenetické modifikaci fenotypu: nejnovější poznatky o patologických procesech vyvolaných kouřením
- EFMA Forum 2013
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Diferenciální diagnostika onemocnění ilea*
- Vitamin D – jeho fyziologie, patofyziologie a význam v etiopatogenezi nádorových onemocnění
- Význam infekcí způsobených lidskými papilomaviry
- Úloha kouření v epigenetické modifikaci fenotypu: nejnovější poznatky o patologických procesech vyvolaných kouřením
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

