-
Medical journals
- Career
Nekonvulzivní status epilepticus
Authors: Zdeněk Vojtěch; Tomáš Procházka; Iva Marečková
Authors‘ workplace: Neurologické oddělení Nemocnice Na Homolce, Praha
Published in: Čas. Lék. čes. 2011; 150: 260-272
Category: Review Article
Overview
V článku jsou krátce shrnuta základní fakta o klasifikaci, klinické prezentaci, EEG diagnostice a léčbě nekonvulzivního epileptického statu.
Klíčová slova:
nekonvulzivní status epilepticus, elektroencefalografie, antiepileptika.Úvod
Nekonvulzivní status epilepticus (NCSE) byl popsán počátkem 19. století a byl tehdy především ve francouzské a anglické literatuře označován rozličnými názvy (furor epilepticus, epileptic mania, epileptic delirium, fureur epileptique, petit mal intellectual). Obsah těchto termínů byl často nejasný. Zavedení EEG v první polovině 20. století vedlo k poznání, že jde o heterogenní poruchu s různou etiologií a několika podtypy, které byly opět pojmenovávány různě, někdy vzájemně se překrývajícími termíny (např. minor status epilepticus, spike-wave stupor, epileptic twilight state, epilepsia minores continua, impulsive petit mal status, dialeptic status epilepticus) (1).
Definice a klasifikace
NCSE je definován jako alespoň 30 minut trvající, od výchozího stavu se odlišující změna vnímání, chování nebo myšlení, spojená s kontinuálními epileptiformními výboji na EEG. Za refrakterní považujeme NCSE, který není kontrolován dvěma až třemi antiepileptiky (AED). Asi u 20 % dospělých pacientů trvá refrakterní NCSE navzdory léčbě týdny i měsíce. Hovoříme o maligním refrakterním epileptickém statu (SE).
V rámci NCSE rozlišujeme status generalizovaný (absence status epilepticus – ASE) a ložiskové (komplexní parciální SE-CPSE, jednoduchý parciální SE a SE u komatózních pacientů). Tato klasifikace může být matoucí, protože u jednoho pacienta se může konvulzivní status vyvíjet v NCSE a také mezi ložiskovými a generalizovanými staty mohou existovat přechody, zejména u komatózních nemocných (2).
Incidence NCSE má věkovou distribuci s vrcholy v časném dětství (<1 rok věku) a ve stáří. Odhaduje se, že NCSE představuje 1/4 až 1/2 případů SE.
Klinické rysy nekonvulzivního status epilepticus
Rozlišujeme 1. NCSE (ASE a CPSE) u chodících pacientů (3), který se obvykle projevuje jako zmatenost, a 2. NCSE u kriticky nemocných (4) manifestující se jako kóma nebo ložisková dysfunkce, někdy po zdánlivě úspěšné léčbě konvulzivního SE. V obou skupinách mohou být klinické příznaky subtilní, potenciálně zaměnitelné s psychiatrickým onemocněním nebo encefalopatií. V důsledku těžkého celkového stavu a/nebo jeho léčby mohou dokonce klinické příznaky, zejména ve 2. skupině, zcela chybět. Odlišení NCSE může být obtížné i proti pozáchvatovým stavům (halucinace, zmatenost, psychóza) a epileptickým encefalopatiím.
SE typických absencí (typical absence status epilepticus – ASE) se projevuje zmateností a sníženou odpovídavostí, jejichž stupeň obvykle příliš nekolísá. Hybnost a pohybová koordinace nebývají narušeny. Kompletní amnézie na příhodu je výjimečná. Mohou být přítomny oboustranné myoklonie (víček, periorální, na horních končetinách), někdy i atonická nebo tonická komponenta, automatismy a vegetativní změny – zblednutí, pocení, mydriáza nebo inkontinence moči. ASE nacházíme asi u 10 až 15 % dospělých pacientů s typickými absencemi. První epizoda se objevuje s dosti dlouhým odstupem po začátku onemocnění (průměrně okolo 30 let). Až u 1/3 pacientů s idiopatickou generalizovanou epilepsií může být ASE první manifestací. Až u 85 % se ASE opakuje a asi u poloviny epizoda končí generalizovaným křečovým záchvatem. Výskyt ASE záleží i na epileptickém syndromu a objevuje se zejména u syndromů s krátkými absencemi mírné intenzity. Provokující faktory představují spánková deprivace, konzumace alkoholu, vysazení AED nebo medikace nevhodnými AED. De novo vzniklý ASE s pozdním začátkem (late onset ASE) se popisuje ve stáří u osob bez anamnézy epilepsie, obvykle v rámci metabolické poruchy nebo toxických a farmakologických vlivů, např. po vysazení benzodiazepinů (BZD), provedení angiografie atd. Status atypických absencí se projevuje kolísající poruchou vědomí, často v kombinaci s tonickými, atonickými a segmentálními nebo generalizovanými myoklonickými záchvaty. Vyskytuje se zejména u dětí se symptomatickými nebo kryptogenními generalizovanými epilepsiemi. CPSE se projevuje jako protrahovaný stav zmatenosti, který může být diskontinuální nebo kontinuální („epileptic twilight state“). Jeho častým, nikoliv však nezbytným rysem je kolísání mezi stavy částečně zachované odpovídavosti a zástavou činnosti s nehybným zíráním a stereotypními automatismy. Vyskytnout se mohou behaviorální změny s dráždivostí a afektivní symptomatologie (úzkost, strach). Na stav bývá kompletní amnézie. Často zjišťujeme anamnézu ložiskové epilepsie nebo vaskulární encefalopatie. V konkrétních případech mezi ASE a CPSE existuje řada semiologických podobností a rozlišit mezi nimi je možné na základě EEG.
Jako aura continua (status aur) označujeme nepříliš často se vyskytující SE, při kterých má pacient při vědomí senzorickou (zrakovou, sluchovou, čichovou, chuťovou, somatosenzorickou), psychickou (např. strach) nebo autonomní symptomatologii.
SE u komatózních nemocných je spojen s vysokou mortalitou a morbiditou. Asi 8 % komatózních pacientů splňuje kritéria NCSE. Tito pacienti mohou mít drobné intermitentní fokální či multifokální rytmické záškuby nebo nystagmus, nemusí však vykazovat žádné semiologické známky, které by na probíhající SE upozorňovaly. Obdobný obraz, který se objevuje při progresi neléčeného nebo nedostatečně léčeného konvulzivního statu, nazýváme subtle status epilepticus.
Postanoxický SE po kardio-pulmo-cerebrální resuscitaci (KPCR) je významným prediktorem špatného výsledku (úmrtí či přežití ve vegetativním stavu). Vyskytuje se jako NCSE, nebo v podobě myoklonického SE (s EEG korelátem). V rámci postanoxického postižení se objevují i myoklonie, jejichž původ není epileptický. Stejně jako u jiných SE závisí prognóza zejména na etiologii (příčina anoxie, doba trvání KPCR, okolnosti KPCR – např. hypertermie, kde každý °C znamená 2,26× větší pravděpodobnost úmrtí). Chybějící fotoreakce a plantární reflex nebo pozitivní Babinskiho příznak 3 dny po KPCR a myoklonický status v prvních 24 hodinách po KPCR značí špatnou prognózu. NCSE má zřejmě lepší prognózu než myoklonický SE. Návrat vědomí za > 3 dny s sebou obvykle nese neurologické postižení.
EEG u epileptického statu
Neexistuje žádný EEG nález, který by byl pro NCSE patognomický. Naopak nacházíme četné EEG vzorce, jejichž význam je nejasný (5, 6). Setkáváme se s epileptiformními vzorci (obr. 1), rytmickou aktivitou (obr. 2) a jejich kombinacemi (obr. 3). Jednoduchým, ale nejednoznačným kritériem je, že jeho EEG vzorec musí představovat jasnou změnu oproti preiktálnímu stavu. Šedou zónu představují periodické epileptiformní výboje (PEDs) (obr. 4), které se někdy objevují jako interiktální, jindy jsou iktální. Podle EEG se SE v řadě případů diagnostikuje obtížně, zejména u encefalopatických osob (obr. 5).
Image 1. Padesátisedmiletá pacientka prodělala v posledním měsíci opakovaně záchvaty bezvědomí se zvracením a následnou zmateností. V mezidobí měla normální neurologický nález a EEG. Poté ráno nalezena pozvracená, v soporu, normálně dýchající, bez známek aspirace. Přechodně stáčela bulby doprava, neměla křeče. Z bezvědomí se během 24 hodin neprobírá, jednou měla záškuby levé horní končetiny, jednou deviaci bulbů doleva. Na EEG obraz NCSE, který přechází v GTCSE. Zavedeno thiopentalové kóma. Na EEG je přítomna buď rytmické záchvatové vzorce (viz šipky a, b), nebo izoelektrická křivka (c). Ještě týž den provedeno MRI mozku, kde zjištěno symetrické postižení kůry, především fronto-temporálně (d). I přes léčbu thiopentalem, i.v. AED a antiedematózní se nadále objevují občasné, lokalizačně měnlivé konvulze. V likvoru 4/3 lymfocyty, normální celková bílkovina, ale výrazné známky destrukce mozkové tkáně s hemoragickou složkou a zvýšená hladina laktátu. Zjištěna masivní hyperamonemie (20× nad normou). Následující den má ještě 2× klinický a EEG záchvat, po posledním přetrvává izoelektrická linie. Za 5 dní po začátku SE za příznaků metabolického rozvratu proveden průkaz mozkové smrti. Pitva provedena na univerzitním pracovišti; příčinou smrti byl mozkový edém. Pátrání po metabolické příčině nepřineslo objasnění etiologie, i když nálezy nevylučují některý ze vzácnějších typů CDG (kongenitální poruchy glykosylace) syndromu. 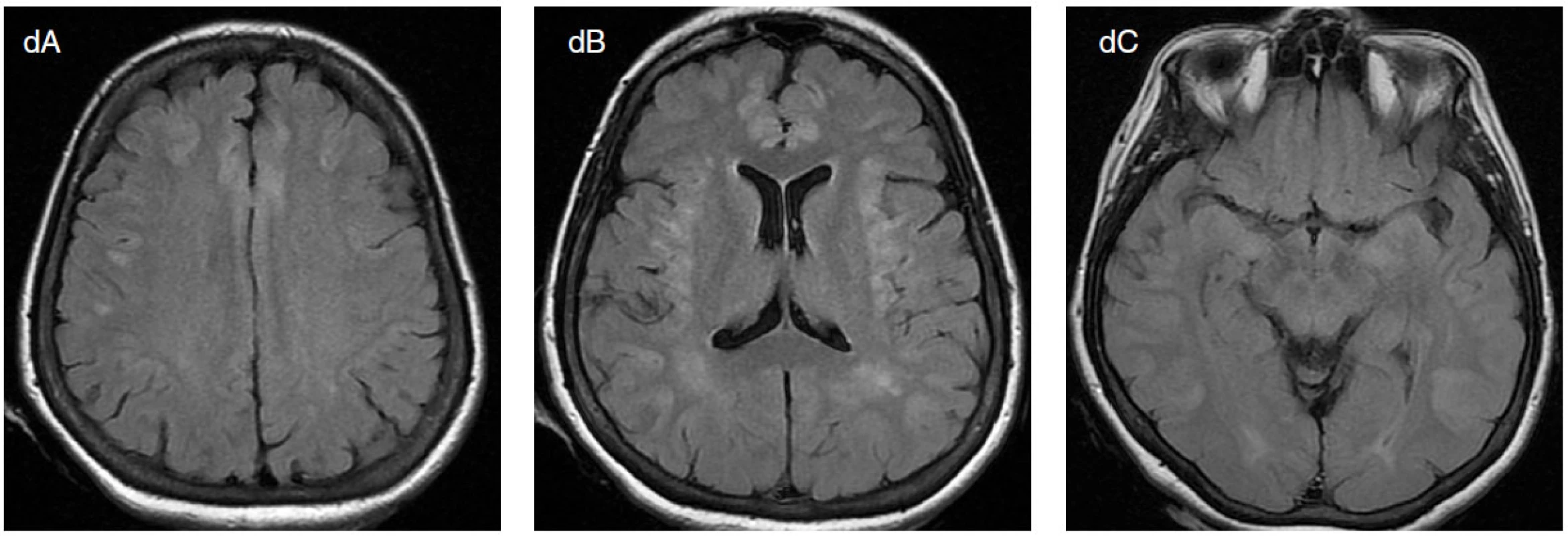
Image 2. Padesátičtyřletý pacient přijat po epileptickém záchvatu, jemuž předcházela únava, bolesti horních končetin a kůže na hrudi. V likvoru obraz serózního zánětu, dle sérologického vyšetření nejspíše boreliového. Iniciální MRI mozku normální. Při kontrolních vyšetřeních moku regredují zánětlivé změny a stoupají destrukční markery. Klinicky hyperalgický syndrom na trupu, neklid a zmatenost. Na obrázku a je patrný rytmický iktální vzorec superponovaný na pomalou aktivitu nad pravou hemisférou. Na obrázku b jsou PEDs s maximem fronto-temporálně vpravo (šipky). Na kontrolním MRI mozku (c) lehce zvýšený signál obou AHK. 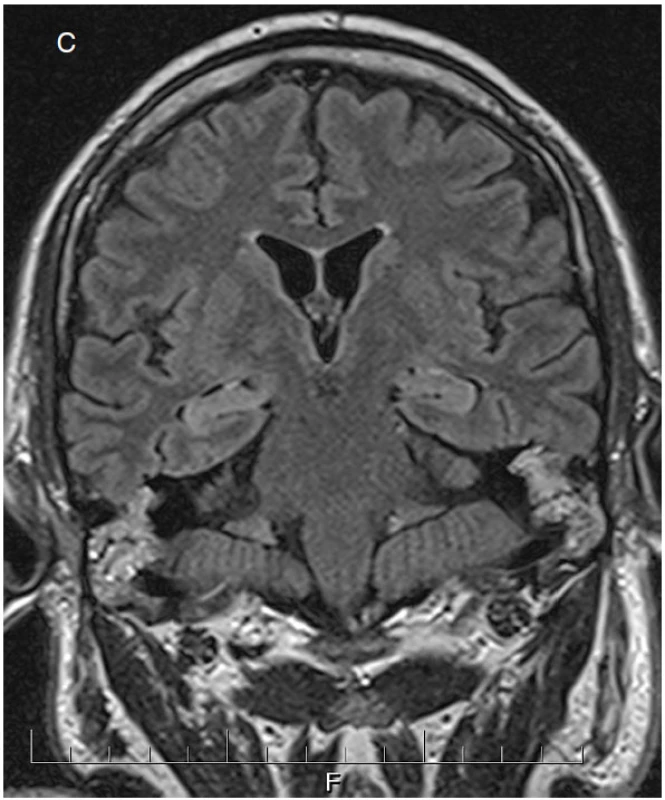
Image 3. Třicetiletá žena s několikadenní anamnézou febrilií, cefaley, nauzey a nejistoty při chůzi. Navazuje generalizovaný konvulzivní SE, pro který léčena thiopentalovým kómatem. Podařilo se dosáhnout vzorce burst-suppression. Při snaze o vyvedení z kómatu se objevují multifokální navazující elektrografické záchvaty (šipky v různých lokalizacích). V likvoru serózně zánětlivé změny, masivní elevace beta-2-mikroglobulinu, ale sérologie na množství mikroorganismů negativní. MRI mozku byla zprvu normální. Znovu zavedeno thiopentalové kóma. Při snížení thiopentalu (celkem 5×) opakované multifokální záchvaty (zejména biokcipitální nezávislé, pravostranné frontální) s drobnými klinickými projevy (např. hippus zornic, levostranná drobná motorická symptomatologie) na terénu PEDs a úseků izoelektrické křivky. V terapii dále vyzkoušen midazolam (3×), propofol (2×), chloralhydrát a ketamin. Kromě toho užita mnohá neanestezující AED v kombinacích. Kontrolní MRI mozku prokazuje difuzní postižení mozkové kůry, pulvinaru thalamů a hippocampů, nejspíše odpovídající stavu po dlouhém SE s cytotoxickým edémem (e). Exitus po 3 měsících trvání SE. Na sekci nalezena částečně poliotropní subakutní meningoencefalomyelitida s výrazným otokem mozku. Známky prionového onemocnění nalezeny nebyly. Etiologie nezjištěna. 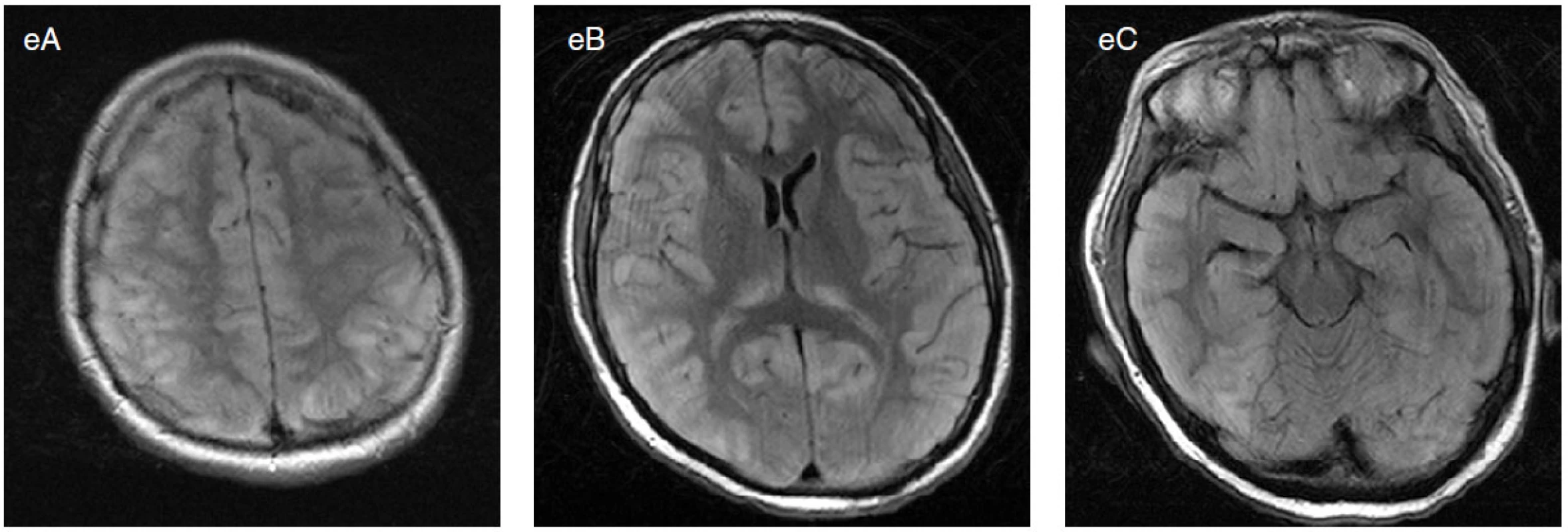
Image 4. Obr. 4d Dvacetitříletá pacientka prodělala 3–4 dny trvající onemocnění s teplotami, mírnou bolestí hlavy a zvracením. Následovalo čtyřdenní období, kdy byla bez příznaků. Pak měla záchvat s poruchou vědomí a křečemi s asi 45 minut přetrvávající zmateností. V dalších 4 dnech měla 2–3 takové záchvaty denně a přidaly se stavy se zahleděním a poklesem saturace. Pátý den se frekvence záchvatů zvětšila a přidaly se záchvaty se stočením bulbů a záškuby ústního koutku, které měnily stranu. Šestý den dochází k rozvoji SGTCSE, pro který bylo zavedeno thiopentalové kóma. Na EEG bylo dosaženo vzorce burst-suppression. Zprvu měla záchvaty i při terapeutickém vzorci, později vždy při pokusu o přerušení kómatu, takže v něm bylo nutno pokračovat 7 dní, přičemž někdy nebylo možné dosáhnout vzorce burst-suppression, ale jen PEDs (a). Na obrázku b a c je patrný rozvoj záchvatu, který na obrázku b vychází z PEDs. Po záchvatu opět nastupují PEDs (d). Po ukončení léčebného kómatu přetrvávají ojedinělé záchvaty. Při kontrolní hospitalizaci za 2 roky přetrvává organický psychosyndrom, multifokální epileptiformní abnormita a byly zachyceny multifokální záchvaty (nejčastěji pravostranné extratemporální). Na MRI jen známky progredující mozečkové atrofie. 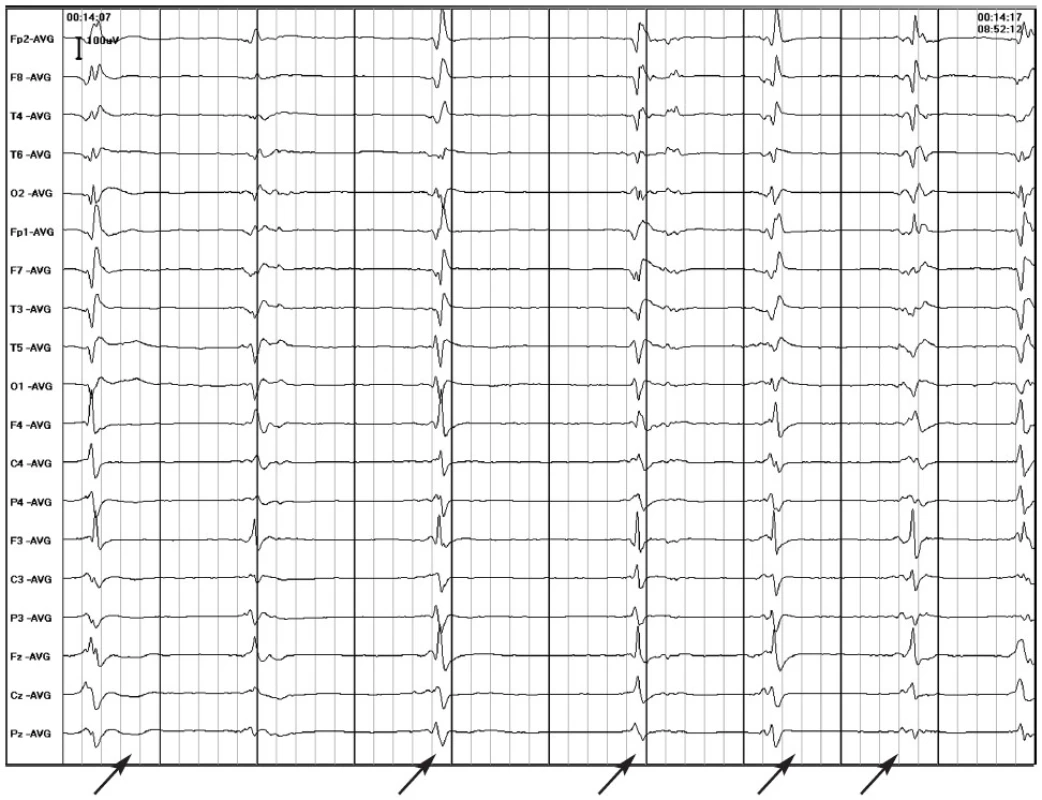
Image 5. Osmnáctiletá pacientka byla přijata po KPCR po otravě oxidem uhelnatým a topení ve vaně. Od přijetí v těžkém kómatu. Na EEG jsou přítomny suspektní, lokalizačně měnlivé iktální vzorce (šipky na obrázcích a, b), které vymizí po aplikaci DZP (c). Na CT mozku je přítomen těžký otok mozku (d). Pacientka umírá za měsíc za příznaků multiorgánového selhání. 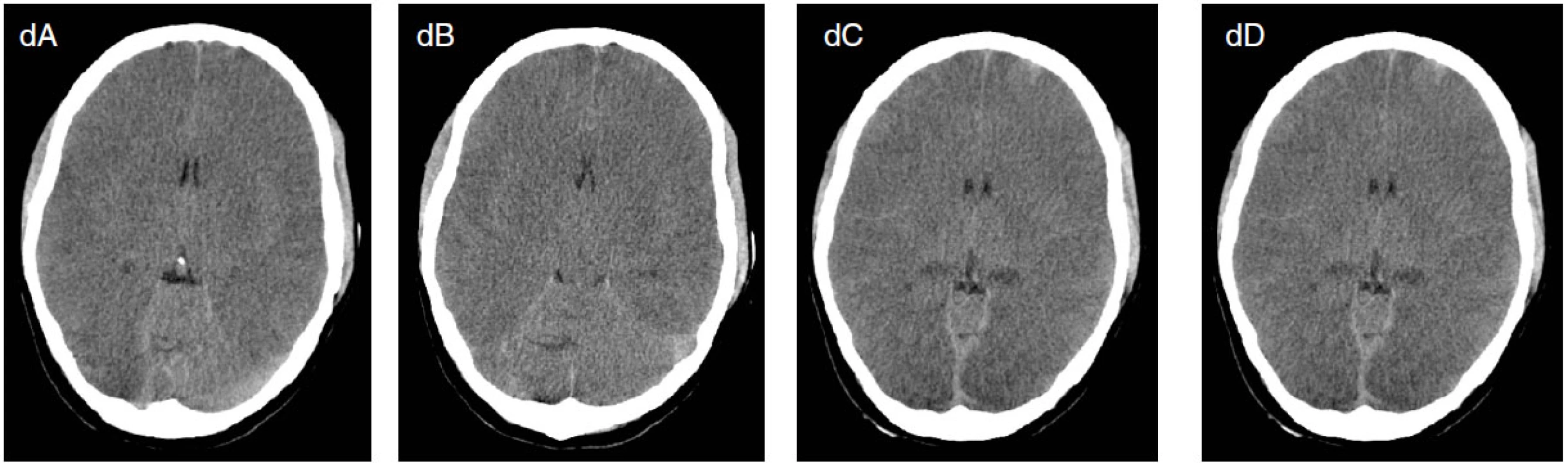
EEG se provádí jako akutní vyšetření („emergency EEG“) nebo jako kontinuální monitorování („continuous EEG“ – cEEG). Akutní EEG je indikováno u všech pacientů s podezřením na NCSE, zejména s nevysvětlenou alterací vědomí. CEEG provádíme k vyloučení NCSE tam, kde se porucha vědomí po léčbě neupravuje nebo navazuje na konvulzivní SE.
U ASE na EEG nacházíme symetrické a synchronní výboje SW nebo PSW komplexů okolo 3 Hz. Graf se normalizuje po i.v. podání BZD. Atypický ASE se na EEG projevuje kontinuálními nebo intermitentními difuzními nepravidelnými pomalými komplexy hrot – vlna nebo polyspike-wave. U pacientů s de novo ASE s pozdním začátkem bývá elektroklinická manifestace různá. Často se mezi generalizovanými výboji hrotů a vln objevují úseky normálního pozadí. CPSE se projevuje ložiskovým iktálním vzorcem s variabilním šířením, eventuálně sekundární generalizací. Zejména u CPSE z frontálního ložiska však může být od počátku přítomen generalizovaný vzorec. Při aura continua bývá EEG často normální.
Elektrografické záchvaty a SE u kriticky nemocných. Záchvaty se objevují asi u 1/5 pacientů ošetřovaných na lůžkách intenzivní péče. Většina z nich je nekonvulzivních, i když jsou často předcházeny záchvaty konvulzivními. Velká většina záchvatů je zachycena během prvních 24 hodin. Zejména tito pacienti jsou indikováni k cEEG, protože téměř v polovině případů dojde k opakování záchvatu v příštích 72 hodinách, což může vést ke komplikacím (např. zvýšení nitrolebního tlaku).
Důvodem zásadních rozdílů mezi elektrografickým iktálním nálezem u nekomatózních a komatózních pacientů je míra encefalopatie, na jejímž základě k záchvatům dochází. Často prokazujeme disociaci klinických a elektrografických záchvatových příznaků, kdy na EEG pozorujeme jasně iktální vzorec, a pacient z nejrůznějších důvodů záchvatovou aktivitu neprojevuje. Nebo se naopak onemocnění jasnými záchvatovými příznaky manifestuje a na EEG není patrná změna oproti mezizáchvatovému grafu. Ještě obtížnější může být popis a interpretace EEG u NCSE. Nacházíme zde: a) iktální vzorce, které se vyvíjejí v amplitudě, frekvenci a/nebo distribuci, b) generalizované výboje hrotů a vln, které se liší od předchozích nálezů, c) periodické vzorce u nemocných v kómatu po prodělaném generalizovaném statu, d) frekventní nebo kontinuální EEG abnormity (hroty, ostré vlny, rytmická pomalá aktivita, PEDs); u pacientů s akutním poškozením mozku, v jejichž předchozím EEG obdobné abnormity nebyly přítomny. Někdy nacházíme i abnormity jiné. Platí, že jestliže klinický obraz naznačuje, že pacient má NCSE, není to na překážku jeho léčbě. Striktní dělení EEG vzorců na interiktální a iktální není totiž v řadě případů NCSE možné.
Výše uvedené nálezy jsou encefalografistům známy. Zmínku zasluhují PEDs. Tvoří je skupina EEG obrazů charakterizovaných pravidelným opakováním komplexů na abnormním pozadí. Tyto vzorce mají často vysokou amplitudu (100 až 300 mV, ale i vyšší) a ostrý tvar, někdy několik fází a komplexní morfologii. Trvání jednotlivých vln může být delší než 150 ms i více. PEDs bývají generalizované nebo lateralizované, EEG křivka mimo ně má obvykle nízkou amplitudu. Signalizují těžké strukturální nebo funkční postižení mozku. Mohou vzniknout při lézích korových, v bílé hmotě i podkorových. Pohlíží se na ně jako na projev nestabilního interiktálně-iktálního kontinua a záchyt záchvatů je u nich velmi častý. Není však jasné nakolik a v jaké klinické situaci je daný vzorec markerem hrozícího nebo již proběhlého sekundárního postižení neuronů.
Příčiny NCSE
NCSE se může vyskytovat jako: 1. akutní symptomatický, 2. v rámci epilepsie, kde může jít a) o první projev, b) o stav v průběhu nemoci podmíněný, a to vlastní aktivitou nemoci, nebo poklesem hladiny AED.
Příčiny SE (7) představují faktor, který významně spolurozhoduje o prognóze. Zejména ve stáří bývá častá multifaktoriální etiologie, např. kombinace infekčních a metabolických příčin s vedlejšími účinky léčby.
Mezi nejčastější příčiny NCSE řadíme: 1. cévní mozkové příhody (CMP), 2. infekce, 3. intrakraniální tumory, 4. kraniocerebrální traumata, 5. SE se vztahem ke konzumaci alkoholu, 6. SE po vysazení či snížení dávek AED, 7. SE se vztahem k hypoxii/anoxii, 8. metabolické poruchy.
Téměř 1/2 SE u dospělých je zapříčiněna akutní nebo anamnestickou CMP. SE se objeví asi u 1 % pacientů po CMP a asi u 8–19 % nemocných, kteří po CMP prodělali symptomatický epileptický záchvat.
Mezi infekcemi způsobujícími SE jsou časté a) bakteriální meningitida, b) virová encefalitida (včetně herpes simplex, lidský herpes virus 6), c) toxoplazmóza mozku, d) tuberkulóza, e) neurocysticerkóza.
Intrakraniální tumory (primární i sekundární, benigní i maligní) jsou příčinou 4–12 % SE u dospělých. Nejčastěji jde o gliomy, často nízkostupňové a s oligodendrogliální složkou.
NCSE může vzniknout po středně těžkých i těžkých kraniocerebrálních úrazech a může zvyšovat nitrolební tlak a poměr laktát/pyruvát v mozku.
SE u alkoholismu představuje 9–25 % SE u dospělých. První SE zde je indikací k přešetření včetně morfologického (např. k vyloučení traumatu). SE často navazuje v rámci abstinenčního syndromu do 6 hodin po izolovaných záchvatech.
Mezi metabolické poruchy, které mohou zapříčinit SE, patří např. hypoglykémie, hyperglykémie, hypokalcémie, jaterní encefalopatie, urémie, hypertenzní encefalopatie a acidóza.
Vzácnější příčiny NCSE (< 1 % pacientů), dělíme na: 1. autoimunitní choroby, 2. mitochondriální nemoci, 3. vzácnější infekce, 4. genetické příčiny, 5. působení toxických látek nebo farmak, 6. jiné vzácné příčiny (např. po elektrokonvulzivní léčbě, jako komplikace řady běžných interních onemocnění atd.) (tab. 1).
Table 1. Méně časté příčiny SE 
Léčba epileptického statu
ASE není spojený s morfologickým a funkčním poškozením mozku. V jeho léčbě většinou vystačíme s BZD.
V animálních experimentech může být NCSE spojen se ztrátou neuronů a negativními kognitívními a behaviorálními důsledky. V humánní medicíně je však obtížné odlišit důsledky základního onemocnění a NCSE. Vzhledem k četným nežádoucím účinkům se léčba medikamentózním kómatem u chodících pacientů nedoporučuje. Může být nasazena v případech NCSE u komatózních pacientů s vědomím, že prognóza je zde velmi závažná. Její použití je však založeno jen na limitovaných experimentálních datech.
Algoritmus péče o nemocného s epileptickým statem (8–10) je součástí českých epileptologických standardů. Zahrnuje tato opatření:
1. Zajistit a stabilizovat vitální funkce, zabránit hypoxii (poloha, oxygenace), základní vyšetření, zajistit žilní přístup, odebrat základní laboratoř včetně plazmatické koncentrace AED a eventuálně toxikologii. U dospělých pacientů při prokázané hypoglykémii podat 50 ml 40% glukózy a 100 mg thiaminu. U dětí glukózu 25–30% v dávce 3–5 mg/kg, udržovací dávka je 0,5–1,0 g/h.
2. Medikamentózní léčba se odvíjí od doby trvání SE v následujících krocích:
- a) 5–10 minut: Diazepam (DZP) dospělým 10–20 mg (0,2 mg/kg/dosi) i. v. během 2 minut. Pokud není žilní přístup, DZP 10 mg rektálně. Alternativně lze dospělým aplikovat midazolam 5–15 mg. Zde však je třeba počítat s kratším poločasem midazolamu, který při tomto dávkování může vést k časnému návratu záchvatů.
- b) 10–30 minut: Fenytoin (PHT) u dospělých 15–20 mg/kg i. v. (u většiny dospělých pacientů celková dávka mezi 1000–2000 mg), rychlost podání 50 mg/min. Pouze prvních 250 mg lze aplikovat rychleji v průběhu 2 minut. Pro děti do 12 let je saturační dávka PHT 20–30 mg/kg i. v. rychlostí 25 mg/min. Neředit glukózou! Během aplikace PHT je nutná monitorace TK a EKG (cave bradyarytmie až zástava). Alternativně lze podat valproát (VPA) v dávce 15–20 mg/kg i. v. (počátečních 800 mg lze aplikovat během 2 minut). Opakovat podání DZP – dávka poloviční nebo stejná jako při předchozím podání.
- c) 30–70 minut: Zahájit EEG monitoraci (pokud SE neustal a pacient se neprobouzí). Phenobarbital (PB) v dávce 20 mg/kg, rychlostí 50 mg/min. Pozn.: Pozor na možnost útlumu dechu a hypotenzi, zejména u pacientů léčených chronicky barbiturátem nebo po opakované aplikaci BZD! Pokud se CPSE stane refrakterním, preferujeme léčbu běžnými AED podanými sondou či i.v. V poslední době se možnosti v tomto směru rozšířily o novější AED pro i.v. použití (VPA, levetiracetam, lacosamid) i pro podání sondou (např. topiramát).
Pokud SE trvá hodinu a déle, může být při NCSE u komatózních nemocných indikované zavedení medikamentózního kómatu. Měli bychom se snažit odlišovat pacienty, u kterých je NCSE příčinou kómatu, od těch, u kterých je těžký klinický stav primární a SE představuje jeho epifenomén. Tyto pacienty ohrožuje příčina SE a komplikace/komorbidity. Agresivní léčba u nich může ještě dále zhoršit prognózu. Diferenciace obou skupin je však v praxi velmi obtížná, musí být založena na zdravé klinické rozvaze a rozhodně není možná pouze na základě semiologie. Většina pacientů se pohybuje mezi těmito dvěma extrémy. V praxi se intenzita léčby řídí multidisciplinárními úvahami o jejích vedlejších účincích a možném prospěchu.
Po zajištění ventilace thiopental jako bolus 100–250 mg i. v., eventuálně dále dávky á 50 mg každé 2–3 minuty do ukončení záchvatu. Následuje kontinuální infuze s thiopentalem obvykle 3–5 mg/kg/h, s monitorací jeho hladin a úpravou dle EEG (dosažení a udržení vzorce burst-suppression). Dávky thiopentalu se snižují postupně, nejdříve za 12 hodin od posledního záchvatu, a to o 1 mg/kg/h každých 6 hodin. Alternativně midazolam – nasycovací dávka 0,15–0,20 mg/kg, poté kontinuálně 0,05–0,30 mg/kg/h s monitorací EEG a přerušením infuze vždy minimálně po 12 hodinách. Alternativně propofol – nasycovací dávka 2–3 mg/kg, poté dávka 5 až 10 mg/kg/h do dosažení vzorce burst/suppression, k jeho udržení později dávka 1–3 mg/kg/h.
U dětí do 3 let se podává DZP v dávce 0,5 mg/kg, u dětí starších 0,3 mg/kg. Při aplikaci rektální se u dětí pod 15 kg tělesné hmotnosti doporučuje dávka DZP 5 mg, nad 15 kg 10 mg pro dosi. Jednorázová maximální dávka DZP u starších dětí zpravidla nepřekračuje 10 mg, celková denní dávka pak 20–40 mg. Jednorázová dávka midazolamu pro děti do 3 let činí 0,15–0,3 mg/kg, pro starší děti 0,1 mg/kg. Midazolam lze v akutní situaci aplikovat i intramuskulárně (0,2–0,3 mg/kg pro dosi), nazálně, bukálně nebo rektálně. Dávkování klonazepamu i. v. představuje přibližně 1/10 dávky DZP, tj. do 3 let věku 0,05 mg/kg, u dětí starších 0,03 mg/kg. PHT se podává u dětí do 12 let v saturační dávce 20–30 mg/kg, rychlost podání se doporučuje pomalejší než u dospělých (25 mg/min). PB v dávce 20 mg/kg, valproát v dávce 25–30 mg/kg. U dětí mladších než 18 měsíců je vhodné aplikovat i pyridoxin v dávce 100–200 mg.
3. Objasnit etiologii SE (včetně vyšetření CT a/nebo likvoru) a léčit kauzálně.
4. Udržet rovnováhu vnitřního prostředí a včas léčit komplikace (hypotenze, arytmie, hypertermie). Antiedematózní terapie. Hospitalizace na JIP nebo ARO oddělení (pracoviště s možností řízené ventilace).
5. K hodnocení účinnosti léčby při SE je nutná EEG monitorace, zejména při léčbě medikamentozním kómatem (křeče mohou vymizet, i když SE podle EEG dále pokračuje).
6. Zabránit recidivě záchvatů (včasné nasazení dlouhodobé perorální terapie, zpočátku do sondy).
Většina odborníků se domnívá, že cílem léčebného kómatu by mělo být dosažení vzorce burst-suppression, že poměr trvání výbojových a supresních úseků by měl být 1 : 1 a že délka trvání kómatu by měla být 24–48 hodin. Vzhledem k liposolubilitě a tendenci ke kumulaci zřejmě není postupné snižování dávkování thiopentalu při vyvádění z kómatu nutné. Indikujeme je u preparátů s kratším poločasem (např. propofol). Časté EEG kontroly či lépe cEEG zde mohou být výraznou pomocí. Léčba ojedinělých/opakovaných elektrografických/klinických záchvatů během vyvádění z kómatu a krátce poté však nemusí zlepšit léčebné výsledky. Ke znovunasazení léčby samozřejmě vede recidiva SE; v ostatních případech je postup individuální.
Zkratky
AED – antiepileptika
ASE – SE typických absencí
BZD – benzodiazepiny
cEEG – kontinuální monitorování EEG
CMP – cévní mozkové příhody
CPSE – komplexní parciální SE
DZP – diazepam
EEG – kontinuální elektroencefalogram
KPCR – kardio-pulmo-cerebrální resuscitace
NCSE – nekonvulzivní status epilepticus
PEDs – periodické epileptiformní výboje
PHT – fenytoin
SE – epileptický status
VPA – valproát
Adresa pro korespondenci:
MUDr. Zdeněk Vojtěch
Neurologické oddělení Nemocnice Na Homolce
Roentgenova 2, 150 30 Praha 5
e-mail: zdenek.vojtech@homolka.cz
Sources
1. Kaplan PW. The clinical features, diagnosis, and prognosis of nonconvulsive status epilepticus. Neurologist 2005; 11 : 348–361.
2. Maganti R, et al. Nonconvulsive status epilepticus. Epilepsy Behav 2008; 12 : 572–586.
3. Meierkord H, Holtkamp M. Non-convulsive status epilepticus in adults: clinical forms and treatment. Lancet Neurol 2007; 6 : 329–339.
4. Bauer G, Trinka E. Nonconvulsive status epilepticus and coma. Epilepsia 2010; 51 : 177–190.
5. Claassen J, et al. Detection of electrographic seizures with continuous EEG monitoring in critically ill patients. Neurology 2004; 62 : 1743–1748.
6. Brenner RP. The interpretation of the EEG in stupor and coma. Neurologist 2005; 11 : 271–284.
7. Tan RY, et al. The uncommon causes of status epilepticus: a systematic review. Epilepsy Res 2010; 91 : 111–122.
8. Kolektiv autorů. Soubor minimálních diagnostických a terapeutických standardů u pacientů s epilepsií. Praha: EpiStop 2010.
9. Meierkord H, et al. EFNS guideline on the management of status epilepticus in adults. Eur J Neurol 2010; 17 : 348–355.
10. Abend NS, et al. Treatment of refractory status epilepticus: literature review and a proposed protocol. Pediatr Neurol 2008; 38 : 377–390.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- Význam radiochirurgie v léčbě mozkových metastáz
- Současná farmakoterapie epilepsie
- Diagnostika sepse
- Nekonvulzivní status epilepticus
- Aplikace moderní mikroneurochirurgie a současných technologií při řešení nádorových a cévních onemocnění mozku
- Karcinom ledviny v éře nastupujících robotických technologií
- Hluboká mozková stimulace u extrapyramidových poruch pohybu – pražská zkušenost
- Antitrombotická terapie po operacích chlopní – současná doporučení a budoucí trendy
- Syndrom časné repolarizace a idiopatická fibrilace komor
- Psychologická péče jako součást interdisciplinární přípravy pacienta k bariatrické operaci
- Minimálně invazivní výkony v cévní chirurgii
- Význam radiochirurgie v léčbě meningiomů
- Temporální epilepsie dospělých a možnosti neurochirurgické léčby: úloha magnetické rezonance
- Pedální bypass a jeho role v záchraně kriticky ischemické končetiny
- Využití vydechovaného oxidu dusnatého v diagnostice astmatu
- Šestileté zkušenosti s operacemi vrozených srdečních vad u dospělých
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Syndrom časné repolarizace a idiopatická fibrilace komor
- Temporální epilepsie dospělých a možnosti neurochirurgické léčby: úloha magnetické rezonance
- Nekonvulzivní status epilepticus
- Využití vydechovaného oxidu dusnatého v diagnostice astmatu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career
















