-
Medical journals
- Career
Antitrombotická terapie po operacích chlopní – současná doporučení a budoucí trendy
Authors: Miroslava Benešová
Authors‘ workplace: Kardiochirurgické oddělení Nemocnice Na Homolce, Praha
Published in: Čas. Lék. čes. 2011; 150: 229-235
Category: Review Article
Overview
V současné době vzhledem k zvyšujícímu se počtu degenerativních chlopenních vad ve stárnoucí populaci stoupají i počty operací chlopní. Každý rok se v současnosti naimplantuje přibližně 300 000 chlopenních protéz a předpoklad je že v roce 2050 se bude nahrazovat přibližně 850 000 chlopní ročně. Po operacích chlopní je zvýšené riziko tromboembolických komplikací, a proto je indikována antikoagulační nebo antiagregační léčba. Výběr preparátů a dávkování závisí na typu provedené operace a na individuálním riziku daného pacienta v dané situaci. V přehledovém článku jsou uvedena jednotlivá schémata léčby vycházející s doporučení kardiologických a kardiochirurgických společností českých, evropských a amerických s upozorněním na výhody a rizika dané léčby.
Klíčová slova:
mechanické chlopenní náhrady, bioprotézy, plastiky chlopní, antikoagulace, antiagregace, warfarin, nefrakcionovaný heparin, nízkomolekulární heparin, kyselina acetylsalicylová, embolie, trombóza.Úvod
Onemocnění srdečních chlopní postihuje více než 100 milionů lidí na celém světě a je stále rostoucím problémem vzhledem k zvyšujícímu se počtu degenerativních chlopenních vad ve stárnoucí populaci. Během posledních 50 let bylo celosvětově naimplantováno kolem 4 milionů chlopenních protéz, každý rok se v současnosti naimplantuje přibližně 300 000 chlopenních protéz a předpoklad je že v roce 2050 se bude nahrazovat přibližně 850 000 chlopní ročně.
Nejčastěji se chlopně nahrazují umělými protézami mechanickými nebo biologickými, dále homografty, autografty. V posledních letech se čím dále více upřednostňují plastiky chlopní. Mechanické protézy mají výhodu, že jsou trvanlivější, jejich nevýhodou je, že jsou více trombogenní. Biologické protézy mají ve srovnání s mechanickými protézami fyziologičtější průtok krve a nevyžadují antikoagulaci. Jejich nevýhodou je, že podléhají degeneraci. V poslední době díky novým technologiím mají bioprotézy delší životnost a jsou odolnější ke strukturální deterioraci. Ve větší míře než dříve jsou implantovány stále mladším pacientům. Homografty jsou preparáty z lidské tkáně, jsou odolnější vůči infekcím, nevyžadují antikoagulaci, nicméně opět mají omezenou životnost a po 10–20 letech podléhají degeneraci. Autografty se používají u Rossovy operace, kdy aortální chlopeň je nahrazena vlastní pulmonální chlopní a do pulmonální pozice je implantován homograft (obr. 1, 2).
Image 1. Příklady mechanických protéz a – Starr-Edwards caged-ball, b – Bjork-Shiley tilting disc, c – Medtronic Hall tilting disc, d – Medtronic Hall tilting disc 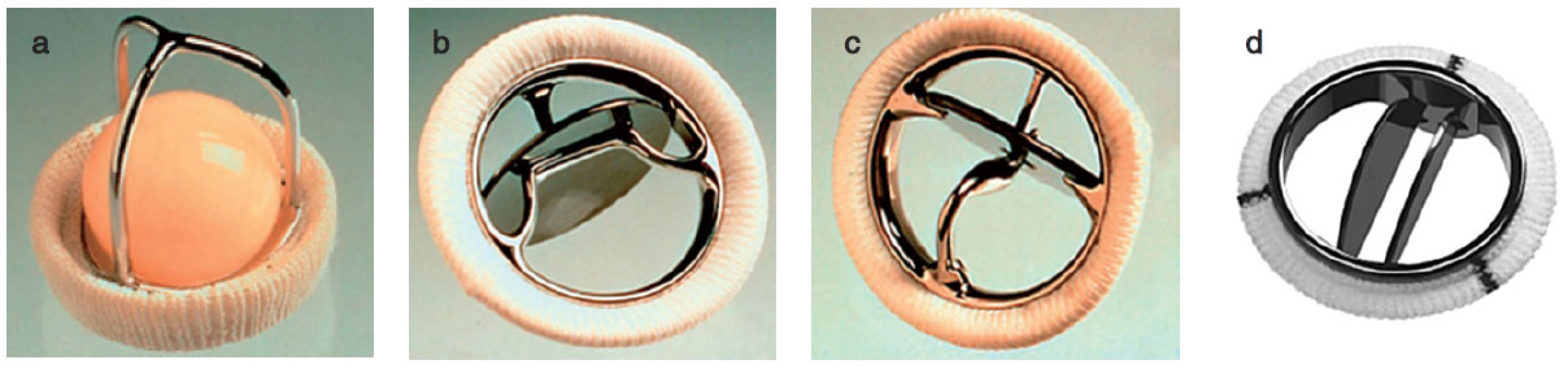
Image 2. Příklady biologických protéz a – Medtronic HK II ultra porcine, b – Medtronic Freestyle porcine, c – Carpentier-Edward Perimount bovine, d – Edwards Sapien transcatheter 
Po všech srdečních operacích je indikována antitrombotická léčba (antikoagulační nebo antiagregační), která se liší v délce a dávkování podle individuálního rizika tromboembolie a rizika krvácení pro daného pacienta (1). Doporučená schémata pro antitrombotickou léčbu po operacích chlopní byla publikována v Doporučených postupech pro diagnostiku a léčbu chlopenních srdečních vad v dospělosti (Česká kardiologická společnost 2007) (2). Vycházejí z doporučení Evropské kardiologické společnosti (Guidelines on the management of valvular heart disease – ESC 2007) (3) a Americké kardiologické společnosti (Guidelines for management of patients with valvular heart disease – ACC/AHA 2006) (4). Další doporučení byla publikována Evropskou společností srdečních a hrudních chirurgů (Guidelines on antiplatelet and anticoagulation management in cardiac surgery – EACTS 2008) (5) a Americkou společností hrudních lékařů (Antithrombotic Therapy in Valvular Heart Disease – Native and Prosthetic – ACCP 2004) (6). V zásadních principech jsou doporučné postupy shodné, nicméně existuje několik oblastí, ve kterých se evropská a americká doporučení liší. Je to proto, že všechna doporučení jsou založena převážně na retrospektivních a observačních studiích, protože randomizované prospektivní studie chybí.
Pro volbu správného schématu antitrombotické léčby pro daného pacienta je nutné stanovit individuální riziko tromboembolie, které závisí na tom, zda byla pacientovi provedena plastika chlopně nebo náhrada chlopně, jaký typ protézy byl zvolen a jaký je časový odstup od operace.
U chlopenních náhrad závisí riziko tromboembolie na typu náhrady (homograft, autograft, mechanická protéza, bioprotéza). Dalším kritériem pro stanovení rizika je pozice, v jaké je náhrada implantována (aortální, mitrální, trikuspidální, pulmonální). Aby byla antitrombotická léčba komplexní a co nejúčinnější, musí zohledňovat další rizikové faktory tromboembolie pro daného pacienta. Vyšší riziko tromboembolie je spojené s pomalým krevním tokem v srdečních oddílech (fibrilace síní, dilatace levé síně > 50 mm, snížená funkce levé komory s ejekční frakcí < 35 %, funkční třída NYHA IV), dále je vyšší riziko u onemocnění tepen nebo u endoteliální dysfunkce (systémová hypertenze, diabetes mellitus, aortická a/nebo karotická ateromatóza) a stavy spojené se zvýšenou koagulací a/nebo agregací destiček (diabetes mellitus, kouření, hyperlipidémie, chronický zánět/infekce, chronická hemolýza, hyperkoagulační stavy, maligní onemocnění) (tab. 1).
Table 1. Rizikové faktory tromboembolie 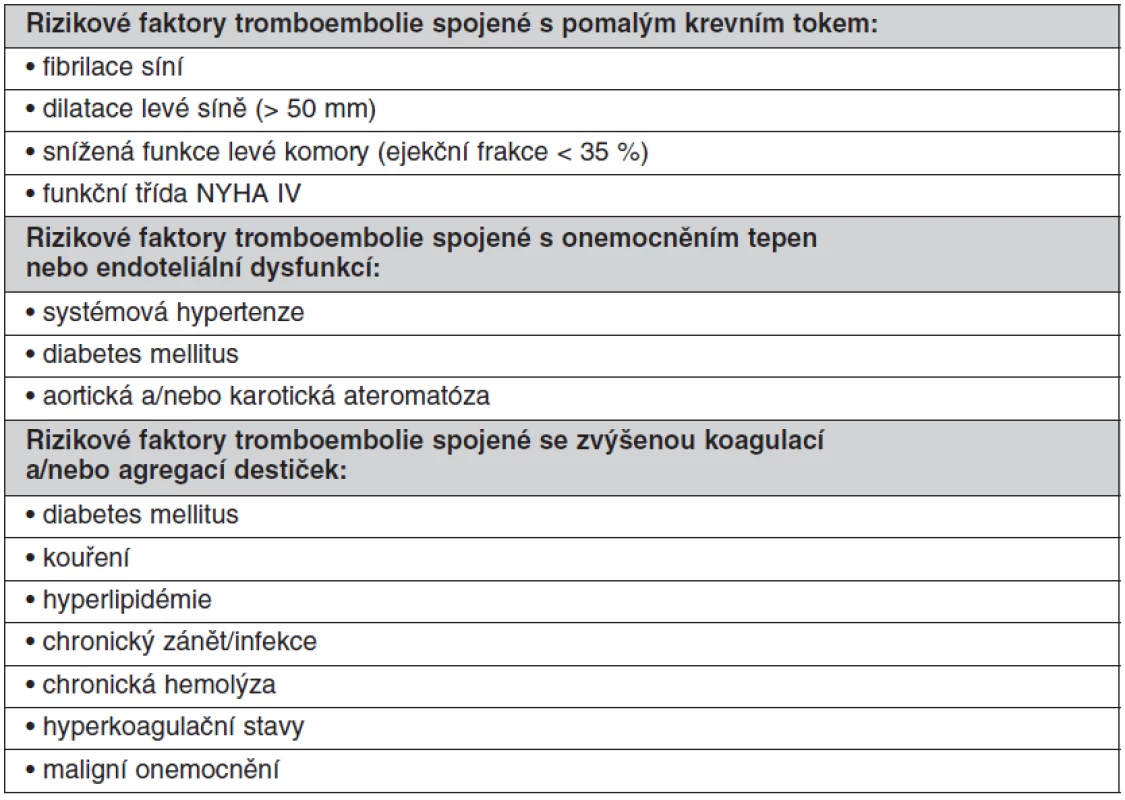
Trombogenicita jednotlivých protéz závisí na konstrukčním typu, použitých materiálech a proudění krve přes náhradu. Všechny mechanické chlopenní protézy mají abnormální průtok krve. Téměř všechny chlopenní protézy jsou stentované, a tudíž mají menší efektivní ústí než nativní chlopeň, a proto vzniká na protéze průtokový gradient. Konstrukce zavíracího mechanismu chlopně způsobuje, že jsou přítomny zóny s pomalejším průtokem a stagnací krve s tendencí k agregaci destiček a naopak zóny s velmi urychleným tokem, který působí aktivaci destiček. Dále dochází k aktivaci hemostázy poškozením cévních stěn během operace a dále při expozici umělých povrchů (šicí prstence, stehy, kostra chlopně, zavírací mechanismy) cirkulující krvi.
Bioprotézy jsou méně trombogenní než mechanické protézy, nicméně rovněž se na nich mohou tvořit tromby, ať již na šicím prstenci, nebo cípech, a to zvláště první měsíce po operaci. Trombus se může vytvořit i na bezstentové bioprotéze. Častější je výskyt trombózy v mitrální pozici. Faktory, které ke vzniku trombóz přispívají, jsou nízký srdeční výdej a zachovalé šlašinky mitrální chlopně.
Vhojování šicího prstence protézy ať již mechanické či biologické začíná pokrytím prstence tenkou vrstvou trombu, který se postupně organizuje. Fibroblasty migrují do trombu a vytvářejí kolagen. Tenká vrstva kolagenu je postupně překryta endotelem. Proces endotelizace šicích prstenců a stentů chlopenních protéz probíhá přibližně po dobu 3 měsíců po operaci. V tomto období je riziko tromboembolie nejvyšší a po této době klesá. Tloušťka nové tkáně pokrývající šicí prstenec závisí na původní tloušťce trombu a může být minimalizována antikoagulací. Excesivní přerůstání tkáně přes šicí prstenec známé jako pannus může poškodit chlopeň jak mechanickou, tak biologickou (7).
Antikoagulační a antiagregační léčba
V současnosti jsou z perorálních antikoagulancií dostupné pouze antagonisté vitaminu K. Jejich velmi úzké terapeutické rozpětí, nepředvídatelná biologická odpověď a řada interakcí s léky a potravinami limituje jejich klinické využití a vyžaduje přesnou monitoraci INR. Nedostatečný antikoagulační efekt může zapříčinit trombózu chlopně, zatímco předávkování je spojeno se zvýšeným rizikem krvácivých komplikací. I při správném dávkování je riziko krvácení 2–4% a musí být vyváženo snížením rizika tromboembolie.
Perorální antikoagulace warfarinem je doporučena v těchto situacích:
- Doživotně pro všechny pacienty s mechanickými chlopněmi bez ohledu na typ protézy a dobu implantace.
- Doživotně pro pacienty s bioprotézami nebo po plastikách chlopní, implantaci homograftů, autograftů v případě, že mají jinou indikaci pro antikoagulaci, např. fibrilaci síní, srdeční selhání nebo dysfunkci levé komory (ejekční frakce < 30 %).
- První 2–3 měsíce po operaci pro všechny pacienty s biologickou protézou v mitrální pozici nebo po plastice mitrální chlopně s použitím anuloplastického prstence. Pro aortální bioprotézy není doporučení jednoznačné. Evropská kardiologická společnost doporučuje po dobu 3 měsíců antikoagulaci warfarinem, zatímco Americká kardiologická společnost doporučuje pouze antiagregační terapii (8). Podle doporučení ČKS je možné použít obě schémata léčby. V současné době probíhají studie ACTION, ANSWER, jejichž cílem je prokázat, že ASA v nízké dávce je adekvátní alternativou k warfarinu první 3 měsíce po operaci u aortálních bioprotéz (9).
- Prvních 6 měsíců po operaci po provedení MAZE procedury (peroperační chirurgická ablace fibrilace síní buď radiofrekvenční, nebo kryo) a léčba se prodlužuje déle, pokud není stabilní setrvalý sinusový rytmus prokázaný opakovanou holterovskou monitorací nebo výpisem z implantabilního rekordéru zaznamenávajícího arytmie (Reveal).
Pacienti s bioprotézami nebo po plastikách mitrální chlopně, kteří nejsou antikoagulovaní, mají být pečlivě sledováni nejenom pro zjištění eventuální degenerace chlopně, ale též pro časné zjištění vzniku fibrilace síní.
Úvodní režim antikoagulace ihned po operaci není podložen žádnými randomizovanými studiemi, a je tudíž poměrně variabilní. Na základě observačních studií, které prokázaly nejvíce tromboembolických příhod velmi časně po operaci, je doporučováno zahájit léčbu perorálními antikoagulancii co nejdříve, pokud pomine riziko krvácení (10). Nejčastěji se terapie warfarinem zahajuje 6–24 hodin po operaci, a současně se aplikuje nízkomolekulární nebo nefrakcionovaný heparin. Dávkování heparinu je třeba pečlivě monitorovat. Dávkování nefrakcionovaného heparinu se řídí podle APTT (rozmezí 1,5–2,0, nebo 55–70 s). Nízkomolekulární heparin se doporučuje podávat v plné terapeutické dávce podle váhy, což je relativně bezpečné do BMI 30,0. Opatrnosti je třeba při podávání nízkomolekulárního heparinu obézním pacientům a pacientům s renální insuficiencí, u kterých je dávkování velmi obtížné pro možnost kumulativního účinku a riziko krvácení. Proto se doporučuje monitorování dávek nízkomolekulárního heparinu podle hladiny antifaktoru Xa (0,7–1,2 j/ml odebrané 4–6 hodin po aplikaci ranní dávky). Heparin se vysazuje po dosažení cílové hladiny INR, v případě, že je tato hladina stabilní alespoň po dobu 2 dnů.
Výběr optimálního cílového INR musí zahrnovat pacientovy rizikové faktory a trombogenicitu dané protézy, která je uváděna jako četnost tromboembolických příhod pro danou protézu a dané INR. U nových typů protéz chybí v literatuře dostatek údajů, které by dokládaly trombogenicitu pro danou protézu při daném INR. Konvenční kategorizace mechanických protéz se opět rozchází mezi evropskými a americkými doporučeními. Americká doporučení zařazují všechny dvoulisté protézy a Medtronic Hall tilting disc (jednolistá protéza) mezi chlopně s nízkým rizikem tromboembolie, mezi protézy se středním rizikem zařazuje všechny jednolisté chlopně kromě Medtronic Hall a s vysokým rizikem všechny kuličkové chlopně. Evropská doporučení kategorizují jednotlivé protézy individuálně (tab. 2). V amerických guidelines ACC/AHA z roku 2008 je doporučována kombinace nízké dávky kyseliny acetylsalicylové (75–100 mg) a warfarinu u všech antikoagulovaných nemocných s mechanickou chlopenní náhradou. Tato kombinace sníží riziko tromboembolických komplikací a celkovou mortalitu, nicméně výrazně stoupá riziko významných krvácivých komplikací. Proto v evropských i českých doporučení je kombinace warfarinu a ASA doporučena pouze cíleně u pacientů se zvýšeným rizikem tromboembolie. Doporučené hodnoty INR pro chlopenní protézy jsou uvedeny v tabulce 3.
Table 2. Kategorie chlopenních protéz podle trombogenicity 
Table 3. Doporučené hodnoty INR pro chlopenní protézy 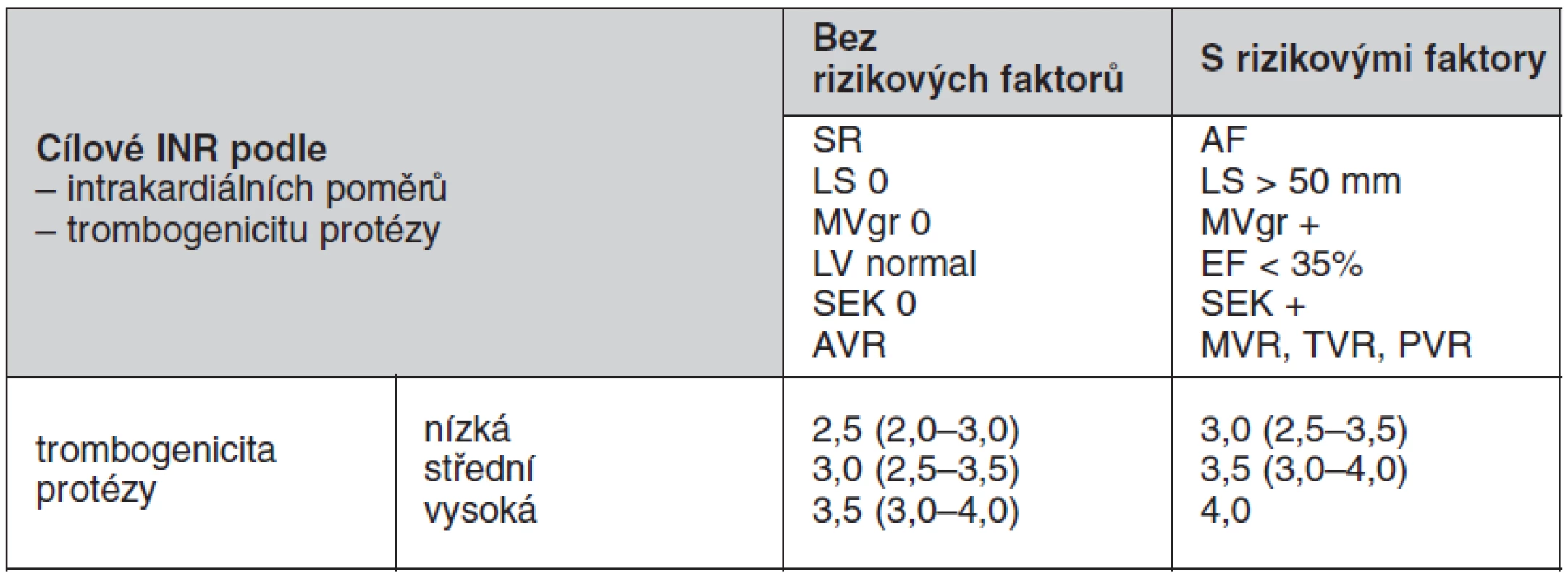
nízká = Medtronic Hall,St.Jude Medical (bez silzonu), Carbomedics AVR, bioprotézy střední = dvoulisté chlopně bez dostatečných údajů trombogenicity, BjorkShiley vysoká = Lillehey Kaster, Omniscience, Starr Edwards SR – sinusový rytmus, LS – levá síň, MVgr – gradient na mitrální chlopni, EF – ejekční frakce, SEK – spontánní echokontrast, AVR – aortální náhrada, MVR – mitrální náhrada, TVR – trikuspidální náhrada, PVR – pulmonální náhrada V individuálních případech, kdy se u pacienta opakuje krvácení z patologického zdroje, který není možné odstranit, má být doporučená cílová hodnota INR revidována a snížena.
Antiagregační léčbu kyselinou acetylsalicylovou (ASA)je doporučeno podávat doživotně po ukončení léčby warfarinem v těchto indikacích:
- a) aortální bioprotéza v případě, že byla podávána antikoagulace časně po operaci,
- b) mitrální, trikuspidální, pulmonální bioprotézy,
- c) mitrální plastika,
- d) MAZE procedura.
Antiagregační léčba kyselinou acetylsalicylovou časně po operaci bez předchozí terapie warfarinem je doporučena v těchto indikacích:
- a) bioprotézy v aortální pozici (v případě že nezvolíme úvodní časnou léčbu warfarinem),
- b) homografty v pulmonální pozici po dobu 6–8 týdnů,
- c) homografty (allografty) v aortální pozici po dobu 6–8 týdnů po operaci, variantou je podat pouze heparin v prvních pooperačních dnech a antiagregaci ani antikoagulaci nepodávat pokud pro ni neexistují jiné důvody,
- d) záchovné operace aortální chlopně.
Léčba kyselinou acetylsalicylovou se zahajuje nejčastěji první pooperační den, pokud není riziko pooperačního krvácení. Stejně jako u warfarinu se zároveň podává heparin nefrakcionovaný nebo nízkomolekulární k prevenci tromboembolických příhod, které jsou nejčastější v prvních 10 dnech po operaci a jsou způsobeny prokoagulačními stavy způsobenými samotnou operací. Heparin současně s ASA se podává pouze krátkodobě, tj. 5–7 dnů (tab. 4).
Table 4. Antitrombotická léčba po operaci chlopně 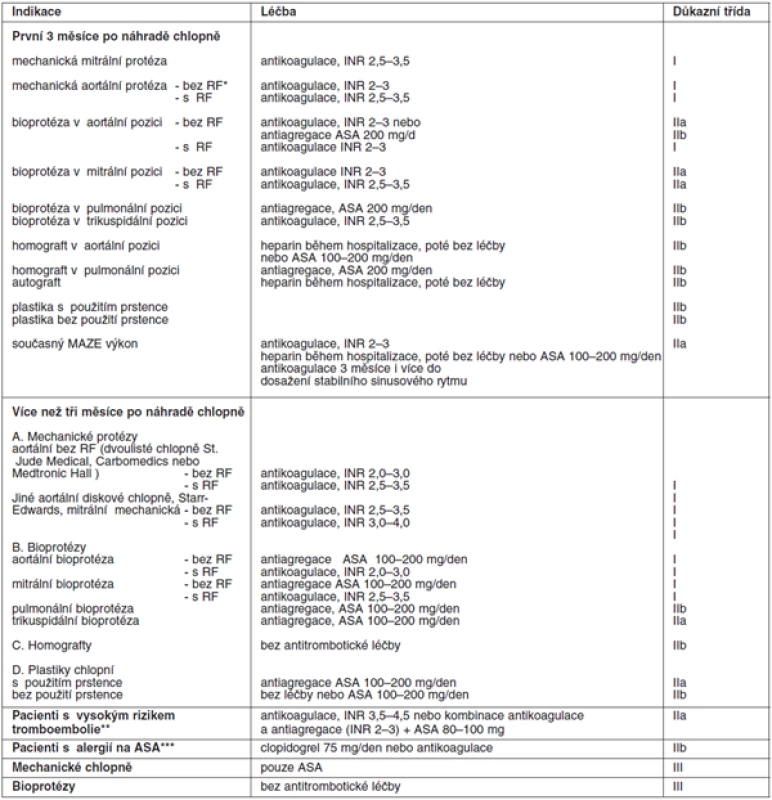
*RF – rizikové faktory: fibrilace síní, významná dysfunkce levé komory, tromboembolie v anamnéze, hyperkoagulační stavy, velká dilatace levé síně, spontánní echokontrast v levé síni, mitrální stenóza ** – výskyt tromboembolie při účinné antikoagulační léčbě nebo nejde-li udržet INR v doporučeném terapeutickém rozmezí, trikuspidální nebo pulmonální mechanická protéza Důkazní třída I: existuje jasný průkaz a/nebo obecný konsenzus, že zvolený postup je užitečný a účinný; Důkazní třída II: není jasný průkaz a/nebo jsou rozdílné názory na užitečnost a účinnost daného postupu; Důkazní třída IIa: není jasný průkaz, ale je obecný konsenzus s daným postupem; Důkazní třída IIb: užitečnost léčby je méně podpořena důkazy a obecně přijímaným názorem; Důkazní třída III: jsou důkazy a/nebo obecná shoda, že léčba není užitečná a v některých případech může být škodlivá. Pacient musí být o antikoagulační léčbě podrobně poučen, aby znal důležitost pravidelných kontrol INR, měl by znát své doporučené rozmezí INR, zásady navyšování a snižování dávkování warfarinu. Důležité je, aby znal dietní opatření, rizika interakce s jinými léky, potravinami a aby znal rizikové stavy, při kterých může dojít ke kolísání INR. Musí znát příznaky krvácení, při kterých musí neprodleně navštívit lékaře. Případná nespolupráce pacienta by měla být zohledněna při indikaci srdeční chlopně k náhradě a při výběru protézy.
Tromboembolické příhody při adekvátní doporučené léčbě
I při doporučeném dávkovacím schématu se mohou vyskytnout tromboembolické příhody. Evropská a americká doporučení se opět liší v léčbě této komplikace. Podle amerických doporučení se navyšuje dávka warfarinu na cílové INR o jednu jednotku vyšší, než bylo původně doporučené, nebo se přidává malá dávka kyseliny acetylsalicylové (75–100 mg) k dosud podávané dávce warfarinu. Evropská doporučení se více zabývají příčinou tromboembolických příhod a možností ovlivnění této příčiny.
Nejčastějším zdrojem embolizace bývá samotná protéza, ale jsou možné i jiné zdroje, které je nutné vyloučit, např. trombus v levé síni, v levé komoře, aterom aorty, stenóza karotid. Relativními indikacemi pro přidání ASA k warfarinu jsou: arteriální nemoc, zvláště koronární nemoc a opakované systémové embolizace po podrobném vyšetření zdroje, nemožnosti ovlivnit rizikové faktory a po optimalizaci kontrol INR. Doporučuje se přidat malou dávku ASA k nižším dávkám warfarinu (≤ 3,0).
Pokud je zdrojem embolizace samotná protéza, je nutné definovat mechanismus trombózy odpovědný za embolizace. Je nutné diagnostikovat a lokalizovat trombus, zda je přítomný na šicím prstenci díky nekompletnímu vhojení nebo na jiném místě protézy a zda nebrání pohybu lístků protézy. Mírnou restrikci pohybu lístků lze jen velmi obtížně rozlišit pomocí echokardiografie, a proto je nutné doplnit fluoroskopii. U protéz v mitrální pozici se malé tromby mohou rozpustit po podání intravenózního heparinu a/nebo intenzivnější antikoagulaci s vyššími hodnotami INR. Významná obstruktivní trombóza protézy vyžaduje téměř vždy reoperaci. Při degeneraci bioprotézy mohou být ztluštělé a kalcifikované cípy místem pro ukládání trombů. Dalším zdrojem embolizace může být endokarditida. V mnoha případech se zdroj embolizace nepodaří prokázat buď proto, že trombus již embolizoval celý, nebo jeho zbytky zůstávají pod rozlišovací schopností echokardiografie.
Vedle rizikových faktorů jako je samotná protéza, diabetes mellitus, dysfunkce levé komory existují ještě tzv. trigrující neboli spouštěcí faktory tromboembolie, které se mohou objevit v podstatě ze dne na den. Jsou to například dehydratace se zvýšenou viskozitou plazmy, plicní infekce s řadou protrombotických mechanismů, náhlý výskyt fibrilace síní, pokles INR na subterapeutické hodnoty. Léčbou rizikových a/nebo trigrujících faktorů v rámci prevence tromboembolie se můžeme vyhnout nutnosti navyšovat antikoagulaci, a tím zvýšenému riziku krvácení.
Warfarin je nepřímé a nedokonalé antikoagulans s úzkým terapeutickým rozpětím a řadou potravinových a lékových interakcí. Standardizace antikoagulace pomocí stanovení INR je velkým přínosem, přesto měření INR stejného vzorku krve se může v závislosti na laboratoři odlišovat až o 0,5. Nedokonalá suprese faktoru VII i při terapeutických hladinách INR byla prokázána jako další fakor tromboembolie po mitrálních náhradách. Proto by měl být faktor VII vyšetřen před prostým navýšením antikoagulace. Kolísání INR během léčby je dalším významným faktorem ať již trombózy, nebo krvácení. Zlepšení kontroly INR může být často větším přínosem pro pacienta než prosté navýšení dávek warfarinu. Nejlepší kontrola INR, a tím i nejnižší četnost tromboembolických i krvácivých komplikací byla dokumentována u selfmonitoringu (11).
Warfarin společně s duální antiagregací může být nevyhnutelný po plastikách koronárních tepen s implantací koronárních stentů, nicméně riziko krvácení je vyšší. Proto se doporučuje neimplantovat drug eluting stenty u mechanických protéz, aby bylo možné zkrátit dobu podávání trojnásobné antikoagulace na co nejkratší dobu. Relativní kontraindikací přidání kyseliny acetylosalicylové k warfarinu je u osob s anamnézou krvácení do gastrointestinálního traktu, špatně korigovanou hypertenzí na kombinované terapii, u pacientů, kteří jsou často léčeni antibiotiky, u pacientů se špatně kontrolovaným INR. V těchto situacích se vyskytuje časté kolísání INR a bylo prokázáno, že časté epizody vysokého INR výrazně zvyšují riziko krvácení při kombinované terapii s ASA. Evropská doporučení nabádají k velké obezřetnosti při přidávání ASA k adekvátní léčbě warfarinem, protože je vždy spojeno s vyšším rizikem závažného krvácení, a je tudíž třeba vybalancovat přínos a riziko pro daného pacienta individuálně.
Pokud je zvýšené riziko tromboembolie, které nelze jinak eliminovat, pak je doporučeno zvýšit dávky antitrombotické terapie, pokud je tento postup klinicky bezpečný:
- warfarin, INR 2–3: zvýšit dávku warfarinu na cílové INR 2,5–3,5;
- warfarin, INR 2,5–3: zvýšit dávku warfarinu na cílové INR 3,5–4,5;
- warfarin bez ASA: přidat kyselinu acetylsalicylovou v dávce 75–100 mg ke stávající terapii;
- warfarin + ASA 75–100 mg: dávka ASA může být navýšena až na 325 mg v případě, zvýšení dávky warfarinu nemá kýžený klinický efekt;
- pouze ASA 75–100 mg: zvýšit dávku ASA až na 325 mg přidat clopidrogel 75 mg a/nebo přidat warfarin.
Excesivní antikoagulace a krvácení
U většiny pacientů s INR nad terapeutickým rozmezím postačí vynechat warfarin a monitorovat hladinu antikoagulace pomocí častých, nejlépe každodenních odběrů INR. Excesivní antikoagulace (INR > 5) velmi výrazně zvyšuje riziko krvácení. Na druhou stranu rychlý pokles INR, který vede až k poklesu INR pod terapeutické rozmezí, zvyšuje riziko tromboembolie. Pacienti s INR > 6 mají být hospitalizováni, léčba warfarinem přerušena a INR má poklesat pomalu. Pokud je INR vyšší než 10, doporučuje se podat čerstvě mraženou plazmu.
Pacienti s chlopenními protézami s INR 5–10, kteří nemají známky krvácení, mohou být léčeni vysazením warfarinu a podáním perorálního vitaminu K v dávce 1–2,5 mg. INR musí být provedeno za 24 hodin a následně dle potřeby, nejlépe denně. Po poklesu INR do terapeutického rozmezí se pokračuje v terapii warfarinem a dávky jsou adekvátně upravovány tak, aby byla jistota, že INR je v terapeutickém rozmezí.
Krvácení při INR v terapeutickém rozmezí má většinou jinou patologickou příčinu, kterou je třeba rozpoznat a léčit.
V emergentních situacích se podává mražená plazma. Pokud je pacient v ohrožení života při pokračujícím krvácení a nemožnosti lokálního ošetření (např. intrakraniální krvácení), podává se současně s vysazením warfarinu protrombinový komplex a intravenózní vitamin K. Obojí, tj. koncentráty koagulačních faktorů i vyšší dávky vitaminu K i.v., zvyšuje riziko chlopenní trombózy, protože stoupá riziko překorigování do hyperkoagulačního stavu. Malá dávka vitaminu K (1 mg) podaného i.v. je v této indikaci bezpečná.
Překlenovací terapie při nutnosti přerušení terapie warfarinem pro nekardiální operace, invazivní procedury nebo dentální ošetření
Přechodné přerušení antikoagulační terapie kvůli jiné operaci je častou příčinou prostetické trombózy, která se klinicky nemusí manifestovat po dobu několika týdnů po přerušení. Riziko je však vyšší u operací pro nádor a infekci, při přítomnosti hyperkoagulačních stavů, u protéz s vyšším rizikem tromboembolie, u všech protéz v mitrální pozici, při přítomnosti nitrosrdečních protrombogenních podmínek, jako je fibrilace síní, dilatace levé síně nebo zhoršená funkce levé komory. Pro stanovení rizika tromboembolie je možné použít stejných parametrů jako pro stanovení optimální hladiny INR (viz tab. 1, tab. 5).
Table 5. Tromboembolický rizikový profil pacienta podstupující operaci, biopsii, perkutánní vaskulární procedury, biopsie, dentální chirurgické zákroky 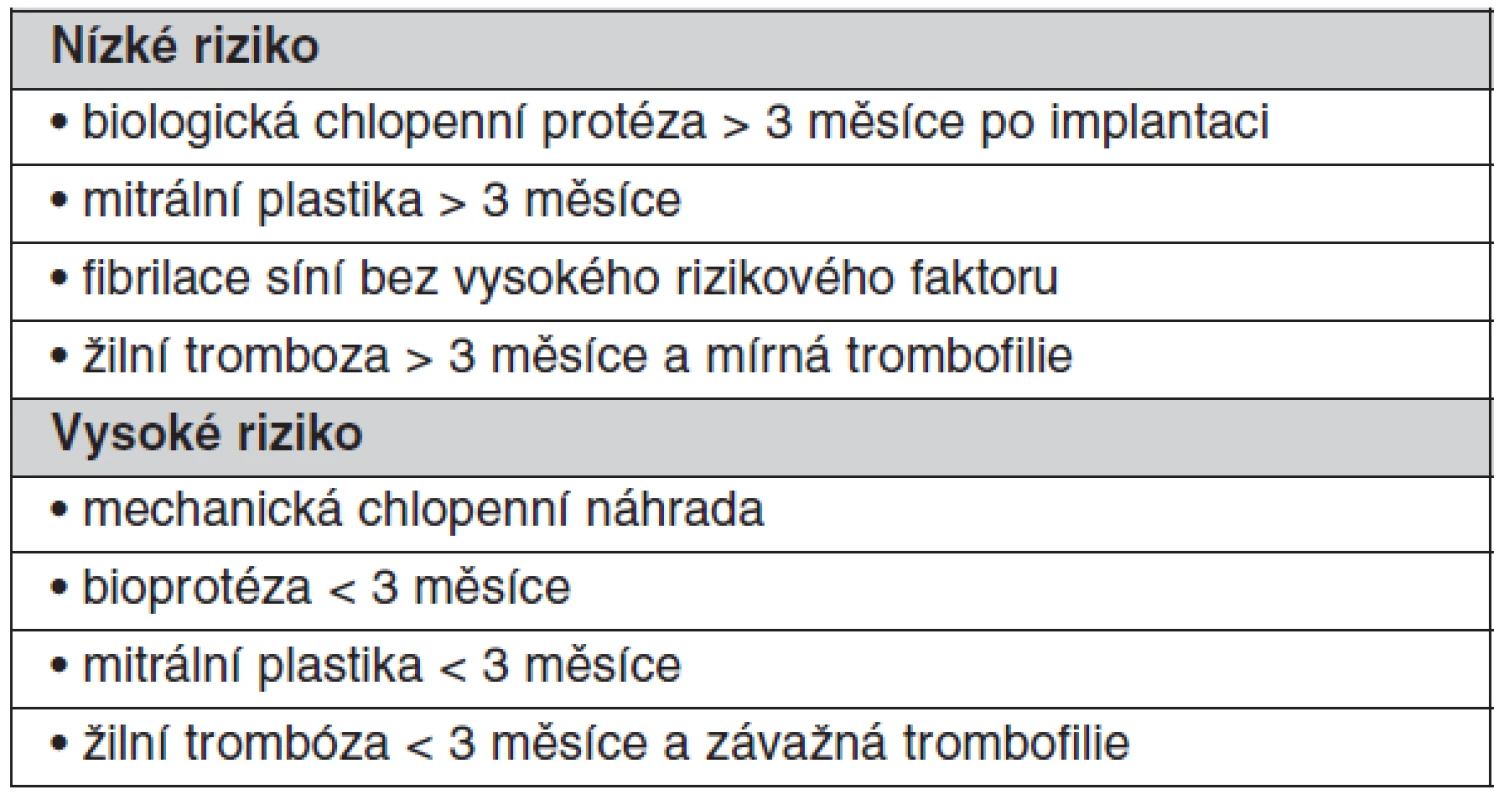
Při vysokém riziku trombózy a u všech mechanických protéz má být zahájena léčba intravenózním heparinem, když INR klesne pod 2,0 a má se podávat až do doby 5–6 hodin před výkonem a znovu nasadit co nejdříve po výkonu a pokračovat dokud INR nedosáhne terapeutického rozmezí. U mnoha menších procedur, kde je možné krvácení snadno kontrolovat včetně dentálních procedur, není přerušení antikoagulační terapie nutné. Překlenující terapie nízkomolekulárním heparinem v terapeutických dávkách se jeví jako bezpečná, jednoduchá a levnější než nefrakcionovaným heparinem, nicméně pokud je pacient v kritickém stavu, kdy hrozí urgentní chirurgický zákrok, je upřednostňován nefrakcionovaný heparin kontinuálně podávaný intravaskulárně za častých kontrol APTT či ACT (po 4 hod.). U procedur s nízkým rizikem krvácení není nutné antikoagulační terapii přerušit (tab. 6).
Table 6. Kategorie procedur podle rizika krvácení 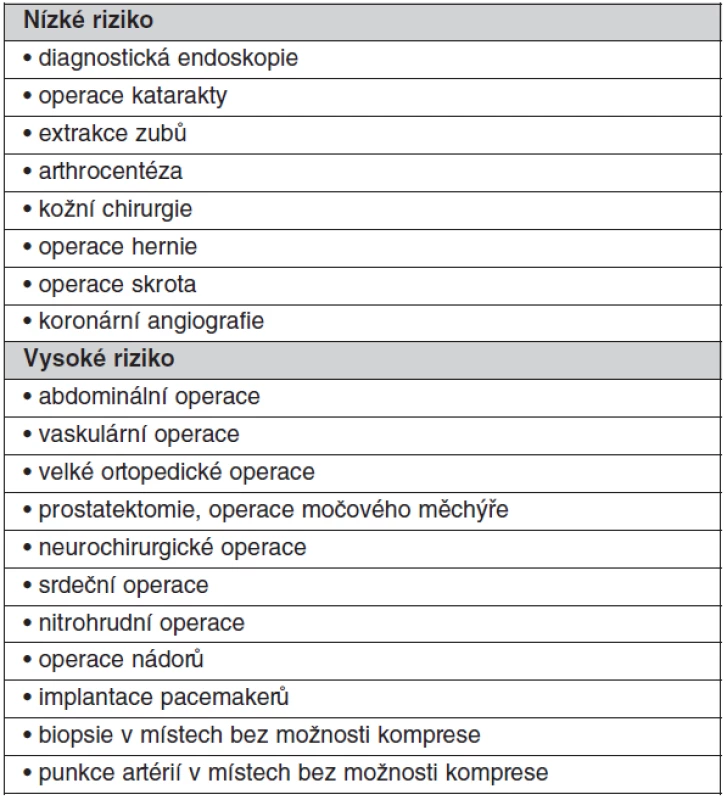
Trombóza chlopenních náhrad
Trombóza chlopenní náhrady se může vyskytnout u jakékoliv náhrady, ať již mechanické nebo biologické, může se vyskytnout i u bezstenotvé bioprotézy i u aortálního homograftu. Podezření na obstruktivní trombózu protézy musíme mít vždy, když se objeví nová dušnost nebo embolické příhoda. Podezření je vyšší, byla-li recentně antikoagulace neadekvátní anebo vznikla další příčina zvýšené koagulace (např. dehydratace, infekce apod.). Diagnóza chlopenní trombózy má být ověřena pomocí transtorakální echokardiografie a/nebo transezofageální echokardiografie nebo fluoroskopie. Jakákoliv trombóza protézy a její řešení je velmi rizikové. V úvahu připadá buď chirurgické řešení, nebo trombolýza. Chirurgické řešení je rizikové proto, že se většinou jedná a emergentní situaci a vždy se jedná o reoperaci. Fibrinolýza je naopak spojena s rizikem krvácení, systémové embolie a rekurentní trombózou. Analýza rizika a přínosu trombolýzy musí být provedena na základě komplexního zhodnocení stavu pacienta individuálně s přihlédnutím na lokální možnosti léčby.
Urgentní nebo emergentní náhrada chlopně je metodou volby při obstruktivní trombóze chlopenní náhrady u pacientů v kritickém stavu bez vážných komorbidit. Pokud trombogenicita protézy byla hlavním faktorem trombózy, má být nahrazena méně trombogenní náhradou.
Fibrinolýza má být zvážena u pacientů kriticky nemocných, kteří mají minimální šanci přežít operaci z důvodu komorbidit nebo špatné srdeční funkci, která byla přítomna dříve, než se vyvinula trombóza.
Fibrinolýza má být dále zvážena u pacientů, kde není rychle dostupná chirurgická léčba a transport na kardiochirurgické oddělení není možný nebo je velmi obtížný.
Fibrinolýza má být dále zvážena u trombózy trikuspidální a pulmonální náhrady, protože v této pozici bývá úspěšnější a riziko embolie je menší. Fibrinolýza má menší naději na úspěch u chlopní v mitrální pozici, u chronické trombózy, při přítomnosti pannu, který může být obtížně odlišitelný od trombu na echokardiografii (12).
Diagnóza neobstruktivní prostetické trombózy je stanovena na základě jícnové echokardiografie provedené po embolické příhodě nebo při vyšetření v rámci systematického sledování pacientů po náhradách chlopní. Léčba závisí hlavně na tom, zda se manifestovala embolická příhoda a na velikosti a morfologii trombu. Nevyhnutelné je pečlivé echokardiografické sledování a/nebo sledování pomocí fluoroskopie. Prognóza je příznivá u malých trombů do 10 mm, léčených medikamentózně. Chirurgická léčba ani fibrinolýza nejsou nutné, pokud je odpověď na zintenzivněnou medikamentózní antitrombotickou léčbu příznivá s postupným rozpouštěním trombu.
Chirurgická léčba je doporučena u trombů velikosti ≥ 10 mm, u neobstruktivní trombózy komplikované embolizací nebo pokud trombus přetrvává navzdory optimální antikoagulační terapii.
Fibrinolýza může být zvážena u neobstruktivní trombózy jako alternativa k operaci u vysoce rizikových pacientů. Protože však výrazně zvyšuje riziko krvácení a tromboembolie, její použití v této indikaci by mělo být zcela výjimečné.
Riziko antikoagulační léčby v těhotenství
Těhotenství pacientky s mechanickou chlopenní náhradou je vždy rizikové a při antikoagulační léčbě stojí proti sobě vždy riziko tromboembolických komplikací matky a poškození plodu. Ideální léčba neexistuje (13, 14). Mateřská mortalita u žen s chlopenní protézou je 1–4%, většinou na podkladě tromboembolických komplikací (15).
Warfarin prochází placentární bariérou, jeho podávání v těhotenství ve vyšších dávkách (> 5 mg) zvláště v prvním trimestru způsobuje embryopatie a je spojeno se spontánními aborty, předčasným porodem a porodem mrtvého plodu. Výskyt embryopatie se pohybuje mezi 4–10 % a je nevyšší mezi 6. a 12. týdnem těhotenství. Podle názoru některých autorů lze užívat warfarin v průběhu celého těhotenství s výjimkou období před porodem, pokud stačí k dosažení cílového INR dávka do 5 mg denně. Warfarin je relativně bezpečný ve II. a III. trimestru, kdy lze k léčbě warfarinem ještě přidat malou dávku kyseliny acetylsalicylové (75–100 mg denně), která sníží riziko trombózy, avšak zvýší riziko krvácivých komplikací. Podávání warfarinu musí být přerušeno 2–3 týdny před termínem porodu pro riziko intracerebrálního krvácení u plodu při porodu. Nefrakcionovaný heparin je bezpečný pro plod, neprochází placentární bariérou. Jeho podávání zvyšuje riziko uteroplacentárního krvácení a je popsán vysoký výskyt tromboembolických komplikací (12–24 %) u mechanických protéz. Dávku nefrakcionovaného heparinu je třeba monitorovat pomocí aktivovaného parciálního tromboplastinového času (APTT), který by měl být 2–3× prodloužen oproti normě. APTT může být nízké při zvýšené koncentraci faktoru VIII a fibrinogenu v těhotenství. Nefrakcionovaný heparin je podáván buď subkutánně 2× denně, nebo v kontinuální infuzi, obojí s kontrolami APTT.
Nízkomolekulární heparin má predikovatelnější účinek než nefrakcionovaný heparin a nezpůsobuje heparinem navozenou trombocytopenii, má pohodlnější aplikaci, neprochází placentární bariérou a je bezpečný pro plod. Nízkomolekulární heparin je podáván 2× denně.
Při jeho podávání je nutná kontrola plazmatické koncentrace anti-Xa za 4–6 hodin po ranní dávce s cílovou hodnotou anti-Xa 0,7–1,2 j/ml. Avšak u těhotných žen s mechanickou chlopní byl popsán při užívání nízkomolekulárního heparinu vysoký výskyt fatálních tromboembolických komplikací, a to až v 25 %. Důvodem těchto tromboembolických komplikací může být nedostatečná průběžná aktivita anti-Xa, která nedosahuje terapeutického rozmezí při doporučeném vrcholovém anti-Xa (07–1,2 j/ml) (16). Nízkomolekulární heparin nesmí být v těhotenství podáván ženám s mechanickou chlopní bez kontrol anti-Xa. Po porodu by měl být podán nefrakcionovaný heparin v kontinuální infuzi opětně za 4–6 hodin a přechod na warfarin by měl být proveden až po vyloučení rizika krvácení. Warfarin není kontraindikován v době kojení.
Perspektivy do budoucnosti
Po operacích chlopní, zvláště po náhradách přetrvává riziko tromboembolie a krvácení. Troboembolické příhody a krvácení v důsledku antikoagulační léčby zaujímají 75 % všech komplikací mechanických chlopenních náhrad. Zatím chybí ideální protéza, která by nebyla trombogenní, i když výzkum materiálů se tímto směrem ubírá a trombogenicita nových protéz klesá. Zatím neznáme ideální antikoagulans a ideální antitrombotikum, které by zamezilo tromboemboliím a přitom neohrožovalo pacienta krvácením. I na poli farmakologie probíhá intenzivní výzkum. Slibné byly výsledky s přímými inhibitory trombinu, zatím jsou však stále ve fázi klinického zkoušení.
Nejnovější výzkum na poli genetiky prokázal význam polymorfismu genu pro cytochrom P450 2C9 (CYP2C9) a vitamin K oxydoredutázový komplex 1 (VKORC1) pro individuální odpověď na kumariny. Perspektivou do budoucnosti je dávkovací schéma, které by zahrnulo genotypizaci CYP2C9 a VKORC1 a mohlo by pomoci optimalizovat výběr úvodních dávek warfarinu, a tím redukovat komplikace spojené s úvodním dávkováním.
Zatím však nezbývá, než optimalizovat terapii na základě pečlivého zvažování rizik tromboembolie a krvácení a pečlivě pacienty monitorovat pomocí laboratorních testů tak, aby se vyloučilo kolísání hladin léků. Jako nejideálnější s nejmenšími výkyvy INR se ukazuje samostatná monitorace pacientem (self-monitoring) pomocí přístroje podobnému glukometru (Coagu-Check). Pacient si sám odebere krev z prstu a pomocí papírku určí INR a sám nebo po telefonické konzultaci s centrem si upravuje dávky warfarinu. Tato metoda není dosud široce rozšířena, ale je již s úspěchem používána a přispívá ke zlepšení kvality antikoagulace, tudíž sníženi rizik a přináší i komfort pro pacienta, protože nemusí docházet na odběry krve do ordinace (17).
K minimalizaci komplikací antitrombotické léčby je nutná zvýšená odpovědnost praktických lékařů, jejich edukace a zlepšený praktický výcvik tak, aby bylo široce zajištěno individuální a adaptivní dávkování, které dále může přispět k zlepšení kvality života pacientů s chlopenními protézami.
Zkratky
ACT – aktivovaný čas srážlivosti
APPT – aktivovaný parciální tromboplastinový čas
ASA – kyselina acetylosalicylová
AVR – náhrada aortální chlopně
BMI – body mass index
EF – ejekční frakce
INR – international normalized ratio
LS – levá síň
MVgr – gradient na mitrální chlopni
MVR – náhrada mitrální chlopně
PVR – náhrada pulmonální chlopně
SEK – spontánní echokontrast
SR – sinusový rytmus
TVR – náhrada trikuspidální chlopně
Adresa pro korespondenci:
MUDr. Miroslava Benešová
Kardiochirurgické oddělení Nemocnice Na Homolce
Roentgenova 2, 150 30 Praha 5
fax: +420 257 272 587e-mail: miroslava.benesova@homolka.cz
Sources
1. Sun JCJ, Davidson MJ, Lamy A, et al. Antitrombotic management of patiens with prosthetic heart valves: current evidence and future trends. Lancet 2009; 374 : 565–576.
2. Popelová J, Benešová M, Brtko M, et al. Doporučené postupy pro diagnostiku a léčbu chlopenních srdečních vad v dospělosti. Cor Vasa 2007; 49(7–8): Kardio.
3. The Task Force on the Management of Valvular Heart Disease of the European Society of Cardiology. Guidelines on the management of valvular heart disease. Eur Heart J 2007; 28 : 230–268.
4. American College of Cardiology. American Heart Association Task Force on Practice Guidelines. ACC. AHA 2006 guielines for the management of patiens with valvular heart disease. J Am Coll Cardiol 2006; 48: e1–148.
5. Dunning J, Versteegh M, Fabbri A, et al. Guideline on antiplatelet and anticoagulation management in cardiac Sumery. Eur J Cardiothorac Surg 2008; 34 : 73–92.
6. Salem DN, Stein PD, Al-Ahmad A, et al. Antithrombotic Therapy in Valvular Heart Disease – Native and Prosthetic. Chest 2004; 126 : 457S–482S.
7. Butchart EG. Antithrombotic management in patiens with prosthetic valves: a comparison of American and European Guidelines. Heart 2009; 95 : 430–136.
8. Sundt TM, Zehr KJ, Dearani JA, et al. Is early anticoagulation with warfarin necessary after bioprosthetic aortic valve replacement? J Thorac Cardiovasc Surg 2005; 129 : 1024–31.
9. Colli A, et al. ACTION registry survey results, Eur J Cardiothorac Surg 2008; 33 : 531–536.
10. Laplace G, Lafitte S, LabŹque JN, et al. Clinical Signicance of Early Thrombosis After Prosthetic Mitral Valve Replacement. J Am Coll Cardiol 2004; 43 : 1283–1290.
11. Henneghan C, et al. A useful meta-analysis of the many trials of anticoagulation self monitoring with discussion of benefits and limitation in practice. Lancet 2006; 367 : 404–411.
12. Butchart EG, Gohlke-Bärwolf Ch, Antunes MJ, et al. Recommendations for the management of patiens after heart valve Sumery. Eur Heart J 2005; 26 : 2463–2471.
13. Chan WS, Anand S, Ginsberg JS. Anticoagulation of pregnant women with mechanical heart valves: a systematic review of the literature. Arch Intern Med 2000; 160 : 191–196.
14. Oakley C, Child A, Iung B, et al. Expert konsensus document on management of cardiovascular dinase during pregnancy. The task force on management of cardiovascular disease during pregnancy of the European Society of Cardiology. Eur Heart J 2003; 24 : 761–768.
15. Elkayam U. Valvular heart disease and pregnancy.Part II: Prosthetic valves. J Am Coll Cardiol 2005; 46 : 403–410.
16. Barbour LA, Oja JL, Schultz LK. A prospective trial that demonstrates that dalteparin requirements increase in pregnancy to maintain therapeutic levels of anticoagulation. American Journal of Obstetrics and Gynecology 2004; 3 : 1024–1029.
17. Herijgers P, Verhamme P. Improving the quality of antikoagulant in patiens with mechanical heart valves: what are we waiting for? EHJ 2007; 28 : 2424–2426.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- Význam radiochirurgie v léčbě mozkových metastáz
- Současná farmakoterapie epilepsie
- Diagnostika sepse
- Nekonvulzivní status epilepticus
- Aplikace moderní mikroneurochirurgie a současných technologií při řešení nádorových a cévních onemocnění mozku
- Karcinom ledviny v éře nastupujících robotických technologií
- Hluboká mozková stimulace u extrapyramidových poruch pohybu – pražská zkušenost
- Antitrombotická terapie po operacích chlopní – současná doporučení a budoucí trendy
- Syndrom časné repolarizace a idiopatická fibrilace komor
- Psychologická péče jako součást interdisciplinární přípravy pacienta k bariatrické operaci
- Minimálně invazivní výkony v cévní chirurgii
- Význam radiochirurgie v léčbě meningiomů
- Temporální epilepsie dospělých a možnosti neurochirurgické léčby: úloha magnetické rezonance
- Pedální bypass a jeho role v záchraně kriticky ischemické končetiny
- Využití vydechovaného oxidu dusnatého v diagnostice astmatu
- Šestileté zkušenosti s operacemi vrozených srdečních vad u dospělých
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Syndrom časné repolarizace a idiopatická fibrilace komor
- Temporální epilepsie dospělých a možnosti neurochirurgické léčby: úloha magnetické rezonance
- Nekonvulzivní status epilepticus
- Využití vydechovaného oxidu dusnatého v diagnostice astmatu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

