-
Medical journals
- Career
Sledování metabolismu v intenzivní péči pomocí mikrodialýzy
Authors: Filip Burša 1; Tomáš Olos 2; Leopold Pleva 3; Roman Kula 1; Jan Jahoda 1; Václav Procházka 4; Ivo Kopáček 3
Authors‘ workplace: Anesteziologicko resuscitační klinika FN, Ostrava 1; Oddělení pediatrické, resuscitační a intenzivní péče FN, Ostrava 2; Traumatologické centrum FN, Ostrava 3; Ústav radiodiagnostický FN, Ostrava 4
Published in: Čas. Lék. čes. 2011; 150: 605-609
Category: Review Articles
Overview
Léčba hemoragického šoku je i v současné medicíně stále závažný problém. Změnám na úrovni makrocirkulace a globálního metabolismu předcházejí změny na úrovni buněk, nejmenších cév a extracelulární tekutiny. Dominantní porucha se odehrává na úrovni buněk a mikrocirkulace. Přímá monitorace extracelulární tekutiny je možná metodou mikrodialýzy. Metoda je ověřena v řadě prací na animálních modelech, ale začíná být i podstatou mnoha klinických studií. Jedná se především o sledování tkáňových hodnot laktátu, pyruvátu, glukózy a glycerolu jako hlavních markerů energetického metabolismu buněk. O stavu tkání informují jak absolutní hodnoty, tak především vzájemné poměry hodnot laktát/pyruvát a laktát/glukóza. Sledované veličiny neupozorňují jen na nastupující anaerobní metabolismus, ale také na míru centralizace oběhu, resp. reperfuzi. Velmi cenné jsou i informace o mitochondriální dysfunkci, která je buněčnou podstatou multiorgánového selhávání v intenzivní péči. Dle dynamiky těchto parametrů můžeme posuzovat kvalitu resuscitační péče s ohledem na rychlost eliminace šoku, zvyšování dodávky kyslíku tkáním a léčbu mitochondriální dysfunkce.
Klíčová slova:
hemoragický šok, mikrodialýza, laktát, svalová tkáň.ÚVOD
Stav buněk a jejich metabolismus v časných fázích hemoragického šoku stále není dostatečně objasněn. Efektivní dodávka kyslíku tkáním je neznámá. Doposud podrobně nevíme, jak tyto buňky dovedou utilizovat kyslík v šokovém stavu organismu. Vodítkem k objasnění těchto dějů může být sledování extracelulární tekutiny a látek, které se v ní vyskytují pomocí mikrodialýzy.
Mikrodialýza je moderní metoda monitorace tkání na buněčné úrovni. Jedná se o semikontinuální sledování hladin jednotlivých analytů v extracelulární tekutině. Periferní svalová tkáň je dobře dostupný kompartment, který je již v časné fázi šoku diskriminován redistribucí minutového srdečního objemu ve prospěch vitálně důležitých orgánů, tedy především mozku a srdce. V průběhu šoku jsou myocyty postiženy velmi časně, ale mohou poměrně rychle regenerovat v případě zvládnutí šokového stavu. Pokud začnou buňky pracovat v režimu anaerobní glykolýzy navozeném ischemií nebo hypoperfuzí, změní se redoxní stav buněk, a následně pak koncentrace látek účastnících se na energetickém metabolismu. Dojde ke změnám koncentrace glukózy, laktátu a pyruvátu, a pokud je ischemie hluboká, tak i glycerolu. Sledování těchto koncentrací nahlíží na stav buněk a lze podle nich usuzovat o nedostatečnosti dodávky kyslíku nebo o neschopnosti buněk kyslík utilizovat.
OBECNÝ PRINCIP METODY MIKRODIALÝZY
Mikrodialýza napodobuje svým chováním krevní kapiláru. Podstatou mikrodialýzy je inertní, elektroneutrální, biologicky neaktivní sonda s mikroskopickou semipermeabilní membránou. Tuto sondu lze umístit do libovolné tkáně. Je možné sondu zavést peroperačně do tkáně jater (1), stěny žaludku (2) nebo střeva anebo monitorovat přístupnější tkáně jako například svalovou nebo tukovou (3). Membrána sondy se tak dostane do kontaktu s extracelulární tekutinou. Sonda je kontinuálně promývána definovaným roztokem nastavenou rychlostí. Dochází k výměně molekul mezi extracelulární tekutinou a dialyzačním roztokem. Proces výměny molekul záleží na fyzikálních vlastnostech roztoků na obou stranách membrány a na velikosti molekul ve srovnání s póry v membráně. Prostou difuzí projdou hydrofilní molekuly menší než otvory v membráně rychlostí dle koncentračních gradientů. Pokud se použije sonda s jinou membránou, kterou projdou velké molekuly, začnou se uplatňovat i osmotické síly. Osmoticky aktivní látky v kapiláře „natahují“ vodu z extracelulární tekutiny, ale také z perfuzního roztoku v sondě. Může tak docházet ke změně objemu dialyzátu, a tím i ke změně koncentrací látek k analýze. Změnou složení dialyzačního roztoku můžeme ovlivňovat jak gradienty, a tím pádem rychlosti prostupu molekul, tak zkoncentrování nebo zředění molekul dialyzátu při průchodu sondou. Další, velmi podstatnou charakteristikou systému, je rychlost průtoku roztoku sondou. Koncentrace analytů ve vzorku závisí na stupni ekvilibrace mezi perfuzním roztokem a extracelulární tekutinou. Zpravidla se míra ekvilibrace udává jako takzvaný „relativní recovery“ v procentech. Při nulovém průtoku by byla ekvilibrace jistě úplná, ale nedocházelo by ke sběru vzorku. S ekvilibrací úzce souvisí také délka membrány. Membrána tedy musí být tak dlouhá a rychlost průtoku taková, aby měly molekuly dostatek času membránou prostoupit a došlo k co nejvyšší ekvilibraci. Systém na straně sondy je stabilní, takže změny analytů jsou dány změnou jejich tvorby/spotřeby buňkami, ale také změnou průtoku krve danou oblastí. V praxi se relativní recovery pohybuje okolo 80–100 %. Celkový počet molekul, který se dostane do zkumavky se označuje jako „absolutní recovery“ a jeho jednotkou je objem/čas. Díky přestupu látek mezi sondou a extracelulární tekutinou oběma směry nemusí být absolutní recovery shodné s nastaveným průtokem na pumpě. Velmi zde záleží na míře prokrvení tkáně. Výsledek výměny molekul v podobě roztoku je sbírán na konci sondy do mikrozkumavky a je k dispozici pro analýzu.
V klinické a experimentální medicíně můžeme například monitorovat hladiny léčiv v jednotlivých tkáních, průnik antibiotik (4, 5) nebo chemoterapeutik do sledované oblasti nebo sledovat imunologický stav orgánů analýzou cytokinů (6). Metoda je jedinečná pro posouzení farmakokinetiky léčiv v nestandardních podmínkách jako například u septických pacientů v intenzivní péči (7). Mikrodialýza je dostatečně senzitivní metodou pro sledování anaerobního metabolismu a pozitivně koreluje s proinflamatorními markery (8). Můžeme také zkoumat stav orgánů při operacích nebo transplantacích (1). Za určitých podmínek je možné sledovat míru prokrvení selektivně v tkáni pomocí průtokových markerů jako etanol (9), urea (10) nebo například značených molekul (11). Existuje rovněž klinický analyzátor, který dokáže vyšetřit dialyzát přímo u lůžka pacienta. Získáváme tak jednoduše a rychle hladiny některých látek, ke kterým existují firemně vyráběné kity pro analýzu. Těmito látkami jsou například laktát, pyruvát, glukóza, glycerol nebo glutamát. Pomocí tohoto analyzátoru získáváme kontinuální grafický přehled trendů jednotlivých vyšetřovaných veličin (obr. 1).
Image 1. Grafický přehled trendů jednotlivých vyšetřovaných veličin 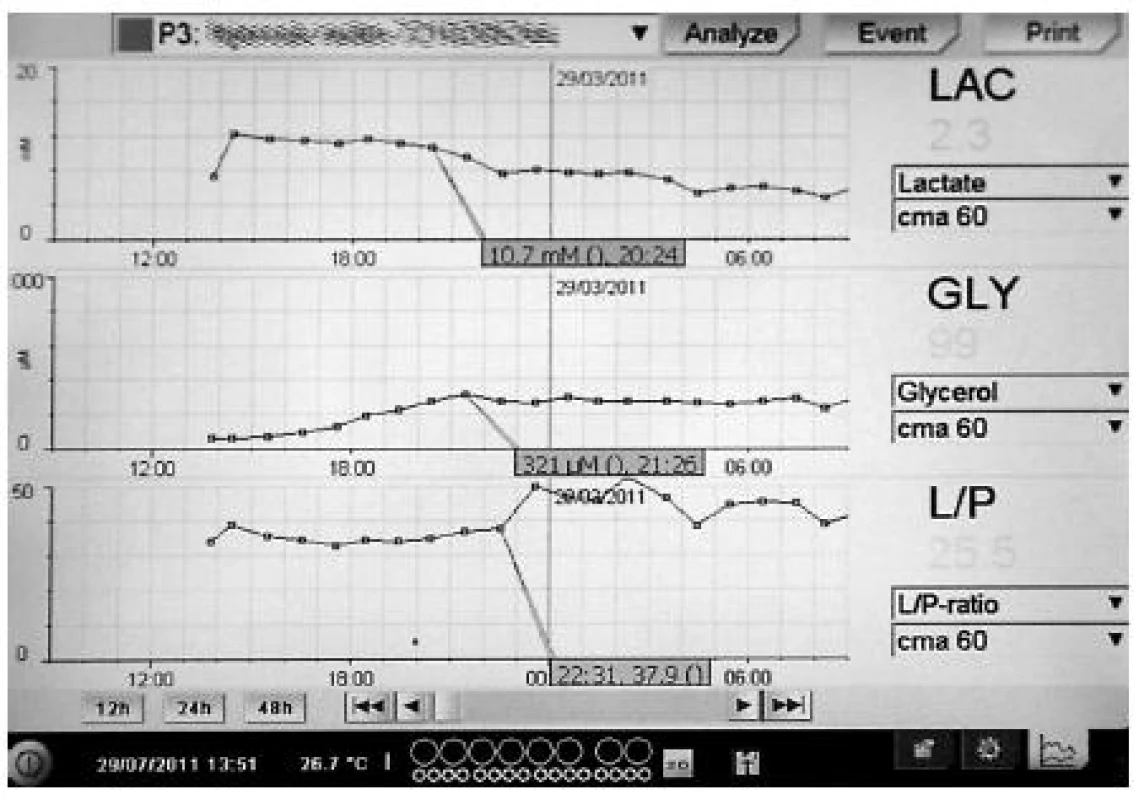
ODHAD STAVU BUNĚK POMOCÍ ANALÝZY EXTRACELULÁRNÍ TEKUTINY
V extracelulární tekutině se vyskytuje nepřeberné množství molekul. Některé jsou výsledkem metabolismu buněk, ale mohou to být i substráty nutné pro jejich funkci. Molekuly, které těsně souvisejí s energetickým metabolismem buňky jsou především laktát a pyruvát, dále glukóza a glycerol (tab. 1).
Table 1. Molekuly související s energetickým metabolismem buňky 
Pozn.: Platí pro průtok μl/min a délce membrány 3 cm. Laktát je široce uznávaným markerem ischémie. Obecnou známkou tkáňové hypoxie je vzestup plazmatického laktátu nad 2 mmol/l. Kosterní svaly, které představují asi 40 % celkové tělesné masy buněk, jsou nejdůležitějším zdrojem laktátu, kdy v šoku existuje trvalý gradient laktátu svaly – plazma asi 1,98 mmol/l (12). Pokud buňky pracují v režimu anaerobní glykolýzy, musí z pyruvátu vzniknout laktát, aby se mohl zregenerovat koenzym NADH + H+ na NAD+. Pokud začne proces probíhat aerobně, přejde pyruvát do cyklu kyseliny citrónové a NADH + H+ se regeneruje v dýchacím řetězci v mitochondriích. Malá část laktátu se v příčně pruhovaných svalech metabolizuje zpět na pyruvát. Větší díl se dostává do oběhu a do jater, kde vstupuje do glukoneogeneze v Coriho cyklu. Současně v ischemické tkáni klesá glukóza. Vzestup poměru laktát/pyruvát je užitečným nástrojem pro monitoraci šoku (13). Změna laktátu a pyruvátu musí být interpretována s ohledem na klinický stav a nemusí nutně znamenat hypoperfuzi nebo nedostatečnou dodávku kyslíku. Při cytopatické hypoxii, která je přítomna u mitochondriální dysfunkce, jsou oba markery vysoké i při dostatečné dodávce kyslíku, protože buňky nejsou schopny tento kyslík utilizovat. Tento stav můžeme pozorovat například u popálenin nebo septického šoku (14). Laktát jako samostatný marker ischémie není dostatečně specifický. Může být zvýšen například i ve zcela aerobním režimu buněk při celkovém zvýšení metabolismu indukovaném stresem a zvýšenou glykogenolýzou díky stimulaci ß-adrenergních receptorů (15, 12). Endogenní nebo exogenní adrenalin přes ß2-receptory stimuluje svalovou Na+ - K+ pumpu, vzniká AMP, reaktivuje se glykolýza a tvoří se laktát. Jedná se o ochranný mechanismus dobře okysličených tkání, upřednostňující jako zdroj energie laktát před glukózou a šetří si glukózu pro anaerobní recyklaci ATP (16). Tato porce laktátu nebude ovlivněna arteficiálním zvýšením dodávky kyslíku. Při šoku je rovněž snížena clearance laktátu. Tato metabolická cesta je stimulována především v terénu SIRS a sepse. Přesto vysoká hladina laktátu koreluje s horším výsledkem (12). U polytraumatizovaných pacientů v hemoragickém šoku je zvýšení laktátu především zásluhou anaerobní glykolýzy. Významné zkreslení hladiny laktátu ale přináší centralizace oběhu, kterou u šoku očekáváme. Známým jevem je tedy masivní zvýšení hladiny sérového laktátu po dosažení eliminace šoku v rámci systémové reperfuze. Proto je tak důležité orientovat se podle poměru laktátu k pyruvátu, protože se dá předpokládat, že clearence obou látek v daném kompartmentu bude ovlivněna stejně. Až oběh začne reperfundovat, opět se změny hladin budou pohybovat proporcionálně na stejné úrovni. Metoda mikrodialýzy je dobře použitelná pro hodnocení regionální perfuze, ať již tzv. diluční technikou pomocí průtokového indikátoru, tak i pozorováním relativních změn metabolických poměrů laktát/pyruvát a laktát/glukóza (2, 9–11). Další významnou výhodou regionálního sledování hladiny laktátu je to, že sérový laktát je výsledkem jak produkce, například při ischémii nebo stresu, tak spotřeby laktátu, který vstupuje jako substrát do metabolismu v tkáních jako játra, srdce nebo mozek. Tkáňový laktát je výsledkem čisté produkce, za předpokladu, že nemonitorujeme tkáň schopnou utilizovat laktát jako energetický substrát.
Glukóza je dalším důležitým markerem počínající ischemie a hypopefuze. Pokud dojde k prudkému poklesu tkáňové glukózy, dodávka energetických substrátů začíná být kritická a toto snížení předchází globálnímu poklesu spotřeby kyslíku (17). Tkáňová glukóza negativně koreluje s ischémií (2). Poměr laktát/glukóza je vhodným metabolickým indikátorem poruchy tkáňové perfuze a je upřednostňován před dilučními metodami s použitím průtokových markerů (2).
Glycerol je markerem těžké ischémie buněk (18). Jedná se o látku, která je integrální součástí buněčných membrán. Jestliže dojde k selhání energetického metabolismu buněk a tyto se začnou rozpadat, dojde ke zvýšení hladin glycerolu. Při snížení dodávky kyslíku buňkám dojde k influxu kalcia do buněk, aktivaci fosfolipázy a uvolnění glycerolu z membrány buněk. Vzestup glycerolu v extracelulární tekutině je známkou významného poškození buněk ischémií (19). Musíme ale také uvažovat o implantačním traumatu, způsobeném zavedením mikrodialyzační sondy. To může způsobit falešně pozitivní hodnoty glycerolu. V tukové tkáni je hladina glycerolu zkreslena jeho frakcí, která nepochází z rozpadu membrán, ale z lipolýzy. Lipolýza je významně ovlivněna sympatickým tonem. Monitorace glycerolu v tukové tkáni tak může být dobrým markerem stresového stavu organismu. Sledování tkáňového glycerolu pomocí mikrodialýzy je vhodnou metodou ke zjištění aktivity lipolýzy (20).
DODÁVKA A SPOTŘEBA KYSLÍKU A MITOCHONDRIÁLNÍ DYSFUNKCE
Měření dodávky a spotřeby kyslíku patří dnes již k zažitým standardům na jednotkách intenzivní péče. Nejdůležitější je pro toto měření získání informace o srdečním výdeji. V dnešní době existuje celá plejáda nejrůznějších přístrojů na odhad nebo sofistikovaná měření srdečního výdeje. Jako zlatý standard pro porovnávání metod je stále používán plicnicový katétr s měřením srdečního výdeje termodiluční metodou. Globální měření ale nevypovídá nic o stavu jednotlivých tkání. Na druhou stranu, pokud není globální dodávka kyslíku dostatečná, budou poškozeny všechny tkáně dle jejich individuální tolerance. Základním předpokladem je, aby spotřeba kyslíku nebyla limitována jeho dodávkou. Spotřeba kyslíku je parametr, který úzce souvisí s mitochondriální dysfunkcí. Pokud je tato přítomna, organismus není schopen spotřebu navýšit, protože není schopen substráty utilizovat. Časné odstranění mitochondriální dysfunkce je spojeno s lepším výsledkem (21). Důležité je proto sledovat trend spotřeby kyslíku v kontextu s jeho dodávkou, ale především v kontextu s klinickým stavem pacienta, hloubkou jeho sedace, mírou systémové zánětlivé odpovědi a hladinami laktátu a dalších markerů ischémie včetně hladiny hemoglobinu.
JAK VYSOKÁ DODÁVKA KYSLÍKU JE NUTNÁ PRO ORGANISMUS
Za předpokladu dostatečného srdečního minutového výdeje je dodávka kyslíku určena množstvím rozpuštěného kyslíku v plazmě a především saturací a hladinou hemoglobinu. Dodávka kyslíku je určena vztahem:
CaO<sub>2</sub> – obsah kyslíku arteriální krve, Hgb – koncentrace hemoglobinu, SaO<sub>2</sub> – saturace arteriální krve kyslíkem, 1,39 – 1 g hemoglobinu váže 1,39 ml kyslíku, PaO<sub>2</sub> – parciální arteriální tlak kyslíku, 0,0225 – koeficient rozpustnosti kyslíku, DO<sub>2</sub> – dodávka kyslíku, CO – srdeční výdej 
První práce z oblasti výzkumu hladin hemoglobinu a doporučení jeho minimálních hodnot pro krevní převod pocházejí z roku 1942 z práce Adamse a Lundyho (22). Tato oblast byla předmětem mnoha studií z přelomu tisíciletí, které se snažily vyvrátit mnoho let trvající dogma pravidla „10/30“ jako hraniční hodnoty hemoglobinu a hematokritu pro podání krevních převodů u kriticky nemocných pacientů, aby byla zachována dostatečná oxygenace tkání. Zajímavá je například práce, která nepotvrdila nedostatečnou dodávku kyslíku tkáním při normovolemické hemodiluci zdravých jedinců až k hodnotě hemoglobinu 50 g/l (23, 24) a některé práce se Svědky Jehovovými ukazují, že je možno přežít i při extrémních hodnotách pod 14 g/l (25), jistě ale za cenu celkového vyčerpání organismu a komplikované regenerace. Celá řada prací potvrdila benefit restriktivního přístupu ke krevním převodům v porovnání se zaběhnutým přístupem liberálním (26–30). Restriktivní přístup snižuje počet komplikací z podání transfuze o 42 % (26). Přesto byla zjištěna průměrná hladina hemoglobinu pro podání transfuzí 84 g/l na 146 JIP západní Evropy (31). Je tato hladina skutečně spojena s diskriminací tkáňové oxygenace? Je možné tuto mez brát jako hraniční pro podání transfuze? U akutní krevní ztráty je doporučováno udržovat Hb > 80 g/l (32). Velmi důležité je odlišit anémii u traumatického hemoragického šoku, kde existuje porucha koagulace, od jiných příčin anémie a přistupovat rozdílně k její léčbě. Při krevním převodu je nutné zvážit cost versus benefit. Podle některých prací by měla být transfuze podána, pokud globální dodávka kyslíku spadne pod kritickou mez, která je doprovázená vzestupem kyslíkové extrakce nad 50 % (33). Některé nové práce přinášejí zcela nové pohledy na indikace transfuzí ne kvůli zvýšení přenosové kapacity pro kyslík, ale kvůli ovlivnění reologických vlastností krve jako jednu z klíčových kroků v léčbě mitochondriální dysfunkce (34). Případně upřednostnění ovlivnění krevní viskozity před zvýšením vazebné kapacity pro kyslík transfuzí, pomocí látek zvyšujících viskozitu krve. Resuscitace mikrocirkulace tedy úzce souvisí s výběrem tekutiny použité k náhradě objemu (35). U kriticky nemocných pacientů bez aktivního onemocnění srdce nebo poruchy koagulace můžeme vyčkat s transfuzí až do Hb < 70 g/l (36). K dosažení adekvátní dodávky kyslíku je klíčový dostatečný srdeční výdej, a tedy i jeho monitorace.
ČASNÁ DIAGNOSTIKA ANAEROBNÍHO METABOLISMU A HYPOPERFUZE
Je důležité si uvědomit, že pokud v buněčném metabolismu nastanou nějaké změny, projeví se nejdříve na této lokální úrovni, tedy v mikrocirkulaci. Mikrocirkulace je tvořena systémem arteriol, kapilár a venul, které bezprostředně obklopují buňky a vytvářejí síť, kterou se distribuují nutrienty a kyslík, a odstraňují se produkty metabolismu. Mezi cévami je extracelulární tekutina obsahující tedy jak substráty pro buňky, tak odpadní produkty. Všechny tyto molekuly mohou prostoupit do mikrodialyzační sondy, jestliže splní fyzikální předpoklady pro prostup do dialyzátu. Právě časným zachycením těchto změn můžeme získat terapeutické okno k intervenci, než tyto hodnoty dosáhnou makrocirkulace. Monitorování mikrocirkulace je proto velmi důležité. Pro úpravu metabolických změn vyvolaných šokem je zlepšení mikrocirkulace efektivnější než zvyšování přenosové kapacity pro kyslík v experimentálním hemoragickém šoku (21). Šok je dysfunkcí mikrocirkulace. V hemoragickém šoku na úrovni mikrocirkulace dochází k redukci funkční kapilární denzity, snižuje se průměr kapilár a redukuje se rychlost krevního proudu. Nedochází ale na rozdíl od jiných typů šoku ke zkratování krve (37).
Svalová tkáň je centralizací oběhu postižena velmi časně a je vhodným prostředím k posuzování míry centralizace oběhu případně reperfuze. Etiologie hemoragického šoku je často traumatická s masivním poškozením svalové tkáně. V této souvislosti je důležité, která svalová tkáň je monitorována. Hodnoty z atraumatizované zdravé tkáně vypovídají o míře centralizace oběhu a případné reperfuzi. Pokud by byla monitorována traumatizovaná tkáň, hodnoty by ukazovaly především na míru regenerace tkání. Tato regionalita je jednou z hlavních předností mikrodialýzy. Z pozorování trendů a současném sledování klinických ukazatelů lze odhadovat i podíl mitochondriální dysfunkce a míru zotavení buněk. Sérové koncentrace arteriálního laktátu, jejichž sledování je běžnou praxí, jsou výsledkem metabolismu v celém organismu, kdy normální hodnoty nemusí vypovídat nic o stavu traumatizované tkáně nebo o dysfunkci mitochondrií. Na druhé straně regionální změny, způsobené např. sekundární traumatizací tkáně mohou přinášet falešné výsledky a ztěžují interpretaci tkáňových hodnot.
PRVNÍ ZKUŠENOSTI S MIKRODIALÝZOU U TRAUMATICKÉHO HEMORHAGICKÉHO ŠOKU
V současnosti na našem pracovišti probíhá studium závislosti tkáňových hodnot na ostatních běžně měřených veličinách v intenzivní péči. Zkoumanou skupinou jsou polytraumatizovaní pacienti s těžkým traumaticko-hemoragickým šokem. Tkáňové hodnoty jsou získávány z netraumatizované svalové tkáně, nejčastěji z musculus deltoideus pomocí mikrodialýzy. Snahou je nalézt závislost sérových a tkáňových hodnot laktátu a saturace centrální venózní krve. Především je ale hledána kritická hladinu hemoglobinu nebo kritická dodávka kyslíku, při které se bude objevovat tkáňová ischemie. To vše v podmínkách akutní koagulopatie traumatického šoku u takto kriticky nemocných pacientů. Na výsledky práce musíme ještě vyčkat.
ZÁVĚR
Sledování tkáňových hodnot metodou mikrodialýzy je ověřená experimentální metoda, která nyní postupně získává své místo v klinickém výzkumu. Zjednodušení metody díky firemně vyráběným bed-side analyzátorům a setům ke stanovení některých látek se metoda dostala již velmi blízko pacientům. Stále se objevují četnější výstupy z experimentů na animálních modelech, ale vzniká i celá řada klinických studií zabývajících se stanovením tkáňových hodnot látek.
Metoda mikrodialýzy přináší nové pohledy na stav organismu v šoku zejména díky rychlé diagnostice změn a regionálním vyšetřování. V budoucnu uvidíme, jak standardní metodou se mikrodialýza v klinických podmínkách stane zejména s ohledem na relativní náročnost získávání dat. Jedná se o užitečnou metodu, která má ale své četné limitace a úskalí zejména v podobě obtížné interpretace naměřených dat. Rovněž omezující může být v současnosti stále velmi vysoká cena měření.
Článek vznikl za podpory grantu Resortní program výzkumu a vývoje – MZ III na léta 2010–2015, identifikační kód NT11371–5/2010 – účelová podpora IGA MZ ČR projektu Metabolická odezva organismu u polytraumat.
Řešitel doc. MUDr. Leopold Pleva CSc.; spoluřešitelé MUDr. Filip Burša, MUDr. Tomáš Olos, MUDr. Jan Jahoda, MUDr. Roman Kula CSc, MUDr. Václav Procházka PhD., MUDr. Ivo Kopáček.
ADRESA PRO KORESPONDENCI:
MUDr. Filip Burša
Anesteziologicko-resuscitační klinika FN Ostrava
17. listopadu 1790, 708 00 Ostrava
e-mail: bursaf@seznam.cz
Sources
1. Waelgaard L, Thorgersen EB, Line PD, et. al. Microdialysis monitoring of liver grafts by metabolic parameters, cytokine production, and complement activation. Transplantation 2008; 86(8): 1096–1103.
2. Cibiček N, Živna H, Čermakova E, et. al. Sledování krevního průtoku v žaludku pomocí mikrodialýzy na potkaním modelu ischemie-reperfuze Klin Biochem Metab 2010; 18(39): 36–240.
3. Rostami E, Bellander BM. Monitoring of glucose in brain, adipose tissue, and peripheral blood in patients with traumatic brain injury: a microdialysis study. J Diabetes Sci Technol 2011; 5(3): 596–604.
4. Liu X, Kruger PS, Roberts MS. How to Measure Pharmacokinetics in Critically Ill Patients? Curr Pharm Biotechnol 2011; May 10 [Epub ahed of print].
5. Douglas A, Altukroni M, Udy AA, et. al. The pharmacokinetics of cefazolin in patients undergoing elective & semi–elective abdominal aortic aneurysm open repair surgery. BMC Anesthesiol 2011; 11 : 5.
6. Simon F, Karlander, LE, et. al. Continous assessment of concentrations of cytokines in experimentak injurie sof the extremity. Exp Med 2009; 2(4): 354–362.
7. Roberts JA, Roberts MS, Semark A, et al. Antibiotic dosing in the ‘at risk’ critically ill patient: Linking pathophysiology with pharmacokinetics/pharmacodynamics in sepsis and trauma patients. BMC Anesthesiol 2011; 11 : 3.
8. Jansson L. et al. Postoperative on-line monitoring with intraperitoneal microdialysis is a sensitive clinical method for measuring increased anaerobic metabolism that correlates to the cytokine response. Scand 2004; 39(5): 434–439.
9. Widegren U, Hickner RC, Jorfeldt L, Henriksson J. Muscle blood flow response to mental stress and adrenaline infusion in man: microdialysis ethanol technique compared to (133)Xe clearance and venous occlusion plethysmography. Clin Physiol Funct Imaging 2010; 30(2): 152–161.
10. Farnebo S, Zettersten EK, Samuelsson A, Tesselaar E, Sjöberg F. Assessment of blood flow changes in human skin by microdialysis urea clearance. Microcirculation 2011; 18(3): 198–204.
11. Farnebo S, Samuelsson A, Henriksson J, et. al. Urea clearance: a new method to register local changes in blood flow in rat skeletal muscle based on microdialysis. Clin 2010; 30(1): 57–63.
12. Bruno L, Sébastien G, Patricia F, et al. Relation between muscle Na+K+ ATPase activity and raised lactate concentration in septic shock:a prospective study. The Lancet 2005; 365 : 9462.
13. Ohashi S, et al. Utility of microdialysis to detect the lactate/pyruvateratio in subcutaneous tissue for the reliable monitoring of hemorrhagic shock. Res 2009; 45(6): 269–278.
14. Samuelsson A, Steinvall I, Sjoberg F. Microdialysis shows metabolit effects in skin during fluid resuscitation in burn-injured patiens. Crit Care 2006; 10(6): R172.
15. Farnebo S, Zettersten A. Assessment of blood flow changes in human skin by microdialysis urea clearance. Microcirculation 2011; 18(3): 198–204.
16. Levy B, Desebbe O, Montemont C, et al. Increased aerobic glycolysis through beta2 stimulation is a common mechanism involved in lactate formation during shock states. Shock 2008; 30(4): 417–421.
17. Krejci V, Hiltebrand L, et al. Decreasing gut wall glucose as an early marker of impaired intestinal perfusion Critical Care Medicine 2006; 34 : 2406–2414.
18. Allam Cl, Xu M, Mendendorp A. Determination of Renal Hypothermic Temperature Adequacy for Renoprotection During Ischemia Using Renal Interstitial Glycerol Concentrations in a Porcine Model Urology 2011; 77(2): 508.e1–4.
19. SolligĆrd E, Jue IS, Bakkelund K, et al. Gut luminal microdialysis of glycerol as a marker of intestinal ischemic injury and recovery. Department of Anesthesiology and Intensive Care 2005; 33(10): 2278–2285.
20. Petriczko E, Horodnicka-Jozwa A, Grabowska-Wnuk W, et al. Interstitial measurements of glucose, glycerol and lactate in adolescents with decompensated type 1 diabetes. Neuro Endocrinol Lett 2010; 31(4): 559–567.
21. Trzeciak S, McCoy JV, Philip Dellinger R, et al. Early increases in microcirculatory perfusion during protocol–directed resuscitation are associated with reduced multi–organ failure at 24 h in patients with sepsis. Intensive Care Med 2008; 34(12): 2210–2217.
22. Adams RC, Lundy JS. Anesthesia in cases of poor surgical risk. Some suggestions for decreasing the risk. Surg Gynecol Obstet 1942; 74 : 1011–1019.
23. Weiskopf RB, Viele MK, Feiner J, Kelley, et al. Human cardiovascular and metabolic response to acute, severe isovolemic anemia. JAMA 1998; 279 : 217–221.
24. Lieberman JA, Weiskopf RB, Kelley SD, et al. Critical oxygen delivery in conscious humans is less than 7.3 mL O2 × kg (-1) × min (-1). Anesthesiology 2000; 92 : 407–413.
25. Brimacombe J, Skippen P, Talbutt P. Acute anemia to a hemoglobin of 14 g/lwith survival. Anaesth Intensive Care 1991; 19 : 581–583.
26. Hill SR, Carless PA, Henry DA, et al. Transfusion thresholds and other strategies for guiding allogeneic red blood cell transfusion. Cochrane Database Syst Rev2002: CD002042.
27. Madjdpour C, Spahn DR, Weiskopf RB. Anemia and perioperative red blood cell transfusion:a matter of tolerance. Crit Care Med 2006; 34: S102–108.
28. Walsh TS, Saleh EE. Anaemia during critical illness. Br J Anaesth 2006; 97 : 278–291.
29. Hebert PC, Wells G, Blajchman MA, et. al. A multicenter, randomized, controlled clinical trial of transfusion requirements in critical care. N Engl J Med 1999; 340 : 409–417.
30. Koch CG, Li L, Duncan AI, Mihaljevic T, et al. Transfusion in coronary artery bypass grafting is associated with reduced long-term survival. Ann Thorac Surg 2006; 81 : 1650–1657.
31. Vincent JL, Baron J-F, Reinhart K, et al. Anemia and blood transfusion in critically ill patients. JAMA 2002; 288 : 1499–1507.
32. Stainsby D, MacLennan S, Thomas, D et al. Guidelines on the management of massive blood loss. Br J Haematol 2006; 135(5): 634–641.
33. Sehgal LR, Zebala LP, Takagi I, et al. Evaluation of oxygen extraction ratio as a physiologic transfusion trigger in coronary artery bypass graft surgery patients. Transfusion 2001; 41 : 591–595.
34. Vázquez BY, Hghtower CM, Martini J. Vasoactive hemoglobin solution improves survival in hemodilution followed by hemorrhagic shock. Crit Care Med 2011; 39(6): 1461–1466.
35. Boldt J, Ince C. The impact of fluid therapy on microcirculation and tissue oxygenation in hypovolemic patients: a review. Care Med 2010; 36(8): 1299–1308.
36. Samir M Fakhry, Fata P. How low is too low? Cardiac risks with anemia. Crit Care 2004; 8(Suppl 2): S11–14.
37. Dubin A, Pozo MO, Ferrara G. Systemic and microcirculatory responses to progressive hemorrhage. Intensive Care Med 2009; 35(3): 556–564.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- Současný stav diagnostiky karcinomu pankreatu
- Pooperační rekurence Crohnovy nemoci*
- Úloha estrogénov v regulácii biologických procesov zapojených do hojenia rán – literárny prehľad
- Sledování metabolismu v intenzivní péči pomocí mikrodialýzy
- Babyboxy v České republice – jak dál?
- Čtyřnásobné jubileum Bohumila Eiselta (1831–1908)
- Korelace intraatriálních elektrických potenciálů a tlaků s morfologickými a funkčními ukazateli přetížených síní stanovenými echokardiografií
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Současný stav diagnostiky karcinomu pankreatu
- Pooperační rekurence Crohnovy nemoci*
- Úloha estrogénov v regulácii biologických procesov zapojených do hojenia rán – literárny prehľad
- Babyboxy v České republice – jak dál?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

