-
Medical journals
- Career
Změny plazmatických hladin obestatinu a ghrelinu po podání rozpustné vlákniny s glukózou a samotné vlákniny zdravým ženám a pacientkám s bulimia nervosa
Authors: Hana Doubková 1; Jana Kopečková 1; Dana Sedláčková 1; Martin Haluzík 3; Hana Kvasničková 1; Hana Papežová 2; Vojtěch Hainer 1; Jara Nedvídková 1
Authors‘ workplace: Endokrinologický ústav Praha, Laboratoř klinické a experimentální neuroendokrinologie 1; Univerzita Karlova Praha, 1. lékařská fakulta, Psychiatrická klinika VFN 2; Univerzita Karlova Praha, 1. lékařská fakulta, III. interní klinika VFN 3
Published in: Čas. Lék. čes. 2010; 149: 542-545
Category: Original Article
Overview
Východisko.
Nedávný objev nového peptidového hormonu obestatinu, odvozeného od stejného genu jako ghrelin, přidal další poznatky ke komplexnosti fyziologie ghrelinu. I tak však zůstává nezodpovězených mnoho otázek, včetně vlivu složení potravy na regulaci orexigenního ghrelinu a obestatinu považovaného spíše za anorexigen. V této studii byl sledován vliv složení kalorické a nekalorické potravy na plazmatické hladiny ghrelinu a obestatinu u zdravých žen (n = 6; věk 23,83 ± 1,1 let; BMI 20,85 ± 0,87 kg/m2) a u žen s bulimia nervosa (n = 6; věk 26,6 ± 5,2 let; BMI 19,2 ± 1,44 kg/m2) charakterizovaných abnormálním jídelním chováním a narušenou energetickou rovnováhou.Metody a výsledky.
Plazmatické hladiny ghrelinu a obestatinu byly měřeny po celonočním hladovění před a po podání rozpustné vlákniny nebo vlákniny s glukózou. Hladiny hormonů byly stanoveny pomocí radioimunologických kitů. U obou skupin žen se hladiny ghrelinu a obestatinu po podání rozpustné vlákniny v průběhu křivky významně neměnily. Po podání rozpustné vlákniny s glukózou byl zjištěn významný pokles ghrelinu i obestatinu u pacientek s bulimia nervosa i u zdravých žen, a to postupně v prvních 30–90 minutách po požití. Poté se hladiny obou hormonů vracely k preprandiálním hodnotám.Závěry.
Postprandiální plazmatické hladiny ghrelinu i obestatinu klesají v závislosti na kalorickém obsahu potravy u zdravých žen i u pacientek s bulimia nervosa.Klíčová slova:
bulimia nervosa, ghrelin, obestatin, rozpustná vláknina.Úvod
Peptidy, které jsou produkty osy gastrointestinální trakt – mozek, se významnou měrou podílejí na regulaci energetické homeostázy a jídelního chování u člověka. Mezi tyto peptidy patří gastrointestinální hormon ghrelin a nedávno objevený obestatin (1, 2). Ghrelin je produkován převážně v žaludku, ale jeho exprese byla zjištěna i v dalších periferních a centrálních tkáních. Předpokládá se, že ghrelin je orexigenním faktorem, který stimuluje příjem potravy a moduluje energetickou rovnováhu (3). Gastrointestinální peptid obestatin byl objeven Zhangem et al. (4) jako produkt posttranslační úpravy preproghrelinové molekuly, podobně jako je tomu u ghrelinu. Zhang et al. a také další autoři (4, 5) pozorovali, že injekční aplikace obestatinu do třetí mozkové komory myši navodila omezení příjmu potravy. Většina autorů pozdějších studií však anorexigenní vlastnosti obestatinu neprokázala (6–9). V naší předchozí studii jsme pozorovali zvýšené bazální plazmatické hladiny jak ghrelinu, tak obestatinu u pacientek s anorexia nervosa a nižší bazální plazmatické hladiny ghrelinu a obestatinu u obézních osob (10).
Při zpracování potravy v gastrointestinálním traktu je významná aktivace chemo - a mechanoreceptorů. Objem jídla nebo jeho složení jsou kontrolovány zpětnovazebnými signály sytosti ze žaludku, tenkého střeva, jater a tukových zásob. Jak ghrelin, tak obestatin jsou po příjmu potravy uvolňovány do krevního oběhu. Optimalizují trávicí proces, podílejí se na energetické rovnováze organismu a ovlivňují jeho fyziologický stav a jídelní chování. Dosud je málo známo o vlivu složení potravy na plazmatické hladiny ghrelinu a obestatinu u člověka. Významnou esenciální komponentou zdravé výživy je kromě živin (nutrientů) také rozpustná vláknina známá svým vysokým sytícím efektem.
Cílem této studie bylo sledování vlivu rozpustné vlákniny (Psyllium) a rozpustné vlákniny obohacené glukózou ve stejném objemu na postprandiální plazmatické hladiny orexigenního ghrelinu a putativního anorexigenu obestatinu u zdravých kontrolních žen a u žen s onemocněním bulimia nervosa (BN) s narušeným jídelním chováním a poruchami energetické rovnováhy (11).
SOUBOR NEMOCNÝCH A POUŽITÉ METODY
Studie byla provedena v souladu s Helsinskou deklarací a byla schválena etickou komisí Endokrinologického ústavu v Praze. Všechny účastnice podepsaly před zahájením studie informovaný souhlas s účastí ve studii.
Sledovaný soubor tvořilo šest žen s onemocněním bulimia nervosa diagnostikovaným podle DSM-IV (4th edition of the Diagnostic and Statistical Manual of Mental Disorders, American Psychiatric Association, 1994), (věk 26,6 ± 5,2 let; BMI 19,2 ± 1,44 kg/m2), hospitalizovaných na Psychiatrické klinice 1. LF UK a VFN v Praze, a šest zdravých žen (věk 23,83 ± 1,1 let; BMI 20,85 ± 0,87 kg/m2). Pacientky s BN byly klinicky stabilizované a relativně v dobrém zdravotním stavu s výjimkou jejich narušeného jídelního chování a amenorey. U těchto pacientek byla průměrná frekvence přejídání a zvracení 2,8× za den a průměrná délka onemocnění poruchou příjmu potravy 5 let a 6 měsíců. Všechny nemocné se zúčastnily studie týden po jejich přijetí k hospitalizaci na psychiatrické klinice. Zdravé kontrolní ženy netrpěly žádným akutním ani chronickým onemocněním, při odběrech krve byly ve folikulární fázi menstruačního cyklu. Obě skupiny žen naposledy konzumovaly potravu v 18.00 hodin v den před experimentem a byly požádány o celonoční hladovění. Všechny účastnice studie se dostavily k odběrům do Endokrinologického ústavu v 7.00 hodin ráno. Studie trvala 4 hodiny a sestávala z konzumace rozpustné vlákniny a krevních odběrů. Před jejím zahájením bylo měřeno tělesné složení metodou bioimpedance (Tanita, Japan), výška a hmotnost probandek a bylo provedeno standardní lékařské vyšetření.
Popis studie
Každá účastnice studie vypila během 15 minut 4 gramy rozpustné vlákniny (Psyllium) ve 300 ml vody (celkový energetický obsah 0,48 kJ). Po uplynutí jednoho týdne se tytéž ženy účastnily experimentu, při kterém během 15 minut vypily Psyllium obohacené o 78 g glukózy, společně rozpuštěné ve 300 ml vody (celkový energetický obsah 1255,5 kJ). V obou testech byla vláknina smíchána s vodou 12 hodin před konzumací.
Sledovaným ženám byla v 7.30 hodin po celonočním půstu odebírána krev z loketní žíly do zkumavek s Na2EDTA a aprotininem (inhibice proteáz) pro získání plazmy. První odběr byl proveden před jídlem v čase 0 a další odběry následovaly po jídle v časech 30, 60, 90, 150 a 210 minut. Bezprostředně po odběru byla krev uložena do ledové lázně, centrifugována 20 minut při 4o C a získaná plazma byla zamražena při -30o C až do doby stanovení vzorků (tab. 1).
Table 1. Preprandiální (0 min) a postprandiální (30, 60, 90, 150, 210 min) hladina plazmatického ghrelinu a obestatinu u pacientek s BN a u kontrolních žen. Počet kontrolních žen i pacientek je 6, hodnoty jsou uvedeny jako průměr ± SEM 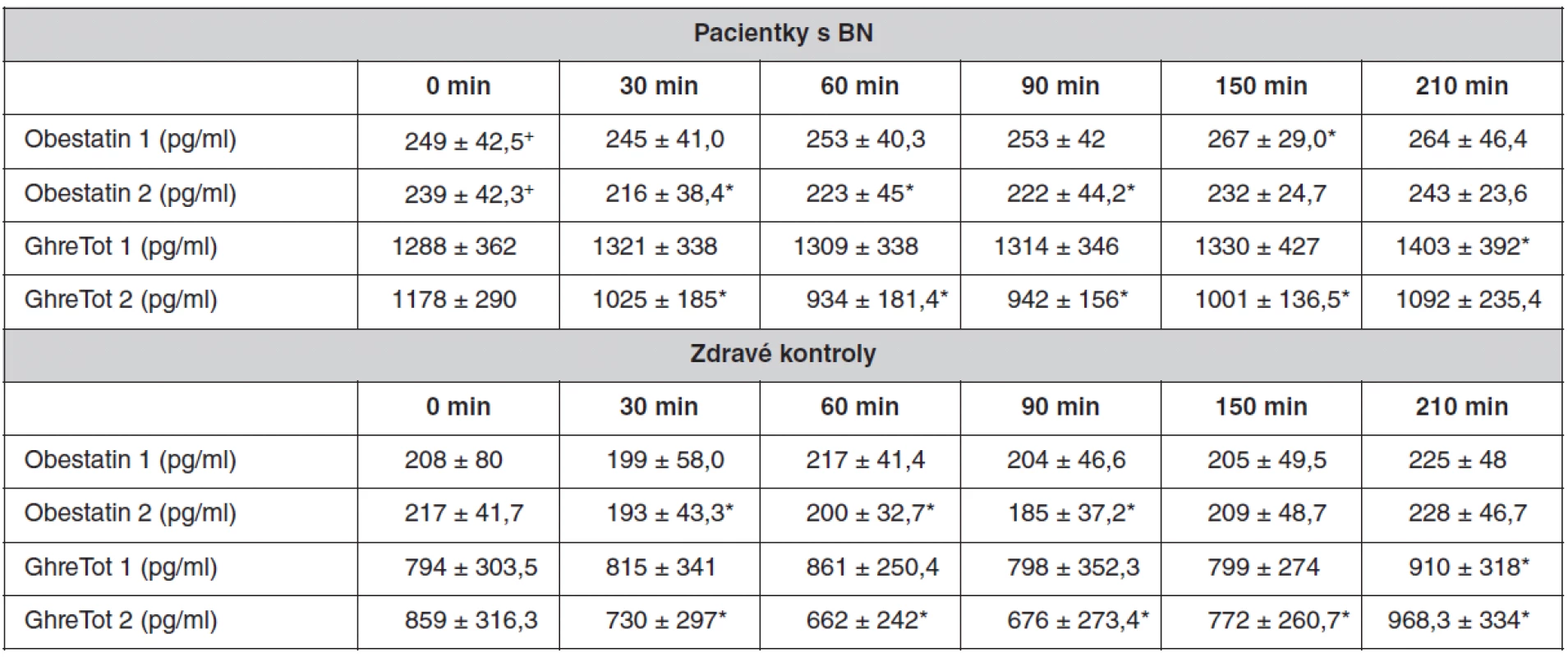
GhreTot 1 – plazmatické hladiny ghrelinu po podání rozpustné vlákniny GhreTot 2 – plazmatické hladiny ghrelinu po podání rozpustné vlákniny s glukózou Obestatin 1 – plazmatické hladiny obestatinu po podání rozpustné vlákniny Obestatin 2 – plazmatické hladiny obestatinu po podání rozpustné vlákniny s glukózou + hladina významnosti p < 0,05 bazální hodnoty obestatinu v plazmě mezi skupinami *označuje rozdíl v hladině hormonu ve srovnání s preprandiální hodnotou (čas 0 min), hladina významnosti p < 0,05 Analýza vzorků
Immunoreaktivita plazmatického obestatinu byla měřena komerčním radioimunologickým (RIA) kitem společnosti Phoenix Pharmaceuticals Inc., Belmont, CA, USA. Intra - a interassay variabilita byla 5,0 % a 14,2 %, senzitivita byla 50 pg/ml. Celkový plazmatický ghrelin byl stanoven komerčním kitem společnosti Linco Research, Inc., St. Charles, Missouri, USA. Intra - a interassay variabilita pro celkový ghrelin byla 6,4 % a 16,3 %, sensitivita byla 93 pg/ml.
Statistická analýza
Závislost hormonálních hladin na statutu pacienta a fázi jídelního testu byla vyhodnocena s užitím ANOVA modelu pro opakovaná měření zahrnujícího faktory subjekt, status pacienta a fáze jídelního testu. ANOVA model následovala vícenásobná porovnávání s užitím metody nejmenšího významného rozdílu. Pro testování byla zvolena hladina statistické významnosti p < 0,05. Z důvodu negaussovského rozdělení u všech závisle proměnných byly tyto podrobeny mocninným transformacím k dosažení distribuční symetrie a konstantního rozptylu v datech i reziduích.
VÝSLEDKY
V naší studii jsme zjistili postprandiální pokles plazmatických hladin celkového ghrelinu a obestatinu po konzumaci rozpustné vlákniny obohacené o glukózu, a to u zdravých žen i pacientek s BN. Bazální plazmatické hladiny ghrelinu nebyly u kontrolních žen a pacientek s BN významně odlišné, i když byl pozorován trend k vyšším hladinám u pacientek s BN (velké individuální odchylky). Bazální plazmatické hladiny obestatinu byly u pacientek s bulimia nervosa významně vyšší (p < 0,05).
Celkový plazmatický ghrelin poklesl u kontrolních žen z průměrné bazální hodnoty 859 ± 316 pg/ml na 662 ± 242 pg/ml v 60. minutě (největší pokles, p < 0,05). Podobně poklesla u zdravých žen plazmatická hladina obestatinu z průměrné bazální hodnoty 217 ± 41 na 185 ± 37 pg/ml v 90. minutě po podání vlákniny s glukózou (největší pokles, p < 0,05). U pacientek s BN poklesl celkový plazmatický ghrelin po podání vlákniny s glukózou z průměrné hladiny 1178 ± 290 pg/ml na hodnotu 934 ± 181 pg/ml v 60. minutě (největší pokles, p < 0,05). Plazmatické hladiny obestatinu poklesly u pacientek s BN po podání vlákniny s glukózou z průměrné bazální hodnoty 239 ± 42 pg/ml na 216 ± 38 pg/ml ve 30. min (největší pokles, p < 0,05). Podání samotné rozpustné vlákniny nevedlo ke statisticky významným změnám v plazmatických hladinách sledovaných hormonů, a to jak u zdravých žen, tak u pacientek s BN. Výjimkou byly hodnoty v poslední 210. minutě, kdy došlo k signifikantnímu zvýšení plazmatických hladin ghrelinu oproti preprandiálním hodnotám u obou sledovaných skupin (pacientky s BN: 1403 ± 392 pg/ml vs. 1288 ± 362 pg/ml, p < 0,05; kontroly: 910 ± 318 pg/ml vs. 794 ± 303, p < 0,05).
DISKUZE
V této studii byl sledován vliv konzumace nekalorické a kalorické stravy o stejném objemu na plazmatické hladiny orexigenního hormonu ghrelinu a putativního anorexigenu obestatinu v postprandiální době u zdravých žen a pacientek s BN. Tyto dva gastroinstestinální hormony jsou intenzivně sledovány. Předpokládá se, že se významně uplatňují v poruchách regulace příjmu potravy a pocitu sytosti, kam jsou řazeny zejména pacientky s onemocněním anorexia a bulimia nervosa. V předcházející studii jsme pozorovali podobný pokles plazmatických hladin ghrelinu a obestatinu u zdravých žen po snídani s převažujícím sacharidovým obsahem. Ukázali jsme, že sekrece obestatinu je vyšší ve srovnání s ghrelinem u BN pacientek v porovnání s jejich sekrecí u zdravých žen (2).
V této studii jsme pozorovali signifikantně vyšší bazální plazmatické hladiny obestatinu (p < 0,05), ne však ghrelinu (vyšší rozptyl hodnot), u pacientek s BN oproti kontrolním ženám, přestože obě skupiny měly obdobný body mass index (BMI). Tanaka et al. (12) pozoroval vyšší hladiny ghrelinu u pacientek s BN se stejným BMI, jako měly zdravé ženy. Konzumace rozpustné vlákniny obohacené glukózou vyvolala u našich probandek pokles plazmatických hladin jak ghrelinu, tak i obestatinu. Sekrece ghrelinu a obestatinu je stimulovaná řadou faktorů, jako jsou nervové faktory (prostřednictvím n. vagus), mechanické (distenze žaludku) nebo chemické faktory (obsah a složení makronutrientů v potravě). Odpověď plazmatického ghrelinu na stravu může být ovlivněna typem nutrientů a celkovým energetickým obsahem dané potravy, jak jsme již dříve, podobně jako i jiní autoři, pozorovali u pacientek s mentální anorexií po standardní snídani (1, 13–15). Námi pozorovaný pokles plazmatických hladin ghrelinu a současně i obestatinu po podání vlákniny s glukózou může poukazovat na význam jak ghrelinu, tak obestatinu při regulaci příjmu potravy u lidí.
Neočekávaně jsme pozorovali, že po podání samotné rozpustné vlákniny jak zdravým ženám, tak pacientkám s BN nedošlo k významným změnám v plazmatických hladinách ghrelinu i obestatinu s výjimkou posledního sledovaného času (210. minuta). To znamená, že pokles plazmatického ghrelinu a obestatinu byl odlišný po kalorické a nekalorické stravě u obou sledovaných skupin.
Shiiya et al. (16) zjistili u zdravých osob, že plazmatická hladina ghrelinu klesá rovněž po intravenózním podání glukózy, což znamená, že sekrece ghrelinu nemusí být ovlivněna jen průchodem jídla žaludkem, tedy jeho expanzí (16). Tyto nálezy by mohly ukazovat, že akutní odpověď plazmatické hladiny ghrelinu a obestatinu je pouze částečně závislá na přítomnosti potravy v žaludku, ale pravděpodobně také záleží na nutriční hodnotě potravy a její odezvě ve změně hladiny glukózy v krvi a aktivaci jiných tkání mimo žaludek. Záleží i na trvání příjmu potravy.
ZÁVĚR
Závěrem konstatujeme, že rozpustná vláknina obohacená glukózou významně modifikovala postprandiální signál pocházející z gastrointestinálního traktu; výsledky ukázaly, že krátkodobá odpověď plazmatické hladiny ghrelinu a obestatinu je závislá na kalorické hodnotě stravy téhož objemu jak u pacientek s BN, tak u zdravých žen. Výsledky této studie ukazují spíše na paralelní změny sekrece ghrelinu a obestatinu za fyziologických podmínek, ale také za patologických podmínek charakterizovaných energetickou nerovnováhou, což nás vede k úvaze, že porušený metabolický stav může potenciálně ovlivnit expresi preproghrelinového genu nebo úpravu produktů jeho exprese. Rozhodující vliv na příjem potravy a energetickou homeostázu by mohl rovněž záviset na poměru ghrelinu a obestatinu. Pro objasnění základních mechanismů spojených s chronickou potravní deprivací, jako je u pacientek s BN, je třeba provést další studie.
Zkratky
BMI – body mass index
BN – bulimia nervosa
SEM – střední chyba průměru
Práce vznikla za podpory grantu č. NR/ 9158-3 IGA MZ ČR a Výzkumného záměru MZOVFN2005.
Rádi bychom poděkovali paní Dianě Riegerové, Nadeždě Procházkové, Janě Novotné a Romaně Bajtlové za jejich technickou asistenci.
Adresa pro korespondenci:
RNDr. Jara Nedvídková, PhD.
Endokrinologický ústav
Národní 8, 116 94 Praha 1
fax: +420 224 905 325, e-mail: jnedvidkova@endo.cz
Sources
1. Nedvídková J, Krykorková I, Barták V, Papežová H, Gold PW, Alesci S, Pacak K. Loss of meal-induced decrease in plasma ghrelin levels in patients with anorexia nervosa. J Clin Endocrinol Metab 2003; 88 : 1678–1682.
2. Sedláčková D, Dostálová I, Hainer V, Beranová L, Kvasničková H, Hill M, Haluzik M, Nedvídková J. Simultaneous Decrease of Plasma Obestatin and Ghrelin Levels after a High-Carbohydrate Breakfast in Healthy Women. Physiol Res 2008; 57(Suppl 1): S29.
3. Gasco V, Beccuti G, Marotta F, Benso A, Granata R, Broglio F, Ghigo E. Endocrine and Metabolic Actions of Ghrelin. Endocr Dev 2010; 17 : 86–95.
4. Zhang JV, Ren PG, Avsian-Kretchmer O, Luo CW, Rauch R, Klein C, Hsueh AJ. Obestatin, a peptide encoded by the ghrelin gene, opposes ghrelin’s effects on food intake. Science 2005; 310 : 996–999.
5. Lagaud GJ, Young A, Acena A, Morton MF, Barrett TD, Shankley NP. Obestatin reduces food intake and suppresses body weight gain in rodents. Biochem Biophys Res Commun 2007; 357 : 264–269.
6. Germain N, Galusca B, Grouselle D, Frere D, Tolle V, Zizzari P, Lang F, Epelbaum J, Estour B. Ghrelin/obestatin ratio in two populations with low bodyweight: Constitutional thinness and anorexia nervosa. Psychoneuroendocrinology 2009; 34 : 413–419.
7. Gourcerol G, Coskun T, Craft LS, Mayer JP, Heiman ML, Wang L, Million M, St-Pierre DH, Taché Y. Preproghrelin-derived peptide, obestatin, fails to influence food intake in lean or obese rodents. Obesity 2007; 15 : 2643–2652.
8. Monteleone P, Serritella C, Martiadis V, Scognamiglio P, Maj M. Plasma obestatin, ghrelin, and Ghrelin/obestatin ratio are increased in underweight patients with anorexia nervosa but not in symptomatic patients with bulimia nervosa. J Clin Endocrinol Metab 2008; 93 : 4418–4421.
9. Nakahara T, Harada T, Yasuhara D, Shimada N, Amitani H, Sakoguchi T, Kamiji MM, Asakawa A, Inui A. Plasma obestatin concentrations are negatively correlated with body mass index, insulin resistance index, and plasma leptin concentrations in obesity and anorexia nervosa. Biol Psychiatry 2008; 64 : 252–255.
10. Zamrazilová H, Hainer V, Sedláčková D, Papežová H, Kunešová M, Bellisle F, Hill M, Nedvídková J. Plasma obestatin levels in normal weight, obese and anorectic women. Physiol Res 2008; 57(Suppl 1): S49–S55.
11. Vitiello B, Lederhendler I. Research on eating disorders: current status and future prospects. Biol Psychiatry 2000; 47 : 777–786.
12. Tanaka M, Tatebe Y, Nakahara T, Yasuhara D, Sagiyama K, Muranaga T, Ueno H, Nakazato M, Nozoe S, Naruo T. Eating pattern and the effect of oral glucose on ghrelin and insulin secretion in patients with anorexia nervosa. Clin Endocrinol 2003; 59 : 574–579.
13. Erdmann J, Töpsch R, Lippl F, Gussmann P, Schudziarra V. Postprandial response of plasma ghrelin levels to various test meals in relation to food intake, plasma insulin and glucose. J Clin Endocrinol Metab 2004; 89 : 3048–3054.
14. Nakai Y, Hosoda H, Nin K, Ooya C, Hayashi H, Akamizu T, Kangawa K. Short-term secretory regulation of the active form of ghrelin and total ghrelin during an oral glucose tolerance test in patients with anorexia nervosa. Eur J Endocrinol 2004; 150 : 913–914.
15. Otto B, Tschöp M, Frühauf E, Heldwein W, Fichter M, Otto C, Cuntz U. Postprandial ghrelin release in anorectic patients before and after weight gain. Psychoneuroendocrinology 2005; 30 : 577–581.
16. Shiiya T, Nakaqzato M, Mizuta M, Date Y, Mondal MSW, Tanaka M, Nozoe S, Hosoda H, Kangawa K, Matsukura S. Plasma ghrelin levels in lean and obese humans and the effect of glucose on ghrelin secretion. J Clin Endocrinol Metab 2002; 87 : 240–244.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- Farmakoterapie obezity – současné možnosti a perspektivy
- Promotorový polymorfismus (TTTTA)n genu CYP11A1 v patogenezi syndromu polycystických ovarií
- Vztah sekrece a působení inzulínu – studium genetické determinace
- Současný stav stravování a pohybové aktivity ve vztahu k obezitě u sedmiletých dětí – studie WHO
- Redukce abdominální obezity a kardiometabolických rizik u obézních adolescentů krátkodobým lázeňským redukčním programem
- Změny plazmatických hladin obestatinu a ghrelinu po podání rozpustné vlákniny s glukózou a samotné vlákniny zdravým ženám a pacientkám s bulimia nervosa
- Primární hyperparatyreóza jako příčina hyperkalcémie u pacientky s karcinomem prsu
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Farmakoterapie obezity – současné možnosti a perspektivy
- Primární hyperparatyreóza jako příčina hyperkalcémie u pacientky s karcinomem prsu
- Vztah sekrece a působení inzulínu – studium genetické determinace
- Současný stav stravování a pohybové aktivity ve vztahu k obezitě u sedmiletých dětí – studie WHO
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

