-
Medical journals
- Career
Závažná kožní toxicita po léčbě ifosfamidem, gemcitabinem a vinorelbinem u pacienta s relapsem Hodgkinova lymfomu a ichtyózou
Authors: H. Mociková 1; E. Konířová 1; J. Stříteský 2
Authors‘ workplace: Univerzita Karlova v Praze, 1. lékařská fakulta, I. interní klinika – klinika hematologie VFN 1; Univerzita Karlova v Praze, Ústav patologie 1. LF 2
Published in: Čas. Lék. čes. 2009; 148: 434-437
Category: Case Report
Overview
U 47letého pacienta s dlouholetou anamnézou ichtyózy byl biopticky prokázán klasický Hodgkinův lymfom, nodulárně sklerotický podtyp, klinické stadium IIB s postižením krčních a axilárních uzlin. Histologické vyšetření kůže prokázalo přítomnost lichenoidních zánětlivých změn. Pacient byl v úvodu léčen šesti cykly kombinované chemoterapie (doxorubicin, bleomycin, vinblastin, dakarbazin). Patnáct měsíců po ukončení léčby byl z biopsie zvětšené uzliny diagnostikován relaps Hodgkinova lymfomu. Rozsah postižení byl stejný jako na počátku. Pacient byl úspěšně léčen šesti cykly chemoterapie obsahující ifosfamid, karboplatinu a etoposid s následnou radioterapií. První ani druhá chemoterapie nevedly k závažné kožní toxicitě. Přibližně po čtyřech letech od ukončení druhé linie léčby byl u pacienta diagnostikován druhý relaps Hodgkinova lymfomu s postižením axilárních a inguinálních uzlin. Histologicky byly v kůži přítomny opět pouze necharakteristické lichenoidní změny. Pacient byl léčen třemi cykly chemoterapie obsahující ifosfamid, gemcitabin, vinorelbin a prednison. Po každém cyklu této léčby došlo k rozvoji těžké neutropenie (WHO 4) s následnou těžkou difuzní toxoalergickou kožní reakcí a s bulózním erytémem. Místy bylo možno hodnotit kožní změny až stupněm 3 a 4 dle WHO. Stav jsme hodnotili jako kombinovaný toxický účinek gemcitabinu a vinorelbinu v terénu kůže poškozené preexistující ichtyózou. Po odeznění kožní toxicity bylo zbytkové uzlinové postižení ozářeno.
Klíčová slova:
Hodgkinův lymfom, ichtyóza, gemcitabin, vinorelbin.Úvod
V léčbě relapsů Hodgkinova lymfomu (HL) se v poslední době uplatňují kombinované chemoterapie s použitím gemcitabinu. Obvykle mají příznivý profil toxicity. Závažná kožní toxicita u nich nebyla popsána (1, 2).
Ichtyóza je heterogenní skupina různě závažných onemocnění se suchou, ztluštělou a šupinatějící kůží. U HL se může vyskytnout jako paraneoplastický projev (3, 4). Naše práce popisuje pacienta s opakovaným relapsem HL a s mnohaletou anamnézou celotělové ichtyózy. Po kombinované chemoterapii IGEV (ifosfamid, gemcitabin, vinorelbin a prednison) došlo ke vzniku závažné kožní toxicity 3. a 4. stupně dle WHO. Předpokládáme, že na této těžké akutní toxicitě se podílel toxický účinek gemcitabinu a vinorelbinu v terénu kůže poškozené preexistující ichtyózou.
Kazuistika
U 47letého muže s anamnézou ichtyózy od roku 1989, která byla léčena jen lokální léčbou, byl v únoru 2002 v krční uzlině (LU) biopticky prokázán klasický Hodgkinův lymfom, nodulárně sklerotický podtyp. Provedené biopsie kůže diagnostikovaly jen nespecifické zánětlivé změny, ale infiltrace kůže lymfomem nebyla prokázaná. Klinickým vyšetřením a zobrazovacími metodami bylo u pacienta potvrzeno klinické stadium IIB (infiltrace oboustranných krčních a axilárních LU). Pacient byl léčen od prosince 2002 do května 2003 celkem šesti cykly chemoterapie ABVD (adriamycin, bleomycin, vinblastin, dakarbazin), po kterých byla dosažena kompletní remise. Léčba byla provázena přechodným mírným zhoršením ichtyózy.
V srpnu 2004 byl v krční LU histologicky zjištěn relaps HL. Klinickým vyšetřením a pomocí zobrazovacích metod bylo vyhodnoceno klinické stadium IIB (postižení oboustranných krčních a axilárních LU). V biopsiích kůže byl opět jen necharakteristický zánětlivý nález, nádorové změny nebyly prokázány. Pacient byl léčen od září 2004 do února 2005 celkem šesti cykly chemoterapie ICE (ifosfamid, karboplatina, etoposid) a následnou radioterapií cílenou na pravou axilu při pozitivním nálezu pozitronové emisní tomografie (PET) v dané lokalizaci. Po ukončené terapii byla v březnu 2005 konstatována druhá kompletní remise. Ichtyóza se v průběhu chemoterapie a radioterapie přechodně mírně zhoršila.
V prosinci 2008 byl u pacienta v biopsii inguinální LU vlevo prokázán druhý relaps HL (obr. 1). Pomocí výpočetní tomografie (CT) a PET bylo klinické stadium hodnoceno jako IIIA (postižení axilární LU vlevo a oboustranných inguinálních LU). U pacienta byla dvakrát provedena kožní biopsie, vždy jen s nepříznačným nálezem chronických zánětlivých změn s lichenoidními rysy bez infiltrace HL (obr. 2). Klinickému obrazu dominoval celotělový, nesvědivý a olupující se exantém s maximem na břiše, bocích a hýždích.
Image 1. Krční lymfatická uzlina, klasický Hodgkinův lymfom, nodulární skleróza (hematoxylin – eozin, objektiv 40×) 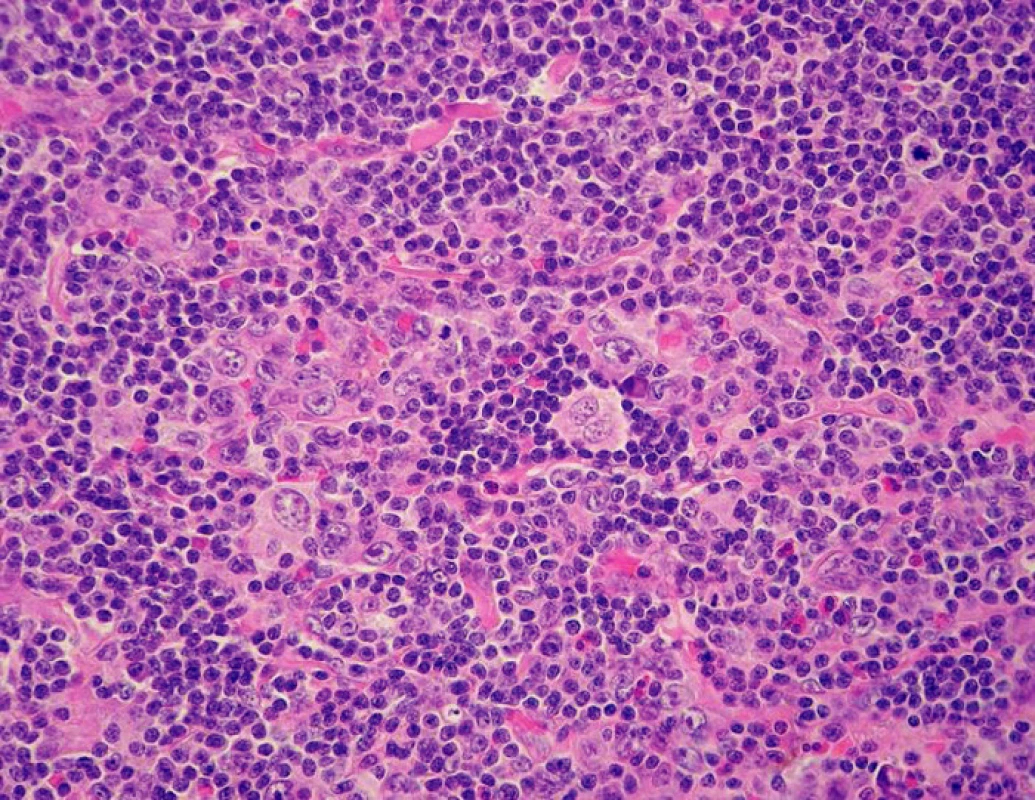
Image 2. Kůže, zánětlivý infiltrát lichenoidního typu (hematoxylin – eozin, objektiv 40×) 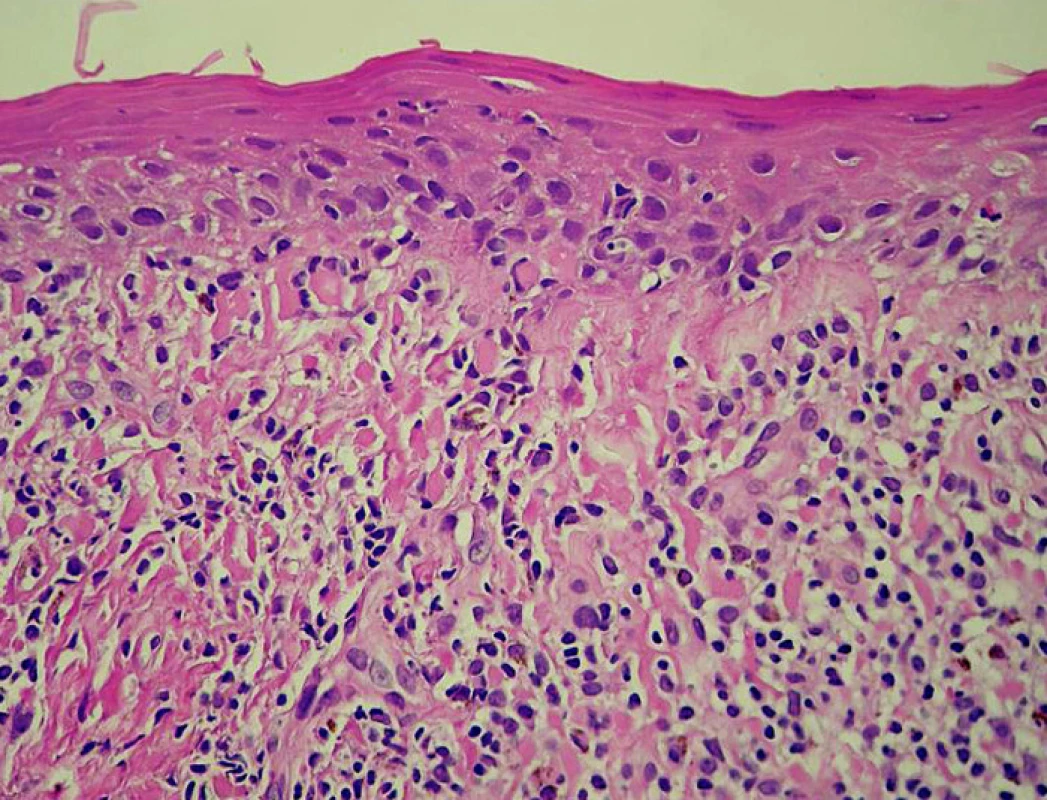
Ve třetí linii léčby od ledna do března 2009 byly podány celkem tři cykly chemoterapie IGEV (ifosfamid, gemcitabin, vinorelbin, prednison). Všechny cykly byly provázeny závažnou hematologickou toxicitou (neutropenií, anémií a trombocytopenií 4. stupně dle WHO) a vývojem febrilní neutropenie s opakovanou sepsí. Po každém cyklu IGEV došlo k difuzní těžké toxoalergické kožní reakci s bulózním erytémem a kožní toxicita dosahovala místy 3. a 4. stupně dle WHO. Toxicita byla patrná pouze na kůži postižené ichtyózou (obr. 3). Mimo komplexní podpůrnou léčbu febrilní neutropenie a sepse vyžadovala kožní toxicita aplikaci systémových kortikoidů, antihistaminik a lokální léčbu krémem s 3% dexametasonem, ambidermanem a chloramfenikolem a následně lokální léčbu krémem s 0,02% dexametasonem a cutilanem. Několik míst kůže bylo přechodně kryto sterilními biologickými kožními kryty (Xe Dermou) (obr. 4).
Image 3. Kožní toxicita po chemoterapii IGEV u pacienta s Hodgkinovým lymfomem 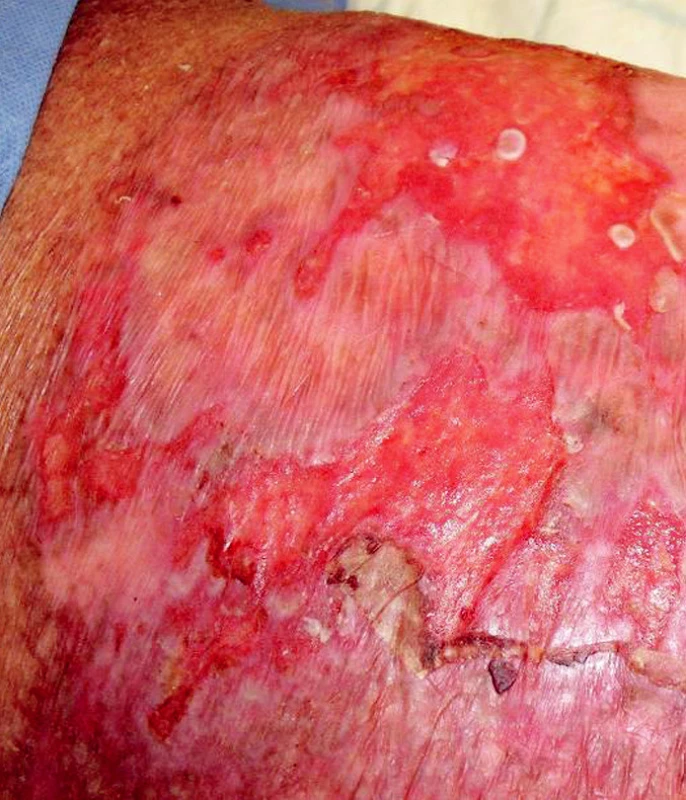
Image 4. Kožní defekt krytý Xe Dermou (biologický kožní kryt) 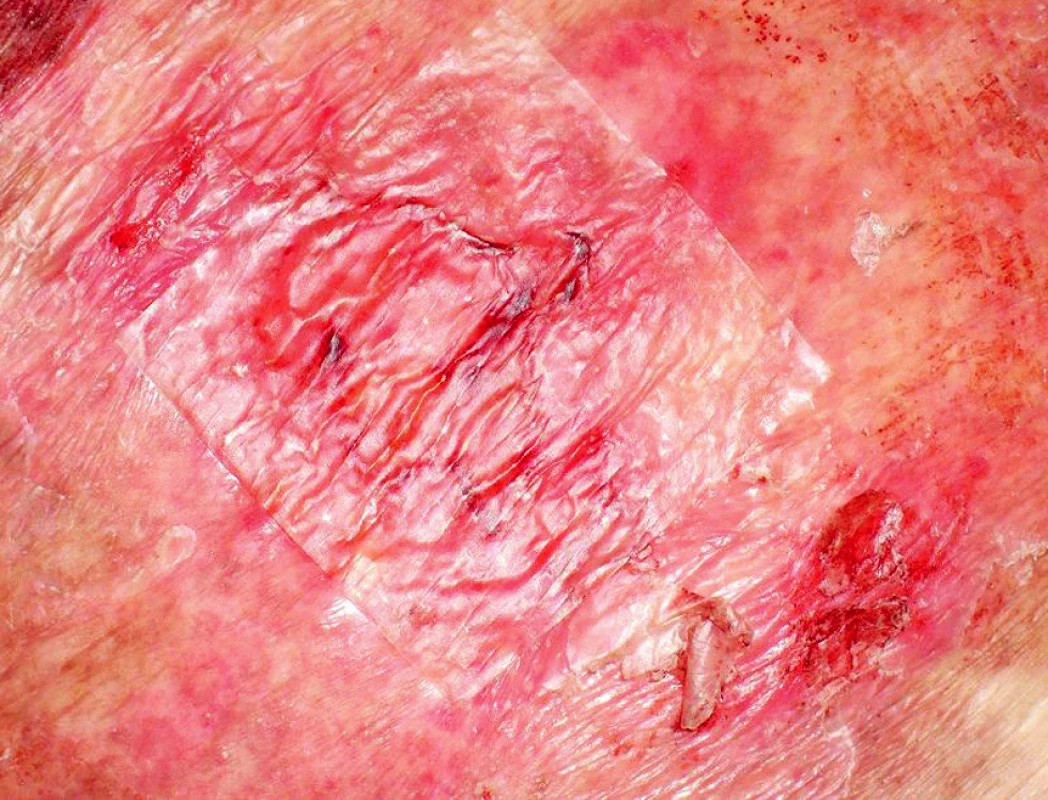
Po úpravě krevního obrazu a odeznění akutní toxicity chemoterapie pokračoval pacient v květnu 2009 radioterapií oblasti axilárních LU vlevo a oboustranných inguinálních LU.
Diskuze
Kožní postižení se u HL vyskytuje společně s lymfadenopatií v 0,5–7,5% nebo zřídka samostatně (5–8). Z lymfatických uzlin se nádor do kůže šíří přímo, hematogenním rozsevem nebo lymfatickými cestami (9). Charakteristickými kožními projevy infiltrace HL jsou papuly na trupu a končetinách. K necharakteristickým projevům kožního postižení patří erytém, vezikuly nebo buly a projevy spojené s infekcí (např. varicella-zoster). Může se přidružit lymfomatoidní papulóza, jejíž odlišení od HL může být obtížné.
Získaná ichtyóza se vyskytuje u nehodgkinských lymfomů a u HL jako paraneoplastický projev (10–12). Kromě ichtyózy ke kožním paraneoplastickým projevům u lymfomů patří psoriáziformní postižení, pemfigus, paraneoplastická akrokeratóza a kožní vaskulitida (13–16).
Infiltrace HL byla u našeho pacienta vyloučena opakovaným histologickým vyšetřením kůže v úvodu a v relapsech. Ichtyóza byla diagnostikována 13 let před HL, proto jednoznačnou kauzální souvislost s HL nelze potvrdit. Léčba první linie (ABVD) a prvního relapsu (ICE a radioterapie) způsobily pouze mírné zhoršení ichtyózy s celotělovým olupujícím se exantémem, které po ukončení léčby vymizelo. Ve druhém relapsu HL byla opět již před léčbou kůže celého těla postižena ichtyózou.
V léčbě relapsů Hodgkinova lymfomu se v současnosti uplatňují kombinace chemoterapie s gemcitabinem s celkovou odpovědí na léčbu 20–81 % (2, 17–24). Proto byl ve druhém relapsu zvolen režim IGEV. Po každém cyklu chemoterapie IGEV došlo k výraznému zhoršení kožního nálezu s toxoalergickou kožní reakcí a místy i k rozvoji kožní toxicity 3. a 4. stupně dle WHO. Těžká toxicita byla patrná pouze na kůži postižené ichtyózou bez závažného postižení sliznic. Závažný kožní nález byl hodnocen jako kombinovaný toxický účinek gemcitabinu a vinorelbinu v terénu kůže poškozené preexistující ichtyózou. Ifosfamid byl u pacienta použit v léčbě prvního relapsu a nezpůsobil závažnou kožní toxicitu v kombinaci s karboplatinou a etoposidem. Faktorem, který mohl dále zhoršit integritu kůže, byla neutropenie s počtem neutrofilních leukocytů < 1,0 × 109/l, která trvala 6–7 dní po každém cyklu IGEV. Zajímavé je, že i při hluboké neutropenii byla pozorována mukositida maximálně druhého stupně dle WHO. V literatuře po čtyřech cyklech IGEV u 91 léčených pacientů kožní toxicita nebyla popsána, jenom mukositida 3. až 4. stupně v 0,3–1,9 % v souvislosti s neutropenií (2). U dvou z 30 dětí s relapsem HL byla v průběhu léčby gemcitabinem s vinorelbinem pozorována mukositida 3. a 4. stupně (25). Samotný gemcitabin nebo jeho metabolity mohou způsobit erysipeloidní zarudnutí v oblasti omezené lymfatické drenáže – při lymfedému u solidních nádorů (26). Gemcitabin je rychle metabolizován a vylučuje se ledvinami. V oblastech s omezenou lymfatickou drenáží je změněná farmakokinetika: Zpomaluje se inaktivace a dochází k akumulaci léku v podkoží a kůži, tím se zvýší jeho toxicita v daném místě. Po léčbě gemcitabinem byla popsána bulozní dermatóza, která vymizela po vysazení léku (27).
Ifosfamid v kombinaci s etoposidem a epirubicinem vede u 80 % pacientů k odpovědi u relabujících nehodgkinských a hodgkinských lymfomů bez závažné kožní toxicity (28). Ifosfamid způsobuje vzácně nespecifické dermatitidy a hyperpigmentace, které mohou přetrvávat řadu měsíců po skončení léčby. Ifosfamid v kombinaci s vinorelbinem byl použit u pacientů s relabujícím nebo refraktérním HL s dosažením 83% odpovědí a s mírnou nehematologickou toxicitou bez závažné kožní toxicity (29). Po chemoterapii MINE (mitoguazon, ifosfamid, vinorelbin a etoposid) byl popsán u HL podkožní edém se zánětem, který byl hodnocen jako následek aplikace vinorelbinu při jeho známé vaskulární toxicitě (30).
I při tak závažné kožní toxicitě u našeho pacienta bylo možné komplexní podpůrnou léčbou včetně lokálního ošetření komplikace zvládnout a pacient následně absolvoval radioterapii na zbytkovou nemoc.
Zkratky
ABVD – adriamycin, bleomycin, vinblastin, dakarbazin
CT – počítačová tomografie
HL – Hodgkinův lymfom
ICE – ifosfamid, karboplatina, etoposid
IGEV – ifosfamid, gemcitabin, vinorelbin a prednison
LU – lymfatická uzlina
MINE – mitoguazon, ifosfamid, vinorelbin a etoposid
PET – pozitronová emisní tomografie
Adresa pro korespondenci:
MUDr. Heidi Mociková, PhD.
I. interní klinika 1. LF UK a VFN
U Nemocnice 2, 128 08 Praha 2
fax: +420 224 963 556, e-mail: heidi.mocikova@seznam.cz
Sources
1. Oki Y, Younes A. Current role of gemcitabine in the treatment of Hodgkin lymphoma. Leuk Lymphoma 2008; 49 : 883–889.
2. Santoro A, Magagnoli M, Spina M, et al. Ifosfamide, gemcitabine, and vinorelbine: a new induction regimen for refractory and relapsed Hodgkin‘s lymphoma. Haematologica 2007; 92 : 35–41.
3. Rizos E, Milionis HJ, Pavlidis N, Elisaf MS. Acquired icthyosis: a paraneoplastic skin manifestation of Hodgkin‘s disease. Lancet Oncol 2002; 3 : 727.
4. Ennibi K, Rabhi M, Al Bouzidi A, et al. Acquired ichthyosis revealing a Hodgkin‘s disease. Rev Med Interne 2008; 29 : 418–420.
5. Introcaso CE, Kantor J, Porter DL, Junkins-Hopkins JM. Cutaneous Hodgkin‘s disease J Am Acad Dermatol 2008; 58 : 295–298.
6. Rubenstein M, Duvic M. Cutaneous manifestations of Hodgkin‘s disease. Int J Dermatol 2006; 45 : 251–256.
7. Jain S, Nigam S, Kumar N, Reddy BS. Cutaneous relapse in Hodgkin‘s disease: a case report. Acta Cytol 2005; 49 : 191–194.
8. Guitart J, Fretzin D. Skin as the primary site of Hodgkin‘s disease: a case report of primary cutaneous Hodgkin‘s disease and review of its relationship with non-Hodgkin‘s lymphoma Am J Dermatopathol 1998; 20 : 218–222.
9. Pagliaro JA, White SI. Specific skin lesions occurring in a patient with Hodgkin‘s lymphoma. Australas J Dermatol 1999; 40 : 41–43.
10. Estines O, Grosieux-Dauger C, Derancourt C, et al. Paraneoplastic acquired ichthyosis revealing non-Hodgkin’s lymphoma. Ann Dermatol Venereol 2001; 128 : 31–34.
11. Rabhi M, Ennibi K, Harket A, et al. Acquired ichthyosis disclosing non-Hodgkin’s malignant lymphoma. Internal Medicine 2007; 46 : 397–399.
12. Ghislain PD, Roussel S, Marot L, et al. Acquired ichthyosis disclosing Hodgkin‘s disease. Simultaneous recurrence. Presse Med 2002; 31 : 1126–1128.
13. Milionis HJ, Elisaf MS. Psoriasiform lesions as paraneoplastic manifestation in Hodgkin’s disease. Ann Oncol 1998; 9 : 449–452.
14. Batista MD, Takano D, Lopes RD, et al. Paraneoplastic pemfigus associated with non-Hodgkin lymphoma. Dermatol Online J 2008; 14 : 11.
15. Lucker GP, Steijlen PM. Acrokeratosis paraneoplastica (Bazex syndrome) occurring with acquired ichthyosis in Hodgkin‘s disease. Br J Dermatol 1995; 133 : 322–325.
16. Simon Z, Tarr T, Tóth L, et al. Cutaneous vasculitis as an initiating paraneoplastic symptom in Hodgkin lymphoma. Rheumatol Int 2008; 28 : 719–723.
17. Todd T, Raj S, Camilleri D. Intermediate dose gemcitabine-cisplatin combination chemotherapy without treatment delay for cytopenia followed by autografting – a new standard of care in relapsed or refractory Hodgkin lymphoma? Ann Hematol 2009 May 6. doi10.1007/s00277-009-0734-6.
18. Oki Y, Pro B, Fayad LE, et al. Phase 2 study of gemcitabine in combination with rituximab in patients with recurrent or refractory Hodgkin lymphoma. Cancer 2008; 112 : 831–836.
19. Validire P, Fermé C, Brice P, et al. A multicenter study of gemcitabine-containing regimen in relapsed or refractory Hodgkin‘s lymphoma patients. Anticancer Drugs 2008; 19 : 309–315.
20. Mendler JH, Kelly J, Voci S, et al. Bortezomib and gemcitabine in relapsed or refractory Hodgkin‘s lymphoma. Ann Oncol 2008; 19 : 1759–1764.
21. Cashen AF, Bartlett NL. Salvage regimens for Hodgkin lymphoma. Clin Adv Hematol Oncol 2008; 6 : 517–524.
22. Bartlett NL, Niedzwiecki D, Johnson JL, et al. Gemcitabine, vinorelbine, and pegylated liposomal doxorubicin (GVD), a salvage regimen in relapsed Hodgkin’s lymphoma: CALGB 59804. Ann Oncol 2007; 18 : 1071–1079.
23. Müller-Beissenhirtz H, Kasper C, Nückel H, Dührsen U. Gemcitabine, vinorelbine and prednisone for refractory or relapsed aggressive lymphoma, results of a phase II single center study. Ann Hematol 2005; 84 : 796–801.
24. Chau I, Watkins D, Cunningham D. Gemcitabine and its combinations in the treatment of malignant lymphoma. Clin Lymphoma 2002; 3 : 97–104.
25. Cole PD, Schwartz CL, Drachtman RA, et al. Phase II study of weekly gemcitabine and vinorelbine for children with recurrent or refractory Hodgkinęs disease: A Children’s Oncology Group report. J Clin Oncol 2009; 27 : 1456–1461.
26. Brandes A, Reichmann U, Plasswilm L, Bamberg M. Time - and dose-limiting erysipeloid rash confined to ares of lymphedema following treatment with gemcitabine a report of three cases. Anticancer drugs 2000; 11 : 15–17.
27. Imen A, Amal K, Ines Z. Bullous dermatosis associated with gemcitabine therapy for non-small-cell lung carcinoma. Respir Med 2006; 100 : 1463–1465.
28. Bishton M, Lush RJ, Byrne JL. Ifosfamide, etoposide and epirubicin is an effective combined salvage and peripheral blood stem cell mobilisation regimen for transplant-eligible patients with non-Hodgkin lymphoma and Hodgkin disease. Br J Hematol 2007; 136 : 752–761.
29. Bonfante V, Viviani S, Devizzi L, et al. High-dose ifosfamide and vinorelbine as salvage therapy for relapsed or refractory Hodgkin’s disease. Eur J Haematol Suppl 2001; 64 : 51–55.
30. Maubec E, Oberlin O, Belhadi K, Roujeau JC. Subcutaneous inflammatory edema induced by MINE chemotherapy. Ann Dermatol Venereol 2001; 128 : 534–537.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- Chraňte děti před počítači a počítače před dětmi
- K diskuzi o etikoterapii
- Analýza anamnestických dat a výsledků vyšetření v souboru 353 nemocných s plicním karcinomem z let 2004–2007
- Zmírňování koktavosti bronchodilatací β2 sympatomimetikem formoterolem
- Závažná kožní toxicita po léčbě ifosfamidem, gemcitabinem a vinorelbinem u pacienta s relapsem Hodgkinova lymfomu a ichtyózou
- ROC analýza a využití analýzy nákladů a přínosů k určení optimálního dělícího bodu
- Vydechovaný oxid dusnatý a jeho korelace s bioptickými nálezy u pacientů s chronickým kašlem
- Subakutní tyreoiditida zaměněna za zubní problém
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- ROC analýza a využití analýzy nákladů a přínosů k určení optimálního dělícího bodu
- Subakutní tyreoiditida zaměněna za zubní problém
- Vydechovaný oxid dusnatý a jeho korelace s bioptickými nálezy u pacientů s chronickým kašlem
- Zmírňování koktavosti bronchodilatací β2 sympatomimetikem formoterolem
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

