-
Medical journals
- Career
Analýza anamnestických dat a výsledků vyšetření v souboru 353 nemocných s plicním karcinomem z let 2004–2007
Authors: M. Marel 1; F. Krejbich 1; P. Stránská 1; O. Měřička 1; J. Homolka 1; Z. Skácel 1; M. Zemanová 2
Authors‘ workplace: Univerzita Karlova v Praze, 1. lékařská fakulta, I. klinika TRN VFN 1; Univerzita Karlova v Praze, 1. lékařská fakulta, Onkologická klinika VFN 2
Published in: Čas. Lék. čes. 2009; 148: 416-423
Category: Original Article
Overview
Východisko.
Incidence bronchogenního karcinomu (BCA) u mužů v České republice od poloviny devadesátých let 20. století mírně poklesla, avšak stále je jednou z nejvyšších v Evropě i ve světě. U žen naopak trvá nárůst. K bližšímu posouzení výskytu symptomů a jejich významu pro diagnostiku, léčbu a prognózu jsme provedli na I. klinice TRN retrospektivní studii.Metody a výsledky.
V letech 2004–2007 zde bylo diagnostikováno 353 nemocných s BCA. Poměr mužů k ženám byl 2 : 1. Výskyt symptomů v době diagnózy byl následující: kašel 69 %, dušnost různého stupně 54 %, hubnutí 49 %, expektorace 39 %, bolesti na hrudníku 37 %, hemoptýza 17,7 %, teploty 16 %, syndrom horní duté žíly 3,7 % nemocných. Kuřáci v porovnání s nekuřáky onemocněli ve významně mladším věku 64 vs. 73 let. Chronickou obstrukční plicní nemoc (CHOPN) mělo 40 % nemocných, převažoval u nich epidermoidní typ. Z morfologických typů plicních nádorů byly nejčastější epidermoidní karcinom 22,1 %. Operovaných bylo 18,1 % celého souboru.
Dále jsme mezi mnoha nálezy hledali souvislosti, které by mohly přispět k časnější diagnostice. Prokázali jsme, že nemocní s centrálním typem tumoru častěji a silněji kašlali a měli častěji přímé známky tumoru zjištěné při bronchoskopii. Dále, že nemocní v TNM stadiu IV významně častěji trpěli teplotou a bolestmi. Významně méně bylo operováno nemocných s dušností a hubnutím, u kterých byl i významně nižší usilovný výdech za první vteřinu (FEV1). Nižší byla rovněž hodnota FEV1 u osob s centrálním nádorem ve srovnání s periferním typem. Pokud byly přímé známky tumoru zjištěné při bronchoskopii, byly nižší FEV1 a usilovná vitální kapacita (FVC), nemocní byli častěji symptomatičtí a měli častěji hemoptýzu. Dušnost korelovala s hodnotou PaO2, nikoli však s hladinou PaCO2. C-reaktivní protein (CRP) byl nižší u periferních nádorů, vyšší u centrálních a dále byl vyšší u malobuněčného typu. Nemocní s nadužíváním alkoholu onemocněli ve významně mladším věku. Údaj o hemoptýze nekoreloval s počtem vykouřených cigaret. Další souvislosti, které by mohly přispět ke zkvalitnění diagnostiky, jsou uvedeny v našem sdělení.Závěry.
Potvrdili jsme, že řádná anamnéza a vyšetření, při znalosti všech souvislostí, může být účinnou pomůckou k zlepšení diagnostiky nemocných s plicními nádory.Klíčová slova:
plicní karcinom, symptomy, diagnostika.Úvod
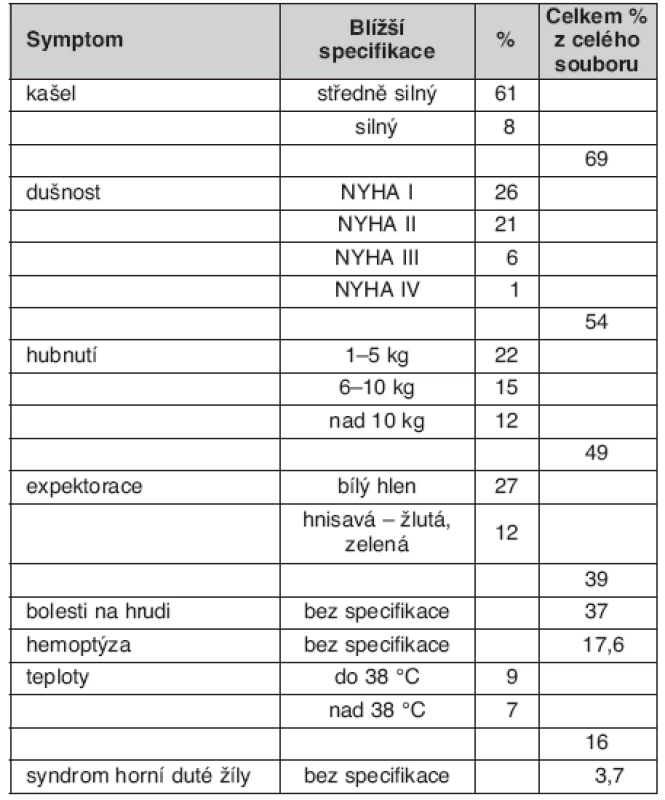
Plicní karcinom (BCA) zůstává po mnoho let jedním z nejzávažnějších zdravotních problémů v České republice. Incidence u mužů sice od poloviny 90. let mírně poklesla, avšak stále je jednou z nejvyšších v Evropě i ve světě, u žen naopak trvá její nárůst (tab. 1). V České republice je diagnostikováno v časných TNM (tj. klasifikace nádorů dle velikosti nádoru, uzlin a přítomnosti metastáz) stadiích I a II méně než 20 % všech nemocných a jen asi jedna desetina nemocných podstoupí operační léčbu. Přesto, že jsou všeobecně dobře známé symptomy onemocnění, jak mezi zdravotníky, tak obyvateli České republiky, nelze považovat diagnostiku BCA za včasnou. Ze studií provedených v České republice v minulosti (1) víme, že lze očekávat následující spektrum a četnosti symptomů u nemocných s BCA: kašel 46 %, dušnost 27 %, bolest na hrudníku 26 %, hemoptýza 21 %, teploty 19 %, asymptomatický průběh u 11 % nemocných.
Table 1. Incidence BCA v České republice v letech 1970–2005 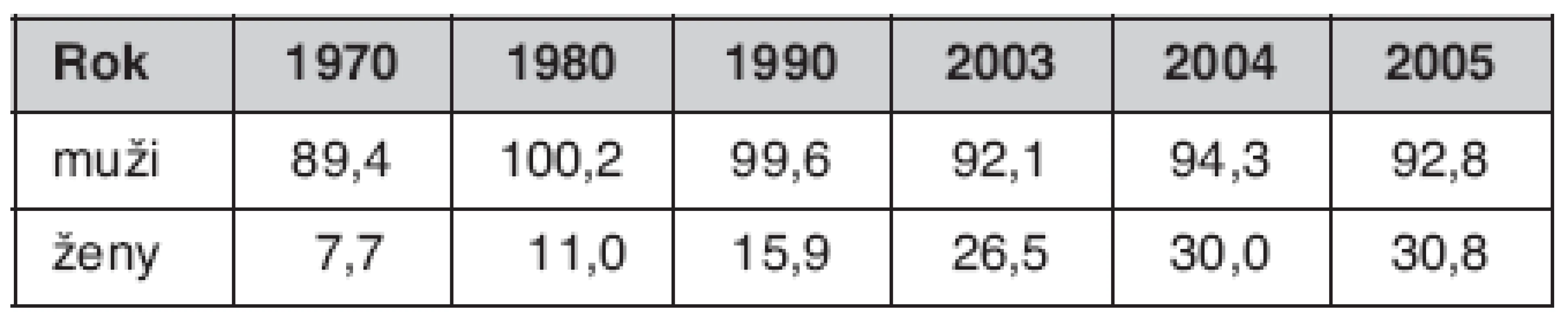
Jaký je výskyt symptomů v současnosti a jak jich lze lépe využít k urychlení diagnostiky plicního karcinomu, je cílem této studie na souboru nemocných s plicním karcinomem na I. klinice tuberkulózy a respiračních nemocí (TRN) z let 2004–2007.
Metodika
Jde o retrospektivní zpracování nálezů u 353 nemocných s plicním karcinomem diagnostikovaným na I. klinice TRN 1. LF UK v letech 2004–2007. Statistické zhodnocení bylo provedeno pomocí χ2-testu, v případě malých počtů s Yatesovou korekcí. Při posuzování dlouhodobých trendů byla použita metoda nejmenších čtverců.
Výsledky
V letech 2004–2007 bylo na I. TRN klinice nově diagnostikováno 353 nemocných s BCA. Mužů bylo 238, žen 115, poměr mužů k ženám byl přibližně 2 : 1. Průměrný věk mužů byl 67 let (směrodatná odchylka 10 let, medián 66 let), průměrný věk žen byl 69 let (směrodatná odchylka 11 let, medián 72 let). Nejmladší byla 34letá žena a nejstarší 92letý muž.
V celém souboru jsme nezjistili žádný symptom plicního karcinomu u 10,5 %, 89,5 % (316) nemocných mělo jeden nebo více symptomů onemocnění. Průměr a medián intervalu od symptomů (pro obě pohlaví) nebo od prvého náhodného vyšetření (u asymptomatických) do diagnózy byl pro celý soubor 42,3, resp. 30 dní. V podskupině nemocných se symptomy tento interval byl 42,8, resp. 30 dní, v podskupině 37 nemocných zjištěných při náhodném vyšetření byl 37,7, resp. 25 dní.
Z nejčastějších symptomů BCA byly zjištěny: kašel u 69 % nemocných, dušnost různého stupně u 54 %, hubnutí u 49 %, expektoraci udávalo 39 %, bolesti na hrudníku 37 %, hemoptýzu mělo 17,6 %, teploty 16 % a syndrom horní duté žíly mělo v době diagnózy 3,7 % nemocných. Některé parametry jsme dle jejich intenzity nebo charakteru stratifikovali do podskupin (tab. 2).
U nemocných jsme zaznamenali anamnestické údaje a dále výsledky bronchoskopického vyšetření, spirometrie, hodnot krevních plynů a dalších laboratorních vyšetření a navrženou léčbu. Z množství nálezů vyjímáme následující:
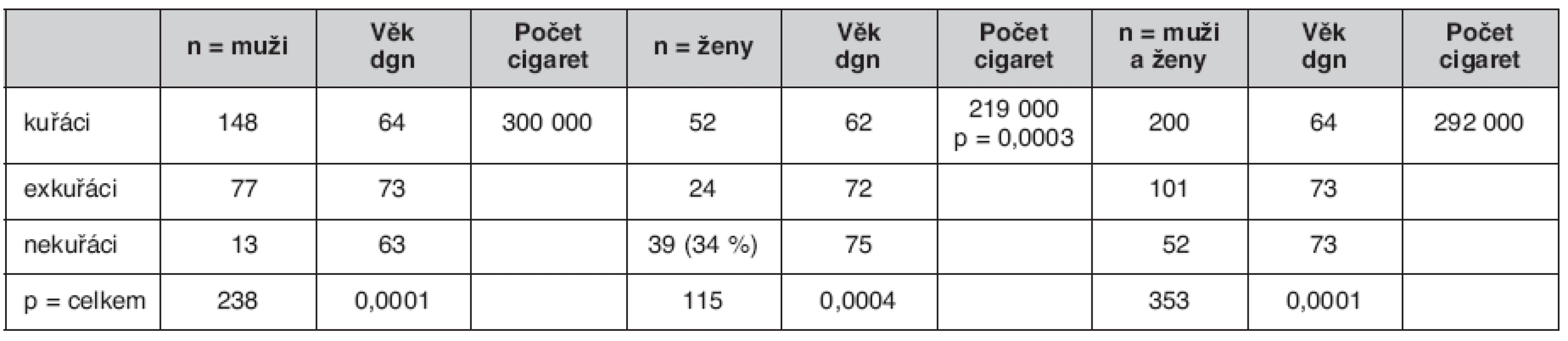
Kuřáků bylo v našem souboru 200 (148 mužů a 52 žen), tj. 56 %, 101 (77 mužů a 24 žen) bylo exkuřáků (doba nekouření více než 6 měsíců), tj. 29 %, a nekuřáků 52 (13 mužů a 39 žen), tj. 15 %. Podíl nekouřících žen (34 %) byl významně vyšší než mužů nekuřáků (5,5 %) (p = 0,00001).
Kuřáci (bez ohledu na pohlaví) v porovnání s exkuřáky a nekuřáky onemocněli o devět let dříve, tedy v mladším věku, medián byl 64 let. Exkuřáci a nekuřáci onemocněli shodně v 73 letech (medián) (p < 0,00001).
Pokud porovnáme věk, kdy onemocněli muži a ženy zvlášť, vidíme, že u mužů byl nejvyšší věk, kdy onemocněli u exkuřáků – medián 73, kuřáci onemocněli v 64 letech a nekuřáci (n = 13) v 63 letech (p = 0,00001). U žen jsme prokázali vysokou významnost rozdílu, kdy onemocněly ženy, které nekouřily – medián 75 let, oproti věku, kdy onemocněly exkuřačky (medián 72 let) a kuřačky (medián 62 let) (p = 0,0004) (tab. 3).
Kuřáci bez rozdílu pohlaví vykouřili v průměru 292 000 cigaret, než u nich byl diagnostikován BCA. Pokud tento počet hodnotíme odděleně pro muže a ženy, vidíme, že ženám stačilo ke vzniku onemocnění významně méně cigaret: 219 000 vs. 300 000 u mužů (medián) (p = 0,0003).
Pro údaj o kouření jsme hledali korelace s ostatními nálezy (tab. 4).
Table 4. Souvislost kuřáckých zvyků s ostatními nálezy 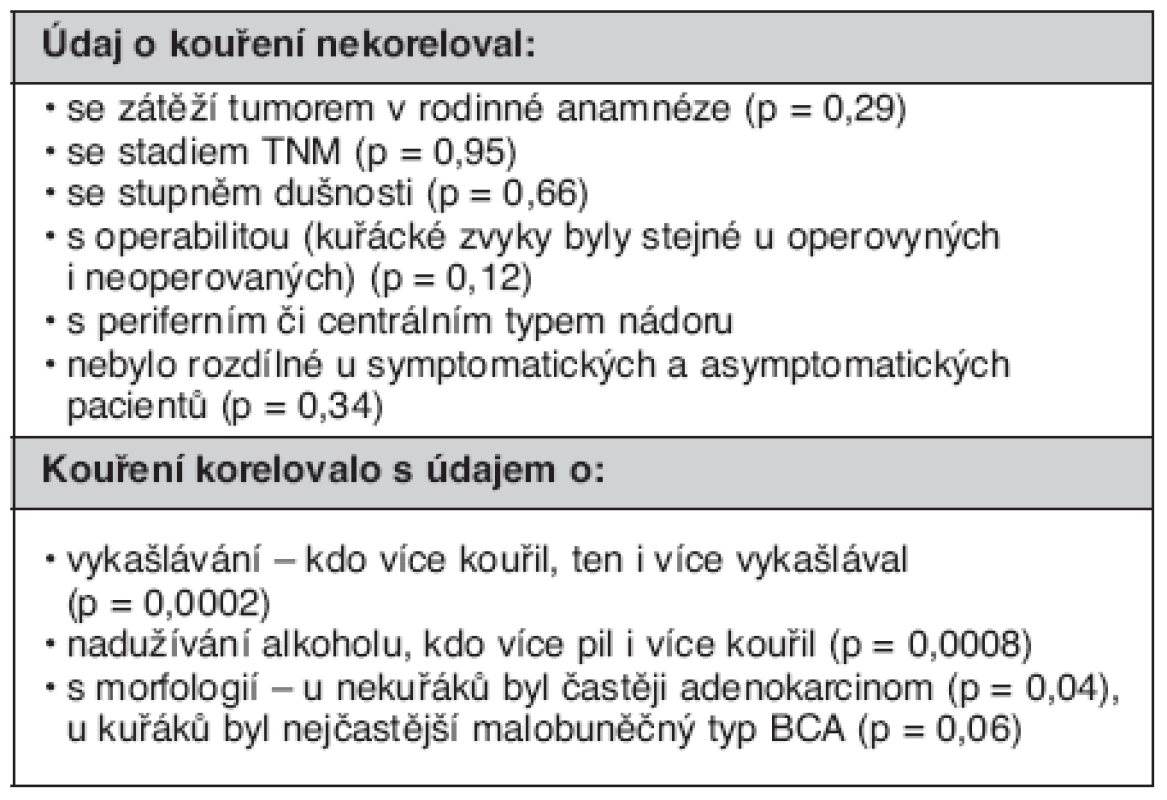
V rodinné anamnéze (RA) jsme zjistili zátěž maligním nádorem u 48 %, u 14 % byly zjištěny dva a více nádorů. Rodinná zátěž neovlivnila věk mužů, kdy byla plicní rakovina diagnostikována; u mužů se zátěží vznikla nemoc v 66 letech, bez zátěže nádorem v RA v 67 letech (p = 0,83). Naopak u žen vznikla nemoc významně v mladším věku u těch, které měly v RA zátěž maligním nádorem 64 vs. 74 let (p = 0,0068).
Bezdětných bylo 15,5 % souboru, jedno dítě mělo 30 %, dvě děti 46 %, více dětí 8,5 % souboru.
Bez maturity bylo 56 % nemocných celého souboru, se středním a vyšším vzděláním 44 %.
V pracovní anamnéze jsme nalezli zátěž kancerogeny pouze u 11 osob, tedy u 3,1 % souboru.
Nadužívání alkoholu přiznalo 35,8 % souboru, kouření i expektorace byly významně častější u osob pijících alkohol (p = 0,0001 a p = 0,0008). Naopak stejně bylo symptomatických či asymptomatických osob mezi pijícími či nepijícími alkohol (p = 0,689).
Alergii v anamnéze uvedlo 22 %.
Sledované přidružené nemoci (CHOPN, jiný tumor, tuberkulóza (TBC), plicní fibróza) mělo 187 nemocných, tj. 53 % souboru. Nejčastější byla CHOPN u 141 nemocných, tj. u 40 % souboru (významně více u epidermoidního a nediferencovaného karcinomu než u adenokarcinomu, p = 0,01), jiný tumor mělo v anamnéze 34 nemocných, tj. 9,6 % souboru, TBC v anamnéze mělo 15 nemocných, tedy 4,2 % souboru, a plicní fibrózu mělo 18 nemocných, tj. 5,2 %. U 21 nemocného se vyskytly dvě komorbidity současně.
Z dalších výsledků vyšetření uvádíme (medián): CRP 24, sedimentace krve (FW) za první hodinu 38, hemoglobin (Hb) 136 g/l, leuko 8,8, trombo 277 000.
Ze spirometrických hodnot celého souboru vyjímáme (medián): FEV1 74 % n.h., FVC 82 % n.h., reziduální objem (RV) 110 % n.h., celková plicní kapacita (TLC) 90 % n.h., přenosový faktor pro kysličník uhelnatý (TLCO) byl lehce snížen na 66 % n.h.
Krevní plyny měly následující hodnoty (medián): PaO2 9,6 kPa, PaCO2 4,5 kPa.
Dle CT a nálezu na skiagramu hrudníku jsme rozdělili BCA na skupinu tumorů centrálních a periferních. Centrálních bylo 190 (54 %) a periferních 163 (46 %).
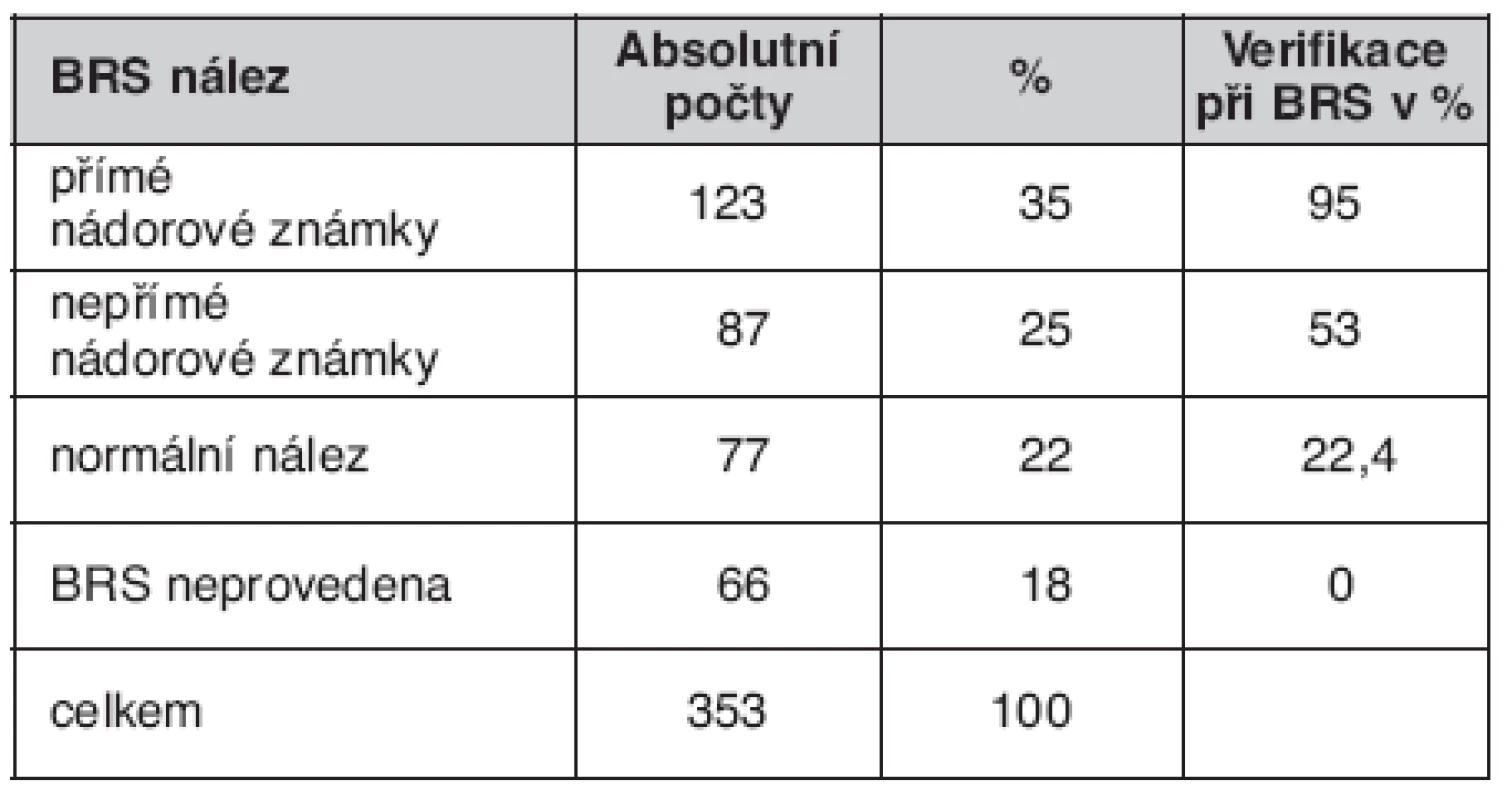
Bronchoskopické (BRS) nálezy u nemocných jsou uvedené v tabulce 5. Způsob ověření souboru je uveden v tabulce 6. Zastoupení jednotlivých TNM stadií v celém souboru uvádí tabulka 7 a morfologii plicních nádorů tabulka 8.
Table 6. Verifikace bronchogenního karcinomu 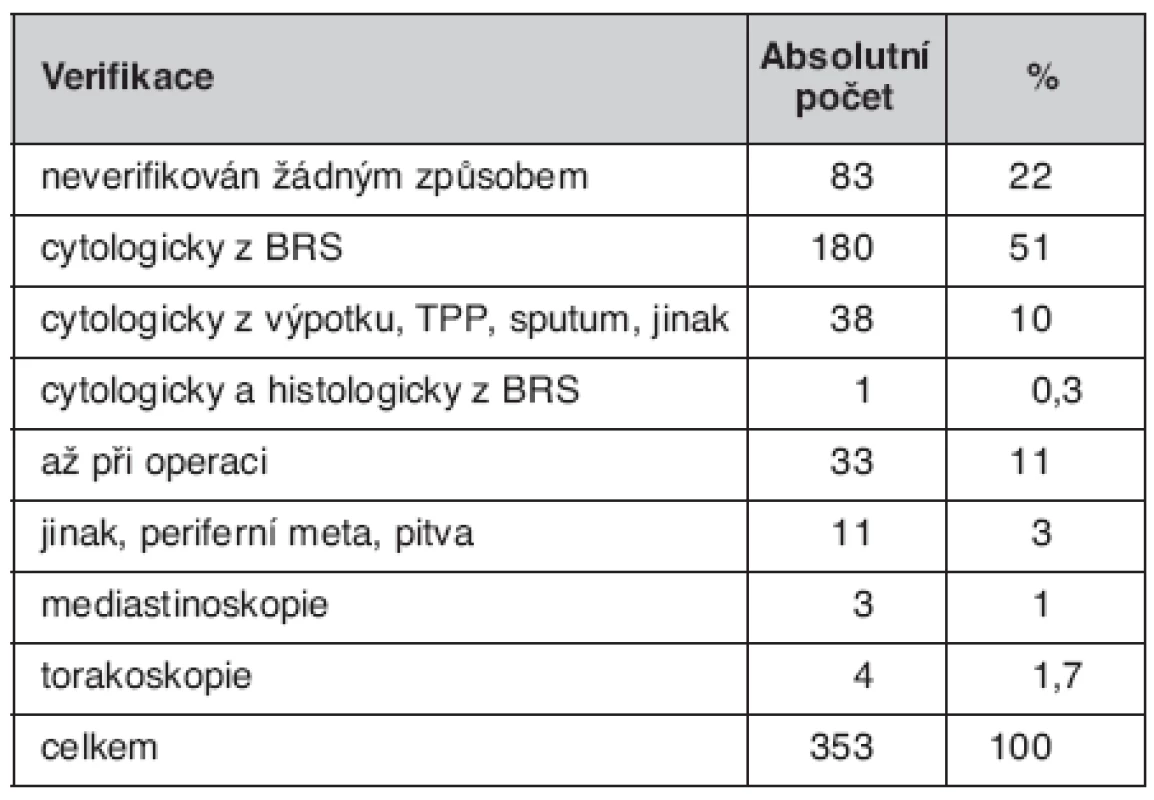
TPP – transparietální punkce tenkou jehlou Table 7. Klinická TNM stadia v době diagnózy 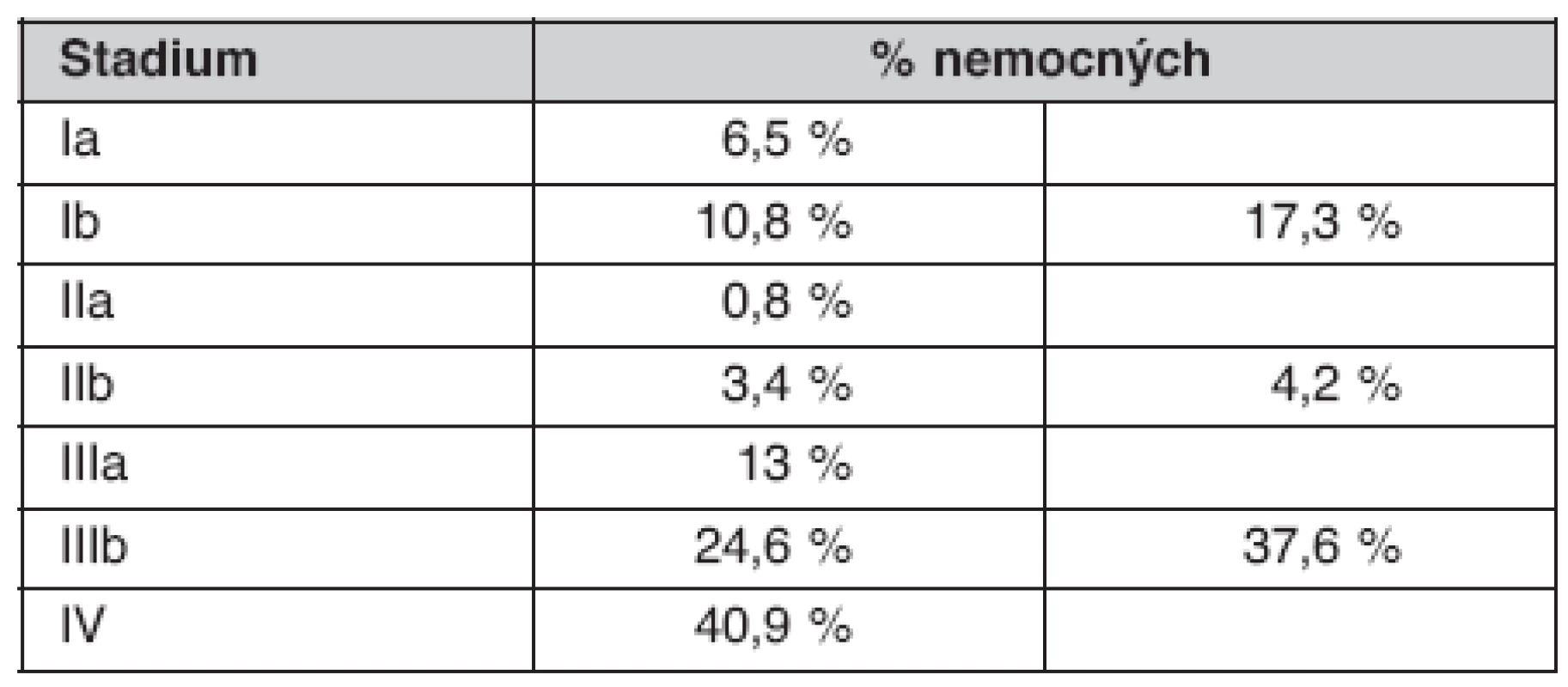
Table 8. Morfologické typy BCA 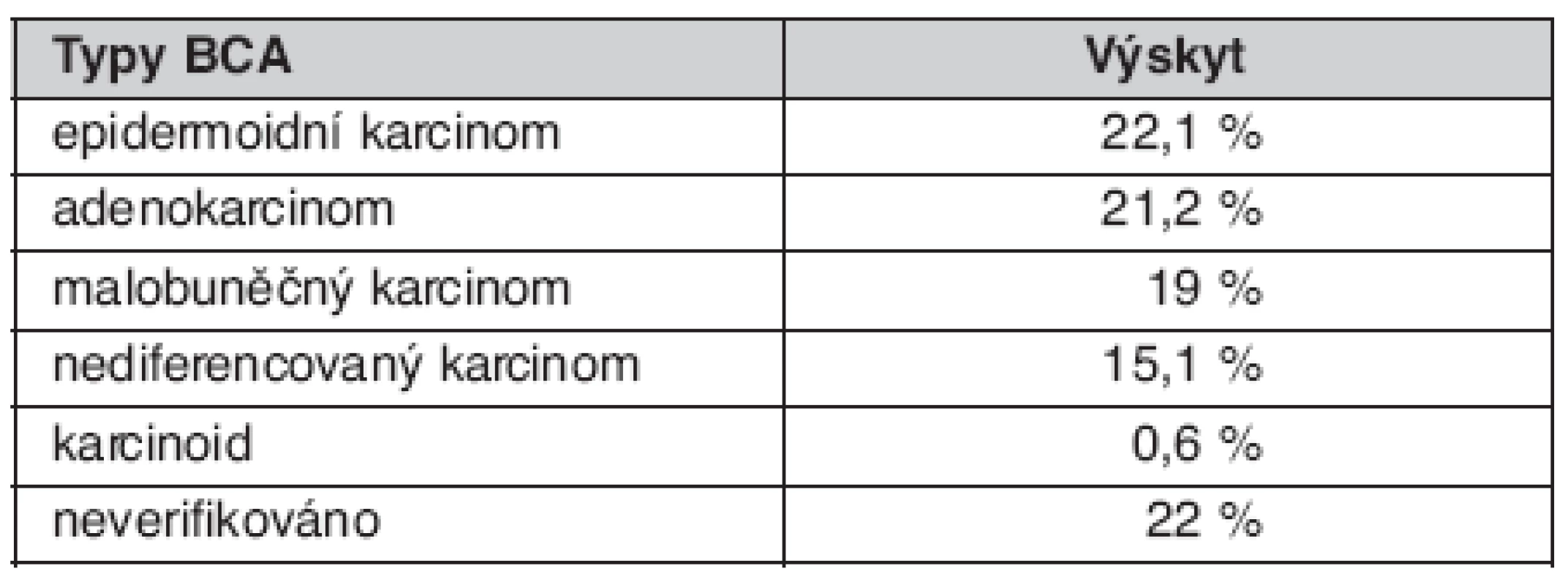
Operovaných bylo celkem 64 nemocných, což je 18,1 % celého souboru. Operační výkony byly následující: 51× lobektomie, 2× bilobektomie, 1× klínovitá resekce, 6× pneumonektomie, 4× výkon skončil explorativní torakotomií.
Operováno bylo 57 nemocných s nemalobuněčným plicním karcinomem (NSCLC) a sedm nemocných s malobuněčným plicním karcinomem (SCLC).
Ze skupiny morfologicky ověřených nemalobuněčných nádorů (celkem 211) jsme operovali 27 %, ze skupiny nemocných s malobuněčným BCA (celkem 67) jsme operovali 10,4 %. Stadia operovaných uvádí tabulka 9.
Table 9. TNM stadia u operovaných 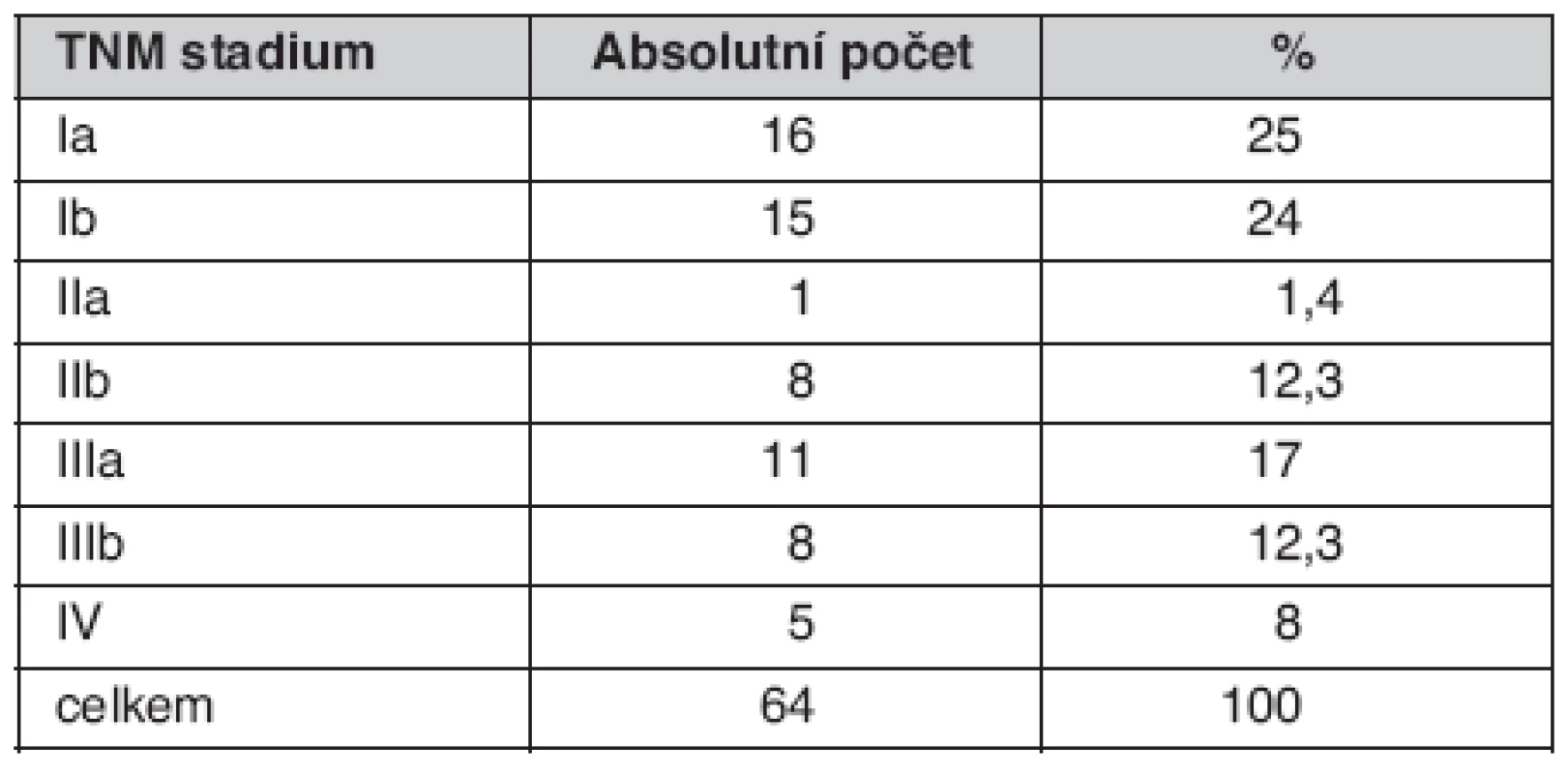
Shoda mezi klinickým stadiem TNM (cTNM) a patologickým TNM stadiem (pTNM) byla v 52 %, cTNM jsme podhodnotili u 31 % a nadhodnotili u 17 %.
Neoadjuvantní chemoterapii jsme podali 19 nemocným (5,4 %), operováno bylo osm z nich.
Chemoterapii podstoupilo 57 % a ozáření 35 % souboru, 27 % nemocných mělo kombinovanou léčbu (jak chemoterapii, tak ozáření). Následně jsme hledali korelace mezi jednotlivými nálezy.
Symptomy
Asymptomatičnost nekorelovala s alkoholismem (p = 0,689), s počtem vykouřených cigaret (p = 0,4) nebo s morfologickým typem (p = 0,75).
Naopak korelovala se stadiem TNM, asymptomatických bylo více v TNM stadiích I a II než ve stadiích III–IV (p = 0,0192), asymptomatických bylo více mezi operovanými (p = 0,002) a bylo mezi nimi významně více periferních tumorů (p = 0,037).
Asymptomatických bylo více mezi verifikovanými až při operaci než mezi ostatními (p = 0,02). Dále jsme prokázali, že pokud nemocní byli symptomatičtí, měli častěji přímé známky tumoru při bronchoskopii (p = 0,0209) než asymptomatičtí.
Interval symptomy – diagnóza
Délka intervalu od prvních symptomů do diagnózy byla v celém souboru stanovena u 316 symptomatických nemocných. Tento interval (průměr) byl u mužů 44 dní, u žen byl kratší – 39 dní; rozdíl nedosáhl statistické významnosti (p = 0,319). Tento interval nezávisel na tom, zda se jednalo o kuřáka, exkuřáka či nekuřáka (p = 0,6762). Interval symptomy – diagnóza nekoreloval s údajem o alergii, o nadužívání alkoholu či s údajem o bolesti, o dušnosti, o kašli, o expektoraci, dokonce ani s údajem o syndromu horní duté žíly, o TNM stadiu či o hubnutí. Doba mezi vznikem symptomů a diagnózou se nelišila u operovaných a neoperovaných, 44 vs. 42 dní.
Naopak jsme prokázali, že u osob s hemoptýzou byl interval od symptomů do diagnózy delší (!) než u osob bez hemoptýzy, 54 vs. 40 dní (p = 0,0063). Další významnou korelaci mezi intervalem symptomy – diagnóza jsme nalezli u nemocných s malobuněčným karcinomem, u kterých byl významně kratší než u adenokarcinomu, 34 dnů vs. 47 dnů (p = 0,02), i než u nediferencovaného typu, 34 vs. 46 dní (p = 0,05). Hraničně významný rozdíl byl mezi délkou tohoto intervalu u malobuněčného a epidermoidního karcinomu, 34 vs. 45 (p = 0,07).
Hraničně kratší byl tento interval u bezdětných (p = 0,08) ve srovnání s osobami s jedním dítětem. Pokud jsme hodnotili tento interval odděleně pro muže a ženy, prokazujeme, že byl významně kratší (p = 0,039) u bezdětných mužů ve srovnání s muži s jedním dítětem, 21 dní oproti 32 dnům (!!!). S délkou tohoto intervalu může souviset i další údaj, kdy jsme prokázali, že nemocní bezdětní plus nemocní s jedním dítětem byli častěji operovaní než osoby se dvěma a více dětmi (p = 0,029).
Kašel
Kašel se nelišil u osob dle TNM stadia (p = 0,5). Nepotvrdili jsme tedy hypotézu, že by nemocní s vyšším stadiem TNM více kašlali, přítomnost kašle ani nekorelovala s určitým morfologickým typem.
Prokázali jsme, že nemocní s centrálním typem tumoru častěji a silněji kašlali (p = 0,0151) a podobnou korelaci jsme prokázali mezi častějším a silnějším kašlem u nemocných s přímými známkami tumoru zjištěným při BRS ve srovnání s osobami s normálním BRS nálezem (p = 0,0302). Rovněž jsme prokázali, že významně méně kašlali nemocní, kteří byli verifikováni až při operaci (v 51,5 %) ve srovnání s nejčastějším typem verifikace tedy cytologicky při bronchoskopii, kterých kašlalo 72,7 % (p = 0,015). Dále se potvrdil předpoklad, že u osob se silným kašlem byla významně nižší FEV1 (61,2 %) než u osob bez kašle, kde byla FEV1 80,3 % (p = 0,0017).
Teploty
Výskyt teplot se nelišil u nemocných dle vykouřených cigaret (p = 0,56), ani nekoreloval s délkou intervalu symptomy – diagnóza (p = 0,40) nebo s morfologií tumoru (p = 0,7) nebo dle typu tumoru centrální/periferní (p = 0,7). Teplotu udávali stejně nemocní operovaní i neoperovaní (p = 0,4). Teplota nekorelovala s BRS nálezem (p = 0,89).
Významně častěji trpěli teplotou pouze nemocní v TNM stadiu IV (p = 0,05).
Hubnutí
Hubnutí nekorelovalo s věkem (p = 0,73) ani s typem verifikace tumoru (p = 0,57).
Prokázali jsme, že hubnutí je negativní prognostický faktor operace. Mezi osobami udávajícími zhubnutí bylo méně operovaných (p = 0,0002) než mezi nemocnými, kteří nehubli. Dále jsme prokázali, že významně více hubli nemocní s vyšším počtem vykouřených cigaret (p = 0,0135) a s vyšším TNM stadiem IV vs. stadium I–III (p = 0,0004). Dále významně více hubli nemocní s nediferencovaným typem karcinomu oproti nemocným s adenokarcinomem (p = 0,025) a s přímými nádorovými známkami ve srovnání s nemocnými s BRS normálním nálezem (p = 0,0079). Hubnutí bylo i významně častěji u nemocných s centrálním tumorem oproti nemocným s periferním typem (p = 0,05).
Alkohol
Blíže jsme prostudovali skupinu nemocných (113 osob, 35,8 % souboru), kteří přiznali nadužívání alkoholu. Tito nemocní onemocněli ve významně mladším věku než osoby bez nadužívání alkoholu (medián věku 64 vs. 71 let (p = 0,02). Alkoholici hraničně častěji udávali bolest (p = 0,1), častěji udávali dušnost (p = 0,04), významně více kašlali (p = 0,0007). Naopak jsme neprokázali, že by u alkoholiků byl častější některý z morfologických typů nebo že by častěji hubli (p = 0,2).
Hemoptýza
Údaj o hemoptýze nikterak nekoreloval s údajem o operabilitě (p = 0,14). Výskyt hemoptýzy se nelišil dle věku nemocných (p = 0,5), rovněž tak nebyla častější hemoptýza u silnějších kuřáků, nekorelovala s počtem vykouřených cigaret (p = 0,313) ani nekorelovala s TNM stadii (p = 0,529) ani s morfologickým typem (p = 0,33), i když nevýznamně nejčastěji byla u epidermoidního typu.
Prokázali jsme však očekávanou korelaci mezi hemoptýzou a výskytem přímých tumorózních známek (p = 0,0073). Hemoptýza byla významně častěji u centrálního typu nádoru (p = 0,03).
Dušnost
FEV1, FVC i DLCO koreluje negativně se stupněm dušnosti (p = 0,0001). S dušností nekorelovala výše zjištěného hemoglobinu (p = 0,46). Dušnost se významně nelišila u různých morfologickýh typů tumoru (p = 0,77). Osoby s nadužíváním alkoholu byly stejně dušné jako bez nadužívání alkoholu (p = 0,3).
Významně více dušných pacientů bylo ve skupině neverifikovaných (p = 0,018), což jistě souvisí s jejich neschopností podstoupit bronchoskopii. Rovněž významně častěji a těžším typem dušnosti trpěli nemocní s centrálním typem nádoru ve srovnání s periferním nádorem (p = 0,014). Pokud byla přítomná dušnost, významně méně z těchto nemocných bylo operováno (p = 0,0003). Více dušných bylo mezi nemocnými s vyšším stadiem BCA, I–IIb vs. III–IV (p = 0,0405).
Bolest
Počet vykouřených cigaret a pociťovaná bolest na hrudníku spolu významně nesouvisely (p = 0,51), stejně jako nekorelovala bolest s morfologickým typem (p = 0,46) a s operabilitou (p = 0,16) a ani s typem tumoru (p = 0,06).
Bolest udávalo více nemocných s TNM stadiem IV (p = 0,017).
CRP, FW, FEV1, TLC
Neprokázali jsme očekávanou negativní korelaci mezi CRP a FEV1 u vysokých hodnot CRP byla FEV1 signifikantně vyšší (p = 0,0075). CRP nekorelovala s údajem o kašli ani o expektoraci (p = 0,75).
Naopak pro počet leukocytů jsme nalezli negativní korelaci s FEV1 (p = 0,016), čím vyšší byl počet leukocytů, tím nižší FEV1. FEV1 se rovněž významně snižovala u nemocných s vyšším TNM stadiem (p = 0,0042).
FEV1 byla tím nižší, čím výraznější bylo hubnutí (p = 0,00001). Nižší byla rovněž hodnota FEV1 u osob s centrálním nádorem ve srovnání s periferním typem (p = 0,0006).
CRP pozitivně korelovala se stadiem nemoci, čím bylo stadium vyšší, tím byla vyšší i hodnota CRP (p = 0,0107). CRP byl dále významně vyšší u SCLC – 59 než u adenokarcinomů – 33 (p = 0,008). Zajímavé může být, že CRP byl nižší u normálních BRS nálezů než u přímých nádorových známek (p = 0,13).
Prokázali jsme, že u nemocných operovaných bylo významně nižší CRP než u neoperovaných (p = 0,01).
CRP bylo rovněž nižší u periferních nádorů, vyšší u centrálních a dále bylo vyšší u malobuněčných typů karcinomu ve srovnání s adenokarcinomy (p = 0,0082).
Pro FW jsme nalezli významný rozdíl mezi její průměrnou hodnotou u adenokarcinomu – 27, u epidermoidního typu – 42, a u nediferencovaného typu karcinomu – 54 (p = 0,01).
TLC bylo významně nižší u centrálního typu tumoru (87 % n.h.) ve srovnání s TLC u periferních tumorů (95 % n.h.) (p = 0,0011). Podobná korelace platila i pro hodnoty FVC (p = 0,0015).
Bronchoskopické nálezy
Nenalezli jsme korelaci mezi bolestí, pitím alkoholu, alergií, expektorací, dušností a nálezy při bronchoskopii. BRS nález se rovněž nelišil podle počtu vykouřených cigaret, teploty či dle pohlaví.
Korelaci jsme prokázali mezi FEV1 a nálezem při BRS. Pokud byly při BRS nalezeny přímé známky tumoru byla FEV1 významně nižší (FEV1 68 %) než u nepřímých známek (FEV1 78 %) či normálního nálezu (FEV1 82 %) (p = 0,0003). To samé platilo i pro FVC (nejnižší u přímých nádorových známek, 76 %), u normálních BRS nálezů byla významně vyšší, 89 % (p = 0,0005). FW byla nejvyšší u přímých známek nádoru zjištěných při bronchoskopii – 48 a nižší u nepřímých známek – 36 a nejnižší u normálních bronchoskopických nálezů – 42 (p = 0,03). Bronchoskopicky jsme častěji prokázali přímé nádorové známky, pokud měli nemocní symptomy (p = 0,02).
Na bronchoskopický nález měl vliv i morfologický typ nádoru, nejméně přímých známek bylo u adenokarcinomu ve srovnání s ostatními typy (p = 0,0022).
PaO2, PaCO2, DLCO, Hb
U osob s centrálními tumory byl významně nižší PaO2 (p = 0,01). PaCO2 se nelišil u osob s centrálními a periferními tumory (p = 0,18). PaO2 dále významně koreloval s údajem o dušnosti. Čím vyšší byla dušnost, tím bylo nižší PaO2 (p = 0,02). Pro PaCO2 jsme tuto korelaci neprokázali (p = 0,29).
U operovaných byla významně vyšší DLCO (p = 0,05) i vyšší FEV1, FVC i TLC (p = 0,0001) i vyšší Hb (p = 0,0001) a naopak nižší FW (p = 0,0001) a CRP (p = 0,003). U operovaných byl dále významně vyšší PaO2 (p = 0,0002). PaCO2 a RV nekoreloval s operabilitou (p = 0,869, p = 0,314).
Z dalších výsledků jsme prokázali očekávanou korelaci mezi FEV1 a CHOPN (p = 0,0001) a méně očekávanou souvislost mezi hubnutím a nižší FEV1 (p = 0,0001).
CHOPN, KFA
CHOPN mělo 40 % nemocných, převažoval u nich nediferencovaný a epidermoidní typ karcinomu, méně častou doprovodnou nemocí byla u adenokarcinomu, rozdíl byl statisticky významný (p = 0,01). Za zajímavé považujeme, že u časných TNM stadií I–II byla CHOPN častěji doprovázející nemocí než u stadií III a IV, i když se významnost nepodařilo prokázat (p = 0,46).
U nemocných s KFA byl hraničně významně častějším typem karcinomu adenokarcinom (p = 0,07).
NSE, CIFRA, CEA
Významně vyšší neuron specifickou enolázu (NSE) jsme nalezli u centrálních malobuněčných typů (p = 0,0001). Překvapením bylo, že NSE nebyla významně vyšší u periferních malobuněčných nádorů, ale významně vyšší byla u nediferencovaného typu než u ostatních typů nádorů (p = 0,02).
Cytokeratin 19 fragment (CIFRA) byl významně vyšší u centrálních typů tumorů než u periferních typů (p = 0,01), nejvyšší byl u epidermoidních typů. Zajímavé je rovněž, že CIFRA byl významně vyšší u osob udávající hubnutí (p = 0,02).
Karcinoembryonální antigen (CEA) byl rovněž významně vyšší u centrálních tumorů než u periferních (p = 0,04), z periferních byl významně vyšší u adenocarcinomu.
Syndrom horní duté žíly (Sy HDŽ)
Sy HDŽ byl hraničně významně častější u osob v TNM stadiích IIIB a IV (p = 0,0848), dále častější u osob s malobuněčným BCA než u ostatních typů (p = 0,05) a častější u centrálních tumorů než u periferních (p = 0,021). Sy HDŽ nekoreloval s typem BRS (p = 0,14).
Diskuze
Stejně jako v předchozích studiích i na nynějším souboru 353 nemocných prokazujeme, že u kuřáků/ček BCA diagnostikujeme ve statisticky významně mladším věku než u ex - a nekuřáků/ček. V literatuře jsme nalezli práce (2, 3), ve kterých autoři prokázali stejně jako my nižší věk vzniku plicní rakoviny u současných kuřáků ve srovnání s exkuřáky (p < 0,0001). Jiní autoři podobně jako my prokázali, že mezi ženami je vysoké procento nekuřaček. V našem souboru to bylo 34 %, ve francouzské studii (n = 904 žen s BCA) bylo nekuřaček 32,3 % (4).
Muži vykouřili významně více cigaret (300 000), než onemocněli plicním karcinomem ve srovnání se ženami (219 000). Myslíme si, že je to potvrzení často v literatuře uváděné vyšší citlivosti žen k tabákovému kouři. Podobně jako my prokázali i švédští autoři ve studii ze švédského Gaevlesborgu (5), že muži byli silnějšími kuřáky než ženy.
Při rozboru rodinné anamnézy jsme zátěž jedním nebo více maligních nádorů nalezli u 48 % nemocných. Za zajímavý považujeme fakt, že u žen s touto zátěží vznikla nemoc ve významně mladším věku než u těch, které v RA neměly malignitu. V podobné sestavě 420 nemocných s BCA z Plicní kliniky Fakultní nemocnice (FN) Hradce Králové prokázali autoři zátěž v RA nádorem u 30 % nemocných (6).
V osobní anamnéze jsme zjistili, že 187 nemocných, tedy 53 %, mělo námi sledovanou přidruženou nemoc (CHOPN, tumor, TBC, plicní fibrózu). Pokud bychom sledovali všechny komorbidity, lze předpokládat, že bychom měli podobné výsledky jako autoři Tammemagi et al. (7). Ti v souboru 1155 nemocných s BCA z Ford Cancer Center prokázali přidruženou nemoc u 88 %.
Jiný nádor v osobní anamnéze byl u 34 nemocných, tedy u 9,6 % našeho souboru. V práci Buccheriho (8) byl jiný nádor v předchorobí zjištěn u podobného počtu nemocných jako v naší sestavě, u 10,6 %. V jiné práci Brocka to bylo u 11 % z 8363 nemocných s BCA z let 1978–2002 (9).
Při porovnávání morfologických typů zjišťujeme, že u celého souboru bez rozdílu pohlaví je i nadále nejčastějším epidermoidní typ karcinomu, ve 22,1 %. Druhým nejčastějším je adenokarcinom. Stejně jako v jiných sestavách nemocných i v našem bylo hraničně statisticky významně více nekuřáků/ček u nemocných s adenokarcinomem (4). Podobné rozložení histologických typů popsali i autoři z plzeňské plicní kliniky. V jejich souboru 350 operovaných nemocných s BCA byl epidermoidní typ u 59 % mužů a adenokarcinom u 68 % žen (10). Obdobné rozložení morfologických typů měli i lékaři z Plicní kliniky FN Hradec Králové. V jejich souboru 420 ambulantních nemocných s BCA z let 2004–2005 mělo 49 % epidermoidní typ, 21 % adenokarcinom a malobuněčný typ 17 % (6).
Stejně jako v jiných studiích i v našem souboru bylo operováno méně než 20 % ze všech nemocných s BCA. Pokud budeme posuzovat počty operovaných ve skupině nemocných s nemalobuněčnou plicní rakovinou, pak vidíme, že jsme z nich operovali 27 %. Podobné výsledky publikovala Skřičková a spol. (11) v roce 2001. Ze všech 348 nemocných s NSCLC operovali 70, tedy 20 %. Třiceti nemocným podali neoadjuvantní terapii, tedy 9 %. V našem souboru 353 nemocných všech typů jsme podali neoadjuvantní léčbu 19 nemocným, tedy 5,4 %.
V roce 2004 brněnští autoři publikovali další práci týkající se této problematiky (12). V této sestavě odeslali k operaci 92 nemocných ze souboru 373 pacientů s NSCLC, tedy 24,7 %. Podobné výsledky operability nemocných s NSCLC byly popsány i v souboru nemocných s BCA z II. kliniky TRN, Praha – Veleslavín z let 1985–1990. Tehdy bylo z 1171 nemocného s NSCLC operováno 28 % (13). V Plzni odeslali k operaci 20 % ze všech diagnostikovaných nemocných s BCA (10). Z uvedených počtů lze i nadále soudit, že BCA je diagnostikován v pokročilých stadiích, tedy pozdě (14).
Úroveň shody mezi cTNM a pTNM v našem souboru (52 %) byla obdobná jako v souboru z Thoraxklinik, Heidelberg Rohrbach, SRN (55 %) či v souboru nemocných s NSCLC z II. kliniky TRN z let 1985–1990 rovněž 55 % (13, 15). Nejvyšší úroveň shody popsali ve svém souboru plzeňští autoři, a sice 64 % (10).
Těžiště nynější analýzy vidíme ve stanovení frekvence symptomů onemocnění a hledání jejich vztahu k ostatním nálezům, které by mohlo přispět k urychlení a zpřesnění diagnostického procesu. Věříme, že nalezené korelace mohou zvýšit předpovědní hodnotu symptomů pro konkrétního pacienta i k lepší selekci indikovaných vyšetření.
Podle našich výsledků lze vyvozovat, že asymptomatický pacient bude mít BCA spíše v nižších TNM stadiích, má větší šanci být operovaný a spíše se bude jednat o periferní typ s normálním BRS nálezem. Naopak nelze předpokládat, že by méně kouřil nebo méně pil alkohol nebo měl méně často malobuněčný typ BCA. V naší sestavě bylo asymptomatických 10,5 %, což je podobné zjištění jako ve Švédské studii (n = 364), kde tento počet byl 7 % (5).
Délka intervalu od prvních symptomů (nebo od náhodného vyšetření) do diagnózy byla u mužů 44 dní, u žen 39 dní. Ve studii sledující tento interval v poměrech okresního zařízení TRN publikované před 14 lety byl tento interval bez rozdílu pohlaví delší, 70 dní (1). Stanovený interval v prezentované sestavě z let 2004–2007 se významně nelišil dle kuřáckých zvyků, dle vztahu k alkoholu. Za zajímavé považujeme, že nebyl kratší u osob s bolestí, s větší dušností či u osob s kašlem a dokonce ani u osob se syndromem horní duté žíly. Nebyl ani významně rozdílný u různých TNM stadií či u osob s hubnutím oproti těm, kteří si váhu drželi či u osob operovaných a neoperovaných. Vysvětlení (snad kromě zbytečně ordinovaných vyšetření) nemáme pro překvapivý nález, že dokonce osoby s hemoptýzou měly tento interval delší než osoby bez hemoptýzy.
Naopak logické se nám zdá, že u osob s malobuněčným karcinomem (rychlá progrese, častější symptomy než ostatní karcinomy) byl tento interval významně kratší než u ostatních typů nádorů. Ke zjištění, že bezdětní muži měli tento interval významně kratší než muži s dětmi, lze jen vyslovit hypotézu, že bezdětní na sebe mají více času, více se pozorují, a proto vyhledají dříve lékařskou pomoc než muži věnující svoji pozornost dětem (?), což mohlo i ovlivnit vyšší počet operovaných mezi osobami bezdětnými nebo s jedním dítětem ve srovnání s osobami s dvěma a více dětmi.
Kašel nebyl častější u osob s vyšším TNM stadiem ani u některého morfologického typu nádoru. Naopak lze jej asociovat s centrálním typem nádoru, s přímými nádorovými známkami při bronchoskopii a s nižším FEV1. Je jistě otázkou, do jaké míry se na snížení FEV1 podílí karcinom sám a jaká byla hodnota FEV1 před vznikem tohoto onemocnění. Podle studie u chronických kuřáků se riziko vzniku rakoviny zvyšuje 1,17× při každém snížení FEV1 o 10 % a lze tedy předpokládat, že snižování FEV1 předchází vzniku plicního karcinomu (16).
Výsledky našeho souboru (kašel u 69 % a expektorace u 39 % celého souboru) jsou velmi blízké závěrům metaanalýzy všech anglických článků v Medlinu s klíčovým slovem kašel a plicní nádor od roku 1966 do roku 2004. Dle nich udává kašel v době diagnózy více než 65 % a expektoraci 25 % nemocných s plicním nádorem (17).
Teplotou významně netrpěli silnější kuřáci ani neovlivnila délku intervalu symptomy – diagnóza, její výskyt se nelišil u operovaných a neoperovaných. Z její existence lze pouze předpokládat, že se může jednat o vyšší TNM stadia. Podle výsledků některých prací lze považovat teplotní epizody za negativní prognostický faktor dlouhodobého přežití (18).
Naše analýza potvrdila významnost údaje o ztrátě hmotnosti jakožto negativního prognostického faktoru operace. Více hubli nemocní dle počtu vykouřených cigaret, dle pokročilosti onemocnění (TNM stadia), s centrálním typem nádoru a s přímými nádorovými BRS známkami. Nejméně naopak hubli nemocní s adenokarcinomem. Podobně prokázali i jiní autoři, že ztráta více než 5 % hmotnosti koreluje se snížením kvality života (Karnofského index), stupněm únavy a intenzitou bolestí (19).
Nadužívání alkoholu nebylo vázáno na některý morfologický typ ani nekorelovalo s údajem o hubnutí. Významné může být, že tyto osoby onemocněly v mladším věku, častěji byly dušné a více kašlaly, což asi souvisí s prokázanou korelací o intenzitě kouření a nadužíváním alkoholu. Pití alkoholu zvyšuje riziko vzniku plicní rakoviny, což potvrdilo osm z deseti prospektivních studií (20).
Hemoptýzu udávalo 17,6 % našeho souboru a byla stejně často u operovaných jako u neoperovaných, u silných i slabých kuřáků. Ani nekorelovala s TNM stadii či s morfologickým typem. Dle tohoto příznaku lze však předpokládat častější výskyt přímých nádorových známek při BRS a centrální typ tumoru. Výskyt hemoptýzy u nemocných s plicním karcinomem v době diagnózy kolísá dosti značně od 2,6 % (5) do 21 % (1). Podobně jako jiní autoři, kteří v multivariantní analýze 247 BCA prokázali, že hemoptýza spolu s dušností a abnormální spirometrií jsou nezávislé rizikové faktory vzniku tohoto onemocnění, považujeme hemoptýzu u kuřáků za významný popud k dalšímu vyšetření (CT, bronchoskopie aj.) (21).
Pokud se však analyzují nemocní s hemoptýzou (n = 184) byla nejčastěji způsobena bronchiektasiemi (26 %), chronickým (23 %) a akutním (15 %) zánětem dýchacích cest a až na 3. místě plicní rakovinou (13 %) (22).
Stupeň dušnosti nekoreloval s údajem o PaCO2, s hladinou hemoglobinu, negativně koreloval s PaO2, s FEV1,FVC i DLCO a byla stejná u různých morfologických typů. U nemocných s dušností však lze předpokládat, že se jedná o centrální typ nádoru s vyšším TNM stadiem, a tedy, že šance na operaci je významně menší. Dušnost udávalo 54 % současného souboru, což je více, než bylo zjištěno v některých studiích, např. 27 % v berounské studii (1) a 15,1 % ve studii ve švédském Gaevleborgu (5 avšak méně než ve studii 44 žen s BCA, u nichž byla dušnost nejčastějším symptomem, u 59 %) (23).
Bolest udávalo 37 % našeho souboru, v jiných studiích tyto počty kolísají dle selekce souboru. V nedávno publikované práci (24) udávalo bolest podstatně více nemocných, 69 %. Ve studii (25)byla silná bolest na stupni 7 v desetistupňové škále u 35 % afro-američanů a u 17 % bělochů. Podle námi nalezené korelace lze pouze oprávněně předpokládat, že nemocní s bolestí mají častěji pokročilý BCA ve IV. stadiu TNM.
Neprokázali jsme očekávanou korelaci mezi CRP, kašlem a expektorací. Naopak CRP se zvyšoval s TNM stadii, byl významně vyšší u malobuněčného typu nádoru a u nemocných s přímými nádorovými známkami při BRS. Nižší byl u operovaných a u periferních nádorů.
Potvrdili jsme předpoklad, že FEV1 se významně snižuje u nemocných s vyšším TNM stadiem, u osob s větším hubnutím, s těžší dušností a u osob s centrálním typem nádoru.
Za zajímavý nález považujeme, že nejnižší FW jsme nalezli u adenokarcinomu, vyšší u epidermoidního typu a nejvyšší u nediferencovaného typu karcinomu.
TLC bylo významně nižší u centrálního typu tumoru ve srovnání s TLC u periferních tumorů.
Bronchoskopický nález se nelišil u osob s rozdílnými kuřáckými zvyky, nesouvisel s dušností či pohlavím. Osoby s přímými tumorózními známkami měly však významně nižší FEV1, byly častěji symptomatické a významně méně častý byl u nich adenokarcinom. Prokázali jsme, že FW byla nejvyšší u přímých tumorózních známek, nižší byla u nepřímých tumorózních známek a nejnižší u normálního BRS nálezu. V domácí literatuře jsme nenalezli mnoho sdělení hodnotící BRS nálezy u nemocných s plicním karcinomem.
Můžeme srovnat počty nemocných s BCA a nádorovými změnami zjištěnými při bronchoskopii v naší sestavě se souborem 157 nemocných z okresního zařízení TRN z let 1981–1986 (1), kdy jsme bronchoskopii provedli u 98 z nich. Nádorové (přímé či nepřímé známky) byly nalezeny u 86 %. My jsme podobné změny prokázali u méně nemocných, u 73 %, přičemž se jednalo o přímé změny u 43 % a nepřímé u 30 % z bronchoskopovaných.
Ve studii Martineze z roku 1994 byly přímé známky nádoru pozorovány častěji, u 49 % z 1801 nemocných s BCA (26).
Stejně jako jiní autoři i my jsme neprokázali v prezentované sestavě nemocných korelaci mezi kouřením a bronchoskopickými nálezy (27). Za přínosné považujeme stanovení procenta úspěšnosti verifikace jednotlivých BRS nálezů. Díky tomu víme, že jsme v popsané sestavě nemocných neověřili 5 % z nemocných s přímými známkami. Lze předpokládat, že při zapojení dalších metod nebo vícenásobných odběrů se dá i toto procento snížit. Nicméně naše výsledky jsou zcela v souladu se závěry německých autorů Franka a Loddenkempera, kteří soudí, že viditelné léze lze bronchoskopicky verifikovat ve více než 90 % a periferní léze mezi 30–90 %. V naší sestavě jsme ověřili pomocí bronchoskopie 22 % „normálních“ bronchoskopických nálezů (28).
Stejně tak je možné zvýšit procento nemocných verifikovaných s nepřímými známkami nádoru eventuálně s normálním nálezem při BRS. Lze předpokládat, že s využitím nových technik (Narrow band imagine, transbronchiální jehlová biopsie (TBNA) a endosonografie (EBUS), ultratenké fibroskopy aj.) dosáhneme lepších výsledků (29, 30). Podle výsledků nedávno publikované práce Aono lze očekávat, že se při rutinně prováděné perbronchiální punkci subkarinálních uzlin zvýší počet verifikovaných o 16 % (31).
Za zajímavý považujeme fakt, že u osob s centrálními tumory byl významně nižší PaO2, naopak PaCO2 se nelišil u osob s centrálními a periferními tumory.
Nepřekvapilo nás, že u operovaných bylo vyšší PaO2, DLCO, FEV1, FVC i TLC a naopak nižší FW, vyšší Hb a významně nižší CRP. Naopak PaCO2 a RV nekoreloval s operabilitou.
Dále jsme prokázali očekávanou korelaci mezi FEV1 a CHOPN a méně očekávanou souvislost mezi hubnutím a nižší FEV1.
CHOPN mělo 40 % nemocných, převažoval u nich nediferencovaný a epidermoidní typ karcinomu. Podobné nálezy popsal ve své práci Papi z roku 2004 (32). Za zajímavé považujeme, že u časných TNM stadií I–II byla CHOPN častěji doprovázející nemocí než u stadií III a IV.
U nemocných s KFA byl hraničně významně častějším typem karcinomu adenokarcinom.
Významně vyšší NSE jsme nalezli u centrálních malobuněčných typů, nebyla však vyšší u periferních malobuněčných nádorů, ale významně vyšší byla u nediferencovaného typu.
CIFRA byla významně vyšší u centrálních typů tumorů, nejvyšší byla dle očekávání u epidermoidních typů. Zajímavé je rovněž, že CIFRA byla významně vyšší u osob udávající hubnutí.
CEA byla rovněž významně vyšší u centrálních tumorů než u periferních, z periferních byla významně vyšší u adenokarcinomu. Podobné korelace tumor markerů CIFRA (vyšší u rozsáhlých centrálních tumorů) a CEA (vyšší u adenokarcinomů) prokázali již v roce 1995 Moro et al. (33).
Syndrom horní duté žíly (HDŽ) byl v našem souboru diagnostikován u 3,7 %. Byl hraničně významně častější u osob v TNM stadiích IIIB a IV, byl nejčastěji u osob s malobuněčným BCA a nekoreloval s bronchoskopickým nálezem. Stejnou asociaci (ve 40 %) s tímto typem karcinomu prokázali i jiní autoři (34).
Závěr
Věříme, že výše uvedené výsledky naší studie mohou přispět ke zlepšení a urychlení diagnostiky nemocných s tímto závažným onemocněním. Potvrdili jsme známou skutečnost, že řádná anamnéza je základem správné diagnostiky. Díky znalostem o vzájemné souvislosti symptomů a dalších výsledků vyšetření s plicním karcinom může lékař lépe plánovat další vyšetření a lépe předvídat typ, rozsah i prognózu onemocnění. Potvrzujeme, že u osob s nejasnou dušností, hemoptýzou, abnormální spirometrií ve spojení s kuřáctvím je nezbytné co nejrychleji možnost plicní rakoviny vyloučit.
Zkratky
BCA – plicní karcinom
BRS – bronchoskopie
CIFRA – Cytokeratin 19 fragment
CEA – karcinoembryonální antigen
CRP – C-reaktivní protein
cTNM – klinické stadium TNM
EBUS – endobronchiální ultrazvuk
FEV1 – usilovný výdech za první vteřinu
FN – fakultní nemocnice
FVC – usilovná vitální kapacita
FW – sedimentace krve
Hb – hemoglobin
CHOPN – chronická obstrukční plicní nemoc
NSCLC – nemalobuněčný plicní karcinom
NSE – neuron specifická enoláza
pTNM – patologické TNM stadium
RA – rodinná anamnéza
RV – reziduální objem
SCLC – malobuněčný plicní karcinom
Sy HDŽ – syndrom horní duté žíly
TBC – tuberkulóza
TBNA – transbronchiální jehlová biopsie
TLC – celková plicní kapacita
TLCO – přenosový faktor pro kysličník uhelnatý
TNM – klasifikace nádorů dle velikosti nádoru, uzlin a přítomnosti metastáz
TRN – tuberkulóza a respirační nemoci
Adresa pro korespondenci:
prof. MUDr. Miloslav Marel, CSc.
I. TRN klinika 1. LF UK a VFN
Kateřinská 19, 120 00 Praha 2
e-mail: miloslav.marel@vfn.cz
Sources
1. Marel M, Kalina P, Melínová L, et al. Epidemiological studies on lung cancer in the Bohemia region. Lung Cancer 1994; 10 : 325–331.
2. Pezzotto SM, Mahuad R, Bay ML, et al. Variation in smoking-related lung cancer risk factors by cell type among men in Argentina: a case – control study. Cancer-Causes-Control, 1993; 4 : 213–217.
3. Tong L, Spitz MR, Fueger JJ, et al. Lung carcinoma in former smokers. Cancer 1996; 78 : 1004–1010.
4. Grivaux M, Breton P, Bombardon P, et al. Lung cancer among women in France. Lung Cancer 2004; 45 : 279–287.
5. Koyi H, et al. A prospective study of total material of lung cancer from a county in Sweden 1997–1999: gender, symptoms, type, stage and smoking habits. Lung Cancer 2002; 36 : 9–14.
6. Hrnčiarik M, Illichová E, Salajka F. Bronchogenní karcinom – souhrnný přehled pacientů léčených na Plicní klinice FN Hradec Králové v letech 2004–2005, Novinky v pneumologii. Sborník prací XIII kongresu ČPFS a SPFS, 2006; 132–133.
7. Tammemagi CM, Neslund-Dudas M, Simoff M, Kvale P. Impact of comorbidity on lung cancer survival. Int J Cancer 2003; 103 : 792–802.
8. Buccheri G, Ferrigno D. Familial and personal history of cancer in bronchogenic carcinoma – frequency and clinical implications. Acta Oncol 2004; 43 : 65–72.
9. Brock MV, Albert CM, Hooker A, et al. Risk of subsequent primary neoplazma developing in lung cancer patiens with prior malignancies. J Thorac Cardiovasc Surg 2006; 127 : 1119–1125.
10. Plicková K, Špiclem V, Pešek M, Mukenšnábl P. Analýza přežití pacientů operovaných pro bronchogenní karcinom v letech 1986–1997. Rozhl Chir 2003; 82 : 293–299.
11. Skřičková J, Špelda S, Svobodník A, et al. A realistic view of the treatment of non-small cell lung cancer. Lung Cancer, Current Topic, Monduzzi Editore S.p.A, 2001; 167–172.
12. Skřičková J, Tomíšková, M, Babičková L, et al. Vývoj chirurgické léčby nemalobuněčného bronchogenního karcinomu v letech 2000–2003. Sborník abstrakt, Hradecké pneumologické dny 2004; 33–35.
13. Marel M, Melínová L, Štastný B, et al. The results of surgical treatment of non-small cell lung cancer at the Pneumological Clinic in Prague, Czech Republic 1985–1990. Lung Cancer 1994; 11 : 293–298.
14. Marel M, Skácel Z, et al. Operační léčba bronchogenního karcinomu v letech 1970–2001. Čas Lék čes 2003; 142 : 88–92.
15. Drings P, Vogt-Moykopf I. Thorax-tumoren. Berlin, Heidelberg: Springer Verlag 1991.
16. Islam SS, Schottenfeld D. Declining FEV1 and chronic productive cough in cigarette smokers: a 25.year prospective study of lung cancer incidence in Tecumseh. Michigan. Cancer Epidemiol Biomarkers Prev 1994; 3 : 289–298.
17. Kvale PA. Chronic cough due to lung tumors. Chest 2006; 129 : 147S–153S.
18. Ide S. Fever and survival with drug-treated non-small cell lung cancer. Kurume Med J 2001; 48 : 9–14.
19. Scott RH, McMilan DC, Brown DJ, et al. A prospective study of the impact of weight loss and the systemic inflammatory response on quality of life in patiens with inoperable non-small cell lung cancer. Lung Cancer 2003; 40 : 295–299.
20. Potter JD, McMichael AJ. Alcohol, beer and lung cancer – a meaningful relationship? Int J Epidemiol 1984; 13 : 240–242
21. Hamilton W, Peters TJ, Round A, et al. What are the clinical features of lung cancer before the diagnosis is made? A population based case-control study. Torax 2005; 60 : 1059–1065.
22. Tsoumakidou M, Chrysofakis GI, Tsiligiani G, et al. A prospective analysis of 184 hemoptysis cases: diagnostic impact of chest X - ray, computed tomography, bronchoscopy. Respiration 2006; 73 : 808–814.
23. Okutan O, Kartaloglu A, IIvan A, et al. Does the primary Lung Cancer rate increase among females? Bull Cancer 2004; 91: E201–E210.
24. Hoffman AJ, Given A, von Eye, et al. Relationships among pain, fatique, insomnia and gender in persons with lung cancer. Oncol Nurs Forum 2007; 34 : 785–792.
25. Reyes-Gibby CC, Spitz M, Wu X, et al. Cytokine genes and pain severity in lung cancer: exploring the influence of TNF-alpha-308 G/A, IL 6-174G/C and IL 8-251 T/A. Cancer Epidem Biomark Prev 2007; 16 : 2745–2751.
26. Martinéz M, Aparicio Uj, Sanchis A, et al. Fiber bronchoscopy in lung cancer: relationship between radiology, endoscopy, histology and diagnostic value in a series of 1801 cases. Arch Bronconeumol 1994; 30 : 291–296.
27. Pavlovska I, Danilovski D, Orovchanec T. et al. An epidemiologic study of some characteristic of lung cancer. Folia Med (Plovdiv) 2004; 46 : 23–31.
28. Frank W, Loddenkemper R. Modern examination methods in pneumology. Versicherungsmedizin 1995; 47 : 191–200.
29. Annema J, Veselic M, Rabe F. EUS quided FNA of centrally located lung tumors following a non-diagnostic bronchoscopy. Lung Cancer 2005; 48, 357–361.
30. Saka H, Oki M, Kitagawa Ch, et al. Ultrathin bronchoscope in the diagnosis of peripheral lung lesions. Chest 2006; 130 (Suppl.): 110S.
31. Aono H, Okamoto H, Kunikane A, et al. Transbronchial needle aspiration cytology of subcarinal lymph nodes for staging procedure in the diagnosis of lung cancer. Respirology 2006; 11 : 782–785.
32. Papi A, Casoni G, Caramori I, et al. COPD increases the risk of squamous histological subtype in smokers who develope non-small cell lung cancer. Thorax 2004; 59 : 679–681.
33. Moro D, Villemain JP, Brambilla C, et al. CEA, CIFRA21-1 and SCC in non-small cell lung cancer. Lung Cancer 1995; 13 : 169–176.
34. Haapoja IS, Blendowski C. Superior vena cava syndrome. Semin Oncol Nurs 1999; 15 : 183–189.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- Chraňte děti před počítači a počítače před dětmi
- K diskuzi o etikoterapii
- Analýza anamnestických dat a výsledků vyšetření v souboru 353 nemocných s plicním karcinomem z let 2004–2007
- Zmírňování koktavosti bronchodilatací β2 sympatomimetikem formoterolem
- Závažná kožní toxicita po léčbě ifosfamidem, gemcitabinem a vinorelbinem u pacienta s relapsem Hodgkinova lymfomu a ichtyózou
- ROC analýza a využití analýzy nákladů a přínosů k určení optimálního dělícího bodu
- Vydechovaný oxid dusnatý a jeho korelace s bioptickými nálezy u pacientů s chronickým kašlem
- Subakutní tyreoiditida zaměněna za zubní problém
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- ROC analýza a využití analýzy nákladů a přínosů k určení optimálního dělícího bodu
- Subakutní tyreoiditida zaměněna za zubní problém
- Vydechovaný oxid dusnatý a jeho korelace s bioptickými nálezy u pacientů s chronickým kašlem
- Zmírňování koktavosti bronchodilatací β2 sympatomimetikem formoterolem
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career