-
Medical journals
- Career
Výživa kriticky nemocných endoskopicky zaváděnou trojluminální sondou – retrospektivní analýza
Authors: K. Balihar 1; I. Novák 1; A. Kroužecký 1; J. Raděj 1; R. Sýkora 1; J. Chvojka 1; J. Koželuhová 1; J. Baliharová 1; I. Chytra 2; M. Matějovič 1
Authors‘ workplace: JIP, I. interní klinika LF UK a FN, Plzeň 1; Anesteziologicko-resuscitační klinika FN, Plzeň 2
Published in: Čas. Lék. čes. 2008; 147: 516-520
Category: Original Article
Overview
Východisko.
Enterální výživa je u kriticky nemocných preferovaný způsob nutriční podpory, ale častým problémem je vysoká incidence intolerance gastrické enterální výživy. Jedním ze způsobů, jak urychlit dodání adekvátního množství výživy, je změna strategie výživy z gastrické na postpylorickou. Trojluminální enterální sonda (TES) umožňuje postpylorickou enterální výživu za současné dekomprese žaludku. Cílem studie bylo zhodnocení efektivity a bezpečnosti techniky endoskopicky zaváděné TES a zároveň její vztah k dosažení adekvátní dávky enterální výživy.Metody a výsledky.
Retrospektivní analýza 140 zavedených TES u 111 kriticky nemocných v období 2003 až 2006 ze dvou jednotek intenzivní péče (JIP) ve Fakultní nemocnici v Plzni zahrnovala soubor nemocných průměrného věku 54 let (± 15), APACHE II skóre 26 (± 10) a JIP mortality 24 %. Technicky neúspěšných zavedení bylo 8 (6 %). Znovuzavedení sondy si vyžádalo 21 pacientů (19 %). Průměrná doba vlastního zavedení TES byla 6 minut (± 3). V přímé souvislosti s endoskopickým výkonem nebyla zaznamenána žádná vážná komplikace. Zaznamenali jsme 34 ventilátorových pneumonií (31 %). Průměrný časový interval od přijetí pacienta k zavedení TES byl 7 dní (± 6). Zhodnocením podskupiny 77 pacientů z jedné JIP bylo zjištěno, že adekvátního množství EN bylo dosaženo u 82 % průměrně za 4 dny (± 3) od zavedení TES. TES byla zavedena v průměru 11 dní (± 7).Závěry.
Endoskopické zavedení TES je bezpečná a spolehlivá metoda k zajištění adekvátního množství enterální výživy u většiny kriticky nemocných s dysfunkcí trávicího traktu. V našich podmínkách není pravděpodobně výhod TES dostatečně využíváno.Klíčová slova:
enterální výživa, intenzivní péče, postpylorická enterální výživa, trojcestná sonda.Adekvátní nutriční režim a vhodně zvolená strategie podání jsou nedílnou součástí komplexní péče o kriticky nemocné. Enterální výživa (EN) je preferovaným způsobem výživy oproti parenterální výživě (PN), neboť je to cesta fyziologická, která pomáhá udržovat integritu střevní sliznice (1–4). Přítomnost nutrientů ve střevním lumen indukuje hyperémii střevní mukózy a brání rozvoji atrofie střevních klků. Tímto způsobem se snižuje riziko translokace střevních bakterií a jejich toxinů do krevního oběhu. Pacienti s EN mají nižší výskyt infekčních komplikací, kratší délku hospitalizace a v neposlední řadě nižší náklady na léčbu (5–7). V současné době by měla být EN standardně používána u všech nemocných, kde není zásadní kontraindikace pro EN (3). Otázkou diskuze a výzkumu zůstává, zda je výhodnější u nemocných na jednotce intenzivní péče (JIP) výživu podávat cestou gastrickou nebo postpylorickou (jejunální) (5–14). Gastrická EN je jednodušší a levnější, ale výsledky studií upozorňují na možnost, že u kriticky nemocných může být na podkladě často obleněné žaludeční motility vyšší riziko aspirace a následné pneumonie (5, 6). Tenké střevo u kriticky nemocných netrpí tak často poruchou motility jako žaludek a zavedení postpylorické výživy dovoluje efektivnější dodávku nutrientů. Zavedení této výživy je však technicky obtížnější a při užití monoluminální sondy neumožňuje současnou dekompresi žaludečního obsahu. Přidání gastrické sondy do druhého nosního otvoru k dekompresi žaludku zvyšuje riziko lokálních komplikací, především sinusitidy (15). Z tohoto pohledu se u kriticky nemocných s dysfunkcí horní části gastrointestinálního traktu (GIT) jeví jako ideální užití trojcestné sondy, jejíž součástí jsou celkem tři porty. Dva z nich slouží na dekompresi žaludečního obsahu a napolykaného vzduchu. Třetí port slouží pro vlastní postpylorickou EN (obr. 1).
Image 1. Správná pozice TES v horní části GIT 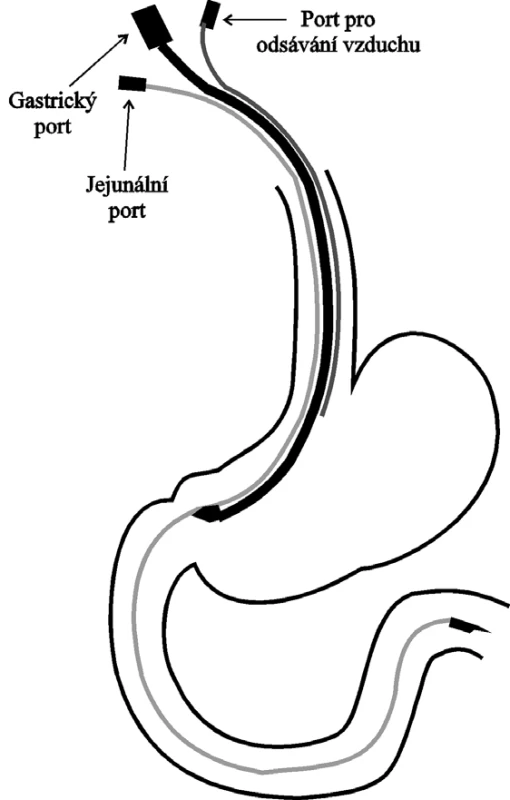
SOUBOR NEMOCNÝCH A POUŽITÉ METODY
Jedná se o retrospektivní analýzu dat získaných z lékařských záznamů. Hodnoceno bylo 140 zavedení trojluminální enterální sondy (TES) u 111 pacientů ze dvou JIP Fakultní nemocnice v Plzni v období od 1. 1. 2003 do 31. 10. 2006. Trojluminální sonda (Freka Trelumina CH/FR 16/9 150 cm, Fresenius Kabi AG, Německo) byla ve všech případech standardně zaváděna za endoskopické kontroly, popř. asistence a následně její poloha ověřována rentgenovým snímkem břicha s nástřikem malého množství kontrastní látky do jejunálního portu. Vlastní technika spočívá ve volném zavedení sondy do oblasti žaludku, následně se zavede endoskop a za kontroly zraku, s pomocí úchopových klíštěk je konec sondy zatažen do první kličky jejuna a endoskop poté vyjmut (obr. 1). Tato metoda zavedení sondy se začala uplatňovat na oddělení gastroenterologie I. interní kliniky Fakultní nemocnice v Plzni od roku 2002.
Indikací k zavedení byla vždy dysfunkce horní části GIT znemožňující gastrickou EN, kontraindikací byly obecné kontraindikace EN a/nebo endoskopie horní části trávicího traktu.
Analýza zahrnula obecné parametry populace pacientů s TES, interval od přijetí k zavedení sondy (interval P–Z) odrážející včasnost indikace, dále parametry charakterizující bezpečnost a efektivitu techniky zavedení TES. V podskupině pacientů z JIP1 (77 pacientů) byla zjištěna průměrná doba zavedení TES a čas potřebný k dosažení adekvátního množství EN. Za adekvátní množství EN bylo považováno alespoň 70 % doporučeného množství dle doporučení ESPEN (The European Society for Clinical Nutrition and Metabolism), tj. 17,5 kcal/den/kg ideální tělesné hmotnosti (3).
Sledován byl také výskyt ventilátorových pneumonií (VAP). Ke statistickému zpracování byl použit statistický software (STATISTICA 7.0 BASE, StatSoft s.r.o., Česká republika) použity byly chí kvadrát test a t-test, při hodnotě p < 0,05 byly výsledky hodnoceny jako významně rozdílné. Data jsou vyjádřena jako četnost v procentech nebo průměr se směrodatnou odchylkou.
VÝSLEDKY
Obecná charakteristika populace pacientů se zavedenou TES
Soubor nemocných byl průměrného věku 54 let (± 15), průměrný APACHE II činil 26 (± 10), převládali muži (62 %), úhrnná mortalita na JIP činila 24 % (27 pacientů). Z celkového počtu pacientů hospitalizovaných na JIP pracovištích ve stejném období byl procentuální podíl pacientů se zavedenou TES 4 % (JIP1 2 %, JIP2 9 %) (tab. 1).
Table 1. Vztah pacientů se zavedenou TES a celkové JIP populace 
1. číselný údaj v okénku vztažen k pacientům s TES, 2. číselný údaj v okénku vztažen k celkovému počtu hospitalizovaných na obou JIP. V závorce ve sloupci 1 je uveden podíl pacientů s TES vůči celkovému počtu hospitalizovaných na obou JIP vyjádřený v procentech. Mortalita je prezentována v procentech, věk a APACHE II skóre jako průměr.
Technické aspekty zavedení TES
Primární selhání endoskopisty při zavádění bylo dle následných rentgenových snímků břicha na polohu sondy zaznamenáno v 8 případech z celkového počtu 140 zavedení (6%), tzn., že úspěšnost endoskopického zavedení TES byla 94 %. Všechna neúspěšná zavedení byla zaznamenána v roce 2003 a 2004, kdy se metoda na pracovišti zaváděla. Průměrná doba zavedení (měřeno od zavedení do vytažení endoskopu) byla 6 minut (± 3). Tento údaj byl měřen prospektivně na souboru 20 za sebou následujících zavedení sondy. Znovuzavedení TES bylo vyžádáno z tohoto souboru u 21 pacientů (19 %). Celkem bylo provedeno 29 znovuzavedení (21 %), protože někteří pacienti měli TES zaváděnou opakovaně (tab. 2). Nejčastějším důvodem znovuzavedení sondy bylo vytažení sondy pacientem či dislokace při manipulacích s pacientem, na druhém místě pak nové zavedení sondy bylo indikováno pro technicky neúspěšné zavedení. Na sledovaném souboru pacientů nebyla zaznamenána žádná vážná komplikace charakteru krvácení či perforace.
Table 2. Příčiny znovuzavedení TES 
ERCP – endoskopická retrográdní cholangiopankreatikografie Vztah mezi TES a dosažením adekvátního množství EN
Průměrný interval P–Z byl 7 dní (± 6). Zhodnocením podskupiny 77 pacientů z jedné JIP bylo adekvátně enterálně živených 82 % v průměru za 4 dny (± 3) od zavedení TES. Čtrnáct pacientů nedosáhlo po dobu zavedení TES adekvátní EN. Důvodem byla nejčastěji hemodynamická nestabilita (8 pacientů) vzniklá v dalším průběhu hospitalizace, dále časná dislokace TES (4 pacienti), kdy stav pacienta si následně vyžádal jiný způsob výživy, krvácení do GIT (1 pacient) a náhlá příhoda břišní s nutností laparotomie (1 pacient). TES byla zavedena v průměru 11 dní (± 7).
Další srovnání a údaje v rámci populace pacientů s TES
Mezi pacienty se zavedenou TES dominovala příjmová diagnóza septického šoku (41 %), následovaná diagnózou akutní pankreatitidy s nutností laparotomie (17 %) (tab. 3).
Table 3. Základní diagózy u pacientů s TES 
KPR – kardiopulmonální resuscitace, CHOPN – chronická obstrukční plicní nemoc Soubor pacientů se zavedenou TES byl tvořen 79 (71 %) interně a 32 (29 %) chirurgicky nemocnými. Interně nemocní měli oproti chirurgickým statisticky významně vyšší příjmové APACHE II skóre (28 (± 10) vs. 21 (± 9), p < 0,05), avšak kratší průměrnou dobu hospitalizace (21 (± 12) vs. 34 (± 20), p < 0,05), zatímco výskyt VAP, mortalita a interval P–Z u obou podskupin byly srovnatelné (tab. 4 a 5).
Table 4. Srovnání chirurgicky a interně stonajících pacientů s TES 1/2 
JIP mortalita a výskyt VAP prezentovány v procentech, APACHE II skóre jako průměr a směrodatná odchylka. a významný rozdíl mezi skupinami (p < 0,05), (chí kvadrát test, t–test) Table 5. Srovnání chirurgicky a interně stonajících pacientů s TES 2/2 
PDH – průměrná doba hospitalizace, avýznamný rozdíl mezi skupinami (p < 0,05), (t-test) Prezentovaná data jsou průměr a směrodatná odchylka. DISKUZE
Dysfunkce GIT je velmi frekventní komponentou multiorgánového selhání. Projevuje se poruchou evakuace žaludku s následnou stagnací žaludečního obsahu, která komplikuje běžnou nazogastrickou výživu. K adekvátnímu zajištění dostatečného přísunu nutrientů je pak často aplikována PN, která je pro pacienty nefyziologická, je spojena s vyšším procentem infekčních komplikací a je ekonomicky náročnější. Tento problém může být příznivě ovlivněn zavedením TES, která umožňuje jejunální EN. Shang udává snížení nákladů užitím TES o 90 % oproti PN (16).
Výsledky studií srovnávající gastrickou a jejunální výživu u kriticky nemocných s dysfunkcí GIT spíše prokazují, že jejunální EN urychlí dosažení náležitého objemu výživy, sníží procento infekčních komplikací i délku hospitalizace (5, 6, 12, 16, 17). Žádná z těchto prospektivních studií neprokázala vliv na mortalitu. Doporučení ESPEN konstatují, že není významného rozdílu v účinnosti mezi gastrickou a jejunální EN (doporučení stupně C) a nedoporučují postpylorickou výživu k paušální aplikaci u všech kriticky nemocných (doporučení stupně A). Nicméně tam, kde je prokázána intolerance gastrického krmení, je postpylorická výživa doporučena (doporučení stupně C) (3).
Endoskopické zavedení TES je dle studií Shanga a Daviese velmi bezpečnou a časově nenáročnou metodou, která je v rukou zkušeného endoskopisty spojena s minimálním technickým neúspěchem (16, 17). Vážné komplikace charakteru krvácení či perforace GIT nebyly zaznamenány. Prakticky shodné závěry vykazuje i námi provedená analýza (94% úspěšnost). Z komplikací, které si vyžádaly reendoskopii se znovuzavedením TES (29 ze 140 zavedení, tj. 21 %), byly na prvním místě komplikace spojené s dislokací sondy (48 % všech reendoskopií). K té docházelo při manipulacích s pacientem nebo si pacient sondu dislokoval sám. Na druhém místě bylo příčinou reendoskopie technicky nesprávné zavedení (28 % všech znovuzavedení), ke kterým však docházelo jen v prvních letech sledovaného období. Následná reendokospie se znovuzavedením sondy přináší pro pacienta dyskomfort, často nutnost sedace a v neposlední řadě je také ekonomicky náročná. Tyto komplikace lze alespoň částečně ovlivnit správnou edukací a pozorností zdravotnického personálu.
Zajímavé výsledky k zamyšlení vyplývají ze vztahu mezi postpyloricky vedenou EN pomocí TES a dosažením adekvátního množství EN, kterou jsme hodnotili u podskupiny pacientů z jedné JIP (77 pacientů). V analýze jsme stanovili jako adekvátní množství EN dosažení 70% cíle dle doporučení ESPEN, tj. 17,5 kcal/den/kg ideální tělesné hmotnosti. Některé studie naznačují, že pacienti i s ještě nižším kalorickým příjmem mají lepší výsledky (18). Výše uvedeného množství EN dosáhlo celkem 82 % pacientů, a to v průměru za 4 dny, což by pravděpodobně gastrickou výživou nebylo možné. Přičteme-li však ještě průměrný interval od přijetí pacienta k zavedení TES (7 dní), obdržíme poměrně velmi dlouhý časový úsek 11 dní, kdy nebyl pacient adekvátně enterálně živen. Z toho vyplývá, že preemptivní zavedení TES u vytipované populace, u které předpokládáme déletrvající dysfunkci GIT, může být pro pacienta přínosem, jak již některé studie naznačují (19).
Zbylých 18% pacientů po dobu zavedení TES nedosáhlo adekvátní dávky EN. Důvodem byla ve většině případů velmi vysoká tíže stonání s následnými většinou septickými komplikacemi ústícími v hemodynamickou nestabilitu a úmrtí (10 pacientů), u 4 pacientů se jednalo o časnou dislokaci TES a výživa pak byla řešena jiným způsobem, než zavedením TES. TES byla zavedena v průměru 11 dní (nejdéle až 31 dní).
Otázkou zůstává, proč při poměrně nízkém riziku během zavádění TES a relativně časně dosažitelné adekvátní EN u většiny pacientů, bylo její zavedení málo indikováno. Při průměrném vstupním APACHE II skóre 26 (± 10) lze očekávat vyšší podíl pacientů s multiorgánovým selháním s dysfunkcí trávicího traktu, kteří by mohli profitovat z tohoto léčebného přístupu. Velký rozdíl v počtu indikací k zavedení TES mezi jednotlivými JIP pracovišti v naší analýze (2 vs. 9 %) lze jen částečně vysvětlit převahou chirurgických pacientů na JIP1 oproti převaze interních pacientů na JIP2. Interně nemocní ve srovnání s chirurgicky nemocnými měli signifikantně vyšší vstupní APACHE II skóre, i když jejich mortalita však byla statisticky srovnatelná. Dalším důvodem celkově nízké frekvence zavádění TES může být i nedostatečná pozornost k samotné indikaci.
Kontroverzní otázkou zůstává možnost snížení rizika VAP u jejunální oproti gastrické EN. V některých studiích nebyl zaznamenán signifikantní rozdíl mezi gastrickou a postpylorickou výživou (5, 12–14). Incidence VAP u jejunálně živených pacientů z naší analýzy (31 %) a u souboru pacientů ze studií Kortbeeka a Monteja byla podobná, i když tito pacienti měli významně jiné vstupní diagnózy (pacienti s polytraumatem a bez selekce) a odlišné průměrné APACHE II skóre (18 ± 6 a 18 ± 7) (5, 12).
ZÁVĚR
Lze konstatovat, že technika endoskopického zavedení TES je spolehlivá metoda v rukou trénovaného endoskopisty a jejím prostřednictvím lze zajistit adekvátní množství EN u většiny kriticky nemocných s dysfunkcí trávicího traktu. Jistou výhodou je i možnost zhodnocení horní části trávicího traktu u kriticky nemocných. Zavedení TES je pravděpodobně v našich podmínkách ještě ne zcela doceněným postupem.
Zkratky
EN – enterální výživa
ESPEN – European Society for Parenteral and Enteral Nutriton
GIT – gastrointestinální trakt
JIP – jednotka intenzivní péče
PN – parenterální výživa
TES – trojluminální enterální sonda
VAP – ventilátorová pneumonie
Podporováno MSM 0021620819 – Náhrada a podpora funkce životně důležitých orgánů.
MUDr. Karel Balihar
I. interní klinika – oddělení gastroenterologie LF UK a FN
Alej Svobody 80, 304 60 Plzeň
fax: +420 377 103 381, e-mail: balihar@fnplzen.cz
Sources
1. Braunschweig, C. L., Levy, P., Sheean, P. M., Wang, X.: Enteral compared with parenteral nutrition: a meta-analysis. Am. J. Clin. Nutr., 2001, 74, s. 534–542.
2. Lipman, T. O.: Grains or veins: is enteral nutrition really better than parenteral nutrition? A look at the evidence. JPEN J. Parent. Ent. Nutrition, 1998, 22, s. 167–182.
3. Kreymann, K. G., Berger, M. M., Deutz, N. E. P. et al.: ESPEN Guidelines on Enteral nutrition: Intensive Care. Clinical Nutrition, 2006, 25, s. 210–223.
4. D. K., Dhalival, R., Drover, J. W. et al.: Canadian Clinical Praktice Guidelines for Nutrition Support in Mechanically Ventilated, Critically Ill Adult Patient. 2003, 27, s. 355–373.
5. Kortbeek, J. B., Haigh, P. I., Doig, C.: Duodenal versus gastric feeding in ventilated blunt trauma patients: a randomized controlled trial. J. Trauma, 1999, 46, s. 992–996.
6. Montecalvo, M. A., Steger, K. A., Farber, H. W. et al.: Nutritional outcome and pneumonia in critical care patients randomized to gastric versus jejunal tube feedings. The Critical Care Research Team [see comments]. Crit. Care Med., 1992, 20, s. 1377–1387.
7. Tailor, S. J., Fettes, S. B., Jewkes, C., Nelson, R. J.: Prospective, randomized, controlled trial to determine the effect of early enhanced enteral nutrition on clinical outcome in mechanically ventilated patients suffering head injury. Crit. Care Med., 1999, 27, s. 2525–2531.
8. Boivin, M. A., Levy, H.: Gastric feeding with erythromycin is equivalent to transpyloric feeding in the critically ill. Crit. Care Med., 2001, 29, s. 1916–1919.
9. Esparza, J., Boivin, M. A., Hartshorne, M. F., Levy, H.: Equal aspiration rates in gastrically and transpylorically fed critically ill patients. Int. Care Med., 2001, 27, s. 660–664.
10. Kearns, P. J., Chin, D., Mueller, L. et al.: The incidence of ventilator-associated pneumonia and success in nutrient delivery with gastric versus small intestinal feeding: a randomized clinical trial. Crit. Care Med., 2000, 28, s. 1742–1746.
11. Minard, G., Kudsk, K. A., Melton, S. et al.: Early versus delayed feeding with an immune-enhancing diet in patients with severe head injuries. JPEN J. Parenter. Enteral Nutr., 2000, 24, s. 145–149.
12. Montejo, J. C., Grau, T., Acosta, J. et al.: Multicenter, prospective, randomized, single-blind study comparing the efficacy and gastrointestinal complications of early jejunal feeding with early gastric feeding in critically ill patients. Crit. Care Med., 2000, 30, s. 796–800.
13. Neumann, D. A., Delegge, M. H.: Gastric versus small-bowel tube feeding in the intensive care unit: a prospective comparison of efficacy. Crit. Care Med., 2002, 30, s. 1436–1438.
14. Day, L., Stotts, N. A., Frankfurt, A. et al.: Gastric versus duodenal feeding in patients with neurological disease: a pilot study. J Neurosci. Nurs., 2001, 33, s. 148–149.
15. Desmond, P., Raman, R., Idikula, J.: Effect of nasogastric tubes on the nose and maxillary sinus. Crit. Care Med., 1991, 19, s. 509–511.
16. Shang, E., Kahler, G., Meier-Hellmann, A., Scheele, J.: Advantages of endoscopic terapy of gastrojejunal feeding dissociation in critical care patients. Int. Care Med., 1999, 25, s. 162–165.
17. Davies, A. R., Froomes, P. R., French, C. J. et al.: Randomized comparison of nasojejunal and nasogastric feeding in critically ill patients. Crit. Care Med., 2002, 30, s. 714–716.
18. Krishnan, J. A., Parce, P. B., Martinez, A. et al.: Caloric intake in medical ICU patients: consistency of care with guidelines and relationship to clinical outcomes. Chest, 2003, 124, s. 297–305.
19. Marik, P. E., Zaloga, G. P.: Early enteral nutrition in acutely ill patients: a systematic review. Crit. Care Med., 2001, 29, s. 2264–2270.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- Vzácná diagnóza: CD4⁺56⁺ leukémie z dendritických buněk typu DC2
- Výživa kriticky nemocných endoskopicky zaváděnou trojluminální sondou – retrospektivní analýza
- Atrézie a stenózy duodena
- Sebevražedné pokusy v souboru mladých dospělých – výsledky studie ELSPAC
- Průběh těhotenství a porodu při vrozeném deficitu antitrombinu typu II
- Léčba hemosuccus pancreaticus embolizací obou gastrických tepen
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Atrézie a stenózy duodena
- Průběh těhotenství a porodu při vrozeném deficitu antitrombinu typu II
- Výživa kriticky nemocných endoskopicky zaváděnou trojluminální sondou – retrospektivní analýza
- Vzácná diagnóza: CD4⁺56⁺ leukémie z dendritických buněk typu DC2
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

