-
Medical journals
- Career
Chronická obstrukční plicní nemoc – diagnóza a léčba stabilní fáze onemocnění; personalizovaný přístup k léčbě s využitím fenotypických rysů nemoci Souhrn pozičního dokumentu České pneumologické a ftizeologické společnosti 2020–2021
Authors: doc. MUDr. Kristián Brat, Ph.D. 1,2; Jaromír Zatloukal 3,4; Kateřina Neumannová 5; MUDr. Eva Voláková, Ph.D. 3,4; Ondřej Kudela 6,7; Michal Kopecký 6,7; Marek Plutinský 1,2; Vladimír Koblížek 6,7
Authors‘ workplace: Klinika nemocí plicních a tuberkulózy, Fakultní nemocnice Brno 1; Lékařská fakulta Masarykovy Univerzity, Brno 2; Klinika plicních nemocí a tuberkulózy, Fakultní nemocnice Olomouc 3; Lékařská fakulta Univerzity Palackého, Olomouc 4; Katedra fyzioterapie, Fakulta tělesné kultury, Univerzita Palackého, Olomouc 5; Plicní klinika, Fakultní nemocnice Hradec Králové 6; Lékařská fakulta v Hradci Králové, Univerzita Karlova 7
Published in: Vnitř Lék 2021; 67(4): 230-239
Category: Review Articles
Overview
Chronická obstrukční plicní nemoc (CHOPN) je nejčastější chronická plicní nemoc, která postihuje stovky milionů lidí ve světě a je asociována se signifikantní morbiditou a mortalitou. V této přehledné práci autoři představují internistům aktuální koncept péče o pacienty s CHOPN, souhrn nejdůležitějších poznatků a doporučení formulované expertní skupinou České pneumologické a ftizeologické společnosti ČLS JEP. Detailnější verze pozičního dokumentu byla publikována v roce 2020 v anglickém jazyce. Cílem autorů této práce bylo přetavit nejnovější vědecké poznatky do kontextu reálné medicínské praxe v České republice. Koncept péče o pacienty s CHOPN je založen na komplexnosti přístupu k pacientovi s respektováním individuálních rysů jeho nemoci a snahou o maximální možnou míru individualizace léčby.
Klíčová slova:
CHOPN – poziční dokument – fenotypy – léčitelné rysy – individualizovaná léčba – personalizovaná medicína
Úvod
Chronická obstrukční plicní nemoc (CHOPN) je závažná nemoc postihující stovky milionů lidí ve světě (1). CHOPN je asociována se signifikantní mortalitou, morbiditou a ekonomickou zátěží. V předchozích letech byla publikována celá řada národních i mezinárodních doporučení k léčbě CHOPN (1–3).
Českou pneumologickou a ftizeologickou společností (ČPFS) byl pověřen expertní tým ze Sekce chorob s bronchiální obstrukcí k aktualizaci dokumentu věnovaného diagnostice a léčbě stabilní CHOPN, jehož první verze byla publikována v roce 2013 (4). V roce 2019 proběhlo několik setkání pracovní skupiny a rozdělení práce (systematické hledání literatury, posuzování relevance důkazů). Přispěním všech členů týmu byla postupně prodiskutována a vytvořena revidovaná verze, jenž byla publikována na konci roku 2020 ve formě systematické práce (5).
Úmyslem autorů dokumentu bylo vytvořit soubor doporučení, který by byl založen nejen na vědeckých důkazech z velkých randomizovaných studií, ale i prací z reálné klinické praxe, a to v kontextu možností zdravotnického systému České republiky (ČR). V ČR je kolem 90 % pacientů s CHOPN léčeno v praxích pneumologů, lze tak zajistit velmi podrobnou diagnostiku a rozsah poskytované léčby. V rámci tohoto pozičního dokumentu je kladen důraz na komplexní léčbu CHOPN a jejích přidružených komorbidit, s maximální možnou mírou individualizace přístupu a léčby (5).
Definice a patofyziologie
CHOPN je preventabilní a léčitelná nemoc charakterizovaná perzistujícími respiračními symptomy, bronchiální obstrukcí a abnormitami dolních cest dýchacích a plicních alveolů, obvykle v důsedku expozice inhalačním noxám. Uplatňují se i další faktory, například genetika či alterovaný prenatální vývoj. Nejčastějšími symptomy jsou dušnost, kašel a expektorace sputa (1, 6).
CHOPN je heterogení nemoc s množstvím plicních i mimoplicních charakteristik a souběžných chorobných stavů. Plicní složka je charakterizována alespoň zčásti ireverzibilní bronchiální obstrukcí. CHOPN vzniká v důsledku dlouhodobých zánětlivých dějů v důsledku expozice inhalačním noxám (1). Uplatňují se procesy oxidativního stresu, nerovnováhy proteáz a antiproteáz a zvýšené aktivace prozánětlivých buněk, zejména neutrofilů a T-lymfocytů (7), u části pacientů se uplatňuje i eozinofilní typ zánětu (8, 9). Chronický zánět vede k progresivnímu odbourávání elastických vláken, peribronchiální fibróze, destrukci stěn alveolů, mikrovaskulatury a malých bronchů, remodelaci dýchacích cest a chronické hypersekreci hlenů (7, 10). Funkčními důsledky jsou obstrukce dýchacích cest, air trapping, hyperinflace, poruchy výměny plynů a snížená výkonnost i funkční kapacita (11, 12). Ze systémových efektů jsou pozorovány vyšší riziko vzniku kardiovaskulárních nemocí, osteoporózy, sarkopenie, deprese, kachexie, diabetu mellitu nebo syndromu spánkové apnoe, ale také karcinomu plic (13–18).
Výše uvedené mechanismy jsou u pacientů exprimovány s různou mírou variability a vedou tak k rozdílné manifestaci nemoci u individuálních pacientů. Mluvíme tak o klinických fenotypech a léčitelných rysech nemoci (3–5, 19, 20).
Rizikové faktory
Kouření tabáku (aktivní i pasivní) a další domácí i pracovní expozice jsou považovány za hlavní vyvolávající příčiny vzniku CHOPN (1). Uplatňují se i: dětské astma, nízká porodní váha, časté respirační infekty v dětském věku a prodělaná tuberkulóza plic či HIV infekce (21–25), z genetických faktorů deficit alfa-1-antitrypsinu (A1AT) a polymorfismy genů pro glutation S-transferázu, matrix metaloproteinázy a superoxiddismutázy (26–30).
Epidemiologie
Epidemie kouření ve světě, stárnutí populace a zvýšená environmentální zátěž vedou ke zvýšené prevalenci nemoci (31, 32), aktuálně odhadovanou na 11,7 % světové populace (32). V ČR je prevalence odhadována na cca 6,7 % populace, tedy cca 710 tisíc pacientů, v pravidelném sledování je přitom pouze cca 230 tisíc nemocných (33).
Zhodnocení rizika
CHOPN je v ČR příčinou úmrtí cca 3 200–3 500 pacientů ročně (33, 34). Stanovení prognózy pacienta s CHOPN by tak mělo být jedním ze základních úkolů ošetřujícího lékaře. V dnešní době jsou k tomuto účelu používány kompozitní prognostické nástroje – indexy ADO a BODE (35, 36). Naše výzkumná skupina zkonstruovala prognostický nástroj CADOT, který předchází některým nevýhodám indexů BODE a ADO a doporučujeme ho k používání v denní praxi (37).
Diagnóza a úvodní klasifikace nemoci
Základem diagnózy CHOPN je spirometrické vyšetření s průkazem post-bronchodilatační obstrukce dýchacích cest. Indikací ke spirometrickému vyšetření je chronická dušnost, kašel a expektorace sputa (38). Pro stanovení definitivní diagnózy je nutné vyloučit alternativní diagnózy, zejména bronchiální astma, bronchiolitidu, bronchiektázie, cystickou fibrózu, primární ciliární dyskinezi, gastroezofageální refluxní nemoc, tracheobronchomalácii, stenózu trachey, sarkoidózu, embolizaci do plicnice a srdeční selhání (1). Z dalších funkčních vyšetření je potřebné provedení bodypletysmografie a vyšetření difuzní kapacity plic pro oxid uhelnatý, které přinesou informaci o případném podezření na emfyzém, plicní hypertenzi či srdeční selhání (1, 39).
Základní evaluace stavu pacienta s CHOPN by měla zahrnovat: zhodnocení inhalačních rizik, míru/úroveň symptomů, funkční vyšetření plic, laboratorní vyšetření a zobrazovací vyšetření (Obr. 1).
Image 1. Pět základních kamenů (pilířů) diagnózy CHOPN potřebných k optimálnímu managementu nemoci 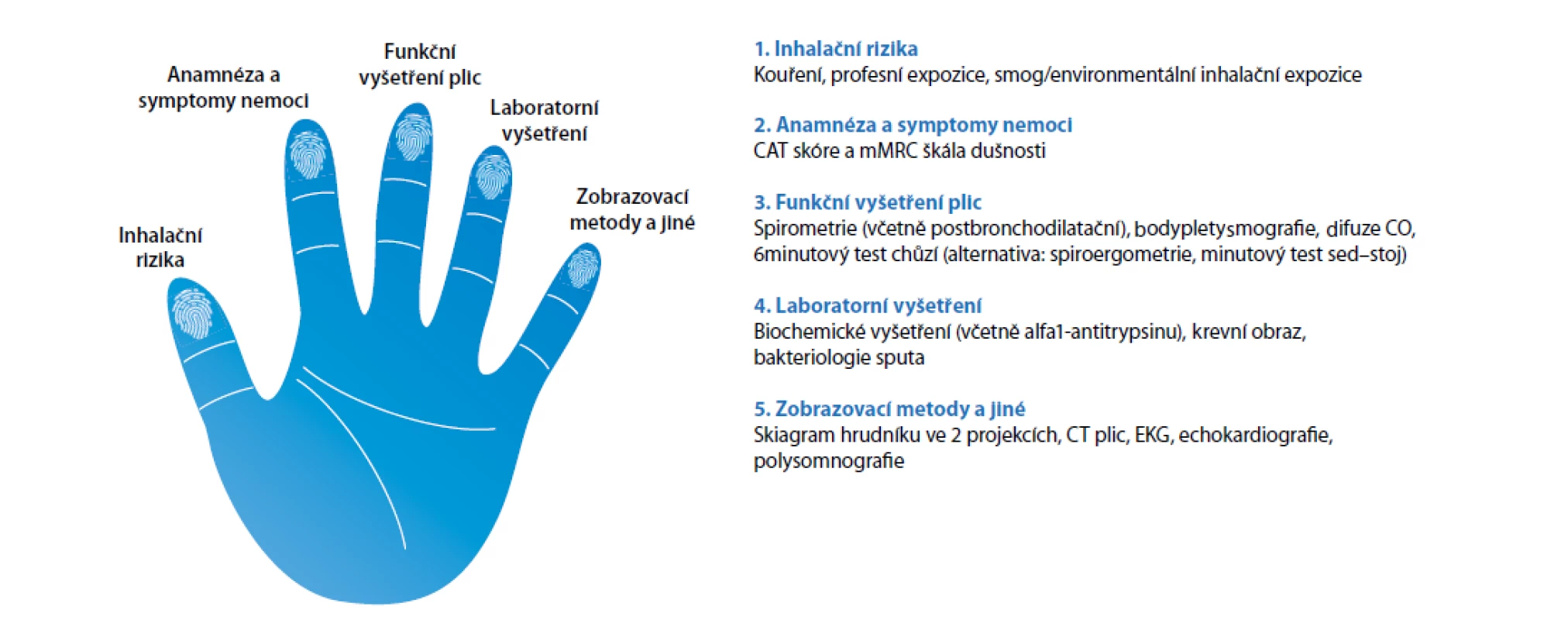
Základní klasifikace nemoci v našem konceptu zahrnuje klasifikaci do stadií I-IV dle Global Initiative for Chronic Obstructive Lung Disease (GOLD), zároveň do skupin A až D dle GOLD a popis fenotypů nemoci (1). Provádíme zhodnocení míry symptomů pomocí dotazníků CAT (COPD Assessment Test) a škály mMRC (modified Medical Research Council) a počtu exacerbací za posledních 12 měsíců. Skupina A reprezentuje asymptomatické pacienty v časném stadiu nemoci, skupina B je zatížena komorbiditami a vyšším rizikem mortality (40), skupina C jsou oligosymptomatičtí pacienti, skupina D jsou pacienti s nejtěžším stavem a s vysokým rizikem mortality.
Fenotypy CHOPN
CHOPN není unifmormní nemoc, ale reprezentuje kontinuum různých subtypů nemoci, které sdílejí stejné biologické mechanismy a projevují se podobnými klinickými, funkčními, radiologickými či biologickými znaky, které mohou vyžadovat specifická léčebná opatření (4, 5, 19, 41). Mluvíme tak o léčitelných rysech nemoci. Ve španělském konceptu je jednomu pacientovi přiřazen jeden dominantní fenotyp, v českém konceptu je popsáno 6 základních fenotypů a jeden pacient může být nositelem jednoho či více fenotypů zároveň (Obr. 2) (3–5, 41). Fenotypy se mohou měnit v čase (např. vznikat nové apod.).
Image 2. Tři přístupy ke klasifikaci CHOPN: A – všichni pacienti jsou léčeni stejným způsobem bez ohledu na specifika nemoci (ve světě dominantně používaný systém); B – kategorizace pacientů do podskupin dle dominantního fenotypu nemoci (španělský přístup); C – jeden pacient může mít několik fenotypických „nálepek“ a léčeny jsou všechny rysy nemoci současně (český přístup) 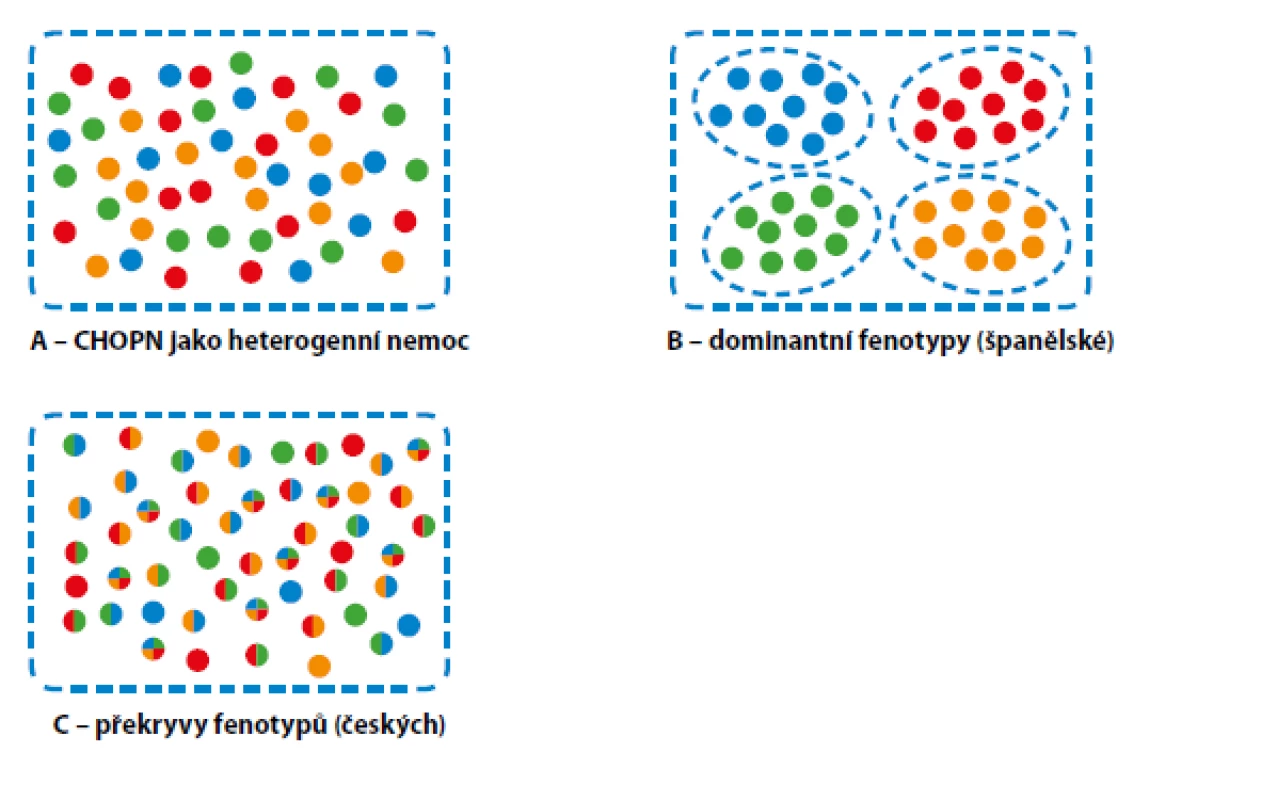
FREKVENTNÍ EXACERBÁTOR
Ataky nemoci, během kterých dochází ke zhoršení symptomů vybočujících z běžné denní variability, v délce trvání ≥ 2 dnů a vyžadujících změnu medikace, nazýváme akutní exacerbace (AE) CHOPN (1). Výskyt AE má signifikantní vliv na plicní funkce, kvalitu života, průběh nemoci i mortalitu (42). Frekventní exacerbátoři mají vyšší riziko výskytu exacerbací i v budoucnu (43). Fenotyp frekventního exacerbátora definujeme jako pacienta s výskytem ≥ 2 AE/rok vyžadujících antibiotickou léčbu a/nebo systémové kortikoidy (středně těžké AE) nebo hospitalizaci (těžké AE). Snížení výskytu AE může mít pozitivní vliv na stav pacienta i jeho prognózu (1).
BRONCHITICKÝ FENOTYP
Je charakterizován chronickým kašlem, ve většině případů produktivním (4, 5, 44). Pacienti s bronchitickým fenotypem mají horší respirační symptomy a vyšší riziko exacerbací (45).
EMFYZEMATICKÝ FENOTYP
Pacienti s emfyzémem mají obvykle vyšší míru dušnosti, obvykle s absencí produkce sputa (vyjma případů se souběhem bronchitického fenotypu či BCO). Podezření na přítomnost emfyzému by mělo být vysloveno u pacientů se soudkovitým tvarem hrudníku a se známkami emfyzému na skiagramu hrudníku nebo hyperinflací plic v rámci výsledku funkčního vyšetření plic. Ve většině případů je nutné provedení HRCT plic k potvrzení a ke zhodnocení charakteru, rozsahu a distribuce emfyzému (4, 5, 46).
PŘEKRYV ASTMA S CHOPN (ACO)
ACO je charakterizováno perzistentní bronchiální obstrukcí a přítomností souběžných klinických rysů CHOPN i astmatu (4, 5). Pacienti s ACO mají typicky výraznější symptomy, horší kvalitu života, častější AE a větší spotřebu zdravotní péče (47). ACO zahrnuje dva subtypy, a to: a) astma kuřáků s remodelací dýchacích cest a neúplnou reverzibilitou bronchiální obstrukce a b) eozinofilní typ CHOPN (48).
ČPFS definuje ACO za pomoci přítomnosti dvou velkých nebo jednoho velkého a dvou malých kritérií (Tab. 1).
Table 1. Diagnostická kritéria pro ACO. Pro diagnózu svědčí přítomnost dvou velkých nebo jednoho velkého a dvou malých kritérií 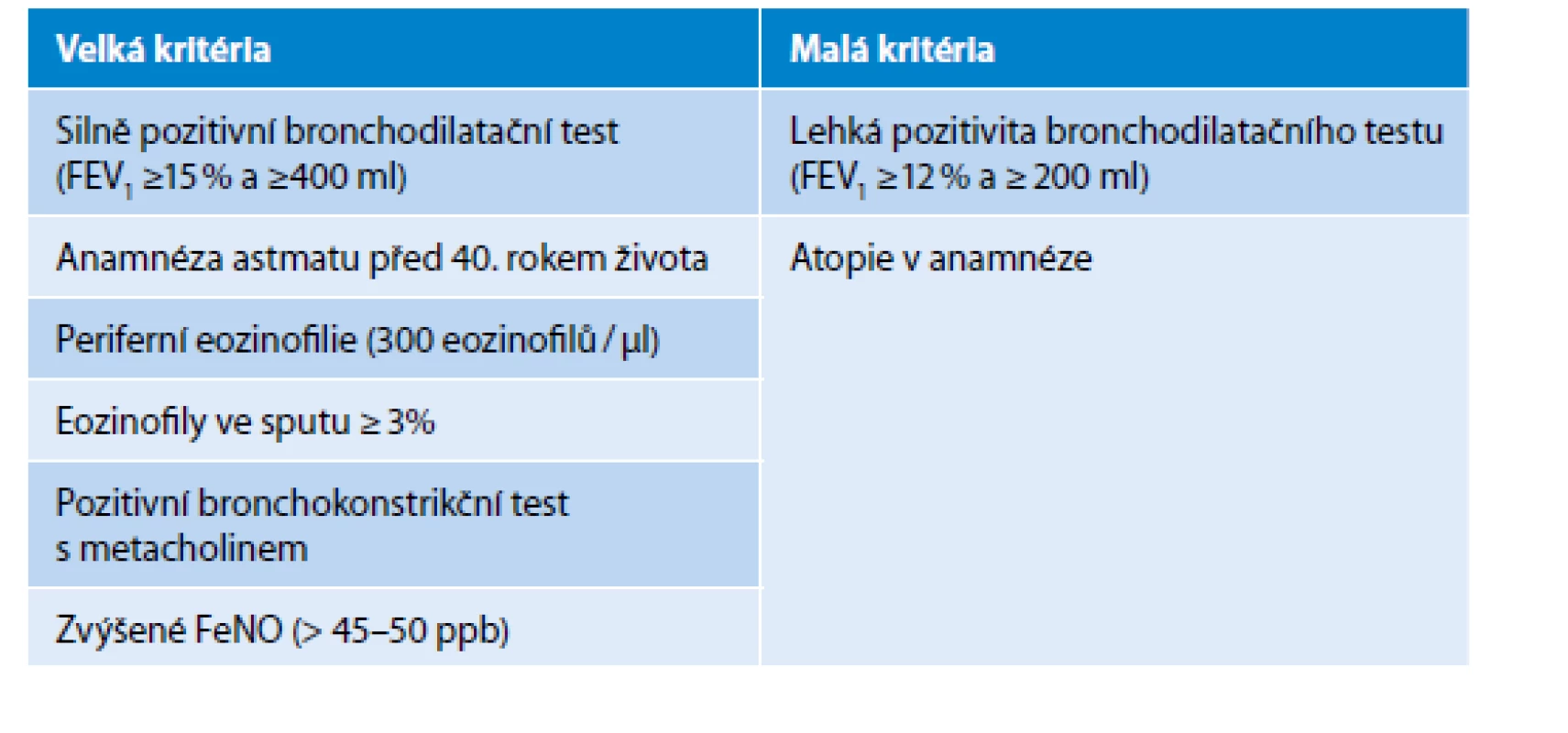
PŘEKRYV CHOPN S BRONCHIEKTÁZIEMI (BCO)
BCO se vyskytuje s vyšší mírou pravděpodobnosti v pokročilejších stadiích CHOPN (zejména stadia III a IV dle GOLD). BCO je asociováno s výraznějším zánětem v dolních dýchacích cestách a horšími plicními funkcemi (49, 50). Na přítomnost bronchiektázií by mělo být pomýšleno u pacientů s mírou symptomů neadekvátní tíži onemocnění, častými exacerbacemi, opakovanými respiračními infekcemi a kolonizací dolních dýchacích cest (zejména Pseudomonas aeruginosa). Pro diagnózu je nezbytné provedení HRCT s nálezem zjevných bronchiektázií v nejméně dvou segmentech (4, 5, 51, 52).
PLICNÍ KACHEXIE
Přibližně 5–10 % pacientů s CHOPN vykazuje tendenci k pomalému a postupnému poklesu tělesné váhy a změnám kompozice těla, bez jakékoliv příčinné souvislosti s jiným (např. nádorovým) onemocněním. Plicní kachexie je asociována s vyšším rizikem mortality pacientů s CHOPN (53). Kritériem pro tento fenotyp je body mass index (BMI) < 21 a fat-free mass index (FFMI) < 16 kg/m2 u mužů a < 15 kg/m2 u žen (5, 54–56). Prevalence kachexie stoupá s vyššími stadii CHOPN a bývá asociována s přítomností emfyzému.
KOINCIDENCE VÍCE FENOTYPŮ
Koincidence chronické bronchitidy a frekventních exacerbací nebo BCO a frekventních exacerbací je asociována s horší kvalitou života a průběhem nemoci (43). Souběh přítomnosti emfyzému, kachexie a častých exacerbací je asociován s výrazně horší prognózou (57).
CHOPN je často asociována s přítomností jiných nemocí/komorbidit: karcinomem plic, ischemickou chorobou srdeční a chronickým srdečním selháním, pneumokoniózou či jinými fibrotizujícími nemocemi plic, anxiózně - depresivní poruchou, osteoporózu, anémií, vředovou chorobou gastroduodena nebo jícnovou refluxní nemocí a syndromem obstrukční spánkové apnoe (1, 58, 59). Někteří autoři mluví o komorbidním fenotypu.
SCREENING CHOPN V ČESKÉ REPUBLICE
Cílené programy časného záchytu CHOPN ve vysoce rizikové (zejména kuřáci a bývalí kuřáci) a symptomatické (s minimálně jedním respiračním příznakem) populaci jsou extrémně efektivní (60, 61).
V České republice probíhá projekt „Časný záchyt CHOPN v rizikové populaci“, který je financován Ministesrtvem zdravotnictví a Evropským sociálním fondem a spravován Ústavem zdravotnických informací a statistiky ČR. Cílovou populací jsou osoby ve věku 40–69 let s anamnézou kouření tabáku (> 10 krabičkoroků) a percepcí dušnosti při běžných denních aktivitách (rychlejší chůze, chůze do schodů). Rizikové osoby jsou aktivně vyhledávány svými praktickými lékaři nebo mohou vstoupit do programu i na základě vlastní žádosti. U rizikových osob splňujících kritéria programu je provedeno pneumologické vyšetření cíleně zaměřené na detekci CHOPN.
TERAPIE CHOPN
9.1. STRATEGIE LÉČBY
Léčba CHOPN by měla reflektovat komplexnost a heterogenitu nemoci u každého jednotlivce (19). Základním cílem je redukce symptomů, počtu a závažnosti exacerbací a zlepšení kvality života. Na mortalitu mají vliv jen některé specifické typy léčby, a to pouze u konkrétních minoritních podskupin pacientů. Rozlišujeme farmakologické a nefarmakologické typy léčby. Spektrum terapeutických možností je rozděleno do pěti sfér/okruhů: (1) eliminace rizik, (2) základní léčba, (3) fenotypově vázaná léčba, (4) léčba respiračního selhání a podpůrná léčba a (5) léčba komorbidit. Základní léčebné schéma prezentuje obrázek 3.
Image 3. Pět základních pilířů adekvátní léčby CHOPN 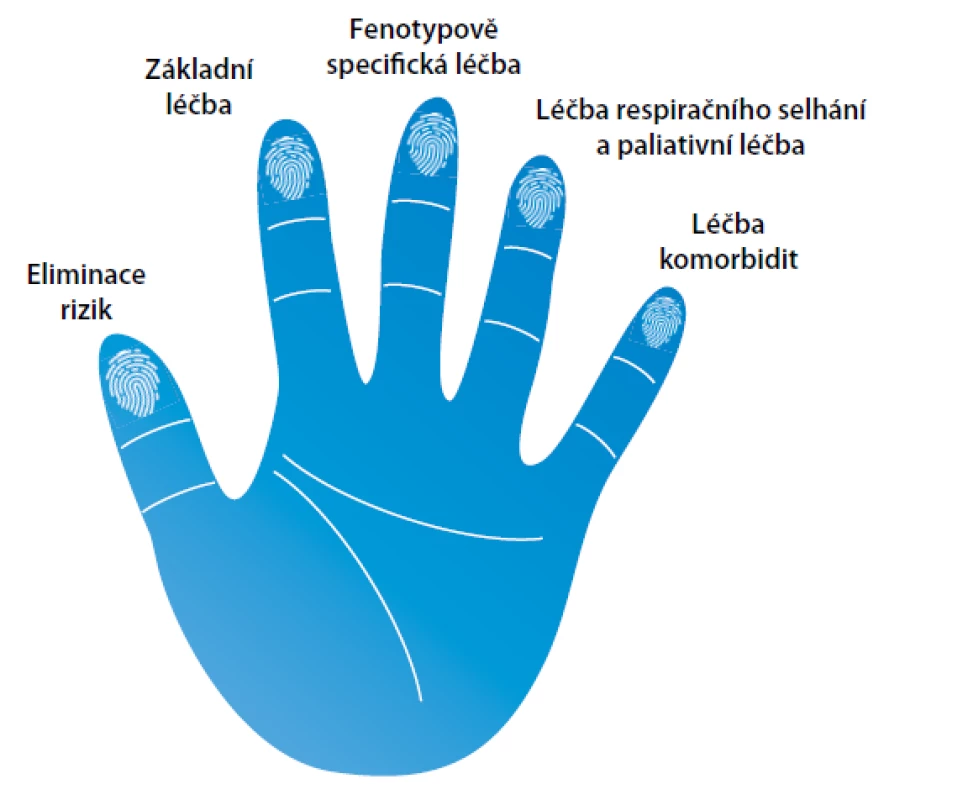
ELIMINACE RIZIK
Odvykání kouření. Mělo by být základní terapeutickou intervencí. U pacientů v nejlehčím stadiu CHOPN signifikantně zpomaluje deklinaci plicních funkcí v čase a prodlužuje přežití. Obecně u všech stadií CHOPN zlepšuje kvalitu života, zvyšuje účinnost bronchodilatačních léků a inhalačních kortikosteroidů (IKS) a snižuje výskyt AE. Pomoc zdravotníka při odvykání kouření spočívá v poradenství a zajištění psychologické podpory a farmakoterapie založené na substituci nikotinu, terapii bupropionem nebo vareniklinem (62).
Znečištěné ovzduší, profesní expozice. Smog nejenže přispívá ke vzniku CHOPN, ale je také spouštěčem AE, zejména v zimním období (1). Obdobně jako u odvykání kouření, eliminace či alespoň minimalizace profesní, domácí či enviromentální zátěže by mělo být základním opatřením při zahájení léčby CHOPN.
ZÁKLADNÍ LÉČBA
Je indikována bez ohledu na fenotyp nemoci a měla by být zahájena co nejdříve od stanovení diagnózy. Zahrnuje bronchodilatancia, plicní rehabilitaci, nácvik inhalační techniky, očkování proti respiračním patogenům, nutriční péči a psychosociální podporu.
Dlouhodobě působící bronchodilatancia
Souhrn poznatků a doporučení: Dlouhodobě působící bronchodilatancia zahrnují beta2-sympatomimetika = LABA (salmeterol, formoterol, olodaterol, vilanterol and indakaterol) a parasympatoly - tika = LAMA (tiotropium, aklidinium, glykopyrronium, umeklidinium) s délkou účinku 12–24 hodin. LAMA a LABA umožňují lepší kontrolu symptomů, zlepšují kvalitu života a snižují počet AE a hospitalizací (63–65). LAMA i LABA jsou účinné od časných stadií CHOPN (63, 64, 66), přičemž LAMA mají výraznější efekt na redukci AE (1) a zlepšují i efekt respirační fyzioterapie (67). LABA preferujeme u pacientů s ACO, a to vždy v kombinaci s inhalačními kortikosteroidy (IKS). Monoterapii LAMA nebo LABA používáme u pacientů s mírnějším stupněm bronchiální obstrukce, duální terapie pak má u těžších pacientů výraznější efekt na plicní funkce a kvalitu života, i na výskyt AE (66, 68, 69). Výběr typu inhalátoru by měl reflektovat charakter CHOPN u daného pacienta i jeho individuální potřeby a schopnosti.
Krátkodobě působící bronchodilatancia
Souhrn poznatků a doporučení: Krátkodobě působící bronchodilatancia opět zahrnují beta2-sympatomimetika = SABA (salbutamol, fenoterol a terbutalin) a parasympatolytika = SAMA (ipratropium). Obě lékové skupiny zlepšují plicní funkce, symptomy a toleranci zátěže, kombinační léčba SAMA/SABA je oproti monoterapii účinnější. Tyto léky používáme jako úlevové, případně je lze podávat jako exkluzivní léčbu pacientům s FEV1 ≥ 80 % a minimálními symptomy.
Plicní rehabilitace
Souhrn poznatků a doporučení: Plicní rehabilitace je komplexní péče zahrnující edukaci, respirační fyzioterapii, pohybový trénink, podporu aktivit denního života (ergoterapii), nutriční a psychosociální podporu (70, 71). Pohybový trénink se sestává z vytrvalostního a silového cvičení. Plicní rehabilitace by měla být v délce trvání 6–8 týdnů. U symptomatických pacientů s CHOPN by měl být pohybový trénink prováděn 3–5× týdně á 20–60 min (38, 72). Základní přehled fyzioterapeutických technik představujeme na obrázku 4.
Image 4. Základní a fenotypově-specifické techniky fyzioterapie používané v léčbě CHOPN 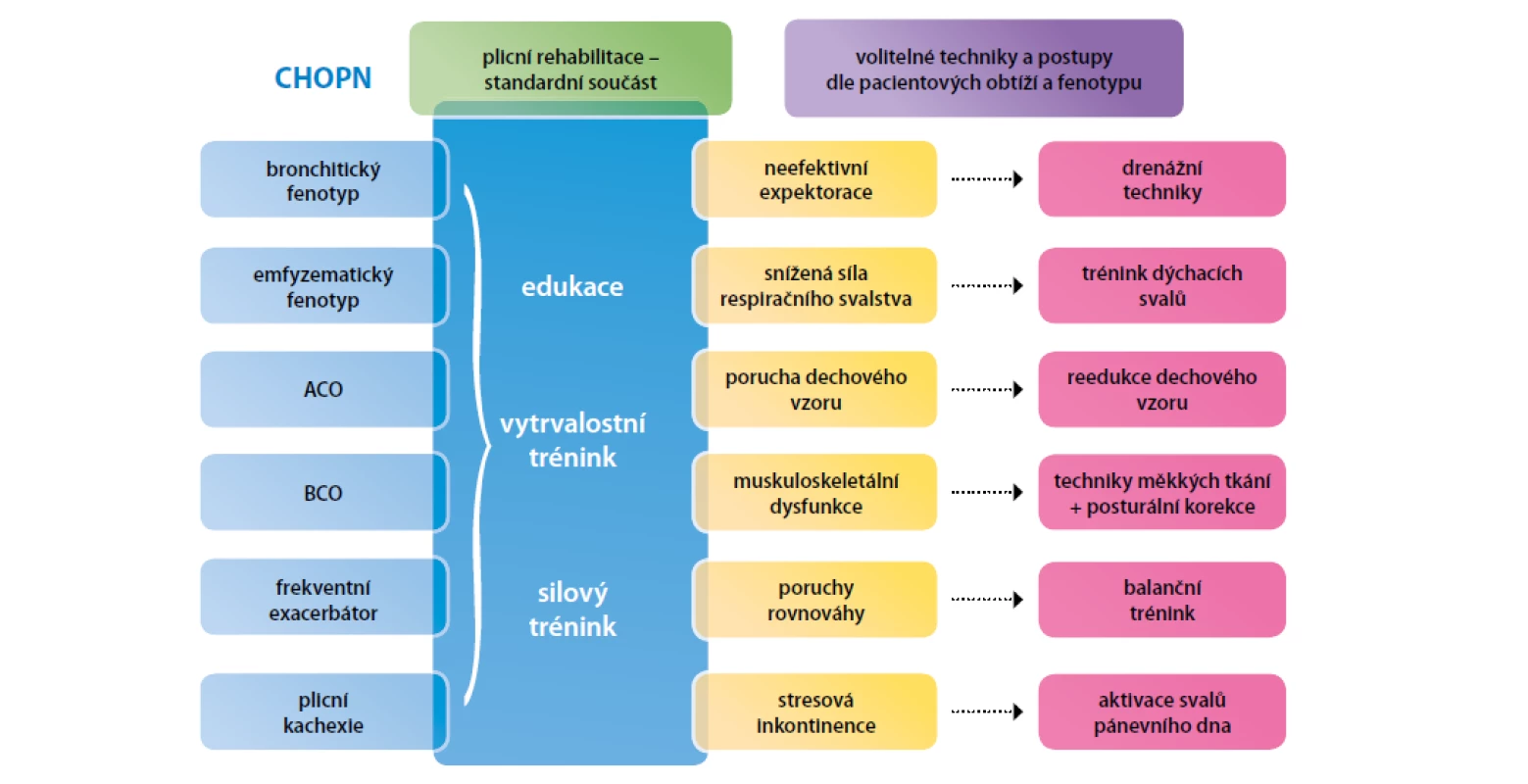
Legenda: CHOPN – chronická obstrukční plicní nemoc; ACO – (fenotyp) překryv astma s CHOPN; BCO – (fenotyp) překryv bronchiektazií s CHOPN Nácvik inhalační techniky
Souhrn poznatků a doporučení: Inhalační preparáty jsou základem léčby CHOPN. Existuje mnoho typů inhalátorů/aplikátorů: tradiční aerosolové aplikátory (pMDIs), Respimat (SMI), práškové inhalátory (DPI) či nebulizátory (73). Používání aplikátorů je zatíženo vysokým stupněm chybovosti a doporučujeme pravidelnou evaluaci (1× ročně) aplikační/ inhalační techniky lékařem, fyzioterapeutem nebo specializovanou sestrou. K ověření správnosti kroků aplikační techniky doporučujeme použít systém tzv. Five Steps Assessment (73).
Vakcinace
Souhrn poznatků a doporučení: Očkování proti viru chřipky a Streptococcus pneumoniae snižuje riziko AE a rozvoje pneumonie. Doporučujeme očkování proti pneumokokovi, každoročně proti chřipce a nově proti covid-19 u všech pacientů s CHOPN, zejména však u komorbidních, s horšími plicními funkcemi a starších věkem (1, 5).
Nutriční podpora
Souhrn poznatků a doporučení: Malnutrice může být jak důsledkem, tak příčinou závažného průběhu CHOPN (74). Základní antropometrická evaluace zahrnuje měření Body Mass Indexu (BMI), Fat-Free Mass Indexu (FFMI) a Skeletal Muscle Indexu (SMI). FFMI může být vypočten na základě měření kaliperem, denzitometricky nebo pomocí bioelektrické impedance, SMI pomocí dat z antropometrie nebo denzitometrie (75, 76). Pacienti s CHOPN mohou mít různé druhy nutričních fenotypů, které jsou asociovány s odlišnou prognózou. Pacienti s obezitou (BMI 30–35 kg/m2) mají vyšší kardiovaskulární riziko, pacienti s morbidní (BMI > 35 kg/m2) nebo se sarkopenickou obezitou (BMI 30–35 kg/m2 a SMI < 2) mají nižší fyzickou výkonnost.
U malnutričních pacientů by dieta měla obsahovat dostatek kalorií, být bohatá na proteiny a kvalitní lipidy a podpořena suplementací vitaminů (zejména A, C D a E) a stopových prvků (77). Souběžně by měl probíhat program plicní rehabilitace (78). U obézních jedinců by váha měla být redukována pod kontrolou odborníka, zejména v případech, kdy má výtznamnou klinickou relevanci (např. vliv na ventilaci a respiraci).
Edukace
Souhrn poznatků a doporučení: Zahrnuje programy odvykání kouření, správné inhalační techniky, včasného rozpoznání AE a situací, které je vyvolávají, podporu adherence k léčbě, správné nutrice a další (1) a jako taková by měla být standardní součástí dlouhodobé péče o pacienta.
Psychosociální podpora
Souhrn poznatků a doporučení: CHOPN je rizikovým faktorem rozvoje anxiety a deprese, nemocní jsou svou nemocí často stigmatizováni (79). Tyto jevy mohou vést k vyhýbání se fyzické aktivitě, sociálním kontaktům, snížení kondice nebo i sexuální aktivity. Pomoc pacientům může poskytnout nejen lékař či specializovaná sestra, ale také fyzioterapeut, psycholog či poradna pacientského spolku, např. Český občanský spolek proti plicním nemocem (ČOPN).
FENOTYPOVĚ SPECIFICKÁ LÉČBA
Pacienti s dobře vyjádřeným klinickým fenotypem by měli být léčeni i specifickými typy léčby. V českém pojetí může mít pacient více fenotypů zároveň a léčba by měla odpovídat přítomnosti každého z nich. Jinými slovy, je potřeba léčbu řídit dle všech fenotypických rysů zároveň.
FREKVENTNÍ EXACERBÁTOR
Pacienti s ≥ 2 AE za rok i navzdory optimální bronchodilatační léčbě by měli dostat IKS, inhibitor fosfodiesterázy 4, mukoaktivní léky, antibiotika nebo kombinaci těchto léků.
Inhalační kortikosteroidy (IKS)
Souhrn poznatků a doporučení: IKS/LABA nebo IKS/LABA/LAMA snižují výskyt AE (65), efekt IKS je přitom výraznější u pacientů s eozinofilií ≥ 300 buněk/μl a u pacientů se současnou ACO (80, 81). Chronické užívání může být asociováno s výskytem pneumonií, kandidózou nebo osteoporózou, vysazení IKS u nízce rizikových pacientů (např. s nízkou hladinou eozinofilů) přitom nevede ke zvýšení počtu AE (82, 83).
Inhibitory fosfodiesterázy 4 (PDE4 inhibitory)
Souhrn poznatků a doporučení: Roflumilast je molekula s protizánětlivou aktivitou, která redukuje neutrofilní zánět v dýchacích cestách (84) i výskyt AE u pacientů se závažnou CHOPN a fenotypem chronické bronchitidy a frekventními exacerbacemi (85). Nežádoucí účinky zahrnují nechutenství a průjem, bolest hlavy, spánkové poruchy (84). Nesmí být používán spolu s metylxantiny, u pacientů s depresí nebo kachexií.
Mukoaktivní látky obsahující tiolovou skupinu
Souhrn poznatků a doporučení: Erdostein a N-acetylcystein redukují výskyt AE a mají imunomodulační a antioxidační efekt (86) při příznivém bezpečnostím profilu. Léčbu podáváme u frekventích exacerbátorů a u bronchitického fenotypu, efekt je výraznější u mírnějších stadií CHOPN.
Dlouhodobá antibiotická léčba
Souhrn poznatků a doporučení: Dlouhodobá terapie azitromycinem (3× týdně 500 mg) nebo moxifloxacinem redukuje výskyt AE (87), je ale asociována s bakteriální rezistencí a prodloužením QT-intervalu (88). Je výhodná u pacientů s častými AE, bakteriální kolonizací, produkcí sputa nebo s bronchiektáziemi.
BRONCHITICKÝ FENOTYP
Mukoaktivní látky obsahující tiolovou skupinu
Souhrn poznatků a doporučení: Erdostein a N-acetylcystein pro jejich antioxidační a protizánětlivý efekt používáme i u pacientů s bronchitickým fenotypem (89). Léčba může být použita i u lehkých stadií CHOPN (90).
Inhibitory fosfodiesterázy 4
Souhrn poznatků a doporučení: Roflumilast používáme u bronchitického fenotypu CHOPN, obzvláště u pacientů v těžkých stadiích, s častými exacerbacemi, neutrofilním sputem či anamnézou bakteriálních pneumonií.
Respirační fyzioterapie
Souhrn poznatků a doporučení: Drenážní techniky pomáhají snadnému odstranění sekretu z dýchacích cest a zmírňují symptomy.
EMFYZEMATICKÝ FENOTYP
Metylxantiny
Souhrn poznatků a doporučení: Teofylin je jediný metylxantin dostupný k použití v ČR. Zmírňuje dušnost, má mírný bronchodilatační efekt, zejména v kombinaci s LABA, zvyšuje sílu bráničních stahů a zmírňuje gas trapping (91–93). Používáme ho proto jen u emfyzematického fenotypu. Teofylin má úzké terapeutické okno, četné nežádoucí účinky a metabolismem přes cytochrom P450 může interferovat s jinými léky.
Nefarmakologická léčba
Souhrn poznatků a doporučení: Nefarmakologické léčebné intervence u pacientů s bulózním emfyzémem zahrnují respirační fyzioterapii, bronchoskopickou volumredukci (BLVR), volumredukční chirurgii (LVRS) a léčbu alfa-1 antitrypsinem. Objevují se i nové endoskopické metody, např. endobronchiální coily (94).
BLVR pomocí jednocestných chlopní provádíme u pacientů s izolovaným emfyzémem jednoho laloku (95, 96). Cílené implantace endobronchiálních coilů používáme u pacientů s homogenním i heterogenním emfyzémem, zlepšuje se FEV1 i zátěžové tolerance (94). Po výkonech se může objevit hemoptýza nebo pneumotorax (94, 97). Novější metody BLVR zahrnují např. bronchoskopickou termoablaci (94, 97).
LVRS by měla být zvážena u pacientů s emfyzémem horních laloků (97, 98).
Plazmatické hladiny alfa-1 antitrypsinu by měly být vyšetřeny u všech pacientů s CHOPN; substituce enzymu je indikována u pacientů s jeho velmi těžkým deficitem (30).
PŘEKRYV ASTMA S CHOPN (ACO)
Inhalační kortikosteroidy (IKS) v kombinaci s LABA
Souhrn poznatků a doporučení: IKS/LABA jsou základem léčby ACO, zejména u pacientů s periferní eozinofilií ≥ 300 buněk/μl a frekventními exacerbacemi (80, 81). Měla by být užívána dávka IKS minimální k dosažení kontroly nemoci. Triple terapie IKS/LABA/LAMA je indikována, pokud IKS/LABA nebo LABA/LAMA nedostačuje k dosažení kontroly ACO.
PŘEKRYV CHOPN S BRONCHIEKTÁZIEMI (BCO)
Mukoaktivní látky obsahující tiolovou skupinu
Souhrn poznatků a doporučení: U pacientů s BCO má erdostein kromě mukolytického účinku také mírný antibakteriální efekt a zvyšuje koncentraci antibiotik v bronchiálním sekretu (99).
Inhibitory fosfodiesterázy 4
Souhrn poznatků a doporučení: Roflumilast inhibuje neutrofilní zánět a snižuje výskyt exacerbací u bronchitického fenotypu. Tyto buňky jsou prominentní i u BCO, proto je možné roflumilast používat i u pacientů s BCO, častými exacerbacemi a výraznou mukoprodukcí (5).
Antibiotika
Souhrn poznatků a doporučení: Léky první volby u pacientů s BCO a s výskytem AE či kolonizací Pseudomonas aeruginosa jsou inhalační kolistin nebo gentamicin, druhou volbou je chronická terapie azitromycinem (5, 100).
Další léčebné možnosti
Souhrn poznatků a doporučení: Drenážní techniky pomáhají snadnému odstranění sekretů z dýchacích cest a redukují zánět v dýchacích cestách a zmírňují symptomy, měly by být proto rutinní součástí léčby. Další možností jsou imunostimulační léky (např. Broncho-Vaxom) (101).
PLICNÍ KACHEXIE
Souhrn poznatků a doporučení: Pacienti s plicní kachexií by měli dostat komplexní nutriční podporu, plicní rehabilitaci a psychosociální podporu. Kachexie se obvykle rozvíjí v pokročilých stadiích CHOPN, proto u značné části pacientů bývá potřeba i léčby současného respiračního selhání, bronchiektázií či bakteriálních AE. Léčba inhibitory fosfodiesterázy 4 je kontraidikována.
LÉČBA RESPIRAČNÍHO SELHÁNÍ A PALIATIVNÍ LÉČBA
Dlouhodobá domácí oxygenoterapie (DDOT)
Souhrn poznatků a doporučení: DDOT u pacientů zmírňuje symptomy, kognitivní funkce, zlepšuje toleranci zátěže a kvalitu života. Efekt DDOT na mortalitu byl prokázán pouze u pacientů s velmi těžkou hypoxemií (102, 103). Kritéria pro DDOT v ČR jsou: klidový PaO2 < 7,3 kPa nebo klidový PaO2 7,3–8,0 kPa a jedno z těchto kritérií: plicní hypertenze nebo polyglobulie nebo desaturace < 90 % během alespoň 30 % doby spánku nebo zátěží indukovaná desaturace. Nutná je 6měsíční abstinence od kouření. Používáme kyslíkový koncentrátor nebo přenosný kapalný kyslík, užívá se minimálně 16 hodin denně.
Domácí neinvazivní ventilace (dNIV)
Souhrn poznatků a doporučení: dNIV indikujeme u stabilních pacientů s CHOPN a s chronickým hyperkapnickým respiračním selháním (5); v případě současné hypoxemie je indikována i souběžná DDOT. Nejlepších výsledků dosahuje NIV s vysokou intenzitou (104, 105). Léčba vede ke zlepšení plicních funkcí, hodnot krevních plynů a kvality života (104, 106).
Paliativní léčba
Souhrn poznatků a doporučení: Paliativní terapie je indikována v případech terminálního stadia CHOPN. Zahrnuje širokou paletu terapeutických modalit, z farmakologických postupů je to maximální bronchodilatační léčba, opiáty, sedativa a/nebo anxiolytika, analgetika, z nefarmakologických modalit má význam respirační fyzioterapie, DDOT, dNIV, léčba deprese a anxiety. Lze využít i hospicové péče. Hlavními cíli léčby jsou přiměřená kvalita života a minimalizace utrpení (107).
LÉČBA KOMORBIDIT
Souhrn poznatků a doporučení: Po nejčastějších komorbiditách (viz kap. 7.7.) je nutno aktivně pátrat a léčit je v souladu s patřičnými specializovanými doporučeními. Neléčené komorbidity zhoršují průběh CHOPN. Kardiovaskulární nemoci (KVD), zejména ischemická choroba srdeční, chronické srdeční selhání, plicní hypertenze a arteriální hypertenze jsou velmi časté a jsou jednou z nejčastějších příčin úmrtí pacientů s CHOPN (14, 108). Přítomnost refluxní choroby gastroduodena (GERD) je asociována s AE CHOPN (109). Syndrom obstrukční spánkové apnoe (OSA) u pacientů s CHOPN prohlubuje tkáňovou hypoxii a systémový zánět a akceleruje rozvoj KVD. Tito pacienti tak mají horší prognózu (110). Karcinom plic je s CHOPN často asociován a je jednou z nejčastějších příčin úmrtí pacientů (14).
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Kristián Brat, Ph.D.
Klinika plicních nemocí a tuberkulózy, Fakultní nemocnice Brno a Lékařská fakulta Masarykovy univerzity
Jihlavská 20, 625 00 Brno
Článek přijat redakcí: 20. 4. 2021
Článek přijat po recenzích: 4. 5. 2021
Sources
1. Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease. 2021 Report. [Naposledy navštíveno: 7.4.2021]. Dostupné z: https://goldcopd.org/wp-content/uploads/2020/11/GOLD-REPORT-2021-v1. 1-25Nov20_WMV.pdf
2. Miravitlles M, Vogelmeier C, Roche N et al. A review of national guidelines for management of COPD in Europe. Eur Respir J. 2016; 47(2): 625–637.
3. Miravitlles M, Soler-Cataluña JJ, Calle M et al. Spanish Guidelines for Management of Chronic Obstructive Pulmonary Disease (GesEPOC) 2017. Pharmacological Treatment of Stable Phase. Arch Bronconeumol. 2017; 53(6): 324–335.
4. Koblizek V, Chlumsky J, Zindr V et al. Czech Pneumological and Phthisiological Society. Chronic Obstructive Pulmonary Disease: official diagnosis and treatment guidelines of the Czech Pneumological and Phthisiological Society; a novel phenotypic approach to COPD with patient-oriented care. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 2013; 157(2): 189–201.
5. Zatloukal J, Brat K, Neumannova K et al. Chronic obstructive pulmonary disease – diagnosis and management of stable disease; a personalized approach to care, using the treatable traits concept based on clinical phenotypes. Position paper of the Czech Pneumological and Phthisiological Society. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 2020; 164(4): 325–356.
6. Martin RJ, Bel EH, Pavord ID et al. Defining severe obstructive lung disease in the biologic era: an endotype-based approach. Eur Respir J. 2019; 54 : 1900108.
7. Barnes PJ. Inflammatory mechanisms in patients with chronic obstructive pulmonary disease. J Allergy Clin Immunol. 2016; 138(1): 16–27.
8. Tashkin DP, Wechsler ME. Role of eosinophils in airway inflammation of chronic obstructive pulmonary disease. Int J Chron Obstruct Pulmon Dis. 2018; 13 : 335–349.
9. Singh D, Kolsum U, Brightling CE et al. ECLIPSE investigators. Eosinophilic inflammation in COPD: prevalence and clinical characteristics. Eur Respir J. 2014; 44(6): 1697–700.
10. Polosukhin VV, Richmond BW, Du RH et al. Secretory IgA Deficiency in Individual Small Airways Is Associated with Persistent Inflammation and Remodeling. Am J Respir Crit Care Med. 2017; 195(8): 1010–1021.
11. McDonough JE, Yuan R, Suzuki M et al. Small-airway obstruction and emphysema in chronic obstructive pulmonary disease. N Engl J Med. 2011; 365(17): 1567–1575.
12. Elbehairy AF, Ciavaglia CE, Webb KA et al. Canadian Respiratory Research Network. Pulmonary Gas Exchange Abnormalities in Mild Chronic Obstructive Pulmonary Disease. Implications for Dyspnea and Exercise Intolerance. Am J Respir Crit Care Med. 2015; 191(12): 1384–1394.
13. Garcia-Rio F, Miravitlles M, Soriano JB et al. EPI-SCAN Steering Committee. Systemic inflammation in chronic obstructive pulmonary disease: a population-based study. Respir Res. 2010; 11 : 63.
14. King PT. Inflammation in chronic obstructive pulmonary disease and its role in cardiovascular disease and lung cancer. Clin Transl Med. 2015; 4(1): 68.
15. Kim HC, Mofarrahi M, Hussain SN. Skeletal muscle dysfunction in patients with chronic obstructive pulmonary disease. Int J Chron Obstruct Pulmon Dis. 2008; 3(4): 637–658.
16. Chen YW, Ramsook AH, Coxson HO et al. Prevalence and Risk Factors for Osteoporosis in Individuals With COPD: A Systematic Review and Meta-analysis. Chest. 2019; 156(6): 1092–1110.
17. Lu Y, Feng L, Feng L et al. Systemic inflammation, depression and obstructive pulmonary function: a population-based study. Respir Res. 2013; 14 : 53.
18. Hersh CP, Make BJ, Lynch DA et al.; COPDGene and ECLIPSE Investigators. Non-emphysematous chronic obstructive pulmonary disease is associated with diabetes mellitus. BMC Pulm Med. 2014; 14 : 164.
19. Agusti A, Bel E, Thomas M et al. Treatable traits: toward precision medicine of chronic airway diseases. Eur Respir J. 2016; 47(2): 410–419.
20. Franssen FM, Alter P, Bar N et al. Personalized medicine for patients with COPD: where are we? Int J Chron Obstruct Pulmon Dis. 2019; 14 : 1465–1484.
21. Bigna JJ, Kenne AM, Asangbeh SL et al. Prevalence of chronic obstructive pulmonary disease in the global population with HIV: a systematic review and meta-analysis. Lancet Glob Health. 2018; 6(2): e193–e202.
22. Bui DS, Burgess JA, Lowe AJ et al. Childhood Lung Function Predicts Adult Chronic Obstructive Pulmonary Disease and Asthma-Chronic Obstructive Pulmonary Disease Overlap Syndrome. Am J Respir Crit Care Med. 2017; 196(1): 39–46.
23. Broström EB, Akre O, Katz-Salamon M et al. Obstructive pulmonary disease in old age among individuals born preterm. Eur J Epidemiol. 2013; 28(1): 79–85.
24. Byrne AL, Marais BJ, Mitnick CD et al. Tuberculosis and chronic respiratory disease: a systematic review. Int J Infect Dis. 2015; 32 : 138–146.
25. Hayden LP, Hobbs BD, Cohen RT et al.; COPDGene Investigators. Childhood pneumonia increases risk for chronic obstructive pulmonary disease: the COPDGene study. Respir Res. 2015; 16 : 115.
26. Greulich T, Nell C, Hohmann D et al. The prevalence of diagnosed α1-antitrypsin deficiency and its comorbidities: results from a large population-based database. Eur Respir J. 2017; 49(1): 1600154.
27. Guo F, Kuang JL. Superoxide dismutase gene polymorphisms and functional activity in chronic obstructive pulmonary disease. Zhonghua Jie He He Hu Xi Za Zhi. 2011; 34(6): 424–428.
28. Houghton AM. Matrix metalloproteinases in destructive lung disease. Matrix Biol. 2015; 44–46 : 167–174.
29. Ding Z, Wang K, Li J et al. Association between glutathione S-transferase gene M1 and T1 polymorphisms and chronic obstructive pulmonary disease risk: A meta-analysis. Clin Genet. 2019; 95(1): 53–62.
30. Miravitlles M, Dirksen A, Ferrarotti I et al. European Respiratory Society statement: diagnosis and treatment of pulmonary disease in α(1)-antitrypsin deficiency. Eur Respir J. 2017; 50(5): 1700610.
31. Burgel PR, Laurendeau C, Raherison C et al. An attempt at modeling COPD epidemiological trends in France. Respir Res. 2018; 19(1): 130.
32. Adeloye D, Chua S, Lee C et al.; Global Health Epidemiology Reference Group (GHERG). Global and regional estimates of COPD prevalence: Systematic review and meta-analysis. J Glob Health. 2015; 5(2): 020415.
33. Koblizek V, Jarkovsky J, Dusek L, Benesova K, Svoboda M, Brat K. The Czechia COPD mortality rate declining, but total deaths increasing. Eur Respir J 2020; 56(suppl 64): 434.
34. Vondra V, Malý M. Výrazný vzestup úmrtnosti na chronickou obstrukční plicní nemoc v České republice v letech 2013-2017. Studia Pneumol Phthiseol. 2019; 79(2): 43–50.
35. Celli BR, Cote CG, Marin JM et al. The body-mass index, airflow obstruction, dyspnea, and exercise capacity index in chronic obstructive pulmonary disease. N Engl J Med. 2004; 350(10): 1005–1012.
36. Puhan MA, Garcia-Aymerich J, Frey M et al. Expansion of the prognostic assessment of patients with chronic obstructive pulmonary disease: the updated BODE index and the ADO index. Lancet. 2009; 374(9691): 704–711.
37. Brat K, Svoboda M, Hejduk K et al..Introducing a new prognostic instrument for long - -term mortality prediction in COPD patients: the CADOT index. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 2020; in press. doi: 10.5507/bp.2020.035.
38. Qaseem A, Wilt TJ, Weinberger SE et al. Diagnosis and management of stable chronic obstructive pulmonary disease: a clinical practice guideline update for the ACP, ACCP, ATS and ERS. Ann Intern Med. 2011; 155(3): 179–191.
39. Pellegrino R, Viegi G, Brusasco V et al. Interpretative strategies for lung function tests. Eur Respir J. 2005; 26(5): 948–968.
40. Brat K, Plutinsky M, Hejduk K et al. Respiratory parameters predict poor outcome in COPD patients, category GOLD 2017 B. Int J Chron Obstruct Pulmon Dis. 2018; 13 : 1037–1052.
41. Agusti A. The path to personalised medicine in COPD. Thorax. 2014; 69(9): 857–864.
42. Le Rouzic O, Roche N, Cortot AB et al. Defining the „Frequent Exacerbator“ Phenotype in COPD: A Hypothesis-Free Approach. Chest. 2018; 153(5): 1106–1115.
43. Chalmers JD, Aliberti S, Filonenko A et al. Characterization of the „Frequent Exacerbator Phenotype“ in Bronchiectasis. Am J Respir Crit Care Med. 2018; 197(11): 1410–1420.
44. Koblizek V, Milenkovic B, Barczyk A et al. Phenotypes of COPD patients with a smoking history in Central and Eastern Europe: the POPE Study. Eur Respir J. 2017; 49(5): 1601446.
45. Kim V, Han MK, Vance GB et al.; COPDGene Investigators. The chronic bronchitic phenotype of COPD: an analysis of the COPDGene Study. Chest. 2011; 140(3): 626–633.
46. Cheng Y, Tu X, Pan L et al. Clinical characteristics of chronic bronchitic, emphysematous and ACOS phenotypes in COPD patients with frequent exacerbations. Int J Chron Obstruct Pulmon Dis. 2017; 12 : 2069–2074.
47. Tho NV, Park HY, Nakano Y. Asthma-COPD overlap syndrome (ACOS): A diagnostic challenge. Respirology. 2016; 21(3): 410–418.
48. Takiguchi H, Asano K. Asthma-COPD overlap syndrome (ACOS). Nihon Rinsho. 2016; 74(5): 778–782.
49. Martinez-Garcia MA, Miravitlles M. Bronchiectasis in COPD patients: more than a comorbidity? Int J Chron Obstruct Pulmon Dis. 2017; 12 : 1401–1411.
50. Polverino E, Dimakou K, Hurst J, et al. The overlap between bronchiectasis and chronic airway diseases: state of the art and future directions. Eur Respir J. 2018; 52(3): 1800328.
51. Yu Q, Peng H, Li B et al. Characteristics and related factors of bronchiectasis in chronic obstructive pulmonary disease. Medicine (Baltimore). 2019; 98(47): e17893.
52. Sánchez-Muñoz G, Lopez-de-Andrés A, Hernández-Barrera V et al. Bronchiectasis in patients hospitalized with acute exacerbation of COPD in Spain: Influence of mortality, hospital stay, and hospital costs (2006-2014) according to gender. PLoS One. 2019; 14(1): e0211222.
53. McDonald MN, Wouters EFM, Rutten E et al. It’s more than low BMI: prevalence of cachexia and associated mortality in COPD. Respir Res. 2019; 20(1): 100.
54. Kwan HY, Maddocks M, Nolan CM et al. The prognostic signifikance of wieght loss in chronic obstructive pulmonary disease – related cachexia: a prospective cohort study. J Cachexia Sarcopenia Muscle. 2019; 10(6): 1330–1338.
55. Mokari-Yamchi A, Jabbari M, Sharifi A et al. Low FEV1 Is Associated With Increased Risk Of Cachexia In COPD Patients. Int J Chron Obstruct Pulmon Dis. 2019; 14 : 2433–2440.
56. Sanchez FF, Faganello MM, Tanni SE et al. Anthropometric midarm measurements can detect systemic fat-free mass depletion in patients with chronic obstructive pulmonary disease. Braz J Med Biol Res. 2011; 44(5): 453–459.
57. Brat K, Svoboda M, Zatloukal J, Plutinsky M, Volakova E, Popelkova P, Novotna B, Dvorak T, Koblizek V. The relation between clinical phenotypes, GOLD groups/stages and mortality in COPD patients - a prospective multicenter study. Int J Chron Obstruct Pulmon Dis. 2021; in press.
58. Ajmera M, Sambamoorthi U, Metzger A et al. Multimorbidity and COPD Medication Receipt Among Medicaid Beneficiaries With Newly Diagnosed COPD. Respir Care. 2015; 60(11): 1592–1602.
59. Jantunen J, Haahtela T, Salimäki J et al. Multimorbidity in Asthma, Allergic Conditions and COPD Increase Disease Severity, Drug Use and Costs: The Finnish Pharmacy Survey. Int Arch Allergy Immunol. 2019; 179(4): 273–280.
60. Spyratos D, Haidich AB, Chloros D et al. COPD screening program: What is appropriate target group population? Respiration. 2017; 94(1): 74.
61. Ulrik CS, Løkke A, Dahl R et al., TOP study group. Early detection of COPD in general practice. Int J Chron Obstruct Pulmon Dis. 2011; 6 : 123–127.
62. Jiménez-Ruiz CA, Andreas S, Lewis KE et al. Statement on smoking cessation in COPD and other pulmonary diseases and in smokers with comorbidities who find it difficult to quit. Eur Respir J. 2015; 46(1): 61–79. Další literatura u autora a na www.casopisvnitrnilekarstvi.cz
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2021 Issue 4-
All articles in this issue
- Použití léků vyvinutých pro jiné indikace v léčbě infekce covid-19
- Targeted and biological drugs in the treatment of inflammatory rheumatic diseases
- Treating inflammatory bowel diseases in the 21st century: individualized therapy and telemedicine
- Biologic therapy for dyslipidemia
- Monitoring the dynamics of clinical and laboratory markers of chronic heart failure during 12 months of sacubitril/valsartan treatment
- Importance and efficiency of blood pressure control not only in type 2 diabetes patients
- Giant cell arteritis: controversial issues
- Chronic obstructive pulmonary disease: diagnosis and treatment of stable phase of disease; personalized treatment approach using phenotype features of the disease Summary of the 2020–2021 Czech Pneumological and Phthiseological Society position paper
- Thymoma – disease of many faces
- An effective communication between the physician and the patient in an early intervention of hypertension and dyslipidemia
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Chronic obstructive pulmonary disease: diagnosis and treatment of stable phase of disease; personalized treatment approach using phenotype features of the disease Summary of the 2020–2021 Czech Pneumological and Phthiseological Society position paper
- Thymoma – disease of many faces
- Targeted and biological drugs in the treatment of inflammatory rheumatic diseases
- Biologic therapy for dyslipidemia
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

