-
Medical journals
- Career
Neobvyklá manifestace CMV infekce – cirkulární stenóza žaludku
Authors: Pavel Hrabák 1; Jaromír Petrtýl 1; Renata Šroubková 1; Aleš Novotný 1; Ivana Vítková 2; Josef Hořejš 3; Miloš Dvořák 1; Radan Brůha 1
Authors‘ workplace: IV. interní klinika VFN a 1. LF UK v Praze 1; Ústav patologie VFN a 1. LF UK v Praze 2; Radiodiagnostická klinika VFN a 1. LF UK v Praze 3
Published in: Vnitř Lék 2020; 66(8): 47-50
Category: Case Report
Overview
V tomto článku popisujeme případ pacientky s bolestmi v epigastriu, u níž byl diagnostikován cirkulární stenózující vřed žaludku. Dalším vyšetřením byla zjištěna CMV etiologie. Po zahájení terapie inhibitory protonové pumpy a antivirové terapie došlo k úzdravě. Orgánová manifestace CMV infekce je poměrně častou komplikací u imunokompromitovaných pacientů. U imunokompetentních pacientů bývá orgánové postižení relativně vzácné. Přesto je však nutno i na tuto etiologii pomýšlet.
Klíčová slova:
cytomegalovirus – gastritida – imunokompetentní.
Kazuistika
44letá dosud prakticky zdravá pacientka navštívila gastroenterologickou ambulanci pro 14 dní trvající křečovité bolesti v epigastriu. Bolesti se nikam nešířily, zhoršovaly se po jídle. Pacientka udávala pocit nadýmání a pokles váhy o cca 3 kg proti dlouhodobě stabilní hmotnosti.
Anamnesticky bylo zjištěno, že matka pacientky prodělala v minulosti resekci žaludku, pacientka však nevěděla, zda z důvodu maligního onemocnění nebo kvůli peptickému vředu.
Pacientka sama v minulosti prodělala pouze apendektomii, trpí obezitou. V naší ambulanci již byla v minulosti sledována pro Helicobacter pylori pozitivní gastritidu, která byla úspěšně zaléčena. Pacientka je dlouhodobá kuřačka. Alkohol pije příležitostně. Léky neužívala.
Své obtíže pacientka přisuzovala stresu (hoteliérka v zimním středisku, v době návštěvy naší ambulance uprostřed zimní sezóny).
Fyzikální vyšetření neodhalilo patologii (mimo obezitu s BMI 30,5).
Vzhledem k anamnéze recidivujících gastritid a charakteru současných obtíží byla gastroenterologem doporučena gastroduodenoskopie (GFS) a ultrasonografické vyšetření břicha (USG). Pacientka toto s ohledem na pracovní vytížení iniciálně odmítla a k vyšetření se dostavila s několikatýdenním zpožděním. V mezidobí pacientka užívala inhibitor protonové pumpy (IPP) (omeprazol 20 mg/den) a prokinetikum (itoprid 50 mg 3×/den) s mírným efektem na bolesti v epigastriu.
GFS odhalila na přechodu žaludečního těla a antra cirkulární, pravidelnou, krátkou, tuhou, kontaktně krvácející stenózu u průměru cca 4 cm, pokrytou fibrinem. Byly odebrány biopsie.
Pro podezření na maligní povahu stenózy bylo indikováno CT břicha s nálezem cirkulárního zúžení žaludku v oblasti těla a antra, v té oblasti popsáno zesílení stěny žaludku. Radiolog na základě tohoto obrazu připouštěl jak maligní, tak benigní (změny po peptickém vředu) etiologii (Obr. 1). Endoskopická ultrasonografie (EUS) nepotvrdila invazivní charakter (neporušená muscularis propria) výše popisované léze (Obr. 2).
Image 1. CT břicha: cirkulární zúžení lumen a zesílení stěny žaludku na rozhraní žal. těla a antra 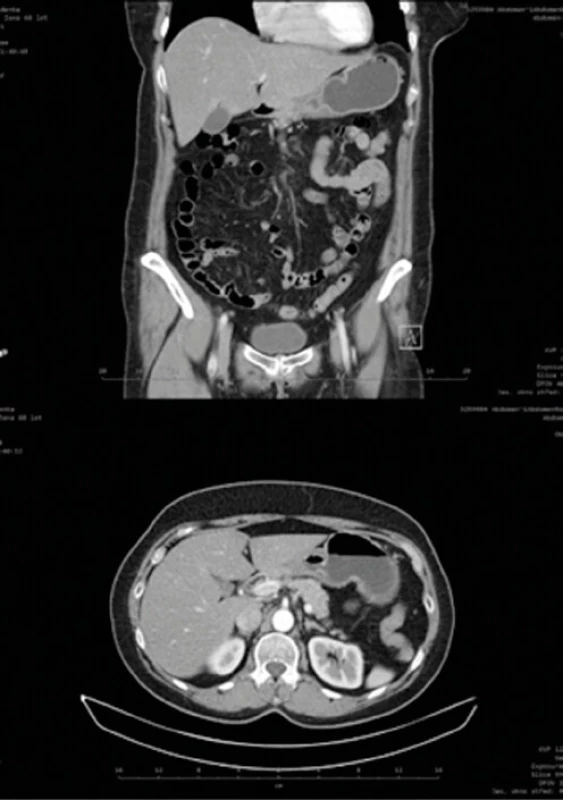
Image 2. Radiální EUS svědčící pro neinvazivní charakter léze, intaktní muscularis propria 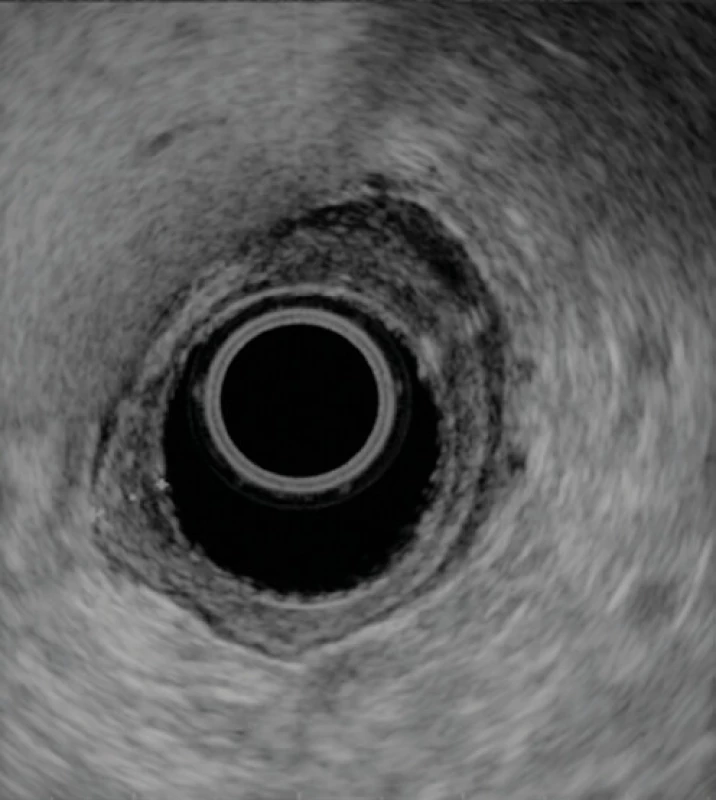
Onkomarkery (CEA, Ca 19–9, CA 125, CA 72–4, CA 15–3) byly negativní, i jinak byl laboratorní obraz, mimo mírnou hypercholesterolemii, bez pozoruhodností.
Výsledek histologie vzorků odebraných v rámci GFS popisoval chronickou ulceraci v terénu středně těžké chronické aktivní gastritidy, bez přítomnosti Helicobacter pylori či intestinální metaplazie.
Pro trvající suspekci na nádorovou etiologii stenózy jsme opakovali po konzultaci s patologem GFS (se stejným makroskopickým nálezem – Obr. 3) s novým odběrem biopsií, kde byla imunohistochemicky prokázána CMV infekce. Helikobakterie jsme opět neprokázali (Obr. 4 + 5).
Image 3. GFS: cirkulární stenóza v proximální části žal. antra 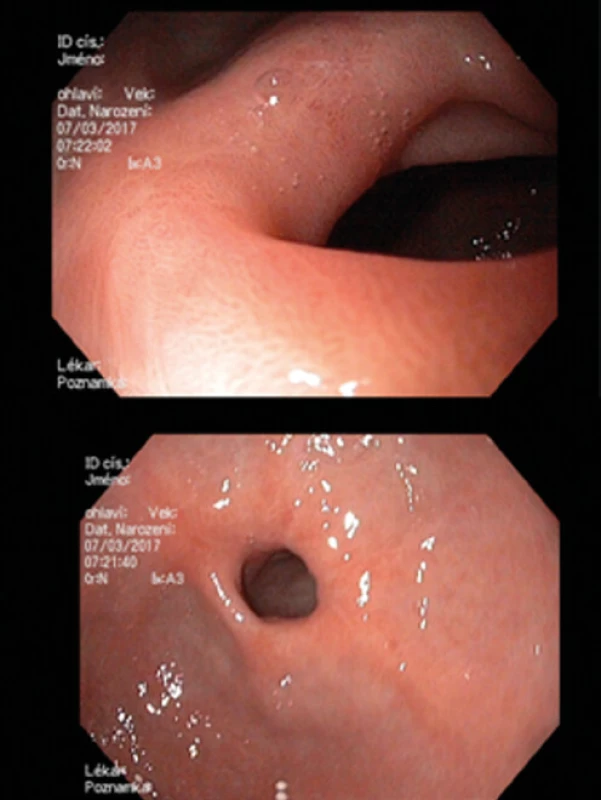
Image 4. CMV inkluze, imunohistoch. vyš, 40× 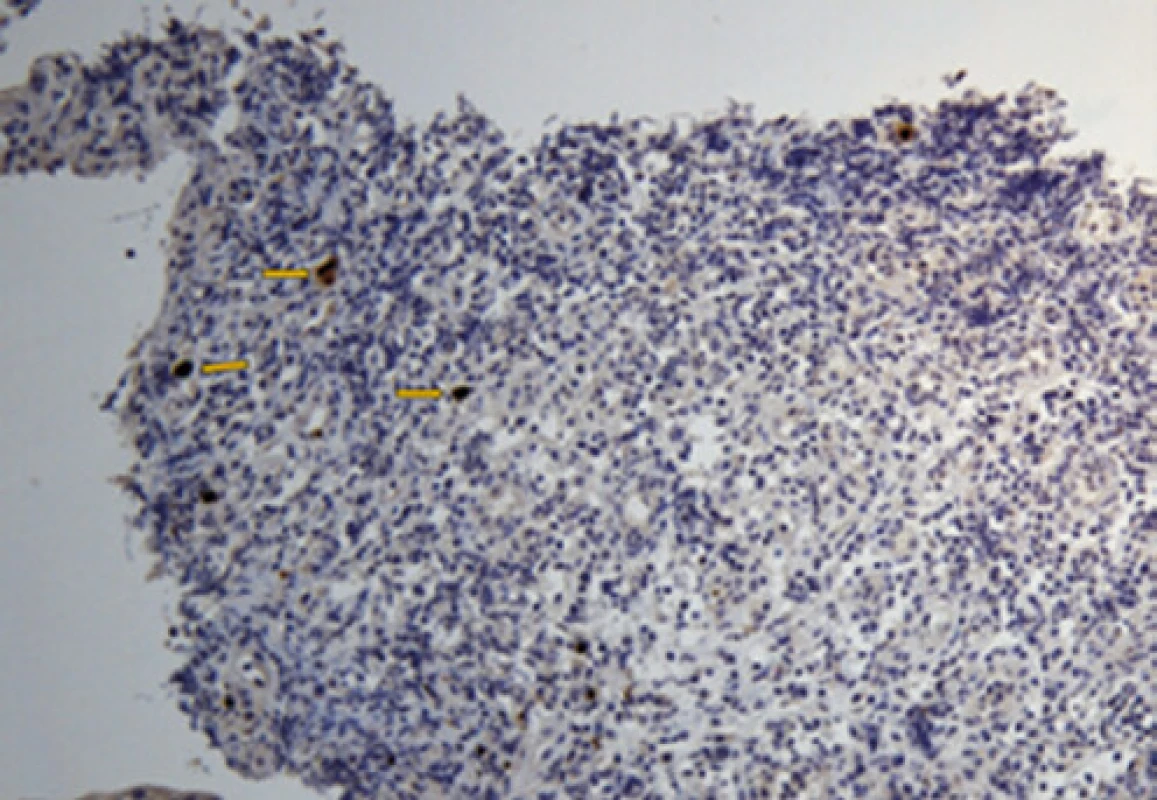
Image 5. CMV inkluze – označeno šipkami, HE staining, 400× 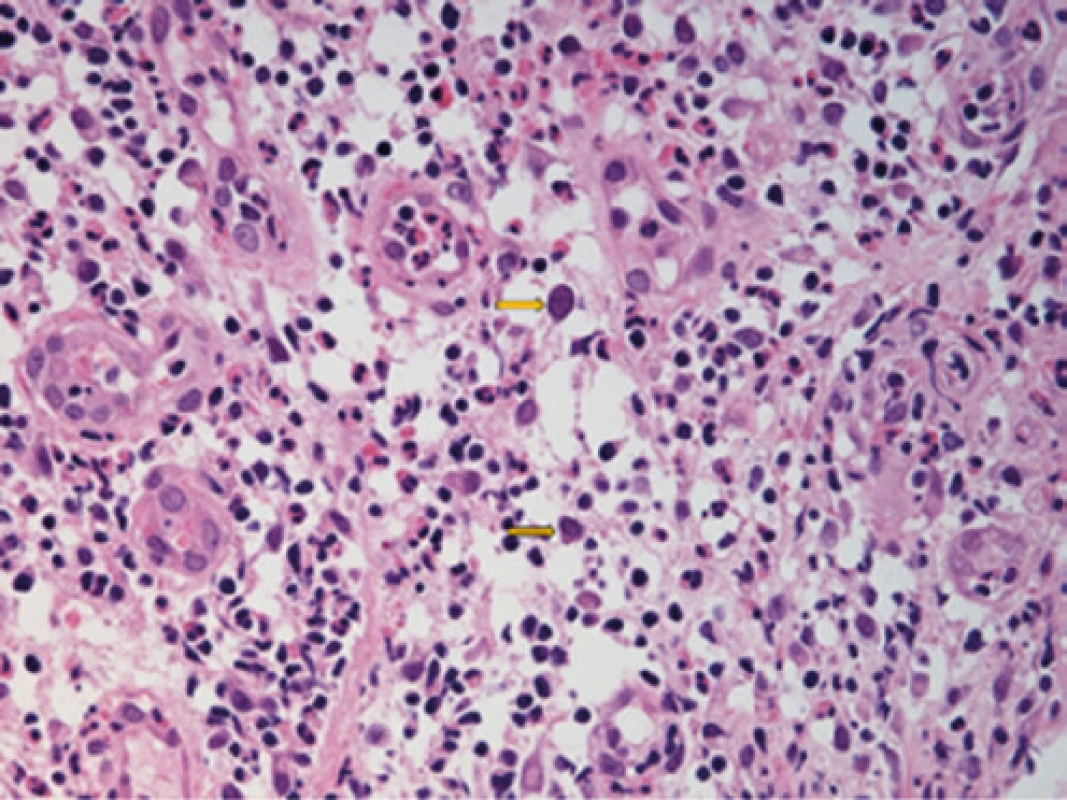
Sérologicky (provedeno s odstupem 3 měsíců od počátku obtíží) byla prokázána pozitivita CMV IgG, CMV IgM bylo v té době negativní.
Zahájili jsme třítýdenní kůru ganciklovirem v dávce 500 mg à 12 hod., pokračovali jsme v terapii IPP a prokinetiky. Z terapie pacientka profitovala, tolerovala perorální příjem, byla bez bolestí. Po 20 dnech terapie byla provedena kontrolní gastroskopie s výraznou regresí nálezu, cirkulární stenóza na přechodu žaludečního těla a antra byla již nevýznamná.
V rámci vyloučení imunokompromitace pacientky byla vyloučena HIV infekce.
Pacientka je nadále ve sledování naší gastroenterologické ambulance a t. č. je zcela bez obtíží. I přes doporučení nadále pokračuje v nikotinismu.
Diskuze
CMV virus poprvé popsaný roku 1956 je DNA virus patřící do skupiny tzv. herpetických virů. Tento virus pravděpodobně doprovází lidstvo od nepaměti a jeho životní cyklus je úzce spjat s člověkem coby hostitelem. Většina infekcí CMV virem probíhá u imunokompetentních jedinců asymptomaticky. Velkým nebezpečím je naproti tomu CMV infekce u imunokompromitovaných pacientů.
První CMV infekce byla u člověka popsána pravděpodobně již r. 1881 Ribbertem. V r. 1920 Goodpasture a Talbot vyslovili domněnku, že cytomegalie popisovaná u pacientů s CMV by mohla být způsobena jejich napadení infekcí. V r. 1960 byl izolován nezávisle Wellerem, Rowem a Smithem z lidských slinných žláz (1). V téže době získal cytomegalovirus své jméno.
CMV se v lidském organismu chová podobně jako ostatní herpetické viry. Po proniknutí virionu do buňky jsou virionové komponenty rychle transportovány do buněčného jádra, kde probíhá replikace. Ta je poměrně pomalá, nicméně detekovatelná již 12–24 hodin po infekci.
Po primoinfekci, která však jen v malém procentu případů probíhá symptomaticky, přetrvává CMV v organismu v T‑lymfocytech nebo jiných leukocytech, v endotelu slinných žláz či v buňkách ledvinových tubulů. Nemocný či asymptomatický nosič vylučují virus slinami a močí. CMV se přenáší horizontálně (přímým kontaktem) i vertikálně (z matky na dítě). Vzhledem k fragilitě CMV se předpokládá, že pro jeho horizontální přenos je nutný těsný fyzický kontakt. Jako vektor byly identifikovány i krevní transfuze případně transplantované orgány. Nemoc postihuje v závislosti na geografické lokalitě 40–100 % populace. Zároveň prevalence v populaci stoupá s věkem, dosahuje 47 % ve 10–12 letech, 68 % u 15–35letých a 81 % u 36–60letých (2).
U imunokompromitovaných jedinců způsobuje CMV symptomatické infekce, při nichž mohou být postiženy prakticky všechny orgány. CMV se tedy může manifestovat jako encefalitida, pneumonitida, hepatitida, retinitida či kolitida. Intrauterinní postižení plodu bývá spojeno se závažnými vývojovými vadami, jakými jsou mikrocefalie, mentální retardace, hluchota či slepota způsobená atrofií optického nervu.
CMV u imunokompetentních pacientů
U imunokompetentních pacientů probíhá CMV typicky inaparentně nebo pod nespecifickým obrazem „mononukleózového syndromu“ či „chřipkových“ příznaků. Syndrom CMV mononukleózy připomíná infekční EBV mononukleózu. Je nejběžnější formou klinicky se projevující CMV infekce u imunokompetentních jedinců.
Manifestní závažné postižení jednoho nebo více orgánů bývají popisovány i u imunokompetentních pacientů. Nicméně tyto případy jsou relativně vzácné (kazuistiky či malé soubory pacientů).
Nejběžnější jsou pak gastrointestinální manifestace, kdy CMV postihuje nejčastěji tlusté střevo (47 %), duodenum ve 21,7 %, žaludek v 17,4 %, jícen v 8,7 % a vzácně (4,3 %) i tenké střevo (3).
Z malých souborů imunokompetentních pacientů s CMV kolitidou vyplývá, že nejčastějšími klinickými příznaky jsou bolesti břicha, horečka a průjem či enterorhagie (4).
Endoskopicky bývá popisováno vředové nebo pseudomembranózní postižení. Vzhledem ke klinické manifestaci může být zejména u starších pacientů zaměněna s ischemickou kolitidou.
Cytomegalová virová hepatitida může probíhat asymptomaticky nebo v rámci mononukleózového syndromu. Může se projevovat horečkami a zvracením, v těžších případech i ikterem a jaterním selháváním. Přítomna bývá hepatomegalie, laboratorně je patrný vzestup aminotransferáz. Jaterní biopse odhaluje infiltraci zejména portálních polí mononukleáry. Přítomny jsou granulace a obrovské buňky (1). CMV primoinfekce nepřechází do chronické formy. Vzácnou komplikací CMV hepatitidy pak může být trombóza portální žíly.
Diagnostika
Diagnostika CMV se opírá o metody přímé – tj. izolaci viru či detekci antigenu nebo CMV DNA ve vzorcích odebraných z postižených orgánů a metody nepřímé – tedy sérologická vyšetření. CMV lze izolovat ve tkáňové kultuře, nicméně do rutinního vyšetřovacího algoritmu se toto zdlouhavé vyšetření příliš nehodí.
Nejrozšířenější metodou přímé detekce CMV infekce je pak molekulárně biologická metoda na principu PCR.
Nepřímé metody detekce CMV spočívají zejména ve stanovení protilátek třídy IgG, IgA a IgM. IgG protilátky se vytvářejí již během časné fázi infekce a přetrvávájí v organismu většinou po celý život jako tzv. anamnestické protilátky. Protilátky IgA a IgM se tvoří rovněž časně, jako protilátková odpověď na replikaci viru se vytvářejí pouze přechodně. Jejich přítomnost tedy svědčí pro probíhající nebo recentně proběhlou infekci. Vyšetření avidity protilátek pak pomáhá v některých případech rozlišit mezi primoinfekcí a reaktivací CMV (5, 6).
Průkazem CMV antigenu imunohistochemickou metodou pomocí monoklonálních protilátek lze s vysokou prediktivní hodnotou zachycovat CMV v časném stadiu infekce nebo detekovat přítomnost CMV v zasažených orgánech. Riziko této metody je v její možné falešné pozitivitě zaviněné zkříženou reakcí s jinými virovými antigeny. Pro detekci infikovaných buněk v biopsiích se využívá monoklonální protilátka proti časnému proteinu CMV (pp 72), která je přítomna v zasažených tkáních již 48 hodin po infekci (6).
Závěr
CMV se závažnými klinickými projevy není neobvyklou komplikací u imunokompromitovaných jedinců. Symptomy u imunokompetentních jedinců se zpravidla omezují na mononukleózový syndrom s únavou a subfrebriliemi. Orgánové postižení u imunukompetentních jedinců je poměrně vzácné. V naší kazuistice popisujeme raritní manifestaci CMV infekce – cirkulárně stenózující pseudotumorózní postižení žaludku. Většinou autorů je doporučována terapie inhibitory protonové pumpy a event. eradikace konkomitantní infekce Hel. pylori. Některými autory je CMV gastritida považovaná za „self‑limiting“ onemocnění a mimo IPP nedoporučují antivirovou terapii (7). Ve většině případů se IPP terapie ukázala být efektivním řešením (10, 7). V některých případech byli pacienti léčeni ganciklovirem (8, 9).
Je otázkou, zdali byla v našem případě CMV infekce primární příčinou ulcerací nebo „nasedá“ na preexistující lézi. Domníváme se, že vzhledem literárně popisovanému vymizení CMV inkluzí z hojících se ulcerací (10) a práci Murraye et al., která neprokazuje na malém souboru pacientů CMV infekci v preexistujících lézích (11) lze považovat cytomegalovirus v případě jeho detekce v slizničních lézích žaludku za jejich kauzální agens.
Práce byla podpořena výzkumnými projekty RVO VFN64165/2012 (MZ ČR) a PROGRES Q25 (1. lékařská fakulta Karlovy Univerzity)
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Pavel Hrabák,
IV. interní klinika,
U Nemocnice 2,
Praha 2
Cit. zkr: Vnitř Lék 2020; 66(8): e47–e50
Článek přijat redakcí: 24. 4. 2020
Článek přijat po recenzích k publikaci: 15. 10. 2020
Sources
1. Beneš J. Infekční lékařství. Praha: Galén, c2009. ISBN 978-80-7262-644-1, str. 184–187.
2. Rafailidis PI, Mourtzoukou EG, Varbobitis IC, Falagas ME. Severe cytomegalovirus infection in apparently immunocompetent patients: a systematic review. Virol J. 2008; 5 : 47.
3. Boteon YL, Alves IP, da Silva AP, et al. Obstructive Gastric Pseudotumor Caused by Cytomegalovirus in an AIDS Patient: A Case Report and Review of Surgical Treatment. Am J Case Rep. 2015; 16 : 536–541.
4. Galiatsatos P, Shrier I, Lamoureux E, et al. Meta‑analysis of outcome of cytomegalovirus colitis in immunocompetent hosts., Dig Dis Sci (2005) 50 : 609.
5. Chmelová K, Fraňková S, Šperl J. Cytomegalovirová infekce a játra, Gastroent Hepatol 2017; 71(6): 517–523.
6. Ross SA, Novak Z, Pati S, Boppana SB. Overview of the diagnosis of cytomegalovirus infection. Infect Disord Drug Targets. 2011; 11(5): 466–474.
7. Kastenbauer U, Ließ H, Kremer M. CMV‑assoziiertes Ulcus ventriculi bei einem immunkompetenten Patienten [CMV‑associated gastric ulcer in an immunocompetent male patient]. Internist (Berl). 2016; 57(7): 724–727. German.
8. Crespo P, Dias N, Marques N, Saraiva da Cunha J. Gastritis as a manifestation of primary CMV infection in an immunocompetent host. BMJ Case Rep. 2015.
9. Krajicek E, Shivashankar R, Hansel S. Cytomegalovirus and the Seemingly Immuno ‑ competent Host: A Case of a Perforating Gastric Ulcer. ACG Case Rep J. 2017; 4: e27. Published 2017 Mar 1.
10. Ebisutani C, Kawamura A, Shibata N, et al. Gastric ulcer associated with cytomegalovirus in an immunocompetent patient: method for diagnosis. Case Rep Gastroenterol. 2012; 6(2): 365–368.
11. Murray RN, Parker A, Kadakia SC, et al. Cytomegalovirus in upper gastrointestinal ulcers. J Clin Gastroenterol. 1994; 19(3): 198–201.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2020 Issue 8-
All articles in this issue
- Změny farmakokinetiky léčiv u obézních pacientů
- Chirurgická léčba těžké obezity – bariatrie
- Současnost a perspektivy farmakoterapie obezity
- Fyzická aktivita v léčbě obezity v praxi
- Jak léčit obézního hypertonika?
- Suplementácia vitamínu D ako dôležitý faktor v prevencii a liečbe ochorenia COVID-19: aké máme dôkazy?
- Protidestičková léčba v sekundární prevenci nekardioembolických ischemických mozkových cévních příhod
- Věkem podmíněná remodelace myokardu: mýtus nebo realita?
- Fixní kombinace rosuvastatinu s ezetimibem
- Vplyv ageizmu na správnosť indikácie antikoagulancií u seniorov s fibriláciou predsiení v práci kardiologickej ambulancie medzi rokmi 2012 a 2017
- Akutní infekce, žilní trombóza a doporučená tromboprofylaxe
- Hypogonadismus obézních mužů
- Péče o hospitalizovaného dialyzovaného pacienta z pohledu internisty
- Monitorování farmakokinetiky infliximabu u idiopatických střevních zánětů
- Heparínom indukovaná trombocytopénia a aktuálne možnosti liečby – prehľad literatúry
- Neobvyklá manifestace CMV infekce – cirkulární stenóza žaludku
- Nebezpečí číhající v mořích – komplikace setkání s jedovatou rybou ropušnicí obecnou (Scorpion fish)
- Disekcia ascendentnej aorty, diagnóza na ktorú treba myslieť
- Prof. Jiří Šonka a obezitologie
- Molekula erdostein společnosti Recipharm byla s pozitivním výsledkem testována jako součást léčby pacientů s COVID-19
- Antioxidační a bronchoprotektivní účinek erdosteinu
- Zkrácená informace o přípravku ERDOMED
- K 100. výročí narození prof. MUDr. Jiřího Šonky, DrSc.
- 2020: rok, kdy ambulantní internisté vzali budoucnost do svých rukou. Konečně!
- Programy kvality Q‑OSTEOPORÓZA a Q‑DYSLIPIDEMIE – cesta k dlouhodobé stabilitě v oboru
- 110. výročí narození primáře Kadeřábka
- Role metabolického syndrome v indukci chronické pankreatitidy po první atace akutní pankreatitidy – multicentrická studie
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Péče o hospitalizovaného dialyzovaného pacienta z pohledu internisty
- Změny farmakokinetiky léčiv u obézních pacientů
- Heparínom indukovaná trombocytopénia a aktuálne možnosti liečby – prehľad literatúry
- Nebezpečí číhající v mořích – komplikace setkání s jedovatou rybou ropušnicí obecnou (Scorpion fish)
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

