-
Medical journals
- Career
Akutní infekce, žilní trombóza a doporučená tromboprofylaxe
Authors: Dalibor Musil
Authors‘ workplace: Cévní centrum, I. interní klinika – kardiologická FN a LF Olomouc
Published in: Vnitř Lék 2020; 66(8): 17-23
Overview
Jednou z nejzávažnějších komplikací akutní infekce je žilní tromboembolická nemoc (TEN). Ke vzniku žilní trombózy dochází prozánětlivou reakcí organismu a aktivací lokální a systémové koagulace. Prozánětlivou odpovědí je tvorba prozánětlivých cytokinů a proteinů komplementového systému. Aktivace lokální a systémové koagulace se odvíjí od exprese tkáňového faktoru (TF) na endotelových buňkách a monocytech/makrofázích, od aktivace trombocytů a neutrofilů. Klíčovou roli při vzniku trombózy má tkáňový faktor (TF). Proniknutí infekce do organismu vede k tvorbě komplexu TF‑f.VIIa na buněčných površích i v krevním oběhu, který zahajuje iniciální fázi koagulace aktivováním faktorů IX a X. Syntézu a expresi TF na endotelových buňkách a monocytech stimulují bakteriální lipopolysacharidy. U akutních nozokomiálních a komunitních infekcí riziko TEN výrazně narůstá 2–4 týdny od začátku onemocnění, potom postupně klesá, ale zůstává významně zvýšené v průběhu celého roku. S nejvyšším rizikem TEN jsou spojené respirační infekce. Pro tromboprofylaxi u pacientů hospitalizovaných s akutní infekcí, akutním interním onemocněním komplikovaným nozokomiální infekcí a u kriticky nemocných pacientů s infekcí, včetně pacientů s covid-19, stále platí ACCP doporučení z roku 2012 o podávání profylaktických dávek LMWH, UFH nebo fondaparinuxu, které bylo aktualizováno expertním panelem v roce 2020. DOAC ani protidestičkové léky se nedoporučují.
Klíčová slova:
tromboembolická nemoc – COVID-19 – Virchowova triáda – zánět – tkáňový faktor – cytokiny – komplement – endotoxin – D‑dimery – respirační infekce – chlamydie – imunotrombóza.
Úvod
Jednou z nejzávažnějších známých komplikací koronavirového onemocnění covid-19, zejména u kriticky nemocných, je žilní tromboembolická nemoc (TEN). Tato skutečnost dnes proto obrací naši pozornost na souvislosti mezi infekčními onemocněními a TEN. O tom, že existuje vztah mezi infekcí, zánětem a akutními kardiovaskulárními příhodami, víme již dlouho, vždyť chřipkové epidemie jsou každoročně provázené nárůstem kardiovaskulární mortality. Proti tomuto trendu se medicína zkouší bránit pravidelným, opakovaným očkováním rizikové populace starších, polymorbidních osob proti chřipce nebo pneumokokům.
Vztah mezi infekcí a TEN je pro klinickou praxi významný již z prostého pohledu četnosti výskytu obou onemocnění v populaci. Zanedbatelné není také riziko smrti a chronických následků, spojených s TEN. I když všechny podrobnosti nejsou stále objasněné, můžeme říct, že akutní infekce a systémový zánět zvyšují riziko TEN, protože jsou spojené se všemi faktory Virchowovy triády – venostáza, zvýšená koagulace, poškození endotelu žilní stěny (Tab. 1).
Table 1. Faktory podílející se na patogenezi žilní trombózy u akutních virových a bakteriálních infekci 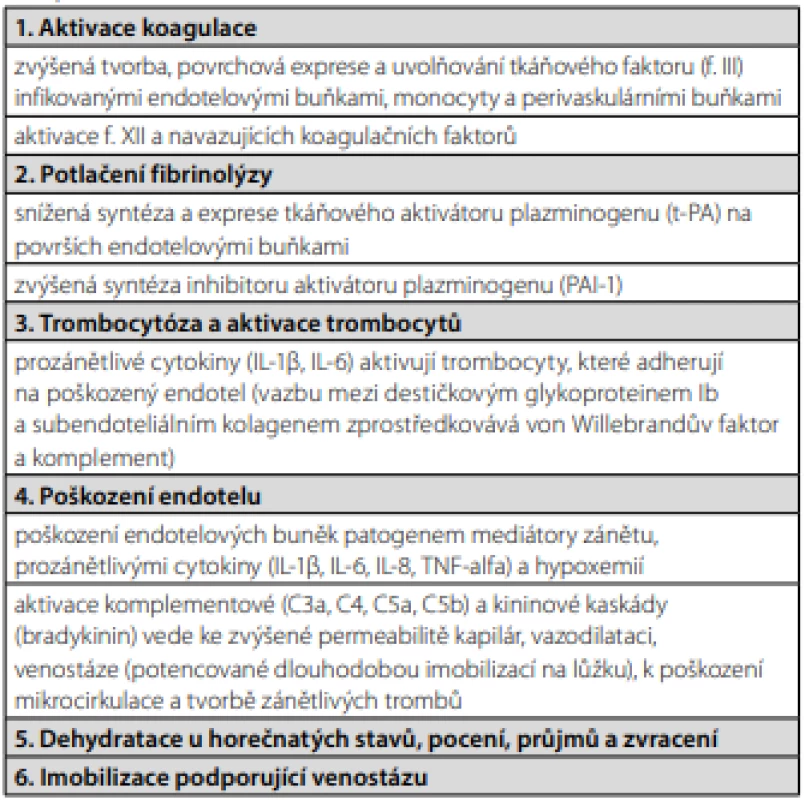
Patofyziologie
Mechanismus prokoagulačních pochodů v organismu v reakci na infekci je komplexní. V patogenezi lze vystopovat spojení: akutní infekce – tromboinflamatorní obranná reakce organismu – Virchowova triáda – žilní trombóza. Takto jednoduše nastíněná posloupnost je ve skutečnosti mnohem komplikovanější a doposud není dostatečně objasněna. Řešení problému neusnadňuje ani fakt, že procesy mohou probíhat obousměrně. Zánět může být příčinou, ale i důsledkem trombózy a imunitní systém může podněcovat vznik i rozpuštění trombu.
Základními protiinfekčními obrannými mechanismy organismu jsou prozánětlivá odpověď a aktivace lokální a později systémové koagulace. Prozánětlivá odpověď spočívá v tvorbě prozánětlivých cytokinů a proteinů komplementového systému, které mohou vyvolat koagulopatii. Aktivace lokální a systémové koagulace se odvíjí od exprese tkáňového faktoru (TF) na endotelových buňkách a monocytech/ makrofázích, od aktivace trombocytů a neutrofilů.
Proniknutí jakéhokoliv infekčního agens do organismu vede k poškození buněčných membrán, jak epiteliálních, tak endoteliálních, a k tvorbě trombinu. Na epitelech orgánů a tělesných povrchů, na endotelových a perivaskulárních buňkách (pericyty obklopující endotelie v kapilárách, arteriolách a venulách, buňky hladkých svalů obklopující velké tepny a žíly) je trvale exprimovaný TF, který zde vytváří hemostatic ‑ kou bariéru. TF je transmembránový proteinový receptor s vysokou afinitou k f. VII (prokonvertin), který aktivuje a spouští tak koagulaci. Během zánětu stoupá tvorba TF buňkami našeho těla a významně se zvyšuje také jeho produkce neutrofilními granulocyty a hlavně monocyty (1).
Infekcí poškozené nebo ovlivněné buňky cévního endotelu ve zvýšené míře syntetizují TF (f. III, tkáňový tromboplastin), poté ho exprimují na svém povrchu a uvolňují do krve, snad také do perivaskulárního prostoru. V krvi je neustále přítomno malé množství f. VII (některé práce mluví o „předpřipraveném“ komplexu TF‑f.VII/f.VIIa v krvi i ve tkáních), který se po setkání s TF aktivuje a vzniká komplex TF‑VIIa‑Ca2+-fosfolipidy, zahajující iniciální fázi koagulace aktivováním faktorů IX a X. Pokud tento proces není včas zastaven inhibitorem TF (TFPI – tissue factor pathway inhibitor, účinně zpětnovazebně inhibuje komplex TF‑F.VIIa a ukončuje aktivaci koagulační kaskády), následují podle nového revidovaného modelu koagulace další dvě fáze, amplifikace a progrese, řízené trombinem (f. IIa). Výsledkem je vznik trombózy. V celé této kaskádě hrají klíčovou roli TF a trombin (1). Proces nastartování koagulace akutní infekcí přehledně schematicky ukazuje obrázek 1.
Důsledkem rychlé akcelerace koagulace je, že v iniciální fázi infekce stoupají hladiny D‑dimerů a fibrinogenu v krvi. Infekce byla označena jako nejčastější důvod zvýšené hladiny D‑dimerů u pacientů vyšetřených na urgentním příjmu (2). Sepse patří spolu s TEN a aktivními nádory k nejčastějším příčinám extrémního zvýšení hladin D‑dimerů v krvi, desetinásobně přesahujících horní hranici normy (> 5000 μg/l) (3).
Pokud chceme zkoumat vztah mezi infekcí, aktivací koagulace a trombózou, měli bychom na problém nahlížet ze dvou úhlů:
- přímé působení infekčního agens na endotel (molekulární vzorce aktivující koagulaci spojené s patogenem)
- prozánětlivá imunitní reakce organismu na patogen (molekulární vzorce aktivující koagulaci spojené s poškozením hostitele)
Přímé působení infekčního agens na endotel
Expozice cévního endotelu virům nebo bakteriím vede k jeho dysfunkci bez makroskopického poškození. Mikroskopické změny jsou však výrazné. Přímou infekcí endotelových buněk virem, kdy virus prostřednictvím receptoru vstupuje do buňky a poškozuje ji, se zvyšuje exprese TF a potlačuje fibrinolýza uvolněným inhibitorem aktivátoru plazminogenu 1 (PAI-1). In vitro byla na kulturách plicních fibroblastů a lidských umbilikálních žilních endotelií demonstrována schopnost virů vyvolávajících závažné respirační infekce (virus chřipky typu A a B, parainfluenzavirus, respiračně‑syncytiální virus, cytomegalovirus, adenovirus) navodit v infikovaných endoteliálních buňkách prokoagulační aktivitu, kdy bylo prokázáno 55% zkrácení protrombinového času (PT) potřebného ke vzniku koagula.
PT je test zevní a společné cesty hemokoagulace, který udává rychlost přeměny protrombinu (f. II) na trombin (f. IIa) působením TF. Nadbytek TF, indukovaný virovou infekcí na endotelových buňkách, proto PT zkracoval a přidáním krevní plazmy bez f. VII se koagulační čas normalizoval. Zkoumané respirační viry způsobily v napadených endotelových buňkách posun jejich přirozeného antikoagulačního nastavení k prokoagulačnímu tím, že 4 až 5násobně zvýšily syntézu a povrchovou expresi TF, měřeného aktivací f. X. (4).
Obdobnou, na TF závislou prokoagulační aktivitu v endoteliálních buňkách lidského pupečníku vyvolal také virus herpes simplex (VHS). Přitom reakce endotelu nezávisela na replikaci viru. Tedy endoteliální buňky zvýšeně exprimovaly TF bez k aktivní, produktivní infekce VHS (5). Dalším zjištěným důvodem prokoagulačního stavu při infekci VHS byla snížená syntéza tkáňového aktivátoru plazminogenu (t‑PA) (6).
Až ke čtyřnásobnému nárůstu exprese TF endoteliálními buňkami docházelo in vitro po jejich infikování bakteriemi chlamydia pneumoniae a chlamydia trachomatis. Maximální hodnoty TF byly změřené 18 hodin po infekci a zvýšené expresi TF nezabránilo ani podání tetracyklinu. Lze tedy předpokládat, že „chlamydiový faktor“ odpovědný za stimulaci syntézy TF byl vytvořený na začátku infekce a jeho tvorba již nemohla být podaným antibiotikem ovlivněna. Kromě toho chlamydiová infekce významně zvyšovala adhezi trombocytů na endotelové buňky (7). Zvýšená interakce mezi trombocyty a endoteliemi je však u infekčních onemocnění běžná a podílí se na vzniku žilní i tepenné trombózy.
Prozánětlivá imunitní reakce organismu na patogen
Etiologie prokoagulační reakce organismu na infekční agens je komplexní vyvolaná specifickými interakcemi mezi imunitním a koagulačním systémem. Řada rizikových faktorů TEN vede ke vzniku trombózy prostřednictvím mediátorů zánětu. Celková zánětlivá reakce organismu na infekci je výsledkem interakce určitých komponent povrchových struktur infekčního agens nebo komplexů antigen‑protilátka s receptory na kompetentních buňkách (v případě infekce COVID-19 je to receptor pro angiotenzin konvertující enzym 2) a s některými plazmatickými proteiny (8).
Infekce a zejména sepse vyvolávají v těle cytokinovou bouři, kdy se do krevního oběhu uvolňují buněčné signalizační proteiny, souhrnně nazývané prozánětlivé cytokiny (IL-1β, IL-6, IL-8, TNF‑alfa), které zvyšují syntézu a uvolňování proteinů akutní fáze játry (CRP, fibrinogen) a aktivují koagulaci. Bylo prokázáno spojení mezi zvýšenými hladinami těchto látek během systémového zánětu a rizikem TEN (9). Zánětlivá odpověď organismu závisí také na typu patogenu. Grampozitivní respirační a kožní infekce stafylokoky, streptokoky nebo pneumokoky vyvolávají ve srovnání s gramnegativními intraabdominálními a urogenitálními infekcemi rychlejší a výraznější zánětlivou odpověď (14). Z toho možná plyne nejvyšší riziko TEN provázející respirační infekce (Tab. 2).
Table 2. Poměry četnosti výskytu jakékoliv TEN spojené s nemocničními a komunitními infekcemi k výskytu TEN u kontrol bez infekce 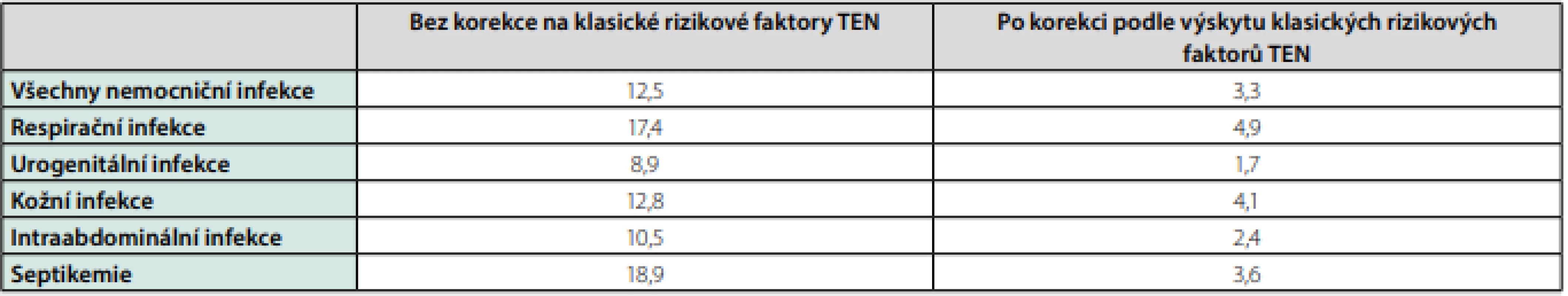
Upraveno podle Schmidt M, et al. Acute infections and venous thromboembolism. J Int Med 2012; 271: 608–618. Bakteriální antigeny, zejména lipopolysacharidy bakteriální stěny, a zánětlivé cytokiny indukují expresi TF na površích různých buněk lidského těla, zejména na endotelu a monocytech a inicializují koagulaci a tvorbu trombinu. Některé cytokiny se mohou vázat přímo na TF a ak ‑ tivovat ho. Na rozdíl od traumatického žilního poškození, které obnaží subendoteliální kolagen a smáčivou extracelulární matrix, může vést zánět ke vzniku trombózy v makroskopicky intaktní cévě, na jejímž povrchu se vlivem mediátorů zánětu exprimuje TF, který spustí koagulační kaskádu, která za určitých okolností může vyústit do vzniku žilní trombózy (9).
Mezi nejvýznamnější bakteriální lipopolysacharidy patří endotoxin gramnegativních bakterií, který byl zkoumán in vitro instilací na izolované segmenty povrchových žil horních končetin zdravých dobrovolníků. Během hodinového působení došlo k endoteliální dysfunkci se snížením syntézy bradykininu a kyseliny arachidonové. Výsledkem byla porucha endotelem zprostředkované relaxace hladké svaloviny cévní stěny, která přetrvávala až 7 dnů, tedy mnohem déle, než trval přímý vliv endotoxinu. Někteří autoři, proto mluví o „omráčení endotelu“, jako o jednom z možných mechanismů spojujících infekci, zánět a zvýšené riziko TEN (10).
Monocyty, klíčoví hráči buněčné imunity, exponované in vitro nebo in vivo bakteriálnímu lipopolysacharidu rychle na svém povrchu exprimují TF a také ho prostřednictvím extracelulárních vesikul uvolňují do oběhu. Jedná se o vrozenou imunitní odpověď usnadňující intravaskulární tvorbu krevní sraženiny, která má omezit diseminaci patogenů krevním oběhem (11). Obranné mechanismy organismu zvyšují svoji aktivitu podle závažnosti infekce a potenciálně mohou vést k poškození hostitele.
U sepse spojené s endotoxinemií může reakce na patogen vyvrcholit až systémovou aktivací koagulace a potlačením fibrinolýzy s tvorbou fibrinových sraženin v mikrocirkulaci selhávajících orgánů (DIC – diseminovaná intravaskulární koagulace), s vazodilatací a hypotenzí. Jindy mohou protilátky vytvářené v rámci imunitní odpovědi na infekci výrazně zvýšit hladinu von Willebrandova faktoru v krvi, který stimuluje agregaci a adhezi trombocytů na cévní stěnu a výsledkem je trombotická trombocytopenická purpura. Při poruše komplementového systému zase dochází k poškození endotelových buněk, tvorbě trombózy a vzniká hemolyticko‑uremický syndrom.
Endotoxin, kromě stimulace TF, také aktivuje f. XII (Hagemanův) a spouští vnitřní cestu koagulace, ovlivňuje agregaci a degranulaci trombocytů, má vliv na makrofágy a neutrofily, ve vyšších koncentracích může aktivovat komplement, ale také fibrinolytickou a kininovou kaskádu. Čistý klinický výsledek aktivace Hagemanova faktoru závisí do značné míry na individuální výkonnosti homeostatických mechanismů jedince. Kromě prokoagulačního působení také dochází k výrazné venostáze, jednomu z faktorů Virchowovy trias, a to hned dvojí cestou. Aktivací kininového systému se uvolňuje bradykinin s velmi výrazným vazodilatačním působením a zvýšenou permeabilitu a poškození kapilár, vazodilataci a venostázu má na svědomí také infekcí dysregulovaný systém komplementu (C3a a C5a, C5b) (8).
O tom, že o vztazích mezi infekcí a žilní trombózou toho stále víme málo, nás přesvědčila také probíhající pandemie. Případy PE u pacientů s covid-19, kde chybí HŽT a tromby jsou lokalizovány pouze daleko na periferii plicních tepen a arteriol, vedly ke vzniku nové hypotézy o tom, že se zde ve skutečnosti nejedná o emboly, ale o tromby primárně vznikající in situ. Tento fenotyp PE je definován jako mikrotrombóza nebo imunotrombózy či zánětlivá trombóza vznikající v plicních tepnách vlivem hypoxie a poškození endotelu zánětem (12, 13).
Akutní infekce a riziko TEN
Jak moc a jak dlouho zvyšují různé nozokomiální a komunitní infekce riziko TEN? Na tuto otázku se pokusila odpovědět v tomto směru zatím největší populační studie případů a kontrol zahrnující velkou skupinu 1,8 milionu obyvatel severního Dánska, která sledovala vztah mezi infekcí a TEN podle údajů v lékařských databázích z let 1999–2009. Ve srovnání s osobami, u kterých se v průběhu jednoho roku žádná infekce nevyskytla, byl poměr četnosti výskytu jakékoliv TEN u pacientů s nemocniční infekci 12,5 : 1 a u pacientů léčených ambulantně pro komunitní infekci 4 : 1 (14).
Samozřejmě, že v porovnání s kontrolami mělo mnohem víc pacientů s TEN kromě infekce současně také další rizikové faktory – nádorové onemocnění, úraz, operaci, závažné interní choroby, pro které byli hospitalizováni, různé komorbidity nebo šlo o těhotné. Bylo proto nutné provést korekci, po které četnost výskytu TEN u pacientů s nozokomiální infekcí klesla na 3,3 a u pacientů s komunitní infekcí léčenou ATB na 2,6, ale spojení mezi akutními nemocničními a komunitními infekcemi a výrazně vyšším rizikem TEN, jak hluboké žilní trombózy (HŽT), tak i plicní embolie (PE), bylo prokázáno. Nejvyšší riziko přinášely respirační nákazy, které bylo vyšší než u septikemií (Tab. 2).
Riziko TEN narostlo osminásobně během prvních 2 týdnů od začátku infekce a poté postupně klesalo, ale až do konce prvního roku bylo stále ještě u všech druhů infekce 2× vyšší než u kontrol. U komunitních infekcí léčených ATB byl výskyt TEN první 2 týdny 5,5× vyšší, potom postupně klesal a v průběhu roku přetrvávalo 1,2–1,6 násobné zvýšení ve srovnání s osobami bez infekce.
Vliv infekce byl modifikován pohlavím, s mírně nižší četností výskytu u žen než u mužů. Jinak přítomnost akutní infekce zvyšovala riziko TEN bez ohledu na věk, přítomnost nádoru, diabetu, kardiovaskulárního onemocnění, obezity, CHOPN či astmatu. Pouze u pacientů s traumatem nebo frakturou, komplikovanými infekcí, se objevovala TEN ve srovnání s osobami bez traumatu méně často. U těchto pacientů bylo zřejmě riziko TEN primárně již tak vysoké, že ho přítomnost infekce dále nemohla významněji zvýšit.
Další studie zjišťující, které rizikové faktory působily během 90 dnů před hospitalizaci pro akutní TEN, nalezla akutní infekci jako jednu z pěti nejčastějších spouštěčů s poměrem četnosti výskytu 2,63 pro všechny infekce. Tento výsledek odpovídá závěrům předchozí dánské studie (15).
Zjištění dánské případové studie, že akutní infekce, zejména respirační, přechodně po dobu až jednoho roku zvyšují riziko TEN, bylo ověřeno také dalšími autory. Série řady případů 7278 pacientů s HŽT a 3775 pacientů s PE ve Velké Británii z let 1987–2004 sledovala výskyt první TEN po akutní ko ‑ munitní respirační a močové infekci. Riziko po močové infekci bylo nejvyšší první 2 týdny (Incidence ratio IR 2,10 pro HŽT a IR 2,11 pro PE) a postupně se normalizovalo v průběhu jednoho roku. U respiračních infekcí riziko rovněž stoupalo, ale nesprávná diagnostická klasifikace zabránila spolehlivému odhadu rizika (16). Další britská studie případů a kontrol s 11557 pacienty s HŽT a 5162 pacienty s PE z let 1991–2006 nalezla po akutní respirační infekci zvýšení rizika HŽT (RR 2,64) a PE (RR 2,5) v průběhu 1–3 měsíců od infekce, které přetrvávalo celý rok (17). Akutní infekce byly spojeny s přechodným zvýšením rizika všech cévních onemocnění. Naproti tomu vakcinace proti chřipce, tetanu a pneumokokům riziko nezvyšovala (18).
Odhady vycházející z pitevních nálezů uvádějí, že fatální PE je příčinou smrti u 5–10 % hospitalizovaných dospělých pacientů, bez ohledu na výrazné pokroky v diagnostice a léčbě na tomto poli. Fatální PE se nevyskytla ve věku pod 18 let, naopak 80 % zemřelých bylo starších 60 let (19, 20). Ve srovnání s chirurgickými obory byla fatální PE častější u interních, nechirurgických pacientů, zejména u kriticky nemocných na JIP. V této skupině byli nejvíce postiženi pacienti, kteří během 6 týdnů před úmrtím trpěli rozvinutým akutním onemocněním, nejčastěji akutní infekcí (24 %) a nádorem (22 %) (20). Fatální PE, potvrzená pitvou, se vyskytla na infekčním oddělení výlučně u osob starších 55 let s incidencí 0,4 %, ve věku nad 65 let s incidencí 0,6 %. U respiračních infekcí byla incidence u obou věkových skupin ještě vyšší, 0, 7 % a 0,8 % (21).
Tromboprofylaxe u pacientů s akutní infekcí
Závěry uvedených klinických studií jednoznačně potvrzují, že akutní infekce patří na seznam velmi významných rizikových faktorů TEN. Ke vzniku žilní trombózy dochází přímým působením infekčního agens na endotel a také zprostředkovaně zánětlivou reakcí organismu (Tab. 1, Obr. 1). Pokud by se v klinické praxi podařilo včas identifikovat biomarkery zánětu aktivující koagulační kaskádu, mohli bychom u pacientů se zánětlivými infekčními a neinfekčními chorobami snáze odhadnout nebezpečí TEN a po zvážení poměru rizika a benefitu nasadit vhodnou tromboprofylaxi nebo protizánětlivé léky.
Image 1. Schéma iniciální fáze koagulace spouštěné akutní infekcí 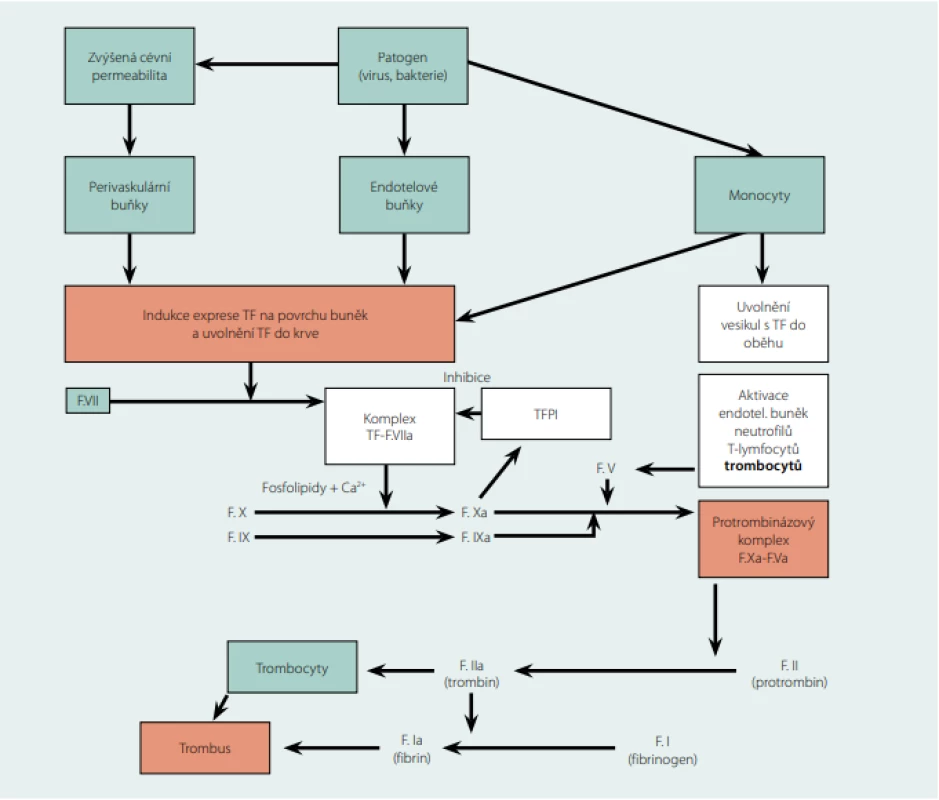
Tkáňový faktor (TF) má klíčovou roli při vzniku žilní trombózy. Je to transmembránový proteinový receptor s vysokou afinitou k f. VII a některým cytokinům. Je exprimován na površích perivaskulárních buněk (fibroblasty adventicie a pericyty), krevních elementů (neutrofilní granulocyty, monocyty), endotelových a epitelových (keratinocyty) buněk orgánů a tělesných povrchů, kde vytváří ochrannou hemostatickou bariéru. Ve velkém množství je exprimován v mozku, plicích, srdci, děloze a placentě. Naopak málo TF se nachází v kosterních svalech a kloubech. Při sepsi a endotoxemii jsou hlavním zdrojem TF monocyty, což může spustit nekontrolovanou intravaskulární koagulaci (DIC). Poškození cévního endotelu vede na buněčných membránách i v krevním oběhu k tvorbě komplexu TF-F.VIIa (zevní tenáza, tedy primární aktivátor f. X, ve starém modelu koagulace označovaná jako zevní cesta aktivovaná tkáňovým poškozením, ke své funkci potřebuje fosfolipidy a ionty Ca2+), který spouští koagulaci aktivací f. IX a f. X. Aktivované trombocyty a trombin jsou důležitým zdrojem f. Va, který spolu s f. Xa vytváří protrombinázový komplex (společně s fosfolipidy a Ca2+). TFPI – tissue factor pathway inhibitor, zpětnovazebně inhibuje komplex TF-F.VIIa, ukončuje aktivaci koagulační kaskády. Z praktického hlediska je třeba problematiku tromboprofylaxe u pacientů s akutní infekcí rozdělit na dvě části (pomíjím akutní komunitní infekce, které zatím nebyly stran tromboprofylaxe konsenzuálně řešeny):
- tromboprofylaxe u pacientů hospitalizovaných s akutní infekcí, nebo s akutním interním onemocněním, u kterých dojde k rozvoji nozokomiální infekce
- tromboprofylaxe u kriticky nemocných infekčních pacientů hospitalizovaných na JIP
Tromboprofylaxe u pacientů hospitalizovaných s akutní infekcí, nebo s akutním interním onemocněním komplikovaným nozokomiální infekcí
Na základě posledních ACCP doporučení (22) založených na důkazech je u nechirurgických pacientů hospitalizovaných pro akutní onemocnění spojeným s vysokým rizikem TEN, kam jistě patří také pacienti s akutní infekcí, indikována tromboprofylaxe LMWH 1× den ‑ ně, nízkými dávkami nefrakcionovaného heparinu (UFH) 2× až 3× denně nebo fondaparinuxem (1B). Po propuštění z hospitalizace by měla být léčba ukončena (2B). Při vysokém riziku krvácení, nebo pokud pacient již krvácí, není doporučena farmakoprofylaxe (1B), ale mechanická tromboprofylaxe kompresivními punčochami (2C) nebo intermitentní pneumatickou kompresí (IPK) (2C).
Tromboprofylaxe u kriticky nemocných infekčních pacientů
Kriticky nemocní pacienti jsou vystaveni vysokému riziku žilní trombózy na základě všech třech faktorů Virchowovy triády. Současně zde narůstá riziko velkého krvácení (13). Přesto se zde ACCP doporučení neliší od tromboprofylaxe u akutně nemocných interních pacientů. Preferují LMWH nebo nízké dávky UFH (2C) bez bližšího upřesnění dávkování a délky podávání, v případě krvácení nebo vysokého rizika krvácení mechanickou tromboprofylaxi kompresivními punčochami nebo IPK (2C) s přechodem na farmakoprofylaxi po vymizení/snížení rizika krvácení (2C). Jediným rozdílem je, že třída doporučení a stupeň důkazů jsou zde nižší, než u akutně nemocných (viz výše). Rutinní ultrazvukový skrínink HŽT se nedoporučuje (2C).
V současnosti se setkáváme s častým výskytem TEN u pacientů hospitalizovaných s pneumonií při onemocnění covid-19, zejména s PE u kriticky nemocných na JIP (23). Retrospektivní studie zjistila v kohortě 1 114 nemocných s covid-19 symptomatickou TEN u 27 % pacientů hospitalizovaných na JIP a u 2,2 % nemocných na standardním oddělení, přičemž profylaktická antikoagulace byla podávána na JIP v 89 % a na standardním oddělení v 85 % případů (24). K trombotickým komplikacím zde docházelo podle některých pozorování často, navzdory obvyklé farmakoprofylaxi (25). To vedlo k prosazování intermediálních dávek LMWH a někteří autoři dokonce navrhují terapeutické dávkování, alespoň v rámci hospitalizace na JIP. Důkazy pro takový postup zatím neexistují a oficiální návod, shrnutý v doporučení a zprávě expertního panelu vydaném během pandemie, se stále drží platných, doporučených postupů, dokud nebudou ukončeny randomizované klinické studie (26) (Tab. 3).
Table 3. Prevence TEN u pacientů hospitalizovaných s akutním onemocněním covid-19 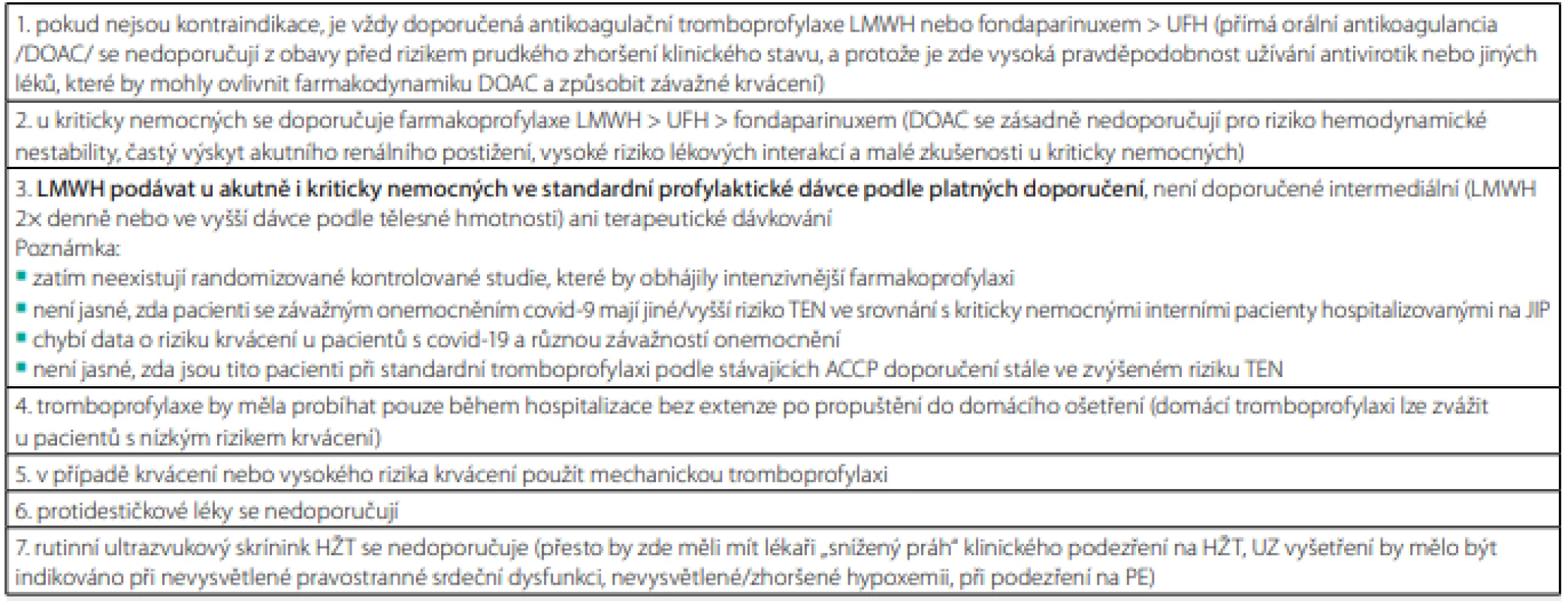
Upraveno podle Moores LK, Tritschler T, Brosnahan S, et al. Prevention, diagnosis, and treatment of VTE in patients with coronavirus disease 2019. Chest guideline and expert panel report. Chest 2020; 158: 1143–1163. Navzdory řadě kazuistických pozorování zatím není vůbec jasné, zda kriticky nemocní pacienti s covid-19 mají opravdu jinou úroveň rizika TEN ve srovnání s ostatními kriticky nemocnými interními pacienty hospitalizovanými na JIP. U těchto pacientů existují také opačné zprávy o zvýšeném výskytu TEN navzdory plné antikoagulaci (23, 27). V prevenci plicní imunotrombózy (viz výše) může být spíše než antikoagulace účinnější antivirová a imunomodulační léčba (12). Kromě toho chybí spolehlivé údaje o riziku krvácení, které zde bude jistě zvýšené.
Závěr
Již dlouho víme, že akutní infekce, zejména závažné nozokomiální a komunitní respirační nákazy a septické stavy, jsou příčinou poruchy hemostázy, která se projevuje zvýšeným výskytem nejenom TEN, ale také CMP, akutních koronárních syndromů nebo lokalizované koagulace v mikrocirkulaci. Prokoagulační vliv má přímé působení infekčního agens na endotel a celková zánětlivá imunitní reakce organismu. Na patogenezi TEN se podílejí všechny faktory Virchowovy triády, zejména potom koagulopatie a venostáza.
U akutních nozokomiálních a komunitních infekcí riziko TEN výrazně narůstá první 2–4 týdny od začátku onemocnění, potom postupně klesá, ale zůstává významně zvýšené asi po dobu jednoho roku. S nejvyšším rizikem TEN jsou spojené respirační infekce. Fatální plicní embolie postihují nejčastěji hospitalizované interní pacienty s onkologickým onemocněním nebo akutní infekcí.
Pro tromboprofylaxi u pacientů hospitalizovaných s akutní infekcí, akutním interním onemocněním komplikovaným nozokomiální infekcí a u kriticky nemocných pacientů s infekcí platí ACCP doporučení z roku 2012 o podávání profylaktických dávek LMWH, UFH nebo fondaparinuxu. DOAC ani protidestičkové léky se nedoporučují.
V současnosti se setkáváme s častějším výskytem TEN u pacientů hospitalizovaných s pneumonií při onemocnění covid-19, zejména s PE u kriticky nemocných na JIP. Stojíme proto před otázkou, zda v těchto případech stále pokračovat v profylaktické dávce LMWH a ukončit léčbu při propuštění z hospitalizace, nebo je lepší přejít na intermediální či dokonce terapeutické dávkování a pokračovat v léčbě ještě po propuštění z JIP nebo z nemocnice. Zatím podle expertního panelu, zveřejněného v červnu 2020, stále platí dosavadní ACCP doporučení o profylaktickém dávkování LMWH, UFH a fondaparinuxu, dokud probíhající randomizované klinické studie neprokáží něco jiného.
KORESPONDENČNÍ ADRESA AUTORA:
doc. MUDr. Dalibor Musil, Ph.D.,
Cévní centrum, I. interní klinika – kardiologická FN a LF Olomouc,
I. P. Pavlova 6,
779 00 Olomouc
Cit. zkr: Vnitř Lék 2020; 66(8): e17–e23
Článek přijat redakcí: 3. 11. 2020
Článek přijat po recenzích: 22. 11. 2020
Sources
1. Fontana J, Lavríková P. Hemostáza, ve: Funkce buněk lidského těla. Multimediální skripta, fblt.cz/skripta
2. Lippi G, Bonfanti L, Saccenti C, Cervellin G. Causes of elevated D‑dimer in patients admitted to a large urban emergency department. Eur J Intern Med 2014; 25 : 45–48.
3. Schutte T, Thijs A, Smulders YM. Never ignore extremely elevated D‑dimer levels: they are specific for serious illness. Neth J Med 2016; 74 : 443–448.
4. Visseren FL, Bouwman JJ, Bouter KP, et al. Procoagulant aktivity of endothelial cells after infection with respiratory viruses. Thromb Haemost 2000; 84 : 319–324.
5. Key NS, Bach RR, Vercellotti GM, Moldow CF. Herpes simplex virus type 1 does not require productive infection to induce tissue factor in human umbilical vein endothelial cells. Lab Invest 1993; 68 : 645–651.
6. Bok RA., Jacob HS., BallaJ., el al. Herpes simplex virus decreases endothelial cell plasminogen activator inhibitor. Thromb Haemost 1993; 69 : 253–258.
7. Fryer RH, Schwobe EP, Woods ML, Rodgers GM. Chlamydia species infect human vascular endothelial cells and induce procoagulant activity. J Invest Med 1997; 45 : 168–174.
8. Havlík J a kol. Infektologie, učebnice pro lékařské fakulty, Avicenum zdravotnické nakladatelství Praha 1990, ISBN 80-201-0062-8.
9. Branchfort BR, Carpenter SL. The role of inflammation in venous thromboembolism. Front Pediatr 2018; 6 : 142.
10. Bhagat K, Moss R, Collier J, Vallance P. Endothelial „stunning“ following a brief exposure to endotoxin: a mechanism to link infection and infarction? Cardiovasc Res 1996; 32 : 822–829.
11. Franco RF, Jonge de E, Dekkers PE, et al. The in vivo kinetics of tissue factor messenger RNA expression during human endotoxemia: relationship with activation af coagulation. Blood 2000; 96 : 554–559.
12. Chowdhury JF, Moores LK, Connors JM. Anticoagulation in hospitalized patients with covid-19. NEJM 2020; 383 : 1675–1678.
13. Desborough MJR, Doyle AJ, Griffiths A, Retter A, et al. Image‑proven thromboembo ‑ lism in patients with severe covid-19 in a tertiary critical care unit in the United Kingdom. Thromb Res 2020; 193 : 1–4.
14. Schmidt M, et al. Acute infections and venous thromboembolism. J Int Med 2012; 271 : 608–618.
15. Rogers MAM, Levine DA, Blumberg N, et al. Triggers of hospitalization for venous thromboembolism. Circulation. 2012; 125 : 2092–2099.
16. Smeeth L, Cook C, Thomas S, et al. Risk of deep vein thrombosis and pulmonary embolism after acute infection in a community setting. Lancet 2006; 367 : 1075–1079.
17. Clayton TC, Gaskin M, Meade TW. Recent respiratory infection and risk of venous thromboembolism: case‑control study through a general practice database. Int J Epidemiol 2011; 40. 819–827.
18. Smeeth L, Thomas SL, Hall Aj, et al. Risk of myocardial infarction and stroke after acute infection or vaccination. N Engl J Med 2004; 351 : 2611–2618.
19. Sandler DA, Martin JF. Autopsy proven pulmonary embolism in hospital patients: are we detecting enough deep vein thrombosis? J R Soc Med 1989; 82 : 203–205.
20. Alikhan R, Peters F, Wilmott R, Cohen AT. Fatal pulmonary embolism in hospitalised patients: a necropsy review. J Clin Pathol 2004; 57 : 1254–1257.
21. Gårdlund B. Fatal pulmonary embolism in hospitalised non‑surgical patients. Acta Med Scand 1985; 218 : 417–421.
22. Guyatt HG, Akl EA, Crowther M, et al. Antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians, evidence‑based clinical practice guidelines. Chest 2012; 141(2) Suppl: 7S–47S.
23. Helms J, Tacquard C, Severac F, et al. High risk of thrombosis in patients with severe SARS‑Cov-2 infection: a multicenter prospective cohort study. Intensive Care Med 2020; 46 : 1089–1098.
24. Piazza G, Campia U, Hurwitz S,et al. Registry of arterial and venous thromboembolic complications in patients with COVID-19. J Am Coll Cardiol. 2020; 76 : 2060–2072.
25. Klok FA, Kruip MJHA, van der Meer NJM, et al. Incidence of thrombotic complications in critically ill ICU patients with COVID-19. Thrombosis Research 2020; 191 : 145–147.
26. Moores LK, Tritschler T, Brosnahan S, et al Prevention, diagnosis, and treatment of VTE in patients with coronavirus disease 2019. Chest guideline and expert panel report. Chest 2020; 158 : 1143–1163.
27. Llitjos JF, Leclerc M, Chochois C, et al. High incidence of venous thromboembolic events in anticoagulated severe covid-19 patients. J Thromb Haemost 2020; 18 : 1743–1746.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2020 Issue 8-
All articles in this issue
- Změny farmakokinetiky léčiv u obézních pacientů
- Chirurgická léčba těžké obezity – bariatrie
- Současnost a perspektivy farmakoterapie obezity
- Fyzická aktivita v léčbě obezity v praxi
- Jak léčit obézního hypertonika?
- Suplementácia vitamínu D ako dôležitý faktor v prevencii a liečbe ochorenia COVID-19: aké máme dôkazy?
- Protidestičková léčba v sekundární prevenci nekardioembolických ischemických mozkových cévních příhod
- Věkem podmíněná remodelace myokardu: mýtus nebo realita?
- Fixní kombinace rosuvastatinu s ezetimibem
- Vplyv ageizmu na správnosť indikácie antikoagulancií u seniorov s fibriláciou predsiení v práci kardiologickej ambulancie medzi rokmi 2012 a 2017
- Akutní infekce, žilní trombóza a doporučená tromboprofylaxe
- Hypogonadismus obézních mužů
- Péče o hospitalizovaného dialyzovaného pacienta z pohledu internisty
- Monitorování farmakokinetiky infliximabu u idiopatických střevních zánětů
- Heparínom indukovaná trombocytopénia a aktuálne možnosti liečby – prehľad literatúry
- Neobvyklá manifestace CMV infekce – cirkulární stenóza žaludku
- Nebezpečí číhající v mořích – komplikace setkání s jedovatou rybou ropušnicí obecnou (Scorpion fish)
- Disekcia ascendentnej aorty, diagnóza na ktorú treba myslieť
- Prof. Jiří Šonka a obezitologie
- Molekula erdostein společnosti Recipharm byla s pozitivním výsledkem testována jako součást léčby pacientů s COVID-19
- Antioxidační a bronchoprotektivní účinek erdosteinu
- Zkrácená informace o přípravku ERDOMED
- K 100. výročí narození prof. MUDr. Jiřího Šonky, DrSc.
- 2020: rok, kdy ambulantní internisté vzali budoucnost do svých rukou. Konečně!
- Programy kvality Q‑OSTEOPORÓZA a Q‑DYSLIPIDEMIE – cesta k dlouhodobé stabilitě v oboru
- 110. výročí narození primáře Kadeřábka
- Role metabolického syndrome v indukci chronické pankreatitidy po první atace akutní pankreatitidy – multicentrická studie
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Péče o hospitalizovaného dialyzovaného pacienta z pohledu internisty
- Změny farmakokinetiky léčiv u obézních pacientů
- Heparínom indukovaná trombocytopénia a aktuálne možnosti liečby – prehľad literatúry
- Nebezpečí číhající v mořích – komplikace setkání s jedovatou rybou ropušnicí obecnou (Scorpion fish)
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

