-
Medical journals
- Career
Funkce endotelu, její vztah k arteriální hypertenzi a možnosti její modulace
Authors: Vladislav Biel 1; Jan Novák 2; Luděk Pluháček 1; Jiří Špác 2
Authors‘ workplace: Interní oddělení Nemocnice Boskovice 1; II. interní klinika LF MU a FN u sv. Anny, Brno 2
Published in: Vnitř Lék 2018; 64(7-8): 762-770
Category: Reviews
Overview
Endotel má mimo ochranné i velmi komplexní parakrinní, endokrinní a autokrinní funkce. Z hlediska cévního tonu lze funkce endotelu chápat jako rovnováhu mezi produkcí vazodilatačních a vazokonstrikčních substancí. Mezi nejdůležitější vazodilatační látky patří oxid dusnatý (NO), PGI2, EDHF (endotel-deriving hyperpolarising factor), adenozin a další, mezi nejvýznamnější vazokonstrikční pak endotelin 1 a angiotenzin 2. Cílem léčebného ovlivnění sekreční funkce endotelu by měla být maximalizace produkce vazodilatancií a minimalizace produkce vazokonstrikčních látek. Zlepšení endotelové funkce lze nejúčinněji dosáhnout dodržováním zdravého životního stylu (změna diety na středomořský typ, dostatečná fyzická aktivita, redukce hmotnosti a zanechání kouření) a v indikovaných případech zahájením léčby ACE inhibitory a statiny. Řada studií prokázala, že všechna tato opatření zlepšila prognózu nemocných a velký díl tohoto efektu má na svědomí právě ovlivnění endotelové dysfunkce.
Klíčová slova:
endotel – endoteliální dysfunkce – hypertenze
Úvod
Jako arteriální hypertenze (AH) je označována situace, při které dochází k chronickému zvýšení krevního arteriálního tlaku. Je tradičně považována za významný rizikový faktor kardiovaskulárních chorob, jehož význam je velikosti krevního tlaku (TK) přímo úměrný. Prevalence AH je tak vysoká, že se řadí mezi civilizační nemoci. Dle registru Světové zdravotnické organizace (World Health Organisation – WHO) trpěla v roce 2014 vysokým TK celosvětově více než jedna miliarda obyvatel (asi 22 % světové populace) a alarmující je, že vzhledem k nezdravému životnímu stylu se přítomnost AH stále častěji přesouvá do mladších věkových skupin.
Úloha endotelu v patogenezi hypertenze
Vzhledem k nejasné etiologii esenciální arteriální hypertenze (EAH) a výraznému pokroku na poli genetiky a molekulární biologie jsme svědky exponenciálního nárůstu počtu identifikovaných rizikových faktorů vzniku EAH. Již nyní je jasné, že etiologie EAH je multifaktoriální a je konstantně spojena s endoteliální dysfunkcí (ED), kterou lze definovat jako generalizovaný defekt všech mechanizmů homeostázy (vazodilatační, antikoagulační, protizánětlivý) zajišťované endotelem. Endotel je vnitřní vrstva cévní stěny, která má celkovou plochu až 700 m2, celkovou hmotnost 1,5 kg a velmi složitou ultrastrukturu i funkci. Slouží jako vysoce selektivní bariéra mezi cévním lumen a okolním prostředím, má zásadní funkci v krevní srážlivosti, v mediaci zánětu (vyvolávající faktor vzniku aterosklerózy), angiogenezi, reparaci poškozených tkání a orgánů a v neposlední řadě i kontrole TK (schéma).
Schéma. Základní principy vazomotorické funkce endotelu 
A2R – adenozinový receptor 2 AMP – adenozin monofosfát ATIIR – receptor pro angiotenzin II B2R – bradykininový receptor 2 CSE – cystation-γ-lyáza ECE – endotelin konvertující enzym EDHF – endoteliální hyperpolarizující faktor EGF – epidermální růstový faktor/epidermal growth factor eNOS – endoteliální NO syntáza ETA – endotelin A NO – oxid dusnatý PDGF – destičkový růstový faktor/platelet derived growth factor Pg – prostaglandin PVTT – perivaskulární tuková tkáň TGFβ – transformující růstový faktor β/transforming growth factor β TNFα – faktor nádorové nekrózy α/tumor necrosis factor α Endotel secernuje celou řadu substancí, které modulují cévní tonus, periferní vaskulární rezistenci, a jsou tak jednou z determinant určujících TK. Některé z těchto látek navozují vazodilataci, jiné naopak vazokonstrikci. U zdravého jedince se koncentrace těchto substancí nachází v rovnováze, naopak u jedinců s EAH dochází k relativnímu nebo absolutnímu nadbytku vazokonstrikčně působících látek. ED je ovlivněna celou řadou faktorů, může ji navodit popřípadě zhoršit např. kouření, hypoxie, oxidační stres, obezita, hyperglykemie, systémový zánět, AH (vlastní AH se tak dále zhoršuje mechanizmem „circulus vitiosus“) a lokálně též turbulentní proudění. Významným rizikovým faktorem vzniku ED je též stárnutí. Jasparse a Laughlin prokázali, že již po 3–4 týdnech pravidelné fyzické aktivity dochází u mladých krys k významné, endotelem navozené vazodilataci. U starších jedinců byla tato vazodilatace méně vyjádřena a klesala s rostoucím věkem [1]. Endotel produkuje celou řadu vazoaktivních substancí, jejichž vztah je značně komplexní a záleží na úhlu, z jakého se na problematiku podíváme.
Vazodilatační substance
Asi za třetinu endoteliální vazodilatační regulační kapacity je zodpovědný kalikrein-kininový systém. Prekalikrein je štěpen pomocí faktoru XII na kalikrein, který vede ke konverzi α-globulinu kininogen na bradykinin, jehož cílovou strukturou jsou bradykininové receptory (B1–3), z nichž zejména B2 ovlivňuje cévní tonus zvýšením syntézy oxidu dusnatého (NO) a prostacyklinu. Degradace bradykininu je zprostředkována angiotenzin konvertujícím enzymem (ACE), aminopeptidázou P a karboxypeptidázou N (právě kumulací bradykininu je vysvětlován známý nežádoucí účinek ACEI – suchý kašel).
Nejdůležitější vazodilatační látkou produkovanou endotelem je bezpochyby oxid dusnatý (NO, identický s EDRF – endoteliálním relaxačním faktorem). Jeho role je tak důležitá, že snížení jeho aktivity (farmakologicky nebo mutací) vede k vzestupu středního arteriálního tlaku (Mean Arterial Pressure – MAP) o 30–50 mm Hg [2]. Biologickým účinkem NO je stimulace cGMP-dependentní proteinkinázy, která vede k výrazné relaxaci hladkého svalstva cév a v konečném důsledku k jejich mohutné vazodilataci. NO vzniká z aminokyseliny L-argininu, který vstupuje do endotelových buněk pomocí kationického aminokyselinového transportéru CAT 1 a 2 (hypoxie snižuje expresi CAT 2 a tvorbu NO v plicní cirkulaci s následnou hypoxickou plicní vazokonstrikcí). V endotelu dochází k syntéze oxidu dusnatého pomocí enzymu NO syntázy (NOS). NO syntáza se vyskytuje ve 3 izoformách: NOS I (neuronální), NOS II (inducibilní, iNOS) a NOS III (endoteliální, eNOS), přičemž zásadní roli v regulaci vaskulárního tonu hraje eNOS, která se v endoteliální membráně nachází uvnitř dutinek ve vazbě na kaveolin 1. Hlavním spouštěčem tvorby NO je zvýšený tzv. shear stress cévní stěny, který přímo stimuluje aktivitu eNOS i její uvolnění z vazby na kaveolin 1. Při chronickém shear stressu dochází k up-regulaci a zvýšení počtu dutinek s komplexem eNOS-kaveolin 1. Zásadní význam NO tkví ve faktu, že mimo shear stressu je NOS aktivována i různými dalšími substancemi, např. acetylcholinem, histaminem, trombinem, serotoninem, ADP, bradykininem, vaskulárním endoteliálním růstovým faktorem (VEGF), substancí P, ATP nebo izoproterenolem. Nejlépe prozkoumaní agonisté NO (acetylcholin, bradykinin, ATP) takto činí pomocí zvýšení cytozolové koncentrace Ca2+. Ve svalové tkáni může být produkce NO stimulována inzulinem, jehož mediátor účinku je receptor APPL1 (Adaptor Protein, Phosphotyrosine interacting with PH domain and Leucine zipper 1). Tato stimulace vede ke zvýšení produkce NO. Propojení v regulaci vazokonstrikční a vazodilatační aktivity endotelu pomocí inzulinu prokázal Wang et al u myší s inhibiční mutací APPL1, které vykazovaly nejen zmíněné snížení vazodilatační aktivity NOS, ale i výrazné zvýšení syntézy vazokonstrikčního ET1 [3]. Tato dysegulace se může podílet na patogenezi vzniku AH u metabolického syndromu, nicméně definitivní význam tohoto paradoxu zatím zůstává neznámý. Zcela určitě ale podtrhuje důležitost rovnováhy koncentrací vazokonstrikčních a vazodilatačních substancí. Dalším důkazem propojení ED a metabolického syndromu je důkaz, že vysoké hladiny LDL-cholesterolu vedou k přímému útlumu syntézy eNOS. Ke zhoršení ED přispívá i další složka metabolického syndromu – hyperglykemie, která nejen tlumí koncentraci eNOS, ale neenzymová glykace eNOS navíc snižuje její efektivitu. A aktivitu NOS dále tlumí i stárnutí jako hlavní neovlivnitelný rizikový faktor vzniku ED. NO se díky přímé inhibici agregace trombocytů a down-regulaci adhezivních molekul u zdravých jedinců podílí i na fyziologickém „antiagregačním“ povrchu cévního endotelu. Při ED tak vzniká lokální prokoagulační stav, který je přímým rizikem vzniku akutní intravaskulární trombózy se všemi závažnými ischemickými důsledky (akutní infarkt myokardu, iktus a další). Na základě celé řady publikovaných poznatků je nutné konstatovat, že NO je nejen zásadní vazodilatační substancí endotelu, ale je i velmi fragilní a může být inhibován množstvím uvedených patologických stavů.
Dalšími vazodilatačními látkami, které produkuje endotel, jsou metabolity arachidonové kyseliny, zejména prostacykliny PGH2 (prostaglandin H2) a PGI2 (prostaglandin I2 neboli prostacyklin). Prokázány byly poprvé v roce 1976 v bovinním koronárním řečišti [4]. Vazba PGI2 na PG receptor vede k rychlému zvýšení syntézy cAMP (cyklický adenozinmonofosfát), aktivaci K+ kanálů hladkého svalstva cév a v důsledku k vazodilataci a antiagregačnímu účinku, dále zvýšení aktivity NOS a inhibici uvolnění vazokonstrikčních endoteliálních substancí (zejména endotelinu 1) [5]. Další zásadní funkcí PGI2 je přímá stimulace eNOS s potenciací vazodilatačního účinku. Při ED dochází k útlumu prostacyklinsyntázy a zvýšené expresi prostanoidů (reakce katalyzována zánětem indukovanou izoformou cyklooxygenázy – COX2), které mají vazokonstrikční efekt a tlumí aktivitu NOS s dalším zvýrazněním vazokonstrikce. Na základě tohoto patofyziologického řetězce vznikla snaha o farmakologické ovlivnění AH COX inhibitory, která ovšem nebyla úspěšná, a další výzkum prokázal, že klidový TK je z vazodilatačních látek téměř výhradně ovlivněn aktivitou NO a PGI2 zde nehraje téměř žádnou roli [6].
Nomenklatura další skupiny vazodilatačních látek, které se souhrnně označují jako EDHF (Endotel-Deriving Hyperpolarising Factor) je poměrně složitá. Z principu definice se jako EDHF označují všechny látky produkované endotelem, jejichž účinkem je elektrická hyperpolarizace a následné snížení tonu hladké svaloviny cévní stěny. Obecně lze říci, že efekt těchto substancí na bazální cévní tonus roste s klesajícím diametrem tepny. I přestože NO a PGI2 mají podobný mechanizmus účinku, do rodiny EDHF se nepočítají. Počet látek splňujících kritéria EDHF se s rostoucími znalostmi fyziologie endotelu také zvyšuje, patří k nim kyselina epoxyeikosatrienová, draslíkový iont, cAMP a natriuretický faktor typu C (CNP). Shimokawa et al v roce 2005 publikovali, že je, podobně jako NO, i syntéza EDHF inhibována vyšším věkem a přítomností složek metabolického syndromu (AH, hyperglykemie, dyslipidemie, kouření), a naopak, stimulována rybím olejem a preparáty obsahujícími kyselinu eikosapentaenovou v dietě, fyzickou aktivitou a substitucí estrogeny [7]. Další podrobnosti o funkci jednotlivých EDHF přesahují již rámec tohoto sdělení.
V roce 1991 se výzkum fyziologie endotelu začal stále více zaměřovat na perivaskulární tukovou tkáň (PVTT). Toho roku publikovali Soltis a Cassis práci, ve které na myším modelu prokázali, že čím větší množství PVTT se v okolí cév nachází, k tím mohutnější vazokonstrikci dochází v přítomnosti noradrenalinu [8]. Pozdější výzkum však naznačil, že přiměřené množství PVTT u zdravého jedince působí jak vazodilatačně, tak antiproliferativně [5]. Tento protektivní účinek se vysvětluje antagonizací účinku vazokonstrikčních substancí pomocí látek, které jsou PVTT syntetizovány. První z nich je perivaskulární relaxační faktor, který stimulací sekrece NO a aktivací napěťově řízených draslíkových kanálů s následnou hyperpolarizací zesiluje vazodilataci. Další látkou produkovanou PVTT je adiponektin, který sice působí humorální vazodilataci, ale na regulaci TK se přímo nepodílí. Jeho zásadním účinkem je zlepšení inzulinové rezistence, snížení endoteliální exprese adhezinů a ochrana endotelu před aterogenezí, a má proto významnou roli v ochraně organizmu proti kardiovaskulárním chorobám. Není proto překvapením, že většina jedinců starších 95 let bez ohledu na pohlaví nebo BMI má hladinu adiponektinu vyšší, než je průměrná hodnota v populaci [9]. Další aktivní substancí původem z PVTT je omentin, cytokin produkovaný zejména viscerální tukovou tkání, jehož účinkem je stimulace eNOS s následnou vazodilatací [5]. Jeho koncentrace klesá u obézních jedinců. „Kontroverzní“ substancí produkovanou tukovou tkání je leptin, který je stimulátorem eNOS a navíc i výrazným antagonistou angiotenzinu II. V tomto okamžiku by se mohlo zdát, že jde o ideální vazodilatační látku. Další výzkum ovšem prokázal, že leptin velmi výrazně zvyšuje oxidační stres endotelu [10], podílí se na rozvoji hypertenze u obézních jedinců [11] a snižuje intracelulární koncentraci prekurzoru NO L-argininu, čímž interferuje s funkcí jím stimulované eNOS [12]. I přes své protichůdné patofyziologické funkce se jeví, že leptin je spíše škodlivá substance a zvířecí modely i studie na lidech prokázaly, že jeho zvýšená koncentrace je přímo spojena s rozvojem AH [12,13].
Relativně nedávno objevenými EDRF jsou oxid siřičitý (SO2) a sulfan. První zprávy o vazodilatačním účinku H2S publikoval v roce 1997 Hosoki [14], nicméně v roce 2011 prokázal Skovgaard, že H2S eNOS inhibuje, snižuje dostupnost NO, a snižuje tak relaxaci hladké svaloviny cév [15]. Klíčovým faktorem funkce H2S je parciální tlak kyslíku ve tkáni. Při ischemizaci tkáně s hypoxií a následné reperfuzi vzniká tzv. reperfuzní poškození spojené se zvýšenou tvorbou reaktivních forem kyslíku a indukcí apoptózy. Zásadním zjištěním je, že H2S působí na tkáně protektivně právě inhibicí zmíněných negativních pochodů provázejících ischemii a následnou reperfuzi. Naopak, při experimentálně navozené hyperoxii (pO2 ve tkáni > 20 kPa) H2S indukuje vazokonstrikci. Produkce SO2 endotelem byla poprvé prokázána v porcinním koronárním řečišti v roce 2003 [16]. Inhalace SO2 na myším modelu vede ne zcela jasným mechanizmem k mohutné arteriální vazodilataci a poklesu TK.
V roce 2000 publikoval Otterbein velmi překvapivé zjištění. Smrtelně jedovatý plyn oxid uhelnatý (CO) je v malém množství produkován také endotelem (vzniká jako meziprodukt při katabolizmu hemu v reakci katalyzované enzymem hemoxygenázou). CO má v nízké koncentraci prokazatelně protektivní účinek na tkáně. Komplexním mechanizmem chrání zejména srdce, játra a plíce před ischemickým poškozením. Působí protizánětlivě antagonizací řady cytokinů (TNFα, IL6) i prozánětlivých molekul (ICAM1, VCAM1) [17] a indukuje vazodilataci hyperpolarizací hladké svaloviny cév a přímou stimulací eNOS se zvýšením koncentrace NO. Tyto příznivé účinky platí pouze pro nízké koncentrace CO ve tkáni (100 nM), naopak vyšší hladiny CO (≥ 100 μM) působí vazokonstrikci přímou inhibicí eNOS.
Silný stresový stimul (např. hypoxie nebo ischemie) velmi silně stimuluje 5´-nukleotidázu, enzym defosforylující AMP za vzniku adenozinu, jehož extracelulární koncentrace vzrůstá až 200krát [18]. Zatím byly popsány 4 druhy receptorů (A1, A2A, A2B, A3), na povrchu endoteliálních buněk se predominantně nacházejí typy A2A a A2B. Stimulace A1 vede k vazokonstrikci aferentní arterioly ledvin, aktivace A2A má za následek mohutnou vazodilataci, u A2B není situace jasná, předpokládá se, že zlepšuje bariérovou funkci endotelu v ischemizované tkáni.
Table 1. Přehled základních endoteliálních substancí 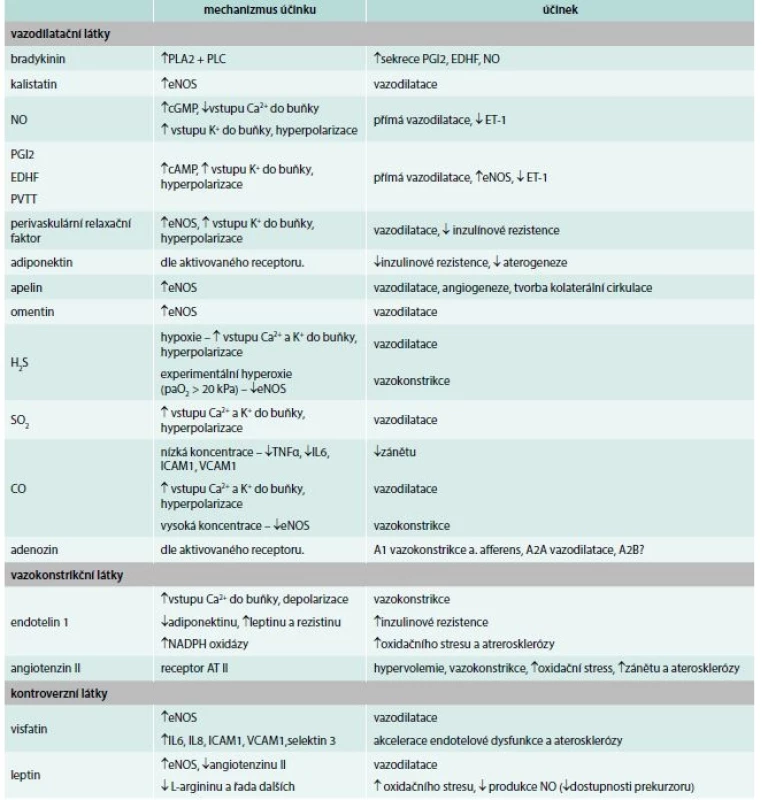
ACE – angiotenzinkonvertující enzym cAMP – cyklický adenozinmonofosfát cGMP – cyklický guanosinmonofosfát EDHF – endoteliální hyperpolarizující faktor eNOS – endoteliální NO syntéza ET1 – endotelin 1 H2S – sulfan ICAM 1 – intercellular adhesion molecule 1 IL – interleukin paO2 – parciální arteriální tlak kyslíku PLA2 – fosfolipáza A2 PLC – fosfolipáza C TNFα – tumor necrosis factor α VCAM 1 – vascular cell adhesion protein 1 Vazokonstrikční substance
V zájmu zachování rovnováhy musí být uvedené vazodilatační látky antagonizovány endoteliálními substancemi se silným vazokonstrikčním účinkem. V roce 1987 byl publikován objev látky secernované endotelem, která měla mohutný vazokonstrikční účinek [19]. Tato látka byla identifikována Tomohem Masakim až v roce 1998 a poprvé pojmenována endotelin (ET) [20]. V roce 2011 prokázal Kawanabe, že se ET v organizmu nachází ve 3 různých izoformách (ET1, ET2, ET3) [21]. Predominantní izoformou secernovanou endotelem je ET1, zatímco ET3 pravděpodobně zajišťuje interakci této majoritní vazokonstrikční substance s vazodilatačním systémem endotelu (zvýšení sekrece NO a PGI2). S jistotou lze říct, že ET1 se spolupodílí na patofyziologii řady chorob, jeho zvýšenou koncentraci lze prokázat u pacientů s chronickým srdečním selháním, hypertenzí, závažnou aterosklerózou, end-stage nefropatií, plicní hypertenzí a podílí se i na vazospazmu po subarachnoidálním krvácení. Syntéza ET1 je stimulována přítomností substancí a cytokinů, které jsou charakteristické pro systémový zánět, stres a další pro organizmus nepříznivé stavy, např. adrenalinem, angiotenzinem II, vazopresinem, trombinem, inzulinem, TGFβ, IL1, PDGF, oxidovaným LDL, TNFα a epidermálním růstovým faktorem [5]. Dále je více než jasná participace ET1 na vzniku metabolického syndromu a zejména na jedné z jeho složek – hypertenzi. Nejvyšší hladinu lze prokázat u obézních hypertenzních diabetiků, zatímco u normotenzních diabetiků a nediabetické populace jsou hladiny ET1 nižší [22]. Vysoké hladiny ET1 zhoršují inzulinovou rezistenci a následná hyperglykemie vede k up-regulaci mRNA ET1 v endotelu a k jeho syntéze [23]. Tímto se uzavírá bludný kruh nepříznivých endokrinních poměrů typických pro metabolický syndrom. Dochází k výrazné vazokonstrikci, stimulaci NADPH oxidázy s nárůstem oxidačního stresu endotelu, oxidaci LDL lipoproteinu a akceleraci aterosklerózy.
Další látkou s výrazným vazokonstrikčním účinkem je angiotenzin II (ATII). Je stimulátorem syntézy aldosteronu, a tak se spolupodílí na regulaci elektrolytové a vodní rovnováhy a pocitu žízně. Syntéza ATII a mechanizmus jeho účinku jsou obecně známé a nebudou zde rozebírány. Zvýšení hladiny ATII vede nejen k aldosteronem zprostředkované hypervolemii, ale má i vazokonstrikční účinek a zhoršuje ED, protože navozuje rezistenci cévní stěny k účinkům NO, zvyšuje oxidační stres stimulací syntézy reaktivních forem kyslíku, upreguluje expresi adhezivních molekul a zánětlivých cytozinů a indukuje proliferaci a apoptózu hladké svaloviny cév. Další nepříjemnou vlastností ATII je zhoršení inzulinové rezistence komplexním mechanizmem, který zahrnuje přímou inhibici vazby inzulinu na jeho receptor a internalizaci inzulinového receptoru do nitra buňky, kde je již pro inzulin nedostupný. Mimo jiné tak přispívá k vazokonstrikci, protože interferuje s inzulinem indukovanou aktivací eNOS [24].
Možnosti ovlivnění endotelové dysfunkce
Z uvedeného vyplývá, že cílem léčby z hlediska AH by měla být maximalizace vazodilatační, resp. minimalizace vazokonstrikční funkce endotelu. Opomínat samozřejmě nelze ani ostatní složky ED (proinflamační stav, nadměrná produkce reaktivních forem kyslíku apod), které participují zejména na akceleraci aterosklerotického postižení cévní stěny. Zásadním krokem v pozitivním ovlivnění funkce endotelu by měla být snaha o eliminaci faktorů, které se podílejí na vzniku jeho dysfunkce. Významným, ale bohužel neovlivnitelným rizikovým faktorem vzniku endoteliální dysfunkce je vyšší věk, díky zvýšení oxidačního stresu, poklesu aktivity NO syntézy a vzniku prozánětlivého stavu [25]. Velmi zjednodušeně lze říct, že nejúčinnějším (ale ne vždy nejjednodušším) krokem je dodržování obecných zásad zdravého životního stylu. Drtivá většina dosud publikovaných intervenčních studií je zaměřena na klinickou kvantifikaci celkové funkce endotelu (nejčastěji pomocí Flow Mediated Dilatation – FMD, při níž se ultrazvukově stanovují změny průměru a. brachialis při reaktivní hyperemii následkem její krátkodobé okluze oproti klidovému stavu) [26] a naopak, jen málo studií je laboratorních se stanovením kinetiky změn koncentrací jednotlivých endoteliálních substancí jako následek modulace jednotlivých vyvolávajících faktorů ED.
Prvním nefarmakologickým opatřením je snaha o výrazné omezení nebo nejlépe zanechání kouření. Cigaretový kouř (mimo svůj obecně známý karcinogenní efekt) významně ovlivňuje endoteliální rovnováhu ve výrazný prospěch vazokonstrikčních substancí. Vliv kouření na endotel lze jak simulovat, tak kvantifikovat vystavením analyzovaných buněk extraktu cigaretového kouře, který lze syntetizovat působením určitého množství kouře na fosfátovou sůl a následně ředit diluentem k získání extraktu požadované koncentrace. Takto bylo zjištěno, že po inhalaci cigaretového kouře se významně snižuje aktivita eNOS, a toto snížení je závislé jak na dávce, tak na délce expozice. Su et al prokázali, že pokud jsou endotelové buňky plicnice exponovány extraktu o koncentraci simulující silně zakouřenou místnost po dobu 24 hod, dochází ke snížení aktivity eNOS až o 57 % ve srovnání s kontrolami [27]. Dalším významným efektem kouření je i signifikantní snížení produkce vazodilatačního PGI2 buňkami endotelu. Nadler et al publikoval již v roce 1983 v Lancetu zjištění, že cigaretový kouř výrazně snižuje jak aktivitu prostacyklinsyntázy, tak její reaktivitu na své přirozené stimulátory (noradrenalin) [28]. Jelikož je PGI2 přirozeným a silným stimulátorem eNOS, je jeho inhibice kouřením spojena s dalším snížením aktivity eNOS. Situaci dále zhoršuje, výrazná akcelerace syntézy endoteliálních vazokonstrikčních látek. Již po 10 min kouření se signifikantně zvyšuje hladina endotelinu 1, po 20 min roste hladina ACTH a po 30 min i koncentrace kortizolu v cirkulaci [29]. Bez nadsázky lze tedy říct, že organizmus reaguje na kouření stresovou reakcí. Zajímavým zjištěním je, že po expozici endoteliálních buněk čistému nikotinu nedochází k žádné změně v aktivitě jak eNOS, tak prostacyklinsyntázy [27–29]. Nejpravděpodobnějším vysvětlením proto je, že za zhoršení endotelové funkce u kuřáků může jiná látka nebo látky z mnoha škodlivin obsažených v cigaretovém kouři.
Vzhledem k totožnosti rizikových faktorů ED i různých izolovaných složek metabolického syndromu je nasnadě předpokládat, že eliminace hlavního vyvolávajícího faktoru metabolického syndromu – obezity povede k výraznému zlepšení endotelové funkce. Proto byla velkým překvapením nekonzistentnost dosud publikovaných intervenčních studií v účinnosti redukce hmotnosti na funkci endotelu. Dle některých závěrů vede pokles BMI z 30 kg/m2 na 25 kg/m2 ke zlepšení endotelové funkce o více než 300 % (měřeno reaktivitou vaskulárního tonu na infuzi acetylcholinu), a to u obézních dětí i dospělých [30,31], na druhou stranu byly publikovány studie, při kterých ani signifikantní redukce tělesné hmotnosti nevede ke zlepšení již existující poruchy endotelu (analyzováno pomocí FMD) [32]. Určitým vysvětlením těchto kontroverzních výsledků může být poměrně malý soubor pacientů analyzovaný u všech těchto studií i různorodost použitých laboratorních metod. K vyřešení této otázky bude potřeba provedení dalších studií s větším souborem pacientů. Naopak, poměrně jasná shoda panuje v příznivém efektu tělesného tréninku na endoteliální funkci. Cvičení výrazně zlepšuje bioavailabilitu NO [33], acetylcholinem indukovanou vazodilataci koronárních tepen [34] i celkový výsledek testu FMD [35].
Ruku v ruce s redukcí tělesné hmotnosti jde i úprava stravovacích návyků. Opakovaně je prokazováno, že dietní intervence směrem k tzv. středomořskému typu diety (nejméně 200 g zeleniny a 200 g ovoce denně, 2krát týdně ryba, olivový olej). Zásadním parametrem se zdá být poměr kyseliny linolové a α-linolenové. „Klasický“ západní typ diety má tento poměr 95 : 5 %, zatímco středomořský typ diety 75 : 25 %. Bezpochyby nejvýznamnější studií provedenou na tomto poli je Lyon Diet Heart Study, která prokázala, že změna diety ze západní na středomořskou vede ke snížení nefatálních akutních infarktů myokardu o 72 %, srdečního selhání a plicních embolií o 62 % a nutnost revaskularizací po již provedených PCI o 47 % [36]. Je pravděpodobné, že se na tomto výsledku z velké části podílí zlepšení ED. Transmastné kyseliny (ve velkém množství obsažené v živočišných tucích a margarínech) tlumí desaturázu uplatňující se v syntéze kyseliny arachidonové s následným poklesem aktivity prostaglandinsyntázy, snížením koncentrace PGI2 a sekundárně i NO. Bylo prokázáno, že jedno vysoce tučné jídlo může krátkodobě snížit FMD až o 11 % [37]. Ke zlepšení funkce endotelu naopak přispívají flavonoidy obsažené v černém čaji (zlepšení FMD o 11,2 %) [38], grepovém džusu (zlepšení FMD o 4,2 %) [39] a červeném víně (zlepšení FMD o 5,6 % u nealkoholického vína, zatímco u alkoholického vína došlo paradoxně k poklesu FMD o 0,3 % oproti stavu před analýzou) [40].
Vzhledem k provázanosti ED a oxidačního stresu se logicky nabízí otázka, zda podání antioxidantů zlepší endotelovou funkci a sekundárně i kardiovaskulární prognózu. Výsledky studií zkoumajících vliv substituce vitaminu C a E na ED byly spíše zklamáním [41,42], z klinického hlediska nebyl prokázán žádný dopad této substituce na kardiovaskulární mortalitu ani rozsáhlými studiemi HOPE [43] a GISSI Prevenzione [44]. Z farmakologických opatření existuje nejvíce důkazů o prospěchu ACE inhibitorů a statinů. Statiny (inhibitory 3-HMG-CoA reduktázy) jsou základním lékem ke snížení hladiny LDL-cholesterolu a právě hladina LDL-cholesterolu přímo koreluje s mírou ED. Podávání základní dávky (10 mg) atorvastatinu po dobu 4 týdnů vedlo u pacientů s dyslipidemií a vysokou hladinou LDL-cholesterolu ke zlepšení vazoreaktivity ze 42,5 % na 55,2 % hodnoty zjištěné u zdravých kontrol [45]. Hlavní příčinou je pravděpodobně mohutná stimulace exprese i aktivity eNOS (3,6krát u lovastatinu a 3,8krát u simvastatinu oproti výchozímu stavu). Poměrně rozsáhlá, dvojitě slepá studie TREND prokázala, že léčba 40 mg quinaprilu denně u pacientů s ischemickou chorobou srdeční zlepší vazomotoriku koronárních tepen o 12,1 % ve srovnání s placebem [46]. Zdá se, že hlavní příčinou tohoto příznivého efektu je inhibice angiotenzinu II, který je sám mohutným inhibitorem exprese eNOS, a to jak přímo, tak nepřímo stimulací NADPH (nárůst tvorby reaktivních forem kyslíku má za následek další inhibici eNOS).
V srpnu roku 2017 byl v New England Journal of Medicine publikován výsledek velmi rozsáhlé prospektivní studie CANTOS: soubor 10 061 pacientů po prodělaném infarktu myokardu s počáteční hodnotou high sensitivity CRP (hs-CRP) > 2,0. Hlavním cílem studie bylo hodnocení vlivu monoklonální protilátky proti IL1β kanakimumabu na zánětlivou složku endoteliální dysfunkce (vedoucí k tvorbě a destabilizaci aterosklerotického plátu) v kontextu s incidencí hlavních nežádoucích kardiovaskulárních příhod. Studie prokázala, že terapie kanakimumabem v dávce 50 mg, 150 mg nebo 300 mg podaných každé 3 měsíce subkutánně vede ke snížení hladiny hs-CRP o 26 %, 37 %, resp. 41 %. Při celkovém follow-up 3,7 roku vedla dávka 150 mg ke snížení rizika kompozitního end-pointu (nefatální infarkt myokardu, nefatální cévní mozková příhoda, kardiovaskulární smrt a hospitalizace pro destabilizaci anginy pectoris) o 17 % (p < 0,005), snížení relativního rizika neplánované revaskularizace pro nestabilní anginu pectoris o 36 % (p < 0,021) a snížení relativního rizika jakékoliv koronární revaskularizace o 32 % (p < 0,001) ve srovnání s placebem, a to vše bez jakéhokoliv vlivu na hladinu krevních lipidů. Hlavním vysvětlením jeho příznivého efektu na kardiovaskulární příhody je tak pravděpodobně snížení endoteliálního zánětu. Na druhou stranu, po aplikaci kanakimumabu došlo ke zvýšení počtu fatálních infekcí a celková mortalita ve srovnání s placebovou větví tak zůstala stejná. Výsledek studie CANTOS prokázal, jak moc se zánět endotelu podílí na zvýšení kardiovaskulární morbidity [47].
Kontroverzním tématem je vliv HRT (hormon replacing therapy) na endotel. Opakovaně bylo prokázáno, že substituce estrogeny u postmenopauzálních žen vedla ke snížení plazmatické koncentrace PAI-1 o 48 %, což by naznačovalo příznivý vliv HRT na aterosklerózu [48]. Přesto prospektivní studie příznivý efekt HRT jak v primární [49], tak sekundární [50] prevenci kardiovaskulárních onemocnění u postmenopauzálních žen neprokázaly. Poměrně malá studie provedená v roce 2012 naznačuje, že substituce tetrahydrobiopterinem snižuje tuhost stěny a. carotis interna a zlepšuje výsledek FMD [51]. Některé malé studie identifikovaly ještě další faktory, které zlepšují ED, např. substituce L-argininu, experimentální inhibice proteinkinázy C, COX-2, tromboxanu A2, xantinoxidázy a TNFα a dále léčba troglitazonem [52]. Význam těchto zjištění zůstává zatím pouze na experimentální úrovni a jejich skutečný přínos bude muset být ověřen dalšími klinickými studiemi.
Table 2. Možnosti ovlivnění endotelové dysfunkce 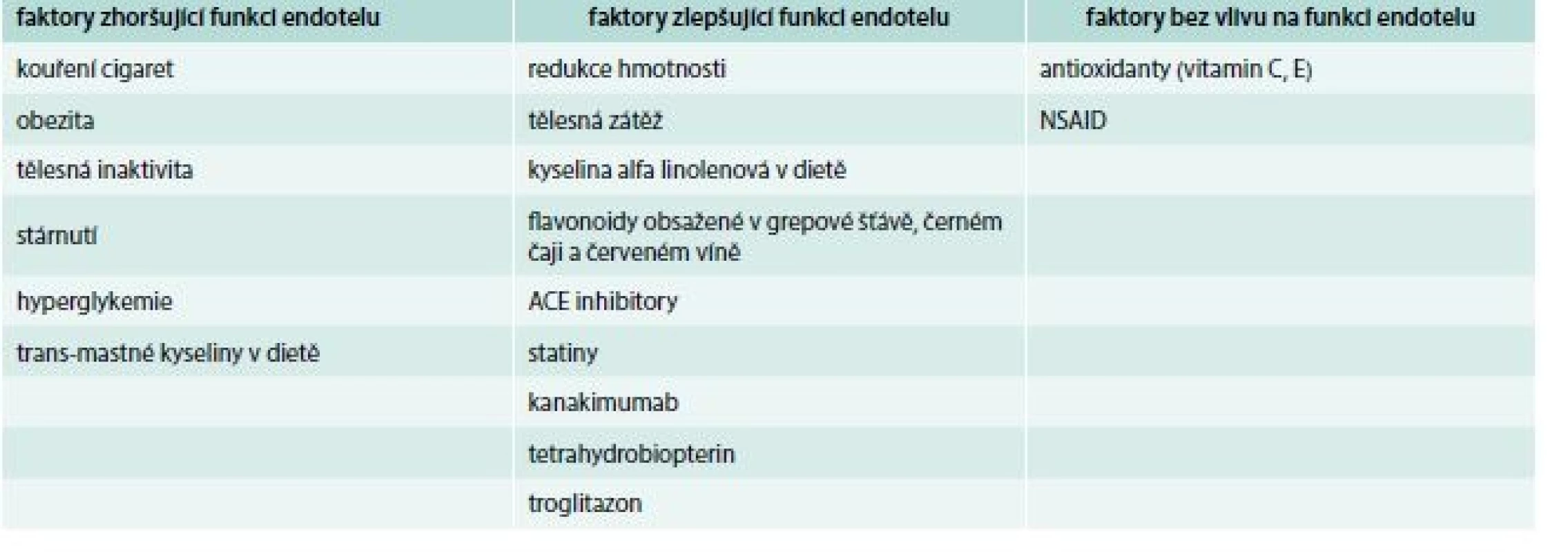
Možnosti stanovení funkce endotelu
Ke stanovení endoteliální funkce lze použít řadu metod invazivních, neinvazivních i biochemických [53]. Podstatou těch invazivních je intraarteriální podání vazoaktivní látky (acetylcholin, endotelin) a stanovení změn v krevním průtoku pomoci high resolution ultrasonografie nebo pletyzmografie. Nejvýznamnějšími neinvazivními metodami jsou flow mediated vasodilatation (FMD), která je založena na změně průměru brachiální arterie následkem krátkodobé ischemie předloktí a dále analýza pulzní vlny brachiální vlny po inhalaci salbutamolu a analýza tvaru pulzní křivky. Laboratorně lze funkci endotelu posuzovat koncentrací jednotlivých endoteliálních substancí, a tak stanovit poměr vazodilatačních a vazokonstrikčních působků. Nejčastější metodou stanovující endoteliální funkci v klinické i vědecké praxi je FMD, která má ale bezesporu určité limitace. Peaková změna průměru posuzované a. brachialis je asi 4 mm. Nejčastěji používané ultrasonografické sondy v publikovaných studiích měly kmitočet krystalů 7,5 MHz, který umožňuje teoretickou rozlišovací schopnost za ideálních podmínek asi 400 μm. Zdá se tak obtížné stanovit jemné rozdíly ve vazomotorice za konkrétních situací.
Table 3. Metody používané k hodnocení endoteliální funkce 
FMD – flow mediated dilatation NO – oxid dusnatý PCA – pulse contour analysis Pg – prostaglandin PWA – analýza pulzové vlny USG – ultrasonografie Závěr
Dosud publikované poznatky prokazují, že zařazení zásad zdravého životního stylu (redukce tělesné hmotnosti, dostatek pohybu, úprava stravy apod), které jsou v souladu s aktuálními doporučeními České kardiologické společnosti [54], významným způsobem zlepšují nejen funkci i stabilitu endotelu, ale i krevní tlak a celkově kardiovaskulární mortalitu. Jako dalším benefit se ukazuje indikovaná medikace některými léky (ACE inhibitory, statiny). Již William Osler, americký internista, vyslovil v roce 1898 ve své knize „Principy a praxe medicíny“ slavnou myšlenku: „Dlouhověkost je především otázka cévní“, což ukazuje, že i staří internisté si uvědomovali, že nejzásadnějším projevem stárnutí je degenerace cévního řečiště. Tato slova neztrácejí na svém významu ani v dnešní době a moderní výzkum jen potvrzuje jejich pravdivost. Endotel nelze chápat jako vrstvu buněk mechanicky chránící vnitřní strukturu cév, ale spíše jako samostatný endokrinní orgán, jehož funkce zásadním způsobem ovlivňuje další osud jedince. K přesnému stanovení možností ovlivnění ED bude potřeba dalších studií s větším počtem probandů a analýzou stavu endotelu kombinací zobrazovacích a laboratorních metod.
Podpořeno Specifickým výzkumem MUNI/A/1221/2017.
MUDr. Vladislav Biel
Interní oddělení Nemocnice Boskovice, a.s.
Doručeno do redakce 25. 12. 2017
Přijato po recenzi 18. 3. 2018
Sources
- Jasparse JL, Laughlin MH. Endothelial Function and Exercise Training: Evidence from Studies Using Animal Models. Med Sci Sports Exerc 2006; 38(3): 445–454. Dostupné z DOI: <http://dx.doi.org/10.1249/01.mss.0000191187.24525.f2>.
- Vallance P, Collier J, Moncada S. Effects of endothelium-derived nitric oxide on peripheral arteriolar tone in man. Lancet 1989; 2(8670): 997–1000.
- Wang Y, Cheng KK, Lam KS et al. APPL1 counteracts obesity-induced vascular insulin resistance and endothelial dysfunction by modulating the endothelial production of nitric oxide and endothelin-1 in mice. Diabetes 2011; 60(11): 3044–3054. Dostupné z DOI: <http://dx.doi.org/10.2337/db11–0666>. Erratum in Erratum. APPL1 Counteracts Obesity-Induced Vascular Insulin Resistance and Endothelial Dysfunction by Modulating the Endothelial Production of Nitric Oxide and Endothelin-1 in Mice. Diabetes 2011; 60 : 3044–3054.
- Moncada S, Gryglewski R, Bunting S et al. An enzyme isolated from arteries transforms prostaglandin endoperoxides to an unstable substance that inhibits platelet aggregation. Nature 1976; 263(5579): 663–665.
- Garczorz W, Francuz T, Gmiński J et al. Influence of elastin-derived peptides, glucose, LDL and oxLDL on nitric oxide synthase expression in human umbilical artery endothelial cells. Acta Biochim Pol 2011; 58(3): 375–379.
- Parkington HC, Coleman HA, Tare M. Prostacyclin and endothelium-dependent hyperpolarization. Pharmacol Res 2004; 49(6): 509–514. Dostupné z DOI: <http://dx.doi.org/10.1016/j.phrs.2003.11.012>.
- Shimokawa H, Morikawa K. Hydrogen peroxide is an endothelium-derived hyperpolarizing factor in animals and humans. J Mol Cell Cardiol 2005; 39(5): 725–732. Dostupné z DOI: <http://dx.doi.org/10.1016/j.yjmcc.2005.07.007>.
- Soltis EE, Cassis LA. Influence of perivascular adipose tissue on rat aortic smooth muscle responsiveness. Clin Exp Hypertens 1991; 275 : 681–692.
- Atzmon G, Pollin TI, Crandall J et al. Adiponectin levels and genotype: a potential regulator of life span in humans. J Gerontol A Biol Sci Med Sci 2008; 63(5): 447–453.
- Yamagishi SI, Edelstein D, Du XL et al. Leptin induces mitochondrial superoxide production and monocyte chemoattractant protein-1 expression in aortic endothelial cells by increasing fatty acid oxidation via protein kinase A. J Biol Chem 2001; 276(27): 25096–25100. Dostupné z DOI: <http://dx.doi.org/10.1074/jbc.M007383200>.
- Shankar A, Xiao J. Positive relationship between plasma leptin level and hypertension. Hypertension 2010; 56(4): 623–628. Dostupné z DOI: <http://dx.doi.org/10.1161/HYPERTENSIONAHA.109.148213>.
- Shek EW, Brands MW, Hall JE. Chronic Leptin Infusion Increases Arterial Pressure. Hypertension 1998; 31(1 Pt 2): 409–414.
- Korda M, Kubant R, Patton S et al. Leptin-induced endothelial dysfunction in obesity. Am J Physiol Heart Circ Physiol 2008; 295(4): H1514-H1521. Dostupné z DOI: <http://dx.doi.org/10.1152/ajpheart.00479.2008>.
- Hosoki R, MatsukiN, Kimura H. The possible role of hydrogen sulfi de as an endogenous smooth muscle relaxant in synergy with nitric oxide. Biochem Biophys Res Commun 1997; 237(3): 527–531. Dostupné z DOI: <http://dx.doi.org/10.1006/bbrc.1997.6878>.
- Skovgaard N, Gouliaev A, Aalling M et al. The role of endogenous H2S in cardiovascular physiology. Curr Pharm Biotechnol 2011; 12(9): 1385–1393.
- Balazy M, Abu-Yousef IA et al. Identification of carbonyl sulfi de and sulfur dioxide in porcine coronary artery by gas chromatography/mass spectrometry, possible relevance to EDHF. Biochem Biophys Res Commun 2003; 311(3): 728–734.
- Otterbein LE, Choi AM. Heme oxygenase: colors of defense against cellular stress. Am J Physiol Lung Cell Mol Physiol 2000; 279(6): L1029-L1037. Dostupné z DOI: <http://dx.doi.org/10.1152/ajplung.2000.279.6.L1029>.
- Milne GR, Palmer MT. Anti-Inflammatory and Immunosuppressive Effects of the A2A Adenosine Receptor. ScientificWorldJournal 2011; 11 : 320–339. Dostupné z DOI: <http://dx.doi.org/10.1100/tsw.2011.22>.
- O’Brien RF, Robbins RJ, McMurtry IF. Endothelial cells in culture produce a vasoconstrictor substance. J Cell Physiol 1987; 132(2): 263–270. Dostupné z DOI: <http://dx.doi.org/10.1002/jcp.1041320210>.
- Masaki T. The discovery of endotelins. Cardiovasc Res 1998; 39(3): 530–533.
- Kawanabe Y, Nauli SM. Endothelin. Cell Mol Life Sci 2011; 68(2): 195–203. Dostupné z DOI: <http://dx.doi.org/10.1007/s00018–010–0518–0>.
- Ak G, Buyukberber S, Sevinc S et al. The relation between plasma endothelin-1 levels and metabolic control, risk factors, treatment modalities, and diabetic microangiopathy in patients with Type 2 diabetes mellitus. J Diabetes Compl 2001; 15(3): 150–157.
- Sen P, Gopalakrishnan R, Kothari H et al. Factor VIIa bound to endothelial cell protein C receptor activates protease activated receptor-1 and mediates cell signaling and barrier protection. Blood 2011; 117(11): 3199–3208. Dostupné z DOI: <http://dx.doi.org/10.1182/blood-2010–09–310706>.
- Oh SJ, Ha WC, Lee JI et al. Angiotensin II Inhibits Insulin Binding to Endothelial Cells. Diabetes Metab J 2011; 35(3): 243–247. Dostupné z DOI: <http://dx.doi.org/10.4093/dmj.2011.35.3.243>.
- Liu H, Yang Y, Huang G et al. Positive association of pro-inflammatory biomarkers and increased oxidative stress in the healthy elderly. Arch Gerontol Geriatr 2012; 54(2): e8-e12. Dostupné z DOI: <http://dx.doi.org/10.1016/j.archger.2011.05.016>.
- Karásek D, Vaverková H, Halenka M. Endoteliální dysfunkce, možnosti její detekce a využití v klinické praxi. Interní Med 2005; 6(9): 450–453.
- Su Y, Han W, Giraldo C et al. Effect of cigarette smoke extract on nitric oxide synthase in pulmonary artery endothelial cells. Am J Respir Cell Mol Biol 1998; 19(5): 819–825. Dostupné z DOI: <http://dx.doi.org/10.1165/ajrcmb.19.5.3091>.
- Nadler JL, Velasco JS, Horton R. Cigarette smoking inhibits prostacyclin formation. Lancet 1983; 1(8336): 1248–1250.
- Haak T, Jungmann E, Raab C et al. Elevated endothelin-1 levels after cigarette smoking. Metab Clin Exp 1994; 43(3): 267–269.
- Perticone F, Ceravolo R, Candigliota M et al. Obesity and Body Fat Distribution Induce Endothelial Dysfunction by Oxidative Stress: Protective Effect of Vitamin C. Diabetes 2001; 50(1): 159–165.
- Woo KS, Chook P, Yu C. et al. Effects of diet and exercise on obesity-related vascular dysfunction in children. Circulation 2004; 109(16): 1981–1986.
- Brook RD, Bard RL, Glazewski L et al. Effect of short-term weight loss on the metabolic syndrome and conduit vascular endothelial function in overweight adults. Am J Cardiol 2004; 93(8): 1012–1016. Dostupné z DOI: <http://dx.doi.org/10.1016/j.amjcard.2004.01.009>.
- Walther C, Gielen S, Hambrecht R. The effect of exercise training on endothelial function in cardiovascular disease in humans. Exerc Sport Sci Rev 2000; 32(4): 129–134.
- Hambrecht R, Wolf A, Gielen S et al. Effect of Exercise on Coronary Endothelial Function in Patients with Coronary Artery Disease. N Engl J Med 2000; 342(7): 454–460.
- Di Francescomarino S, Sciartilli A, Di Valerio P et al. The effect of physical exercise on endothelial function. Sports Med 2009; 39(10): 797–812. Dostupné z DOI: <http://dx.doi.org/10.2165/11317750–000000000–00000>.
- Kris-Etherton P, Eckel RH, Howard BV et al. AHA Science Advisory: Lyon Diet Heart Study. Benefits of a Mediterranean-style, National Cholesterol Education Program/American Heart Association Step I Dietary Pattern on Cardiovascular Disease. Circulation 2001; 103(13): 1823–1825.
- Vogel RA, Corretti MC, Plotnick GD. Effect of a Single High-Fat Meal on Endothelial Function in Healthy Subjects. Am J Cardiol 1997; 79(3): 350–354.
- Duffy SJ, Keaney JF, Holbrook M et al. Short - and long-term black tea consumption reverses endothelial dysfunction in patients with coronary artery disease. Circulation 2001; 104(2): 151–156.
- Stein JH, Keevil JG, Wiebe DA et al. Purple grape juice improves endothelial function and reduces the susceptibility of LDL cholesterol to oxidation in patients with coronary artery disease. Circulation 1999; 100(10): 1050–1055.
- Agewall S, Wright S, Doughty RN et al. Does a glass of red wine improve endothelial function? Eur Heart J 2000; 21(1): 74–78. Dostupné z DOI: <http://dx.doi.org/10.1053/euhj.1999.1759>.
- Gazis A, White DJ, Page SR et al. Effect of oral vitamin E (alpha-tocopherol) supplementation on vascular endothelial function in Type 2 diabetes mellitus. Diabet Med 1999; 16(4): 304–311.
- Title LM, Cummings PM, Giddens K et al. Effect of folic acid and antioxidant vitamins on endothelial dysfunction in patients with coronary artery disease. J Am Coll Cardiol 2000; 36(3): 758–765.
- Effects of ramipril on cardiovascular and microvascular outcomes in people with diabetes mellitus: results of the HOPE study and MICRO-HOPE substudy. Lancet 2000; 355(9200): 253–259. Erratum in Lancet 2000; 356(9232): 860.
- Dietary supplementation with n-3 polyunsaturated fatty acids and vitamin E after myocardial infarction: results of the GISSI-Prevenzione trial. Gruppo Italiano per lo Studio della Sopravivenza nell’Infarto miocardico. Lancet 1999; 354 : 447–455.
- Perticone F, Ceravolo R, Maio R et al. Effects of atorvastatin and vitamin C on endothelial function of hypercholesterolemic patients. Atherosclerosis 2000; 152(2): 511–518.
- Mancini GB, Henry GC, Macaya C et al. Angiotensin-converting enzyme inhibition with quinapril improves endothelial vasomotor dysfunction in patients with coronary artery disease. The TREND (Trial on Reversing ENdothelial Dysfunction) Study. Circulation 1996; 94(3): 258–265. Erratum in Circulation 1996; 94(6): 1490.
- Ridker PM, Everett BM, Thuren T et al. CANTOS Trial Group. Antiinflammatory Therapy with Canakinumab for Atherosclerotic Disease. N Engl J Med 2017; 377(12): 1119–1131. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1707914>.
- Brown NJ, Abbas A, Byrne D et al. Comparative effects of estrogen and angiotensin-converting enzyme inhibition on plasminogen activator inhibitor-1 in healthy postmenopausal women. Circulation 2002; 105(3): 304–309.
- Rossouw JE, Anderson GL, Prentice RL et al. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results From the Women’s Health Initiative randomized controlled trial. JAMA 2002; 288(3): 321–333.
- Hulley S, Grady D, Bush T et al. Randomized trial of estrogen plus progestin for secondary prevention of coronary heart disease in postmenopausal women. Heart and Estrogen/progestin Replacement Study (HERS) Research Group. JAMA 1998; 280(7): 605–613.
- Moreau KL, Meditz A, Deane KD et al. Tetrahydrobiopterin improves endothelial function and decreases arterial stiffness in estrogen-deficient postmenopausal women. Am J Physiol Heart Circ Physiol 2012; 302(5): H1211-H1218. Dostupné z DOI: <http://dx.doi.org/10.1152/ajpheart.01065.2011>.
- Widlansky ME, Gokce N, Keaney JF et al. The clinical implications of endothelial dysfunction. J Am Coll Cardiol 2003; 42(7): 1149–1160.
- Al-Qaisi M, Kharbanda RK, Mittal TK et al. Measurement of endothelial function and its clinical utility for cardiovascular risk. Vasc Health Risk Manag 2008; 4(3): 647–652.
- Souhrn evropských doporučení pro prevenci kardiovaskulárních onemocnění. Dostupné z WWW: <www.kardio-cz.cz/data/upload/Souhrn_Evropskych_doporuceni_pro_prevenci.pdf>.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2018 Issue 7-8-
All articles in this issue
- Skotský model dávkování vankomycinu a monitorování jeho hladin zlepšuje účinnost i bezpečnost léčby vankomycinem
- Mezenchymální kmenové buňky a léčba diabetu 1. typu
- Jak diagnostikovat sarkoidózu srdce?
- Budúcnosť farmakologickej liečby nealkoholovej steatoheptitídy z pohľadu kľúčových patofyziologických mechanizmov
- Nízkosacharidová strava v léčbě diabetes mellitus
- Kontroverze v léčbě dny
- Funkce endotelu, její vztah k arteriální hypertenzi a možnosti její modulace
- Srdeční postižení u suicidální intoxikace oxidem uhelnatým s rysy toxické i stresové kardiomyopatie: kazuistika
- Spironolakton v léčbě hypertenze: opomíjená molekula
- Trimeresurus albolabris (štrkáčovec bieloústy) – hlásenie uhryznutia: kazuistika
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Nízkosacharidová strava v léčbě diabetes mellitus
- Spironolakton v léčbě hypertenze: opomíjená molekula
- Mezenchymální kmenové buňky a léčba diabetu 1. typu
- Kontroverze v léčbě dny
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

