-
Medical journals
- Career
Život ohrožující projevy systémového lupusu a antifosfolipidového syndromu ve vnitřním lékařství
Authors: Pavel Horák; Martina Skácelová; Jiří Vymětal; Markéta Schubertová
Authors‘ workplace: III. interní klinika – nefrologická, revmatologická a endokrinologická LF UP a FN Olomouc
Published in: Vnitř Lék 2018; 64(2): 136-145
Category: Reviews
Overview
Klinický obraz systémového lupusu a antifosfolipidového syndromu je pestrý a projevy choroby jsou často velmi heterogenní. Relativně často jsou oba stavy spojeny s velmi závažnými, akutními a život ohrožujícími projevy nebo komplikacemi, které kladou vysoké nároky na znalosti diferenciální diagnostiky a na zkušenosti lékařů. Přehledový článek se zabývá závažným a povětšinou akutně probíhajícím postižením kardiovaskulárního, respiračního, ledvinného, gastrointestinálního, hemopoetického nebo nervového systému, dotýká se stručně problematiky gravidity a schematizuje základní terapeutické postupy. Klade si za cíl zdůraznit místo těchto dvou jednotek v diferenciálně diagnostických procesech při akutních stavech ve vnitřním lékařství.
Klíčová slova:
antifosfolipidový syndrom – diagnostika – klinické projevy – léčba – systémový lupus erythematodes – život ohrožující manifestaceÚvod
Přehledový článek se věnuje nejčastějším život ohrožujícím stavům v rámci systémového lupus erythematodes (SLE) a antifosfolipidového syndromu (Antiphospholipid Syndrome – APS). Tyto dvě diagnostické jednotky nelze často navzájem oddělit. Představují svou šíří projevů učebnicový příklad choroby, která se jako pověstná červená nit táhne všemi podobory interny stejně jako dalšími oblastmi klinické i laboratorní medicíny.
Systémový lupus erythematodes
Systémový lupus erythematodes (SLE) je autoimunitní zánětlivé onemocnění charakterizované postižením řady tkání či orgánů. Postihuje častěji ženy v reprodukčním věku a je charakterizován nadprodukcí řady orgánově nespecifických autoprotilátek, podílejících se na tvorbě imunokomplexů, které se ukládají v tkáních a vedou k zánětlivé reakci a orgánovému postižení. SLE lze rozdělit do řady definovaných podtypů, které se mohou navíc překrývat s řadou dalších jednotek (Sjögrenův syndrom, antifosfolipidový syndrom, revmatoidní artritida, smíšená choroba pojiva). Chronický průběh choroby může být komplikován střídáním období exacerbací (flare), vzácněji se objevují spontánní remise. Akutní vzplanutí je zpravidla doprovázeno systémovými příznaky, jako je horečka, únava, váhový úbytek. K nejčastějším projevům patří postižení kůže, kloubů, kardiovaskulárního systému, plic, glomerulů ledvin, centrálního nervového systému nebo krvetvorby. SLE může vyústit do selhání postiženého orgánu a závažná forma choroby je spojena s významnou mortalitou. Stanovení přítomnosti autoprotilátek je jedním ze základních prvků diagnostiky choroby. Více než 95 % nemocných se SLE má pozitivní test na antinukleární protilátky (ANA) v séru v signifikantním titru (1 : 160 či více). Anti-dsDNA protilátky se vyskytují u 40–90 % nemocných se SLE. Protilátky proti extrahovatelným nukleárním antigenům (ENA) zahrnující antigeny Ro, La, Sm, U1RNP, U2RNP, Ku se vyskytují asi u 30–50 % nemocných. Protilátky proti histonům se vyskytují asi u 40–60 % SLE, takřka v 100 % jsou přítomny u lupusu indukovaného léky. Lupus antikoagulans, antikardiolipinové protilátky a protilátky proti glykoproteinu 1 mají význam v diagnostice antifosfolipidového syndromu. Hypokomplementemie souvisí s aktivitou choroby. Anémie se vyskytuje u 50 % nemocných, zejména během období vyšší aktivity procesu. U více než 1/3 nemocných se SLE se vyskytuje pozitivita přímého Coombsova testu, skutečná hemolytická anémie se projeví asi u 10 % nemocných. Zejména období vystupňované aktivity choroby jsou spojena s leukopenií, přičemž nejčastěji se vyskytuje lymfopenie způsobená přítomností antilymfocytárních protilátek, může se však objevit i protilátkami mediovaná neutropenie. Trombocytopenie se vyskytuje často v rámci antifosfolipidového syndromu, trombotické trombocytopenické purpury či hemolyticko-uremického syndromu. Protilátky proti trombocytům jsou velmi častým nálezem. Rutinní biochemický screening odráží přítomnost a stupeň orgánového postižení. V diagnostice choroby chybí zlatý standard. Klasifikační kritéria, včetně naposledy publikovaných SLICC (Systemic Lupus International Collaborating Clinic), se opírají o kombinaci typických klinických projevů a typických laboratorních abnormalit. Dle pravidel SLICC pro klasifikaci SLE se přítomnost definitivní choroby opírá o pozitivitu nejméně 4 kritérií, z nichž musí být alespoň jedno klinické a jedno laboratorní nebo pacient musí mít biopticky prokázanou lupusovou nefritidu se současnou přítomností ANA či anti-dsDNA protilátek (tab. 1) [1].
Table 1. Klasifikační kritéria SLICC (Systemic lupus International Collaborating Clinics) – diagnóza se opírá o přítomnost nejméně 4 kritérií, v nichž má být přítomno alespoň jedno laboratorní (respektive alespoň jedno klinické), event. o histologický průkaz lupusové nefritidy se současnou přítomností ANA či anti-dsDNA protilátek 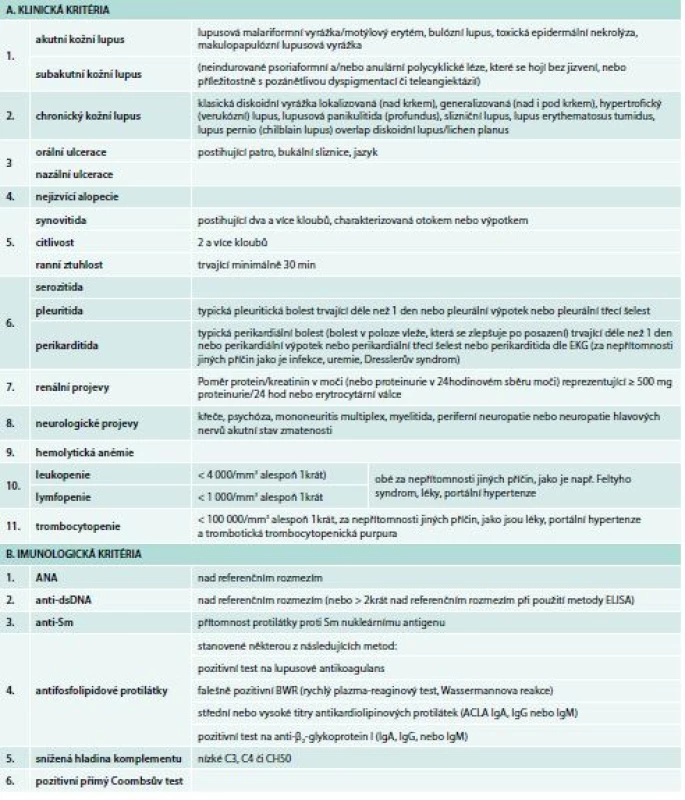
Antifosfolipidový syndrom
Za antifosfolipidový syndrom (APS) se považuje stav, při němž se vyskytují trombotické manifestace ve venózním a/nebo arteriálním řečišti a/nebo specifické komplikace gravidity spolu s perzistující přítomností antifosfolipidových protilátek (lupus antikoagulans, antikardiolipinové protilátky, protilátky proti β2-glykoproteinu 1). Za perzistující přítomnost antifosfolipidových protilátek se považuje průkaz jejich pozitivity ve 2 či více měřeních provedených v intervalu nejméně 12 týdnů [2]. Sekundární nebo asociovaný antifosfolipidový syndrom se vyskytuje v rámci systémových chorob pojiva, zejména v rámci systémového lupus erythematodes, primární antifosfolipidový syndrom se vyskytuje samostatně. Nejčastější klinické manifestace choroby jsou v sestupném pořadí: hluboká žilní trombóza, trombocytopenie, livedo reticularis, mozková příhoda, povrchová tromboflebitida, plicní embolie, ztráta plodu, tranzitorní mozková ataka a hemolytická anémie. APS se asociuje s migrenózními bolestmi hlavy, Raynaudovým fenoménem, plicní hypertenzí, kožními ulceracemi, postižením CNS, hypokortizolizmem při hemoragické infarzaci nadledvin, kognitivními poruchami, demencí a dalšími příznaky. APS je často spojen se závažnou těhotenskou problematikou, kterou představují zejména úmrtí plodu po 10. týdnu gestace, předčasné porody pro preeklampsii či placentární insuficienci či opakované potraty embrya do 10. týdnu gestace. U těchto pacientek se častěji vyskytuje HELLP (Hemolysis, Elevated Liver enzymes, Low Platelets) syndrom a eklampsie [3]. Mezi život ohrožující projevy APS, mimo již zmiňovaných trombotických manifestací, patří také mikroangiopatické postižení charakteru trombotické trombocytopenické purpury či hemolyticko-uremického syndromu i problematika spojená graviditou.
Vzácnou a velmi závažnou manifestací této choroby je katastrofický APS s rozsáhlou trombotickou chorobou spojenou s multiorgánovým selháním. Jedná se často o fatální příhodu spojenou s rozvojem diseminované intravaskulární koagulace se zvýšením hladin fibrin-degradačních produktů a D-dimerů a s konzumpcí fibrinogenu [4].
Život či zdraví ohrožující akutní postižení jednotlivých systémů v rámci SLE a APS
Postižení kardiovaskulárního systému
S postižením kardiovaskulárního systému se lze v rámci SLE a APS potkat poměrně často. Tato problematika zahrnuje několik okruhů.
Chlopenní postižení
Nejčastěji se vyskytuje mitrální regurgitace, která je však zpravidla hemodynamicky málo významná. Závažnější formy chlopenního postižení jsou způsobeny chlopenními vegetacemi, které mohou mít velikost od malých uzlíků až po velké verukózní vegetace nazývané Libmanova-Sacksova endokarditida. Vegetace mohou být spojeny s rozvojem chlopenní vady, nejčastěji s mitrální nedostatečností, méně pak s insuficiencí aortální chlopně [5].
Perikardiální postižení – perikarditida
Spolu s pleuritidou a difuzním zánětem pobřišnice se řadí mezi tzv. serozitidy. Perikarditida je často asymptomatická [6]. Může se však projevit pleurální bodavou bolestí lokalizovanou za dolní částí sterna a spojenou s přítomností třecího šelestu.
Myokardiální dysfunkce
Projevuje se známkami srdečního selhání, tachykardií či arytmiemi, bývá spojena s kardiomegalií. Echokardiografické vyšetření nachází obvykle poruchu diastolické funkce, někdy i dilataci a difuzní hypokinezu s depresí systolické funkce levé komory. Akutní myokarditida je často doprovázena perikarditidou [7].
Tromboembolická choroba
Riziko plicní embolizace je vysoké zejména u nemocných se SLE a sekundárním antifosfolipidovým syndromem a také se všemi stavy, které jsou spojeny s imobilizací nemocného [8].
Plicní arteriální hypertenze
Plicní arteriální hypertenze (PAH) je primárním onemocněním plicních arteriol, které se vyskytuje u systémových onemocnění pojiva, a to nejčastěji u systémové sklerodermie, dále pak u SLE, APS či u Sjögrenova syndromu. PAH asociovaná s těmito chorobami je po hemodynamické stránce o prekapilárního typu (zvýšení středního tlaku v plícnici > 25 mm Hg). Nejčastějším symptomem u PAH je progredující námahová dušnost a únavnost. Anginózní bolesti na hrudi jsou důsledkem ischemie pravé komory, synkopy a presynkopy jsou projevem nízkého srdečního výdeje. Pokročilá PAH se projeví obrazem těžkého pravostranného srdečního selhání. V případě SLE je však stále hlavní příčinou plicní hypertenze tromboembolická choroba [9].
Periferní cévní řečiště
S postižením periferního cévního řečiště se lze potkat jednak ve formě digitálních ulcerací, ale také nekrotického postižení prstů horních či dolních končetin, nekrózami podkoží a kůže. Důvodem může být vaskulitida při akutně probíhající chorobě nebo v pozdějších fázích choroby aterosklerotické postižení arteriálního řečiště.
Ischemická choroba srdeční
Kardiovaskulární mortalita je v rámci SLE na jednom z předních míst v příčinách úmrtí pacientů. Relativní riziko infarktu myokardu je 2,27, cévní mozkové příhody 2,05 a aterosklerózy dokonce 7,1 [10]. Rozvoj aterosklerózy je spojen jednak s vyšší přítomností tradičních rizikových faktorů aterogeneze (obezita, kouření, metabolický syndrom), na jejím rozvoji se však podílejí i faktory specifické pro lupus (antifosfolipidové protilátky, aktivita choroby, endoteliální dysfunkce, vaskulitida, vliv léčiv).
Vyšetřovací metody
Zahrnují celou škálu neinvazivních i invazivních kardiologických vyšetřovacích postupů. V laboratorních testech se využívají dostupné kardiomarkery jako troponin I či natriuretický peptid (NTproBNP). Je třeba zdůraznit nezastupitelnou úlohu transtorakální i transezofageální echokardiografie u řady stavů včetně diagnostiky plicní hypertenze, dále v případě potřeby pravostranné srdeční katetrizace (PAH), angiografie, zobrazení magnetickou rezonancí nebo biopsie myokardu.
Akutní plicní manifestace
Lupusová pneumonitida
Projevuje se horečkou, dušností, produktivním kašlem s menším množstvím sputa, tachypnoí, hemoptýzou, pleurální bolestí a hypoxemií. Fyzikální nález odhalí oboustranný bazální krepitus a v těžkých případech i centrální cyanózu. Na radiogramech plic bývají přítomny oboustranné skvrnité alveolární infiltráty. Jedná se o relativně vzácnou manifestaci lupusu. Je třeba vždy vyloučit infekce, ale také komplikaci léčby (např. metotrexátová plíce) [11].
Alveolární plicní hemoragie
Je vzácná, ale závažná a často fatální příhoda. V rámci SLE se může vyskytnout častěji v souvislosti s antifosfolipidovým syndromem. Klinický průběh je podobný průběhu akutní lupusové pneumonitidy, je doprovázena rychlou progresí a alterací stavu nemocného s úzkostí. Je přítomná tachypnoe, hypoxemie, tachykardie, může se rozvinout syndrom dechové tísně dospělých ARDS (Adult Respiratory Distress Syndrome). Hemoragie může být buď intraalveolární, nebo zevní a je často doprovázena poměrně rychlým poklesem hemoglobinu. Histopatologicky je přítomno intraalveolární prokrvácení s intaktními erytrocyty a makrofágy nabitými hemosiderinem. Nemusí být přítomny zjevné známky vaskulitidy, někdy je popisovaná přítomnost mikroangiitidy, zánětu s nekrózou alveolárních kapilár, arteriol a malých muskulárních arteriol [12], obr. 1.
Image 1. Difuzní alveolární hemoragie u 19leté nemocné se SLE a sekundárním APS 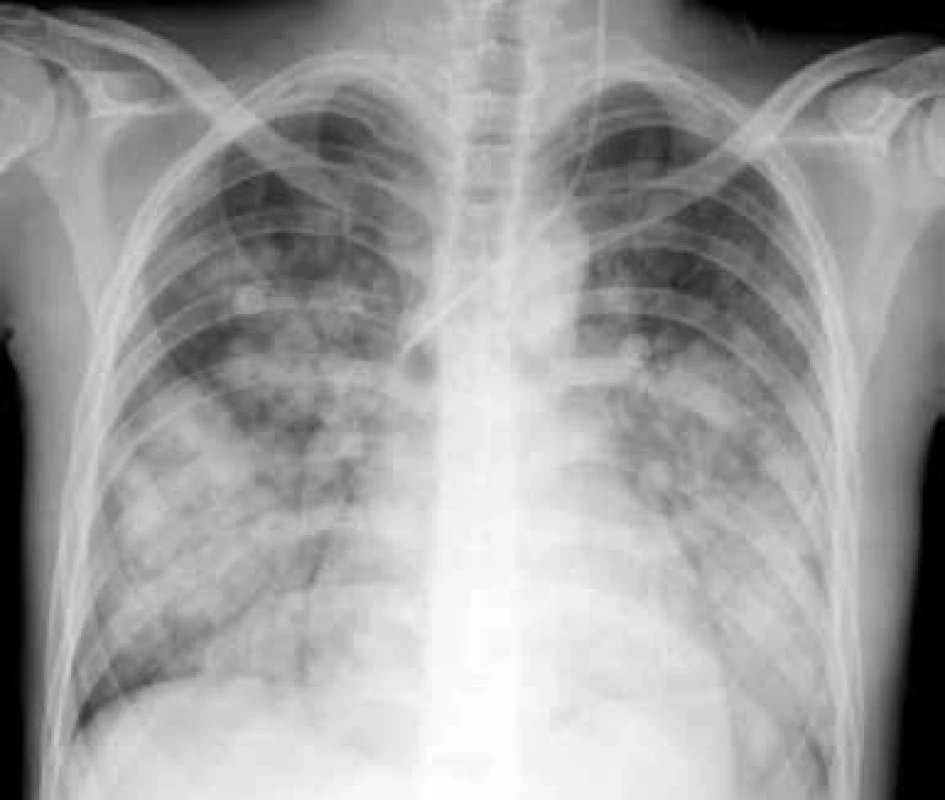
Akutní reverzibilní hypoxemie
Patogeneze tohoto syndromu je nejasná. Snížená oxygenační kapacita plic může být vyvolána agregací neutrofilních leukocytů, jež obsahují rozpadové produkty komplementu v plicních cévách [13].
Vyšetřovací metody
Je třeba využít možností klinického laboratorního vyšetření doplněného radiografií, testy respiračních funkcí, bronchoalveolární laváž a cytologická vyšetření až po v indikovaných případech provedenou biopsii plic.
Postižení ledvin
- Akutní postižení ledvin u SLE probíhá s histologickým obrazem
- glomerulonefritidy, respektive rychle progredující glomerulonefritidy (RPGN) dále s obrazem
- trombotické mikroangiopatie (vaskulární postižení) či formou
- akutní intersticiální nefritidy
Klinický obraz zahrnuje širokou škálu projevů od hypertenze přes většinou mikroskopickou hematurii, nefritický nebo nefrotický syndrom po akutně vznikající renální nedostatečnost. Představuje důležitou problematiku péče o nemocné se SLE a APS.
U SLE je základním patogenetickým faktorem postižení ledviny přítomnost glomerulonefritidy. Histologická klasifikace WHO a její revize z roku 2004 rozlišuje 6 základních tříd glomerulonefritid [14]. Lupusová nefritida se vyskytuje zvlášť často u případů manifestních v mladším věku. Akutní renální selhání se často rozvíjí v souvislosti s přítomností kapilárních mikrotrombů při trombotické trombocytopenické purpuře nebo hemolyticko-uremickém syndromu či u trombóz renálních arterií i žil v rámci těchto významných komplikací SLE a APS [15] (obr. 2). Akutní intersticiální nefritida spojená s depozity imunokomplexů podél tubulární bazální membrány nekorelující s přítomností a aktivitou glomerulonefritidy může být další manifestací choroby [16].
Image 2. Fibrinové tromby v kapilárních kličkách u mikroangiopatie v rámci trombotické trombocytopenické purpury (TTP) u SLE jsou zvýrazněné speciálním barvením (modrý trichrom), tromby jsou zbarveny červeně (šipka), zvětšení 200× (snímek poskytnut MUDr. T. Tichým, Ústav klinické a molekulární patologie FN a LF UP Olomouc) 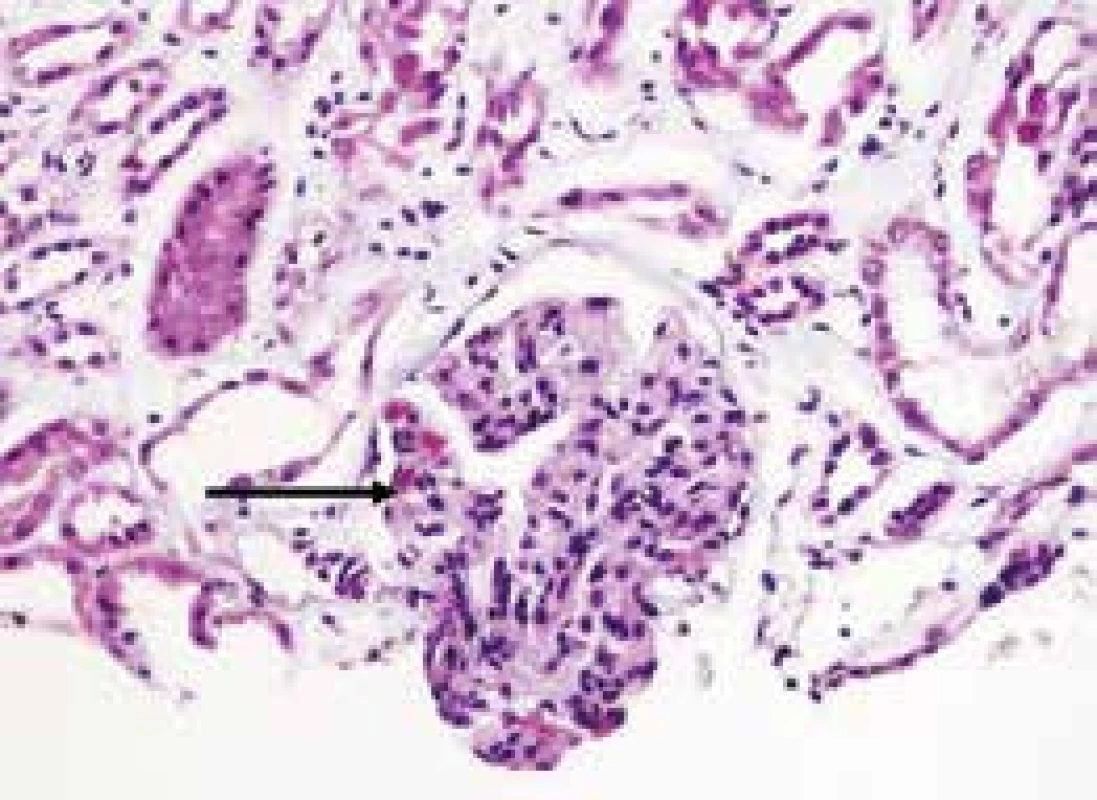
Lékové postižení
Mezí významné nefrotoxické léky užívané v rámci léčby SLE patří nesteroidní antirevmatika nebo kalcineurinové inhibitory (cyklosporin A). Podání cyklofosfamidu je spojeno s rizikem akutní hemoragické cystitidy.
Vyšetřovací metody
Diagnostika postižení ledvin se opírá o detailní klinické a laboratorní vyšetření, v indikovaných případech doplněné o histologické vyšetření vzorku získaného při biopsii ledvin.
Gastrointestinální systém
Mezenterická vaskulitida
Jedná se o vzácnější, ale potenciálně nebezpečnou manifestaci lupusu a vaskulitid (polyarteriitis nodosa, granulomatóza s polyangiitidou). Její počátek může být nenápadný s mírnou bolestivostí v podbřišku, přítomnou i několik měsíců před projevy akutní břišní příhody s nauzeou, zvracením, průjmem, enteroragií a horečkou [17]. Tato manifestace může být doprovázena rovněž mezenterickou trombózou či okluzí, častěji se vyskytuje u jedinců s APS. Pankreatitida se vyskytuje občas u vysoce aktivního lupusu či Sjögrenova syndromu a je charakterizovaná bolestí v epigastriu, nauzeou, zvracením a zvýšením hladin sérové pankreatické amylázy a lipázy
NSA gastropatie
Nesteroidní antirevmatika (NSA) patří mezi léky často užívané nemocnými se SLE. Na poškození horní části zažívacího traktu se podílí zejména inhibice protektivního izoenzymu COX1. Dlouhodobí uživatelé NSA mají 1–4% roční incidenci gastroduodenálních perforací, vředů a krvácení (tzv. PUB – perforations, ulcers, bleeding) [18]. Rozhoduje typ NSA, všeobecně rozšířený ibuprofen a diklofenak patří z hlediska gastrotoxicity mezi ta bezpečnější. NSA poškozují i nižší etáže GIT traktu (NSA enteropatie).
Vyšetřovací metody
Diagnostika GIT manifestací zahrnuje řadu laboratorních i zobrazovacích metod včetně ultrasonografického vyšetření, CT vyšetření, zobrazení magnetickou rezonancí, angiografii, endoskopické metody atd.
Akutní manifestace hematologické
Mezi závažné stavy pojící se se SLE či APS patří především anémie (aplastická či hemolytická), konzumpční koagulopatie, těžké trombocytopenie, trombofilní i krvácivé stavy [19,20].
Aplastická anémie
Čistá aplazie červené řady je u SLE vzácná. Může být způsobena přítomností protilátek proti erytropoetinu či proti prekurzorům červených krvinek. Útlak dřeňové krvetvorby však může být důsledkem imunosupresní terapie [21].
Autoimunitní hemolytická anémie
Autoimunitní hemolytická anémie (AIHA) je charakterizovaná poklesem hladin hemoglobinu, zvýšením počtu retikulocytů, zvýšením volného hemoglobinu, nepřímého bilirubinu nebo snížením haptoglobinu. AIHA může být doprovázena také pozitivitou Coombsova testu či přítomností tepelných i chladových antierytrocytárních protilátek. Patří mezi klasické projevy SLE.
Mikroangiopatická hemolytická anémie
Mimo základní rysy hemolýzy je doprovázena přítomností schistocytů (fragmenty erytrocytů) a vysokých hladin LDL-cholesterolu. Často je doprovázena také trombocytopenií, postižením ledvin (mikroangiopatická nefropatie), horečkou, neurologickými syndromy či plicní hemoragií. Tyto rysy jsou shodné s TTP či s HUS, u kterého nebývá přítomná horečka a neurologické postižení. Vyskytuje se u SLE či u APS, bývá popisovaná v souvislosti terapií cyklosporinem A [22].
Trombocytopenie
Je velmi častá u SLE a APS. Těžší formy < 50 000/μmol jsou však vzácnější. Na jejím vzniku se může podílet
- autoimunitně mediovaná destrukce destiček za přítomnosti antitrombocytárních či antifosfolipidových protilátek
- konsumpční trombocytopenie asociovaná s mikroangiopatickým postižením
- postižení produkce trombocytů v rámci užívání cytotoxické, imunosupresní terapie či vlivy dalších léků
Trombofilie
Jsou v rámci SLE velmi časté. Vyskytující se zejména u sekundárního antifosfolipidového syndromu. Na jejich vzniku se mohou podílet rovněž další faktory, jako je snížená mobilita nemocných, gravidita či lékové interakce (glukokortikoidy, estrogeny atd).
Krvácivé stavy
U SLE se vzácně mohou vyskytnout protilátky proti faktorům VIII, IX, XI, XII a XIII, které se manifestují zvýšeným sklonem ke krvácení a také vyšším rizikem alveolární hemoragie.
Syndrom aktivovaných makrofágů
Syndrom aktivovaných makrofágů (MAS) bývá spojený se SLE, ale také juvenilní idiopatickou artritidou či se Stillovou chorobou dospělých. Klinicky se MAS projevuje horečkou, anémií, lymfadenopatií, úbytkem hmotnosti, artritidou, vyrážkou, perikarditidou, hepatomegalií. Může být neobvyklou příčinou pancytopenie. V laboratorních testech se nachází vysoké hladiny feritinu, v případě SLE anti-dsDNA protilátky a hypokomplementemie. Může být aktivovaná koagulace s hypofibrinogenemií a může se vyskytnout atypické snížení sedimentace erytrocytů. Definitivní průkaz MAS se opírá o nález hemofagocytózy ve dřeni nebo v uzlinách [23].
Vyšetřovací metody
Zahrnují kompletní analýzu krevního obrazu, stanovení přítomnosti retikulocytů a schistocytů, imunohematologické vyšetření, stanovení Coombsova testu, vyšetření koagulace, přítomnosti antifosfolipidových protilátek, protilátek proti trombocytům, analýzu kostní dřeně, stanovení přítomnosti inhibitorů koagulace atd.
Neuropsychiatrické manifestace
Údaje o prevalenci neuropsychiatrických projevů SLE se často rozcházejí dle úhlu pohledu autorů. Na počátku nemoci se vyskytují asi v 10 % případů, kdykoli v průběhu až v 80 % [24]. Takto rozdílně stanovená prevalence neuropsychiatrických manifestací odráží existenci různých kritérií postižení CNS u SLE.
Cévní mozkové příhody
SLE a APS jsou spojeny s vyšším rizikem mozkových infarktů, které se mohou projevit jako dokonaný iktus či jako tranzitorní ischemická ataka. Riziko rekurence je vysoké zejména v souvislosti s antifosfolipidovým syndromem. APS je někdy doprovázen drobnými a tranzitorními ischemickými příhodami, které mohou vést k demenci. Tento stav tvořený triádou mikroinfarktové demence, přítomností liveda reticularis a průkazu antifosfolipidových protilátek se nazývá Sneddonův syndrom [25].
Psychóza
U SLE se vyskytuje vzácně a musí být odlišena od primární psychiatrické choroby (schizofrenie), od deliria (návykové látky, otravy, metabolické příčiny) a poruch souvisejících s podáním některých léků (glukokortikoidy).
Stavy akutní zmatenosti
V klasické formě se jedná o komplexní poruchu s redukovanou schopností udržet pozornost a koncentraci. Bývají doprovázeny také poruchami chování, nálad, objevuje se psychomotorický neklid a různý stupeň poruchy vědomí. Tyto delirantní stavy, rozvíjející se během několika hodin či dnů, mohou vyústit do kómatu.
Křeče – epiparoxyzmy
Mohou být ve své generalizované či parciální formě prvním příznakem SLE a pojí se rovněž s APS. Jejich příčinou může být autoimunitní encefalopatie či vaskulopatie, je však třeba odlišit i další jednotky jako jsou idiopatické či poúrazové epilepsie, metabolické příčiny, toxicita léků, stavy po iktech [26].
Méně časté projevy akutního postižení CNS zahrnují transverzální myelitidu vyskytující se u APS, aseptickou meningitidu, pseudotumor cerebri, syndrom inadekvátní sekrece antidiuretického hormonu (SIADH – syndrome of inappropriate antidiuretic hormone secretion), senzoneuronální postižení sluchu, syndromy cerebelární či mozkového kmene či demyelinizační poruchy (multiple sclerosis like syndrome, lupoidní skleróza).
Vyšetřovací metody
Zahrnují neurologické a psychiatrické vyšetření, psychologické testy, magnetickou rezonanci mozku, elektroencefalografii, případně elektromyografii, analýzu likvoru, séra, oční vyšetření, vyšetření evokovaných potenciálů atd.
Akutní projevy SLE a APS v graviditě
Díky soustavné léčbě a monitoraci nemocných žen se SLE se riziko vzplanutí během gravidity či po jejím ukončení do určité míry snížilo. Rizikovým faktorem zůstává jednak vysoká aktivita choroby před početím, jednak přítomnost ledvinného postižení.
První manifestace lupusu během gravidity či bezprostředně po ní může být velmi těžká až katastrofická. U žen se SLE je vyšší riziko preeklampsie i hepatopatie. Preeklampsie je charakterizovaná náhlým vznikem hypertenze a proteinurie po 24. týdnu gravidity a je častější u prvních gravidit. Závažná klinická manifestace je důsledkem systémové endoteliální dysfunkce a mikroangiopatie, postiženými orgány mohou být CNS (křeče, eklampsie), játra (elevace jaterních indikátorových enzymů, porucha koagulace), HELLP syndrom, ledvina (glomerulární postižení a proteinurie), mikroangiopatická hemolýza a trombocytopenie [27,28].
Léčba život ohrožujících projevů SLE a APS
Léčba musí být v tomto případě zaměřena na zvládnutí akutního projevu choroby, zabránění vzniku závažného a ireverzibilního orgánového postižení, navození remise onemocnění a prevenci vzniku druhotných komplikací či na jejich zvládání.
Indukční léčba
Indukční léčba představuje úvodní terapii choroby či její nové manifestace, která je zaměřena na rychlou kontrolu aktivity choroby, zlepšení funkce, zastavení procesu tkáňového poškození a indukci remise. Indukční fáze léčby využívá agresivnější dávkování používaných léčiv a je spojena s vyšším rizikem vzniku nežádoucích účinků.
Udržovací léčba
Udržovací léčba je dlouhé období méně intenzivní a toxické léčby, která s sebou nese nižší riziko komplikací a lepší toleranci. Jejím účelem je konsolidace remise a prevence vzplanutí (flare) aktivity SLE. Všeobecnou indikaci imunosupresivní terapie představuje závažné orgánové postižení a/nebo extenzivní postižení kůže či kloubů refrakterní na léčbu glukokortikoidy a antimalariky či s nemožností adekvátního snížení glukokortikoidů k akceptovatelné dávce [29–32].
Osu farmakologické léčby závažných stavů představuje podání vysokých dávek glukokortikoidů a imunosupresiv. V rámci léčby nejzávažnějších manifestací SLE je lékem první linie cyklofosfamid podávaný v naprosté většině případů intravenózně (pulzně). Pulzy se obvykle opakují v intervalu 3–4 týdnů po dobu prvních 6 měsíců, jejich podávání je možno dle stavu pacienta i prodloužit v delších časových intervalech. Bezpečnější alternativou agresivně podávaného cyklofosfamidu zejména z pohledu gonadální toxicity je u lupusové nefritidy podávání tzv. minipulzů (500 mg pro každou infuzi) v intervalu 2 týdnů po dobu 3 měsíců s následnou udržovací imunosupresí (azatioprin, mykofenolát mofetil) v režimu zvaném EUROLUPUS. Grafické znázornění léčebných přístupů u SLE je uvedeno na schématu a v tab. 2 [33].
Schéma. Léčebné postupy používané v terapii SLE a jejich schematická indikace. Upraveno dle [29] ![Schéma. Léčebné postupy používané v terapii SLE a jejich schematická indikace. Upraveno dle [29]](https://pl-master.mdcdn.cz/media/image/689560994d8a57585d89359adc1f75da.jpg?version=1537794407)
APS – antifosfolipidový syndrom CNS – postižení centrálního nervového systému GN – glomerulonefritida HEM – hematologické manifestace IVIG – intravenózní imunoglobuliny/intravenous immunoglobulins Table 2. Doporučená léčba SLE dle závažnosti a rozsahu orgánového postižení stavu. Upraveno dle [29] ![Doporučená léčba SLE dle závažnosti a rozsahu orgánového postižení stavu. Upraveno dle [29]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/504ce0f835ee22d27875c201237e99d2.jpg)
AZA – azatioprin CFA – cyklofosfamid GKK – glukokortikoidy IVIG – intravenózní imunoglobuliny/intravenous immunoglobulins MMF – mykofenolát mofetil MTX – metotrexát #Doporučené dávkovací schéma belimumabu je 10 mg/kg ve dnech 0, 14 a 28 a poté ve 4týdenních intervalech Charakteristika užívaných farmak
Mykofenolát mofetil
Představuje lék vhodný pro indukční i udržovací léčbu proliferativních i membranózních forem lupusové nefritidy. Jeho účinnost je srovnatelná s cyklofosfamidem při menší incidenci nežádoucích účinků. V indukční léčbě se podává v dávce 2 g (maximálně 3 g) denně, v udržovací léčbě v dávce 1–2 g denně. V udržovací léčbě choroby byl srovnáván především s azatioprinem – při tomto srovnání byla jeho účinnost dle výsledků buď srovnatelná, či superiorní s lepší snášenlivostí [33]. Podobně jako cyklofosfamid či metotrexát je kontraindikován v graviditě.
Azatioprin
Podává se u aktivních forem lupusu s orgánovým postižením. Jako udržovací léčba se nasazuje k udržení remise dosažené cyklofosfamidem. Podává se také jako prostředek umožňující snížit doposud podávanou dávku glukokortikoidů. Zvyklá dávka je 1–3 mg/kg/den.
Cyklosporin A
Představuje určitou alternativu podání cyklofosfamidu či mykofenolátu při jejich nesnášenlivosti, a to zejména u membranózní glomerulonefritidy nebo v terapii refrakterní trombocytopenie, hemolytické anémie, leukopenie a refrakterních serozitid. Cyklosporin A se podává v dávce 3–5 mg/kg/den.
Intravenózní imunoglobuliny
Podání vysokých intravenózních dávek imunoglobulinů je u SLE indikováno výjimečně ve stavech, jako je refrakterní trombocytopenie, hemolytická anémie či refrakterní lupusová glomerulonefritida.
Rituximab
Jeho podání je možno zvážit u refrakterních forem lupusu zejména s lupusovou nefritidou, u kterých selhala terapie cyklofosfamidem a/nebo mykofenolátem. Rituximab je u SLE podáván, ostatně jako řada dalších léčiv, v režimu off label.
Plazmaferéza
Plazmaferéza odstraňuje cirkulující imunokomplexy a protilátky z oběhu. Jeví se jako užitečná v úzce specifikovaných a vybraných situacích (mikroangiopatické postižení ledvin, hemolyticko-uremický syndrom, katastrofický antifosfolipidový syndrom).
Belimumab, metotrexát
Pro podání dalších léků, běžně u lupusu užívaných (belimumab, metotrexát), chybí v případě život ohrožujících stavů dostatek údajů.
Specifika léčby APS
Terapie primárního či sekundárního APS se zásadně neliší. V případě závažných trombotických manifestací je třeba přistoupit k léčbě dle léčebných doporučení a protokolů pro plicní embolizaci, infarkt myokardu, cévní mozkové příhody atd, a v případech, v nichž je to indikováno, zvolit specifickou aktivní intervenci (trombolýza, trombektomie, koronaroplastika atd).
U sekundární formy je často nezbytná i imunosuprese k potlačení aktivity základního patologického procesu. Nejčastěji se v léčbě užívá heparin (nízkomolekulární LMWH či nefrakcionovaný), warfarin a kyselina acetylsalicylová. Pacienti se systémovým lupusem užívají velmi často hydroxychlorochin, který má prospěšný efekt i v rámci antifosfolipidového syndromu [34]. Léčba TTP/HUS v rámci antifosfolipidového syndromu se neliší od doporučení k léčbě idiopatických forem těchto závažných stavů a zahrnuje mimo symptomatické léčby také provedení opakovaných plazmaferéz.
Heparin je dnes častěji nahrazován frakcionovanými formami LMWH (Low Molecular Weight Heparin). LMWH hraje také zásadní roli v léčbě těhotných žen s APS, jelikož warfarin je u nich kontraindikován.
Současně s heparinem se většinou zahajuje také podávání warfarinu, překrývání obou léků je zvykle 4–5 dní do doby, než se INR (International Normalized Ratio) dostává do terapeutického rozmezí (2,0–3,0) po dobu 2 následujících dní.
Katastrofický APS
Je spojený s vysokou mortalitou. Léčba spočívá v eliminaci možných vyvolávacích faktorů (infekce) a dále v kombinaci antikoagulační terapie (heparin, LMWH) s vysokými dávkami metylprednisolonu a opakovanou plazmaferézou v případě známek mikroangiopatie. Počet potřebných plazmaferéz se řídí klinickou situací, dle některých prací dochází k 95% poklesu hladin antikardiolipinových protilátek po 5 plazmaferézách. Tyto postupy mohou být ještě doplněny o podávání intravenózních imunoglobulinů v dávce 400 mg/kg denně nebo rituximabu [4,35].
Závěr
Systémový lupus erythematodes (SLE) představuje onemocnění, které jako málokteré jiné zasahuje takřka do všech oblastí klinické medicíny. Díky mimořádně pestrému klinickému obrazu a heterogenitě choroby se s pacientem se systémovým lupusem může potkat dermatolog, pediatr, neurolog, psychiatr či porodník a samozřejmě také internista, včetně všech interních oborů, nebo intenzivista [36]. S akutními projevy SLE se lze setkat poměrně často. Mohou ohrozit zdraví nebo život postiženého a vyžadují okamžitou intervenci a intenzivní péči. Je třeba vždy zdůraznit potřebu mezioborové spolupráce při jejich diagnostice, péči o takto postižené pacienty a při vedení racionální terapie.
Podpora grantu AZV 15–28659A.
Doručeno do redakce 26. 9. 2017
Přijato po recenzi 19. 11. 2017
prof. MUDr. Pavel Horák, CSc.
III. interní klinika - nefrologická, revmatologická a endokrinologická LF UP a FN Olomouc
Sources
1. Petri M, Orbai AM, Alarcon GS et al. Derivation and validation of the Systemic Lupus International Collaborating Clinics classification criteria for systemic lupus erythematosus. Arthritis Rheum 2012; 64(8): 2677–2686. Dostupné z DOI: <http://dx.doi.org/10.1002/art.34473.
2. Gómez-Puerta JA, Cervera R. Diagnosis and classification of the antiphospholipid syndrome. J Autoimmun 2014; 48–49 : 20–25. Dostupné z DOI:
3. Miyakis S, Lockshin MD, Atsumi T et al. International consensus statement on an update of the classification criteria for definite antiphospholipid syndrome (APS). J Thromb Haemost 2006; 4(2): 295–306. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1538–7836.2006.01753.x>.
4. Nayer A, Ortega LM. Catastrophic antiphospholipid syndrome: a clinical review. J Nephropathol 2014; 3(1): 9–17. Dostupné z DOI: <http://dx.doi.org/10.12860/jnp.2014.03>.
5. Galve E, Candell-Riera J, Pigrau C et al. Prevalence, morphologic types, and evolution of cardiac valvular disease in systemic lupus erythematosus. N Engl J Med 1988; 319(13): 817–823. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJM198809293191302>.
6. Doria A, Iaccarino L, Sarzi-Puttini P et al. Cardiac involvement in systemic lupus erythematosus. Lupus 2005; 14(9): 683–686. Dostupné z DOI: <http://dx.doi.org/10.1191/0961203305lu2200oa>.
7. Moder KG, Miller TD, Tazelaar HD. Cardiac involvement in systemic lupus erythematosus. Mayo Clin Proc 1999; 74(3): 275–284. Dostupné z DOI: <http://dx.doi.org/10.4065/74.3.275>.
8. Akdogan A, Kilic L, Dogan I et al. Pulmonary hypertension in systemic lupus erythematosus: pulmonary thromboembolism is the leading cause. J Clin Rheumatol 2013; 19(8): 421–425. Dostupné z DOI: <http://dx.doi.org/10.1097/RHU.0000000000000037>.
9. Bazzan M, Vaccarino A, Marletto F. Systemic lupus erythematosus and thrombosis. Thrombosis J 2015; 13 : 16. Dostupné z DOI: <http://dx.doi.org/10.1186/s12959–015–0043–3>.
10. Smržová A, Horák P, Skácelova M et al. Cardiovascular events in patients with systemic lupus erytematodes. Cor vasa 2014; 56(2): e145-e152.
11. Mira-Avendano IC, Abril A. Pulmonary manifestations of Sjögren syndrome, systemic lupus erythematosus, and mixed connective tissue disease. Rheum Dis Clin North Am 2015; 41(2): 263–277. Dostupné z DOI: <http://dx.doi.org/10.1016/j.rdc.2015.01.001>.
12. Martinez-Martinez MU, Abud-Mendoza C. Diffuse alveolar hemorrhage in patients with systemic lupus erythematosus. Clinical manifestations, treatment, and prognosis. Reumatol Clin 2014; 10(4): 248–253. Dostupné z DOI: <http://dx.doi.org/10.1016/j.reuma.2014.02.002>.
13. Martinez-Taboada VM, Blanco R, Armona J et al. Acute reversible hypoxemia in systemic lupus erythematosus: a new syndrome or an index of disease activity? Lupus 1995; 4(4): 259–262. Dostupné z DOI: <http://dx.doi.org/10.1177/096120339500400405>.
14. Weening JJ, D‘Agati VD, Schwartz MM et al. The classification of glomerulonephritis in systemic lupus erythematosus revisited. J Am Soc Nephrol 2004; 15(2): 241–250. Erratum in J Am Soc Nephrol. 2004; 15(3): 835–836.
15. Hughson MD, Nadasdy T, McCarty GA et al. Renal thrombotic microangiopathy in patients with systemic lupus erythematosus and the antiphospholipid syndrome. Am J Kidney Dis 1992; 20(2): 150–158.
16. Dhingra S, Qureshi R, Abdellatif A et al. Tubulointerstitial nephritis in systemic lupus erythematosus: innocent bystander or ominous presage. Histol Histopathol 2014; 29(5): 553–565. Dostupné z DOI: <http://dx.doi.org/10.14670/HH-29.10.553>.
17. Tian XP, Zhang X. Gastrointestinal involvement in systemic lupus erythematosus: Insight into pathogenesis, diagnosis and treatment. World J Gastroenterol 2010; 16(24): 2971–2977.
18. Rahme E, Barkun A, Nedie H et al. Hospitalizations for upper and lower GI events associated with traditional NSAIDs and acetaminophen among the elderly in Quebec, Canada. Am J Gastroenterol 2008; 103(4): 872–882. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1572–0241.2008.01811.x>.
19. Rouf A, Uddin R, Hoque E. Pattern of hematological manifestations in patients with systemic lupus erythematosus attending in a tertiary care hospital. Medical College Journal 2014; 13(1): 49–53. Dostupné z DOI: <http://dx.doi.org/10.3329/cmoshmcj.v13i1.19420>.
20. Aleem A, Al Arfaj AS, Khalil N et al. Haematological abnormalities in systemic lupus erythematosus. Acta Reumatol Port 2014; 39(3): 236–241.
21. Giannouli S, Voulgarelis M, Ziakas PD et al. Anaemia in systemic lupus erythematosus: from pathophysiology to clinical assessment. Ann Rheum Dis; 2006 : 65(2): 144–144. Dostupné z DOI: <http://dx.doi.org/10.1136/ard.2005.041673>.
22. Lansigan F, Isufi I, Tagoe CE. Microangiopatic haemolytic anemia resembling trombocytopenic purpura in SLE: the role of ADAMTS 13. Rheumatology (Oxford) 2011; 50(5): 824–829. Dostupné z DOI: <http://dx.doi.org/10.1093/rheumatology/keq395>.
23. Vilaiyuk S, Sirachainan N, Wanitkun S et al. Recurrent macrophage activation syndrome as the primary manifestation in systemic lupus erythematosus and the benefit of serial ferritin measurements: a case-based review. Clinical Rheumatology 2013; 32(6): 899–904. Dostupné z DOI: <http://dx.doi.org/10.1007/s10067–013–2227–1>.
24. Brey RL, Holliday SL, Saklad AR et al. Neuropsychiatric syndromes in lupus: Prevalence using standardized definitions. Neurology 2002; 58(8): 1214–1220.
25. Sneddon IB. Cerebrovascular lesions and livedo reticularis. Br J Dermatol 1965; 77 : 180–185.
26. Cimaz R, Meroni PL, Shoenfeld Y. Epilepsy as part of systemic lupus erythematosus and systemic antiphospholipid syndrome (Hughes syndrome). Lupus 2006; 15(4): 191–197. Dostupné z DOI: <http://dx.doi.org/10.1191/0961203306lu2272rr>.
27. Petri M, Howard D, Repke J. Frequency of lupus flare in pregnancy. The Hopkins Lupus Pregnancy Center experience. Arthritis Rheum 1991; 34(12): 1538–1545.
28. Stojan G, Baer AN. Flares of systemic lupus erythematosus during pregnancy and the puerperium: prevention, diagnosis and management. Expert Rev Clin Immunol 2012; 8(5): 439–453. Dostupné z DOI: <http://dx.doi.org/10.1586/eci.12.36>.
29. Horák P, Tegzová D, Závada J et al. Doporučení České revmatologické společnosti pro léčbu nemocných se SLE. Čes Revmatol 2013; 21(3): 110–122.
30. Xiong W, Lahita RG. Pragmatic approaches to therapy for systemic lupus erythematosus. Nat Rev Rheumatol 2014; 10(2): 97–107. Dostupné z DOI: <http://dx.doi.org/10.1038/nrrheum.2013.157>.
31. Dall‘era M, Chakravarty EF. Treatment of mild, moderate, and severe lupus erythematosus: focus on new therapies. Curr Rheumatol Rep 2011; 13(4): 308–316. Dostupné z DOI: <http://dx.doi.org/10.1007/s11926–011–0186–6>.
32. Van Vollenhoven RF, Mosca M, Bertsias G et al. Treat-to-target in systemic lupus erythematosus: recommendations from an international task force. Ann Rheum Dis 2014; 73(6): 958–967. Dostupné z DOI: <http://dx.doi.org/10.1136/annrheumdis-2013–205139>.
33. Bertsias GK, Tektonidou M, Amoura Z et al. Joint European League Against Rheumatism and European Renal Association – European Dialysis and Transplant Association (EULAR/ERA-EDTA) recommendations for the management of adult and paediatric lupus nephritis. Ann Rheum Dis 2012; 71(11): 1771–1782. Dostupné z DOI: <http://dx.doi.org/10.1136/annrheumdis-2012–201940>.
34. Ruffatti A, Salvan E, Del Ross T et al. Treatment strategies and pregnancy outcomes in antiphospholipid syndrome patients with thrombosis and triple antiphospholipid positivity. A European multicentre retrospective study Thromb Haemost 2014; 112(4): 727–735. Dostupné z DOI: <http://dx.doi.org/10.1160/TH14–03–0191>.
35. Berman H, Rodríguez-Pintó I, Cervera R et al. Rituximab use in the catastrophic antiphospholipid syndrome: Descriptive analysis of the CAPS registry patients receiving rituximab. Autoimmun Rev 2013; 12(11): 1085–1090. Dostupné z DOI: <http://dx.doi.org/10.1016/j.autrev.2013.05.004>.
36. Vymětal J, Skácelová M, Smržová A et al. Emergency situations in rheumatology with a focus on systemic autoimmune diseases. Biomed Pap Med Fac Univ Palacky Olomouc Czech Republic 2016; 160(1): 20–29. Dostupné z DOI: <http://dx.doi.org/10.5507/bp.2016.002>.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2018 Issue 2-
All articles in this issue
- Revmatoidní artritida
- Axiální spondylartritida
- Využitie MRI vyšetrenia pri diagnostike axiálnej spondylartritídy
- Biologická léčba psoriatické artritidy
- Život ohrožující projevy systémového lupusu a antifosfolipidového syndromu ve vnitřním lékařství
- Systémová sklerodermie v roce 2017
- Idiopatické zánětlivé myopatie
- Nové trendy v monitorování a léčbě ANCA asociovaných vaskulitid
- Difuzní alveolární hemoragie – akutní, život ohrožující stav v revmatologii
- Polymyalgia rheumatica
- Léčba k cíli u dnavé artritidy
- Nutraceutika v terapii gonartrózy: pohled ortopeda
- Osteoporóza a kvalita kostní hmoty
- Léčba chronické bolesti u zánětlivých revmatických onemocnění
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Axiální spondylartritida
- Využitie MRI vyšetrenia pri diagnostike axiálnej spondylartritídy
- Idiopatické zánětlivé myopatie
- Difuzní alveolární hemoragie – akutní, život ohrožující stav v revmatologii
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

