-
Medical journals
- Career
Sepse – jak ji poznat, na co se zaměřit aneb zpět k základům ve světle nové definice
Authors: Jan Horák 1,2; Martin Harazim 1; Thomas Karvunidis 1,2; Jaroslav Raděj 1,2; Ivan Novák 1; Martin Matějovič 1,2
Authors‘ workplace: I. interní klinika LF UK a FN Plzeň 1; Biomedicínské centrum LF UK, Plzeň 2
Published in: Vnitř Lék 2016; 62(7-8): 568-574
Category: Reviews
Overview
Sepse je hlavní příčinou úmrtí na infekční choroby. Její včasné rozpoznání však zůstává základní výzvou současné klinické praxe. V únoru roku 2016 byla uveřejněna nově revidovaná definice sepse (SEPSIS-3). Ta nyní definuje sepsi jako život ohrožující orgánovou dysfunkci způsobenou deregulovanou odezvou hostitelského organizmu na přítomnost infekce. Cílem tohoto článku je seznámit odbornou veřejnost s konceptem nové definice, jeho předostmi a slabinami a předložit názor autorů na jeho praktické využití. Důraz je kladen na základní, ale zevrubné klinické vyhodnocení.
Klíčová slova:
časné rozpoznání sepse – definice sepse – infekce – sepse – septický šokÚvod
Sepse je hlavní příčinou úmrtí na infekční choroby. Každoročně na světě postihne 30 miliónů pacientů, z nichž 25–30 % zemře [1]. Této skutečnosti odpovídají i recentní data českého multicentrického projektu EPOSS (Data-based Evaluation and Prediction of Outcome in Severe Sepsis), poukazujícího na 40% hospitalizační mortalitu pacientů s diagnózou těžké sepse [2]. Pacient hospitalizovaný s těžkou sepsí má 6–10krát vyšší riziko úmrtí než pacient s akutním infarktem myokardu a 4–5krát vyšší, než pokud by byl hospitalizován pro cévní mozkovou příhodu. Existuje jen málo chorobných procesů s tak vysokou mortalitou. Kvalifikované odhady a epidemiologická data dnes jasně hovoří o sepsi jako o jedné z nejčastějších příčin smrti vůbec. Ve vyspělých zemích se počet hospitalizovaných pacientů se sepsí za posledních 8 let zdvojnásobil a je vyšší než počet hospitalizací v důsledku infarktu myokardu. Sepse je ve 30–50 % případů příčinou všech úmrtí v nemocnicích [3]. Infekce komplikované rozvojem sepse také velmi negativně ovlivňují výsledky všech páteřních medicínských oborů. Zvyšuje se povědomí i o dlouhodobých důsledcích sepse. Pacienti, kteří sepsi přežijí, trpí dlouhodobými tělesnými, mentálními a kognitivními poruchami s významnými zdravotními, sociálními a ekonomickými důsledky a mají zvýšené riziko úmrtí ještě řadu let po epizodě sepse. Finanční náklady, které každé zdravotnictví vynakládá na léčbu sepse během hospitalizace, jsou enormní a dosahují 5,2 % celkových výdajů na zdravotnictví ve vyspělých zemích. V roce 2006 bylo v Evropě vynaloženo na hospitalizace způsobené sepsí odhadem 7,6 miliard EUR. Navzdory těmto alarmujícím číslům zůstává vnímání sepse laickou i odbornou veřejností stále významně ve stínu kardiovaskulárních či onkologických onemocnění.
Má tento pacient sepsi?
Klinická viněta
19letý muž se poraní na stehně při sportovní činnosti. Za 24 hod po zranění je přivezen na příjmovou ambulanci rodinou pro bolesti poraněné končetiny, opakovaně zvrací, je febrilní, tachykardický, schvácený.
77letý pacient s anamnézou chronického onemocnění ledvin je přivezen na urgentní příjem pro několik hodin se rozvíjející zmatenost, dušnost a bolesti břicha.
58letá žena čeká na vyšetření neurologem pro 2 dny trvající slabost končetin a celkovou nevůli, v čekárně prodělá synkopu.
Tři pacienti, tři osudy, různé obtíže, ale stejná diagnóza. Sepse.
Vlastní rozpoznání sepse se v průběhu historie značně měnilo. Hippokratés byl prvním, kdo použil termín sépsis (řec. hnití, rozklad) již ve 4. stol. př. n. l., avšak do souvislosti s infekcí se sepse dostala až díky objevům L. Pasteura [4].
První definice sepse vznikla však mnohem později. V roce 1989 nabídl dr. Bone odborné veřejnosti vysvětlení sepse jako stavu, který je způsoben průnikem mikroorganizmů nebo jejich toxinů do krve se současnou reakcí organizmu na tuto invazi [5]. O několik málo let později byla tato definice nahrazena konceptem systémové zánětlivé odezvy (SIRS – systemic inflammatory response syndrome), který, v kombinaci s prokázanou či jen předpokládanou přítomností infekce, definoval sepsi. Těžkou sepsí se pak rozuměl stav, při němž se projevila jedna či více orgánových dysfunkcí. Poslední jednotkou v rámci klasifikace septických stavů z roku 1991 byl septický šok, tedy se sepsí spojená hypotenze nereagující na tekutinovou resuscitaci a vyžadující podávání vazopresorů k udržení dostatečného středního arteriálního tlaku (MAP – mean arterial pressure) a/nebo hladina laktátu v krvi vyšší než 2 mmol/l [6]. V roce 2001 byla kritéria sepse doplněna o rozsáhlý seznam dalších projevů a symptomů. Definice sepse založená společně s přítomností infekce na kritériích SIRS byla opakovaně kritizována pro nedostatečnou senzitivitu a specificitu a přílišný důraz na koncept nadměrné inflamatorní odezvy. Tuto kritiku podpořily i recentní výsledky dokumentující, že 1 z 8 pacientů s diagnózou sepse a současné akutní orgánové dysfunkce nesplňuje ani 2 ze 4 kritérií SIRS [7]. Podobně nemalé procento pacientů s fyziologickou, tj. žádoucí odezvou imunitního systému na nezávažnou infekci tato kritéria snadno naplní, přesto se nejedná o sepsi.
V únoru roku 2016 byla v The Journal of American Medical Association publikována nová definice sepse (Consensus Definitions for Sepsis and Septic Shock) označovaná též jako SEPSIS-3 [8]. Podkladem pro formulaci této definice byla retrospektivní analýza dat 1,2 miliónů pacientů postižených sepsí. Cílem analýzy bylo nalézt taková data, která zvětší přesnost a rychlost stanovení diagnózy sepse a umožní odlišit nekomplikovanou infekci od té, která vede k akutní orgánové dysfunkci, a která je tudíž spojena s významně vyšším rizikem úmrtí. Sepse je nově definována jako život ohrožující orgánová dysfunkce způsobená deregulovanou odezvou hostitelského organizmu na přítomnost infekce (obr. 1). Definice tudíž vyžaduje rozpoznání akutní orgánové dysfunkce. K tomuto účelu je určeno Sequential/Sepsis-related Organ Failure Assessment (SOFA) score [9]. Toto skóre hodnotí pomocí bodové stupnice (0–4 body) respirační funkce, parametry koagulace, jaterní a renální funkce, hemodynamiku a stav vědomí (obr. 2). SOFA skóre vyžaduje řadu laboratorních testů, které nemusí být vždy včas dostupné. S cílem zjednodušit a zrychlit posouzení přítomnosti orgánové dysfunkce způsobené sepsí v přednemocniční péči, na urgentních příjmech a standardních odděleních doporučuje pracovní skupina SEPSIS-3 používat tzv. qSOFA (quickSOFA). Jedná se o 3bodový systém, ve kterém každý bod reprezentuje odchylku v 1 vitálním parametru: nízký krevní tlak (systolický krevní tlak, STK ≤ 100 mm Hg), tachypnoe (≥ 22 dechů/min), změna vědomí (Glasgow Coma Scale < 15), obr. 3. Přítomnost 2 nebo více qSOFA bodů u pacienta s infekcí znamená vysokou pravděpodobnost sepse a významně vyšší riziko nepříznivého průběhu akutního onemocnění. Septickým šokem se nyní z pohledu nové klinické definice rozumí stav, při němž je sepse komplikována rozvojem hypotenze, která navzdory dostatečné objemové resuscitaci vyžaduje k dosažení středního arteriálního tlaku ≥ 65 mm Hg užití vazopresoru a současně je přítomna hladina laktátu nad 2 mmol/l (obr. 4). Tento stav je spojen s více než 40% nemocniční mortalitou [8]. Srovnání původních definicí a definice nové shrnuje schéma.
Image 1. Sepse dle definice SEPSIS-3 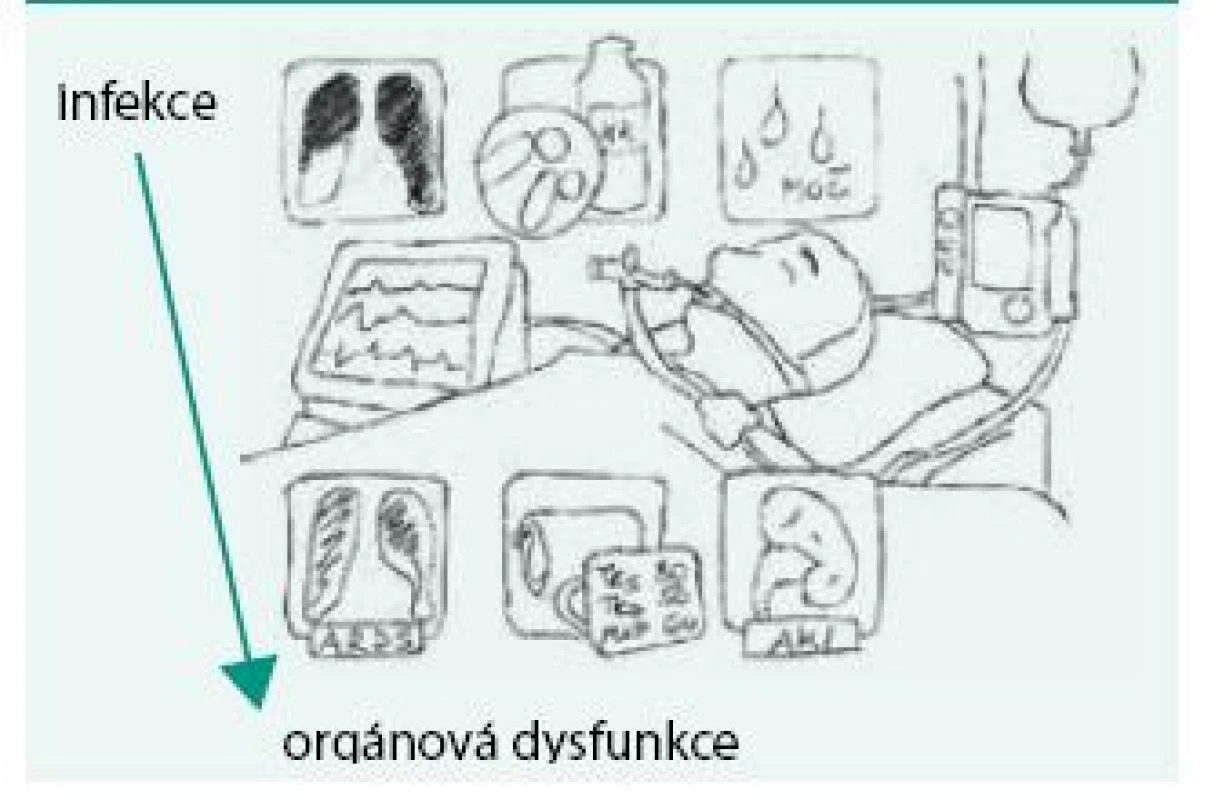
Sepse je nově definována jako život ohrožující orgánová dysfunkce způsobená deregulovanou odezvou hostitelského organizmu na přítomnost infekce Image 2. SOFA kritéria sepse 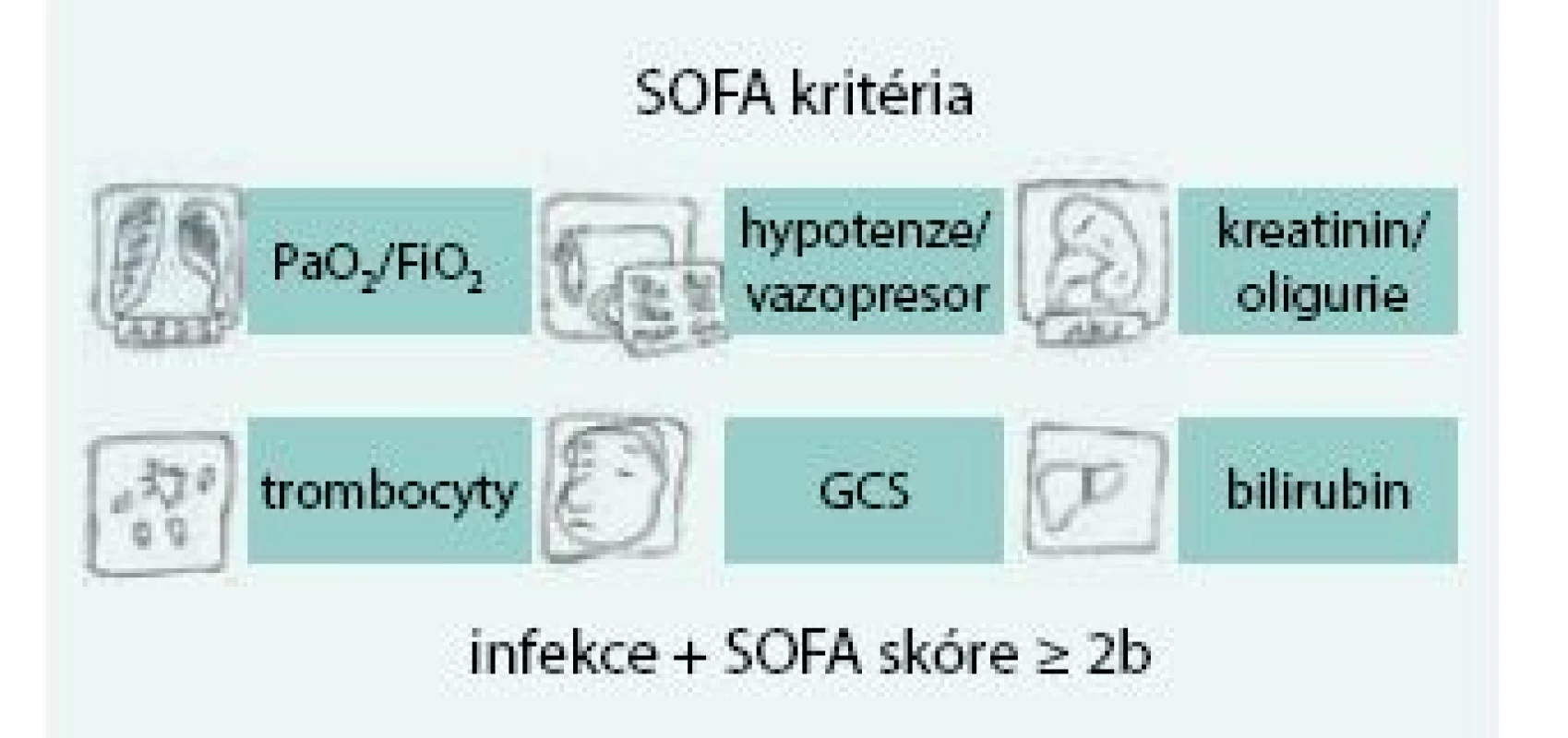
SOFA skóre je měřítkem orgánového postižení u závažných infekcí SOFA – Sequential/Sepsis-related Organ Failure Assessment Image 3. qSOFA kritéria sepse 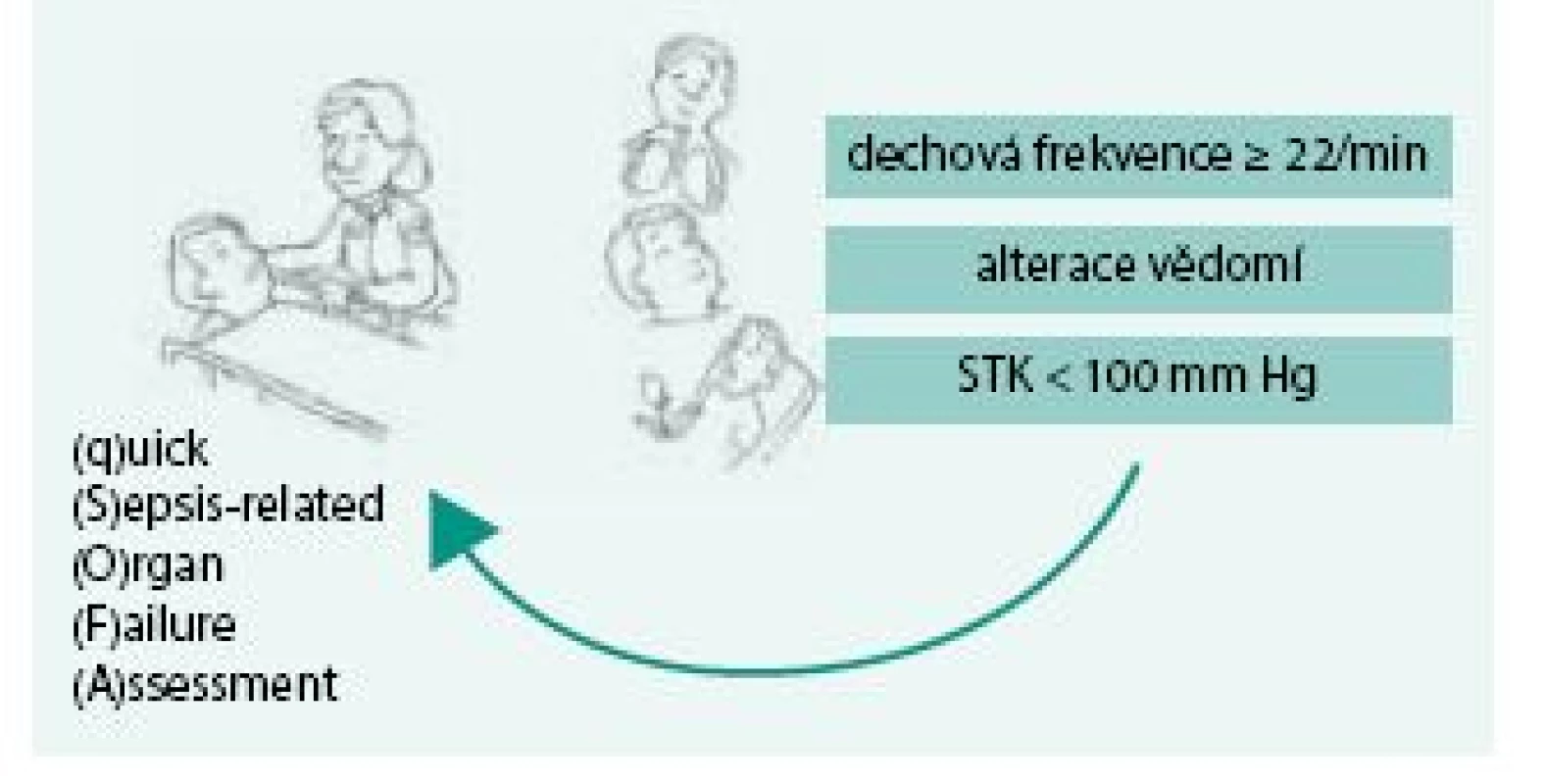
qSOFA (quickSOFA) umožňuje rychlé základní posouzení orgánové dysfunkce způsobené sepsí v přednemocniční péči, na urgentních příjmech a standardních odděleních. Jde o 3bodový systém, v němž každý bod reprezentuje odchylku v 1 vitálním parametru: nízký krevní tlak (systolický krevní tlak, STK ≤ 100 mm Hg), tachypnoe (≥ 22 dechů/min), změna vědomí (Glasgow Coma Scale < 15). Přítomnost 2 nebo více qSOFA bodů u pacienta s infekcí znamená vysokou pravděpodobnost sepse a významně vyšší riziko nepříznivého průběhu akutního onemocnění. Image 4. Septický šok dle SEPSIS-3 
Septický šok je definován jako stav, při němž je sepse komplikována rozvojem hypotenze, která navzdory dostatečné objemové resuscitaci vyžaduje užití vazopresoru k dosažení středního arteriálního tlaku ≥ 65 mm Hg a současně je přítomna hladina laktátu > 2 mmol/l Schéma. Srovnání původních definicí a nové definice sepse 
Navržená definice sepse bude mít bezesporu své oponenty i proponenty. Kritikové budou argumentovat skutečností, že nedokonalá původní definice je nahrazena definicí neméně dokonalou, neověřenou žádnými prospektivními daty. Mohou se objevit výhrady, že čekání na symptomy orgánové dysfunkce mohou paradoxně zpozdit diagnostiku sepse, resp. včasné zahájení léčebných opatření (stejný argument platí pro koncept založený na SIRS). SOFA skóre není univerzálně v klinické praxi používáno a je více prediktorem mortality než testem diagnostickým a jistě nemůže být v izolaci interpretováno jako nástroj pro screening sepse. Nová definice nebude příliš klinicky užitečná v prostředí jednotek intenzivní péče, na nichž jsou základní komponenty qSOFA obvykle modifikovány léčebnými intervencemi (umělá plicní ventilace, analgosedace) a zhoršení stavu v důsledku sepse nastane bez doprovodné změny qSOFA. Na druhou stranu zastánci nového pojetí vidí v nové definici koncepční posun ve vnímání patobiologie sepse – mnoho stavů, které jsou v současnosti kategorizovány jako sepse, jsou prostou infekcí s adaptivní systémovou zánětlivou odezvou, která nevede k poškození funkce orgánů. Původní rozlišení na podjednotky sepse a těžkou sepsi již nemá patobiologické odůvodnění. Naopak původní termín těžká sepse ve světle současných poznatků odpovídá navrhované definici sepse. Předložené pojetí klinickým lékařům umožní přesnější a bezpečnější triage pacientů s infekcí, zlepší vnímání sepse jako skutečné „medical emergency“, tedy stavu, který si zasluhuje neodkladné zahájení diagnostického a terapeutického managementu, včetně rozvahy o dalším směrování pacienta (JIP vs standardní oddělení). Předností qSOFA skóre je neinvazivita, rychlost a možnost opakované reevaluace aktuálního stavu přímo u lůžka nemocného na standardním oddělení nebo na příjmové ambulanci.
Implementace nové definice do klinické praxe
Uveřejnění SEPSIS-3 vyvolalo bouřlivou diskusi a zdaleka ne všechna odborná grémia novou definici přijala. Lze usuzovat, že pro zkušeného lékaře nebude předložený koncept představovat žádnou zásadní změnu v klinickém rozhodování a postupu. Časné rozpoznání sepse a posouzení její závažnosti zůstane pro erudovaného klinika i nadále záležitostí podvědomé aplikace bayesovského modelu – hypotéza H platí, tj. pacient má pravděpodobně sepsi, pokud pozorujeme evidenci E, tj. soubor klinických a komplementárních dat. Součástí takového souboru je simultánní vyhodnocení řady základních klinických informací – vitálních funkcí, přítomnosti a míry systémové zánětlivé odezvy (biomarkery zánětu a infekce, např. jinou váhu bude mít informace o CRP 500 mg/l s leukocytózou 35 × 109/l ve srovnání s CRP 50 mg/l a leukocytózou 12 × 109/l ), pečlivé zhodnocení ukazatelů hemodynamiky, orgánové dysfunkce a tkáňové perfuze (viz níže). Domníváme se však, že SEPSIS-3 poskytuje klinicky užitečný koncepční rámec především pro méně zkušené lékaře či segment zdravotní péče jakými jsou oddělení neselektovaného příjmu, přednemocniční péče či standardní oddělení. Pro tyto oblasti jednoduchá definice a kritéria sepse a septického šoku zdůrazňují 3 nepodkročitelné kroky při klinickém vyhodnocení a managementu pacienta:
- stanovení diagnózy infekce a její včasná léčba (zahrnuje odběry k mikrobiologickému vyšetření včetně hemokultur a včasné podání vhodných antibiotik)
- aktivní posouzení akutní orgánové dysfunkce k rychlé stratifikaci rizika pacienta
- rozpoznání a léčba hypotenze jako jednoho z klíčových určovatelů prognózy (podání balancovaných krystaloidních roztoků a bezprostřední vyhodnocení jejich efektu, konzultace intenzivisty)
Samozřejmě je nutné si uvědomit, že nová definice neznamená změnu v doporučených léčebných postupech [10].
Díky své heterogenitě zůstane sepse stále obtížně stanovitelnou diagnózou, neexistuje žádný zlatý standard pro potvrzení její diagnózy. Vysokou variabilitu a míru subjektivity při stanovení diagnózy sepse dobře dokumentuje recentní průzkum 94 intenzivistů z akademických center, který ukázal značné interindividuální rozdíly při hodnocení 5 fiktivních, ale klinicky velmi reálných případů sepse [11]. Nadále bude existovat nemalá subpopulace pacientů, která nebude odpovídat žádné z definic sepse, přesto tímto syndromem budou trpět. Budou to především pacienti, u kterých je sepse komplikací jiného či jiných závažných akutních či chronických stavů. Podobně jako absence SIRS kritérií, ani negativní qSOFA nevylučuje sepsi, a naopak, jejich přítomnost není jejím absolutním synonymem navzdory současně přítomné infekci (např. ovlivnění kvality vědomí medikací, v perioperačním období, chronickým kognitivním deficitem, tachypnoe způsobená anxietou, bolestí, exacerbací CHOPN). Axiomem pro praxi zůstává: pokud vznikne důvodné klinické podezření na rozvoj sepse (pacient „vypadá nemocně“ nebo se „neočekávaně náhle zhorší“ a nemáme pro to jiné vysvětlení), je třeba vždy postupovat bez ohledu na naplnění či nenaplnění diagnostických kritérií (ať ve smyslu qSOFA či původního SIRS konceptu). Stejně tak nesplnění kritérií v rámci qSOFA nemůže pacienta s předpokládanou či potvrzenou infekcí automaticky vylučovat z úvah o rizikovosti a prospěšnosti z léčby na jednotce intenzivní péče. Nový koncept definice sepse tak jistě není imunní vůči limitacím a čeká jej prospektivní obhajoba a případně další úprava. Přesto se domníváme, že může v pozitivním slova smyslu změnit současné vnímání sepse, včetně způsobu, jakým je tato zásadní problematika komunikována odborné i laické veřejnosti.
Sepse v příjmové ambulanci a na standardním interním oddělení – zpět k základům
Klinický případ
72letý pacient je vyšetřován na příjmové ambulanci pro komunitní pneumonii. Lékař jednotky intenzivní péče je volán ke konzultaci o jeho přijetí na standardní oddělní, nebo JIP. Shledává mírně zmateného pacienta s kyslíkovou maskou, na které má pacient saturaci hemoglobinu kyslíkem 94 % (bez 86 %), palpačně zjišťuje nepravidelný tep 110–135/min, v močovém katétru je koncentrovaná tmavá moč, sběrný močový sáček je po 2 hod vyšetřování na příjmové ambulanci téměř prázdný. Krevní tlak je v rozmezí 95–105/55–65 mm Hg po podání 1 l krystaloidního roztoku. Jaké bude rozhodnutí?
Infekční choroby jsou v USA zodpovědné za více než 10 miliónů návštěv urgentních příjmů ročně a podobná epidemiologická data platí i pro Evropu. U populace pacientů nad 65 let věku jsou infekční příčiny častějším důvodem hospitalizace než srdeční selhání a infarkt myokardu dohromady [12]. Z nich podstatná část (36–54 %) je přijímána na standardní oddělení [13], přičemž u jednoho z 5 takových pacientů se v průběhu dalších 72 hod vyvine septický šok [14]. Český projekt EPOSS ukázal, že prognóza septických pacientů překládaných na JIP ze standardních stanic interních oddělení je významně horší (45,1 %) než pacientů přijímaných primárně z nízkoprahových příjmových oddělení (26,5 %) [2]. Sepse je také nejčastějším důvodem akutní deteriorace pacientů na standardních odděleních. Urgentní příjmy nemocnic, stejně jako standardní oddělení, jsou tak častým místem úvodního vyhodnocení septických pacientů. Zřejmou výzvou je proto rozpoznání pacientů s vysokým rizikem progrese stavu nebo smrti, především u nemocných, kteří nejsou v úvodu zjevně kriticky nemocní.
Jak bylo uvedeno výše, absence některého ze 3 screeningových kritérií závažnosti sepse (qSOFA) nevylučuje riziko progrese sepse do septického šoku či multiorgánové dysfunkce. Kde tedy hledat další příslovečné varovné známky (tzv. red flag symptoms)? Technologiemi odsouvané pečlivé klinické vyšetření (head to toe), využívající naše základní smysly, nadále zůstává zcela zásadní pro vyhodnocení rizika septického pacienta. Periferní tkáně, např. kůže, jsou mezi prvními, na kterých lze klinicky zaznamenat projevy alterované hemodynamiky a tkáňové perfuze u těžkých infekcí.
3 jednoduché a za každé situace vyhodnotitelné varovné známky zahrnují:
- výskyt skvrnitých změn barvy kůže (mramoráž), přítomných typicky v oblasti kolen, případně prstů a uší; jednoduché skóre od 0 do 5 dle velikosti postižené oblasti od kolen směrem do periferie úzce koreluje s mortalitou, nezávisle na systémové hemodynamice [15]; vysoké skóre po 6 hod od úvodní hemodynamické resuscitace je silným prediktorem 14denní mortality [15]
- opožděný kapilární návrat, tj. rychlost obnovy prokrvení nehtového lůžka po jeho 5sekundové stlačení; jeho prodloužení (uniformní validovaná časová definice chybí, uvádí se cut-off 2,5–4,5 s) u obecné populace akutně nemocných koreluje s tíží orgánové dysfunkce, predikuje mortalitu, a naopak, jeho normalizace je spojena s lepším přežitím [16–18]
- teplotní rozdíl mezi předloktím a prsty („chladná akra“) ať již subjektivně posouzený či exaktně změřený; rozdíl větší než 4 °C je známkou významné periferní vazokonstrikce [17]
Kromě vyhodnocení vitálních funkcí, hemodynamiky a posouzení periferní perfuze je třetím základním krokem vyšetření hladiny laktátu. Laktát má u septických stavů stejnou důležitost jako vysoce senzitivní troponin u akutních koronárních syndromů. Je klíčovým markerem metabolického buněčného stresu. Jeho normální hladiny jsou s určitou nadsázkou relativní zárukou fyziologické rezervy. Naopak, i mírně zvýšená hladina laktátu (2,1–3,9 mmol/l) je spojena s vyšší mortalitou, přičemž riziko úmrtí strmě stoupá při hladinách laktátu nad 4 mmol/l. Vyšetření laktátu má význam nejen u hypotenzních pacientů, u nichž zvýšené hodnoty po úvodní tekutinové resuscitaci potvrzují rozvoj septického šoku („overt shock“). Mimořádný přínos má jeho stanovení u další podskupiny septických pacientů s vysokým rizikem nepříznivého průběhu, u tzv. okultního či utajeného šoku. Jedná se o fenotyp sepse charakterizovaný normálním krevním tlakem, u něhož nemusí být přítomny ani jiné známky akutní orgánové dysfunkce či klinické projevy šoku. Pamatujme, že septický pacient může být „nemocnější“ než v danou chvíli vypadá. Tato situace nastává téměř u poloviny septických pacientů, kteří nemají STK < 90 mm Hg [19]. Zvýšené hladiny laktátu u jinak normotenzních pacientů společně s hypertermií představují silné prediktory časného (do 72 hod) rozvoje septického šoku navzdory účinné a včasné antibiotické léčbě [14,20]. Tato podskupina nemocných vyžaduje velmi pečlivé vyhodnocení, nejlépe ve spolupráci s intenzivistou. Pokud se z jakéhokoliv důvodu (dobře v dokumentaci uvedeného) rozhodneme takového pacienta přijmout na standardní oddělení, je nezbytné zajistit jeho pečlivé sledování a frekventní zhodnocení efektu poskytované léčby. Existuje i skupina pacientů, která má perzistující hypotenzi a zcela normální laktát. Bylo by však chybou z uvedených informací vyvodit závěr, že se nejedná o emergentní situaci, vyžadující léčbu na jednotce intenzivní péče. Tato skupina má sice lepší prognózu, ale riziko nepříznivého průběhu stále existuje. Užitečnou může být informace, že pro stanovení laktátu dobře poslouží i venózní krev. Vhodné je laktát odebírat po zaškrcení končetiny jako první, ale obecně krátké zaškrcení neovlivňuje výsledek. Vzhledem k dostupnosti POCT analyzátorů krevních plynů na urgentních příjmech je výsledek k dispozici během minut.
Izolované hodnocení jakéhokoliv klinického či laboratorního ukazatele není dostatečně senzitivním ani specifickým nástrojem k definitivnímu posouzení tkáňové perfuze. V multimodálním pojetí se však jedná o jednoduché, opakovaně snadno vyhodnotitelné a významné varovné známky, které umožňují ve většině případů rychlou triage jakéhokoliv pacienta s akutní deteriorací stavu. Podobně jejich vývoj po úvodní intervenci je důležitým signálem úspěšnosti/neúspěšnosti přijatých léčebných opatření. Nicméně i pacient s rezolucí varovných známek v reakci na úvodní management zasluhuje častou re-evaluaci v prvních 48 hod hospitalizace.
Pacient popsaný v úvodu této podkapitoly patří mezi rizikové pacienty (encefalopatie, hypoxemie, relativní hypotenze, 2hodinová anurie, tachyarytmie) a vyžaduje získání dalších informací a pečlivé vyhodnocení reakce na navazující léčebná opatření. Mezi ně patří úvaha o pokračování v tekutinové intervenci (úvodní dávka balancovaných krystaloidů u nemocných bez známek tekutinového přetížení je 20–30 ml/kg), vyhodnocení a případná korekce febrilií (hypertermie se může podílet na změně mentálního stavu, tachypnoi, tachyfibrilaci síní, ale cave: hypotenze po podání paracetamolu či metamizolu), včasná a odpovídající antimikrobiální terapie s odběrem mikrobiologického materiálu včetně hemokultur. Paralelně probíhá multimodální vyhodnocení klinických známek hypoperfuze, hladiny laktátu, vyšetření acidobazické rovnováhy a laboratorní ukazatele jiné orgánové dysfunkce. Úprava encefalopatie, zklidnění tachyarytmie, nepřítomnost či úprava výše popsaných kožních abnormalit, obnova diurézy a fyziologická hodnota laktátu opravňují k léčbě v podmínkách standardního oddělení. V opačném případě by měl nemocný směřovat na lůžko intenzivní péče, neurčuje-li kontext pacienta jinak (např. terminální stavy chronických chorob).
10 klíčových bodů na závěr
- sepse je hlavní příčinou úmrtí na infekční choroby
- sepsi je nutné vnímat jako „medical emergency“, tedy stav, který vyžaduje neodkladné zahájení diagnostického a terapeutického managementu, včetně rozvahy o dalším směrování pacienta
- sepse je nově definována jako život ohrožující orgánová dysfunkce způsobená deregulovanou odpovědí hostitelského organizmu na přítomnost infekce
- nová definice neznamená změnu v doporučených léčebných postupech
- pamatujme, že septický pacient může být „nemocnější“ než v danou chvíli vypadá
- důvodné klinické podezření na rozvoj sepse (pacient „vypadá nemocně“ nebo se „neočekávaně náhle zhorší“ a nemáme pro to jiné vysvětlení) opravňuje k aktivním krokům bez ohledu na naplnění či nenaplnění kritérií definice
- tři základní kroky zahrnují:
- stanovení diagnózy infekce, včetně její včasné léčby
- posouzení akutní orgánové dysfunkce k rychlé stratifikaci rizika pacienta
- rozpoznání a bezprostřední léčbu hypotenze
- vyhodnocení qSOFA společně s klinickými známkami periferní hypoperfuze a stanovením hladiny laktátu představuje základní úvodní nástroj pro bezpečnou triage pacientů s podezřením na sepsi
- podceňovanou proměnou v úvodním vyhodnocení pacienta je hypotenze; pozdní korekce hypotenze je silným nezávislým faktorem mortality
- pacient s přítomností uvedených „red flags“ vyžaduje aktivaci procesu/systému: příjmový lékař → intezivista, lékař standardního oddělení → intenzivista.
Práce byla podpořena Programem rozvoje vědních oborů Univerzity Karlovy (PRVOUK – projekt P36) a Národním programem udržitelnosti I (NPU I) č. LO1503 poskytovaný Ministerstvem školství, mládeže a tělovýchovy.
prof. MUDr. Martin Matějovič, Ph.D.
matejovic@fnplzen.cz
I. interní klinika LF UK a FN Plzeň
www.fnplzen.cz
Doručeno do redakce 18. 7. 2016
Přijato po recenzi 1. 8. 2016
Sources
1. Fleischmann C, Scherag A, Adhikari NKJ et al. Assessment of global incidence and mortality of hospital-treated sepsis – Current estimates and limitations. Am J Respir Crit Care Med 2016; 193(3): 259–272.
2. Uvizl R, Adamus M, Cerny V et al. Patient survival, predictive factors and disease course of severe sepsis in Czech intensive care units: A multicentre, retrospective, observational study. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2016; 160(2): 287–297.
3. Liu V, Escobar GJ, Greene JD et al. Hospital deaths in patients with sepsis from 2 independent cohorts. JAMA 2014; 312(1): 90–92.
4. Kreymann G, Wolf M. History and definition of sepsis – do we need new terminology? Anasthesiol Intensivmed Notfallmed Schmerzther 1996; 31(1): 9–14.
5. Balk RA, Bone RC. The septic syndrome. Definition and clinical implications. Crit Care Clin 1989; 5(1): 1–8.
6. Bone RC, Balk RA, Cerra FB et al. Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. The ACCP/SCCM Consensus Conference Committee. American College of Chest Physicians/Society of Critical Care Medicine. Chest 1992; 101(6): 1644–1655.
7. Kaukonen KM, Bailey M, Pilcher D et al. Systemic inflammatory response syndrome criteria in defining severe sepsis. N Engl J Med 2015; 372(17): 1629–1638.
8. Singer M, Deutschman CS, Seymour C et al. The third international consensus definitions for sepsis and septic shock (sepsis-3). JAMA 2016; 315(8): 801–810.
9. Vincent JL, de Mendonca A, Cantraine F et al. Use of the SOFA score to assess the incidence of organ dysfunction/failure in intensive care units: results of a multicenter, prospective study. Working group on “sepsis-related problems” of the European Society of Intensive Care Medicine. Crit Care Med 1998; 26(11): 1793–1800.
10. Chvojka J, Matějovič M. Mezinárodní doporučení pro léčbu těžké sepse a septického šoku 2012 – komentovaný výběr. Vnitř Lék 2014; 60(1): 59–67.
11. Rhee C, Kadri SS, Danner RL et al. Diagnosing sepsis is subjective and highly variable: a survey of intensivists using case vignettes. Crit Care 2016; 20 : 89. Dostupné z DOI: <http://dx.doi.org/10.1186/s13054–016–1266–9>.
12. Goto T, Yoshida K, Tsugawa Y et al. Infectious Disease-Related Emergency Department Visits of Elderly Adults in the United States, 2011–2012. J Am Geriatr Soc 2016; 64(1): 31–36.
13. Whittaker SA, Fuchs BD, Gaieski DF et al. Epidemiology and outcomes in patients with severe sepsis admitted to the hospital wards. J Crit Care 2015; 30(1): 78–84.
14. Glickman SW, Cairns CB, Otero RM et al. Disease progression in hemodynamically stable patients presenting to the emergency department with sepsis. Acad Emerg Med 2010; 17(4): 383–390.
15. Ait-Oufella H, Joffre J, Boelle PY et al. Knee area tissue oxygen saturation is predictive of 14-day mortality in septic shock. Intensive Care Med 2012; 38(6): 976–983.
16. Ait-Oufella H, Bige N, Boelle PY et al. Capillary refill time exploration during septic shock. Intensive Care Med 2014; 40(7): 958–964.
17. Lima A, Jansen TC, van Bommel J et al. The prognostic value of the subjective assessment of peripheral perfusion in critically ill patients. Crit Care Medicine 2009; 37(3): 934–938.
18. Hernandez G, Regueira T, Bruhn A et al. Relationship of systemic, hepatosplanchnic, and microcirculatory perfusion parameters with 6-hour lactate clearance in hyperdynamic septic shock patients: an acute, clinical-physiological, pilot study. Ann Intensive Care 2012; 2(1): 44.
19. Rivers E, Nguyen B, Havstad S et al. Early goal-directed therapy in the treatment of severe sepsis and septic shock. N Engl J Med 2001; 345(19): 1368–1377.
20. Casserly B, Phillips GS, Schorr C et al. Lactate measurements in sepsis-induced tissue hypoperfusion: results from the Surviving Sepsis Campaign database. Crit Care Med 2015; 43(3): 567–573.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2016 Issue 7-8-
All articles in this issue
- Určení prevalence potenciálních lékových interakcí u pacientů léčených 5 a více léčivými přípravky v České a Slovenské republice
-
Autoimunitná inzulítída u pacientov s diabetes mellitus 2. typu.
Randomizovaný klinický prieskum u hospitalizovaných pacientov. - Klinický přínos nových bazálních analog inzulinu
- Posuny v nutričních doporučeních pro zdravé obyvatelstvo a jejich dopad pro diabetickou dietu
- Syndrom porušeného vnímání hypoglykemie u diabetes mellitus
- Aktuální možnosti léčby jaterní cirhózy v ambulanci internisty
- Hypoglykemie jako symptom maligního onemocnění v dospělém věku
- Sepse – jak ji poznat, na co se zaměřit aneb zpět k základům ve světle nové definice
- Kůže – zrcadlo vnitřních nemocí
- Vliv antidiabetické léčby na skelet nemocných s diabetes mellitus 2. typu
- Přínos urgentně provedené endoskopické retrográdní cholangiopankreatografie pro terapii akutní pankreatitidy
- Diabetes mellitus 2. typu a srdeční selhání
- Diferenciální diagnostika pleurálních výpotků
- Nežádoucí účinky biologické léčby v revmatologii
-
Možnosti ovlivnění kardiovaskulárního rizika u diabetes mellitus 2. typu antidiabetickou léčbou
Snížení kardiovaskulárního rizika při léčbě liraglutidem – výsledky studie LEADER - Metanol: hrozba intoxikace je stále aktuální
- Diabetická retinopatie: patogeneze a terapeutické implikace
- Diference a poměr sérových koncentrací natria a chloridů u pacientů s hyponatremií
- Cílové hodnoty systolického krevního tlaku
- Klinický význam natriuretických peptidů v diferenciální diagnostice dušnosti
- Srdeční selhání se zachovanou ejekční frakcí
- Blízká budoucnost léčby dyslipidemie u diabetiků 2. typu
- Antagonisté glukagonu otevírají novou cestu v léčbě diabetu 2. typu
- Breviár edukácie diabetika pre internistu
- Prevence a terapie sarkopenie ve stáří
- Granulomatóza s polyangiitidou manifestující se jako diabetes insipidus
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Aktuální možnosti léčby jaterní cirhózy v ambulanci internisty
- Sepse – jak ji poznat, na co se zaměřit aneb zpět k základům ve světle nové definice
- Kůže – zrcadlo vnitřních nemocí
- Prevence a terapie sarkopenie ve stáří
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

