-
Medical journals
- Career
Autoimunitná inzulítída u pacientov s diabetes mellitus 2. typu.
Randomizovaný klinický prieskum u hospitalizovaných pacientov.
Authors: Emil Martinka; Mariana Rončáková; Michaela Mišaníková; Arash Davani
Authors‘ workplace: Národný endokrinologický a diabetologický ústav, n. o., Ľubochňa, Slovenská republika
Published in: Vnitř Lék 2016; 62(7-8): 521-533
Category: Original Contributions
Overview
Pozadie:
Klasifikácia diabetu (DM) so vznikom v dospelom veku nie je vždy jednoduchá a u významnej časti pacientov, u ktorých bolo ochorenie iniciálne klasifikované a liečené ako diabetes mellitus 2. typu (DM2T) sa zisťujú znaky nasvedčujúce prítomnosti autoimunitnej inzulitídy (AI), ktorá je typická pre diabetes mellitus 1. typu (DM1T), resp. latentný autoimunitný diabetes dospelých (LADA).Cieľ:
Zistiť, aký podiel pacientov vedených s DM2T má znaky AI, aký podiel z nich má súčasne nízku sekréciu inzulínu a aké klinické a laboratórne prejavy by sa dali využiť na odlíšenie týchto pacientov.Súbor a metódy:
Randomizovaný klinický prieskum s vopred plánovaným rozsahom hodnotených parametrov u n = 625 pacientov, ktorí boli hospitalizovaní počas prvých 6 mesiacov roku 2016 v Národnom endokrinologickom a diabetologickom ústavu (NEDU) Ľubochňa. Okrem štandardných parametrov bol u každého pacienta vyšetrený C-peptid (CP) a autoprotilátky proti dekarboxyláze kyseliny glutámovej (GADA). Pacienti s pozitivitou GADA (GADA+) boli porovnávaní s pacientmi s GADA- v nasledovných parametroch: pohlavie, vek, vek v čase zistenia DM, trvanie DM, HbA1c, výskyt hypoglykémií, lipidogram, C-peptid nalačno, BMI, obvod pása, výskyt hypoglykémií, prítomnosť mikrovaskulárnych a makrovaskulárnych komplikácií, liečba diabetu a výskyt iných endokrinopatií. GADA+ s nízkym CP boli následne porovnávaní s GADA+ s normálnou hodnotou CP.Výsledky:
Spomedzi 625 pacientov pôvodne klasifikovaných a liečených pre DM2T, 13 % bolo GADA+. Spomedzi nich malo 31 % nízke hodnoty CP (< 0,2 nmol/l) a 28 % hodnoty CP v intermediárnom pásme (0,2–0,4 nmol/l). Medzi GADA+ boli častejšie zastúpené ženy, mali nižší BMI, obvod pása, CP, vyšší HDL-cholesterol, častejší výskyt hypoglykémií a nižšiu celodennú dávku inzulínu. Pacienti s GADA+ a nízkym CP sa od GADA+ s normálnym CP líšili vyššími hodnotami HDL-cholesterolu, nižšími hodnotami triglyceridov a skoršou potrebou inzulínovej terapie. Vyšetrenie GADA a CP s ohľadom na ostatné relevantné charakteristiky viedlo k preklasifikovaniu resp. pridaniu diagnózy DM1T/LADA (ako hlavnej resp. súbežnej príčiny DM) u 2,9 % pacientov z celku a klinicky významný podiel AI bolo možné predpokladať v 6,1 % pacientov.Súhrn:
Výsledky našej štúdie ukazujú, že v patogenéze DM u pacientov iniciálne diagnostikovaných a vedených ako DM2T a so súčasnou prítomnosťou GADA sa paralelne uplatňujú mechanizmy typické tak pre DM2T (inzulínová rezistencia) ako aj DM1T (autoimunitná inzulitída), a to v rôznej intenzite, rôznom pomere a v rôznej časovej následnosti, ako plynulé kontinuum, čo vysvetľuje aj rozdiely medzi jednotlivými pacientmi. Znakmi zdôrazňujúcimi podiel a úlohu AI sú podľa našich výsledkov vysoké titre GADA+, nízke hodnoty CP, skorá potreba liečby inzulínom, prítomnosť ochorení štítnej žľazy, vyššie hodnoty HDL–cholesterolu a nižšie hodnoty triglyceridov. Znakmi zdôrazňujúcimi dominanciu mechanizmov typických pre DM2T (inzulínová rezistencia) bola vyššia hodnota BMI, obvodu pása, normálna hodnota CP, nízka hodnota HDL-cholesterolu, vyššie hladiny triglyceridov, vyšší krvný tlak a hraničné titre GADA.Kľúčové slová:
autoimunitný diabetes mellitus – C-peptid – GADA – HDL-cholesterol – klasifikáciaÚvod
Diabetes mellitus (DM) je veľmi heterogénne ochorenie s účasťou rôznych patofyziologických mechanizmov, ktoré sa uplatňujú na úrovni viacerých orgánov. Klasifikácia do 4 základných typov podľa etiológie (diabetes mellitus 1. typu, diabetes mellitus 2. typu, iné špecifické typy diabetu a gestačný diabetes) z roku 1998 [2] je účelná, mnohokrát však limitovaná neistotou vyplývajúcou práve z heterogenity ochorenia. V bežnej klinickej praxi totiž často nie je jednoduché odlíšiť ani 2 najčastejšie sa vyskytujúce typy diabetu, diabetes mellitus 1. typu (DM1T), ktorý je vo väčšine prípadov podmienený autoimunitnou inzulitídou (AI) s deštrukciou B-buniek pankreasu a následným deficitom inzulínu, od diabetes mellitus 2. typu (DM2T), ktorý je znovu veľmi heterogénne ochorenie s rôznym vzájomným pomerom zníženej citlivosti na inzulín a funkčnej poruchy sekrécie inzulínu s relatívnym nedostatkom, ale aj (neskorším) úbytkom inzulínu v absolútnom množstve, v priebehu vývoja ochorenia. Takéto „čierno-biele“ odlíšenie zrejme ani nie je možné, nakoľko jednotlivé klinické znaky vrátane laboratórnych sa relatívne často prekrývajú a nemožno vylúčiť, že u rovnakého pacienta sa môže súčasne (resp. následne) uplatňovať kombinácia viacerých patofyziologických mechanizmov a ich klinických a laboratórnych prejavov, vrátane tých, ktoré sú charakteristické pre odlišné „etiologické“ typy diabetu [8,16,18,22].
V klinickej praxi sa iniciálna klasifikácia diabetu obvykle zakladá iba na použití klinických charakteristík [1] a u mnohých pacientov je často subjektívna. Nesprávna klasifikácia pritom môže viesť k omylom pri výbere zvolenej liečby, napr. nevhodné použitie niektorých orálnych antidiabetík u pacientov s DM1T ako je napr. sulfonylurea [10,28] či SGLT2 inhibítory.
Podľa literárnych údajov 7–15 % pacientov (s veľkou regionálnou variabilitou), ktorí sú iniciálne klasifikovaní a vedení ako pacienti s DM2T, majú prítomné sérologické markery autoimunitnej inzulitídy a teda, v skutočnosti sa u nich môže jednať o DM1T vyžadujúci odlišný terapeutický prístup [6,7,10,13,26,27]. Hoci ani u pacientov so začiatkom diabetu v dospelom veku nemožno vylúčiť „klasický“ DM1T, vo väčšine prípadov je úbytok sekrécie inzulínu pomalší a liečba inzulínom počas prvých mesiacov až rokov nie je nutná, ako je tomu pri klasickom DM1T. Takýto priebeh sa zvykne označovať aj ako tzv. „latentný autoimunintný DM dospelých“ (LADA) [10,16,19–21,24,27,29–31], ktorý sa považuje za menej agresívnu, pomalšie sa rozvíjajúcu formu DM1T. Diagnóza sa zakladá na prítomnosti aspoň jednej autoprotilátky proti antigénovým štruktúram B-buniek pankreasu (najčastejšie proti dekarboxyláze kyseliny glutámovej) u pacienta s diagnózou diabetu vo veku po 30. roku života, u ktorého liečba inzulínom nie je nutná minimálne počas nasledovných 6 mesiacov od diagnózy diabetu [4,13]. Kritériá pre definíciu LADA sú však predmetom dlhodobých diskusií, rovnako ako aj otázka, či LADA predstavuje iba podtyp DM1T alebo samostatnú (odlišnú) klinickú jednotku [3,5,12,19–22,24]. V porovnaní s klasickým DM1T sú pacienti s LADA viac obézni a majú prítomné aj iné prejavy metabolického syndrómu [8,18,26]. Poukazuje sa tiež na heterogenitu týchto pacientov a viacerí autori ich rozdeľujú do 2 skupín s odlišnými klinickými, autoimunitnými aj genetickými črtami, a to podľa titra autoprotilátok [9,14,15,21,32]. Podľa týchto údajov sa pacienti s vysokými titrami alebo pozitivitou viacerých autoprotilátok vo viacerých črtách podobajú pacientom s DM1T, zatiaľ čo pacienti s nízkymi titrami jednej autoprotilátky sa podobajú (aj z hľadiska progresie úbytku sekrécie inzulínu) pacientom s DM2T [14,32].
S cieľom zistiť, do akej miery pretrváva neistota (chyby) pri klasifikácii DM v dospelom veku v bežnej klinickej praxi, koľko pacientov klasifikovaných a vedených ako DM2T má znaky autoimunitnej inzulitídy a aké klinické markery by sa dali využiť na odlíšeniu pacientov, u ktorých autoimunitná inzulitída zohráva v patogenéze DM zásadnú úlohu ovplyvňujúcu aj terapeutický výber, sme zrealizovali randomizovaný klinický prieskum s nasledovným cieľom:
- zistiť, aký podiel pacientov vedených a liečených ako DM2T má pozitívnu jednu alebo viacero autoprotilátok proti antigénovým štruktúram B-buniek
- aký podiel z týchto pacientov má súčasne zníženú sekréciu inzulínu
- aké antropometrické, klinické a laboratórne prejavy sa združujú s pozitivitou autoprotilátok a súčasne zníženou sekréciou inzulínu
Súbor a metódy
Randomizovaný klinický prieskum s vopred plánovaným rozsahom vyšetrení a hodnotených parametrov u n = 625 pacientov z celého Slovenska vedených a liečených pre diabetes mellitus 2. typu (DM2T), ktorí boli v dobe od 1. 1. 2016 do 30. 6. 2016 hospitalizovaní v Národnom endokrinologickom a diabetologickom ústave (NEDU) Ľubochňa, n.o., z dôvodu nedostatočnej glykemickej kontroly, komplikácií, či iných dôvodov súvisiacich s diagnózou diabetes mellitus.
U všetkých pacientov boli okrem základných a bežne vyšetrovaných antropometrických, klinických a laboratórnych parametrov vyšetrené a vyhodnocované aj nasledovné parametre: C-peptid nalačno, autoprotilátky proti antigénovým štruktúram B-buniek pankreasu (proti dekarboxyláze kyseliny glutámovej – GADA, proti tyrozínovým fosfatázam – IA-2A a proti inzulínu – AIA). Kompletný zoznam hodnotených parametrov je uvedený v tab. 1.
Table 1. Porovnanie základných klinických a laboratórnych parametrov pacientov vedených a liečených ako pacienti s diabetes mellitus 2. typu 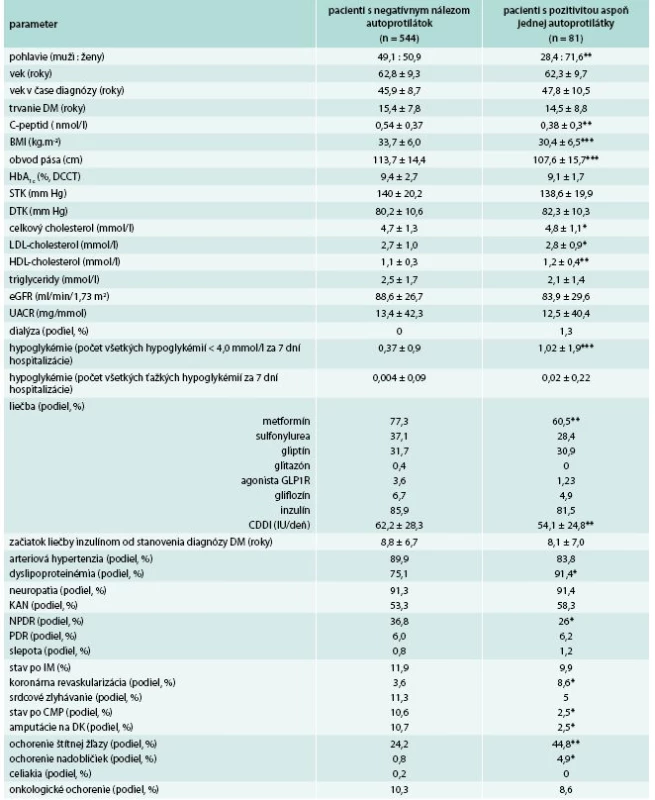
CDDI – celodenná dávka inzulínu CMP – cievna mozgová príhoda DK – dolné končatiny DM – diabetes mellitus GADA – autoprotilátky proti dekarboxyláze kyseliny glutámovej eGFR – vypočítaná glomerulárna filtrácia HDL-C – HDL-cholesterol IM – infarkt myokardu IA-2A – autoprotilátky proti tyrozínovej fosfatáze KAN – kardiálna autonómna neuropatia NPDR – neprolifertívna diabetická retinopatia PDR– proliferatívna diabetická retinopatia TAG – triglyceridy STK – systolický tlak krvi DTK – diastolický tlak krvi UACR – pomer močového albumínu a kreatinínu * štatistická významnosť na úrovni p < 0,05 ** štatistická významnosť na úrovni p < 0,01 *** štatistická významnosť na úrovni p < 0,001 Pacienti s DM2T s pozitivitou GADA alebo IA-2A boli porovnávaní s pacientmi s DM2T bez pozitivity uvedených autoprotilátok v nasledovných parametroch: pohlavie, vek, vek v čase zistenia DM, trvanie DM, HbA1c, lipidogram (celkový cholesterol, LDL-cholesterol, HDL-cholesterol, triglyceridy), C-peptid nalačno, body mass index (BMI), obvod pása, eGFR, pomer albumínu a kreatinínu v moči (UACR), výskyt hypoglykémií, prítomnosť dyslipoproteinemie, prítomnosť artériovej hypertenzie, výskyt neproliferatívnej a proliferatívnej retinopatie, slepoty, periférnej a kardiálnej autonómnej neuropatie, nefropatie, liečby dialýzou, prekonaného infarktu myokardu, koronárnej intervencie, srdcového zlyhávania, cievnej mozgovej príhody, amputácií na dolných končatinách, ochorení štítnej žľazy, ochorení nadobličky, ochorení pečene, celiakie a onkologických ochorení. Porovnávaná tiež bola liečba diabetu podľa jednotlivých skupín antidiabetík, čas do iniciácie liečby inzulínom od diagnózy a celodenná dávka inzulínu. Výskyt hypoglykémií bol hodnotený podľa ich výskytu v 7-bodových glykemických profiloch počas 7 dní hospitalizácie.
Randomizácia bola zabezpečená spôsobom, že boli vyšetrení všetci pacienti s diagnózou DM2T, ktorí boli hospitalizovaní v NEDU Ľubochňa od 1. 1. 2016 do 30. 6. 2016 bez ohľadu na dôvod prijatia, pohlavie, liečbu, trvanie diabetu, komplikácie, bydlisko, či iné charakteristiky.
Antropometrické a klinické parametre
Parametre boli vyšetrené štandardným spôsobom a boli použité hodnoty z chorobopisov pacientov. Výskyt komplikácií diabetu a sprievodných ochorení bol získaný z dokumentácie pacienta, alebo na základe zistenia počas hospitalizácie v NEDU.
Laboratórne parametre
Hodnoty všetkých laboratórnych parametrov boli získané priamym meraním v laboratóriách Alfa Medical.
Hodnotenie autoprotilátok
Pozitivita GADA, IA-2A ako aj IAA sa podľa údajov laboratória uvádza pri hodnote > 1 IU/ml. Hodnoty titrov v rozsahu 1–2 IU/ml sme považovali spornú (hraničnú) pozitivitu. Za jednoznačnú pozitivitu sme považovali hodnoty > 2 IU/ml. Za pozitivitu s nízkym titrom sme považovali hodnoty 2–20 IU/ml a za pozitivitu s vysokým titrom sme považovali hodnoty > 20 IU/ml.
Hodnotenie C-peptidu nalačno
Podľa údajov laboratória sa za normálne hodnoty považuje rozsah 0,27–1,27 nmol/l. Za nízke hodnoty sme považovali hodnoty < 0,2 nmol/l, za intremediárne 0,2–0,4 nmol/l a za normálne sme považovali hodnoty > 0,4 nmol/l.
Ako podklad pre preklasifikovanie typu diabetu z DM2T na DM1T/LADA resp. „pridanie“ diagnózy DM1T/LADA ako hlavnej resp. súbežnej príčiny DM sme použili: vek v čase diagnózy diabetu (DM) viac ako 30 rokov, prítomnosť nízkej hodnoty C-peptidu (< 0,2 nmol/l), jednoznačnú pozitivitu GADA a/alebo IA-2A a liečbu inzulínom, ktorá začala do < 6 rokov od stanovenia diagnózy DM. Ako podklad pre konštatovanie prítomnosti klinicky významnej AI u pacienta sme použili vek v čase diagnózy diabetu (DM) viac ako 30 rokov, prítomnosť intermediárnej hodnoty C-peptidu (0,2–0,4 nmol/l) a jednoznačnú pozitivitu GADA alebo IA-2A.
K štatistickému hodnoteniu boli použité: dvojstranný Studentov t-test, χ2-test a Pearsonov korelačný koeficient (r). Program MedCalc.
Výsledky
Hodnoty základných antropometrických, laboratórnych a klinických údajov o súbore pacientov sú uvedené v tab. 1. V tab. 2–7 sú uvedené charakteristiky pacientov rozdelených podľa príslušných kritérií.
Table 2. Základné klinické a laboratórne charakteristiky súboru pri trvaní diabetu do 10 rokov 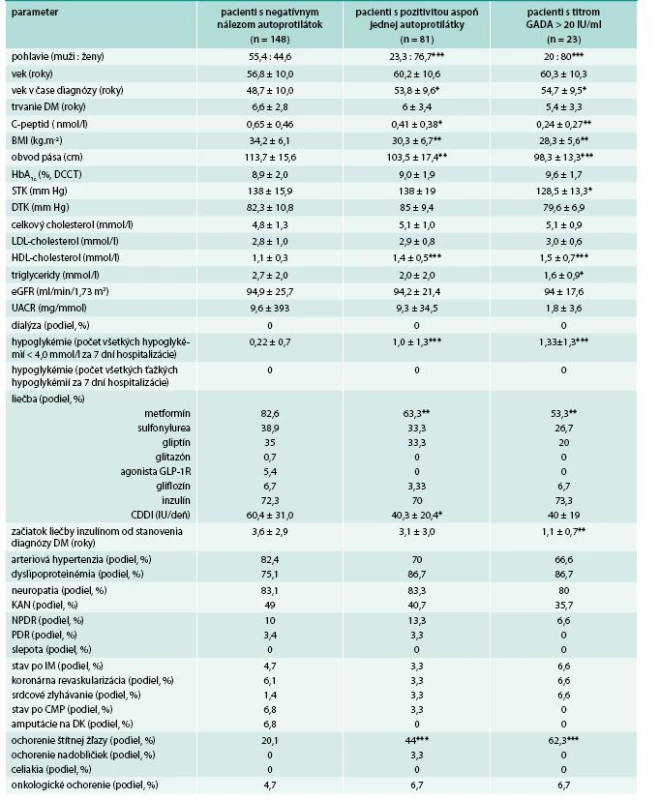
CDDI – celodenná dávka inzulínu CMP – cievna mozgová príhoda DK – dolné končatiny DM – diabetes mellitus eGFR – vypočítaná glomerulárna filtrácia GADA – autoprotilátky proti dekarboxyláze kyseliny glutámovej HDL-C– HDL-cholesterol IA-2A – autoprotilátky proti tyrozínovej fosfatáze IM – infarkt myokardu KAN – kardiálna autonómna neuropatia NPDR – neprolifertívna diabetická retinopatia PDR – proliferatívna diabetická retinopatia TAG – triglyceridy STK – systolický tlak krvi DTK – diastolický tlak krvi UACR – pomer močového albumínu a kreatinínu * štatistická významnosť na úrovni p < 0,05 (v porovnaní s pacientmi s negatívnym nálezom autoprotilátok) ** štatistická významnosť na úrovni p < 0,01 (v porovnaní s pacientmi s negatívnym nálezom autoprotilátok) *** štatistická významnosť na úrovni p < 0,001 (v porovnaní s pacientmi s negatívnym nálezom autoprotilátok) Table 3. Základné klinické a laboratórne charakteristiky pacientov s GADA+ podľa titrov GADA 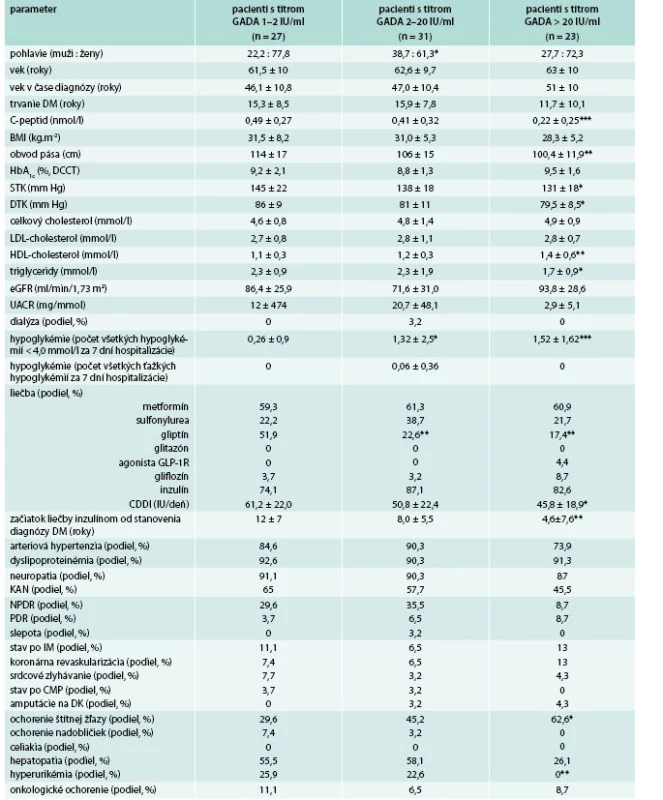
CDDI – celodenná dávka inzulínu CMP – cievna mozgová príhoda DM – diabetes mellitus DK – dolné končatiny GADA – autoprotilátky proti dekarboxyláze kyseliny glutámovej HDL-C – HDL-cholesterol IA-2A – autoprotilátky proti tyrozínovej fosfatáze IM – infarkt myokardu KAN – kardiálna autonómna neuropatia NPDR – neprolifertívna diabetická retinopatia PDR – proliferatívna diabetická retinopatia TAG – triglyceridy STK – systolický tlak krvi DTK – diastolický tlak krvi eGFR – vypočítaná glomerulárna filtrácia UACR – pomer močového albumínu a kreatinínu * štatistická významnosť na úrovni p < 0,05 (v porovnani s pacientmi s hraničnym titrom 1–2 IU/ml) ** štatistická významnosť na úrovni p < 0,01 (v porovnaní s pacientmi s hraničným titrom 1–2 IU/ml) *** štatistická významnosť na úrovni p < 0,001 (v porovnaní s pacientmi s hraničným titrom 1–2 IU/ml) Table 4. Vybraté charakteristiky pacientov, u ktorých bolo možné diagnózu preklasifikovať na DM1T resp. LADA (GADA > 2 IU/ml, začiatok liečby inzulínom do 6 rokov od diagnózy, hodnota C-peptidu < 0,2 nmol/l) 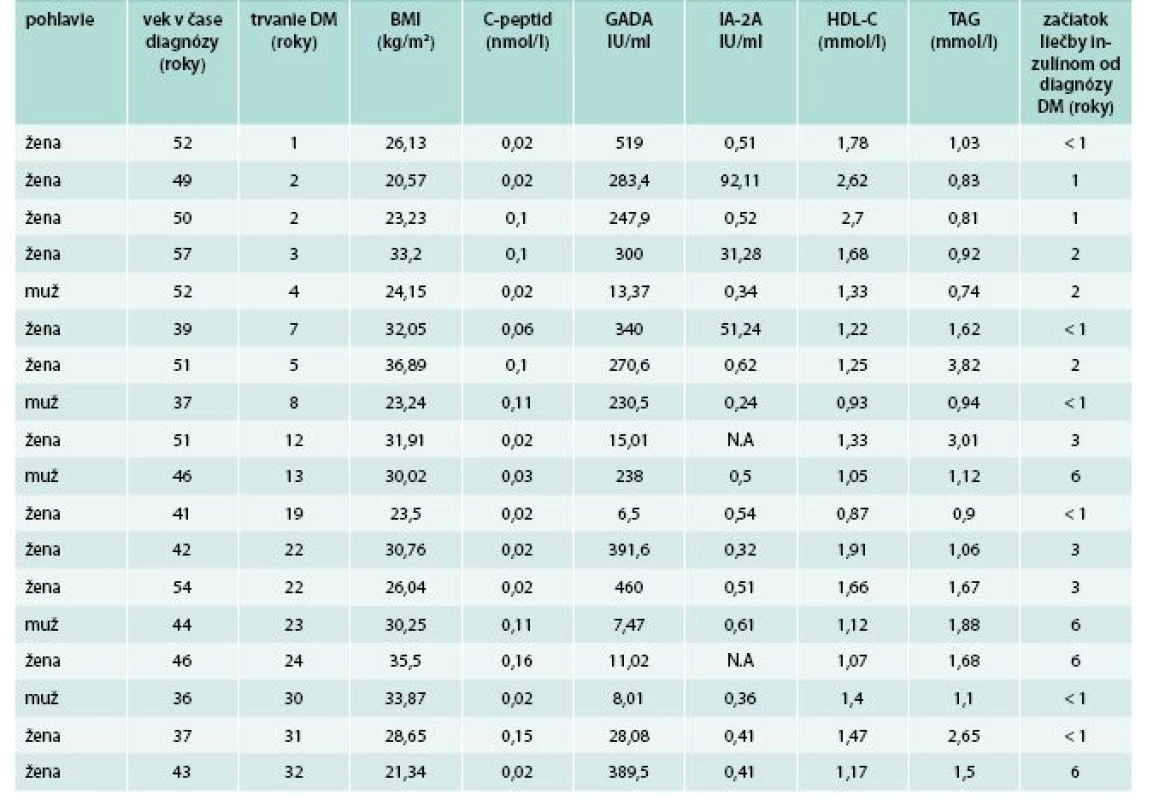
DM – diabetes mellitus GADA – autoprotilátky proti dekarboxyláze kyseliny glutámovej HDL-C – HDL-cholesterol IA-2A – autoprotilátky proti tyrozínovej fosfatáze TAG – triglyceridy Table 5. Vybraté charakteristiky u pacientov s jednoznačnou pozitivitou GADA, trvaním diabetu > 15 rokov a zachovanou sekréciou inzulínu (C-peptid > 0,4 nmol/l) 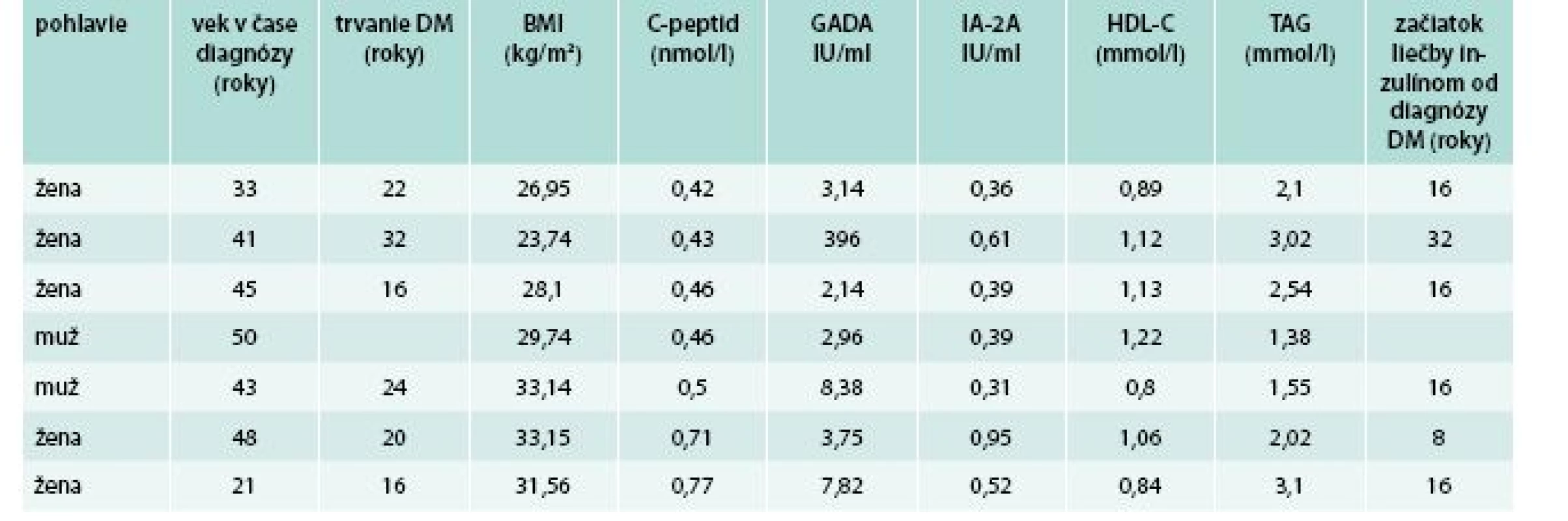
DM – diabetes mellitus GADA – autoprotilátky proti dekarboxyláze kyseliny glutámovej HDL-C – HDL-cholesterol IA-2A – autoprotilátky proti tyrozínovej fosfatáze TAG – triglyceridy Table 6. Vybraté charakteristiky pacientov s hraničnou pozitivitou GADA (1–2 IU/ml) 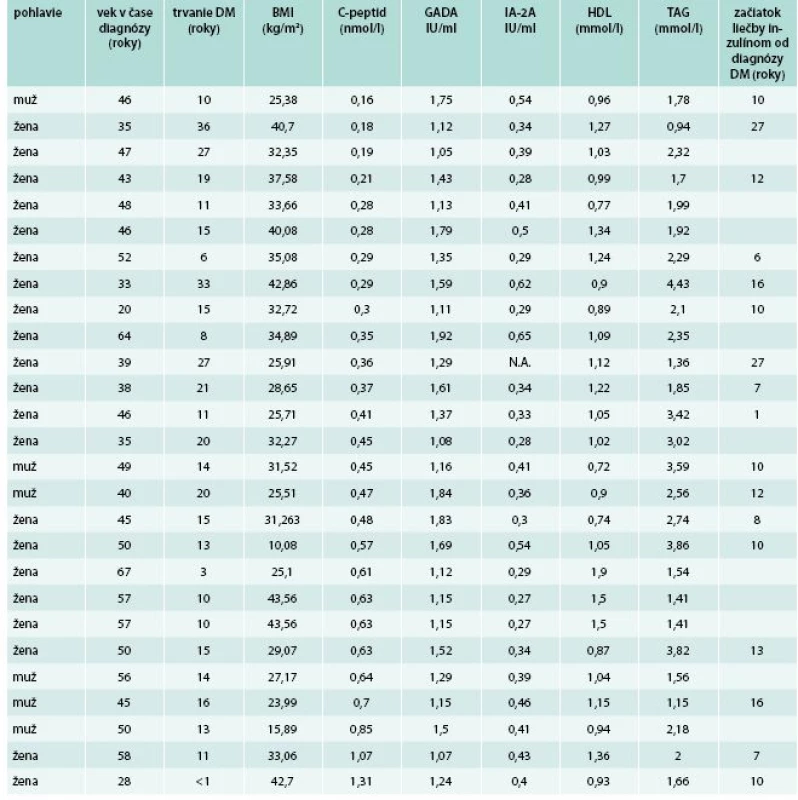
DM – diabetes mellitus GADA – autoprotilátky proti dekarboxyláze kyseliny glutámovej HDL-C – HDL-cholesterol IA-2A – autoprotilátky proti tyrozínovej fosfatáze TAG – triglyceridy Table 7. Základné klinické a laboratórne charakteristiky pacientov s GADA+ rozdelených podľa hodnoty C-peptidu 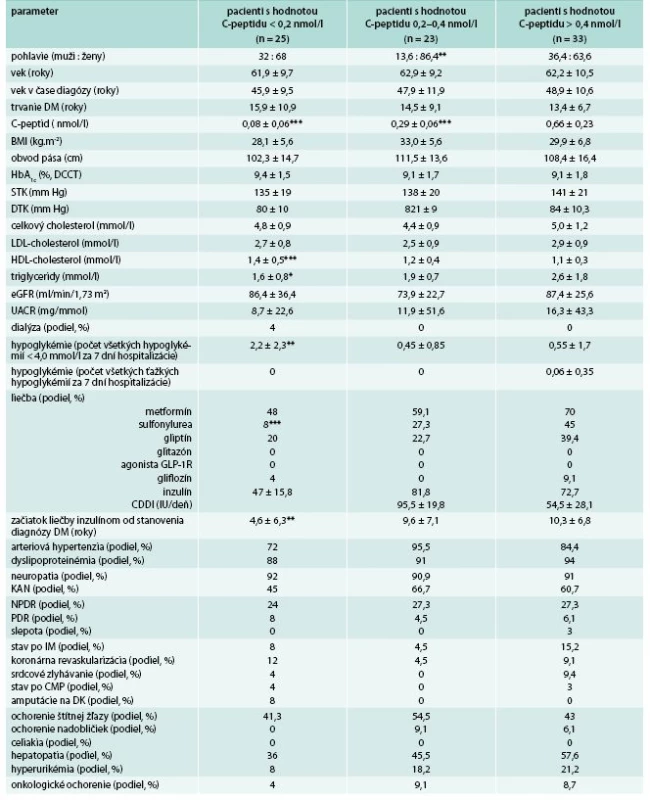
CDDI – celodenná dávka inzulínu CMP – cievna mozgová príhoda DM – diabetes mellitus DK – dolné končatiny eGFR – vypočítaná glomerulárna filtrácia GADA – autoprotilátky proti dekarboxyláze kyseliny glutámovej HDL-C – HDL-cholesterol IA-2A – autoprotilátky proti tyrozínovej fosfatáze IM – infarkt myokardu KAN – kardiálna autonómna neuropatia NPDR – neprolifertívna diabetická retinopatia PDR – proliferatívna diabetická retinopatia TAG – triglyceridy STK – systolický tlak krvi DTK – diastolický tlak krvi UACR – pomer močového albumínu a kreatinínu * štatistická významnosť na úrovni p < 0,05 (v porovnani s pacientmi s hodnotou C-peptidu > 0,4 nmol/l) ** štatistická významnosť na úrovni p < 0,01 (v porovnani s pacientmi s hodnotou C-peptidu > 0,4 nmol/l) *** štatistická významnosť na úrovni p < 0,001 (v porovnani s pacientmi s hodnotou C-peptidu > 0,4 nmol/l) Pozitivita aspoň jedného typu autoprotilátky (vrátane hraničnej) bola zistená u 81/625 (13 %) vyšetrených pacientov s DM2T, pričom najčastejším typom boli autoprotilátky GADA, ktoré boli pozitívne u 81/625 (13 %). Sporná (hraničná) pozitivita, za ktorú sme považovali titre GADA v rozsahu 1–2 IU/ml, bola zistená u 27/625 (4,3 %) pacientov. Nízke titre GADA (hodnoty 2–20 IU/ml) boli zistené u 31/625 (4,96 %) pacientov. Vysoké titre (hodnoty > 20 IU/ml) boli zistené u 23/625 (3,7 %) pacientov, pričom u 19/625 (3,1 %) pacientov titre GADA presahovali 100 IU/ml.
Autoprotilátky proti IA-2A (vo všetkých prípadoch v titroch > 6 IU/ml) boli zistené u 5/625 (0,8 %) pacientov, pričom všetci pacienti s pozitivitou IA-2A mali súčasne prítomné aj GADA v titroch > 20 IU/ml.
Autoprotilátky IAA boli zistené u 3/81 (3,7 %) pacientov s prítomnosťou GADA a u 15/544 (2,7 %) pacientov bez pozitivity GADA a/alebo IA-2A.
U všetkých pacientov bol diabetes diagnostikovaný v dospelom veku. Medzi pacientmi s pozitivitou GADA (GADA+) v porovnaní s tými, u ktorých pozitivita nebola zistená (GADA-), boli signifikantne častejšie zastúpené ženy. Okrem toho, pacienti s GADA+ mali signifikantne nižší BMI, obvod pása, C-peptid, vyšší HDL-cholesterol, častejší výskyt hypoglykémií a nižšiu celodennú dávku inzulínu. U GADA+ bol tiež častejší výskyt ochorení štítnej žľazy, nadobličiek a naopak nižší výskyt amputácií na dolných končatinách a retinoaptie. V ostatných sledovaných parametroch štatisticky významné rozdiely neboli zistené (tab. 1).
C-peptid < 0,4 nmol/l a jednoznačnú pozitivitu GADA malo 38/625 (6,1 %) pacientov z celého súboru. C-peptid < 0,2 nmol/l a jednoznačnú pozitivitu GADA malo 22/625 (3,5 %) pacientov celého súboru. U GADA+ pacientov hodnoty C-peptidu inverzne korelovali s titrami GADA (r = -0,29, p < 0,01), HDL-cholesterolom (r = -0,26, p < 0,05) a pozitívne s triglyceridmi (r = 0,46, p < 0,001). U GADA- pacientov hladiny C-peptidu inverzne korelovali s HDL-cholesterolom (r = -0,33, p < 0,004) a pozitívne s triglyceridmi (r = 0,27, p < 0,001).
U GADA+ vs GADA- pacientov s trvaním diabetu do 10 rokov (tab. 2) boli signifikantne častejšie zastúpené ženy, pacienti tiež mali signifikantne vyšší vek v čase diagnózy diabetu, nižší C-peptid, BMI a obvod pása, vyšší HDL-cholesterol, častejší výskyt hypoglykémií a častejší výskyt ochorení štítnej žľazy. U GADA+ pacientov s titrami GADA > 20 IU/ml boli rozdiely v uvedených parametroch ešte výraznejšie. Okrem toho títo pacienti mali nižší systolický krvný tlak (STK), nižšie triglyceridy a skôr začínali liečbu inzulínom.
Pacienti s vysokým titrom GADA (> 20 IU/ml) mali v porovnaní s pacientmi s hraničnou pozitivitou GADA (1–2 IU/ml) nižší C-peptid, nižší obvod pása, STK aj diastolický krvný tlak (DTK), vyšší HDL-cholesterol, nižšie triglyceridy, nižší výskyt hyperurikémie, častejší výskyt hypoglykémií a vyžadovali skorší začiatok liečby inzulínom a nižšiu celodennú dávku inzulínu (tab. 3).
U 18/625 (2,9 %) pacientov boli okrem GADA+ súčasne zistené aj nízke hodnoty C-peptidu (< 0,2 nmol/l) a potreba skorého začiatku liečby inzulínom (do < 6 rokov) od diagnózy diabetu (tab. 4). Títo pacienti boli preklasifikovaní resp. im bola pridaná diagnóza LADA ako hlavná alebo súbežná príčina diabetu a bola u nich upravená liečba (pridaný inzulín, pokiaľ ho v liečbe nemali a prehodnotené používanie neinzulínových antidiabetík v zmysle SPC).
10 spomedzi 81 GADA+ pacientov (12,3 %) s trvaním diabetu viac ako 15 rokov malo hodnotu C-peptidu > 0,4 nmol/l a 7 z nich (7/10) malo vysoké alebo stredne vysoké titre GADA (tab. 5).
V skupine pacientov s trvaním diabetu < 10 rokov v rámci celého súboru, nízke alebo hraničné hodnoty C-peptidu (< 0,4 nmol/l) boli tak medzi GADA+ (25 %) ako aj GADA- (18 %) pacientmi (neuvedené v tabuľkovej forme). Medzi GADA+ vs GADA- pacientmi v tejto skupine boli častejšie ženy, mali nižší C-peptid, nižší systolický krvný tlak, vyšší výskyt hypoglykémií a nižšiu potrebu inzulínu.
Medzi GADA+ pacientmi malo hodnoty C-peptidu < 0,2 nmol/l 26/81 (32 %) pacientov, hodnoty 0,21–0,4 nmol/l malo 22/81 (27 %) pacientov a hodnoty > 0,4 nmol/l malo 33/81 (41 %) pacientov (tab. 7). Po rozdelení GADA+ pacientov podľa hodnôt C-peptidu mali pacienti s hodnotami C-peptidu < 0,2 nmol/l v porovnaní s pacientmi s hodnotami > 0,4 nmol/l vyššie hodnoty HDL-cholesterolu a nižšie hodnoty triglyceridov, vyšší výskyt hypoglykémií a skorší začiatok liečby inzulínom. GADA+ pacienti s intemediárnymi hodnotami C-peptidu (0,2–0,4 nmol/l) sa v sledovaných charakteristikách nelíšili od pacientov s hodnotami C-peptidu > 0,4 nmol/l (tab. 7).
Pacienti s hraničnými titrami GADA (1–2 IU/ml) predstavovali v našej štúdii podiel 27/625 (4,3 %). V tejto skupine 15/27 (56 % pacientov) malo hodnotu C-peptidu > 0,4 nmol/l, alebo 9/27 (33 %) pacientov malo intermediárne hodnoty (0,2–0,4 nmol/l) aj pri dlhom trvaní diabetu. Mierne znížené hodnoty malo 3/27 (11 %) pacientov po dlhšom trvaní diabetu a neskorou potrebou inzulínovej terapie, resp. bez nej. Pacienti s hraničnou pozitivitou GADA sa okrem signifikantne vyššieho podielu žien a hranične nižšieho BMI a DTK v hodnotených parametroch nelíšili od DM2T s GADA-.
Diskusia
Výsledky tejto štúdie poukazujú na pretrvávajúce problémy pri klasifikácii pacientov s diabetes mellitus v bežnej klinickej praxi. Spomedzi 625 pacientov z celého Slovenska pôvodne klasifikovaných a liečených ako ako diabetici 2. typu, ktorí boli hospitalizovaní v NEDU Ľubochňa, až 81 (13 %) malo pozitívne autoprotilátky proti antigénovým štruktúram B-buniek, pričom vo všetkých prípadoch sa jednalo o autoprotilátky GADA (GADA+) a u časti (5 pacienti) z nich boli súčasne prítomné aj autoprotilátky IA-2A. Hoci výskyt GADA je u hospitalizovaných pacientov pravdepodobne vyšší než v populácii bežných ambulantných pacientov, výsledky poukazujú na pretrvávajúcu neistotu pri klasifikácii DM diagnostikovaným v dospelom veku.
Spomedzi GADA+ malo 31 % pacientov, resp. 4 % pacientov z celého súboru, nízke hodnoty C-peptidu (< 0,2 nmol/l) a 28 %, resp. 3,7 % pacientov hodnoty C-peptidu v intermediárnom pásme (0,2–0,4 nmol/l).
Vyšetrenie GADA a C-peptidu s ohľadom na ostatné relevantné charakteristiky (potreba liečby inzulínom, čas od diagnózy do začatia liečby inzulínom) v našej štúdii umožnilo preklasifikovať resp. „pridať“ diagnózu DM1T/LADA (ako hlavnú resp. súbežnú príčinu DM) až u 2,9 % (s nízkou hladinou C-peptidu, jednoznačnou pozitivitou GADA a potrebou liečby inzulínom do 6 rokov od diagnózy diabetu), resp. u 3,7 % pacientov (vrátane intermediárnych hodnôt C-peptidu). Ak sa nebral do úvahy čas do začatia liečby inzulínom, klinicky významný podiel autoimunitnej inzulitídy bolo možné predpokladať až u 6,1 % pacientov. Táto skutočnosť má nepochybne významný klinický dosah nakoľko u mnohých pacientov bolo potrebné prehodnotiť liečbu v zmysle iniciácie inzulínu (pokiaľ pacient ešte inzulínom nebol liečený) a vysadenia OAD, ktoré sú podľa SPC u pacientov s nízkou hladinou C-peptidu nevhodné, resp. nie je dostatok skúseností pre ich používanie (vrátane SGLT2 inhibítorov či sulfonylurey).
Stanovovania markerov funkcie B-buniek (C-peptid) a autoimunitnej inzulitídy (GADA, IA-2A) u pacientov s DM2T, resp. u pacientov so začiatkom DM v dospelom veku má význam najmä z hľadiska terapeutického manažmentu. Práce iných autorov ukázali, že včasná liečba inzulínom u pacientov s LADA môže napomôcť dlhšie udržať funkcie B-buniek v porovnaní so sulfonylureou, čo môže mať vplyv na prognózu pacienta [27].
Diskutovanou otázkou však je, ktorí pacienti s DM2T sú optimálnymi kandidátmi pre vyšetrenie, či vyšetrenie má opodstatnenie iba v čase diagnózy diabetu alebo aj v neskoršom priebehu diabetu a ako hodnotiť nálezy v kontexte s ostatnými vyšetrovanými parametrami a či je prítomnosť GADA dostatočným kritériom pre preklasifikovanie pacienta.
Kým nižší C-peptid, BMI a obvod pása boli očakávanými nálezmi u pacientov s GADA+, zaujímavým pozorovaním tejto štúdie bolo, že medzi GADA+ pacientmi dominovali ženy a pacienti mali vyššie hodnoty HDL-cholesterolu, vyšší výskyt hypoglykémií a vyžadovali nižšie dávky inzulínu (tab. 1). Naviac, v skupine pacientov s vysokými titrami GADA sa tieto charakteristiky ešte zvýraznili a pribudli k nim aj nižšia hladina triglyceridov, nižší STK a skorší začiatok liečby inzulínom (tab. 3). Vyššie hodnoty HDL-cholesterolu, nižšie hodnoty triglyceridov a častejší výskyt hypoglykémií sa združoval s GADA+ pacientmi aj po rozdelení podľa hladín C-peptidu (tab. 7), keď sa združovali s jeho nízkymi hodnotami. Okrem vyšších hodnôt HDL-cholesterolu a nižších hodnôt triglyceridov mali pacienti s nízkymi hodnotami C-peptidu (< 0,2 nmol/l) vyšší výskyt hypoglykémií, častejšie boli liečení inzulínom a menej prípravkami sulfonylurey. V iných parametroch sa od pacientov s normálnou sekréciou inzulínu nelíšili. Pacienti s intermediárnymi hodnotami C-peptidu sa v sledovaných parametroch od pacientov s normálnymi hodnotami C-peptidu (> 0,4 nmol/l) nelíšili. Hladiny C-peptidu signifikantne inverzne korelovali nielen s titrami GADA (r = -0,29, p < 0,01), ale aj s hodnotami HDL-cholesterolu (r = -0,26, p < 0,05) a signifikantnej pozitívnej korelovali s hodnotami triglyceridov (r = 0,46, p < 0,001). Rovnaké, resp. ešte silnejšie korelácie medzi hladinami C-peptidu a HDL-cholesterolu (r = -0,33, p < 0,01) a triglyceridov (r = -0,27, p < 0,001) boli zistené aj u GADA - pacientov. Korelácie medzi HDL-cholesterolom a C-peptidom boli opakovane popísané aj v literatúre [11,28] a dávajú sa do súvislosti s inzulínovou rezistenciou, ktorú odráža aj hodnota C-peptidu a tiež ako prejav u pacientov s nízkym C-peptidom. Vyšetrenie HDL-cholesterolu a triglyceridov sa tak javí ako užitočný parameter pri hodnotení významu pozitivity GADA.
Výsledky našej štúdie sú v zhode s literárnymi údajmi, ktoré zdôrazňujú heterogenitu a rozdeľujú pacientov s LADA do 2 skupín s odlišnými klinickými, autoimunitnými aj genetickými črtami, a to práve s ohľadom na titre autoprotilátok [14,15,31]. Podľa týchto údajov sa pacienti s vysokými titrami alebo pozitivitou viacerých autoprotilátok vo viacerých črtách podobajú pacientom s DM1T (nízky BMI, prítomnosť iných autoimunitných ochorení), zatiaľ čo pacienti s nízkymi titrami jednej autoprotilátky sa viacerými typickými črtami (obezita a iné prejavy metabolického syndrómu) ako aj pomalšou progresiou úbytku sekrécie inzulínu podobajú pacientom s DM2T [14,15,31].
Rovnako v našej štúdii, vysoké titre GADA+ (a v niekoľkých prípadoch aj dvojkomibácia GADA+ a IA-2A+) dominovali práve u pacientov s nízkym C-peptidom a skorou potrebou liečby inzulínom aj pri krátkom trvaní diabetu a u pacientov, ktorí boli preklasifikovaní na DM1T/LADA, resp. u ktorých sme sa rozhodli „pridať“ diagnózu DM1T/LADA ako súbežnú príčinu DM (tab. 4). Vysoké hodnoty HDL-cholesterolu a nízke hodnoty triglyceridov (poväčšine doprevádzané aj nižším BMI) by mohli byť v súlade s nižším podielom inzulínovej rezistencie u týchto pacientov.
Na druhej strane, štúdia tiež preukázala, že autoprotilátky môžu byť prítomné aj u mnohých pacientov s normálnou hodnotou C-peptidu napriek dlhšiemu trvaniu ochorenia. V našej štúdii 7/81 (8,6 %) GADA+ pacientov malo napriek jednoznačnej pozitivite GADA a trvaniu DM > 15 rokov zachovanú sekréciu inzulínu s hodnotami C-peptidu > 0,4 nmol/l s potrebou iniciácie liečby inzulínom po viac ako 8 rokoch (u väčšiny po > 16 rokoch) a niektorí z nich liečbu inzulínom nevyžadovali vôbec (tab. 5). Aj keď titre GADA+ boli nižšie než u pacientov s nízkymi hodnotami C-peptidu, u väčšiny (7/10) pacientov boli stredne vysoké (tab. 6). Títo pacienti mali nižšie hodnoty HDL-cholesterolu a vyššie hodnoty triglyceridov než predošlá skupina. Takýto nález môže byť predmetom diferenciálne diagnostickej neistoty. Môže napr. poukazovať, že AI typická pre DM1T ako aj iznulínová rezistencia spolu s ostatnými prejavmi metabolického syndrómu typickými pre DM2T môžu u rovnakého pacienta prebiehať súbežne, v rôznom pomere, resp. že predošlá prítomnosť typického DM2T nevylučuje možnosť neskôr nasadajúcej AI s následnými klinickými prejavmi, ako aj, že prítomnosť markerov AI neznamená automaticky DM1T/LADA. V klinickej praxi je preto u takýchto pacientov vhodné sledovania dynamiky C-peptidu.
Inou otázkou je, ako hodnotiť pacientov s hraničnou pozitivitou GADA (1–2 IU/ml). Takýchto pacientov bolo v našom súbore 27/625 (4,3 %). Ako zobrazuje tab. 6, väčšina z nich (15/27, 56 % pacientov) mala hodnotu C-peptidu > 0,4 nmol/l, alebo 9/27 (33 %) pacientov intermediárne hodnoty C-peptidu (0,2–0,4 nmol/l) aj pri dlhom trvaní diabetu. Mierne znížené hodnoty malo 3/27 (11 %) pacientov, po dlhšom trvaní diabetu a neskorou potrebou inzulínovej terapie, resp. bez nej. Pacienti s hraničnou pozitivitou GADA sa okrem signifikantne vyššieho podielu žien a hranične nižšieho BMI a DTK v hodnotených parametroch nelíšili od DM2T s GADA-, čo je opäť v súlade s literatúrou [8,9,14,15,18,21,23,25]. Teda, zatiaľ čo u pacientov s hraničnými (1–2 IU/ml) alebo nízkymi titrami GADA sa môže jednať o spornú (laboratórnu) pozitivitu, resp. málo agresívnu formu AI, u pacientov s vysokými titrami GADA a normálnymi hodnotami C-peptidu nemožno vylúčiť, že AI sa u týchto pacientov objavila (pridala sa) v neskoršom priebehu trvania diabetu, s rizikom urýchlenia úbytku sekrécie inzulínu v budúcnosti. U týchto pacientov je potrebné sledovať ďalší vývoj dynamiky sekrécie inzulínu s navrhovaným odstupom 2–5 rokov.
Komplikujúcim nálezom v našej štúdii bol nález pomerne vysokého podielu GADA - pacientov, u ktorých napriek relatívne krátkemu trvaniu diabetu je hladina C-peptidu nízka alebo hraničná (< 0,4 nmol/l). Títo pacienti sa od GADA+ pacientov s C-peptidom < 0,4 nmol/l líšili iba v častejšom zastúpení žien, nižšom C-peptide, častejšom výskyte hypoglykémie a nižších dávkach inzulínu.
Výsledky našej štúdie nepriamo ukazujú, že v patogenéze DM u pacientov iniciálne diagnostikovaných a vedených ako DM2T a so súčasnou prítomnosťou GADA sa súčasne uplatňujú mechanizmy typické tak pre DM2T (inzulínová rezistencia) ako aj DM1T (autoimunitná inzulitída) a to v rôznej intenzite, rôznom pomere a v rôznej časovej následnosti, ako plynulé kontinuum, čo vysvetľuje aj rozdiely medzi jednotlivými pacientmi. To však nevylučuje, že u niektorých pacientov sa môže skutočne jednať „prakticky výlučne“ len o jeden z typov diabetu.
Avšak, vo všeobecnosti, prítomnosť GADA+ u pacientov vedených ako DM2T neznamená automaticky dôvod pre preklasifikovanie na LADA. Obzvlášť pri hraničných titroch a ak pod pojmom LADA máme na mysli iba pomalšie sa rozvíjajúci podtyp DM1T. A naopak, neprítomnosť GADA nevylučuje nižšie hodnoty C-peptidu a potrebu liečby inzulínom. Nálezy je potrebné hodnotiť v kontexte s ostatnými klinickými a laboratórnymi ukazovateľmi.
Znakmi zdôrazňujúcimi podiel a úlohu autoimunitnej inzulitídy sú podľa našich výsledkov vysoké titre GADA, nízke hodnoty C-peptidu, ako aj skorá potreba liečby inzulínom pri kratšom trvaní diabetu a prítomnosť ochorení štítnej žľazy (poväčšine autoimunitnej genézy). V klinicky využiteľných parametroch sa GADA+ pacienti s nízkou hladinou C-peptidu od GADA+ pacientov s normálnou hladinou C-peptidu líšili iba vyššími hodnotami HDL-cholesterolu, nižšími hodnotami triglyceridov a potrebou skoršieho začiatku liečby inzulínom. V iných hodnotených parametroch sa nelíšili. Znakmi zdôrazňujúcimi dominanciu mechanizmov typických pre DM2T (inzulínová rezistencia) je vyššia hodnota BMI, obvodu pása, normálna hodnota C-peptidu, nízka hodnota HDL-cholesterolu, vyššie hladiny triglyceridov, vyšší krvný tlak a iba hraničné titre GADA.
doc. MUDr. Emil Martinka, PhD.
martinka@nedu.sk
Národný endokrinologický a diabetologický ústav, n.o.,
Ľubochňa,
Slovenská republika
www.nedu.sk
Doručeno do redakce 25. 7. 2016
Přijato po recenzi 1. 8. 2016
Sources
1. American Diabetes Association. Diagnosis and classification of diabetes mellitus. Diabetes Care 2010; 33(Suppl 1): S62-S69.
2. Alberti KGMM, Zimmet PZ. Definition, diagnosis and classification of diabetes mellitus and its complications. Part I. Diagnosis and classifiction of diabetes mellitus – Provisional report of WHO consultation. Diabet Med 1998; 15(7): 539–553.
3. Djekic K, Mouzeyan A, Ipp E. Latent autoimmune diabetes of adults is phenotypically similar to type 1 diabetes in a minority population. J Clin Endocrinol Metab 2012; 97(3): E409-E413.
4. Fourlanos S, Perry C, Stein MS et al. A clinical screening tool identifies autoimmune diabetes in adults. Diabetes Care 2006; 29(5): 970–975.
5. Gale EA. Latent autoimmune diabetes in adults: a guide for the perplexed. Diabetologia 2005; 48(11): 2195–2199.
6. Guglielmi C, Palermo A, Pozzilli P. Latent autoimmune diabetes in the adults (LADA) in Asia: from pathogenesis and epidemiology to therapy. Diabetes Metab Res Rev 2012; 28(Suppl 2): 2S40–2S46.
7. Banerjee S, Bytyci F. Latent Autoimmune Diabetes of Adulthood (LADA): A Commonly Misdiagnosed Condition as Type II Diabetes Mellitus. Medicine Journal 2016; 3(1): 1–5.
8. Hawa MI, Kolb H, Schloot N et al. Adult-onset autoimmune diabetes in Europe is prevalent with a broad clinical phenotype: action LADA 7. Diabetes Care 2013; 36(4): 908–913.
9. Huang G, Xiang Y, Pan L et al. Zinc transporter 8 autoantibody (ZnT8A) could help differentiate latent autoimmune diabetes in adults (LADA) from phenotypic type 2 diabetes mellitus. Diabetes Metab Res Rev 2013; 29(5): 363–368.
10. Itariu BK, Stulnig TM. Autoimmune Aspects of Type 2 Diabetes Mellitus – A Mini-Review. Gerontology 2014; 60(3): 189–196.
11. Laakso M, Voutilainen E, Sarlund H et al. Inverse relationship of serum HDL and HDL2 cholesterol to C-peptide level in middle-aged insulin-treated diabetics. Metabolism 1985; 34(8): 715–720.
12. Leslie RDG, Williams R, Pozzilli P. Clinical review: type 1 diabetes and latent autoimmune diabetes in adults: one end of the rainbow. J Clin Endocrinol Metab 2006; 91(5): 1654–1659.
13. Leslie RD, Kolb H, Schloot NC et al. Diabetes classification: grey zones, sound and smoke: Action LADA 1. Diabetes Metab Res Rev 2008; 24(7): 511–519.
14. Lohmann T, Kellner K, Verlohren HJ et al. Titre and combination of ICA and autoantibodies to glutamic acid decarboxylase discriminate two clinically distinct types of latent autoimmune diabetes in adults (LADA). Diabetologia 2001; 44(8): 1005–1010.
15. Liu L, Li X, Xiang,G et al. Latent autoimmune diabetes in adults with low-titer GAD antibodies: similar disease progression with type 2 diabetes: a nationwide, multicenter prospective study (LADA China Study 3). Diabetes Care 2015; 38(1): 16–21.
16. Martinka E. Úskalia klasifikácie diabetes mellitus zo začiatkom v dospelom veku. Lufema: Bratislava 1999.
17. Migdalis IN, Iliopoulou V, Kalogeropoulou K et al. Correlation between high density lipoprotein cholesterol and C-peptide in sulfonylurea-treated diabetic patients. J Med 1989; 20(5–6): 349–355.
18. Mollo A, Hernandez M, Marsal JR et al. [Action LADA 8]. Latent autoimmune diabetes in adults is perched between type 1 and type 2: evidence from adults in one region of Spain. Diabetes Metab Res Rev 2013; 29(6): 446–451. Erratum in Diabetes Metab Res Rev 2013; 29(8):693.
19. Palmer JP, Hampe CS, Chiu H et al. Is latent autoimmune diabetes in adults distinct from type 1 diabetes or just type 1 diabetes at an older age? Diabetes 2005; 54(Suppl 2): 2S62–2S67.
20. Pietropaolo M, Barinas-Mitchell E, Pietropaolo SL et al: Evidence of islet cell autoimmunity in elderly patients with type 2 diabetes. Diabetes 2000; 49(1): 32–38.
21. Pettersen E, Skorpen F, Kvaløy K et al. Genetic heterogeneity in latent autoimmune diabetes is linked to various degrees of autoimmune activity: results from the Nord-Trøndelag Health Study. Diabetes 2010; 59(1): 302–310.
22. Redondo MJ. LADA Time for a New Definition. Diabetes 2013; 62(2): 339–340.
23. Reghina AD, Florea S, Constantin M et al. The Impact of Thyroid Autoimmunity on the Clinical and Diabetes Parameters of Patients with Latent Autoimmune Diabetes in Adults. Exp Clin Endokinol Diabetes 2015; 123(9): 543–547.
24. Rolandsson O, Palmer JP. Latent autoimmune diabetes in adults (LADA) is dead: long live autoimmune diabetes! Diabetologia 2010; 53(7): 1250–1253.
25. Sachdeva N, Paul M, Badal D et al. Preproinsulin specific CD8+ T cells in subjects with latent autoimmune diabetes show lower frequency and different pathophysiological characteristics than those with type 1 diabetes. Clin Immunol 2015; 157(1): 78–90.
26. Shields BM, Peters JL, Cooper Ch et al. Can clinical features be used to differentiate type 1 from type 2 diabetes? A systematic review of the literature. BMJ Open 2015; 5(11): e009088. Dostupné z DOI: <http://dx.doi.org/10.1136/bmjopen-2015–009088>.
27. Thunander M, Petersson C, Jonzon K et al. Incidence of type 1 and type 2 diabetes in adults and children in Kronoberg, Sweden. Diabetes Res Clin Pract 2008; 82(2): 247–255.
28. Tiittanen M, Huupponen JT, Knip M et al. Insulin treatment in patients with type 1 diabetes induces upregulation of regulatory T-cell markers in peripheral blood mononuclear cells stimulated with insulin in vitro. Diabetes 2006; 55(12): 3446–3454.
29. Tuomi T, Carlsson A, Li H et al. Clinical and genetic characteristics of type 2 diabetes with and without GAD antibodies. Diabetes 1999; 48(1): 150–157.
30. Tuomi T, Groop LC, Zimmet PZ et al. Antibodies to glutamic acid decarboxylase reveal latent autoimmune diabetes mellitus in adults with a non-insulin-dependent onset of disease. Diabetes 1993; 42(2): 359–362.
31. Turner R, Stratton I, Horton V et al. [UK Prospective Diabetes Study Group]. UKPDS 25: autoantibodies to islet-cell cytoplasm and glutamic acid decarboxylasefor prediction of insulin requirementin type 2 diabetes. Lancet 1997; 350(9087): 1288–1293.
32. Zampetti S, Capizzi M, Spoletini M et al. [NIRAD Study Group]. GADA Titer-Related Risk for Organ-Specific Autoimmunity in LADA Subjects Subdivided according to Gender (NIRAD Study 6). J Clin Endocrinol Metab 2012; 97(10): 3759–3765.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2016 Issue 7-8-
All articles in this issue
- Určení prevalence potenciálních lékových interakcí u pacientů léčených 5 a více léčivými přípravky v České a Slovenské republice
-
Autoimunitná inzulítída u pacientov s diabetes mellitus 2. typu.
Randomizovaný klinický prieskum u hospitalizovaných pacientov. - Klinický přínos nových bazálních analog inzulinu
- Posuny v nutričních doporučeních pro zdravé obyvatelstvo a jejich dopad pro diabetickou dietu
- Syndrom porušeného vnímání hypoglykemie u diabetes mellitus
- Aktuální možnosti léčby jaterní cirhózy v ambulanci internisty
- Hypoglykemie jako symptom maligního onemocnění v dospělém věku
- Sepse – jak ji poznat, na co se zaměřit aneb zpět k základům ve světle nové definice
- Kůže – zrcadlo vnitřních nemocí
- Vliv antidiabetické léčby na skelet nemocných s diabetes mellitus 2. typu
- Přínos urgentně provedené endoskopické retrográdní cholangiopankreatografie pro terapii akutní pankreatitidy
- Diabetes mellitus 2. typu a srdeční selhání
- Diferenciální diagnostika pleurálních výpotků
- Nežádoucí účinky biologické léčby v revmatologii
-
Možnosti ovlivnění kardiovaskulárního rizika u diabetes mellitus 2. typu antidiabetickou léčbou
Snížení kardiovaskulárního rizika při léčbě liraglutidem – výsledky studie LEADER - Metanol: hrozba intoxikace je stále aktuální
- Diabetická retinopatie: patogeneze a terapeutické implikace
- Diference a poměr sérových koncentrací natria a chloridů u pacientů s hyponatremií
- Cílové hodnoty systolického krevního tlaku
- Klinický význam natriuretických peptidů v diferenciální diagnostice dušnosti
- Srdeční selhání se zachovanou ejekční frakcí
- Blízká budoucnost léčby dyslipidemie u diabetiků 2. typu
- Antagonisté glukagonu otevírají novou cestu v léčbě diabetu 2. typu
- Breviár edukácie diabetika pre internistu
- Prevence a terapie sarkopenie ve stáří
- Granulomatóza s polyangiitidou manifestující se jako diabetes insipidus
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Aktuální možnosti léčby jaterní cirhózy v ambulanci internisty
- Sepse – jak ji poznat, na co se zaměřit aneb zpět k základům ve světle nové definice
- Kůže – zrcadlo vnitřních nemocí
- Prevence a terapie sarkopenie ve stáří
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

