-
Medical journals
- Career
Role metabolického syndromu v gastroenterologii
Authors: Petr Dítě 1; Jitka Přinosilová 1; Lenka Dovrtělová 2; Tomáš Kupka 1; Hana Nechutová 3; Bohuslav Kianička 3; Bohdana Břegová 1; Lumír Kunovský 4; Arnošt Martínek 1; Miroslav Souček 3
Authors‘ workplace: Oddělení gastroenterologie, metabolizmu a výživy Interní kliniky LF Ostravské univerzity a FN Ostrava, přednosta doc. MUDr. Arnošt Martínek, CSc. 1; Katedra podpory zdraví, Fakulta sportovních studií MU Brno, vedoucí katedry Mgr. Lenka Dovrtělová, Ph. D. 2; Gastroenterologické oddělení II. interní kliniky LF MU a FN u sv. Anny Brno, přednosta prof. MUDr. Miroslav Souček, CSc. 3; Chirurgická klinika LF MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Zdeněk Kala, CSc. 4
Published in: Vnitř Lék 2015; 61(9): 792-798
Category: Reviews
Overview
Cíl:
Metabolický syndrom a jeho komponenty se významně podílejí na vzniku nemocí nejen kardiovaskulárních, ale i zažívacího traktu a pankreatobiliárního systému. Cílem naší studie je podat komplexní přehled o chorobách, u nichž je metabolický syndrom indukujícím rizikovým faktorem, respektive u nichž ovlivňuje průběh onemocnění.Výsledky:
Metabolický syndrom je významným rizikovým faktorem indukce gastroezofageálního refluxu a jeho komplikace, kterou je Barrettův jícen. Metabolický syndrom byl popsán jako choroba s těsným vztahem k idiopatickým střevním zánětům, onemocnění biliárního stromu a pankreatu. Akutní pankreatitida, jak její vznik u obézních osob, tak tíže jejího průběhu, jsou v těsné korelaci s metabolickým syndromem, podobně průběh chronické, především alkoholické pankreatitidy. Výzvou je studium nealkoholické steatopankreatitidy, především z pohledu funkce pankreatických B-buněk u obézních osob. Nealkoholická steatóza jater a její formy mohou vést až ke vzniku stadia jaterní cirhózy a jsou rizikem jaterního karcinomu. Metabolický syndrom byl popsán i jako rizikový faktor u populační studie karcinomu tlustého střeva.Souhrn:
Metabolický syndrom a jeho komponenty jsou významným rizikovým faktorem v indukci řady benigních i maligních chorob gastrointestinálních a pankreatobiliárních. Systémový přístup k ovlivnění metabolického syndromu a jeho komponent je tak jedním z významných přístupů ovlivnění vzniku a průběhu nejen kardiovaskulárních onemocnění.Klíčová slova:
idiopatický střevní zánět – metabolický syndrom – nádory trávicího traktu – obezita – pankreatopatie – refluxní nemoc – steatohepatitidaÚvod
Metabolický syndrom, včetně jeho komponent, je v současné době závažným stavem z pohledu zdravotního i celospolečenského. Postihuje přibližně 25–30 % populace [1,2]. Po diskusích o jeho definici byl v roce 2009 přijat konsenzus [3] akceptovaný i v naší republice a označený jako harmonizovaná definice metabolického syndromu [4,5]. Při použití těchto diagnostických kritérií platí, že 3 pozitivní kritéria z celkového počtu 5 činí diagnózu pozitivní:
Harmonizovaná definice metabolického syndromu 3 a více kritérií: (2009):
- zvětšený obvod pasu (specifické pro populace a země)
- zvýšené triacylglyceroly (≥ 1,7 mmol/l) nebo zvýšených triacylglycerolů
- snížený HDL-cholesterol < 1,0/1,3 mmol/l nebo medikamentózní léčba sníženého HDL-cholesterolu
- zvýšený krevní tlak (TK systolický ≥ 130 mm Hg nebo TK diastolický ≥ 80 mm Hg) nebo medikamentózní léčba již diagnostikované hypertenze
- zvýšená glykemie nalačno (≥ 5,6 mmol/l) nebo medikamentózní léčba hyperglykemie
V patogenezi metabolického syndromu existuje řada významných faktorů, jejichž společný výskyt je považován za veličinu nikoliv nahodilou. Mezi tyto faktory patří hyperglykemie při současně přítomné inzulinové rezistenci, přítomnost dyslipidemie s proaterogenními faktory, arteriální hypertenze, chronická inflamace a její modulátory, endoteliální dysfunkce a přítomnost obezity (obr. 1).
Image 1. Patogenetické faktory metabolického syndromu 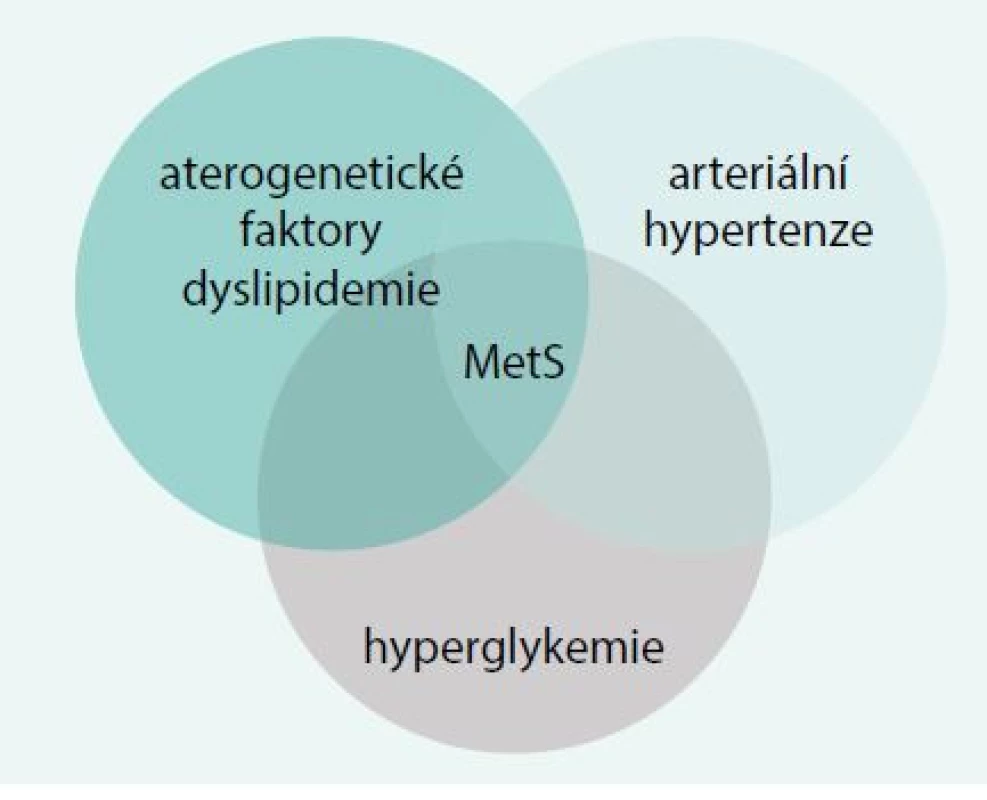
Významnou roli v patofyziologii metabolického syndromu má zvýšená aktivita sympatického nervového systému, snížená aktivita dřeně nadledvin a hormonální aktivita tukové tkáně [5]. Zvláště významným (z klinického hlediska) je současná přítomnost obezity. Bez nadsázky lze hovořit o obezitě jako společensky závažné endemii. Existuje řada důkazů, že abdominální obezita je markerem „dysfunkční tukové tkáně“ a je stěžejním rizikovým faktorem vzniku nejen kardiovaskulárních onemocnění, ale i např. abnormálního ukládání tuku v játrech a ovlivnění jejich morfologie a funkce [6]. U osob s abdominálním typem obezity bylo prokázáno, že je alterován metabolizmus neesterifikovaných mastných kyselin, spolu s inzulinovou rezistencí pak významný faktor pro vznik kardiovaskulárních onemocnění [7]. Hypertrofie intraabdominálních adipocytů a přítomná hyperlipidemie je znakem selhání antilipolytického efektu inzulinu [8,9]. Porucha jaterního metabolizmu neesterifikovaných mastných kyselin je provázena zvýšenou produkcí triacylglycerolů a poklesem lipoproteinu A. Tuková tkáň je ovšem i významným endokrinním orgánem s produkcí řady cytokinů, zánětlivých mediátorů, včetně TNFα [10]. Tuková tkáň, infiltrovaná makrofágy, má znaky tkáně zánětlivé [11], se specifickou produkcí proteinu adiponektinu, který hraje roli v regulaci prozánětlivých adipokinů [12]. U viscerální obezity je produkce adiponektinu snížena [13]. Uvedené faktory jsou zásadními patogenetickými faktory v indukci kardiovaskulárních onemocnění. Změny metabolizmu mastných kyselin, chronická inflamace a její mediátory jsou rovněž významnými faktory podílejícími se na indukci benigních i maligních gastroenterologických onemocnění.
Metabolický syndrom/obezita a gastroenterologická onemocnění
Metabolický syndrom a jeho jednotlivé komponenty nejsou pouze významnými faktory v indukci nemocí kardiovaskulárních, ale v posledních letech se vyskytla řada studií, které prokazují vztah metabolického syndromu k chorobám gastrointestinálního traktu, jater a systému pankreatobiliárního.
Metabolický syndrom v gastroenterologii:
- onemocnění jícnu – gastroezofageální reflux (GERD), Barrettův jícen
- nemoci střev – idiopatické střevní záněty
- nemoci jater – steatohepatitida
- nemoci biliární – cholecystopatie
- nemoci pankreatu – akutní, chronická pankreatitida
- nádorová onemocnění
Onemocnění jícnu – gastroezofageální reflux (GERD), Barrettův jícen
Gastroezofageální reflux (GERD) je definován jako chronické, multifaktoriální onemocnění, u něhož anatomické a funkční faktory hrají principiální roli a jehož symptomatologie neodpovídá vždy endoskopickému nálezu [14]. Klinicky se onemocnění manifestuje 3 formami, a to jako reflux nonerozivní, reflux erozivní s endoskopickým obrazem na sliznici jícnu a jako Barrettův jícen [15]. Tyto 3 formy charakterizují 3 odlišné stavy, ale některé studie ukazují, že asi 10 % neerozivních ezofagitid se může vyvinout do formy erozivní [16].
Vztah mezi GERD a metabolickým syndromem je charakterizován přítomností několika rozdílných indukčních mechanizmů. Lee et al [17] u 3 669 osob provedli celkem 4 endoskopická vyšetření per protocol a posuzovali roli metabolického syndromu na průběh refluxní ezofagitidy. Výsledky studie prokázaly, že kromě jícnových příznaků jsou dynamickým procesem, který je akcelerován přítomností metabolického syndromu, zvláště u obézních kuřáků. Podobné výsledky popsal Ieradi et al [16]. Významným faktorem, indukujícím GERD, je obezita [17]. Přestože ve většině případů jsou obézní osoby osobami polymorbidními, je obezita považována za zcela samostatný, nezávislý rizikový faktor. Jakkoliv stále exaktní patofyziologické vysvětlení tohoto faktu chybí, existuje řada zajímavých hypotéz. Viscerální typ obezity, spojený se zvětšenou hodnotou obvodu stěny břišní (abdominal waist circumference), je spojen se zvýšením nitrobřišního tlaku, což prostřednictvím zvýšeného intragastrického tlaku může vést je vzniku refluxu [18]. Tato skutečnost, kromě zvýšení tlakového gradientu mezi žaludkem a jícnem [19], zvyšuje i riziko vzniku hiátové hernie, anatomické změny, která je velmi často s GERD spojena [20]. Významné jsou rovněž změny funkce – nedostatečnost dolního jícnového svěrače u obézních, stejně tak jako necharakteristické změny jícnové motility [20]. Konečně je třeba zmínit i skutečnost, že viscerální tuk je metabolicky aktivní látkou, v jejíž přítomnosti dochází k poklesu produkce sérových hladin protektivních cytokinů, jako je adiponektin, a k významnému vzestupu sérových hladin prozánětlivých cytokinů, jako jeTNFα, IL1β nebo IL6 [21]. Obezita je v indukci GERD nepochybně faktorem významným.
Významnou komponentou metabolického syndromu je inzulinová rezistence. Role inzulinové rezistence u gastroezofageálního refluxu byla sledována skupinou Hsu et al [22]. Prokázali vzájemný vztah metabolického syndromu, inzulinové rezistence a erozivní ezofagitidy. Zajímavé je pozorování, že zvýšené riziko vzniku erozivní ezofagitidy u osob s inzulinovou rezistencí je nezávislé na přítomnosti dalších komponent metabolického syndromu. V publikaci jsou sledované faktory a jejich pozitivita, jako je mužské pohlaví, arteriální hypertenze, kouření, abúzus alkoholu, abnormální hladiny triglyceridů nebo změny LDL-cholesterolu, významnými faktory v indukci GERD a erozivní ezofagitidy, ale jejich přítomnost není podmínkou manifestace příznaků provázejících gastroezofageální reflux.
Zvláštní formou GERD je tzv. noční reflux. Epizody refluxu v noci jsou sice méně časté, ale trvají déle, což při minimální noční produkci slin a omezení polykacích vln vede ke zhoršené očistě sliznice jícnu. Burgerhart et al sledovali vztah mezi BMI a noční expozicí sliznice jícnu kyselým obsahem za použití 24hodinové pH-metrie a jícnové manometrie [23]. U skupiny osob s normální tělesnou váhou nalezli dobu expozice sliznice jícnu významně kratší než u osob s nadváhou. Podobně tomu bylo i u skupiny osob obézních a u obou skupin rozdíl proti osobám s normální tělesnou váhou byl statisticky významně odlišný.
Barrettův jícen, jako jedna z forem GERD, je charakterizován histomorfologickými změnami stěny jícnu s typickým nálezem intestinální metaplazie. Barrettův jícen je stavem, který je označován jako prekurzor vzniku adenokarcinomu jícnu. Riziko jeho vzniku u osob s Barrettovým jícnem je 40–50krát vyšší než u běžné populace [21]. Ryan et al sledovali skupinu 102 osob, z nichž u 46 % byla splněna diagnostická kritéria Barettova jícnu a u 78 % osob byla diagnostikována centrální obezita. U osob s metabolickým syndromem a Barrettovým jícnem byla prokázána nižší hladina leptinu se současným zvýšením CRP. U 60 % osob s dlouhým segmentem Barrettova jícnu byl zjištěn metabolický syndrom až u 92 % osob s centrální obezitou. Nález dlouhého segmentu Barrettova jícnu byl dále spojen s hyperinzulinemií a významně zvýšenou hladinou prozánětlivého cytokinu IL6. Z výsledků této studie je zřejmé, že metabolický syndrom může být významným rizikovým faktorem, především z pohledu extenze intestinální metaplazie, u osob s Barrettovým jícnem [21]. Současně z těchto výsledků vyplývá i konsekvence mezi nálezem adenokarcinomu jícnu a Barrettovým jícnem u osob s obezitou [24]. Zatímco obezitu a metabolický syndrom lze považovat za rizikový faktor vzniku Barrettova jícnu a adenokarcinomu jícnu, Rubenstein et al [25] publikovali sdělení, podle něhož u osob s gluteofemorální formou obezity naopak prokázali její možný protektivní efekt ve vztahu ke vzniku Barrettova jícnu i adenokarcinomu jícnu.
Metabolický syndrom a idiopatické střevní záněty
Idiopatické střevní záněty, především jejich 2 hlavní formy, ulcerózní kolitida a morbus Crohn, jsou společensky neobyčejně závažná onemocnění. V minulosti byl popsán vzájemný vztah těchto střevních chorob, kardiovaskulárních chorob a diabetes mellitus 2. typu. Obezita ovlivňuje aktivitu a průběh idiopatických střevních zánětů a je známým rizikovým faktorem kolorektálního karcinomu. U osob s m. Crohn průkaz zmnožení mezenterické tukové tkáně [26] vede ke zvýšenému riziku vzniku komplikací a je spojen s vyšší aktivitou onemocnění. Nemocní s m. Crohn mají přítomnu inzulinovou rezistenci ve více než 25 %, zatímco osoby s ulcerózní kolitidou pouze v 16 %. Nemocní s ulcerózní kolitidou a inzulinovou rezistencí měli významně vyšší body mass index (BMI), leukocytózu, hyperinzulinemii, zvýšenou triglyceridemii, urikemii a CRP [27]. Metabolický syndrom byl prokázán statisticky významně častěji u osob s ulcerózní kolitidou (29,5 %) oproti osobám s Crohnovou nemocí (17,7 %). Metabolický syndrom u nemocných s idiopatickými střevními záněty byl nejčastěji nalezen ve věkové skupině osob starších 45 let (55 %).
Jaterní onemocnění
Jaterním onemocněním, u jehož vzniku hraje významnou roli metabolický syndrom, je nealkoholická steatohepatitida [28]. Onemocnění je charakterizováno nahromaděním tuku v játrech, poškozením jaterních buněk a přítomností zánětu. Mechanizmus vzniku steatohepatitidy nevyvolané alkoholem není přesně znám, za významné etiologicky rizikové faktory je považována inzulinová rezistence, oxidační stres a produkce zánětlivých cytokinů [29,30]. Hromadění tuku v játrech, za přítomnosti inzulinové rezistence, je označeno jako non-alcoholic fatty liver disease (NAFLD). U některých nemocných se NAFLD, díky přítomnosti parenchymatózních zánětlivých změn, může vyvinout do stadia označeného jako NASH, event. jaterní fibrózy až cirhózy, což je graficky vyjádřeno ve studii Neuschwandera-Tetri [31], obr. 2. Dle americké prospektivní kohortové studie z roku 2011 NAFLD není sice spojeno se zvýšeným rizikem vzniku kardiovaskulárních onemocnění nebo malignit, avšak u 15–30 % vzniká jaterní fibróza, která u 12–25 % nemocných vyústí až do jaterní cirhózy [32]. Jiné studie však na nebezpečí zvýšené mortality u osob s NAFLD naopak upozorňují, již jen skutečnost indukce jaterní cirhózy jako život ohrožujícího stavu tento názor podporuje [33,34]. Je evidentní, že metabolický syndrom a jeho komponenty jsou významným rizikovým faktorem v etiologii steatohepatitidy. Dietoterapie obezity a fyzické cvičení mohou být těmi faktory, které mohou obraz steatohepatitidy v klinice ovlivnit [35].
Image 2. Jaterní menifestace metabolického syndromu 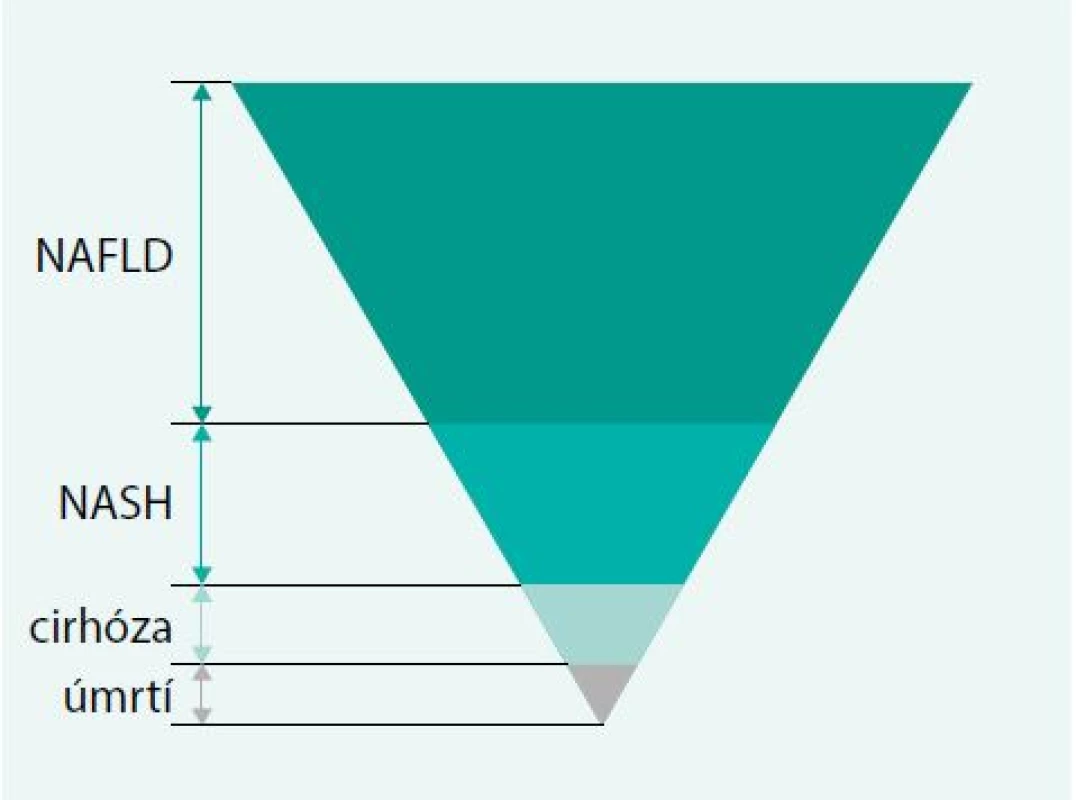
Neuschwander-Tets BA. Am J Med Sci 2005; 330(6): 326–335 Nemoci žlučového systému
Cholelitiáza patří v ekonomicky vyspělých zemích mezi častá onemocnění, tímto onemocněním trpí 15–30 % osob. Nejčastěji jsou zastoupeny cholesterolové konkrementy. Pohlaví, věk a především přítomnost obezity patří mezi významné rizikové faktory [36]. Koller et al prokázali u souboru osob s NAFLD prevalenci cholelitiázy v 47 % oproti osobám bez NAFLD, u nichž prevalence cholelitiázy činila pouze 26 %, rozdíl je vysoce statisticky významný [37]. Tato skutečnost je neobyčejně, z pohledu společenského, velmi závažná, protože jak endoskopická, tak chirurgická terapie jsou nákladné. Přitom tato onemocnění lze dieto-terapeutickými opatřeními a obecně změnou životní režimu (fyzické cvičení) pozitivně ovlivnit, i proto jsou označena jako nemoci „preventabilně senzitivní“. V roce 2010 publikované sdělení Aty et al prokázalo, že metabolický syndrom, diabetes mellitus a cholelitiáza jsou úzce spojeny zvláště s komplikovaným průběhem cholelitiázy. Dle autorů je proto doporučováno zvážit, zda přítomnost metabolického syndromu není indikací k provedení profylaktické cholecystektomie [38]. Výsledky řady studií tak jasně prokázaly, že metabolický syndrom je významným rizikovým faktorem vzniku cholelitiázy a jeho přítomnost může negativně ovlivnit průběh nemoci [39,40].
Nemoci slinivky břišní
Epidemiologická data ukazují, že incidence akutní pankreatitidy koreluje se vzestupem prevalence obezity. Sawalhi et al sledovali soubor 140 osob s akutní pankreatitidou a hodnotili u nich obvod v pase, BMI a antropometrická data společně se škálou dat biochemických. 62,8 % sledovaného souboru splňovalo kritéria metabolického syndromu. Přítomnost metabolického syndromu je u osob s akutní pankreatitidou nepochybná, ale neovlivňuje, na rozdíl od obezity, především stupeň akutní pankreatitidy [41]. Obezita, která se významně jeví jako rizikový faktor cholelitiázy, je tímto samozřejmě i rizikovým etiologickým faktorem indukce akutní biliární pankreatitidy. Zajímavá práce byla publikována v roce 2010 Ammannem et al: u osob s alkoholickou formou pankreatitidy sledovali ovlivnění incidence této formy nemoci současně přítomnou nadváhou [42], jednalo se o dlouhodobou prospektivní studii. Celkový interval sledování činil 18 let. Nadváha u této skupiny osob byla zjištěna u 54,2 % osob, obezita byla zjištěna u 15 % osob, u kontrolní skupiny výskyt nadváhy činil 37,7 % a obezity 3,1 %. Překvapivě nadváha při BMI > 25 neovlivnila významně progresi exokrinní nedostatečnosti pankreatu ani diabetes mellitus. Mortalita nebyla rozdílná mezi osobami s alkoholickou formou pankreatitidy a současně přítomnou obezitou a nemocnými s alkoholickou formou pankreatitidy bez obezity. Zjištění autorů, že obezita není faktorem ovlivňujícím průběh a progresi chronické pankreatitidy, je překvapující. To ovšem nevylučuje známou skutečnost, že chronická pankreatitida, kromě jiného, vzniká jako důsledek opakujících se akutních pankreatitid a ty jsou, jak jsme již uvedli, spojeny s rizikovým faktorem – obezitou. V posledních letech je stále více věnována pozornost stavu označenému jako pankreatická steatóza. Tento stav hromadění tuku v pankreatu má řadu synonym, jako lipomatóza pankreatu, nealkoholická pankreatická steatóza nebo prostá pankreatická steatóza [43]. Prvé sdělení, systematicky se zabývající pankreatickou steatózou, bylo publikováno již v roce 1933 Olgilviem [44]. Porovnával přítomnost tuku v exokrinní části pankreatu u obézních osob a u osob s normální tělesnou hmotností. Zjistil, že steatóza pankreatu se vyskytla průměrně u 17,1 % obézních osob a pouze u 9,4 % osob bez obezity a současně popsal hypertrofii Langerhansových ostrůvků u skupiny obézních. Pankreatická steatóza, klinicky nejlépe detekovatelná neinvazivními zobrazovacími metodami, dle Pezzilliho studie není v příčinném vztahu k diabetes mellitus, ale statisticky významný je vztah k současné přítomnosti metabolického syndromu [43]. Nabízí se otázka, zda nonalkoholická pankreatická steatóza (NAPS) není stavem porovnatelným s jaterním onemocněním – NAFLD. Kim et al [45] vyšetřili přítomnost steatopankreatitidy u 198 osob s diabetes mellitus 2. typu. Dle jejich nálezů průkaz přítomnosti pankreatické steatózy striktně koreluje s aterosklerotickými změnami karotických arterií u neobézních jedinců s diabetes mellitus 2. typu. Autoři upozorňují na možný rizikový vztah mezi pankreatickou steatózou u neobézních osob a rizikem kardiovaskulárních onemocnění, avšak blíže nekomentují možný vliv diabetes mellitus. Není stále jasné, zda pankreatická steatóza ovlivní exokrinní pankreatickou funkci, současné práce jsou stále ojedinělé a kazuistické [46].
Nádorová onemocnění a metabolický syndrom
Metabolický syndrom a jeho komponenty, zvláště pak obezita, jsou považovány za významné rizikové faktory zvyšující riziko vzniku různých nádorů trávicího traktu, biliárního systému a pankreatu [47]. Jakkoliv stále přesná identifikace vzniku malignity není jasná, chronická inflamace [48], která je typickým znakem provázejícím obezitu, je nepochybně faktorem významným. Dalšími předpokládanými mechanizmy jsou změny imunity [49], přítomnost adipocytokinů jako leptin, adiponektin [50], insulin-like growth faktor a inzulinemie [51] nebo změny střevní mikroflóry [52].
Karcinom jícnu je nejčastěji spojován s přítomným gastroezofageálním refluxem [53], významnou roli hraje samozřejmě přítomnost cytokinů, např. TNFα nebo Il6, které se jako mediátory zánětu podílejí na vzniku malignit sekvencí zánět – nádor. Tento mechanizmus je znám v indukci nádoru nejen jícnu, ale i střeva a jater [54]. Výskyt karcinomu jícnu je zvláště častý u tzv. viscerálního typu obezity, u nějž je tuková tkáň potentním zdrojem adipocytokinů a dalších prozánětlivých substancí. Zajímavý je průkaz korelace mezi hladinou leptinu a nálezem prekurzoru jícnového adenokarcinomu – Barrettovým jícnem u obézních mužů. V současné době je obezita považována za nepochybný rizikový faktor karcinomu jícnu.
Kolorektální karcinom je onemocněním, jehož výskyt je zvýšen u osob obézních, resp. u stavů s obezitou souvisejících [55]. V rámci screeningu kolorektálního karcinomu je efektivním přístupem odstranění adenomových střevních polypů, prekurzorů možného nádorového bujení. Z tohoto pohledu je proto významné zjištění Ferlitsche et al [56], že u obézních osob je vyšší výskyt adenomových polypů, především u mužů, u nichž jsou polypy zjištěny přibližně o dekádu dříve, než tomu je u obézních žen. Tato data podporují názory, zda nepřihlédnout v rámci screeningu kolorektálního karcinomu k této odlišnosti u obézních osob. Mechanizmy, kterými se tuková tkáň na indukci kolorektálního karcinomu podílí, jsou intenzivně sledovány, prokázán byl vztah mezi kolorektálním, žaludečním a plicním nádorovým bujením a nízkou hladinou cirkulujícího adiponektinu, naopak zvýšena je produkce IL6, který byl v experimentu prokázán jako induktor kancerogeneze. Nejen adipocytokiny, ale i další substance, resp. mechanizmy jsou spojovány s kolorektálním karcinomem, např. přítomnost oxidativního stresu, vzestup koncentrace IGF1 nebo mitogenní aktivace protein kinázy (MAPK) prostřednictvím p38.
Hepatocelulární karcinom. Obezita spolu s diabetes mellitus 2. typu a NFLD jsou uznávány jako rizikové faktory jaterního karcinomu [57]. Přitom vznik hepatocelulárního karcinomu u osob s NAFLD není podmíněn současnou přítomností jaterní cirhózy [58]. Pokročilá jaterní onemocnění jsou provázena nálezem zvýšené hladiny adiponektinu, jaterní adenokarcinom byl prokázán u osob s jaterní cirhózou, ale i bez jaterní cirhózy, v těchto případech je typicky zvýšen adiponektin i leptin [59]. Inzulinová rezistence u diabetiků 2. typu je statisticky významně spojena se vznikem hepatocelulárního karcinomu v terénu hepatitidy C [60]. Hyperadiponektinemie je významným fenoménem vzniku hepatocelulárního karcinomu, zvláště díky zvýšení apoptózy prostřednictvím aktivace kaspázy 3.
Karcinom pankreatu patří stále mezi neobyčejně agresivně se chovající nádory, 5leté přežití není vyšší než 5 % všech případů. Důvodem je především pozdní diagnostika nemoci, takže jediné efektivní – kurabilní řešení, kterým je chirurgická terapie, je proveditelná u méně než 20 % případů. Mezi prokazatelně významné rizikové faktory patří kouření, diabetes mellitus, rizikovým faktorem může být sporadická chronická pankreatitida a některé hereditární stavy. Dalším významným rizikovým faktorem je obezita. Především centrální typ obezity, u něhož je častěji nalezena inzulinová rezistence, byl potvrzen jako významný rizikový faktor vzniku karcinomu pankreatu [61]. Arsian et al [62] sledovali vztah obezity a karcinomu pankreatu u 2 170 osob s karcinomem a u 2 209 kontrol. Nalezli vysoké riziko u osob s BMI > 35. Podobně Genkinger et al [63] prokázali riziko karcinomu pankreatu o 47 % vyšší u osob s BMI > 30 oproti skupině osob s BMI v rozmezí 21,0–22,8. Je zřejmé, že u obézních osob je zvýšené riziko karcinomu pankreatu a riziko stoupá se stupněm obezity. Hyperinzulinemie a hyperestrogenizmus v souvislosti s metabolickým syndromem a diabetes mellitus jsou klíčovými faktory indukce karcinomu pankreatu u obézních osob [64].
Závěr
Metabolický syndrom a jeho komponenty – obezita, arteriální hypertenze, hyperglykemie, diabetes mellitus a dyslipidemie – jsou závažnými faktory ovlivňujícími zdravotní stav populace. Kromě známých faktorů, jako je exprese prozánětlivých cykokinů a adipocytokinů, obecně chronická inflamace, inzulinová rezistence nebo oxidativní stres a jeho mediátory, se podílejí na ovlivnění histomorfologie i funkce, především v oblasti kardiovaskulárního systému, ale i orgánů gastrointestinálního traktu, včetně jater a systému pankreatobiliárního [65,66]. Nepochybný je vztah mezi gastroezofageální refluxní nemocí a obezitou, podobně průkazný je vztah mezi Barrettovým jícnem a metabolickým syndromem. Zajímavé je pozorování, že v indukci změn Barretova jícnu hraje významnou roli současná přítomnost inzulinové rezistence jako součást metabolického syndromu.
Nonalkoholická jaterní steatóza je významně často identifikována u obézních osob. Část osob s tímto onemocněním končí ve stadiu jaterní cirhózy, která patří mezi rizikové faktory indukce hepatocelulárního karcinomu, který je ale přítomen i u obézních osob bez současné jaterní cirhózy.
Pankreatická steatóza, jako jeden z obrazů metabolického syndromu a především obezity, patří mezi pankreatologické výzvy, stále ale není dostatek důkazů, zda nemoc probíhá podobně jako jaterní steatohepatitida, nebo zda a jak stav indukuje změny exokrinní a endokrinní pankreatické funkce.
Mezi nádorovými nemocemi u obézních osob je metabolický syndrom závažným rizikovým faktorem kolorektálního karcinomu. U souboru 580 000 mužů a žen byl metabolický syndrom, za účasti dalších faktorů, jako je dyslipidemie a arteriální hypertenze, jednoznačně potvrzen jako faktor zvyšující riziko karcinomu [67].
Karcinom pankreatu patří mezi nádorová onemocnění v současnosti s nejmenší efektivitou konzervativní terapie. Nemoc může být dlouho asymptomatická, a i proto přichází nemocní většinou již s pokročilou formou nemoci. Diagnóza je tak pozdní a stav je chirurgicky neléčitelný. Avšak i diferenciální diagnostika fokálních pankreatických lézí, včetně autoimunitní pankreatitidy a karcinomu pankreatu, je velmi svízelná.
Metabolický syndrom a jeho komponenty, zvláště obezita, jsou v současnosti celosvětovým zdravotním problémem, který vyžaduje přijetí zásadních opatření. I přesto, že není jednoznačně prokázáno, jak např. zásadně úprava tělesné hmotnosti ovlivní mortalitu, nikoliv jen morbiditu, změna dietních návyků, pravidelné fyzické cvičení, a to cíleně již u malých dětí, se stávají opatřeními zásadními.
Doručeno do redakce 17. 2. 2015
Přijato po recenzi 10. 4. 2015
prof. MUDr. Petr Dítě, DrSc.
pdite.epc@gmail.com
Oddělení gastroenterologie, metabolizmu a výživy, Interní klinika LF Ostravské univerzity a FN Ostrava
www.osu.cz
Sources
1. Ford ES. Prevalence of metabolit syndrome defined by the International Diabetes Federation among adults in U.S. Diabetes Care 2005; 28(11): 2745–2749.
2. Mokan M, Galajda P, Pridavkova P et al. Prevalence of diabetes mellitus and metabolit syndrome in Slovakia. Diabetes Res Clin Pract 2008; 81(2): 238–241.
3. Alberti KG, Eckel RH, Grundy SM et al. Harmonizing the Metabolic Syndrome: A joint intrim statement of the International Diabetes Federation task force on epidemiology and prevention: National Heart, Lung and Blood Institute, American Heart Association, World Heart Federation, International Atherosclerosis Society, and International Association for the Study of Obesity. Circulation 2009; 120(16): 1640–1645.
4. Karen I, Souček M, Rosolová H et al. Metabolický syndrom. Doporučené diagnostické a terapeutické postupy pro všeobecné praktické lékaře : novelizace 2014. Centrum doporučených postupů pro praktické lékaře. SVL: Praha 2014. ISBN 978–80–86998–70–1.
5. Rosolová H. Kardiometabolický syndrom. Maxdorf-Jesenius: Praha 2013. ISBN 978–80–7345–300–8.
6. Despres JP, Lemieux I. Abdominal obesity and metabolit syndrome. Nature 2006; 444(7121): 881–887.
7. Abbasi F, Brown B, Lamendola C et al. Relationship between obesity, insulin resistence and coronary heart disease risk. J Am Coll Cardiol 2002; 40(5): 937–943.
8. Mittelman SD, Van Citters GW, Kirkman GIK et al. Extreme insulin resistence of the central adipose depot in vivo. Diabetes 2002; 51(3): 755–761.
9. Mauriége P Marette A, Atgié C. Regional variationin adipose tissue metabolism of severely obese premenopausal women. J Lipid Re 1995; 36(4): 672–684.
10. Weisberg SP, McCann D, Desai M. Obesity is associated with macrophage accumulation in adipose tissue. I Clin Invest 2003; 112(12): 795–806.
11. Yudkin JS, Stehouwer CD, Emeis JJ et al. C-reactive protein in healthy subjects, association with obesity, insulin resistance and endothelial dysfunction: a potential role for cytokines originating from adipose tissue? Arterioscler Tromb Vasc Biol 1999; 19(4): 972–978.
12. Cote M. Adiponectinaemia in visceral obesity: Impact on glucose tolerance and plasma lipoproteins and lipid levels in man. J Clin Endocrinol Metabol 2005; 90(3): 1434–1439.
13. Berd AH, Scherer PE. Adipose tissue, inflammation and cardiovascular disease. Circ Res 2005; 96(9): 939–949.
14. Lichtenstein DR, Cash BD, Davila R et al. Role of endoscopy in the management of GERD. Gastrointest Endosc 2007; 66(2): 219–224.
15. Labenz J. Extraesopohageal manifestation of gastroesophageal reflux disease, a critical analysis. Dtsch Med Wschr 2009; 134(37): 1812–1816.
16. Ierardi E, Rosania R, Zotti M et al. Metabolic syndrome and gastresophageal reflux. A link towards a growing interest in developed countries. World J Gastrointest Pathophysiol 2010; 1(3): 91–96.
17. Ogden CL, Caroll MD, Curtin RL et al. Prevalence of overweight and obesity in the United States 1999–2004. JAMA 2006; 295(13): 1549–1555.
18. Falk GW. Obesity and gastroesophageal reflux disease: another piece of the puzzle. Gastroenterology 2008; 134(5): 1620–1622.
19. El-Serag TT, Richardson P. Antrophometric correlates of intragastric pressure. Scand J Gastroenterol 2006; 41(8): 887–891.
20. Koppman JS, Poggi I, Szomstein S et al. Esophageal motility disorders in the morbidly obese population. Surg Endosc 2007; 21(5): 761–764.
21. Ryan AM, Healy LA, Power DG et al. Barrett esophagus prevalence of central obesity, metabolic syndrome and proinflammatory state. Ann Surg 2008; 247(6): 909–915.
22. Hsu CS, Wang PC, Chen JH et al. Increasing insulin resistence is associated with increased severity and prevalence of gastroesophageal reflux disease. Aliment Pharmacol Ther 2011; 34(8): 994–1004.
23. Burgerhart JS, van de Meeberg PC, Siersema PD et al. Nocturnal and daytime esophageal acid exposure in normal weight, overweight and obese patients with reflux symptoms. Eur J Gastroenterol Hepatol 2010; 26(1): 6–10.
24. Ryan AM, Rowley SP, Fitzgerald AP et al. Adenocarcinoma of the esophagus and gastric cardia : male preponderance in association with obesity. Eur J Cancer 2006; 42(8): 1151–1158.
25. Rubenstein JH, Morgenstern H, Chey WD et al. Protective role of gluteofemoral obesity in erosive esophagitis and Barrett´s oesophagus. Gut 2014; 63(2): 230–235.
26. Peayrin-Biroulet L, Chamaillard M, Gonzales E at al. Mesenteric fat in Crohn disease. A pathogenesis hallmark or an innocent bystander? Gut 2007; 56(4): 577–583.
27. Yorulmaz E, Adali G, Yorulmaz H et al. Metabolic syndrome frequency in inflammatory bowel diseases. Saudi J Gastroenterol 2011; 17(6): 376–382.
28. Wilkins T, Tadkod A, Hepurn LM et al. Non alcoholic fatty liver disease. Diagnosis and management. Am Pham Physician 2013; 88(1): 35–42.
29. Ioannou G, Weiss NS, Kowdley KV et al. Is obesity a risk factor for cirrhosis-related death or hospitalization? A population-based cohort study. Gastroenterology 2003; 125(4): 1053–1059.
30. Sanyl AJ, Campbell-Sargent C, Mirshani F et al. Non-alcoholic steatohepatitis : association of insulin resistence and mitochondrial abnormalities. Gastroenterology 2001; 120(5): 1183–1192.
31. Neuschwander-Tetri BA. Non-alcoholic steatohepatitis and metabolit syndrome. J of Amer Sci 2006; 130 : 326–334.
32. Lazo M, Hernaez M, Bonekamp S et al. Non-alcoholic fatty liver disease and mortality among US adults: prospective cohort study. BMJ 2011; 343: d6891. Dostupné z DOI: <http://dx.doi.org/10.1136/bmj.d6891>.
33. Roselli M, Loterszjan S, Vizzutti F et al. The metabolic syndrome and chronic liver disease. Curr Pharm Des 2014; 20(31): 5010–5024.
34. 34 Lonardo A, Sookolan S, Chonchol M et al. Cardiovascular and systemic complications in non alcoholic fatty liver disease. Atherosclerosis as a major player in natural course of NAFLD. Curr Pharm Des 2013; 19(29): 5177 - 5192.
35. 35 Halosworth K, Thoma Ch, Moore S et al. Non-alcoholic fatty liver disease is associated with higher levels activity than matched healthy controls. Frontline Gastroenterology 2015; 6(1): 44–51.
36. Schaffer EA. Gallstone disease: Epidemiology of gallblader stone disease. Best Practice Res Clin Gastroent 2006; 20(6): 981–996.
37. Koller T, Kollerova I, Hlavaty T et al. Cholelithiasis and markers of non-alcoholic fatty liver disease in patients with metabolic risk factors. Scand J Gastroenterol 2012; 47(2): 197–203.
38. Ata N, Kucukazman M, Yavuz B et al. The metabolic syndrome is associated with complicated gallstone disease. Can J Gastroent 2011; 25(5): 274–276.
39. Pontincasa M, Moshetta A, Palasciano G. Cholesterol gallstone disease. Lancet 2006; 168(9531 : 230–239.
40. Mendez-Sanchez N, Chavez-Tapis NC, Motola-Kuba D et al. Strong association between gallstones and cardiovascular disease. World J Gastroenterol 2005; 11 : 1653–1657.
41. Sawalhi S, Al-Maramphy H, Abdelrahman Al et al. Does the present of obesity and/or metabolic syndrome affect the course of acute pancreatitis: A prospective study. Pancreas 2014; 43(4): 565–570.
42. Ammann RW, Raimondi S, Maisonnneuve P et al. Is obesity an aditional risk factor for alcoholic chronic pancreatitis? Pancreatology 2010; 10(1): 47–53.
43. Pezzilli R, Calculli L. Pancreatic steatosis: Is it related to either obesity or diabetes mellitus? World J Diabetes 2014; 5(4): 415–419.
44. Ogilvie RF. The island of Langerhans in 19 cases of obesity. Pathol 1933; 37(3): 473–481.
45. Kim MK, Chun HJ, Park JH et al. The association between ectopic fat in the pancreas and subclinical atherosclerosis in type 2 diabetes. Diabetes Res Clin Pract 2014; 106(3): 590–596.
46. Aubert A, Gornet JM, Hammel P et al. Diffuse primary fat replacement of the pancreas: an unusual cause of steatorrhea. Gastroenterol Clin Biol 2007; 31(3): 303–306.
47. Tilg H, Moschen AR. Mechanisms behind the link between obesity and gastrointestial cancer. Best Practice and Res Clin Gastroenterol 2014; 28(4): 599–560.
48. Mantovani A, Allavena P, Balkwill F et al. Cancer related inflammation. Nature 2008; 454(7203): 436–444.
49. Osborn O, Olefsky JM. The cellular and signaling network linking the immune system and metabolic disease. Nat Med 2012; 18(3): 363–374.
50. Tilg H, Moschen AR. Adipocytokines: mediators linking adipose tissue: inflammation and immunity. Nat Rev Immunol 2006; 6(10): 772–783.
51. Johnson AM, Olefsky JM. The origin and driver of insulin resistence. Cell 2013; 152(4): 673–684.
52. Ohtani M, Yoshimoto S, Hara E. Obesity and cancer: a gut microbial connection. Cancer Res 2014; 74(7): 1885–1889.
53. Kubo A, Curley DA. Body mass index and adenocarcinomas of the esophagus or cardia: a systematic review and meta-analysis. Cancer Epidemiol Biomarkers Rev 2006; 15(5): 872–878.
54. Donohoe CL, Pidgeon GP, Lysaght L et al. Obesity and gastrointestinale cancer. Br J Surg 2010; 97(5): 628–642.
55. Ferlitsch M, Reinhart K, Pramhas S et al. Sex-specific prevalence of adenomas, advanced adenomas, and colorectal cancer in individuals undergoing screening colonoscopy. JAMA 2011; 306(12): 1352–1358.
56. Ho GY, Wang T, Gunter MJ et al. Adipokines linking obesity with colorectal cancer risk in postmenopausal women. Cancer Res 2012; 72(12): 3029–3037.
57. White D, Kanwal F, El-Serag HB. Association between nonalcoholic fatty liver disease and risk for hepatocellur cancer, based on systematic review. Clin Gastroenterol Hepatol 2012; 10(12): 1342–1359.
58. Kawada N, Imanaka K, Kawaguchi T et al. Hepatocellular carcinoma arising from and pancreatic cancer: non-cirrhotic nonalcoholic steatohepatitis. J Gastroenterol 2009; 44(12): 1190–1194.
59. Sadik NA, Ahmed A, Ahmed S. The significance of serum levels of adiponectin, leptin and hyaluronic acid in hepatocelular carcinoma of cirrhotic and noncirrhotic patients. Human Exp Toxicol 2012; 31(4): 311–321.
60. Hung CH, Wang JH, Hu TH et al. Insulin resistence is associated with hepatocelluler carcinoma in chronic hepatitis C infection. World J Gastroenterol 2010; 16(18): 2265–2271.
61. Patel AV, Rodriguez C, Bernstein L et al. Obesity, recreational physical activity and risk of pancreatic cancer in a large U.S. cohort. Cancer Epidemiol Biomarkers Prev 2005; 14(2): 459–466.
62. Arslan AA, Helzinger RJ, Kooperberg C et al. Anthropometric measures, body mass index, and pancreatic cancer: a pooled analysis from the Pancreatic Cancer Cohort Consortium (PanScan). Arch Intern Med 2010; 170(9): 791–803.
63. Genkinger JM, Spegelman D, Anderson KE et al. A pooled analysis of 14 cohort studie of antropometric factors and pancreatic cancer risk. Int J Cancer 2011; 129(7): 1708–1717.
64. Preziosi G, Oben JA, Fusai G. Obesity and pancreatic cancer. Surg Oncol 2014; 23(2): 61–71.
65. Katzmarszyk PT, Church TS, Janssen I et al. Metabolic syndrome, obesity, and mortality. Diabetes Care 2005; 28(2): 391–397.
66. Matsuda M, Shimomuto I. Increased oxidative stress in obesity: implications for metabolic syndrome, diabetes, hypertension, dyslipidemie, atherosclerosis and cancer. Obesity Res and Clin Practice 2013; 7(5): e330-e341.
67. Stocks T, Lukanova A, Bjorge E et al. Metabolic factors and the risk of colorectal cancer in 580,000 men and women in the metabolic syndrome and cancer project (Me-Can). Cancer 2011; 117(11): 1398–1407.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2015 Issue 9-
All articles in this issue
- Návrh optimálního léčebného postupu v léčbě nízkorizikového karcinomu štítné žlázy
- Sekundární humorální imunodeficience u nemocných se systémovým lupus erythematodes
- Má věk nemocných s chronickou myeloidní leukemií při léčbě imatinibem vliv na dosaženou léčebnou odpověď?
- Role metabolického syndromu v gastroenterologii
- Účelnost zavádění kaválních filtrů z pohledu internisty
- Terapeutický potenciál mikronizované purifikované flavonoidní frakce (MPFF) diosminu a hesperidinu v rámci léčby chronického žilního onemocnění
- Změny stravovacích návyků ve vztahu k rizikovým faktorům a kardiovaskulární mortalitě
-
Myopatie při Waldenströmově makroglobulinemii.
Popis případu a přehled autoimunitních projevů monoklonálních imunoglobulinů typu IgM
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Terapeutický potenciál mikronizované purifikované flavonoidní frakce (MPFF) diosminu a hesperidinu v rámci léčby chronického žilního onemocnění
- Účelnost zavádění kaválních filtrů z pohledu internisty
- Návrh optimálního léčebného postupu v léčbě nízkorizikového karcinomu štítné žlázy
- Sekundární humorální imunodeficience u nemocných se systémovým lupus erythematodes
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

