-
Medical journals
- Career
Konopí – léčba budoucnosti?
Authors: Jan Hajer
Authors‘ workplace: II. interní klinika 3. LF UK a FN Královské Vinohrady Praha, přednosta prof. MUDr. Michal Anděl, CSc.
Published in: Vnitř Lék 2015; 61(7-8): 680-685
Category: Vanýsek´s day 2015
Přes veškeré pokroky v léčbě chronických gastrointestinálních onemocnění u části pacientů nedosahuje léčba dlouhodobé optimální efektivity. Proto se řada pacientů uchyluje ke komplementární a alternativní medicíně (complementary and alternative medicine – CAM). Z různých typů CAM je pacienty s GIT onemocněními preferována především homeopatie, akupunktura a v neposlední řadě i fytoterapie, pod kterou lze řadit i léčebné užití Cannabis sativa. Patofyziologická báze terapeutického efektu léčebného konopí není doposud zcela objasněná.
Overview
Přes veškeré pokroky v léčbě chronických gastrointestinálních onemocnění u části pacientů nedosahuje léčba dlouhodobé optimální efektivity. Proto se řada pacientů uchyluje ke komplementární a alternativní medicíně (complementary and alternative medicine – CAM). Z různých typů CAM je pacienty s GIT onemocněními preferována především homeopatie, akupunktura a v neposlední řadě i fytoterapie, pod kterou lze řadit i léčebné užití Cannabis sativa. Patofyziologická báze terapeutického efektu léčebného konopí není doposud zcela objasněná. Studium působení kanabinoidů v organizmu je zájmem mnoha vědců z mnoha odvětví medicíny a farmakologie od začátku 20. století s významným vzestupem zájmu v 80. letech 20. století. Objev kanabinoidních receptorů (1988) a endogenních molekul aktivujících tyto receptory (1992) vedl k objevení endokanabinoidního systému. Farmakologická modulace endogenního kanabinoidního systému nabízí nové terapeutické možnosti v léčbě mnoha onemocnění a symptomů včetně onemocnění GIT, zahrnující nauzeu, zvracení, kachexii, IBS, Crohnovu chorobu a některá další onemocnění. Kanabinoidy jsou atraktivní terapeutickou možností – ovlivňují mnoho symptomů s minimálními vedlejšími účinky. Zkušenosti pacientů s GIT onemocněními ukazují, že užití kanabis je efektivní a pomáhá v případech, kdy selhává standardní terapie.
Klíčová slova:
Cannabis sativa – endokanabinoidní systém – fototerapie – komplementární alternativní medicína (CAM)Úvod
U značné části pacientů s chronickými onemocněními gastrointestinálního traktu (GIT) se setkáváme se zvýšeným zájmem o alternativní medicínu, což je obvykle dáno dlouhodobým ne zcela uspokojivým průběhem léčby. Proto se řada pacientů uchyluje ke komplementární a alternativní medicíně (complementary and alternative medicine – CAM).
CAM je označením pro nekonvenční medicínu a zahrnuje širokou škálu diagnostických a léčebných postupů. Na rozdíl od klasické medicíny je přístup k péči o pacienta holistický, což je obzvláště důležité u chronických onemocnění (IBD, malignity, funkční dyspepsie atd).
Z různých typů CAM je pacienty s GIT onemocněními preferována především homeopatie, akupunktura a v neposlední řadě i fytoterapie, pod kterou lze řadit i léčebné užití rostliny Cannabis sativa, česky konopí seté, kanabis [1].
Historie léčebného užití konopí
Léčebné využití k je známo tisíciletí. První písemné zmínky o užití konopí jako léčebného prostředku pocházejí z Egypta asi 1 500 let před n. l.
První zmínky užití konopí jako léčebného prostředku v Evropě jsou ze 13. století. Kanabis byla nejvíce popularizována v 19. století, kdy byla užívána především pro své antikonvulzivní, analgetické a antiemetické účinky. Kanabis je legalizována pro léčebné užití v různých zemích světa, první země, která legalizovala léčebné užití kanabis, byly Spojené státy americké, kde došlo k legalizaci již v roce 1937. Ta byla ovšem zrušena ve 40. letech minulého století [2]. V České republice došlo k legalizaci v roce 2011, a to v indikacích terapie roztroušené sklerózy, bolesti a terapie anorexie u nádorových onemocnění. Některými autory je kanabis považována pro své minimální nežádoucí účinky a rozsáhlý efekt za aspirin 21. století. Dnes je kanabis třetí neužívanější drogou po alkoholu a tabáku.
Cannabis sativa
Vlastní rostlina – Cannabis sativa – obsahuje více než 460 složek (obr. 1). Tetrahydrokanabinol (tetrahydrocannabinol – THC) je hlavní psychoaktivní složkou. Hlavní nepsychogenní komponentou je kanabidiol (cannabidiol – CBD).
Kanabinoidy jsou vysoce lipofilní, lehce pronikají přes buněčné membrány. Kanabis může obsahovat více než 80 kanabinoidních složek (tricyklické dibentopyreny), jako je kanabidiol (cannabidiol – CBD), kanabinol (cannabinol – CBN), kanabicyklol (cannabicyclol – CBL), kanabichromen (cannabichromene – CBC) a kanabigerol (cannabigerol – CBG), které mohou modulovat odpověď na THC [2,3].
Endokanabinoidní systém
Patofyziologická báze terapeutického efektu léčebného konopí není doposud zcela objasněná. Objev CB receptorů (1988) a endogenních molekul aktivujících tyto receptory (1993) vedl k objevení endokanabinoidního systému.
Tento systém se skládá z CB receptorů (CB1, CB2), jejich hlavních endogenních ligand – endokanabinoidů – anandamidu a 2-arachidonoilglycerolu (2-AG) a jejich syntetizačních a degradačních enzymů.
CB1 receptory jsou primárně exprimované především v centrální a periferní nervové soustavě a jsou zodpovědné za psychomimetické účinky kanabinoidů. V centrální nervové soustavě (CNS) je CB1 receptor jeden z nejčastěji zastoupených receptorů vázající G proteiny (GTP-áza). CB1 receptory jsou exprimovány kortikálně (neokortex, pyriformkortex, hypokampus, amygdala) v bazálních gangliích, mozečku, talamu a hypotalamu a periakveduktální šedi, které jsou zodpovědné za motorickou koordinaci a krátkodobou paměť. CB1 receptor je též exprimován v aferentních míšních oblastech, které jsou zásadní v patofyziologii bolesti [4–6]. Mimo nervový systém jsou CB1 receptory exprimovány v hypofýze, štítné žláze a nadledvinách, dále v buňkách, které se podílejí na metabolizmu, tj. v tukových, svalových a jaterních buňkách a v buňkách GIT. Nalezneme je v plicích, ledvinách, u mužů ve spermiích a u žen v ovariích, myometriu, buňkách deciduy i v placentě těhotných žen.
CB2 receptory se vyskytují především na buňkách imunitního systému. CB2 receptor je exprimován v buňkách sleziny, tonzil, v tymu. Dále jsou exprimované monocyty, makrofágy, a B-lymfocyty a T-lymfocyty. Díky této expresi se účastní imunomodulace – suprese, indukce apoptózy, indukce buněčné migrace [7]. Dále jsou exprimované v gastrointestinálním traktu (GIT), v němž je zkoumána jejich role při patogenezi nespecifických střevních zánětů [8]. CB2 receptory kontrolují zánětem indukovanou bolest.
Kanabis a endokanabinoidní systém
Tetrahydrokanabinol (THC) je predominantním herbálním ligandem (parciálním agonistou) pro CB receptory, napodobuje efekt anandaminu a 2-AG. CBD nepůsobí přímo na receptory, ale ovlivňuje právě endokanabinoidní signalizaci prostřednictvím interakce s degradačním systémem kanabinoidů s FAAH (fatty acid amid hydroxylase) a transportérem pro anadamid (AT). Následkem toho dochází k nespecifickému zvýšení hladin anandamidu a 2-AG [9].
Výsledky nejrecentnějších studií prokazují, že CBD má účinky protizánětlivé, anxiolytické, antipsychotické a mírně sedativní [10,11]. Jeho další výhodou je fakt, že do značné míry zmírňuje (antagonizuje) psychotomimetické účinky THC a stejně tak zabraňuje propsychotickému působení THC z dlouhodobého hlediska [12,13].
Biologické účinky kanabis
Akutní účinky po užití kanabis jsou velmi dobře známé. Indukuje psychoaktivní, lehce euforickou, relaxační intoxikaci, která způsobuje mírné změny v psychomotorických a kognitivních funkcích, výrazně stimuluje apetit. Nežádoucím účinkem může být sucho v ústech, závratě, u části uživatelů může vést k anxiozitě, panice a k paranoii. U citlivých jedinců může spustit akutní psychózu zahrnující deziluzi a halucinace. Z celkových příznaků zvyšuje srdeční frekvenci, snižuje krevní tlak v důsledku vazodilatace, kterou obvykle provází typické zarudnutí očí (obr. 2). U chronických uživatelů může pravidelné dlouhodobé užívání konopí vést k amotivačnímu syndromu [14].
Image 2. Typické zarudnutí očí 
Je kanabis lék?
V posledních době je patrný velký zájem o působení kanabis na lidský organizmus, a to v celé vědecké společnosti, který je podložený rozsáhlou publikační činností. V posledním desetiletí bylo publikováno více než 15 000 vědeckých článků o biochemii a farmakologických účincích konopí a více než 2 000 článků zabývajících se funkcí endogenních kanabinoidů. Tyto publikace vycházejí z celého spektra medicínských oborů. Kromě možného terapeutického využití u gastrointestinálních onemocnění jsem se snažil vyzdvihnout indikace i v jiných medicínských oborech, v nichž byl terapeutický potenciál kanabinoidů prokázán na základě klinických či teoretických studií.
Neurologická onemocnění
Pozitivní vliv kanabinoidů na neurologické onemocnění je znám již delší dobu. Klinické studie prokazují léčebný efekt u pacientů s vážnými neurologickými onemocněními jako epilepsie, sclerosis multiplex, Parkinsonova choroba, amyotrofická laterální skleróza, ovlivnění neuropatické bolesti. Několik klinických studií s nazálním sprayem Sativex (fáze II a III) prokázalo jednoznačný terapeutický efekt kanabis u pacientů s roztroušenou sklerózou a spasticitou. Významnou klinickou studií byla mezinárodní multicentrická studie s českou účastí neurologických klinik v Praze, Olomouci, Ostravě a nemocnic v Pardubicích a Teplicích [15]. V randomizovaném, dvojitě slepém a placebem kontrolovaném uspořádání byla v paralelních skupinách pacientů se sclerosis multiplex nereagujících uspokojivě na dosavadní antispastickou farmakoterapii přidávána po 4 týdny aplikace nabixomolu (tetrahydrokanabinol + kanabidiol; Sativex). Z celkového počtu pacientů reagovalo 20% snížením spasticity, v následném pokračování studie se s vysokou signifikací (P = 0,0002) projevil antispastický efekt nabixomolu.
Jak ukázala další randomizovaná studie, efekt kanabinoidů lze prokázat i u pacientů s neuropatickými bolestmi po úrazu spinální míchy [16].
Výrazné zlepšení kvality života po aplikaci syntetického tetrahydrokanabinolu je referováno rovněž z randomizované placebem kontrolované dvojitě slepé klinické studii u diabetické neuropatie s bolestí a příznaky deprese [17].
U epilepsie je testovaný preparát Epidiolex (purifikovaný CBD), který je zkoušen u dětských pacientů s epilepsií [18,19]. Dále je účinek konopí zkoumán u Touretteova sydromu.
Psychiatrická onemocnění
Dalším odvětvím, v němž je prokázán a stále zkoumán efekt kanabinoidů, je psychiatrie. Vědecké studie prokazují význam endokanabinoidního systému v patofyziologii bipolární poruchy a jejího možného ovlivnění užitím kanabis. Hodnocením neurokognitivních funkcí (pozornosti, verbální pohotovosti, logické paměti/učení) bylo po užití kanabis zaznamenáno signifikantní zlepšení pacientů s diagnózou bipolární poruchy, a naopak zhoršení u pacientů se schizofrenií [20].
Studiemi je také podložena možnost terapie anxiety. V placebem kontrolované dvojitě slepé klinické studii působil kanabidiol stimulaci výkonu slovního projevu na veřejnosti (s menšími změnami krevního tlaku, tepové frekvence a kožní vodivosti a subjektivních úzkostných příznaků) u pacientů s diagnózou sociální úzkostné poruchy oproti zdravým dobrovolníkům [21]. Tyto závěry byly podpořeny rovněž výsledky studie využívající perfuzní scintigrafii mozku (99mTc-ECD). V dvojitě slepém uspořádání působil kanabidiol proti placebu snížením subjektivní úzkosti pacientů se sociální úzkostnou poruchou doprovázené objektivními změnami aktivity (zvýšené vychytávání radiofarmaka) v limbické a paralimbické oblasti mozku [22].
Na základě nových poznatků endokanabinoidního systému se předpokládá, že kanabinoidy mohou inhibovat exotoxické glutamanergní poškození striata a touto cestou potlačovat kompulzivní chování. Pilotní studie sledující vliv kanabinergního agonisty dronabinolu na jinak dosud obtížně léčitelnou trichotilomanii prokázala signifikantní potlačení příznaků bez negativního dopadu na výkon v objektivních neurokognitivních testech [23].
V psychiatrii je ale také studiemi prokázán negativní účinek chronického užívání kanabinoidů dokazující korelaci mezi užíváním kanabis v adolescenci a rozvojem schizofrenie v dospělosti [24,25].
Terapie bolesti
Více než 100 různých kanabinoidů obsažených v cannabis sativa má analgetické účinky, které jsou zprostředkovány neuromodulací v ascendentních a descendentních drahách bolesti. Efekt kanabis je i v tomto směru podložen výsledky klinických studií. Byl prokázán efekt na kontrolu bolesti u zánětlivé a revmatoidní artritidy a poranění brachiálního plexu [26,27]. V Kanadě je Sativex používán u pacientů s pokročilými nádory nereagujících na léčbu opiáty. Sativex je dostupný v roce 2014 ve 24 zemích, včetně UK, Španělska, Itálie, Německa a ČR.
Terapeutický efekt kanabinoidů je zmiňován v souvislosti s celou řadou dalších onemocnění. U nádorových onemocnění byl v laboratorních experimentech prokázán antikancerogenní a antitumorózní efekt, tyto výsledky však nebyly doposud podpořeny výsledky klinických studií. Zatím se nepotvrdil ani předpoklad efektu terapie u dalších onemocnění, jako jsou např. diabetes mellitus, demence, Alzheimerova choroba či glaukom [28].
Endogenní kanabinoidní systém u GIT onemocnění
Historie užívání kanabis v terapii onemocnění gastrointestinálního traktu je v Evropě bezmála stoletá. Ve východní medicíně sahá tato historie mnohem dále. V GIT se vyskytují veškeré komponenty endokanabinoidního systému [32]. Laboratorním výzkumem byla prokázána velice četná přítomnost CB receptorů v tenkém a tlustém střevě. Endokanabinoidní systém hraje kruciální neuromodulační roli v kontrole motility a střevního zánětu [29]. CB receptory – G protein párové receptory jsou predominantně exprimovány ve střevě a CNS (CB1) a imunitních buňkách (CB2). GIT obsahuje endogenní kanabinoidy (anandamid, 2-arachidonylgylecerol). CB1 receptory byly nalezeny v myenterické a submukózní nervové pleteni. Aktivací kanabinoidních receptorů dochází k inhibici sekrece v GIT a zánětu na zvířecích modelech. Testované kanabinoidy – kanabidiol a kanabigerol, nepsychotropní kanabinoidy, snižují expresi iNOS (iso-Nitric Oxide Synthase), modulují hladiny cytokinů a vykazují antioxidační účinky, a tímto způsobem ovlivňují zánět [30].
Léčebné užití kanabis u onemocnění GIT
Stimulace apetitu
CB1 receptor je spojen s regulací chuti k jídlu. K regulaci dochází centrálně cestou stimulace CB1 receptorů v hypotalamu, dále ovlivněním v oblasti limbického systému (potravina se stává chutnější) [33–35]. Dále jsou stimulovány CB receptory lokálně v GIT v žaludku a v tenkém střevě. Stimulací těchto receptorů dochází ke zvýšení pocitu hladu. Obecně tedy stimulace CB receptorů jak centrálně, tak lokálně vede ke zvýšení pocitu hladu a stimulaci příjmu potravy. Studie na zdravých dobrovolnících prokázaly stimulaci apetitu s nárůstem hmotnosti. Vzhledem k těmto účinkům se předpokládá a studiemi je podpořen efekt při terapii anorexie např. u HIV pacientů a pacientů s anorexia nervosa. Byl prokázán také antiemetický účinek s výrazným zmírněním nauzey a zlepšením chuti k jídlu [36–38].
Další využití kanabis v oblasti gastroenterologie je možnost ovlivnění gastroezofageálního refluxu, spazmů, bolesti a motility [39,40]. Kanabidiol (CBD), druhá nejvýraznější složka cannabis sativa po THC, redukuje hypermotilitu, zánět a poškození tkáně u experimentálních modelů onemocnění GIT, pomáhá tak ovlivňovat bolest. Stimulace CB receptorů v GIT má spazmolytický efekt. Kanabinoidy mají schopnost blokovat spinální, periferní a GIT mechanizmy způsobující bolest u syndromu dráždivého tračníku (irritable bowel syndrome – IBS) a přidružených funkčních onemocnění. V poslední době proběhly studie u pacientů s IBS a pacientů s Crohnovou chorobou (Crohn disease – CD), které prokázaly, že kanabis snižuje křeče, zmírňuje průjem a zácpu u těchto nemocných [41,42].
Protizánětlivé a imunomodulační účinky kanabinoidů
Jeden z možných účinků kanabinoidů v experimentálním střevním zánětu je efekt na imunocyty, které převážně exprimují CB2 receptory. Po CB2 aktivaci T buňky podléhají apoptóze a snižují svoji proliferaci. Aktivací CB2 se snižuje putování neutrofilů, T buněk a makrofágů do zánětem postižené sliznice [43]. Při zánětu střevní sliznice dochází ke zvýšené expresi CB receptorů v postižených oblastech, což vede k regulaci zánětu zvýšeným přísunem endokanabinoidů. Tyto předpoklady vycházejí i z experimentu na CB receptor knock out myší s použitím agonistů a antagonistů CB receptorů [44].
Zatímco adandamid a jeho syntetizační enzymy jsou snížené u ulcerózní kolitidy (ulcerative colitis – UC), exprese CB2 receptorů a enzymů zodpovědných za syntézu a degradaci 2-AG je zvýšená [45]. Tyto závěry indikují, že CB2 receptory hrají klíčovou roli v amelioračním efektu kanabinoidů u IBD. Jsou různorodě exprimované u pacientů s IBD a ukazují na jejich regulační roli v progresi onemocnění [46]. CB receptory byly také nalezeny ve střevním nervovém systému (ENS). Proto aktivace CB receptorů (THC/CBD) může redukovat hypermotilitu asociovanou se zánětem střeva [47,48].
Klinické studie u CD
Retrospektivní observační studie u pacientů s CD prokázala, že konopí snižuje index aktivity onemocnění a potřebu užívání dalších léků a operací [49]. Obdobné výsledky prokázala i recentní prospektivní placebem kontrolovaná studie stejného autora u 21 pacientů s Crohnovou chorobou, u nichž selhává na standardní terapie. Přestože terapie kanabinoidy nevedla k navození remise, jednoznačně prokázala, že 8týdenní léčba konopím bohatým na δ-9-tetrahydrokanabinol (THC) vede ke snížení indexu aktivity CD (Crohn Disease Activity Index – CDAI) u 90 % pacientů a k signifikantnímu zlepšení kvality života bez výraznějších vedlejších účinků [50].
Formy aplikace léčebného konopí
Kouření (joint) je nejčastějším způsobem užití kanabis. Nevýhodou tohoto způsobu aplikace je problém s ne zcela predikovatelnou farmakologickou odezvou vzhledem k rozdílné koncentraci kanabinoidů u jednotlivých pacientů. Patrný je rozdíl zvláště mezi kuřáky a nekuřáky.
Dalším způsobem aplikace je valorizace – aerosol (obr. 3) [51] a aplikace ve formě nazálního spraye (Sativex).
U tabletových forem (dronabinol, nabilon) je problematické pomalé uvolňování kanabinoidů z tukové tkáně a snížení hladin THC prvním průchodem játry, což vede k rozdílným plazmatickým koncentracím. Dronabinol (Marinol) je syntetický THC, který nemá stejný terapeutický efekt jako cannabis sativa, obsahující více než 100 dalších kanabinoidů. Marinol není tak efektivní jako kanabis v léčbě bolesti, která je zřejmě závislá na poměru THC a CBD. Na základě tohoto poznatku je Marinol indikován pouze pro stimulaci apetitu (tab. 1).
Table 1. Komerčně dostupné formy kanabinoidů a jejich indikační skupiny 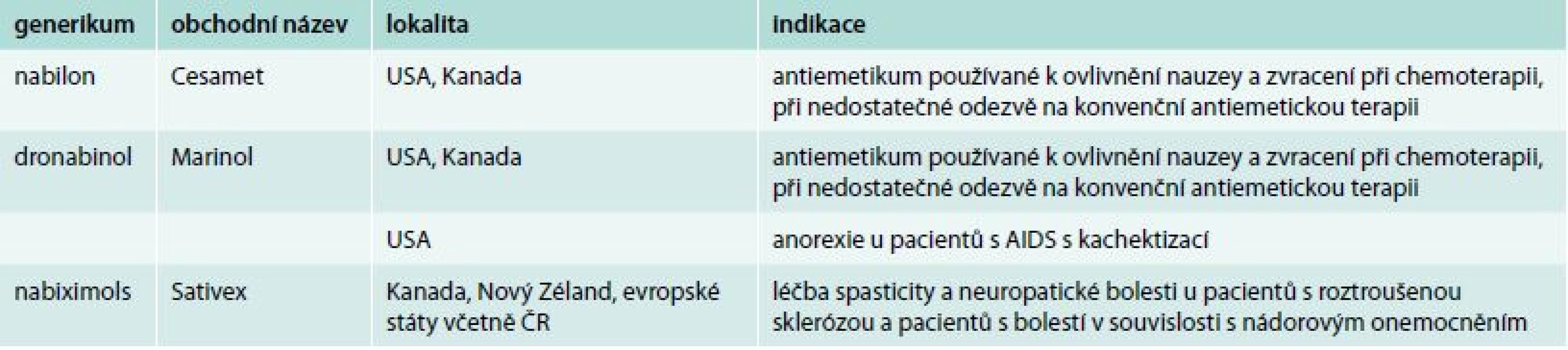
Další možnosti aplikace jsou ve formě oleje nebo másla a také ve formě tinktury.
Obecně lze říci, že inhalační aplikace je efektivnější než perorální podání, a to pro jednodušší titraci dávky a nižší výskyt nežádoucích účinků.
Je kanabis bezpečná?
Na tuto otázku není zcela jednoduché odpovědět, ale jednoduchou odpověď nenalezneme ani u jiných farmak, která se běžně konvenčně užívají a jsou dostupná široké veřejnosti i bez nutnosti preskripce lékařem.
Není známé akutní letální předávkování kanabis. Kanabis je méně návyková než běžně užívaná farmaka ze skupiny myorelaxancií, hypnotik nebo analgetik. Zásadním problémem je při aplikaci kouřením zvýšený obsah dehtu a jiných škodlivých látek, který je asi 4krát škodlivější, než je kouření cigaret. Tento problém je řešitelný jiným způsobem aplikace (nejlépe vaporizací). Největším problémem užití je její nelegálnost a nedostupnost, což kriminalizuje potenciální pacienty, u kterých by měla terapie zásadní pozitivní efekt.
Závěr
Farmakologická modulace endogenního kanabinoidního systému nabízí nové terapeutické možnosti v léčbě mnoha GIT onemocnění, zahrnující nauzeu, zvracení, kachexii, IBS, Crohnovu chorobu, a některá další onemocnění. Kanabinoidy jsou atraktivní terapeutickou alternativou, která ovlivňuje mnoho symptomů s minimálními vedlejšími účinky. Zkušenosti pacientů s onemocněními GIT ukazují, že kanabis je efektivní a pomáhá i v případech, kdy selhává standardní terapie.
MUDr. Jan Hajer, Ph.D.
honza.hajer@gmail.com
II. interní klinika 3. LF UK a FN Královské Vinohrady
www.fnhk.cz
Doručeno do redakce 4. 6. 2015
Přijato po recenzi 18. 7. 2015
Sources
1. Vochyánová Z, Sikorová K, Šmejkal K et al. Rostliny v terapiii diopatických střevních zánětů. Gastroent Hepatol 2014; 68(3): 248–254.
2. Mohamed BA. Cannabinoids in medicine: a review of their therapeutic potential. J Ethnopharmacol 2006; 105(1–2): 1–25.
3. Hawks RL. The constituents of cannabis and the disposition and metabolism of cannabinoids. NIDA Res Monogr 1982; 42 : 125–137.
4. Devane WA, Hanus L, Breuer A et al. Isolation and structure of a brain constituent that binds to the cannabinoid receptor. Science 1992; 258 (5090): 1946–1949.
5. Wilson RI, Nicoll RA. Endocannabinoid signalling in the brain. Science 2002; 296 (5568): 678–682.
6. Baker D, Pryce G, Giovannoni G et al. The therapeutic potential of cannabis. Lancet Neurol 2003; 2(5): 291–298.
7. Basu S, Ray A, Dittel BN. Cannabinoid Receptor 2 (CB2) is Critical for the Homing and Retention of Marginal Zone B Lineage Cells and for Efficient T-independent Immune Responses. J Immunol 2011; 187(11): 5720–5732.
8. Wright KL, Duncan M, Sharkey KA. Cannabinoid CB2 receptors in the gastrointestinal tract: a regulatory system in states of inflammation. Br J Pharmacol 2008; 153(2): 263–270.
9. Pertwee RG. Inverse agonism and neutral antagonism at cannabinoid CB1 receptors. Life Sci 2005; 76(12): 1307–1324.
10. Zuardi AW. Cannabidiol: from an inactive cannabinoid to a drug with wide spectrum of action. Rev Bras Psiquiatr 2008; 30(3): 271–280.
11. Leweke FM, Piomelli D, Pahlisch F et al. Cannabidiol enhances anandamide signaling and alleviates psychotic symptoms of schizophrenia. Transl Psychiatry 2012; 2: e94. Dostupné z DOI: <http://dx.doi.org/10.1038/tp.2012.15>.
12. Morgan NH, Stanford IM, Woodhall GL Functional CB2 type cannabinoid receptors at CNS synapses. Neuropharmacology 2009; 57(4): 356–368.
13. Schubart CD, Sommer IEC, van Gastel WA et al. Cannabis with high cannabidiol content is associated with fewer psychotic experiences. Schizophr Res 2011; 130(1–3): 216–221.
14. 14 .Mechoulam R. The pharmacohistory of Cannabis sativa. In: Mechoulam R (ed). Cannabinoids as therapeutic agents. CRC Press: Boca Raton 1986, 1–19. ISBN 978–0849357725.
15. Novotna A, Mares J, Ratcliffe S et al. A randomized, double-blind, placebo-controlled, parallel-group, enriched-design study of nabiximols (Sativex (R), as add-on therapy, in subjects with refractory spasticity caused by multiple sclerosis. Eur J Neurol 2011; 18(2): 1122–1131.
16. Rintala DH, Fiess RN, Tan G et al. Effect of dronabinol on central neuropathic pain after spinal cord injury: a pilot study. Am J Phys Med Rehabil 2010; 89(10): 840–848.
17. Selvarajah D, Gandhi R, Emery CJ et al. Randomized placebo-controlled double-blind clinical trial of cannabis-based medicinal product (Sativex) in painful diabetic neuropathy. Diabetes Care 2010; 33(1): 128–130.
18. Muller-Vahl KR, Schneider U, Koblenz A et al. Treatment of Tourette’s syndrome with Delta 9 - tetrahydrocannabinol (THC): a randomized crossover trial. Pharmacopsychiatry 2002; 35(2): 57–61.
19. Collins TR. Special Report: What Neurologists Are Doing About Medical Marijuana. Neurology Today 2014; 14(8): 1, 28–33. Dostupné z WWW: <http://journals.lww.com/neurotodayonline/Citation/2014/04170/Special_Report__What_Neurologists_Are_Doing_About.2.aspx>.
20. Ringen PA, Vaskinn A, Sundet K et al. Opposite relationship between cannabis use and neurocognitive function in bipolar disorder and schizophrenia. Psychol Med 2010; 40(8):1337–1347. Dostupné z DOI: <http://dx.doi.org/10.1017/S0033291709991620>.
21. Bergamaschi MM1, Queiroz RH, Chagas MH et al. Cannabidiol Reduces the Anxiety Induced by Simulated Public Speaking in Treatment-Naïve Social Phobia Patients. Neuropsychopharmacology 2011; 36(6): 1219–1226.
22. Fagherazzi EV1, Garcia VA, Maurmann N et al. Memory-rescuing effects of cannabidiol in an animal model of cognitive impairment relevant to neurodegenerative disorders. Psychopharmacology (Berl) 2012; 219(4): 1133–1140.
23. Grant JA, Courtemanche J, Rainville P et al. A non-elaborative mental stance and decoupling of executive and pain-related cortices predicts low pain sensitivity in Zen meditators. Pain 2011; 152(1): 150–156.
24. Rubino T, Zamberletti E, Parolaro D et al. Adolescent exposure to cannabis as a risk factor for psychiatric disorders. J Psychopharmacol 2012; 26(1): 177–188.
25. Campos AC, Moreira FA, Gomes FV et al. Multiple mechanisms involved in the large-spectrum therapeutic potential of cannabidiol in psychiatric disorders. Philos Trans R SocLond B BiolSci 2012; 367(1607): 3364–3378.
26. Campbell FA, Tramer MR, Carroll D et al. Are cannabinoids an effective and safe treatment option in the management of pain? BMJ 2001; 323(7303 : 13–16.
27. 27.Notcutt W, Price M, Blossfeldt P et al. Clinical experience of the synthetic cannabinoid nabilone for chronic pain. In: Nahas GG, Sutin KM, Harvey D et al(eds.) Marihuana and medicine. Humana Press: Totowa 1999 : 567–572. ISBN 978–0896035935.
28. 28.Gieringer D. Review of Human Studies on the Medical Use of Marijuana. Dostupné z WWW: <http://www.safeaccessnow.org/gastrointestinal_disorders>.
29. Izzo AA, Fezza F, Capasso R et al. Cannabinoid CB1-receptor mediated regulation of gastrointestinal motility in mice in a model of intestinal inflammation. Br J Pharmacol 2001; 134(3): 563–570.
30. De Mei C, Ramos M, Iitaka C et al. Getting specialized: presynaptic and postsynaptic dopamine D2 receptors. Curr Opin Pharmacol 2009; 9(1): 53–58.
31. Pertwee RG. Cannabinoids and the gastrointestinal tract. Gut 2001; 48(6): 859–867.
32. Kulkarni-Narla A, Brown DR. Localization of CB1-cannabinoid receptor immunoreactivity in the porcine enteric nervous system. Cell Tissue Res 2000; 302(1):73–80.
33. Greenberg I, Kuehnle J, Mendelson JH et al. Effects of marihuana use on body weight and caloric intake in humans. Psychopharmacology (Berl) 1976; 49(1): 79–84.
34. Foltin R et al. Behavioral analysis of marijuana effects on food intake in humans. Pharmacol Biochem Behav 1986; 25(3): 577–582.
35. Foltin R et al. Effects of smoked marijuana on food intake and body weight of humans living in a residential laboratory Appetite 1988; 11(1): 1–14.
36. Beal JE, Olson R, Laubenstein L et al. Dronabinol as a treatment for anorexia associated with weight loss in patients with AIDS. J Pain Symptom Manage 1995; 10(2): 89–97.
37. Gonzalez-Rosales F, Walsh D Intractable nausea and vomiting due to gastrointestinal mucosal metastases relieved by tetrahydrocannabinol (dronabinol). J Pain Symptom Manage 1997; 14 : 311–314.
38. Musty R, Rossi R. Effects of smoked cannabis and oral delta-9-tetrahydrocannabinol on nausea and emesis after cancer chemotherapy: a review of state clinical trials. Journal of Cannabis Therapeutics 2001; 1(1): 29–56.
39. Partosoedarso ER, Abrahams TP, Scullion RT et al. Cannabinoid 1 receptor in the dorsal vagal complex modulates lower oesophageal sphincter relaxation in ferrets. J Physiol 2003; 550(Pt 1): 149–158.
40. Lehmann A, Blackshaw LA, Brändén L et al. Cannabinoid receptor agonism inhibits transient lower esophageal sphincter relaxations and reflux in dogs. Gastroenterology 2002; 123(4): 1129–1134.
41. Izzo AA, Mascolo N, Pinto L et al. The role of cannabinoid receptors in intestinal motility, defecation and diarrhoea in rats. Eur J Pharmacol 1999; 384(1): 37–42.
42. Mancinelli R, Fabrizi A, Del Monaco S et al. Inhibition of peristaltic activity by cannabinoids in the isolated distal colon of mouse. Life Sci 2001; 69(1):101–111.
43. Singh U, Singh NP, Singh B et al. Role of resveratrol-induced CD11b+ Gr-1+ myeloid derived suppressor cells (MDSCs) in the reduction of CXCR3+ T cells and amelioration of chronic colitis in IL-10−/ − mice. Brain Behav Immun 2012; 26(1): 72–82.
44. Schicho R, Storr M Patients with IBD find symptom relief in the Cannabis field. Nat Rev Gastroenterol Hepatol.2014; 11(3): 142–143.
45. Marquéz L, Suárez J, Iglesias M et al. Ulcerative colitis induces changes on the expression of the endocannabinoid system in the human colonic tissue. PLoS One 2009; 4(9): e6893. Dostupné z DOI: <http://dx.doi.org/10.1371/journal.pone.0006893>.
46. Di Sabatino A, Battista N, Biancheri P et al. The endogenous cannabinoid system in the gut of patients with inflammatory bowel disease. Mucosal immunol 2011; 4(5): 574–583.
47. Alhouayek M, Muccioli GG. The endocannabinoid system in inflammatory bowel diseases: from pathophysiology to therapeutic opportunity. Trends Mol Med 2012; 18(10): 615–625.
48. Capasso R, Borrelli F, Aviello G et al. Cannabidiol, extracted from Cannabis sativa, selectively inhibits inflammatory hypermotility in mice. Br J Pharmacol 2008; 154(5):1001–1008.
49. Naftali T, Lev LB, Yablecovitch D, Half E et al. Treatment of Crohn’s disease with cannabis: an observational study. Isr Med Assoc J 2011; 13(8): 455–458.
50. Naftali T, Bar-Lev Schleider L, Dotan I et al. Cannabis induces a clinical response in patients with Crohn’s disease: a prospective placebo-controlled study. Clin Gastroenterol Hepatol 2013; 11(10): 1276–1280.
51. Hazekamp A, Ruhaak R, Zuurman L et al. Evaluation of a vaporizing device (Volcano(R)) for the pulmonary administration of tetrahydrocannabinol. J Pharm Sci 2006; 95(6): 1308–1317.
Labels
Diabetology Endocrinology Internal medicine Neurology General practitioner for adults Rheumatology Clinical oncology Orthopaedics Pain management
Article was published inInternal Medicine

2015 Issue 7-8-
All articles in this issue
- Transplantace pankreatu: současný stav a výhledy do budoucna
- Tumory a transplantace jater
- Transplantace solidních orgánů v České republice
- Konopí – léčba budoucnosti?
- Novinky v léčbě akutního nevarikózního krvácení do horní části gastrointestinálního traktu
- Domácí nutriční péče v České republice
- Vitamin D – stará látka s novými perspektivami
- Možnosti endoskopického řešení polypoidních a nepolypoidních lézí v kolon
- Obyčejná nemoc – apendicitida
- Platí „LDL-hypotéza“ i pro pacienty s diabetem?
- Snížení krevního tlaku – léčbou dalších rizikových faktorů
- Jak na dyslipidemii u pacientů s metabolickým syndromem
- Transplantace ledviny při inkompatibilitě krevní skupiny – úvodní zkušenosti programu
- Takotsubo (stresová) kardiomyopatie – co se změnilo? – editorial
- Rizikové faktory vzniku karcinomu štítné žlázy – editorial
- Takotsubo kardiomyopatie, klinické zkušenosti s onemocněním a jednoletá prognóza pacientů
- Infuzní toxicita rituximabu u nemocných s chronickou lymfocytární leukemií
- Kardiovaskulární účinky léčby GLP-1 agonisty se zaměřením na liraglutid
- Transkatétrová implantácia aortálnej chlopne – indikácie, priebeh intervencie a výsledky
- Hepatorenální syndrom – patofyziologie, diagnostika a léčba
- Rizikové faktory vzniku karcinomu štítné žlázy
-
Erektilná dysfunkcia ako prvý znak systémových cievnych chorôb a orgánovovaskulárnych artériových ischemických chorôb
Odporúčania a výzva Angiologickej sekcie Slovenskej lekárskej komory (2015)
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Obyčejná nemoc – apendicitida
- Transkatétrová implantácia aortálnej chlopne – indikácie, priebeh intervencie a výsledky
- Hepatorenální syndrom – patofyziologie, diagnostika a léčba
-
Erektilná dysfunkcia ako prvý znak systémových cievnych chorôb a orgánovovaskulárnych artériových ischemických chorôb
Odporúčania a výzva Angiologickej sekcie Slovenskej lekárskej komory (2015)
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career



