-
Medical journals
- Career
Transplantace ledviny při inkompatibilitě krevní skupiny – úvodní zkušenosti programu
Authors: Ondřej Viklický 1; Alena Paříková 1; Janka Slatinská 1; Vladimír Hanzal 1; Libuše Pagáčová 2; Eva Honsová 3; Eva Kieslichová 4; Libor Janoušek 5; Jiří Froněk 5
Authors‘ workplace: Klinika nefrologie IKEM Praha, přednosta prof. MUDr. Ondřej Viklický, CSc. 1; Pracoviště laboratorních metod IKEM Praha, přednosta prof. MUDr. Antonín Jabor, CSc. 2; Pracoviště klinické a transplantační patologie IKEM Praha, přednostka doc. MUDr. Eva Honsová, Ph. D. 3; Klinika anestezie, resuscitace a intenzivní péče IKEM Praha, přednostka MUDr. Eva Kieslichová, Ph. D. 4; Klinika transplantační chirurgie IKEM Praha, přednosta doc. MUDr. Jiří Froněk, Ph. D., FRCS 5
Published in: Vnitř Lék 2015; 61(7-8): 725-730
Category: Vanýsek´s day 2015
Overview
Transplantace ledviny od žijícího dárce inkompatibilního v krevní skupině představuje nový nástroj, jak zvýšit dostupnost transplantací. Většina evropských protokolů je založena na desenzitizačním protokolu s rituximabem, trojkombinace imunosupresiv, intravenózních imunoglobulinů a specifické imunoadsorpce, při které jsou z plazmy odstraňovány konkrétní hemaglutininy. Program transplantací ledvin od inkompatibilních dárců v krevní skupině byl v našem centru založen v roce 2011. Dosud bylo provedeno 21 těchto transplantací. Nejvyšší titr hemaglutininů před rituximabem byl 1 : 64 a korespondující počty imunoadsorpcí před transplantací od 2 do 9 výkonů. Po transplantaci byly imunoadsorpce prováděny podle aktuálního titru hemaglutininů 1–2krát u 5 nemocných. V posledních 2 letech jsou tyto transplantace nabízeny inkompatibilním příjemcům, kteří nenaleznou uplatnění v systému párových výměn ledvin anebo se účastní párové výměny s cílem dosáhnout vyšší míry shody v HLA antigenech. Hlavní komplikací bylo častější pooperační krvácení a infekce močových cest u rizikových nemocných. Ve většině protokolárních biopsií byla popsána pozitivita C4d barvení. Nebyla pozorována ztráta štěpu ani úmrtí nemocných.
Klíčová slova:
AB0 inkompatibilita – glykosorb – imunoadsorpce – transplantace ledvinyÚvod
Transplantace ledviny od žijícího dárce je nejvýhodnější metodou léčby chronického selhání ledvin, protože přežívání štěpů je oproti kadaverózním transplantacím delší a další nespornou výhodou je, že takovou transplantaci lze provést preemptivně, tzn. ještě před zahájením dialyzační léčby. V posledních letech proto došlo k velikému rozvoji transplantací ledvin od žijících dárců také u nás. V roce 2010 bylo v ČR provedeno těchto transplantací jenom 17, kdežto v roce 2013 to bylo 83 a v roce 2014 pak 63. Oproti tomu ve stejných letech bylo provedeno 347, respektive 377 a 444 transplantací od zemřelých dárců (www.kst.cz). Další výhodou transplantací ledviny od žijících dárců je zvýšení dostupnosti transplantací ledvin pro ostatní nemocné v čekací listině, protože se tímto způsobem sníží kohorta ostatních čekatelů.
Každý druhý potenciální dárce ledviny není při tradičním přístupu k vyšetření shledán vhodným k dárcovství, protože příjemce má buď přirozené protilátky proti jeho krevní skupině v AB0 systému nebo HLA protilátky. V současnosti ale existují metody, jak tyto překážky překonat. Jsou to transplantace od AB0 inkompatibilního (AB0i) nebo HLA inkompatibilního (HLAi) dárce, které vyžadují specifickou desensitizační přípravu nebo transplantace mezi dvěma a více inkompatibilními dvojicemi navzájem tak, aby transplantace byly kompatibilní, tedy v systému tzv. párové výměny [1].
Protože jsme chtěli rozšířit dostupnost transplantací od žijících dárců, rozhodli jsme se zahájit po vzoru některých center v západní Evropě program inkompatibilních transplantací v Institutu klinické a experimentální medicíny v Praze a v tomto příspěvku referujeme o úvodních výsledcích tohoto programu.
Metody
V ČR byl program AB0i transplantací ledvin úspěšně zahájen v lednu roku 2011 v IKEM Praha. Od té doby byla v IKEM provedena AB0i transplantace ledviny u 21 pacientů.
Nemocní a dárci
Střední věk pacientů v době transplantace byl 39 (24–71) let. Medián délky dialyzační léčby před transplantací byl 21 (3–120) měsíců, 7 pacientů bylo transplantováno preemptivně. Z dialyzovaných pacientů byli 4 léčeni peritoneální dialýzou, 10 hemodialýzou. Demografická data jsou uvedena v tab. 1.
Table 1. Demografická data a základní imunologické parametry 
aHUS – atypický hemolyticko-uremický syndrom FSGS – fokálně segmentální glomeruloskleróza GN – glomerulonefritida HLA – human leukocyte antigens PKD – polycystická choroba ledvin PRA – panel reaktivní protilátky SLE – systémový lupus erythematodes TIN – tubulointersticiální nefritida Dárcem byl v 9 případech manžel(ka) nebo partner, v 7 případech příbuzný. U 5 pacientů byla AB0i transplantace ledviny provedena v rámci párové výměny s cílem dosáhnout vyšší míry shody v HLA antigenech než s originálním dárcem. Všechny nefrektomie byly provedeny miniinvazivně (hand-assisted retroperitoneoscopic live donor nephrectomy technique – HARS), jde o laparoskopickou extraperitoenální rukou asistovanou techniku nefrektomie, která je šetrná pro dárce i ledvinu.
Desenzitizace
Desenzitizace sestávala z intravenózní aplikace rituximabu (375 mg/m2) 28–30 dní před plánovaným termínem transplantace, následovalo zahájení konvenční imunosuprese 14 dní před transplantací [2]. V rámci přípravy absolvovali pacienti v průběhu týdne před plánovaným datem transplantace imunoadsorpce (IA), jejichž počet se odvíjel od výše titru hemaglutininů proti krevně skupinovým antigenům dárce. Titry anti-A/anti-B hemaglutininů byly vyšetřovány přímým aglutinačním testem. Vzhledem k dokumentovaným těžkým hypotenzním reakcím při současné léčbě pacientů ACE inhibitory a IA byla tato medikace pacientům při zahájení imunosuprese vysazena [22]. Během IA byla plazma oddělena membránovou nebo centrifugační separací od plné krve (přístroje Art Universal, COM.TEC®). Plazma byla následně očištěna od hemaglutininů v IA koloně obsahující syntetický oligosacharidový konec A nebo B antigenu navázaný na sefarózovou matrix. Během každé IA procedury byl zpracován 2,5násobek plazmatického objemu. Všechny IA byly provedeny pomocí A, B nebo AB kolon Glycosorb® (Glycorex Transplantation AB, Lund, Sweden, obr.). Transplantace byly provedeny při poklesu titru donor specifických anti A/B protilátek < 1 : 8. Den před výkonem byla aplikována jedna dávka intravenózních imunoglobulinů (IVIG) v dávce 0,5 g/kg.
Image 1. Imunoadsorpční kolona Glycosorb a přístroj COM.TEC<sup>®</sup> 
Po transplantaci byly v průběhu 1. týdne vyšetřovány titry hemaglutininů, při jejich vzestupu > 1 : 8 byly u 5 pacientů od 2. pooperačního dne prováděny další IA procedury.
Imunosuprese
Konvenční imunosuprese byla zahájena 2 týdny před transplantací trojkombinací takrolimu (0,2 mg/kg/den s cílovou hladinou 10–15 mg/ml), mykofenolát mofetilu (2 g/den) a prednisonu (30 mg/den).
Perioperačně byl podán metylprednisolon 500 mg a u nemocných v nízkém imunologickém riziku bylo aplikováno 20 mg i.v. basiliximabu (anti-CD25 monoklonální protilátky, která blokuje receptor pro interleukin 2), nebo u nemocných ve vysokém riziku rejekce byl podán králičí antithymocytární globulin (rATG, Thymoglobulin, 1,5 mg/kg). V indukční imunosupresi se v případě basiliximabu pokračovalo 4. pooperační den ve stejné dávce a v případě rATG se pokračovalo denně do podání kumulativní dávky 5 mg/kg.
Pooperačně bylo pokračováno ve standardním imunosupresivním protokolu s cílovou hladinou takrolimu 15 ng/ml během 1. měsíce, 10 ng/ml během 2. měsíce a poté 5 ng/ml. Mykofenolát mofetil byl podáván v prvních 2 měsících 2 g denně ve 2 dávkách a následně byly dávky redukovány na 1–1,5 g denně.
Léčba prednisonem byla po transplantaci pomalu redukována dle zvyklostí centra tak, že ve 3. měsíci byla jeho dávka 5 mg denně.
Výsledky
Perioperační imunoadsorpce
Vstupní titr hemaglutininů v našem souboru kolísal od 1 : 2 k 1 : 64 před aplikací rituximabu. U jedné pacientky byl titr před zahájením IA zaznamenán 1 : 512, podobný trend ke zvýšení titru hemaglutininů byl zaznamenán u 7 pacientů. V 9 případech jsme použili kolony anti-A, v 9 případech anti-B a ve 3 případech anti-AB (tab. 1). Počty nutných výkonů k redukci titru hemaglutininů < 1 : 8 byl od 2 do 9 před transplantací, u 5 nemocných z prvních 7 jsme IA prováděli i po transplantaci ledviny. U dalších nemocných nebyly IA po transplantaci prováděny a žádný z nemocných neměl titr > 1 : 8 během 1. týdne po operaci (tab. 2).
Table 2. Výsledky programu: imunoadsorpce, komplikace, rejekce a funkce štěpu 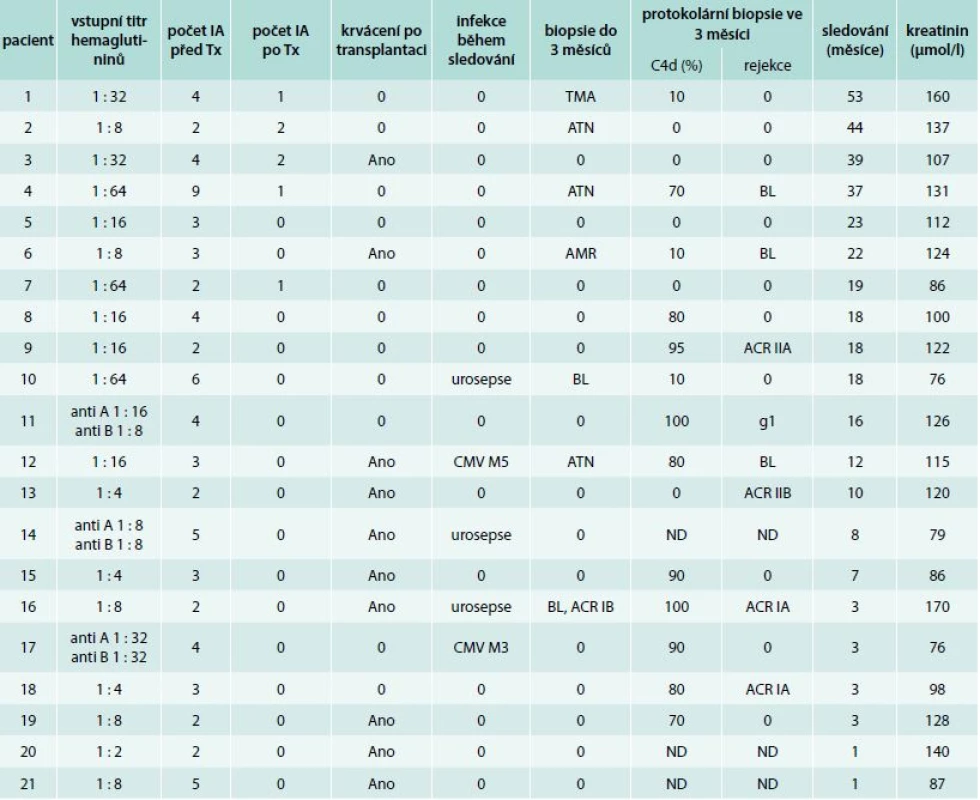
ACR – akutní celulární rejekce AMR – protilátkami zprostředkovaná rejekce antiA – hemaglutinin proti aglutinogenu A antiB – hemaglutinin proti aglutinogenu B ATN – akutní tubulární nekróza BL – hraniční změny (borderline changes) CMV – cytomegalovirus g – glomerulitida IA – imunoadsorbce M – měsíc ND – neprovedeno TMA – trombotická mikroangiopatie Tx – transplantace ledviny Uvedená hodnota sérového kreatininu je naměřená hodnota při poslední ambulantní kontrole. U prvních 7 pacientů byly IA výkony prováděny v citrátové antikoagulaci. Od roku 2013 je standardně používán k antikoagulaci během IA procedur nízkomolekulární heparin. Pouze u 2 pacientů připravovaných k transplantaci po tomto roce byl z důvodu rizika krvácení po bezprostředně předcházející obtížné kanylaci centrální žíly použit k antikoagulaci citrát. Hlavní komplikací IA výkonů při použití citrátu byly periprocedurální symptomatické hypokalcemie a těžká metabolická alkalóza především po opakovaných výkonech u pacientů v predialýze. Výkony prováděné v antikoagulaci nízkomolekulárním heparinem proběhly bez komplikací.
Pooperační průběh
Operační výkony samotné byly provedeny bez pozoruhodností až na drobné vícečetné krvácení z tukové tkáně retroperitonea popsané u 15 z 21 nemocných. Po transplantaci pak bylo krvácení vyžadující podání krevních převodů nebo operační revizi zaznamenáno celkem u 10 nemocných. Sedmi nemocným byly podány erytrocytární koncentráty pro anemizaci s ověřenými většími hematomy v okolí štěpů a operační revize byly indikovány u 3 pacientek. U 2 z důvodu pokračujícího krvácení v okolí močového měchýře a u 1 pro krvácení ze žilní anastomózy (tab. 2).
U všech nemocných se funkce štěpu rozvinula okamžitě a žádný z nemocných nepotřeboval po transplantaci dialýzu. Nicméně, u 4 nemocných byla v 1. týdnu pozorována stagnace rozvoje funkce štěpu a byla provedena biopsie.
Jeden nemocný měl biopticky ověřenu nerejekční trombotickou mikroangiopatii, která byla léčena výměnami plazmy kompatibilní i s dárcovskou krevní skupinou s úplnou restitucí histologického nálezu. Jeden nemocný měl v 1. týdnu ověřenu glomerulitidu v rámci mírné akutní protilátkami zprostředkované rejekce s průkazem DSA proti HLA antigenu I třídy s MFI 3300. Tento nemocný byl léčen 9 plazmaferézami a aplikací 3 dávek IVIG. Následně nebyly prokázány žádné DSA a funkce štěpu se normalizovala. Tento nemocný měl v protokolární 3měsíční biopsii nález hraničních změn, které byly léčeny metylprednisolonem. Jeden nemocný měl v úvodní biopsii přítomnu jenom akutní tubulární nekrózu, ve 3. měsíci ale byly v protokolární biopsii přítomny hraniční změny léčené metylprednisolonem a v 5. měsíci pak byla léčena pozdní CMV nemoc a současně pozdní celulární rejekce IIa, pro kterou byl podán rATG s úplnou restitucí funkce štěpu. Jeden nemocný měl v úvodní biopsii přítomny hraniční změny, pro které mu byl podán metylprednisolon, ale současně byla přítomna retence moči, pro kterou měl následně provedenu incizi hrdla močového měchýře. Následně byl opakovaně hospitalizován pro recidivující infekce močových cest. Tento nemocný měl pak ve 3. měsíci provedenu další biopsii s nálezem celulární rejekce, pro kterou mu byl podán rATG.
Jedna nemocná byla léčena před, při a po transplantaci ekulizumabem (anti-C5 monoklonální protilátka) z důvodů prevence rekurence atypického hemolyticko-uremického syndromu (ověřená mutace CFH, časné selhání prvního štěpu z důvodu rekurence a HUS). Tato nemocná byla rovněž léčena po transplantaci ledviny indukcí s rATG pro vyšší riziko vyplývající z druhé transplantace a PRA (panel reaktivní protilátky 50 %). Dárcovsky specifické protilátky (DSA) ale byly před transplantací negativní.
U jedné nemocné byly v době finální přípravy identifikovány DSA proti antigenu DR4 s MFI 2000. Proto byla desenzitizace rozšířena i o 3 plazmaferézy před transplantací a jednu plazmaferézu po transplantaci. Jako indukční imunosuprese byl použit rATG. Jednalo se tak o HLA inkompatibilní i AB0 inkompatibilní transplantaci ledviny.
Ve 3. měsíci byly u nemocných provedeny protokolární biopsie. Ve většině z provedených biopsií, a to včetně protokolárních, byla pozorována pozitivita C4d barvení, která koresponduje s imunologickou akomodací u těchto transplantací a není součástí protilátkami zprostředkované rejekce. V protokolárních biopsiích byla popsána u dvou pacientů rejekce Ia a IIa, hraniční změny u dvou nemocných a glomerulitida nejasného významu u jednoho nemocného (tab. 2). Všechny tyto nálezy byly léčeny metylprednisolonem, kromě jednoho pacienta s opakovanou rejekcí, který byl léčen s rATG a za situace, kdy byla funkce štěpu stabilní.
Follow-up
Všichni nemocní dosud mají stabilní funkci transplantované ledviny. Jeden nemocný má proteinurii a erytrocyturii jako obraz rekurence IgA nefropatie do štěpu.
Diskuse
V současnosti existují vypracované postupy pro AB0i transplantaci ledviny, jejichž výsledkem je stejné přežití nemocných a štěpů jako v případě kompatibilních transplantací v krevní skupině, a proto jsou tyto transplantace vedle párové výměny nabízeny nemocným, kteří mají dárce inkompatibilního v krevní skupině.
Již v roce 1989 byl v Japonsku zahájen program těchto transplantací [3]. Protokol zahrnoval předtransplantační splenektomii a titr AB protilátek byl snižován pomocí plazmaferézy nebo plazmaferézy s dvojitou filtrací. Dlouhodobé výsledky tohoto programu ale ukázaly na horší přežívání štěpů v porovnání s kompatibilními transplantacemi [4]. Studie ze Spojených států z let 2004–2005 prokázaly, že místo splenektomie je možno použít monoklonální protilátku anti-CD20, rituximab [5,6].
Tydén et al z Karolinského institutu ve Stockholmu dále upravili protokol tak, že jeho výsledky byly srovnatelné s kompatibilními transplantacemi, a to včetně střednědobých výsledků [2,7]. Tento protokol byl následně přijat ve většině evropských center, která tyto transplantace provádějí. Hlavní nevýhodou protokolu je jeho cena, místo plazmaferéz se používají specifické imunoabsorpční kolony, které z plazmy odstraní výhradně konkrétní hemaglutiny (A, B, AB). Zřejmě levnější alternativa spočívá v použití nespecifických imunoabsorpčních kolon, kterými jsou z plazmy odstraňovány prakticky všechny imunoglobuliny [8].
Naše centrum se rozhodlo při přípravě protokolu vyjít ze švédských zkušeností [2], protokol byl ale modifikován po vzoru některých německých a rakouských center [9,10]. Selektivní IA jsme prováděli v 1. týdnu obden, u vyšších titrů hemaglutininů denně tak, aby finální titr hemaglutininů byl 1 : 4 a nižší. U většiny nemocných jsme byli schopni dosáhnout úplné eliminace hemaglutininů před transplantací. Intravenózní imunoglobuliny byly podávány den před operací. Selektivní imunoadsorpce byly nemocnými dobře snášeny s výjimkou důsledků zvolené antikoagulace. Citrátová antikoagulace byla spojena s rizikem symptomatických hypokalcemií a metabolické alkalózy, zvláště u dosud nedialyzovaných nemocných.
Další zjevnou komplikací protokolu bylo častější perioperační a pooperační krvácení, které nebývá takto časté u kompatibilních transplantací. Mechanizmy nejsou jasné, ale výskyt krvácivých komplikací je v literatuře již znám a zřejmě nezávisí jenom na typu zvolené aferetické metody nebo hemodiluci, protože častější krvácení je popisováno jak u plazmaferéz [11,12], tak u selektivní imunoabsorpce a závisí na počtu provedených IA výkonů [13,14].
Infekční komplikace jsou popisovány rovněž častěji u AB0i transplantací a zřejmě souvisí s podaným rituximabem nebo splenektomií [12]. V případě rituximabu je zjevné, že deplece B-lymfocytů jako antigen prezentujících buněk vede k poruše aktivace T-lymfocytů, což může mít za důsledek vyšší výskyt virových i bakteriálních infekcí [15]. V našem souboru jsme několika nemocným podali v rámci profylaxe nebo léčby rejekce také králičí antithymocytární globulin. Je jasné, že jsme tak zvýšili riziko vzniku infekčních komplikací. V našem souboru jsme pozorovali u 3 nemocných infekční komplikace. Jednalo se ale výhradně o bakteriální infekce močových cest a nikoliv o infekce virové. Je rovněž třeba říci, že 2 ze 3 nemocných měli dysfunkci močových cest již před samotnou transplantací, což je známým rizikovým faktorem potransplantačních infekčních komplikací [16].
I když byl výskyt rejekcí nízký, je ale třeba poznamenat, že jsme do programu AB0i transplantací ledvin zařadili až na jednu výjimku nemocné s nízkým rizikem rejekce. Z tohoto pohledu stojí za komentář 2 pozdní rejekce léčené s rATG. Interpretace bioptických nálezů u AB0i transplantací je problematická, protože depozice C4d svědčí pro akomodaci, a nikoliv pro rejekci [17]. Na druhou stranu přítomnost tubulointersticální inflamace u těchto biopsií je spojena s dysfunkcí štěpu [18]. Je zajímavé, že dosud neexistují jasné důkazy o výhodách rituximabu v prevenci akutní rejekce [19]. Nyní víme, že přítomnost naivních a nezralých B-lymfocytů je spojena s nižším výskytem akutní rejekce [20]. Z tohoto pohledu může být aplikace rituximabu v desenzitizačních protokolech problematická, protože se počet naivních a nezralých B-lymfocytů nesoucích CD20 významně sníží.
V poslední době jsme AB0i transplantace ledviny začali nabízet nemocným zařazeným v systému párové výměny za situace, kdy nenalezli kompatibilního dárce. Jedná se většinou o příjemce krevní skupiny 0, kteří obtížně naleznou kompatibilního dárce v programu párových výměn. Transplantace ledviny se tak urychlí, což má pro nemocné nesporný význam, protože setrvání na dialýze může být spojeno s mnohými riziky, které mohou budoucí transplantaci znemožnit. Zařazení AB0i transplantací do párové výměny má smysl tehdy, pokud dojde ke zvýšení shody v HLA antigenech mezi dárcem a příjemcem. Navíc lze transplantaci provést pro dotyčné rychleji a také se současně uplatní více dvojic. Tento systém je v současnosti již používán v některých jiných centrech [21].
Závěr
Je možno shrnout, že AB0i transplantace ledviny představují možnost, jak zvýšit dostupnost transplantací ledvin [23]. Tento program jsme úspěšně v IKEM Praha zavedli v roce 2011 a dosavadní výsledky nás opravňují k jeho pokračování. Vzhledem k tendenci k vyššímu výskytu pooperačního krvácení, infekčních komplikací u rizikových nemocných a nejasnosti ohledně výskytu akutní rejekce, tedy komplikacím popsaným jak v našem souboru, tak i v literatuře, je vhodnější tyto transplantace paušálně nabízet nízkorizikovým nemocným s nižšími titry hemaglutininů a jako doplňkový program k párovým výměnám. Nicméně pro některé nemocné může transplantace od žijícího inkompatibilního dárce představovat jedinou reálnou možnost jak rychle dosáhnout transplantace.
Studie byla podpořena Institutem klinické a experimentální medicíny č. MZO 00023001.
Poděkování
Autoři děkují Zuzaně Eretové, Simoně Ptáčkové, sestrám dialyzačního oddělení a klinického oddělení Kliniky nefrologie IKEM, koordinátorkám Renatě Zámečníkové a Haně Maňáskové za nezištnou a obětavou pomoc. Speciální dík patří emeritnímu řediteli IKEM doc. MUDr. Janu Malému, CSc., za podporu při zavedení programu AB0i transplantací ledvin do praxe.
prof. MUDr. Ondřej Viklický, CSc.
ondrej.viklicky@ikem.cz
Klinika nefrologie TC IKEM, Praha
www.ikem.cz
Doručeno do redakce 13. 7. 2015
Přijato po recenzi 14. 7. 2015
Sources
1. Maggiore U, Oberbauer R, Pascual J et al. ERA-EDTA-DESCARTES Working Group. Strategies to increase the donor pool and access to kidney transplantation: an international perspective. Nephrol Dial Transplant 2015; 30(2): 217–222.
2. Tydén G, Kumlien G, Genberg H et al. AB0 incompatible kidney transplantations without splenectomy, using antigen-specific immunoadsorption and rituximab. Am J Transplant 2005; 5(1): 145–148.
3. Agishi T, Takahashi K, Yagisawa T et al. Immunoadsorption of anti-A or anti-B antibody for successful kidney transplantation between ABO incompatible pairs and its limitation. Japanese Biosynsorb Research Group. ASAIO Trans 1991; 37(3): M496-M498.
4. Tanabe K, Takahashi K, Sonda K et al. Long-term results of ABO-incompatible living kidney transplantation: a single-center experience. Transplantation 1998; 65(2): 224–228.
5. Sonnenday CJ, Warren DS, Cooper M et al. Plasmapheresis, CMV hyperimmune globulin, and anti-CD20 allow ABO-incompatible renal transplantation without splenectomy. Am J Transplant 2004; 4(8): 1315–1322.
6. Segev DL, Simpkins CE, Warren DS et al. AB0 incompatible high-titer renal transplantation without splenectomy or anti-CD20 treatment. Am J Transplant 2005; 5(10): 2570–2575.
7. Genberg H, Kumlien G, Wennberg L et al. AB0-incompatible kidney transplantation using antigen-specific immunoadsorption and rituximab: a 3-year follow-up. Transplantation 2008; 85(12): 1745–1754.
8. Hickstein H, Koball S, Lehmann R et al. AB0 incompatible kidney transplantation using unspecific immunoadsorption. Transfus Apher Sci 2014; 50(2): 263–266.
9. Wilpert J, Geyer M, Teschner S et al. AB0-incompatible kidney transplantation-proposal of an intensified apheresis strategy for patients with high initial isoagglutinine titers. J Clin Apher 2007; 22(6): 314–322.
10. Haidinger M, Schmaldienst S, Körmöczi G et al. Vienna experience of ABO-incompatible living-donor kidney transplantation. Wien Klin Wochenschr 2009; 121(7–8): 247–255.
11. Kim MH, Jun KW, Hwang JK et al. Risk factors for postoperative bleeding in AB0-incompatible kidney transplantation. Clin Transplant 2015; 29(4): 365–372.
12. Lentine KL, Axelrod D, Klein C et al. Early clinical complications after AB0-incompatible live-donor kidney transplantation: a national study of Medicare-insured recipients. Transplantation 2014; 98(1): 54–65.
13. de Weerd AE, van Agteren M, Leebeek FW et al. AB0-incompatible kidney transplant recipients have a higher bleeding risk after antigen-specific immunoadsorption. Transpl Int 2015; 28(1): 25–33.
14. Renner FC, Czekalinska B, Kemkes-Matthes B et al. Postoperative bleeding after AB0-incompatible living donor kidney transplantation. Transplant Proc 2010; 42(10): 4164–4166.
15. Schachtner T, Stein M, Reinke P. AB0 desensitization affects cellular immunity and infection control after renal transplantation. Transpl Int 2015. Dostupné z DOI: <http://dx.doi.org/10.1111/tri.12616>.
16. Esezobor CI, Nourse P, Gajjar P. Urinary tract infection following kidney transplantation: frequency, risk factors and graft function. Pediatr Nephrol 2012; 27(4): 651–657.
17. Fehr T, Stussi G. AB0-incompatible kidney transplantation. Curr Opin Organ Transplant 2012; 17(4): 376–385.
18. Couzi L, Perera R, Manook M et al. Incidence and Outcome of C4d Staining With Tubulointerstitial Inflammation in Blood Group-incompatible Kidney Transplantation. Transplantation 2015; 99(7): 1487–1494.
19. Macklin PS, Morris PJ, Knight SR. A systematic review of the use of rituximab as induction therapy in renal transplantation. Transplant Rev (Orlando) 2015; 29(2): 103–108.
20. Viklicky O, Krystufkova E, Brabcova I et al. B-cell-related biomarkers of tolerance are up-regulated in rejection-free kidney transplant recipients. Transplantation 2013; 95(1): 148–154.
21. Ferrari P, Hughes PD, Cohney SJ et al. AB0-incompatible matching significantly enhances transplant rates in kidney paired donation. Transplantation 2013; 96(9): 821–826.
22. Genberg H, Kumlien G, Wennberg L et al. Isoagglutinin adsorption in AB0-incompatible transplantation. Transfus Apher Sci 2010; 43(2): 231–235.
23. Opelz G, Morath C, Süsal C et al. Three-year outcomes following 1420 AB0-incompatible living-donor kidney transplants performed after ABO antibody reduction: results from 101 centers. Transplantation 2015; 99(2): 400–404.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2015 Issue 7-8-
All articles in this issue
- Transplantace pankreatu: současný stav a výhledy do budoucna
- Tumory a transplantace jater
- Transplantace solidních orgánů v České republice
- Konopí – léčba budoucnosti?
- Novinky v léčbě akutního nevarikózního krvácení do horní části gastrointestinálního traktu
- Domácí nutriční péče v České republice
- Vitamin D – stará látka s novými perspektivami
- Možnosti endoskopického řešení polypoidních a nepolypoidních lézí v kolon
- Obyčejná nemoc – apendicitida
- Platí „LDL-hypotéza“ i pro pacienty s diabetem?
- Snížení krevního tlaku – léčbou dalších rizikových faktorů
- Jak na dyslipidemii u pacientů s metabolickým syndromem
- Transplantace ledviny při inkompatibilitě krevní skupiny – úvodní zkušenosti programu
- Takotsubo (stresová) kardiomyopatie – co se změnilo? – editorial
- Rizikové faktory vzniku karcinomu štítné žlázy – editorial
- Takotsubo kardiomyopatie, klinické zkušenosti s onemocněním a jednoletá prognóza pacientů
- Infuzní toxicita rituximabu u nemocných s chronickou lymfocytární leukemií
- Kardiovaskulární účinky léčby GLP-1 agonisty se zaměřením na liraglutid
- Transkatétrová implantácia aortálnej chlopne – indikácie, priebeh intervencie a výsledky
- Hepatorenální syndrom – patofyziologie, diagnostika a léčba
- Rizikové faktory vzniku karcinomu štítné žlázy
-
Erektilná dysfunkcia ako prvý znak systémových cievnych chorôb a orgánovovaskulárnych artériových ischemických chorôb
Odporúčania a výzva Angiologickej sekcie Slovenskej lekárskej komory (2015)
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Obyčejná nemoc – apendicitida
- Transkatétrová implantácia aortálnej chlopne – indikácie, priebeh intervencie a výsledky
- Hepatorenální syndrom – patofyziologie, diagnostika a léčba
-
Erektilná dysfunkcia ako prvý znak systémových cievnych chorôb a orgánovovaskulárnych artériových ischemických chorôb
Odporúčania a výzva Angiologickej sekcie Slovenskej lekárskej komory (2015)
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

