-
Medical journals
- Career
Akutní a chronická antikoagulační léčba u kloubních náhrad
Authors: Jaroslav Malý
Authors‘ workplace: IV. interní hematologická klinika LF UK a FN Hradec Králové, přednosta doc. MUDr. Pavel Žák, Ph. D.
Published in: Vnitř Lék 2015; 61(6): 574-581
Category:
Předneseno na mezioborovém sympoziu s postgraduálním zaměřením „Diabetik – společný pacient diabetologa a ortopeda“ 10. října 2014 v Hradci Králové
Overview
Tromboembolická nemoc (TEN) je významný společensko-zdravotní problém. Je zřejmé, že východiskem je profylaxe TEN v klinických oborech, nikoli léčba sama. Lze usuzovat, že efektivní profylaxe ve svém důsledku snižuje náklady na následnou léčbu. Smrtící plicní embolie (PE) může představovat první a konečnou klinickou prezentaci u nemocných s asymptomatickou hlubokou žilní trombózou. Z těchto důvodů je nutná systematická prevence žilní tromboembolie u nemocných se zvýšeným rizikem. Bohužel farmakologická prevence se užívá méně, než by bylo třeba. Nedílnou součástí profylaxe TEN jsou fyzikální metody. Farmakologické možnosti profylaxe tromboembolické nemoci se v posledních 10 letech výrazně rozšířily. Pro profylaxi TEN po totální náhradě (TEP) kyčelního a kolenního kloubu je třeba dodržovat tyto zásady: profylaxe TEN by měla být prováděna LMWH, fondaparinuxem, dabigatranem, rivaroxabanem nebo apixabanem po dobu 28–35 dnů u kyčelního kloubu a nejméně po dobu 14 dní od operace kolenního kloubu. Použití ASA, dextranu a UFH jako tromboprofylaxe po TEP kyčelního kloubu a kolenního kloubu nemá v rámci ČR opodstatnění. Fyzikální prostředky (kompresní punčochy s graduovaným tlakem nebo IPC) je možno použít jako doplněk doporučené farmakologické léčby, neměly by být používány samostatně kromě případů, kdy je farmakologická tromboprofylaxe kontraindikována.
Klíčová slova:
apixaban – dabigatran – LMWH – rivaroxaban – totální náhrada kyčelního a kolenního kloubu – tromboembolická nemocÚvod
Úrovní profylaxe tromboembolické nemoci na klinických odděleních se zabývala epidemiologická studie ENDORSE, která se jako první celosvětová studie zabývala i riziky tromboembolické nemoci. Studie měla bezprecedentní rozsah – proběhla ve 32 zemích, 358 nemocnicích a soustředila data od 68 183 nemocných. Na základě údajů z chirurgických a interních pracovišť zjišťovala, zda hospitalizovaní pacienti, kteří splňují kritéria ACCP (American College of Chest Physicians) v riziku tromboembolické nemoci, dostávají či nedostávají odpovídající tromboprofylaxi. Primárním cílem bylo zjištění prevalence akutních interních a chirurgických nemocných v riziku žilní tromboembolie. Studie ENDORSE poukázala i na úroveň tromboprofylaxe v České republice. Do studie bylo zařazeno 10 nemocnic s celkem 7 027 lůžky. Hodnoceno bylo 3 609 lůžek na interních a chirurgických odděleních, data se podařilo získat od 2 988 nemocných. Na chirurgických odděleních je podle kritérií ACCP 63 % nemocných v riziku tromboembolické nemoci (TEN), z nichž 74 % dostává řádnou tromboprofylaxi. Na interních odděleních v českých nemocnicích je 34 % pacientů v riziku tromboembolické nemoci a pouze 44 % z nich dostává řádnou tromboprofylaxi TEN. Téměř 60 % nemocných na interních odděleních v České republice není žádným způsobem chráněno proti definovanému riziku TEN. Studie ENDORSE jasně prokázala vysokou prevalenci nemocných v riziku TEN a nutnost změny v četnosti profylaxe TEN a vedla TEN jako významný společensko-zdravotní problém. Je zřejmé, že východiskem je profylaxe TEN v klinických oborech, nikoli léčba sama. Lze usuzovat, že efektivní profylaxe ve svém důsledku snižuje náklady na následnou léčbu. Účinná a bezpečná prevence výrazně snižuje náklady na následnou léčbu TEN a antikoagulační prevence v operačních oborech a vnitřním lékařství je v EU i ČR značně podceňována [1].
Smrtící plicní embolie (PE) může představovat první a konečnou klinickou prezentaci u nemocných s asymptomatickou hlubokou žilní trombózou. Navíc neinvazivní testy mají nízkou senzitivitu v rozpoznávání hluboké žilní trombózy u asymptomatických nemocných. Z těchto důvodů je nutná systematická prevence žilní tromboembolie u nemocných se zvýšeným rizikem. Bohužel farmakologická prevence se užívá méně, než by bylo třeba [2].
Nedílnou součástí profylaxe TEN jsou fyzikální metody. Důležitá je časná mobilizace nemocného po operacích, cvičení – dorzální a plantární flexe nohou po dobu alespoň jedné minuty každou hodinu u nemocných upoutaných na lůžko (pooperační stavy, srdeční selhání, systémové infekce, cévní mozkové příhody), elastické antitrombotické punčochy (komprese na nártu okolo 20 mm Hg). Nejúčinnější fyzikální prevencí je intermitentní elastická komprese nafukovacími punčochami. Užívá se hlavně u nemocných, u nichž by i malé krvácení představovalo vážnou komplikaci (neurochirurgie). Farmakologické možnosti profylaxe tromboembolické nemoci se v posledních 10 letech výrazně rozšířily. Navzdory objevení nových léků a průkazu jejich účinnosti v profylaxi TEN není dosud nalezeno ideální antitrombotikum. Přehled vlastností současných antitrombotik předkládá tab. 1.
Table 1. Přehled účinků nových antitrombotik v hemostáze 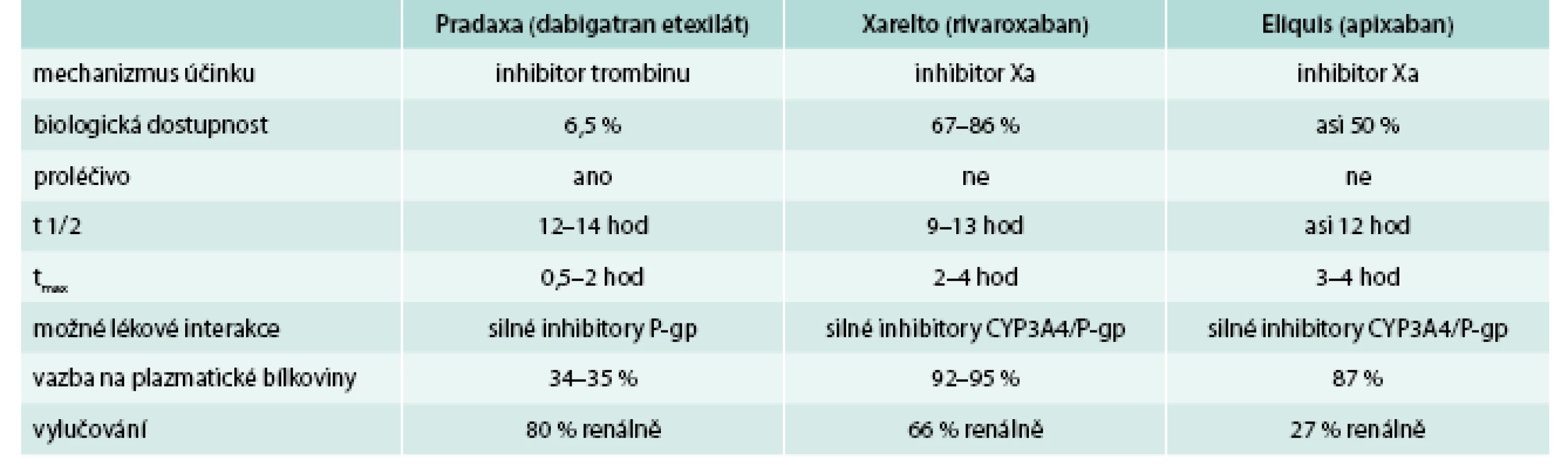
Dabigatran etexilát
Dabigatran etexilát je proléčivo o malé molekule, které nevykazuje žádnou farmakologickou aktivitu. Po perorálním podání se dabigatran etexilát rychle vstřebává a je v plazmě a v játrech konvertován na dabigatran cestou hydrolýzy katalyzované esterázou. Dabigatran je kompetitivním, reverzibilním a přímým inhibitorem trombinu a je hlavním účinným činitelem v plazmě. Dabigatran inhibuje také volný trombin, trombin navázaný na fibrin a agregaci krevních destiček navozenou trombinem [3,4]. Existuje jasná korelace mezi plazmatickou koncentrací dabigatranu a stupněm antikoagulačního účinku. Po perorálním podání je dabigatran etexilát rychle a úplně konvertován na dabigatran, který je účinnou formou v plazmě. Hydrolytické štěpení proléčiva dabigatran etexilátu na aktivní dabigatran představuje hlavní metabolickou reakci. Absolutní biologická dostupnost dabigatranu po perorálním podání je přibližně 6,5 %. Vazba dabigatranu na plazmatické bílkoviny je nízká (35 %), nezávislá na koncentraci a dabigatran je na rozdíl od přímých inhibitorů Xa dialyzovatelný. Distribuční objem dabigatranu 60–70 l převyšuje objem celkové tělesné vody, což svědčí o středně významné tkáňové distribuci dabigatranu. Maximální plazmatická koncentrace léčiva (Cmax) a plocha pod křivkou plazmatických koncentrací (AUC) v čase byly úměrné dávce. Plazmatické koncentrace dabigatranu vykázaly biexponenciální pokles s průměrným terminálním poločasem 12–14 hod u zdravých dobrovolníků a 14–17 hod u pacientů podstupujících velkou ortopedickou operaci. Poločas nebyl závislý na dávce [5,6]. Jídlo neovlivňuje biologickou dostupnost dabigatranu, ale zpožďuje čas dosažení maximální plazmatické koncentrace o 2 hod [7]. Dabigatran je vylučován zejména (asi v 80 %) v nezměněné formě močí, rychlostí přibližně 100 ml/min, což odpovídá rychlosti glomerulární filtrace, zbytek je vylučován biliárním systémem [8].
U pacientů s těžkou poruchou funkce ledvin (ClR < 30 ml/min) je léčba dabigatranem kontraindikována.
Indikace
Primární prevence žilních tromboembolických příhod u dospělých pacientů, kteří podstoupili elektivní totální náhradu kyčelního nebo kolenního kloubu. Prevence cévní mozkové příhody a systémové embolie u dospělých pacientů s nevalvulární fibrilací síní (NVFS), s jedním nebo více rizikovými faktory, jako je cévní mozková příhoda nebo tranzitorní ischemická ataka (TIA) v anamnéze; věk ≥ 75 let; srdeční selhání (NYHA třída ≥ II); diabetes mellitus; hypertenze. Léčba hluboké žilní trombózy (DVT) a plicní embolie (PE) a prevence rekurence DVT a PE u dospělých pacientů.
Monitorování antikoagulačního účinku
Vzhledem k předvídatelnému farmakologickému profilu dabigatranu s fixním dávkováním není nutná laboratorní kontrola léčby. Dilutovaný trombinový čas (dTT), ekarinový koagulační čas (ECT) a aktivovaný parciální tromboplastinový čas (aPTT) mohou poskytnout užitečné informace o stavu koagulace. V akutních situacích jsou aPTT (aktivovaný parciální tromboplastinový test) a trombinový čas nejčastěji dostupnými metodami pro monitorování antikoagulačního efektu dabigatranu, ale aPTT je méně senzitivní v supraterapeutických koncentracích dabigatranu. Protrombinový čas (INR) je málo senzitivní test, a nemůže být tedy pro sledování působení dabigatranu doporučován [9].
Lékové interakce
Dabigatran etexilát není metabolizován systémem cytochromu P450 a nemá žádný klinický účinek na enzymy lidského cytochromu P450. Je nutná opatrnost při podávání silných inhibitorů glykoproteinu P, jako je verapamil, při jehož současném podání s dabigatranem je nutno snížit dávku. Ketokonazol, cyklosporin, itrakonazol, takrolimus a dronedaron jsou kontraindikovány. Silné induktory glykoproteinu P, jako je rifampicin a třezalka tečkovaná, mohou snižovat expozici dabigatranu a nedoporučuje se současné podávání
Dabigatran v prevenci TEN v ortopedii byl prověřen řadou klinických studií, ze kterých vybíráme studie v programu RE-VOLUTION (tab. 2) [7,10,11].
Table 2. Přehled klinických studií RE-VOLUTION 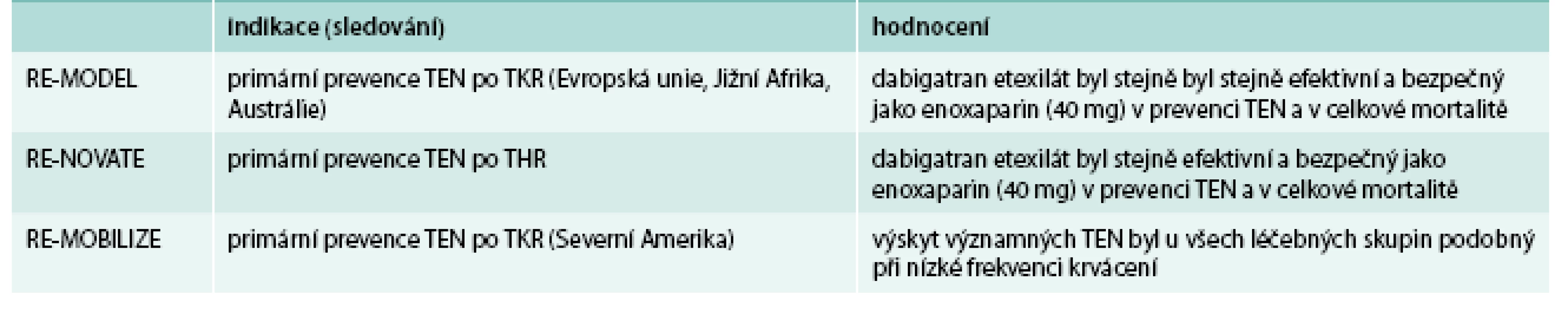
Rivaroxaban
Mechanizmus účinku rivaroxabanu
Rivaroxaban je selektivní inhibitor faktoru Xa, který má rychlý nástup účinku (3 hod) a poločas účinku 9 hod. Rivaroxaban se váže přímo na koagulační faktor Xa, a to prostřednictvím interakce mezi jeho centrální oxazolidinonovým centrem a chlorotiofenovou a morfolinovou doménou. Faktor Xa je touto interakcí inhibován, přičemž inhibiční koncentrace IC50 odpovídá 21 nM. Tromboplastinový čas (PT) je zdvojnásoben při lokální koncentraci 230 nM a aktivovaný parciální tromboplastinový čas (aPTT) při 690 nM. Rivaroxaban tak de facto zabraňuje vzniku trombinu při IC50 –25 nM; kompletní inhibice byla popsána při koncentraci 80 nM [12].
Farmakologické vlastnosti rivaroxabanu
Rivaroxaban v přímé závislosti na dávce blokuje aktivitu faktoru Xa, stejně tak jako prodlužuje PT, aPTT či HepTest s maximálním účinkem za 1–4 hod po podání. Maximální inhibice aktivity faktoru Xa se pohybuje v rozmezí mezi 22 a 68 % a trvá přibližně po dobu 12 hod při podání vyšší dávky než 5 mg.
Farmakokinetické vlastnosti rivaroxabanu
Rivaroxaban má rychlý nástup účinku, přičemž maximální plazmatické koncentrace (Cmax) bývá dosaženo v rozmezí 2,5–4 hod. V cirkulaci nebyla zjištěna přítomnost jakýchkoliv jeho farmakologicky aktivně působících metabolitů. Eliminace se řídí kinetikou 1. řádu a do určité míry může být ovlivněna věkem, činností ledvin či současným podáváním silných inhibitorů cytochromu P450 3A4. Rivaroxaban má duální vylučování. Vylučuje se z 65 % ledvinami a z 35 % biliární stolicí. Biologický poločas rivaroxabanu je při ustáleném stavu udáván v rozmezí mezi 5,7–9,2 hod; u seniorů pak 9–13 hod [22]. K jeho výhodám patří, že má minimální interakci s cytochromem P450, což vede k menší interakci s léky, které s cytochromem P-450 vstupují do kontaktu. Ovlivňuje tromboplastinový test (INR) a méně také aktivovaný parciální tromboplastinový test (aPTT). Lze jej monitorovat také pomocí stanovení antiXa [13].
Farmakologicky je důležité, že inhibice faktoru Xa rivaroxabanem účinně předchází „explozi“ generace trombinu, tím předchází další potenciaci generace trombinu mechanizmem pozitivní zpětné vazby. Inhibice molekuly faktoru Xa může předejít aktivaci až 1 000 molekul trombinu. Inhibice trombinu interferuje s proteiny C a S1, dochází k depleci přirozených antikoagulancií. Aktivitu rivaroxabanu zvyšují významně pouze látky, které ovlivňují zároveň CYP3A4 a P-gp, což jsou inhibitory virových proteáz a některá azolová antimykotika [14].
Indikace
Prevence žilní tromboembolie (TEN) u dospělých pacientů podstupujících elektivní operativní náhradu kyčelního a kolenního kloubu. Prevence cévní mozkové příhody (CMP) a systémové embolie u dospělých pacientů s nevalvulární fibrilaci síní s jedním nebo více rizikovými faktory. Léčba hluboké žilní trombózy a prevence recidivující hluboké žilní trombózy a plicní embolie po akutní hluboké žilní trombóze u dospělých. V případě jaterní a renální nedostatečnosti je potřeba opatrnosti při podávaní, při clearance kreatininu < 15 ml/min se jeho podávání nedoporučuje.
Monitoring léčby
Monitoring léčby není nutný. Ve specifických situacích lze jeho účinek sledovat měřením aktivity FXa [13].
Lékové interakce
Rivaroxaban se nedoporučuje u pacientů současně léčených systémovými azolovými antimykotiky (jako jsou ketokonazol, itrakonazol, vorikonazol a posakonazol) nebo inhibitory proteáz HIV (např. ritonavir). Tyto léčivé látky jsou silnými inhibitory systémů CYP3A4 a současně P-gp, a proto mohou zvyšovat plazmatické koncentrace rivaroxabanu v klinicky významném rozsahu (v průměru 2,6násobek), což může vést ke zvýšenému riziku krvácení [14].
Rivaroxaban byt testován v řadě klinických studií v prevenci a léčbě žilní tromboembolické nemoci. Přehled ukončených klinických studií s rivaroxabanem ukazuje tab. 3 [15–19].
Table 3. Přehled klinických studií RECORD s rivaroxabanem 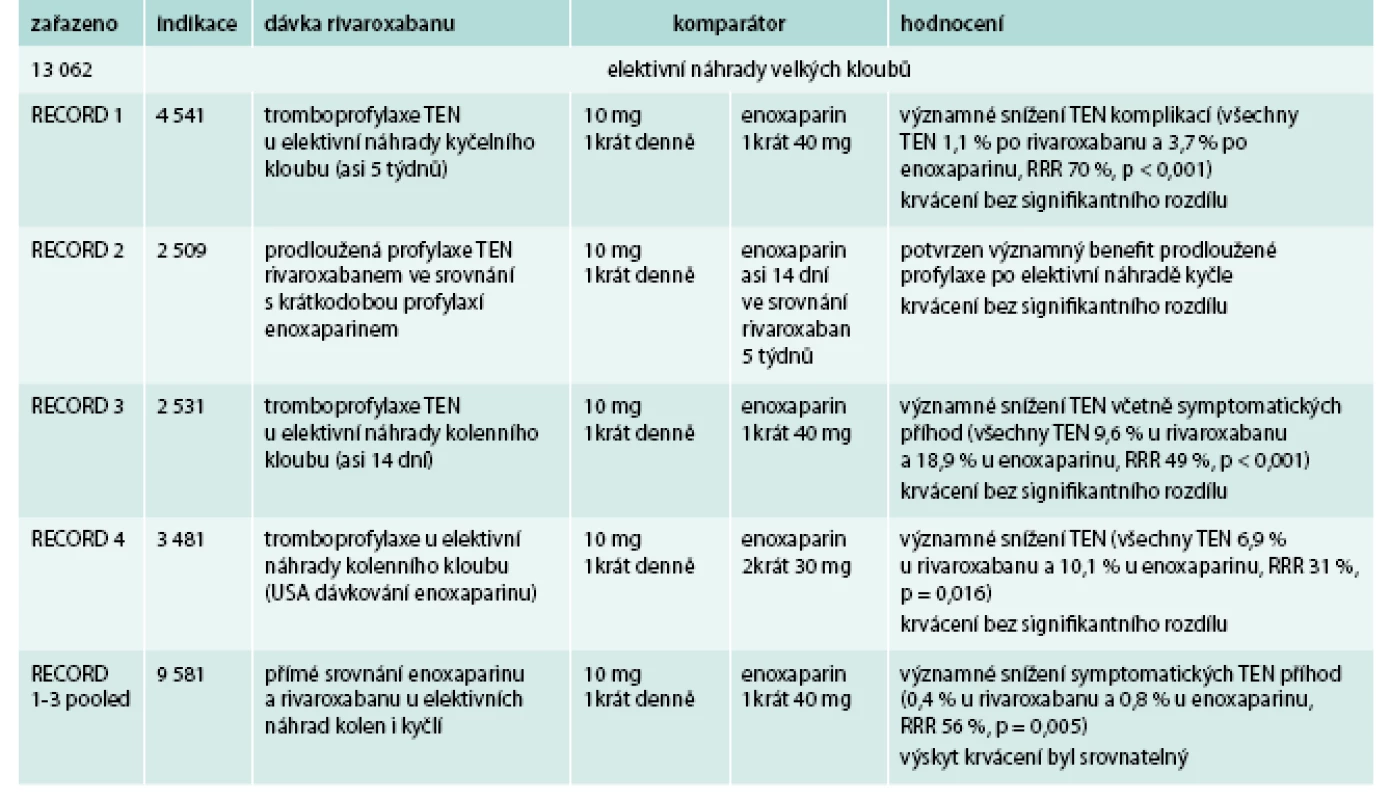
Rivaroxaban u pacientů po elektivní endoprotéze kyčle nebo kolene ve srovnání s enoxaparinem významně snížil riziko tromboembolických komplikací včetně symptomatických příhod. Riziko krvácivých komplikací je nízké, bez statisticky signifikantního rozdílu mezi skupinami. Byla potvrzena účinnost a bezpečnost použitého dávkovacího schématu rivaroxabanu: pooperační podání do 10 hod po výkonu 1 tableta 1krát denně.
Apixaban
Apixaban je perorální, reverzibilní, přímý a vysoce selektivní inhibitor aktivního místa faktoru Xa. Pro antitrombotické působení nevyžaduje antitrombin. Apixaban inhibuje volný a vázaný faktor Xa a protrombinázovou aktivitu. Apixaban nemá přímé účinky na agregaci destiček, ale nepřímo inhibuje agregaci destiček indukovanou trombinem. Inhibicí faktoru Xa zabraňuje apixaban tvorbě trombinu a vzniku trombu. Po odeznění účinku antikoagulancia nevzniká riziko rebound fenoménu. V preklinických studiích apixabanu na zvířecích modelech byla prokázána antitrombotická účinnost v prevenci arteriální a venózní trombózy v dávkách, při kterých byla zachována hemostáza [20].
Farmakokinetické vlastnosti jsou charakterizovány dobrou, více než 50% dostupností, dlouhým plazmatickým poločasem (více než 12 hod), dvojí možností eliminace (játry a ledvinami), nekomplikovaným metabolizmem s nízkým rizikem lékových interakcí a s velmi malou interindividuální i intraindviduální variabilitou účinku. Apixaban má rychlý nástup účinku a minimální lékové a potravinové interakce [21].
Farmakodynamické účinky apixabanu odrážejí mechanizmus působení (inhibice F Xa). V důsledku inhibice faktoru Xa prodlužuje apixaban koagulační testy, jako je např. protrombinový čas (PT), INR a aktivovaný parciální tromboplastinový čas (aPTT). Tyto testy se však nedoporučují ke zhodnocení farmakodynamických účinků apixabanu [22].
Indikace
Prevence TEN u elektivní náhrady kyčelního nebo kolenního kloubu. Prevence cévní mozkové příhody a systémové embolie u pacientů s nevalvulární fibrilací síní.
Použití se nedoporučuje u pacientů s CrCL < 15 ml/min. U pacientů s CrCL < 15–29 ml/min je nutné apixaban užívat s opatrností. Nedoporučuje podávat pacientům se závažnou jaterní nedostatečností. U pacientů s mírnou a středně závažnou jaterní nedostatečností není nutná žádná úprava dávkování.
Lékové interakce
Apixaban má interakce s azolovými antimykotiky (např. ketokonazol, itrakonazol, vorikonazol a posakonazol), inhibitory HIV proteázy (např. ritonavir), rifampicinem, fenytoinem, karbamazepinem, fenobarbitalem, s třezalkou tečkovanou, nesteroidními protizánětlivými léky, včetně kyseliny acetylsalicylové.
Monitoring léčby
Monitoring léčby není nutný. Ve specifických situacích lze jeho účinek sledovat měřením aktivity faktoru Xa [22].
Klinický efekt apixabanu byl prověřován jak v profylaxi tromboembolických komplikací u nemocných po náhradě velkých kloubů (koleno, kyčel). Přehled studií uvádí tab. 4 [23–25].
Table 4. Přehled klinických studií v profylaxi TEN s apixabanem 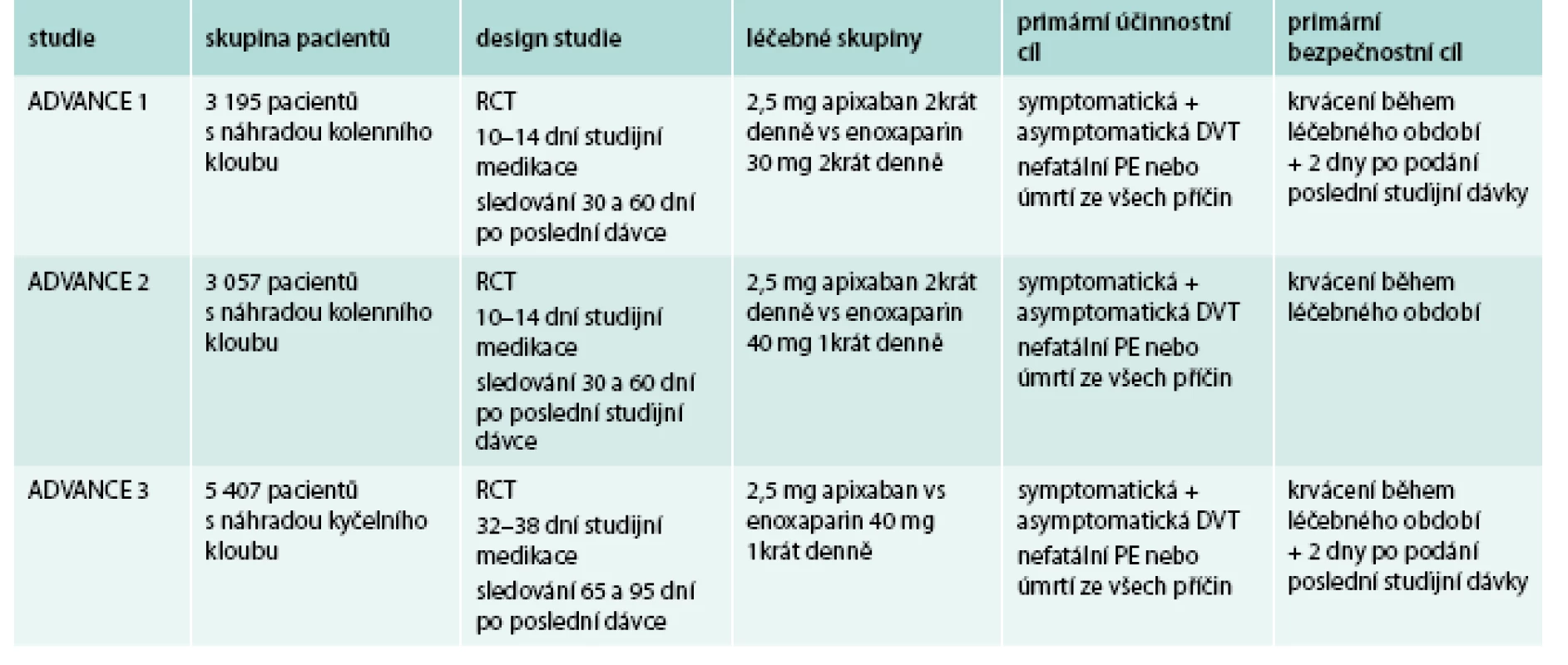
Souhrn doporučení profylaxe TEN po TEP kyčelního kloubu (tab. 5)
Table 5. Souhrny možností profylaxe tromboembolické nemoci při totální náhradě (TEP) kyčelního kloubu 
- Profylaxe TEN by měla být prováděna LMWH, fondaparinuxem, dabigatranem, rivaroxabanem nebo apixabanem po dobu 28–35 dní od operace.
- Alternativou je po úvodní léčbě LMWH převedení na warfarin a jeho další podávání po dobu nejméně 6 týdnů po operaci s cílovým INR 2,0–3,0, pokud jsou zajištěny podmínky pro řádné vedení antikoagulační léčby.
- Dávka LMWH by měla odpovídat dávce pro ortopedické operace podle SPC jednotlivých přípravků. Profylaxe by měla být zahájena buď nejméně 12 hod před operací, nebo nejméně 12 hod po ukončení operace, a dále podávána à 24 hod, při použití bemiparinu je doporučeno podání 1. dávky 6 hod po ukončení operace a dále à 24 hod. Dávka fondaparinuxu je 2,5 mg 1krát denně, léčba by měla být zahájena 6 hod po ukončení operace.
- Rivaroxaban by měl být podáván v dávce 10 mg 1krát denně, léčba by měla být zahájena 6–10 hod po ukončení operace.
- Léčba dabigatranem by měla být zahájena 1–4 hod po ukončení operace dávkou 110 mg, dále by mělo být pokračováno dávkou 220 mg 1krát denně. U osob nad 75 let a u osob s renální insuficiencí je nutná redukce dávky podle SPC.
- Léčba apixabanem by měla být zahájena 12–24 hod po operaci v dávkování 2,5 mg denně à 12 hod.
- Podání antitrombotika po operaci musí být odloženo v případě, že krevní ztráty jsou větší než obvyklé. Při odkladu podání farmakologické tromboprofylaxe je nutno použít mechanické prostředky.
- Použití ASA, dextranu a UFH jako tromboprofylaxe po TEP kyčelního kloubu nemá v rámci ČR opodstatnění.
- Fyzikální prostředky (kompresní punčochy s graduovaným tlakem nebo IPC) je možno použít jako doplněk doporučené farmakologické léčby, neměly by být používány samostatně kromě případů, v nichž je farmakologická tromboprofylaxe kontraindikována.
- U pacientů s renální insuficiencí (GF < 30 ml/min) se jeví jako nejbezpečnější postup pooperační zahájení LMWH za monitorace faktoru Xa a převod na warfarin v prvních dnech po operaci [2,9,26].
Souhrn doporučení profylaxe TEN po TEP kolenního kloubu (tab. 6)
Table 6. Souhrny možností profylaxe tromboembolické nemoci při TEP kolenního kloubu 
- Profylaxe TEN by měla být prováděna LMWH, fondaparinuxem, dabigatranem, rivaroxabanem nebo apixabanem po dobu 14 dní od operace, extendovaná profylaxe je doporučena u pacientů s anamnézou prodělané trombotické příhody nebo s nakupením dalších rizikových faktorů trombózy.
- Alternativou je po úvodní léčbě LMWH převedení na warfarin a jeho další podávání po dobu nejméně 6 týdnů po operaci s cílovým INR 2,0–3,0, pokud jsou zajištěny podmínky pro řádné vedení antikoagulační léčby.
- Dávka LMWH by měla odpovídat dávce pro ortopedické operace podle SPC jednotlivých přípravků. Profylaxe by měla být zahájena buď nejméně 12 hod před operací, nebo nejméně 12 hod po ukončení operace a dále podávána à 24 hod, při použití bemiparinu je doporučeno podání 1. dávky 6 hod po ukončení operace a dále à 24 hod. Dávka fondaparinuxu je 2,5 mg 1krát denně, léčba by měla být zahájena 6 hod po ukončení operace.
- Rivaroxaban by měl být podáván v dávce 10 mg 1krát denně, léčba by měla být zahájena 6–10 hod po ukončení operace.
- Léčba dabigatranem by měla být zahájena 1–4 hod po ukončení operace dávkou 110 mg, dále by mělo být pokračováno dávkou 220 mg 1krát denně. U osob nad 75 let a u osob s renální insuficiencí je nutná redukce dávky podle SPC.
- Léčba apixabanem by měla být zahájena 12–24 hod po operaci v dávkování 2,5 mg denně à 12 hod.
- Podání antitrombotika po operaci musí být odloženo v případě, že krevní ztráty jsou větší než obvyklé. Při odkladu podání farmakologické tromboprofylaxe je nutno použít mechanické prostředky.
- Použití ASA, dextranu a UFH jako tromboprofylaxe po TEP kolenního kloubu nemá v rámci ČR opodstatnění.
- Fyzikální prostředky (kompresní punčochy s graduovaným tlakem nebo IPC) je možno použít jako doplněk doporučené farmakologické léčby, neměly by být používány samostatně kromě případů, v nichž je farmakologická tromboprofylaxe kontraindikována.
- U pacientů s renální insuficiencí (GF < 30 ml/min) se jeví jako nejbezpečnější postup pooperační zahájení LMWH za monitorace Xa a převod na warfarin v prvních dnech po operaci [2,9,26].
Závěr
Zásady strategie pro maximálně efektivní prevenci tromboembolické nemoci při náhradách velkých kloubů
Základní potřebou je vybudování systému národní strategie:
- excelentní kvalita evidence-based guidelines
- podpora národních subjektů zabývajících se tématikou profylaxe žilní tromboembolie
- při akreditaci nemocnic dbát implementace doporučení efektivní prevence tromboembolické nemoci při náhradách velkých kloubů
- bylo by výhodné mít systém placených hlášení o výkonech na velkých kloubech
- je k diskusi, zda nezavést systém – neplatit za komplikace
V systémech místní strategie je důležité:
- poskytovat edukaci o nových prostředcích a možnostech tromboprofylaxe
- zvyšovat povědomí o problematice rizik tromboembolie a krvácení při operačních výkonech
- vést a inovovat protokoly prevence tromboembolické nemoci
- implementovat elektronické programy a výstrahy
- provádět pravidelné audity a jejich zpětné vazby
- uskutečňovat iniciativy „bezpečné“ hospitalizace
Podpořeno výzkumným záměrem MZ ČR – RVO (FNHK, 00179906) a výzkumným záměrem PRVOUK 37-08.
prof. MUDr. Jaroslav Malý, CSc.
jaroslav.maly@fnhk.cz
IV. interní hematologická klinika LF UK a FN Hradec Králové
www.fnhk.cz
Doručeno do redakce 1. 3. 2015
Přijato po recenzi 6. 5. 2015
Sources
1. Cohen AT, Tapson VF, Bergmann JF et al. ENDORSE Investigators. Venous thromboembolism risk and prophylaxis in the acute hospital care setting (ENDORSE study): a multinational cross-sectional study. Lancet 2008; 371(9610): 387–394.
2. Malý J, Penka M, Gumulec J et al. Shrnutí doporučených operačních postupů pro prevenci žilní tromboembolické nemoci u rizikových nemocných. In: Malý J; Kessler P; Gumelec J (eds). Trendy v profylaxi žilní tromboembolické nemoci. 2. ed. Mladá fronta: Praha 2013. ISBN 978–80–204–2878–3.
3. Gustafsson D. Oral direct thrombin inhibitors in clinical development. J Intern Med 2003; 254(4): 322–334.
4. Mungall D. BIBR-1048 Boehringer Ingelheim. Curr Opin Investig Drugs 2002; 3(6): 905–907.
5. Stangier J, Rathgen K, Stähle H et al. The pharmacokinetics, pharmacodynamics and tolerability of dabigatran etexilate, a new oral direct thrombin inhibitor, in healthy male subjects. Br J Clin Pharmacol 2007; 64(3): 292–303.
6. Stangier J, Stähle H, Rathgen K et al. Pharmacokinetics and pharmacodynamics of the direct oral thrombin inhibitor dabigatran in healthy elderly subjects. Clin Pharmacokinet 2008; 47(1): 47–59.
7. Eriksson BI, Dahl OE, Ahnfelt L et al. Dose escalating safety study of a new oral direct thrombin inhibitor, dabigatran etexilate, in patients undergoing total hip replacement: BISTRO I. J Thromb Haemost 2004; 2(9): 1573–1580.
8. Eriksson BI, Dahl OE, Rosencher N et al. Oral dabigatran etexilate vs. subcutaneous enoxaparin for the prevention of venous thromboembolism after total knee replacement: the RE-MODEL randomized trial. J Thromb Haemost 2007; 5(11): 2178–2185.
9. Ageno W, Gallus AS, Wittkowsky A et al. American College of Chest Physicians Oral anticoagulant therapy: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed. American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest 2012; 141(2 Suppl): e44S-e88S. Dostupné z DOI: <http://dx.doi.org/10.1378/chest.11–2292>.
10. Huo M, Eriksson B, Dahl O et al. RE-NOVATE II Study Group. Oral dabigatran versus enoxaparin for thromboprophylaxis after primary total hip arthroplasty (RE-NOVATE II*). A randomised, double-blind, non-inferiority trial.Abstract: Thromb Haemost 2011; 105(4): 721–729. Dostupné z DOI: <http://dx.doi.org/10.1160/TH10–10–0679 >.
11. Schulman S, Kearon C, Kakkar AK et al. RE-COVER Study Group. Dabigatran versus warfarin in the treatment of acute venous thromboembolism. N Engl J Med 2009; 361(24): 2342–2352.
12. Samama MM. The mechanism of action of rivaroxaban – an oral, direct Factor Xa inhibitor – compared with other anticoagulants. Thromb Res 2011; 127(6): 497–504.
13. Samama MM, Martinoli JL, Le Flem L et al. Assessment of laboratory assays to measure rivaroxaban – an oral, direct Factor Xa inhibitor. Thromb Haemost 2010; 103(4): 815–825.
14. Stampfuss J, Kubitza D, Becka M et al. The effect of food on the absorption and pharmacokinetics of rivaroxaban. Int J Clin Pharmacol Ther 2013; 51(7): 549–561.
15. Eriksson BI, Borris LC, Friedman RJ et al. RECORD1 Study Group. Rivaroxaban versus enoxaparin for thromboprophylaxis after hip arthroplasty. N Engl J Med 2008; 358(26): 2765–2775.
16. Lassen MR, Ageno W, Borris LC et al. RECORD3 Investigators. Rivaroxaban versus enoxaparin for thromboprophylaxis after total knee arthroplasty. Engl J Med 2008; 358(26): 2776–2786.
17. Eriksson BI, Kakkar AK, Turpie AGG et al. Oral rivaroxaban for the prevention of symptomatic venous thromboembolism after elective hip and knee replacement. J Bone Joint Surg Br 2009; 91(5): 636–644.
18. Kakkar AK, Brenner B, Dahl OE et al. RECORD 2 investigators. Extended duration rivaroxaban versus short-term enoxaparin for the prevention of venous thromboembolism after total hip arthroplasty: a double-blind, randomised controlled trial. Lancet 2008; 372(9632): 31–39.
19. Turpie AGG, Lassen MR, Davidson BL et al. RECORD 4 Investigators. Rivaroxaban versus enoxaparin for thromboprophylaxis after total knee arthroplasty. Lancet 2009; 373(9676): 1673–1680.
20. Wong PC, Crain EJ, Xin B et al. Apixaban, an oral, direct and highly selective factor Xa inhibitor: in vitro, antithrombotic and antihemostatic studies. J Thromb Haemost 2008; 6(5): 820–829.
21. Bultas J, Karetova D. Apixaban. Remedia 2011; 21(4): 304–313.
22. Tun NM, Oo TH. Prevention and treatment of venous thromboembolism with new oral anticoagulants: a practical update for clinicians. Thrombosis.2013; 2013 : 183616. Dostupné z DOI: <http://dx.doi.org/10.1155/2013/183616>.
23. Lassen MR, Raskob GE, Gallus A et al. Apixaban or Enoxaparin for Thromboprophylaxis after Knee Replacement. N Engl J Med 2009; 361(6): 594–604.
24. Lassen MR, Raskob GE, Gallus A et al. Apixaban versus enoxaparin for thromboprophylaxis after knee replacement (ADVANCE-2): a randomised double-blind trial. Lancet 2010; 375(9717): 807–815.
25. Lassen MR, Gallus A, Raskob GE et al. Apixaban versus enoxaparin for thromboprophylaxis after hip replacement. N Engl J Med 2010; 363(26): 2487–2498.
26. Malý J, Penka M, Gumulec J et al. Shrnutí doporučených operačních postupů pro prevenci žilní tromboembolické nemoci u rizikových nemocných. In: Malý J; Kessler P; Gumelec J (eds). Trendy v profylaxi žilní tromboembolické nemoci. 2. ed. Mladá fronta: Praha 2013. ISBN 978–80–204–2878–3.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2015 Issue 6-
All articles in this issue
- Diagnostika a terapie dny – editorial
- Echinokokové infekce – vzácná postižení jater – editorial
- Zobrazení muskuloskeletálních projevů a komplikací diabetes mellitus
- Pokračující periferní nervové blokády – přínos pro ortopedické pacienty s diabetes mellitus?
- Perioperační péče a diabetes
- Komplikace endoprotéz u diabetiků
- Obezita a ortopedické operace aneb existují mechanické komplikace obezity?
- Akutní a chronická antikoagulační léčba u kloubních náhrad
- Diabetická neuropatie
- Infekce v rámci syndromu diabetické nohy
- Vybrané kožní změny typu necrosis lipoidica a kožní a slizniční mykotické afekce u diabetes mellitus
- Uplatnění kmenových buněk v ortopedii
- Ortopedická operační léčba syndromu diabetické nohy
- Základní principy a úskalí rehabilitace u diabetiků po amputaci
- Pegasus – Tikagrelor v sekundární prevenci u nemocných po infarktu myokardu
- Diagnostika a terapie dny
- Neobvyklý případ cystického postižení jater – alveolární echinokokóza jater
- „Stresová dovolená“ aneb takotsubo kardiomyopatie
- Doporučení České společnosti pro trombózu a hemostázu České lékařské společnosti J. E. Purkyně pro bezpečnou léčbu novými perorálními antikoagulancii (NOAC) – dabigatran etexilátem, apixabanem a rivaroxabanem
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Diagnostika a terapie dny
- „Stresová dovolená“ aneb takotsubo kardiomyopatie
- Echinokokové infekce – vzácná postižení jater – editorial
- Doporučení České společnosti pro trombózu a hemostázu České lékařské společnosti J. E. Purkyně pro bezpečnou léčbu novými perorálními antikoagulancii (NOAC) – dabigatran etexilátem, apixabanem a rivaroxabanem
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

