-
Medical journals
- Career
Primární hyperaldosteronizmus: problémy diagnostických přístupů
Authors: Jiří Widimský Jr
Authors‘ workplace: Centrum pro hypertenzi III. interní kliniky 1. LF UK a VFN Praha, přednosta prof. MUDr. Štěpán Svačina, DrSc., MBA
Published in: Vnitř Lék 2015; 61(5): 480-483
Category: Reviews
Overview
Primární hyperaldosteronizmus (PH) je nejčastější příčinou nejen endokrinní, ale i sekundární hypertenze vyvolané autonomní nadprodukcí aldosteronu kůrou nadledvin. PH je typicky charakterizován hypertenzí, hypokalemií, zvýšeným poměrem aldosteron/renin díky zvýšeným koncentracím aldosteronu a nízkým hladinám reninu a chyběním suprese aldosteronu v průběhu konfirmačních testů. Laboratorní diagnostika PH může však být svízelná, neboť hypokalemie se vyskytuje pouze u asi 50 % případů a vyšetřování parametrů osy renin-angiotenzin-aldosteron může být ovlivněno celou řadou faktorů, ke kterým je třeba přihlédnout. Morfologická diagnostika PH bývá rovněž svízelná díky malé velikosti nádorů/hyperplazií a ve většině případů je nutné provést katetrizaci suprarenálních žil s cílenými separovanými odběry na hormonální testy. Díky relativně vysoké prevalenci PH v populaci hypertoniků (5–11 %) a možnosti trvalého vyléčení u části pacientů je nezbytná časná diagnostika s přesným odlišením jednotlivých forem PH a brzkým zahájením specifické terapie (konzervativní vs chirurgická). Díky četným úskalím diagnostických a léčebných přístupů by každý pacient s podezřením na PH měl býti vyšetřen ve specializovaném hypertenzním centru.
Klíčová slova:
diagnostika – hypertenze – primární hyperaldosteronizmusÚvod
Primární hyperaldosteronizmus (PH) je nejčastější příčina nejen endokrinní, ale i sekundární hypertenze vyvolaná autonomní nadprodukcí mineralokortikoidů (aldosteronu) kůrou nadledvin s vysokými hladinami aldosteronu, potlačeným reninem a arteriální hypertenzí [1–3]. Výskyt v neselektované populaci hypertoniků je 5–11 %! [4–6]
Klasifikace
Klasifikace je uvedena v tab. 1.
Table 1. Klasifikace primárního hyperaldosteronizmu 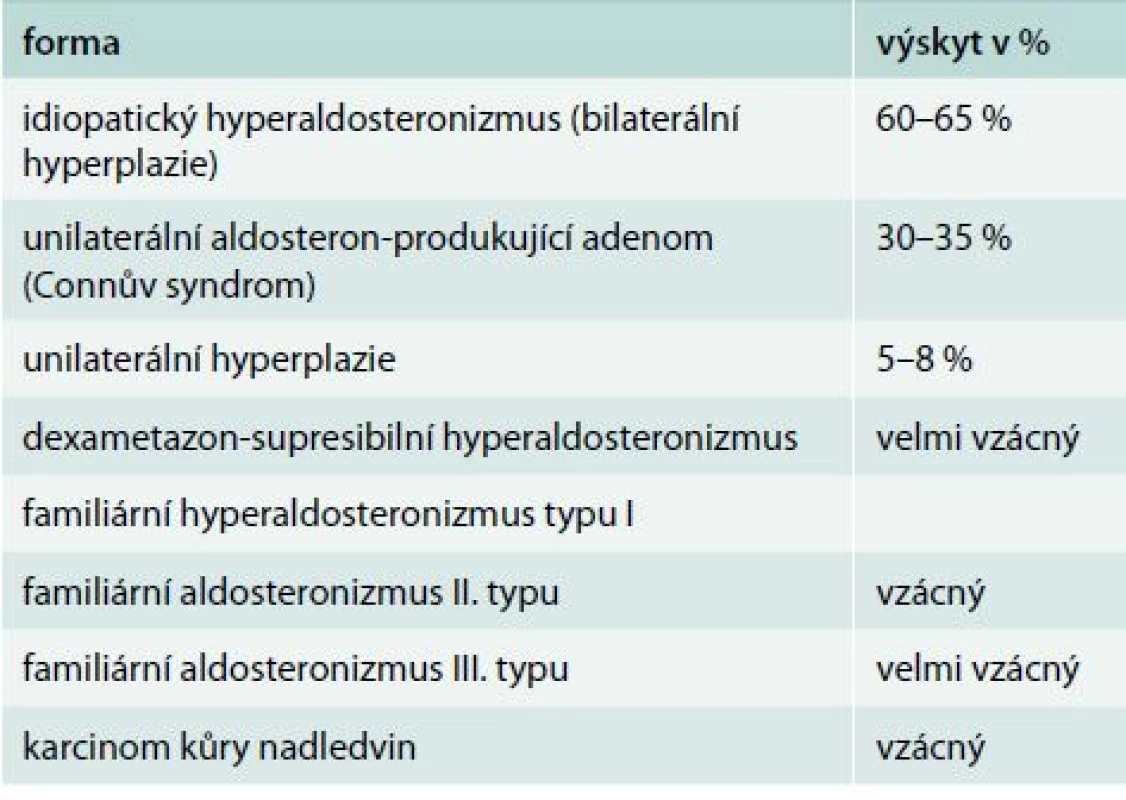
Klinický obraz
Klinické známky primárního hyperaldosteronizmu
- arteriální hypertenze (ve 100 % případů) – středně těžká až těžká, mnohdy rezistentní na léčbu
- častější subklinické orgánové poškození, arytmie – supraventrikulární i komorové, kardiovaskulární příhody
- neuromuskulární příznaky (asi v 30 % – jen u těžších případů spojených s významnou hypokalemií): svalová únava, obrny až paralýzy
- hypokalemie, zvýšená kaliuréza, metabolická alkalóza, hypernatremie (všechny tyto příznaky jsou jen u asi 50–60 %, převážně u těžších forem)
- mírná polyurie (převážně u těžších forem spojených s hypokalemií)
Asi u poloviny nemocných je klinický obraz primárního hyperaldosteronizmu (PH) kromě hypertenze velmi chudý, takže se PH u těchto osob může maskovat za esenciální hypertenzi.
Chvostkův a Trousseaův příznak může být vyjádřen v případě těžké hypokalemie a metabolické alkalózy. Výskyt periferních otoků je vzácný.
Laboratorní diagnostika
Screening
Vyloučení primárního hyperaldosteronizmu by mělo být provedeno v následujících případech [3]:
- hypertenze a spontánní nebo diuretiky navozená hypokalemie
- středně těžká až těžká hypertenze, rezistentní hypertenze
- hypertenze v mladém věku
- pacienti s hypertenzí a incidentalomem nadledviny
- příbuzní hypertonici pacientů s primárním hyperaldosteronizmem
- časný výskyt CMP do 50 let věku
Základním screeningovým nástrojem pro diagnostiku primárního hyperaldosteronizmu je stanovení poměru plazmatického aldosteronu a plazmatické reninové aktivity (PRA) v ranních hodinách ambulantně (stanovení provádíme vždy po korekci hypokalemie). Jako pozitivní poměr považujeme hodnotu ≥ 30 ng/dl (ng/ml/hod) v přítomnosti alespoň hraniční elevace plazmatického aldosteronu (≥ 150 g/dl). Místo PRA se však dnes stále častěji stanovuje přímo renin [7], což je technicky snazší. Mezi oběma vyšetřeními je těsná korelace. Díky rozdílům laboratorního stanovení (PRA nebo renin, různé jednotky u aldosteronu, reninu nebo PRA) jsou také rozdílné hodnoty „cut-off“ pro posuzování abnormalit poměru aldosteron/PRA, resp. aldosteron/renin. Každá laboratoř by si měla vytvořit své vlastní normy, neboť naměřené hodnoty jsou závislé také na použité laboratorní metodě (RIA, chemiluminiscence apod), způsobu odběru (vleže – vsedě nebo vstoje), a tak nelze zcela spoléhat na literární údaje.
Hlavní faktory ovlivňující poměr aldosteron/renin
- věk (nižší renin u starších)
- čas odběru, dieta (NaCl)
- medikace (antihypertenziva, NSA, steroidy)
- poloha nemocného, délka vertikalizace, pohlaví
- způsob odběru krve
- koncentrace K+, kreatininu
Pro hodnocení poměru plazmatického aldosteronu a plazmatické reninové aktivity či reninu je nutné si uvědomit několik skutečností:
Úprava medikace před jeho vyšetřením (přehled antihypertenziv ovlivňujících osu renin-angiotenzin-aldosteron), tab. 2.
Table 2. Antihypertenziva ovlivňující aldosteron (ALDO), plazmatickou reninovou aktivitu (PRA) a poměr aldo/PRA 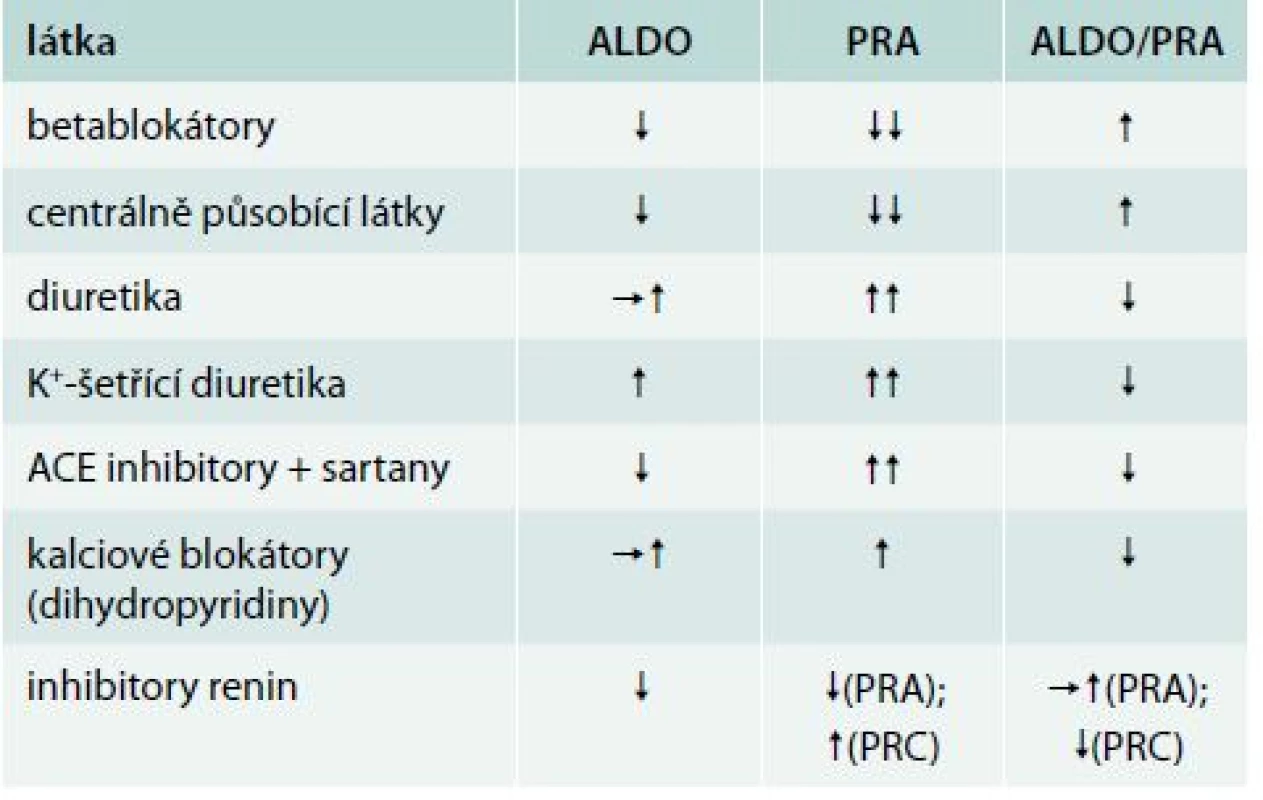
Je nutné nejméně 4 týdny před stanovením vysadit blokátory mineralokortikoidních receptorů (spironolakton a eplerenon) a 2 týdny betablokátory, inhibitory ACE, AT1-blokátory, diuretika a centrálně působící antihypertenziva. Nejméně je tento poměr ovlivněn blokátory kalciového kanálu (verapamil) a alfablokátory [3]. Samozřejmostí je korekce hypokalemie a normální přísun soli v dietě (nevhodná je neslaná dieta). Existují ale i názory, které ukazují, že tento poměr je možno stanovit při plné antihypertenzní medikaci bez diuretik [8]. Mezi další látky potenciálně ovlivňující hormonální stanovení, patří nesteroidní antirevmatika, kortikoidy či hormonální antikoncepce.
Závislost poměru na věku (s věkem klesá aktivita systému renin-angiotenzin-aldosteron), denní době a postavení. U žen jsou častější falešně pozitivní výsledky díky změnám sekrece aldosteronu v průběhu menstruačního cyklu.
Koncentrace aldosteronu a reninu – s ohledem na to, že se jedná o hyperaldosteronizmus, je nutné vždy brát v úvahu samotnou hodnotu plazmatického aldosteronu – ta musí být alespoň na horní hranici normy. Samotná suprimovaná hodnota plazmatické reninové aktivity doprovází i jiné formy nízkoreninové hypertenze [9].
Senzitivita vyšetření aldosteronu a reninu – ačkoliv se jedná o screeningové vyšetření, jeho senzitivita není optimální. Při trvání podezření a negativitě prvního vyšetření je vhodné jeho opakování [10].
Ledvinné funkce – u pacientů s renální insuficiencí může být abnormálně zvýšená PRA, která může po zlepšení hodnoty renálních funkcí poklesnout, a teprve pak se může projevit obraz primárního hyperaldosteronizmu [11]. U pokročilejšího renálního selhání obvykle naopak koncentrace reninu/PRA klesá.
Genetické vyšetření se provádí zejména u dětí a mladších osob při podezření na familiární typ I (dexametazon-supresibilní) pomocí technik PCR prokazujících přítomnost tzv. chimérického genu.
Konfirmační testy
Jestliže je poměr plazmatického aldosteronu a plazmatické reninové aktivity pozitivní a aldosteron alespoň hraničně zvýšený, je vhodné ještě potvrdit autonomii sekrece aldosteronu jedním z konfirmačních testů. Nejčastěji se používá test pomocí volumové nálože NaCl – nejčastěji infuzí 2 l fyziologického roztoku (FR) během 4 hodin nebo pomocí fludrokortizonu (podávání 4 dny). Kaptoprilový supresní test je považován za méně přesný. Test s podáváním perorální soli během 4 dnů se provádí již jen vzácně vzhledem k častým dyspeptickým potížím. Slabinou všech konfirmačních testů je absence přesné hodnoty, která svědčí pro jeho pozitivitu. Pro test s FR někteří autoři považují pozitivitu při chybění poklesu aldosteronu po FR pod 10 ng/dl [12] a někteří se spokojují s hodnotami 5 ng/dl [13]. I negativní konfirmační test tak nemusí vylučovat primární aldosteronizmus. Výskyt opakovaných vysokých hodnot poměru aldosteron/renin spolu s přesvědčivou elevací aldosteronu tak může být dle některých názorů pro diagnostiku postačující.
Morfologická diagnostika
K vyšetření nadledvin je možné použít CT nebo event. MR. Obě metody mají však dvě podstatné nevýhody:
- velmi často se setkáváme s mikroadenomy/mikrohyperplaziemi pod limitem detekce obou metod, což platí i pro nejmodernější přístroje
- s věkem stoupá pravděpodobnost afunkční léze nadledvin (až 7 % pacientů starších 50 let může mít tzv. afunkční tumor nadledvin) [14]
S ohledem na to, že chirurgické řešení nabízí možnost trvalého vyléčení, měli bychom se snažit ve většině případů jednoznačně určit typ primárního hyperaldosteronizmu. Pokud pacient s případnou operací nesouhlasí, nebo jsou kontraindikace, pak není nutné doplňovat další testy a je možné postupovat konzervativně. Operační řešení můžeme indikovat bez provedení dalších testů pouze u mladých pacientů (věk ≤ 40 let), s jednoznačným nálezem adenomu na CT či MRI (> 1 cm), významnou hypokalemií ≤ 3,0 mmol/l a výrazně zvýšeným plazmatickým aldosteronem (≥ 30 ng/dl) [12].
Pakliže se rozhodneme, že by pacient mohl být kandidátem případného chirurgického řešení, je nutné provést separované odběry aldosteronu z nadledvinných žil při katetrizaci (obr. 1).
Image 1. Schéma katetrizace nadledvinných žil 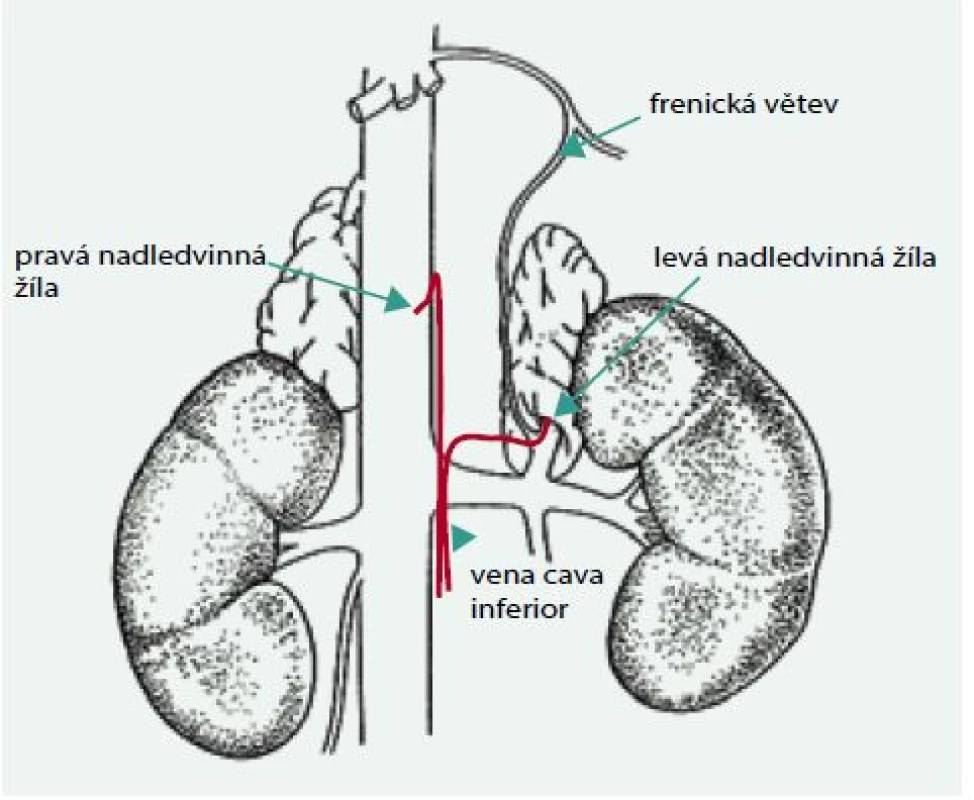
Jedině pomocí tohoto vyšetření máme šanci odlišit unilaterální od bilaterální nadprodukce a stanovit tak definitivní terapeutickou strategii. Katetrizace nadledvinných žil se separovanými odběry má však řadu následujících úskalí:
Technická náročnost – kanylace tenkých nadledvinných žil, zejména pravé, je obtížná. Pravá nadledvinná žíla je velmi krátká a má navíc relativně často variabilní odstup. Odebírané vzorky krve na hormonální stanovení (kortizol, aldosteron) mohou tak pocházet z jiného cévního řečiště. Je vhodné při vyšetření provádět rychlé stanovení kortizolu k ověření selektivity odběru. Katetrizace suprarenálních žil by se měla provádět jen zkušenými rentgenology v rámci hypertenzních center.
Nemáme přesná a jednoznačná guidelines provádění (např. některá pracoviště realizují vyšetření po předchozí stimulaci ACTH, jiná nikoliv atd) a interpretace výsledků. Mezi pracovišti mohou existovat velké rozdíly v hodnocení selektivity, stranových rozdílů či supresibility [3,15,16]. Podrobná analýza přesahuje rámec tohoto článku.
Dříve prováděná scintigrafie nadledvin pomocí 131I-6-β-jodometyl-19-norcholesterolu (NP 59) po supresi dexametazonem se již opouští vzhledem k menší výtěžnosti a vysokým nákladům. Určitou perspektivu pro diagnostiku skýtá PET-CT značeným 11C-metomidatem, zatím jen ve fázi výzkumu [17].
Základní algoritmus diagnostického a léčebného postupu u PH uvádí obr. 2.
Image 2. Algoritmus diagnostického a terapeutického přístupu u primárního hyperaldosteronzimu. Upraveno podle [12] ![Algoritmus diagnostického a terapeutického přístupu u primárního hyperaldosteronzimu. Upraveno podle [12]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/6b98adb93fdf79c5a77ac80cf6e52e47.jpg)
Závěry
PH je nejčastější formou sekundární hypertenze s možností vyléčení, a je proto nezbytná časná diagnostika tohoto onemocnění s přesným odlišením jednotlivých forem a brzkým zahájením specifické terapie.
Laboratorní a morfologické diagnostické přístupy bývají však u PH komplikované a ovlivněné řadou faktorů. Proto by pacienti s podezřením na PH měli býti vyšetřování jen ve specializovaných centrech.
prof. MUDr. Jiří Widimský jr, CSc.
jwidi@lf1.cuni.cz
III. interní klinika 1. LF UK a VFN, Praha
www.vfn.cz
Doručeno do redakce 19. 1. 2015
Přijato po recenzi 8. 4. 2015
Sources
1. Conn JW. Part I. Painting background. Part II. Primary aldosteronism, a new clinical syndrome, 1954. J Lab Clin Med 1990; 116(2):253–267.
2. Litynski M. Nadcisnienie tetnicze wyvolane guzami korowo-nad-nerczowymi. Pol Tyg Lek (Wars) 1953; 8(6): 204–208.
3. Funder JW, Carey RM, Fardella C et al. Case detection, diagnosis and treatment of patients with primary aldosteronism: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab 2008; 93(9): 3266–3281.
4. Štrauch B, Zelinka T, Widimský J Jr et al. Prevalence of primary hyperaldosteronism in middle Europe region. J Hum Hypertens 2003; 17(5): 349–352.
5. Widimský J Jr. Primární hyperaldosteronismus: epidemie anebo jen častá příčina sekundární hypertenze? Cor et Vasa 2008; 50(10): 366–367.
6. Rossi GP, Bernini G, Caliumi C et al. A Prospective Study of the Prevalence of Primary Aldosteronism in 1,125 Hypertensive Patients. J Am Coll Cardiol 2006; 48(11): 2293–2300.
7. Rossi GP, Barisa M, Belfiore A et al. PAPY study Investigators. The aldosterone-renin ratio based on the plasma renin activity and the direct renin assay for diagnosing aldosterone-producing adenoma. J Hypertens 2010; 28(9): 1892–1899.
8. Solar M, Malirova E, Ballon M et al. Confirmatory testing in primary aldosteronism: extensive medication switching is not needed in all patients. Eur J Endocrinol 2012; 166(4): 679–686.
9. Kaplan NM. Clinical Hypertension. 10th ed. Lippincott Williams & Wilkins: Philadelphia 2009. ISBN-13 : 000–1605475033. ISBN-10 : 1605475033.
10. Tanabe A, Naruse M, Takagi S et al. Variability in the renin/aldosterone profile under random and standardized sampling conditions in primary aldosteronism. J Clin Endocrinol Metab 2003; 88(6): 2489–2494.
11. Oelkers W, Diederich S, Bahr V. Primary hyperaldosteronism without suppressed renin due to secondary hypertensive kidney damage. J Clin Endocrinol Metab 2000; 85(9): 3266–3270.
12. Mattsson C, Young WF Jr. Primary aldosteronism: diagnostic and treatment strategies. Nat Clin Pract Nephrol 2006; 2(4): 198–208.
13. Mulatero P, Milan A, Fallo F et al. Comparison of confirmatory tests for the diagnosis of primary aldosteronism. J Clin Endocrinol Metab 2006; 91(7): 2618–2623.
14. Mansmann G, Lau J, Balk E et al. The clinically inapparent adrenal mass: update in diagnosis and management. Endocr Rev 2004; 25(2): 309–340.
15. Rossi GP, Auchus RJ, Brown M et al. An expert consensus statement on use of adrenal vein sampling for the subtyping of primary aldosteronism. Hypertension 2014; 63(1): 151–160.
16. Monticone S, Viola A, Rossato D et al. Adrenal vein sampling in primary aldosteronism: towards a standardised protocol. Lancet Diabetes Endocrinol 2015; 3(4): 296–303. Dostupné z DOI: <http://dx.doi.org/10.1016/S2213–8587(14)70069–5>.
17. Burton TJ, Mackenzie IS, Balan K et al. Evaluation of the sensitivity and specificity of 11C-metomidate positron emission tomography (PET)-CT for lateralizing aldosterone secretion by conn’s adenomas. J Clin Endocrinol Metab 2012; 97(1): 100–109.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2015 Issue 5-
All articles in this issue
- Vliv spironolaktonu u pacientů se srdečním selháním a zachovalou funkcí levé komory – studie TOPCAT
- Nová verze klasifikace plicní hypertenze
- Hypertenze u žen
- Vplyv pridania fytosterolu ku hypolipidemickej liečbe statínom na veľkosť lipoproteínových partikúl u pacientov s veľmi vysokým kardiovaskulárnym rizikom
- Hypertenze bílého pláště a maskovaná hypertenze
- Personalizovaná farmakoterapie digoxinem
- Kontroverze kolem betablokátorů
- Je potřeba léčit agresivně fibrilaci síní?
- Význam kyseliny močové a terapie alopurinolem v ovlivnění kardiovaskulárních onemocnění
- Ambulantní léčba žilní plicní embolie
- Současný stav a budoucnost péče o nemocné s vrozeným srdečními vadami
- Inhibice systému renin-angiotenzin-aldosteron u srdečního selhání aneb od obecného souhlasu (CONSENSUS) po vzorec myšlení (PARADIGM-HF)
- Hemokoagulace – nové pohledy na starou kaskádu
- Primární hyperaldosteronizmus: problémy diagnostických přístupů
- Neurokardiologie nebo kardioneurologie – nová specializace budoucnosti?
- Feochromocytom – proč je jeho časná diagnóza pro pacienta důležitá?
- Nakolik jsme schopni dosáhnout současně platných cílových hodnot LDL-cholesterolu v sekundární prevenci ischemické choroby srdeční
- Čo môže zapríčiniť diabetes
- Hyperosmolární hyperglykemický stav
- Kombinační léčba hypertenze 2015
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Hyperosmolární hyperglykemický stav
- Hemokoagulace – nové pohledy na starou kaskádu
- Význam kyseliny močové a terapie alopurinolem v ovlivnění kardiovaskulárních onemocnění
- Hypertenze u žen
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

