-
Medical journals
- Career
Ambulantní léčba žilní plicní embolie
Authors: Radovan Malý 1,3; Jaroslav Malý 2
Authors‘ workplace: I. interní kardioangiologická klinika LF UK a FN Hradec Králové, přednosta doc. MUDr. Josef Šťástek, Ph. D. 1; IV. interní hematologická klinika LF UK a FN Hradec Králové, přednosta doc. MUDr. Pavel Žák, Ph. D. 2; Ústav ošetřovatelství, Fakulta veřejných politik, Slezská Univerzita Opava, vedoucí ústavu PhDr. Jana Haluzíková, Ph. D. 3
Published in: Vnitř Lék 2015; 61(5): 431-438
Category: Reviews
Overview
Žilní tromboembolická nemoc (TEN), zahrnující žilní trombózu stejně jako plicní embolii, je časté a potencionálně fatální onemocnění. S uvedením nízkomolekulárních heparinů (LMWH) do praxe bylo prokázáno, že ambulantní léčba žilní trombózy je efektivní a bezpečná pro velkou část nemocných s TEN. Vzrůstající data o ambulantní léčbě LMWH v posledních letech ukazují, že až 50 % pacientů s klinicky stabilní plicní embolií může být léčeno doma. I přes tato fakta dosud neměla domácí léčba plicní embolie pevnou pozici v běžné praxi. Pokud bychom měli sumarizovat podmínky pro domácí léčbu, potom by bylo možné uvažovat o ambulantní léčbě u nemocných s nízkým rizikem dle pomocných kritérií, bez hemodynamické nestability (především bez šokového stavu), bez selhávání pravé komory, bez předchozího chronického srdečního či plicního onemocnění, bez závažných komorbidit (onemocnění gastrointestinálního traktu, onemocnění ledvin, krevní choroby, pokročilá nádorová onemocnění), s nízkým rizikem časné rekurence tromboembolické nemoci, bez jiných indikací pro hospitalizaci (bolest vyžadující parenterální analgetika, infekce apod), s nízkým rizikem krvácení a s garantovanou spoluprací nemocného a dobře organizovanou domácí péčí.
Klíčová slova:
ambulantní léčba plicní embolie – PESI – rizikové faktory plicní embolieÚvod
Žilní tromboembolická nemoc (TEN), zahrnující žilní trombózu stejně jako plicní embolii, je časté a potencionálně fatální onemocnění. S uvedením nízkomolekulárních heparinů (LMWH – low-molecular-weight heparin) do praxe bylo prokázáno, že ambulantní léčba žilní trombózy je pro velkou část nemocných s TEN efektivní a bezpečná [18]. Narůstající data o ambulantní léčbě LMWH v posledních letech ukazují, že až 50 % pacientů s klinicky stabilní plicní embolií může být léčeno doma [6,13,22]. I přes tato fakta dosud neměla domácí léčba plicní embolie pevnou pozici v běžné praxi. Základním důvodem byla absence vhodných a přesných kritérií k stratifikaci pacientů s nízkým rizikem komplikací pro domácí léčbu plicní embolie. Dalším nedostatkem byl také fakt, že až donedávna nebyla publikována data z randomizovaných studií, která by ukázala na bezpečnost a efektivitu této léčby. Současná doporučení odborných společností zahrnují i ambulantní léčbu plicní embolie, ale upřesnění, kterých pacientů by se mohla týkat, nejsou zcela jasná. Podle doporučení British Thoracic Society z roku 2003 je domácí léčba plicní embolie vhodná pro „klinicky stabilní“ pacienty, ale síla doporučení je nízká (grade C). Na základě praktických doporučení ACCP (American College of Physicians) a American Academy of Family Physicians [33] je ambulantní léčba žilní trombózy a event. i plicní embolie bezpečná pro „pečlivě vybrané“ jednice. Evropská kardiologická společnost v roce 2014 ve svých doporučeních zvažuje časné propuštění nebo léčbu doma pacientů s plicní embolií s nízkým rizikem dle prognostických kritérií. Nejvíce validizovaným kritériem je do současné doby Pulmonary Embolism Severity Index – PESI [20].
Doporučení ACCP z roku 2012
Poslední doporučení ACCP z roku 2012 [19] uvádí k časné léčbě plicní embolie (PE):
- u vysokého klinického podezření na akutní PE jsou doporučena parenterální antikoagulancia ihned
- u středního klinického podezření na akutní PE je více doporučeno podání parenterálních antikoagulancií, než nepodávat žádnou terapii, pokud výsledky diagnostických testů jsou za více než 4 hod
- u nízkého klinického podezření na akutní PE je doporučeno nepodávat parenterální antikoagulancia během čekání na výsledky diagnostických testů za předpokladu, že výsledky testů jsou očekávány do 24 hod
- u pacientů s akutní PE je více doporučena iniciální parenterální antikoagulační terapie (nízkomolekulární heparin, fondaparinux, i.v. nefrakcionovaný heparin či s.c. nefrakcionovaný heparin) než nezahájení žádné léčby
- u pacientů s nízkým rizikem PE, kteří mají adekvátní domácí podmínky, je více doporučeno včasné propuštění než propuštění po standardní době (např. po prvních 5 dnech léčby) (stupeň 2B)
Léčba plicní embolie v domácím prostředí
V poslední dekádě (tab. 1) byla publikována řada retrospektivních i prospektivních prací, které se zabývaly efektivitou a bezpečností léčby plicní embolie v domácím prostředí. Např. v celosvětovém registru RIETE byl porovnáván osud více než 10 000 nemocných s plicní embolií, kteří byli léčení v nemocnici nebo doma [24]. Domácí léčba, která byla indikována u více než 7 500 jedinců, byla spojena s nižším výskytem 90denní mortality na plicní embolii (1,5 % vs 2,1 %) a také nižší výskytem závažného krvácení (2,1 % vs 2,9 %). Rovněž celková mortalita byla u všech pacientů léčených ambulantně nižší ve srovnání s hospitalizační léčbou (5,4 % vs 7,0 %).
Table 1. Prospektivní studie ambulantní léčby plicní embolie. Upraveno podle [4,23] ![Prospektivní studie ambulantní léčby plicní embolie. Upraveno podle [4,23]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/7cc0f9e44d732227cf675f9b509cce48.jpg)
TEN – tromboembolická nemoc ŽT – žilní trombóza PE – plicní embolie GPS – Ženevské prognostické skóre HIT – heparinem indukovaná trombocytopenie LMWH – nízkomolekulární heparin TTE – transtorakální echokardiografie CHOPN – chronická obstrukční plicní nemoc * v práci Siragusa et al [32] byla doba sledování 180 dní Výhodou domácí léčby plicní embolie je kromě snížení finančních nákladů na péči v nemocnici jistě i zlepšení kvality života pacienta a jeho sociálního působení. Nevýhodou většího rozšíření domácího přístupu léčby je v první řadě nejasnost, jak vybrat vhodné pacienty s nízkým rizikem. V řadě publikovaných prospektivních studií byla kritéria pro ambulantní léčbu plicní embolie různorodá, mnohdy vágní a také obtížně použitelná pro praxi. Rovněž v praktických doporučeních chybí specifikace pro výběr pacientů s nízkým rizikem plicní embolie [4].
Klinická prognostická kritéria pro domácí léčbu
K určení, který z pacientů s plicní embolií bude mít dobrou prognózu, nízké riziko komplikací a může být vhodným kandidátem pro ambulantní léčbu plicní embolii nám mohou pomoci klinická prognostická kritéria, zobrazovací techniky a srdeční biomarkery. Pro domácí léčbu plicní embolie budou jistě vhodnější pacienti se stabilní plicní embolií bez známek systolické dysfunkce pravé komory při echokardiografii, bez dilatace pravé komory na výpočetní tomografii a bez zvýšení srdečních troponinů (troponin T a I), popřípadě mozkového natriuretického peptidu (BNP nebo NT-pro-BNP). Velmi užitečnou informaci o stratifikaci rizika s možností výběru pacienta s nízkým rizikem komplikací plicní embolie vhodným pro domácí léčbu přinášejí prognostické modely [4,25].
Ženevské prognostické skóre (Geneva Prognostic Score – GPS) je postavené na 6 jednoduchých klinických, laboratorních a ultrasonografických proměnách (tab. 2). Tyto faktory predikují možnost nepříznivého výsledku zahrnující úmrtí, recidivu TEN a velké krvácení během prvních 3 měsíců po vstupní epizodě plicní embolie. Pacienti s nízkým rizikem, se skóre ≤ 2 body, mají nízký výskyt těchto nežádoucích událostí (2,2–5,0 %) se senzitivitou mezi 58–85 % a negativní prediktivní hodnotou v rozmezí 95–98 % [26,38].
Table 2. Ženevské prognostické skóre 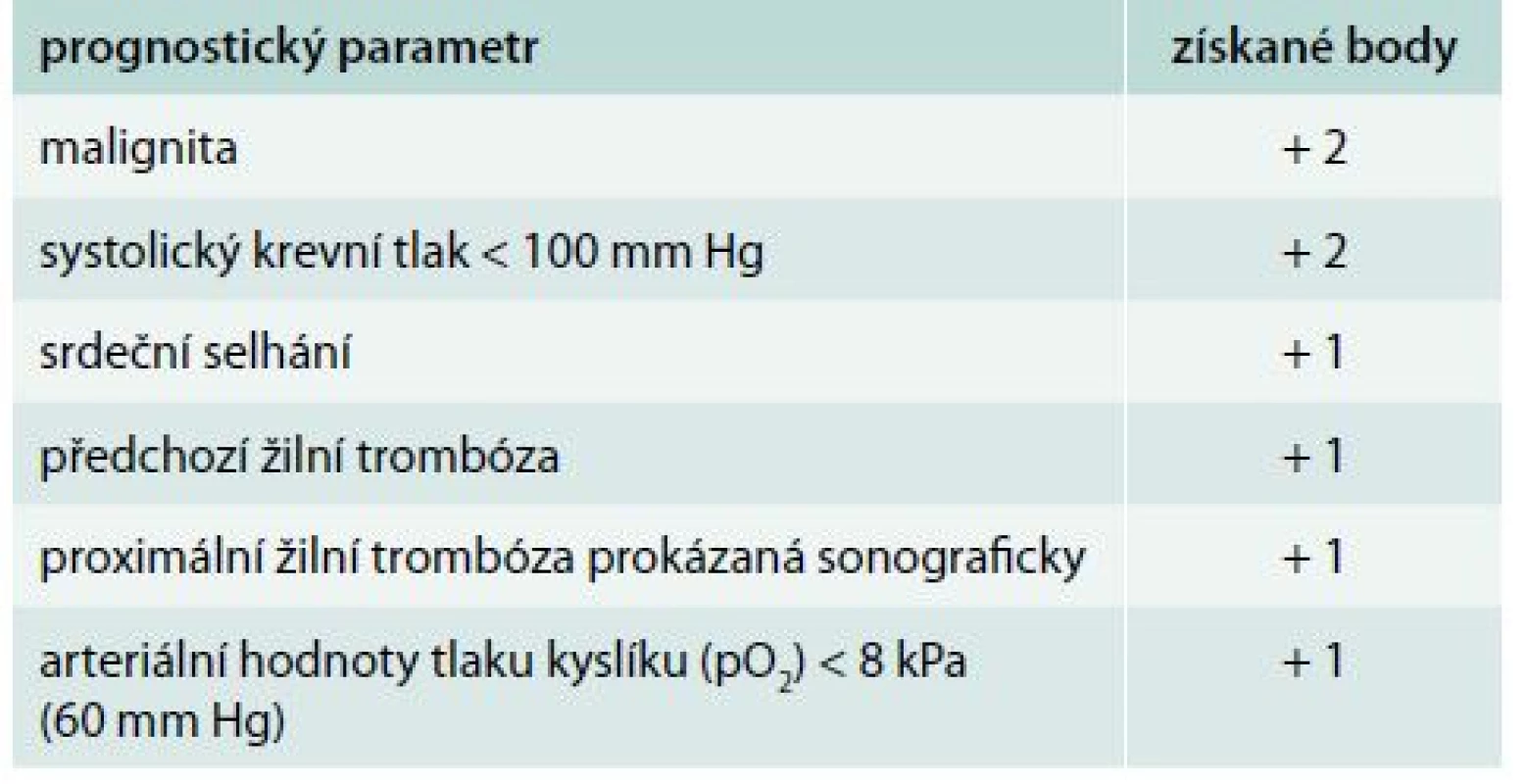
celkový počet bodů ≤ 2 určuje pacienta s nízkým rizikem plicní embolie Mnohem více ověřeným klinickým prognostickým modelem je PESI (Pulmonary Embolism Severity Index), který zařazuje pacienta do 5 skupin s určením celkové 30denní mortality od 1,1 % ve třídě I až po 24,5 % ve třídě V (tab. 3). PESI model nepotřebuje žádné laboratorní ani ultrasonografické parametry, je založen jen na klinických a rutinně dostupných faktorech. Tento model předpovídá nízkou 30denní mortalitu (0,9–2,6 %) u pacientů s nízkým rizikem (třída I a II). Porovnání nízkého (třída I a II) a vysokého rizika (třída V) vykazuje více než 90% senzitivitu a 98–100% negativní prediktivní hodnotu k v odhadu mortality [2,3,16].
Table 3. Pulmonary embolism severity index (PESI) 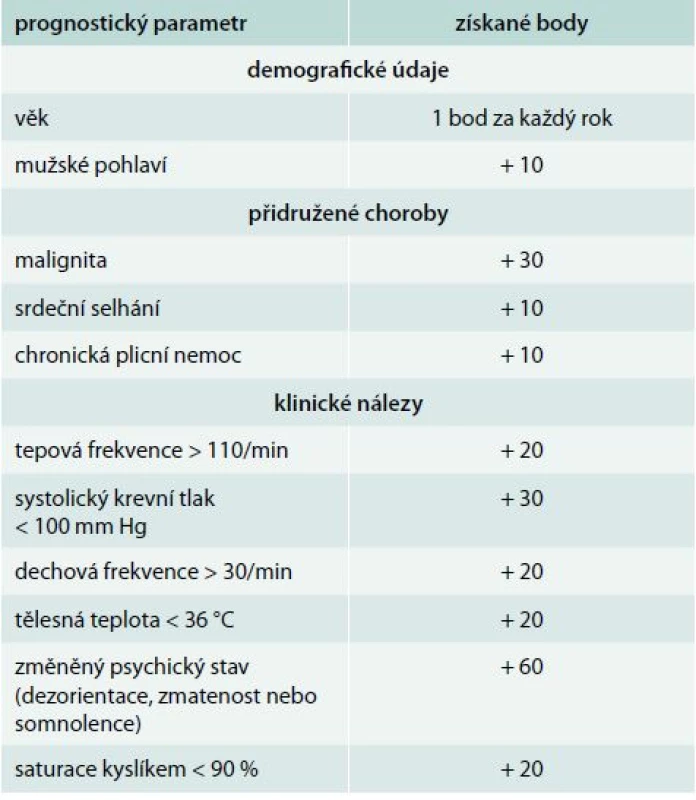
Získané body odpovídají pro zařazení pacientů do následujících tříd rizika: ≤ 65 třída I; 66–85 třída II; 86–105 třída III; 106–125 třída IV; a >125 třída V. Pacienti ve třídě I a II jsou definováni jako nízce rizikoví. V roce 2010 byla již dokončena a následně publikována zatím jediná randomizovaná studie s touto problematikou OTPE (Outpatient Treatment of Pulmonary Embolism). Studie zahrnula 344 pacientů z 19 center v Evropě a v USA. V primární analýze se rekurence TEN, do 90. dne léčby, vyskytla u 1 pacienta (0,6 %) oproti žádné recidivě ve skupině 168 hospitalizovaných. Ve stejném období se významné krvácení objevilo u 3 jedinců (1,8 %) ambulantně léčených v porovnání s žádnou epizodou ve druhé skupině. Výskyt celkové mortality byl v obou skupinách stejný (1 pacient; 0,6 %). Studie doporučila PESI jako model pro rozlišení rizikových a nerizikových nemocných. V roce 2010 Jimenez et al [17] uvedli práci, ve které zjednodušují PESI index na tzv. S-PESI (Simplified pulmonary embolism severity index, tab. 4). Stejně jako několikrát prospektivně validizovaný PESI [10,12], tak i S-PESI byl podroben validizaci, nicméně ne v přímém vztahu k ambulantní léčbě plicní embolie [30]. S-PESI vyžaduje znalost podstatně méně prognostických faktorů a jeho hodnota vyšší než 1 identifikuje nemocné nevhodné k domácí léčbě.
Table 4. Pulmonary embolism severity index (PESI) a zjednodušený pulmonary embolism severity index (S-PESI) 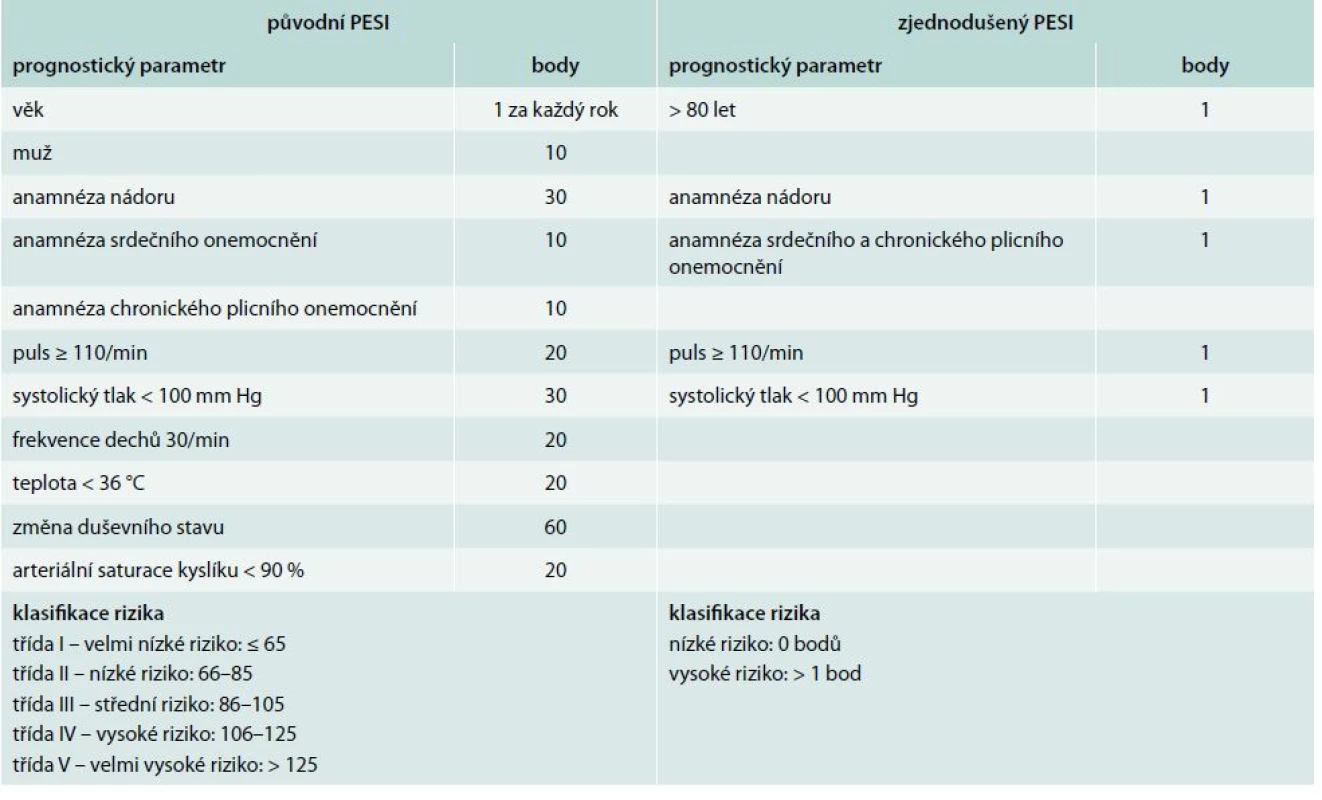
Vylučovací kritéria
Kromě indexů PESI a S-PESI se ukázalo, že také vylučovací kritéria použitá v Hestia studii [41], jsou vhodná a efektivní pro určení pacientů pro bezpečnou domácí léčbu plicní embolie. V post-hoc analýze bylo prokázáno, že 30denní mortalita dle Hestia kritérií byla stejně nízká jako při použití indexu S-PESI s dobrou senzitivitou a negativní prediktivní hodnotou (82, resp. 99 %) [41].
Vylučovací kritéria pro domácí léčbu plicní embolie v Hestia studii
- hemodynamická nestabilita (systolický TK < 100 mm Hg, TF > 100/min, stav vyžadující léčbu na jednotce intenzivní péče)
- nutnost trombolýzy nebo embolektomie
- aktivní krvácení nebo vysoké riziko krvácení
- nutnost podávat 24 hod kyslík k udržení saturace O2 > 90 %
- plicní embolie při antikoagulační terapii
- nutnost podávat parenterální analgetika > 24 hod
- nutnost hospitalizace z jiného medicínského nebo sociálního důvodu > 24 hod
- clearence kreatininu < 30 ml/min
- závažné jaterní onemocnění
- gravidita
- anamnéza heparinem indukované trombocytopenie
Bezpečnost domácí léčby
V otázce bezpečnosti domácí léčby lze využít i data o ambulantní léčbě žilní trombózy na základě dat z registru pacientů s žilní trombózou a plicní embolií RIETE. Malignita a clearence kreatininu < 60 ml/min se ukázaly jako významné prediktory komplikací (recidiva žilní trombózy, krvácení) ambulantní léčby [35]. Data z rozsáhlého registru RIETE byla hodnocena také v práci den Extera et al [14], kteří si položili otázku, zda pacienti s plicní embolií a malignitou mohou být léčeni doma. Byly vypracovány prediktory 30denní mortality u onkologických nemocných a podobně jako v kritériích PESI a S-PESI byly vytvořeny třídy klasifikující riziko ambulantní léčby plicní embolie. Mezi nepříznivé faktory s vyšší mortalitou patřila přítomnost metastáz, imobilizace a věk nad 80 let (tab. 5).
Table 5. Prediktory 30denní mortality u onkologických nemocných s plicní embolií sledovaný 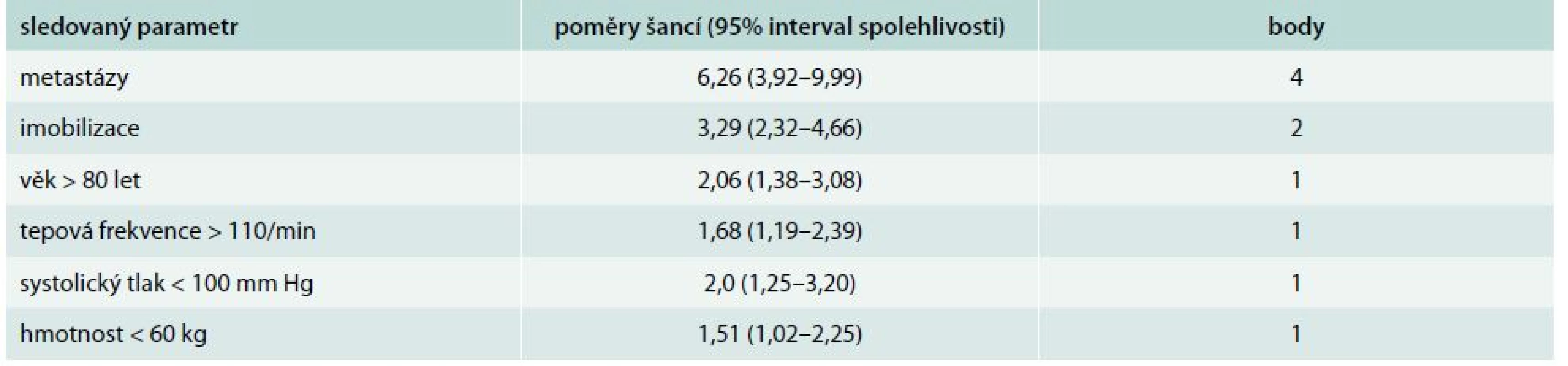
klasifikace rizika: třída I – nízké riziko < 2 body třída II – střední riziko 2–4 body třída III – vysoké riziko 5–7 bodů třída IV – velmi vysoké riziko > 7 bodů Nová orální antikoagulancia v domácí léčbě
Důležitým faktorem, který podporuje domácí léčbu plicní embolie, je uvedení nových orálních antikoagulancií (rivaroxaban, dabigatran, apixaban), která budou zřejmě postupně nahrazovat léčbu LMWH a kumariny. Aplikací těchto nových inhibitorů aktivovaného faktoru Xa nebo IIa by byla výrazně zjednodušena strategie vedení antikoagulační léčby. Tato nová antikoagulancia nevyžadují nutnost monitorace, mají málo lékových a potravinových interakcí, mohou být použita u pacientů s mírnou až střední renální a hepatální nedostatečností, většinou nevyžadují změny dávek a užívají se 1krát nebo maximálně 2krát denně. V případě rivaroxabanu a apixabanu je lék podáván bez nutnosti předchozí nebo souběžné léčby heparinem [9].
Domácí léčba klinicky stabilní malé plicní embolie je logicky možná. Vhodnými kandidáty by byli výhradně mladší jedinci s nízkým rizikem dle klinických prognostických parametrů (PESI, GPS, S-PESI), bez výrazné dilatace a dysfunkce pravé komory, bez zvýšení srdečních troponinů nebo mozkového natriuretického peptidu (NT-pro-BNP), s absencí tachykardie, hypotenze a bez poklesu saturace kyslíku. Ambulantní léčba plicní embolie není rovněž indikována u pacientů se srdečním selháním, závažným maligním onemocněním, se závažnou renální insuficiencí, chronickým plicním onemocněním nebo s jinými významnými přidruženými stavy, které by vyžadovaly hospitalizaci. Ačkoliv použití klinických prognostických modelů, srdečních biomarkerů a parametrů ultrasonografie v prospektivních studiích určilo skupinu pacientů s nízkým rizikem, je stále nejasná otázka účinnosti a bezpečnosti jejich léčby doma.
Pokud bychom měli sumarizovat podmínky pro domácí léčbu, potom by bylo možné uvažovat o ambulantní léčbě u těchto nemocných:
- nízké riziko dle S-PESI
- bez hemodynamické nestability (především bez šokového stavu)
- bez selhávání pravé komory
- bez předchozího chronického srdečního či plicního onemocnění
- bez závažných komorbidit (onemocnění gastrointestinálního traktu, onemocnění ledvin, krevní choroby, pokročilá nádorová onemocnění)
- s nízkým rizikem časné rekurence tromboembolické nemoci
- bez jiných indikací pro hospitalizaci (bolest vyžadující parenterální analgetika, infekce apod)
- s nízkým rizikem krvácení
- s garantovanou spoluprací nemocného, dobře organizovanou domácí péčí
Výsledky studií zabývajících se ambulantní léčbou plicní embolie
Recentně jsou publikovány práce, které podrobně analyzují kvalitu a protokoly studií zabývajících se ambulantní léčbou plicní embolie. Nejen v nich můžeme najít odpověď na otázku, zda skutečně mohou být vybraní jednici s plicní embolií léčeni doma. V následující části jsou uvedeny důvody, proč si myslíme, že nemáme dostatek důkazů pro odpověď na tuto otázku.
Vinson et al [36] pomocí údajů z databází MEDLINE, EMBASE a dalších podrobně do března roku 2012 hodnotili prospektivní studie s akutní symptomatickou plicní embolií, v nichž byla aplikována léčba doma. Byla sledována zejména vstupní a výstupní kritéria, rekurence tromboembolizmu, výskyt velkého krvácení, mortalita a také stupeň kvality jednotlivých studií GRADE (Grading of Recommendations Assessment, Development and Evaluation) [15]. Celkem bylo vybráno 8 studií, ve kterých bylo 777 pacientů. Bohužel drtivá většina studií byla nízké kvality dle GRADE a pouze jediná randomizovaná práce OTPE [5] byla střední kvality. Při rozboru 7 studií, které měly celkem 741 pacientů a uváděly primární a sekundární cíle do 90 dní, byl výskyt mortality z důvodu tromboembolizmu a krvácení spojené s moralitou nulový, rekurence tromboembolizmu 1,8 % (13/741), významné krvácení 0,4 % (3/741) a celková mortalita 1,3 % (10/741). Zondag [40] ve své analýze 13 studií (1 657 pacientů) o bezpečnosti domácí léčby plicní embolie s nízkým rizikem uvádí, že výskyt rekurence tromboembolizmu, závažného krvácení a mortality (po korelaci pro malignity) byl shodný pro pacienty léčených doma, s časným propuštěním i léčených v nemocnici.
Pokud bychom se zaměřili jen na 3 poslední prospektivní studie ambulantní léčby plicní embolie (tab. 6), máme k dispozici data zahrnující 620 jedinců s výskytem rekurence u 1,1 %, významného krvácení v 0,8 % a celkovou mortalitou 0,6 %. Je třeba ale také uvést, že randomizovaná studie Otera [28] byla předčasně ukončena, protože ve skupině pacientů propuštěných domů (po 3 a 5 dnech hospitalizace) byl vysoký výskyt krátkodobé mortality v porovnání s hospitalizovanými standardně (2,8 % vs 0 %).
Table 6. Přehled recentních studií ambulantní léčby plicní embolie 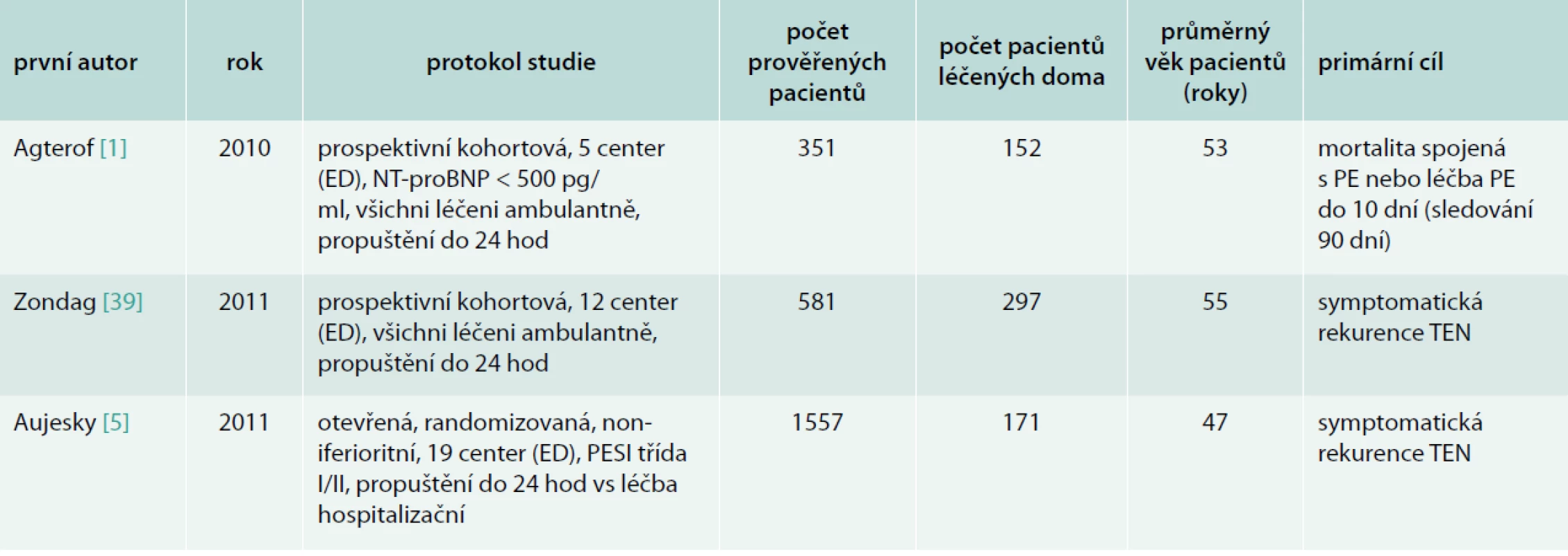
ED – oddělení emergency PE – plicní embolie TEN – tromboembolická nemoc Výsledky to jistě nejsou špatné, spíše naopak, jen je třeba si říci, zda nám to stačí k rozhodnutí k přijetí do nemocnice či nikoliv. Domnívám se, že počet pacientů, u nichž byla léčba plicní embolie vedena doma, je příliš nízký, a jak bylo uvedeno v systematickém přehledu Vinsona [36], kvalita dat je ve většině případů nízká. Máme k dispozici jen 1 randomizovanou studii [5], v níž bylo iniciálně doma léčeno pouze 171 pacientů. Průměrný věk pacientů v této studii byl 47 let a ani ve studiích Agterofa [1] a Zondaga [39] průměrný věk nepřekročil 55 let. Jednalo se tedy o výhradě mladší jednice, než je průměrný věk pacientů přicházejících pro plicní embolii. Baglin [6] uvádí, že až 50 % pacientů s plicní embolií může být léčeno doma. V recentních studiích z tab. 6 bylo prověřováno 2 489 pacientů a z nich jen 25 % bylo nakonec léčeno doma, tedy o polovinu méně, než předpokládá Baglin. Rovněž v rozsáhlém registru pacientů s plicní embolií EMPEROR zahrnující data z 22 oddělení emergency v USA bylo zjištěno, že pouze 21 z 1 880 (1,1 %) pacientů bylo propuštěno bez hospitalizace domů [29].
Postavení domácí léčby v současných doporučených postupech
Dalším důležitým faktem je skutečnost, že současná nejčastěji používaná guidelines pro léčbu plicní embolie se nestaví k ambulantní léčbě jednoznačně a příznivě. Doporučení jsou nepřesná, vágní a síla důkazu pro jejich aplikaci nízká. Poslední doporučení ACCP z roku 2012 [19] preferuje časné propuštění z nemocnice u vybraných jedinců a o iniciální ambulantní léčbě vůbec nehovoří. Také evropská guidelines, publikována v roce 2014, zvažují časné propuštění pacientů s plicní embolií, nebo léčbu iniciálně doma s nízkým rizikem [20], ale uvádějí, že vyjma PESI není dostatečné ověření síly důkazů pro ostatní prognostické postupy ve vztahu k domáčí léčbě. Nad lékařem, který zvažuje domácí léčbu, stojí několik otazníků. Musí provést stratifikace rizika plicní embolie. Má provádět hodnocení PESI, S-PESI, nebo použít tzv. Hestia kritéria? Vylučovacích kritérií v Hestia studie Zondaga [39] bylo 11 (přehled na s. 434). Bude provádět sonografii srdce se zaměřením na funkci a velikost pravé komory, bude zjišťovat troponin T nebo NT-proBNP? Jistě mu práce zabere mnohem více času, než kdyby se rozhodl pro hospitalizační léčbu. Průměrná doma pobytu pacienta na oddělení emergency před propuštěním domů byla v prospektivních studiích 3–14 hod, maximálně 24 hod [5,32,36]. Důležitým faktorem pro rozhodnutí k ambulantní léčbě je kromě správného výběru pacientů také obava lékaře z možných právních dopadů při komplikacích léčby vedené doma a rovněž i strach pacientů, že nebudou pod stálou kontrolou zdravotníků. V neposlední řadě je nutné si uvědomit, že s aplikací léčby plicní embolie nemáme v České republice příliš zkušeností a stále je řada pracovišť, které ani nekomplikovanou žilní trombózu neléčí doma.
Kdybychom měli hodnotit argumenty proti ambulantní léčbě plicní embolie, tak bychom uvedli následující faktory:
Podpořeno programem PRVOUK P37/03.
doc. MUDr. Radovan Malý, Ph.D.
radovan.maly@fnhk.cz
I. interní kardioangiologická klinika LF UK a FN Hradec Králové
www.fnhk.cz
Doručeno do redakce 2. 3. 2015
Přijato po recenzi 8. 4. 2015
Sources
1. Agterof MJ, Schutgens REG, Snijder RJ et al. Out of hospital treatment of acute pulmonary embolism in patients with a low NT-proBNP level. J Thromb Haemost 2010; 8(6): 1235–1241.
2. Aujesky D, Obrosky DS, Stone RA et al. Derivation and validation of a prognostic model for pulmonary embolism. Am J Respir Crit Care Med 2005; 172(8): 1041–1046.
3. Aujesky D, Roy PM, Le Manach CP et al. Validation of a model to predict averse outcomes in patients with pulmonary embolism. Eur Heart J 2006; 27(4): 476–481.
4. Aujesky D, Mazzolai L, Hugli O et al. Outpatient treatment of pulmonary embolism. Swiss Med Wkly 2009; 139(47–48): 685–690.
5. Aujesky D, Roy PM, Verschuren F et al. Outpatient versus inpatient treatment for patients with acute pulmonary embolism: an international, open-label, randomised, non-inferiority trial. Lancet 2011; 378(9785): 41–48.
6. Baglin T. Fifty per cent of patients with pulmonary embolism can be treated as outpatients. J Thromb Haemost 2010; 8(11): 2404–2405.
7. Beer JH, Burger M, Gretener S et al. Outpatient treatment of pulmonary embolism is feasible and safe in a substantial proportion of patients. J Thromb Haemost 2003; 1(1): 186–187.
8. British Thoracic Society Standards of Care Committee Pulmonary Embolism Guideline Development Group. British Thoracic Society guidelines for the management of suspected acute pulmonary embolism. Thorax 2003; 58(6): 470–483.
9. Buller HR, Prins MH, Lensin AW et al. Oral rivaroxaban for the treatment of symptomatic pulmonary embolism. N Engl J Med 2012; 366(14): 1287–1297.
10. Chan CM, Woods C, Shorr AF. The validation and reproducibility of the pulmonary embolism severity index. J Thromb Haemost 2010; 8(7): 1509–1514.
11. Davies CW, Wimperis J, Green ES et al. Early discharge of patients with pulmonary embolism: a two-phase observational study. Eur Respir J 2007; 30(4): 708–714.
12. Donzé J, Le Gal G, Fine MJ et al. Prospective validation of the Pulmonary Embolism Severity Index. A clinical prognostic model for pulmonary embolism. Thromb Haemost 2008; 100(5): 943–948.
13. Erkens PMG, Gandara E, Wells P et al. Safety of outpatient treatment in acute pulmonary embolism. J Thromb Haemost 2010; 8(11): 2412–2417.
14. Exter PL, Gómez V, Jiménez D et al. for the RIETE investigators. A clinical prognostic model for the identification of low-risk patiens with acute symptomatic pulmonary embolism and actice cancer. Chest 2013; 143(1): 138–145.
15. Guyatt GH, Oxman AD, Vist GE et al. GRADE Working Group. GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. BMJ 2008; 336(7650): 924–926.
16. Jimenez D, Yusen RD, Otero R et al. Prognostic models for selecting patients with acute pulmonary embolism for initial outpatient therapy. Chest 2007; 132(1): 24–30.
17. Jimenez D, Aujesky D, Moores L et al. Simplification of the pulmonary embolism severity index for prognostication in patients with acute symptomatic pulmonary embolism. Arch Intern Med 2010; 170(15): 1383–1389.
18. Karetová D. Antikoagulační léčba flebotrombóz v ambulantní praxi. Vnitř Lék 2005; 51(7–8): 790–794.
19. Kearon C, Akl EA, Comerota AJ et al. American College of Chest Physicians. Antithrombotic therapy for VTE disease: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest 2012; 141(2 Suppl): e419S-e494S. Dostupné z DOI: <http://doi: 10.1378/chest.11–2301>.
20. Konstantinides SV, Torbicki A, Agnelli G et al. Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J 2014; 35(43): 3033–3069, 3069a-3069k.
21. Kovacs MJ, Anderson D, Morrow B et al. Outpatient treatment of pulmonary embolism with dalteparin. Thromb Haemost 2000; 83(2): 209–211.
22. Kovacs MJ, Hawel JD, Rekman JF et al. Ambulatory management of pulmonary embolism: a pragmatic evaluation. J Thromb Haemost 2010; 8(11): 2406–2411.
23. Lankeit M, Konstantinides S. Is it time for home treatment of pulmonary embolism? Eur Respir J 2012; 40(3): 742–749.
24. Maestre A, Sánchez R, Rosa V et al. RIETE Investigators. Clinical characteristics and outcome of inpatients versus outpatients with venous thromboembolism: findings from the RIETE Registry. Eur J Intern Med 2010; 21(5): 377–382.
25. Malý R, Beran L, Tomko T. Ambulantní léčba žilního tromboembolismu. Interní Med 2011; 13(5): 193–195.
26. Nendaz MR, Bandelier P, Aujesky D et al. Validation of a risk score identifying patients with acute pulmonary embolism, who are at low risk of clinical adverse outcome. Thromb Haemost 2004; 91(6): 1232–1236.
27. Olsson CG, Bitzen U, Olsson B et al. Outpatient tinzaparin therapy in pulmonary embolism quantified with ventilation/perfusion scintigraphy. Med Sci Monit 2006; 12(2): PI9-P13.
28. Otero R, Uresandi F, Jimenez D et al. Home treatment in pulmonary embolism. Thromb Res 2010; 126(1): e1-e5. Dostupné z DOI: <http://doi: 10.1016/j.thromres.2009.09.026>.
29. Pollack CV, Schreiber D, Goldhaber SZ et al. Clinical characteristics, management, and outcomes of patients diagnosed with acute pulmonary embolism in the emergency department: initial report of EMPEROR (Multicenter Emergency Medicine Pulmonary Embolism in the Real World Registry). J Am Coll Cardiol 2011; 57(6): 700–706.
30. Righini M, Roy PM, Meyer G et al. The Simplified Pulmonary Embolism Severity Index (PESI): validation of a clinical prognostic model for pulmonary embolism. J Thromb Haemost 2011 : 9(10): 2115–2117.
31. Rodríguez-Cerrillo M, Alvarez-Arcaya A, Fernandez-Diaz E et al. A prospective study of the management of non-massive pulmonary embolism in the home. Eur J Intern Med 2009; 20(6): 598–600.
32. Siragusa S, Arcara C, Malato A et al. Home therapy for deep vein thrombosis and pulmonary embolism in cancer patients. Ann Oncol 2005; 16(Suppl 4): iv136-iv139.
33. Snow V, Qaseem A, Barry P et al. Management of venous thromboembolism: a clinical practice guideline from the American College of Physicians and the American Academy of Family Physicians. Ann Intern Med 2007; 146(3): 204–210.
34. Torbicki A, Perrier A, Konstantinides S et al. Guidelines on the diagnosis and management of acute pulmonary embolism: the Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). Eur Heart J 2008; 29(18): 2276–2315.
35. Trujillo-Santos J, Herrera S, Page MA et al. RIETE Investigators. Predicting adverse outcome in outpatients with acute deep vein thrombosis findings from the RIETE Registry. J Vasc Surg 2006; 44(4): 789–793.
36. Vinson DR, Zehtabchi S, Yealy DM. Can selected patients with newly diagnosed pulmonary embolism be safely treated without hospitalization? A systematic review. Ann Emerg Med 2012; 60(5): 651–662. Erratum in Ann Emerg Med 2015; 65(2): 177.
37. Wells PS, Anderson DR, Rodger MA et al. A randomized trial comparing 2 low-molecular-weight heparins for the outpatient treatment of deep vein thrombosis and pulmonary embolism. Arch Intern Med 2005; 165(7): 733–738.
38. Wicki J, Perrier A, Perneger TV et al. Predicting adverse outcome in patients with acute pulmonary embolism: a risk score. Thromb Haemost 2000; 84(4): 548–552.
39. Zondag W, Mos IC, Creemers-Schild D et al. Outpatient treatment in patients with acute pulmonary embolism: the Hestia Study. J Thromb Haemost 2011; 9(8): 1500–1507.
40. Zondag W, den Exter PL, Crobach MJ et al. Hestia Study Investigators. Comparison of two methods for selection of out of hospital treatment in patients with acute pulmonary embolism. Thromb Haemost 2013; 109(1): 47–52.
41. Zondag W, Kooiman J, Klok FA et al. Outpatient versus inpatient treatment in patients with pulmonary embolism: a meta-analysis. Eur Respir J 2013; 42(1): 134–144.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2015 Issue 5-
All articles in this issue
- Vliv spironolaktonu u pacientů se srdečním selháním a zachovalou funkcí levé komory – studie TOPCAT
- Nová verze klasifikace plicní hypertenze
- Hypertenze u žen
- Vplyv pridania fytosterolu ku hypolipidemickej liečbe statínom na veľkosť lipoproteínových partikúl u pacientov s veľmi vysokým kardiovaskulárnym rizikom
- Hypertenze bílého pláště a maskovaná hypertenze
- Personalizovaná farmakoterapie digoxinem
- Kontroverze kolem betablokátorů
- Je potřeba léčit agresivně fibrilaci síní?
- Význam kyseliny močové a terapie alopurinolem v ovlivnění kardiovaskulárních onemocnění
- Ambulantní léčba žilní plicní embolie
- Současný stav a budoucnost péče o nemocné s vrozeným srdečními vadami
- Inhibice systému renin-angiotenzin-aldosteron u srdečního selhání aneb od obecného souhlasu (CONSENSUS) po vzorec myšlení (PARADIGM-HF)
- Hemokoagulace – nové pohledy na starou kaskádu
- Primární hyperaldosteronizmus: problémy diagnostických přístupů
- Neurokardiologie nebo kardioneurologie – nová specializace budoucnosti?
- Feochromocytom – proč je jeho časná diagnóza pro pacienta důležitá?
- Nakolik jsme schopni dosáhnout současně platných cílových hodnot LDL-cholesterolu v sekundární prevenci ischemické choroby srdeční
- Čo môže zapríčiniť diabetes
- Hyperosmolární hyperglykemický stav
- Kombinační léčba hypertenze 2015
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Hyperosmolární hyperglykemický stav
- Hemokoagulace – nové pohledy na starou kaskádu
- Význam kyseliny močové a terapie alopurinolem v ovlivnění kardiovaskulárních onemocnění
- Hypertenze u žen
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


