-
Medical journals
- Career
Je potřeba léčit agresivně fibrilaci síní?
Authors: Josef Kautzner
Authors‘ workplace: Klinika kardiologie IKEM Praha, přednosta prof. MUDr. Josef Kautzner, CSc.
Published in: Vnitř Lék 2015; 61(5): 417-420
Category: Reviews
Overview
Fibrilace síní (FS) je nejčastější setrvalou srdeční arytmií u člověka. Dřívější studie srovnávající strategii kontroly rytmu se strategií kontroly tepové frekvence neukázaly rozdíl v sledovaných parametrech. Výsledkem byl konzervativní postup při léčení méně symptomatické FS. Tato situace se v posledních létech mění. Důvodem jsou v první řadě údaje o větších rizicích FS, zejména důsledky asymptomatických mozkových embolizací a mozkové hypoperfuze. Ty mohou vysvětlovat spojení FS s demencí. Dalším důvodem jsou povzbudivé výsledky katetrizační ablace FS. Tyto skutečnosti poskytují nový pohled na indikace k intervenční léčbě této arytmie. Obhajují totiž snahy o udržení sinusového rytmu i za cenu opakované intervence nebo kombinované léčby s dříve neúčinnými antiarytmiky.
Klíčová slova:
asymptomatické mozkové embolizace – demence – fibrilace síní – katetrizační ablaceÚvod
Fibrilace síní (FS) je nejčastější setrvalou srdeční arytmií u člověka. Její výskyt je odhadován na 1–2 % z celkové populace, nicméně může dosáhnout až 10 % u populace osmdesátníků [1]. Prognózy, které vycházejí z epidemiologických údajů, naznačují, že počet nemocných se v nejbližších 10–20 letech minimálně zdvojnásobí. FS představuje závažný společenský problém, a to nejen četností svého výskytu, ale především díky svým četným komplikacím a nákladům spojených s jejich léčením. V posledních létech se začínají hromadit údaje, které ukazují, že problém je daleko větší a že FS je nebezpečnější, než se dosud zdálo. Mozkové příhody a případy srdečního selhání navozeného touto tachyarytmií jsou zřejmě jen špičkou pomyslného ledovce. Tento přehled shrnuje současné znalosti a argumenty na podporu časnější a agresivnější léčby FS.
Historicky bylo provedeno několik randomizovaných studií, které porovnávaly u nemocných s FS strategii kontroly rytmu nebo frekvence a jejich dopad na prognózu nemocných. Jejich metaanalýza (celkem 8 studií se 7 499 pacienty s FS) potvrdila chybění jakéhokoliv rozdílu ve výsledku [2]. Nebyl shledán rozdíl v celkové mortalitě (RR 0,95; CI 0,86–1,05), kardiovaskulární mortalitě (RR 0,99; CI 0,87–1,13), výskytu arytmické/náhlé smrti (RR 1,12; CI 0,91–1,38), ischemických mozkových příhod (RR 0,89; CI 0,52–1,53), systémových embolizací (RR 0,89; CI 0,69–1,14) a většího krvácení (RR 1,10; CI 0,89–1,36). Nebyl shledán ani rozdíl v sledovaných parametrech v závislosti na stupni kontroly srdeční frekvence [3]. Tato absence rozdílu v sledovaných parametrech mezi oběma strategiemi byla obecně interpretována tak, že je možno kontrolovat u FS pouze frekvenci a zajistit antikoagulační léčbu. Uvedené výsledky po svém zveřejnění ovlivnily veřejné mínění lékařské veřejnosti v tom smyslu, že není potřeba se snažit o udržení sinusového rytmu. Ekonomické studie navíc ukázaly, že strategie kontroly frekvence je podstatně levnější [4]. Výsledkem bylo, že u mnoha nemocných nebyla ani jednou vyzkoušena kardioverze [5]. V poslední době se však situace začíná pozvolna měnit. V následujícím textu se pokusím vysvětlit, co přispívá k této změně pohledu na FS.
Současný pohled na problematiku fibrilace síní
V první řadě to byly podrobnější rozbory a následné analýzy zmíněných studií. Důležité je zdůraznit, že se tato data netýkala vysoce symptomatických pacientů, které bylo nutno intenzivně léčit a nikoliv randomizovat k jedné nebo druhé strategii. Dále se ukázalo, že u skupin nemocných léčených jednou ze dvou strategií bylo zvýšené riziko úmrtí spojeno s vyšším věkem, ischemickou chorobou srdeční, srdečním selháním, diabetem, mozkovými příhodami, kouřením, dysfunkcí levé komory a mitrální regurgitací. Nejdůležitějším pozorováním bylo, že přítomnost sinusového rytmu byla spjata s nižším rizikem mortality [6]. Podobně tomu bylo u nemocných léčených trvale warfarinem. Naopak, použití antiarytmik zvyšovalo mortalitu po adjustaci na přítomnost sinusového rytmu. Pacienti léčení strategií kontroly rytmu měli výrazně méně projevů srdečního selhání a lepší funkční parametry [7]. Tato data potvrzují, že zmíněné studie nelze interpretovat, jako se často činí, tj. zda se má nebo nemá léčit FS. Ve skutečnosti šlo o porovnání 2 léčebných strategií, z nichž jedna byla zaměřena na snahu o udržení sinusového rytmu pomocí antiarytmik. Pokud byl dokumentován sinusový rytmus při běžných kontrolách, byla některým pacientům vysazena dokonce i antikoagulancia. Následné analýzy ukázaly, že pacienti, kteří měli skutečně sinusový rytmus a kteří brali antikoagulancia, měli lepší prognózu.
Dalším argumentem svědčícím proti benignitě FS jsou objektivní data o tom, že FS zhoršuje prognózu postižených jedinců z celé řady příčin. Ukázalo se, že u pacientů s FS je více než dvojnásobně zvýšeno dlouhodobé riziko úmrtí [8]. Pacienti s FS mají dále výrazně vyšší riziko mozkových příhod embolického charakteru. Ty tvoří asi 20 % všech mozkových příhod, ale mají nejhorší prognózu [9]. Jejich riziko se výrazně zvyšuje s věkem. Víme, že riziko mozkových příhod lze významně snížit antikoagulační léčbou [10]. Nicméně se hromadí údaje o tom, že mozkové příhody mohou být jen pomyslnou špičkou ledovce. Ve skutečnosti mají zřejmě pacienti s FS řadu asymptomatických embolizačních příhod, a to i při adekvátní antikoagulační léčbě. Tomu nasvědčují data z různých studií u pacientů podstupujících katetrizační ablaci FS. V jedné studii byly asymptomatické léze v mozku nalezeny před ablací v plných 60 % případů [11]. Např. v naší populaci nemocných, kteří byli indikováni ke katetrizační ablaci arytmie a podstoupili před výkonem MRI mozku, byl zjištěn značný výskyt asymptomatických mozkových lézí [12]. Alespoň jedna asymptomatická léze byla nalezena v 75 % případů před katetrizační ablaci. Jejich přítomnost korelovala s vyšším CHA2DS2-VASC skóre, nicméně průměrná hodnota u skupiny s lézemi byla 1,8 ± 1,3. Tento a podobné nálezy mohou do jisté míry vysvětlovat dokumentovanou souvislost FS s různými formami demence. V metaanalýze studií s více než 77 000 nemocných byla v průběhu sledování zjištěna FS v 15 % případů a demence v 6,5 % [13]. FS byla nejsilnějším prediktorem rozvoje demence (relativní riziko 1,36). Nicméně, zdá se, že kognitivní funkce se u pacientů s FS snižují nezávisle na výskytu embolických mozkových příhod. Některé studie totiž potvrdily, že FS způsobuje hypoperfuzi určitých oblastí mozku. To může mít za následek zmenšení objemu mozku a rozvoj demence [14]. Hypoperfuze je zřejmě důsledkem narušení delikátní mozkové autoregulace průtoku krve v závislosti na krevním tlaku. Neustálé změny krevního tlaku při FS mohou zmíněný regulární mechanizmus oslabit a může dojít k určité redistribuci krevního průtoku do preferenčních oblastí. Existují data o tom, že pouhé zpravidelnění rytmu prostřednictvím katetrizační ablace AV junkce s následnou implantaci kardiostimulátoru vedou k úpravě hypoperfuze a zlepšení kognitivních funkcí [15]. Tato problematika je nyní předmětem intenzivního výzkumu [16].
Image 1. MRI mozku pacienta indikovaného ke katetrizační ablaci fibrilace síní. Šipky označují asymptomatické mozkové léze 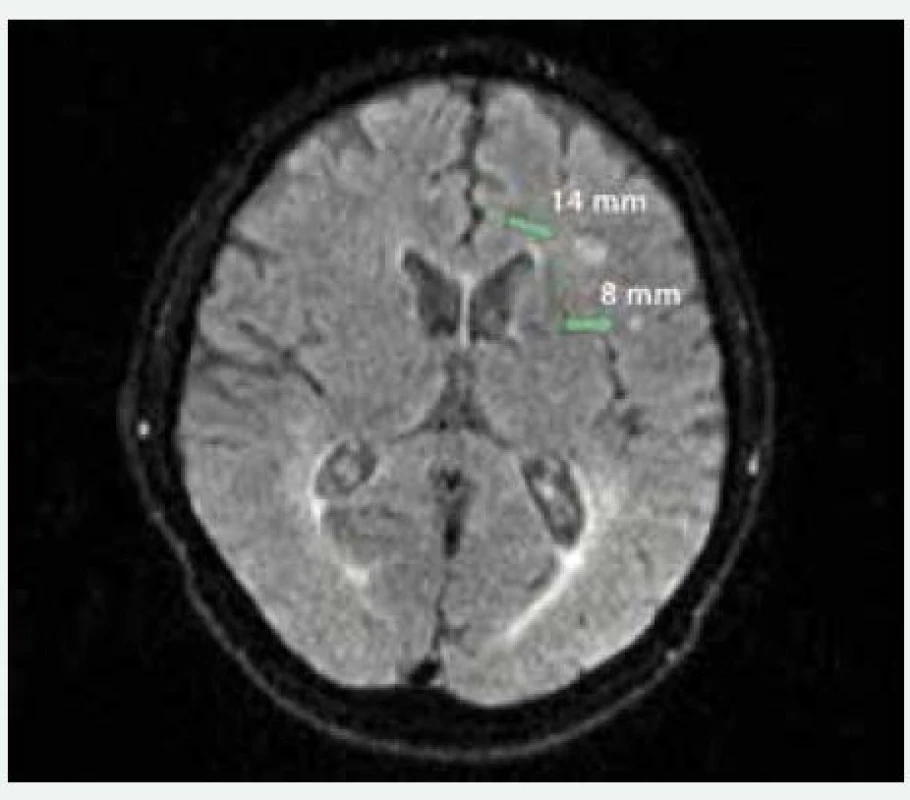
FS přispívá i k progresi srdečního selhání a může být dokonce jeho příčinou [17,18]. Podezření na tzv. tachykardií indukovanou kardiomyopatii lze vyslovit na základě recentního záchytu srdečního selhání s FS a při nepříliš zvětšených srdečních oddílech. Na druhé straně je známo, že FS je častou komplikací srdečního selhání a její výskyt narůstá s tíží srdečního selhání. U nemocných ve 4. třídě funkční klasifikace se může FS vyskytovat téměř v polovině případů [19]. Proto je při podezření na tachykardií indukovanou kardiomyopatii vhodné indikovat buď jako dočasné řešení elektrickou kardioverzi s následnou farmakoterapií, nebo rovnou katetrizační ablaci FS. V prvním případě je možné potvrdit diagnózu tím, že dojde při sinusovém rytmu k zlepšení funkce levé komory. Jediným problémem je, že výběr antiarytmik zůstává u nás omezen prakticky pouze na amiodaron. Na druhé straně je známo, že udržení sinusového rytmu před katetrizační ablací perzistující formy arytmie zlepšuje výsledky samotné ablace.
Data z poslední doby ukazují, že FS je spojena i se zvýšeným výskytem fibrilace komor a oběhové zástavy. Např. kontrolovaná populační studie naznačila, že FS byla spojena s trojnásobným rizikem vzniku fibrilace komor. Toto riziko nebylo závislé na přidružených onemocněních nebo podávání antiarytmik [20]. Některé studie naznačují, že tento vztah platí pouze tehdy, je-li přítomno srdeční selhání. To může vysvětlovat zvýšené riziko fibrilace komor [21].
Dalším momentem, který mění náš pohled na léčbu FS, je omezená účinnost antiarytmik a narůstající úspěšnost katetrizační ablace [22]. Potenciálně závažné nežádoucí účinky antiarytmik vysvětlují zřejmě neutrální výsledky výše zmíněných prognostických studií [6]. Na druhé straně se stala katetrizační ablace metodou volby u nemocných, kteří mají recidivy FS i při léčbě antiarytmiky [23,24]. Bez ohledu na použitou techniku se odborníci shodují na tom, že základem katetrizační ablace FS je elektrická izolace plicních žil. Právě v rukávech srdeční svaloviny, které se šíří na plicní žíly, jsou velmi často lokalizovány fokální zdroje. Ty spouštějí v převážné většině případů FS. Současné zkušenosti svědčí pro to, že úspěšnost výkonu je větší, pokud je intervence nabídnuta nemocným v časnějším stadiu onemocnění – tedy obvykle u paroxyzmální formy nebo krátce trvající perzistující formy. U těchto nemocných je i nejnižší riziko komplikací. Naše recentní data ukazují, že časná indikace k ablaci a reablace v případě recidiv umožňují dosáhnout vysokého procenta pacientů, kteří nemají recidivy FS. Při kombinaci katetrizační ablace s léky je možno zbavit dlouhodobě až 95–97 % nemocných významnějších recidiv arytmie a udržet sinusový rytmus [25]. Podobná data publikovali další autoři [26]. Dalším argumentem, který hovoří ve prospěch intervenční léčby FS, je nízký výskyt komplikací, pokud je výkon prováděn v centru s odpovídajícím vybavením, zkušenostmi a objemem procedur. Podle poslední verze Doporučení ESC má být prováděna ablace lékaři s odpovídajícím vzděláním a v centru s velkými zkušenostmi [24]. To samozřejmě platí zejména v případech, v nichž chceme ablaci FS nabízet jako metodu první volby. Že to není samozřejmostí, ukazují data z USA, získaná analýzou hospitalizačních záznamů pro pojišťovny [27]. Počet závažných kardiálních komplikací dosáhl 2,54 % a jejich výskyt byl signifikantně vyšší v centrech, která prováděla méně než 50 výkonů za rok a u operatérů, kteří prováděli méně než 25 výkonů za rok. Takových byla v USA naprostá většina, plných 81 %. Naše analýza téměř 1 200 ablačních výkonů odhalila výskyt komplikací v 3,3 % [28]. Potenciálně život ohrožující komplikace byly zjištěny v 0,75 % (3 případy tamponády, 5 mozkových příhod nebo TIA a 2 případy hemotoraxu). V jiné studii jsme ukázali, že asymptomatické mikroembolizace zjištěné po katetrizační ablaci se vyskytly pouze v 1,7 % případů [29]. To je velice příznivé číslo ve srovnání s ostatními podobnými studiemi, v nichž se počty pohybovaly běžně okolo 10 % s maximem nad 30 % [26].
Image 2. Ukázka elektroanatomické mapy levé síně se schématem lézí, které vedly k izolaci plicních žil u nemocného s paroxyzmální fibrilací síní (levý panel, pohled zezadu). 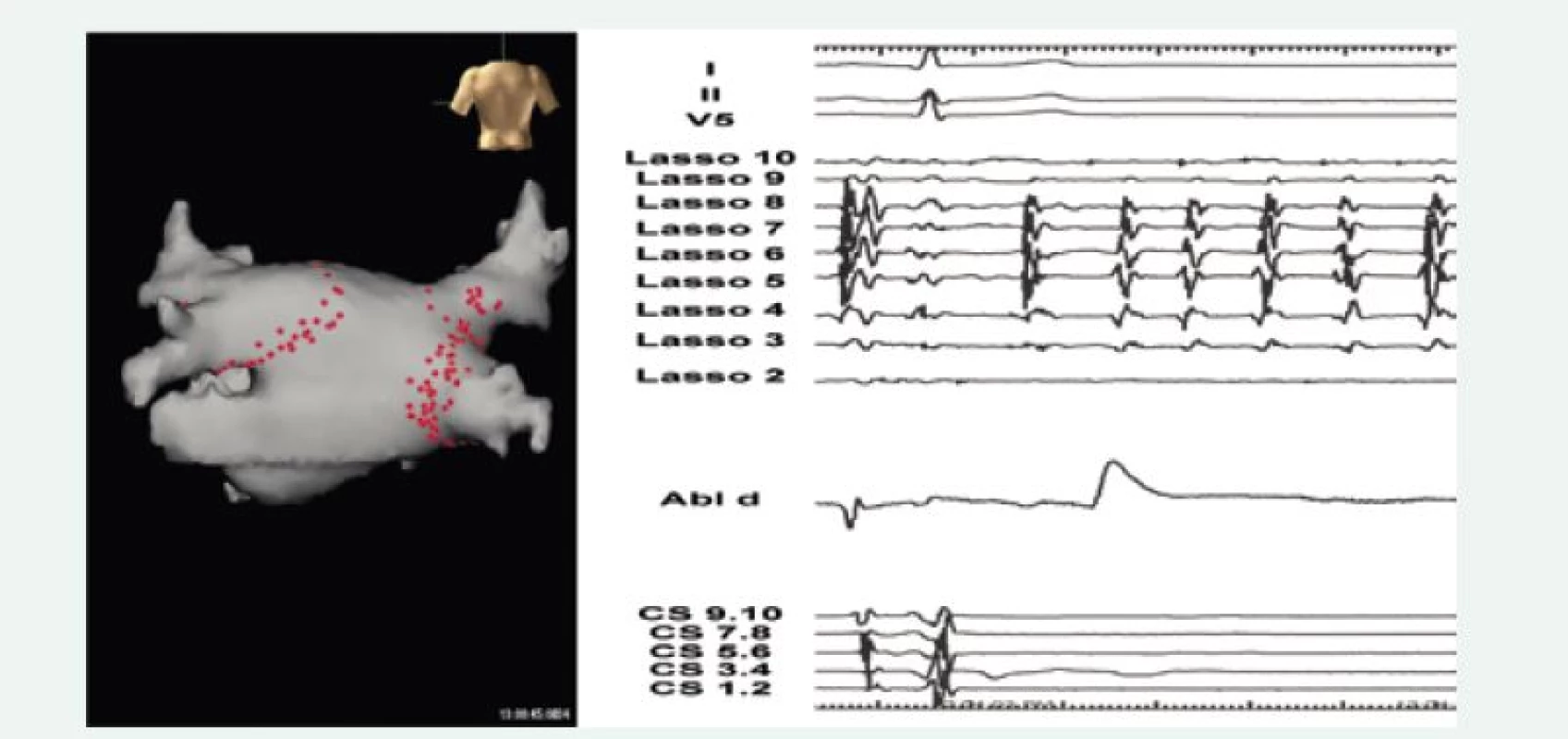
Pravý panel přibližuje záznam EKG a intrakardiálních elektrogramů v okamžiku elektrické izolace plicních žil. Elektrogramy označené Lasso 2–10 ukazují přetrvávající fibrilaci síní ve společném kmeni levých plicních žil (viz CT angiogram na levém panelu), zatímco zbytek srdce je aktivován sinusovým rytmem (CS 1.2–9.10 – záznam z koronárního sinu). Tato ukázka dokumentuje klíčovou úlohu plicních žil ve spouštění fibrilace síní v mnoha případech. Závěr
Výše uvedený přehled dokumentuje, že FS je zřejmě nebezpečnější arytmií, než se dosud zdálo. Tato skutečnost poskytuje nový pohled na indikace k intervenční léčbě této arytmie. Obhajuje totiž snahy o udržení sinusového rytmu i za cenu opakované intervence a určitého procedurálního rizika.
Podpořeno z grantových prostředků Ministerstva zdravotnictví České republiky – institucionální záměr výzkumných organizací – Institut klinické a experimentální medicíny – IKEM – IN 00023001.
prof. MUDr. Josef Kautzner, CSc.
josef.kautzner@ikem.cz
Klinika kardiologie IKEM, Praha
www.ikem.cz
Doručeno do redakce 1. 3. 2015
Přijato po recenzi 8. 4. 2015
Sources
1. Heeringa J, van der Kuip DA, Hofman A et al. Prevalence, incidence and lifetime risk of atrial fibrillation: the Rotterdam study. Eur Heart J 2006; 27(8): 949–953.
2. Caldeira D, David C, Sampaio C. Rate versus rhythm control in atrial fibrillation and clinical outcomes: Updated systematic review and meta-analysis of randomized controlled trials. Arch Cardiovasc Dis 2012; 105(4): 226–238.
3. Van Gelder IC, Wyse DG, Chandler ML et al. Does intensity of rate-control influence outcome in atrial fibrillation? An analysis of pooled data from the RACE and AFFIRM studies. Europace 2006; 8(11): 935–942.
4. Marshall DA, Levy AR, Vidaillet H et al. Cost-effectiveness of rhythm versus rate control in atrial fibrillation. Ann Intern Med 2004; 141(9): 653–661.
5. Mason PK, Wood MA, Lake D et al. Influence of the randomized trials, AFFIRM and RACE, on the management of atrial fibrillation in two University Medical Centers. Am J Cardiol 2005; 95(10): 1248–1250.
6. Corley SD, Epstein AE, DiMarco JP et al. Relationships between sinus rhythm, treatment, and survival in the Atrial Fibrillation Follow-Up Investigation of Rhythm Management (AFFIRM) Study. Circulation 2004; 109(12): 1509–1513.
7. Guglin M, Chen R, Curtis AB. Sinus rhythm is associated with fewer heart failure symptoms: insights from the AFFIRM trial. Heart Rhythm 2010; 7(5): 596–601.
8. Vidaillet H, Granada JF, Chyou PH et al. A population-based study of mortality among patients with atrial fibrillation or flutter. Am J Med 2002; 113(5): 365–370.
9. Dulli DA, Stanko H, Levine RL. Atrial fibrillation is associated with severe acute ischemic stroke. Neuroepidemiology 2003; 22(2): 118–123.
10. Waldo AL. Anticoagulation: stroke prevention in patients with atrial fibrillation. Med Clin North Am 2008; 92(1): 143–159.
11. Verma A, Debruyne P, Nardi S et al. ERACE Investigators. Evaluation and reduction of asymptomatic cerebral embolism in ablation of atrial fibrillation, but high prevalence of chronic silent infarction: results of the evaluation of reduction of asymptomatic cerebral embolism trial. Circ Arrhythm Electrophysiol 2013; 6(5): 835–842.
12. Sramko M, Peichl P, Wichterle D et al. A novel biomarker-based approach for the detection of asymptomatic brain injury during catheter ablation of atrial fibrillation. J Cardiovasc Electrophysiol 2014; 25(4): 349–354.
13. Santangeli P, Di Biase L, Bai R et al. Atrial fibrillation and the risk of incident dementia: a meta-analysis. Heart Rhythm 2012; 9(11): 1761–1768.
14. Stefansdottir H, Arnar DO, Aspelund T et al. Atrial fibrillation is associated with reduced brain volume and cognitive function independent of cerebral infarcts. Stroke 2013; 44(4): 1020–1025.
15. Efimova I, Efimova N, Chernov V et al. Ablation and pacing: improving brain perfusion and cognitive function in patients with atrial fibrillation and uncontrolled ventricular rates. Pacing Clin Electrophysiol 2012; 35(3): 320–326.
16. de la Torre JC. Cardiovascular risk factors promote brain hypoperfusion leading to cognitive decline and dementia. Cardiovasc Psychiatry Neurol 2012; 2012 : 367516. Dostupné z DOI: <http://dx.doi.org/10.1155/2012/367516>.
17. Lishmanov A, Chockalingam P, Senthilkumar A et al. Tachycardia-induced cardiomyopathy: evaluation and therapeutic options. Congest Heart Fail 2010; 16(3): 122–126.
18. Gupta S, Figueredo VM. Tachycardia mediated cardiomyopathy: pathophysiology, mechanisms, clinical features and management. Int J Cardiol 2014; 172(1): 40–46.
19. Maisel WH, Stevenson LW. Atrial fibrillation in heart failure: epidemiology, pathophysiology, and rationale for therapy. Am J Cardiol 2003; 91(6A): 2D-8D.
20. Bardai A, Blom MT, van Hoeijen DA et al. Atrial fibrillation is an independent risk factor for ventricular fibrillation: a large-scale population-based case-control study. Circ Arrhythm Electrophysiol 2014; 7(6): 1033–1039.
21. Reinier K, Marijon E, Uy-Evanado A et al. The association between atrial fibrillation and sudden cardiac death: the relevance of heart failure. JACC Heart Fail 2014; 2(3): 221–227.
22. Calkins H, Reynolds MR, Spector P et al. Treatment of atrial fibrillation with antiarrhythmic drugs or radiofrequency ablation: two systematic literature reviews and meta-analyses. Circ Arrhythm Electrophysiol 2009; 2(4): 349–361.
23. Camm AJ, Lip GY, De Caterina R et al. 2012 focused update of the ESC Guidelines for the management of atrial fibrillation: an update of the 2010 ESC Guidelines for the management of atrial fibrillation. Developed with the special contribution of the European Heart Rhythm Association. Eur Heart J 2012; 33(21): 2719–2747.
24. Calkins H, Kuck KH, Cappato R et al. 2012 HRS/EHRA/ECAS Expert Consensus Statement on Catheter and Surgical Ablation of Atrial Fibrillation: recommendations for patient selection, procedural techniques, patient management and follow-up, definitions, endpoints, and research trial design. Europace 2012; 14(10): 528–606.
25. Sramko M, Peichl P, Wichterle D et al. Clinical value of assessment of left atrial late gadolinium enhancement in patients undergoing ablation of atrial fibrillation. Int J Cardiol 2015; 179 : 351–357.
26. Hussein AA, Saliba WI, Martin DO et al. Natural history and long-term outcomes of ablated atrial fibrillation. Circ Arrhythm Electrophysiol 2011; 4(3): 271–278.
27. Deshmukh A, Patel NJ, Pant S et al. In-hospital complications associated with catheter ablation of atrial fibrillation in the United States between 2000 and 2010: analysis of 93 801 procedures. Circulation 2013; 128(19): 2104–2112.
28. Aldhoon B, Wichterle D, Peichl P et al. Complications of catheter ablation for atrial fibrillation in a high-volume centre with the use of intracardiac echocardiography. Europace 2013; 15(1): 24–32.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2015 Issue 5-
All articles in this issue
- Vliv spironolaktonu u pacientů se srdečním selháním a zachovalou funkcí levé komory – studie TOPCAT
- Nová verze klasifikace plicní hypertenze
- Hypertenze u žen
- Vplyv pridania fytosterolu ku hypolipidemickej liečbe statínom na veľkosť lipoproteínových partikúl u pacientov s veľmi vysokým kardiovaskulárnym rizikom
- Hypertenze bílého pláště a maskovaná hypertenze
- Personalizovaná farmakoterapie digoxinem
- Kontroverze kolem betablokátorů
- Je potřeba léčit agresivně fibrilaci síní?
- Význam kyseliny močové a terapie alopurinolem v ovlivnění kardiovaskulárních onemocnění
- Ambulantní léčba žilní plicní embolie
- Současný stav a budoucnost péče o nemocné s vrozeným srdečními vadami
- Inhibice systému renin-angiotenzin-aldosteron u srdečního selhání aneb od obecného souhlasu (CONSENSUS) po vzorec myšlení (PARADIGM-HF)
- Hemokoagulace – nové pohledy na starou kaskádu
- Primární hyperaldosteronizmus: problémy diagnostických přístupů
- Neurokardiologie nebo kardioneurologie – nová specializace budoucnosti?
- Feochromocytom – proč je jeho časná diagnóza pro pacienta důležitá?
- Nakolik jsme schopni dosáhnout současně platných cílových hodnot LDL-cholesterolu v sekundární prevenci ischemické choroby srdeční
- Čo môže zapríčiniť diabetes
- Hyperosmolární hyperglykemický stav
- Kombinační léčba hypertenze 2015
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Hyperosmolární hyperglykemický stav
- Hemokoagulace – nové pohledy na starou kaskádu
- Význam kyseliny močové a terapie alopurinolem v ovlivnění kardiovaskulárních onemocnění
- Hypertenze u žen
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

