-
Medical journals
- Career
Dispenzarizace nemocných po léčbě karcinomu prsu, kolorekta a prostaty
: Tomáš Büchler
: Onkologická klinika 1. LF UK a Thomayerovy nemocnice, Praha
: Vnitř Lék 2014; 60(Suppl 2): 15-20
: 70th Birthday - prof. MUDr. Jiří Vorlíček, CSc.
Prevalence zhoubných nádorů v České republice překračuje 350 000 osob (bez pacientů s nemelanomovým kožním nádorem). Podstatná část z nich jsou pacienti, u nichž se podařilo dosáhnout dlouhodobé kompletní remise po protinádorové léčbě. Tito pacienti jsou ohroženi jednak recidivou malignity, jednak dlouhodobými komplikace souvisejícími s onkologickou léčbou. Cílem tohoto článku je poskytnout přehled problematicky se specifickým zaměřením na pacienty s anamnézou tři prevalenčně nejvýznamnějších typů solidních nádorů: karcinomu prsu, karcinomu kolorekta a karcinomu prostaty.
Klíčová slova:
dispenzarizace – karcinom prostaty – karcinom prsu – kolorektální karcinom – prevalenceÚvod
Prevalence maligních chorob v posledních desetiletích výrazně narůstá. Na tomto trendu se podílí jednak rostoucí incidence většiny solidních nádorů, jednak zlepšování léčebných možností. Nemocní s vyléčeným nádorem (tj. v dlouhodobé kompletní remisi) mají často za sebou náročnou multimodální léčbu a mají specifické zdravotní problémy. Cílem onkologické dispenzarizace je včasná diagnóza nádorových recidiv a také detekce a řešení dlouhodobých komplikací nádorové choroby nebo její léčby.
Organizaci dispenzární péče o onkologické pacienty u nás definuje Vyhláška Ministerstva zdravotnictví ČR č. 39/2012 Sb. Dispenzární prohlídky se podle ní mají uskutečňovat minimálně 1krát ročně. Nemocní mají po ukončení léčby onkologických onemocnění nárok na dispenzární péči u „poskytovatelů, kteří poskytují zdravotní služby v příslušném oboru“, čili zjednodušeně u lékaře, který může poskytovat onkologickou léčbu. V praxi bývá obvykle dispenzarizujícím lékařem klinický nebo radiační onkolog, pokud byli pacienti léčeni systémovou onkologickou léčbou nebo radioterapii, v opačném případě pak odborník chirurgického oboru. U některých typů nádorů pak dispenzarizuje pacienta hematolog, dermatolog nebo jiný specialista. Velká část zdravotní péče o pacienty, kteří přežili nádorové onemocnění, však leží na bedrech praktických lékařů. Dlouhodobé komplikace nádorů a jejich léčby si pak u části nemocných vyžadují další specializovanou léčbu.
Následující část článku poskytuje přehled doporučení pro sledování solidních nádorů s nejvyšší prevalencí podle doporučení Evropské společností pro klinickou onkologii (European Society for Medical Oncology – ESMO) a Americké společnosti pro klinickou onkologii (American Society of Clinical Oncology – ASCO) a Americké onkologické společnosti (American Cancer Society – ACS) a americké Národní sítě komplexních onkologických center (National Comprehensive Cancer Network – NCCN). Na tato doporučení je nutno hledět jako na „nepodkročitelné“ minimum. V individuálních případech lze zdůvodnit i intenzivnější sledování.
V tomto přehledu budu pro větší srozumitelnost dále používat jednodušší termín „vyléčený pacient“ místo správnějšího (a skeptičtějšího) výrazu „pacient v dlouhodobé kompletní remisi po úspěšné onkologické léčbě“. V článku používám výraz „recidiva“ ve smyslu návratu nádorového onemocnění považovaného za vyléčené. Zdrojem pro údaje o prevalenci jednotlivých typů nádorů je publikace Novotvary 2010 vydaná Ústavem zdravotnických informací a statistiky [1].
Doporučení zde uvedená se vesměs týkají jen pacientů se standardním rizikem. Pro dispenzarizaci pacientů s geneticky podmíněnými nádory nebo genetickými stavy se zvýšeným rizikem nádorů platí jiné zásady – viz např. přehledný článek Foretové z roku 2010 [2] a publikaci Dispenzarizace dědičných nádorových syndromů [3].
Karcinom prsu
Karcinom prsu je nejčastějším nádorem žen v České republice. Prevalence karcinomu prsu v České republice činí 66 945 žen.
Podle doporučení ESMO a ASCO je hlavním cílem sledování odhalit časnou lokální recidivu nebo kontralaterální karcinom prsu, u nichž včasná a správná léčba může vést k úplnému vyléčení. Mezi další cíle dlouhodobé dispenzarizace patří záchyt a léčba poléčebných komplikací, jako je osteoporóza a druhé primární nádory [4,5].
Nejvyšší riziko recidivy onemocnění je ve 2. roce po stanovení diagnózy. Riziko recidivy přetrvává na úrovni 2–5 % mezi 5.–20. rokem od stanovení diagnózy. Výjimečně se mohou recidivy objevit i po delší době.
Podle doporučení ESMO se v prvních 2 letech od diagnózy doporučuje kontrola každé 3–4 měsíce, v 3.–5. roce každých 6 měsíců a poté 1krát ročně. Obsahem kontroly by měla být cílená anamnéza se zaměřením na možné příznaky recidivy (bolesti kostí, bolesti v oblasti hrudníku, bolesti hlavy, dušnost, abdominální diskomfort) a fyzikální vyšetření. Doporučení ASCO navíc doporučují samovyšetřování prsů v jednoměsíčních intervalech. Gynekologické kontroly se mají provádět 1krát ročně s náplní odpovídající běžnému preventivnímu gynekologickému vyšetření. Ženy, u nichž je podezření na geneticky zvýšené riziko karcinomu prsu (tab. 1), mají být odeslány ke genetickému vyšetření [5].
1. Indikace ke genetickému vyšetření u pacientky s karcinomem prsu podle ASCO 
Mamografie se má provádět 1krát za rok. První poléčebná mamografie pak ne dříve než 6 měsíců po ukončení adjuvantní radioterapie. U pacientek s genetickou predispozicí nebo hustou prsní tkání se doporučuje vyšetření zobrazením magnetickou rezonancí (magnetic resonance imaging – MRI) prsů. V doporučeních ESMO ani ASCO se neobjevuje, že by MRI mohla být nahrazena ultrasonografickým sledováním, pokud je mamografie nevýtěžná.
Obě zmíněná doporučení zdůrazňují, že nikdy nebylo prokázáno zlepšení přežití při intenzivním sledování asymptomatických pacientek pomocí vyšetření krevního obrazu, rutinního biochemického vyšetření, RTG hrudníku, scintigrafie skeletu, ultrasonografického vyšetření jater, vyšetření CT a PET/CT nebo měření nádorových markerů jako CA15–3, CEA a jiné. U symptomatických pacientek nebo při abnormalitách zjištěných během fyzikálního vyšetření je samozřejmě indikováno neprodlené provedení potřebných odběrů, zobrazovacích a dalších vyšetření.
U pacientek s anamnézou karcinomu prsu je kontraindikovaná postmenopauzální hormonální substituce, která zvyšuje riziko recidiv a druhých primárních nádorů (prsu, endometria, ovaria).
U pacientek užívajících tamoxifen je nutné věnovat pozornost zvýšenému riziku endometriální hyperplazie, endometriálního karcinomu a žilní trombózy (např. po operacích nesouvisejících se základním onemocněním). Pacientky léčené inhibitory aromatázy by se měly pravidelně podrobovat denzitometrickému vyšetření.
Rehabilitace a fyzioterapie by měla být zaměřena na prevenci a léčbu lymfedému, pohyblivost horní končetiny na operované straně a řešení posturální problémů po jednostranné mastektomii. V případě, že součástí léčby byla exenterace axily, nedoporučuje se obvykle kanylace žil a měření tlaku na ipsilaterální horní končetině, i když toto opatření není podpořeno důkazy. Naopak existuje jednoznačná indikace včasné systémové antibiotické terapie při infikované ráně na ipsilaterální horní končetině.
Mezinárodní doporučení pro sledování pacientek vycházejí z faktu, že karcinom prsu se vzdálenými metastázami je vždy nevyléčitelným onemocněním. Na rozdíl od kolorektálního karcinomu a některých dalších solidních malignit (karcinom ledviny, karcinom plic) není v případě karcinomu prsu radikální odstranění metastáz při oligometastatickém onemocnění potenciálně kurativním postupem. Naproti tomu léčba lokoregionální recidivy nebo metachronního kontralaterálního karcinomu prsu potenciálně kurativním postupem jistě je.
V ČR je na řadě pracovišť zvykem provádět daleko intenzivnější sledování pacientek s karcinomem prsu, než uvádí doporučení ESMO a ASCO. Jako zdůvodnění pro toto intenzivní sledování se často uvádí, že záchyt generalizovaného karcinomu prsu v asymptomatické fázi může déle zachovat kvalitu života a oddálit orgánové komplikace. Důkazy pro toto tvrzení ve smyslu evidence based medicine ovšem neexistují.
Kolorektální karcinom
Kolorektální karcinom (colorectal carcinoma – CRC) nejčastějším nádorem české populace. Prevalence CRC v České republice je 28 716 osob (ÚZIS udává souhrn pro diagnózy C18–21, tj. nádory kolon, sigmoidea, rekta a anu).
Asi k 80 % recidiv dochází během prvních 3 let od operace [6,7]. Riziko recidivy po optimální léčbě nemetastatického onemocnění je přibližně 30–50%. Včasná detekce recidiv je hlavním cílem sledování po primární léčbě, pokud je pacient potenciálně schopen další intenzivní terapie. Sledování CRC je proto v prvních letech po úspěšné léčbě zaměřeno na včasnou detekci lokoregionální recidivy a oligometastatického onemocnění pomocí kolonoskopie, CT a nádorových markerů. Poměrně intenzivní sledování je odůvodněno tím, že léčba jak lokoregionální recidivy, tak solitárního či oligometastatického postižení jater nebo plic (což jsou nejčastější orgánové metastatické lokalizace) může vést k úplnému vyléčení pacienta.
Na rozdíl od karcinomu prsu u CRC existují studie, které prokazují lepší přežití pacientů podstupujících intenzivní sledování [8]. Za příčinu tohoto zlepšení přežití se považuje dřívější detekce izolovaných lokoregionálních recidiv a vzdálených metastáz řešitelných radikálním chirurgickým zákrokem (plicní nebo jaterní metastazektomie). Absolutní snížení úmrtnosti ve studiích s intenzivním sledováním pacientů bylo 9–13 %, což přibližně odpovídá benefitu adjuvantní chemoterapie [7].
Doporučuje se následující schéma sledování po primární léčbě [6,7]:
- anamnéza, fyzikální vyšetření a stanovení CEA 1krát za 3–6 měsíců po dobu 3 let a každých 6–12 měsíců ve 4. a 5. roce po operaci
- kolonoskopie během 1. roku po operaci a poté každých 3–5 let, u pacientů s opakovaným nálezem adenomů 1krát ročně
- CT hrudníku a břicha každých 12 měsíců v prvních 3 letech, u pacientů, kteří mají vyšší riziko recidivy, je toto vyšetření doporučeno 1krát za 6 měsíců během prvních 3 let. Běžná ultrasonografie břicha má nižší senzitivitu než CT. Ultrasonografické vyšetření s kontrastem (CEUS contrast-enhanced ultrasound) má senzitivitu podobnou jako CT, není však v ČR široce dostupné. Pravidelné RTG vyšetřování hrudníku pravděpodobně není prospěšné. Rutinní vyšetřování pomocí PET se rovněž nedoporučuje.
- u pacientů s karcinomem rekta je doporučováno CT vyšetření pánve 1krát ročně po dobu 3 let od stanovení diagnózy. U pacientů, kteří z nějakého důvodu nepodstoupili radioterapii na oblast pánve, a pacientů s vysokým rizikem recidivy (T4 nebo N2) i po radioterapii se doporučuje rektosigmoideoskopie každých 6 měsíců prvních 2–5 let od stanovení diagnózy.
CEA jako každý onkomarker není zcela spolehlivý (falešná pozitiva 7–16 %, falešná negativita 40 %), ale je důležitou částí dispenzarizace, protože někdy dokáže odhalit recidivu dříve než zobrazovací vyšetření.
Zdá se, že riziko vzniku dalších kolorektálních polypů a kolorektálního karcinomu by mohlo snížit pravidelné užívání kyseliny acetylsalicylové, i když na druhé straně je tato medikace spojena s vyšším rizikem krvácení [9,10].
Někteří pacienti po léčbě CRC mohou dlouhodobě trpět střevní dysfunkcí (průjem, zácpa, opakované střevní obstrukce, bolesti). Je důležité poskytovat dietní poradenství a vhodnou léčbu střevních potíží (dietní změny, změkčovadla stolice). Asi 50 % pacientů, kteří byli léčení oxaliplatinou, trpí trvalou periferní neuropatii, z toho u 10–20 % se jedná o těžké postižení [11].
Karcinom prostaty
Karcinom prostaty je nejčastějším nádorem vyskytujícím se u českých mužů. Jeho prevalence dosáhla v roce 2010 počtu 36 071 mužů a předpokládá se její další strmý vzestup. Většina pacientů s karcinomem prostaty je diagnostikovaná v asymptomatickém stadiu na základě elevace PSA a 90 % mužů již má době stanovení diagnózy lokalizovaný karcinom. Pro tuto skupinu pacientů se 5leté relativní přežití blíží 100 %. Jen asi 2–14 % pacientů diagnostikovaných v nepokročilých stadiích na tuto chorobu zemře, hlavní příčinou mortality jsou kardiovaskulární nemoci [12]. Samozřejmě, vyskytují se i agresivní formy karcinomu prostaty s rychlou progresí a špatnou odezvou na systémovou léčbu.
Lokalizovaný karcinom prostaty lze vyléčit radikální prostatektomií nebo radikální radioterapií, ale velká část pacientů dlouhodobě přežívá i bez aktivní léčby, a tudíž nežádoucích účinků s léčbou spojených. Postupy jako aktivní sledování (active surveillance – pravidelné sledování PSA v intervalech 3–6 měsíců a rebiopsie 1krát ročně) a méně intenzivní sledování (watchful waiting – jen odběry pro stanovení PSA v delších intervalech) jsou však v ČR příliš málo užívány. U diseminovaného karcinomu prostaty dosáhneme obvykle dlouhodobé kontroly nemoci hormonální terapii, která bývá relativně dobře snášená.
Cílem sledování pacientů s karcinomem prostaty je detekce recidiv nebo progrese a sledování dlouhodobých následků léčby. V případě recidivy je možná buď radikální záchranná terapie (radioterapie po prostatektomii, radioterapie nebo prostatektomie po sledování, hormonoterapie po všech léčebných alternativách).
Doporučení pro sledování pacientů po radikální léčbě karcinomu prostaty jsou jednoduchá:
- hladina PSA v séru každých 6–12 měsíců prvních 5 let a poté 1krát ročně
- palpační vyšetření prostaty per rektum 1krát ročně
Jiná vyšetření neprokázala efektivitu pro zjištění recidivy a nemají prokázaný dopad na další vývoj onemocnění a prognózu.
Nežádoucí účinky radikální léčby často výrazně omezují kvalitu života pacientů postižených karcinomem prostaty (tab. 2).
2. Dlouhodobé/trvalé nežádoucí účinky terapie karcinomu prostaty 
Doporučení pro dispenzarizaci se proto týkají také poléčebných komplikací. U pacientů s androgenní deprivací (po bilaterální orchiektomii nebo podstupujících léčbu agonisty LHRH) se specificky doporučuje kontrola krevního obrazu 1krát ročně (kvůli riziku anémie) a sledování zaměřené na kardiovaskulární riziko – monitorování krevního tlaku, lipidového profilu a glykemie podle platných doporučení jednotlivých kardiologických společností [13], dále sledování denzitometrie skeletu kvůli vysokému riziku osteoporózy a přidružených komplikací. Časté jsou i vazomotorické příznaky následkem androgenní deprivace, jako návaly horka a zvýšené pocení. Dosud pro ně neexistuje optimální léčba, doporučují se inhibitory zpětného vychytávání serotoninu nebo gabapentin.
Všichni pacienti postižení karcinomem prostaty bez ohledu na typ léčby by měli být sledováni urologem pro vysoké riziko komplikací souvisejících s močením (časté močení, slabší močový proud, bolesti při močení, močová inkontinence). Nejvyšší riziko tohoto typu dlouhodobých komplikací je po radikální prostatektomii.
Pacienti po radikální prostatektomii a v menší míře pacienti po radioterapii často trpí erektilními poruchami, které jsou v některých případech léčitelné moderní farmakoterapii nebo různými pomůckami.
Zejména u pacientů po radikální radioterapii je nutné dbát na dodržování screeningu pro kolorektální karcinom a doporučuje se cílená anamnéza na poruchy defekačního stereotypu a krvácení z konečníku.
U pacientů s vysokým rizikem recidiv a také u nemocných podstupujících aktivní sledování nebo watchful waiting je častá anxieta a deprese. ACS doporučuje cílené vyšetření na přítomnost těchto poruch dotazníkem 1krát ročně [12].
Obecná doporučení pro dispenzarizaci onkologických pacientů
U všech pacientů po úspěšné onkologické léčbě lze doporučit některá obecná opatření bez ohledu na primární lokalizaci nádoru. Patří mezi ně zejména podpora zdravé životosprávy, psychologická podpora a rehabilitace směřující k návratu pacienta do normálního sociálního a pracovního života (tab. 3) [14,15].
3. Obecná doporučení pro péči o pacienty dispenzarizované po úspěšné onkologické léčbě 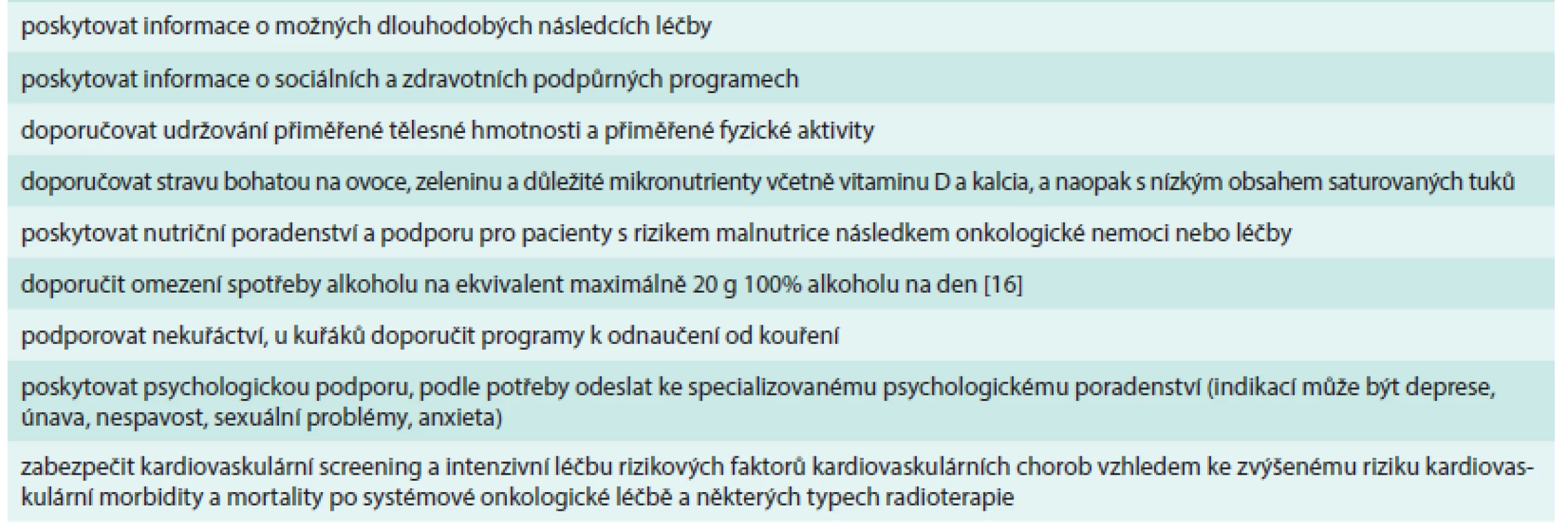
Jedním z deklarovaných cílů onkologické dispenzarizace je včasná detekce druhých primárních nádorů. Široce zaměřené programy na detekci sekundárních malignit však zatím nejsou úspěšné a nelze je považovat za efektivně využitý čas a prostředky [17,18]. Pacienti by ale měli podstupovat vyšetření v rámci platných screeningových programů [19] a cílená vyšetření pro odhalení stejného typu nádoru, pro nějž již byli léčeni (např. nádor kontralaterálního prsu, metachronní kolorektální nebo plicní karcinom a podobně).
Důležitou součástí dispenzárních programů je edukace. Pacienti často nevědí, že poléčebné komplikace mohou kromě recidiv původní malignity zahrnovat i jiné, často závažné nemoci související s prodělanou léčbou. Pacienti i mnoho lékařů má také tendenci přeceňovat význam intenzivního sledování zejména pomocí nádorových markerů a zobrazovacích metod pro včasnou detekci recidiv a druhých malignit a naopak podceňovat význam screeningu zaměřeného na jiné komorbidity (hlavně kardiovaskulární onemocnění, diabetes mellitus a psychické poruchy). Navíc intenzivní sledování s použitím ionizujícího záření může riziko druhých malignit dále zvýšit [20]. Pomohla by nějaká validovaná metoda pro stratifikaci rizika poléčebných komplikací, žádná však zatím není k dispozici [21]. Důležitým dovětkem všech doporučení pro dispenzarizaci je, že intenzivní vyšetřování má smysl jen u těch pacientů, jejichž zdravotní stav umožňuje další léčbu.
Prevence ztráty výdělečné schopnosti u onkologických pacientů
Navzdory tomu, že nádory vzniklé z různých buněk se budou významně lišit z hlediska terapie a prognózy, z hlediska funkčního postižení pacienta na konkrétním tkáňovém původu nádoru záleží jen málo. V onkologii se na funkčním postižení podílí jak nádorová nemoc, tak onkologická terapie. V případě časných stadií nádorů může být podíl terapie jako příčiny na funkčního postižení převažující [22].
Pacienti s onkologickými nemocemi tvoří významnou část osob s přiznaným invalidním důchodem (ID). V roce 2012 byl ID I. stupně (plná invalidita) přiznán 674 pacientům s nádory z celkem 14 095 důchodů (4,8 %), ID I. a II stupně (částečná invalidita) 3 798 pacientům s nádory z celkem 14 520 důchodů (26 %). Počet i podíl pacientů s nádory s přiznaným plným ID klesají. Pro srovnání uvádím údaje za rok 2006: plný ID 4 841 pacientů s nádory z 24 207 důchodů (20 %), částečný ID 1 842 pacientů s nádory z 24 718 důchodů (7,5 %) [23]. Terciární onkologická prevence zahrnuje časnou detekci funkčního postižení a rehabilitaci zaměřenou na zamezení snížení funkčních schopností a jejich obnovu. Obecně je cílem rehabilitace u nádorových nemocí psychosociální podpora, zlepšení tělesných funkcí, pracovní poradenství a pomoc při sociálním začlenění jedince [22,24,25].
Metody prevence invalidity a rehabilitace u onkologických pacientů
Mezi metody rehabilitace u pacientů s novotvary patří zejména:
- aktivity zaměřené na sport a tělesnou zdatnost
- relaxační cvičení
- edukace pacientů ohledem jejich diagnózy nebo funkčního postižení
- poradenství pro pacienty a jejich blízké o vyrovnávání se s nádorovou nemocí, zvládání krizí a strachu
- sociální a kulturní terapie zaměřená na stanovení nových životních cílů
- dietní poradenství
Z hlediska prevence invalidity a opětovného začleňování do pracovního provozu je nutné se zaměřit zejména na reverzibilní nebo léčbou kontrolovatelné problémy:
- psychologické poruchy, z kterých jsou časté zejména deprese, postresová porucha, úzkostní poruchy, chronický únavový syndrom
- chronická bolest
- funkční svalová slabost
- lymfedém
- poruchy kontinence moče nebo stolice.
Úloha praktického lékaře
Jak již bylo uvedeno výše, dispenzarizaci pacientů s vyléčeným nádorem by měl zajišťovat specialista příslušného oboru poskytujícího léčbu. Vzhledem ke zvyšujícímu se počtu pacientů s vyléčenými nádory a širokému spektru potenciálních dlouhodobých komplikací by však bylo žádoucí roli praktických lékařů v onkologické dispenzarizaci posílit. K lepší edukaci pacientů a poradenství ohledně životosprávy by mohlo v budoucnu přispět vyškolení specializovaných onkologických sester, jejichž úloha by byla analogická např. stomickým sestrám radícím nemocným se stomiemi [26]. Samozřejmě možnost pravidelné dispenzarizace specialistou by měla být zachována a je i v souladu s přáním většiny pacientů [27].
Některá světová onkologická centra se širokou geografickou působností předávají pacienty do další péče praktickému lékaři nebo lokálnímu onkologickému týmu s vypracovaným tzv. survivorship plans, tedy plány péče pro vyléčené pacienty. Jejich cílem je maximální návaznost poskytované péče [28]. Survivorship plan by měl kromě diagnostického souhrnu a souhrnu absolvované léčby obsahovat potenciální pozdní účinky onkologické léčby, jejich příznaky a možnou prevenci/léčbu, doporučení pro další prevenci a screening nádorů, popis případných psychosociálních a finančních problémů, doporučení pro zdravý životní styl, doporučení nebo výsledky genetického poradenství, doporučení pro následnou péči a případné použití podpůrných prostředků [29]. Jedná se tedy o mnohem rozsáhlejší materiál, než obvykle bývá praktickým lékařům poskytován onkology a dalšími specialisty v současné době.
Závěr
Hlavním prvky péče o pacienty s vyléčenými nádory jsou prevence nebo včasná detekce recidivy a druhých nádorů, rehabilitace následků nádorového onemocnění a onkologické léčby (zdravotních a psychických) a obecná podpora zdraví (prevence komorbidit, podpora zdravé životosprávy). Vzhledem k vzrůstajícímu počtu osob po onkologické léčbě a vysoké incidenci preventabilních a léčitelných dlouhodobých komplikací v této populaci bude nutné rozšíření a současně racionalizace dispenzární péče.
doc. MUDr. Tomáš Büchler, Ph.D.
tomas.buchler@ftn.cz
Onkologická klinika 1. LF UK a Thomayerovy nemocnice, Praha
www.ftn.cz
Doručeno do redakce 21. 7. 2014
Přijato po recenzi 5. 9. 2014
Sources
1. Ústav zdravotnických informací a statistiky. Dostupné z WWW: <http://www.uzis.cz/category/tematicke-rady/zdravotnicka-statistika/novotvary>.
2. Foretová L. Jak sledovat pacienty s výskytem nádoru v rodině? Interní Med 2010; 12(10): 510–515.
3. Dispenzarizace dědičných nádorových syndromů. Česká lékařská společnost. Dostupné z WWW: <http://www.cls.cz/dokumenty/dispenzarizace_dedicnych_nador_syndromu.pdf>.
4. Senkus E, Kyriakides S, Penault-Llorca F et al. Primary breast cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2013; 24(Suppl 6): vi7-vi23. Dostupné z DOI: <http://doi: 10.1093/annonc/mdt284>.
5. Khatcheressian JL, Hurley P, Bantug E et al. Breast cancer follow-up and management after primary treatment: American Society of Clinical Oncology clinical practice guideline update. J Clin Oncol 2013; 31879 : 961–965.
6. Meyerhardt JA, Mangu PB, Flynn PJ et al. Follow-up care, surveillance protocol, and secondary prevention measures for survivors of colorectal cancer: American Society of Clinical Oncology clinical practice guideline endorsement. J Clin Oncol 2013; 31(35): 4465–4470.
7. Labianca R, Nordlinger B, Beretta GD et al. Early colon cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2013; 24(Suppl 6): vi64-vi72. Dostupné z DOI: <http://doi: 10.1093/annonc/mdt354>.
8. Jeffery GM, Hickey BE, Hider P. Follow-up strategies for patients treated for non-metastatic colorectal cancer. Cochrane Database Syst Rev 2002; (1): CD002200.
9. Sandler RS, Halabi S, Baron JA et al. A randomized trial of aspirin to prevent colorectal adenomas in patients with previous colorectal cancer. N Engl J Med 2003; 348(10): 883–890.
10. Thun MJ, Jacobs EJ, Patrono C. The role of aspirin in cancer prevention. Nat Rev Clin Oncol 2012; 9(5): 259–267.
11. Park SB, Goldstein D, Krishnan AV et al. Chemotherapy-induced peripheral neurotoxicity: a critical analysis. CA Cancer J Clin 2013; 63(6): 419–437.
12. Skolarus TA, Wolf AM, Erb NL et al. American Cancer Society prostate cancer survivorship care guidelines. CA Cancer J Clin 2014; 64(4): 225–249.
13. Perk J, De Backer G, Gohlke H et al. European Guidelines on cardiovascular disease prevention in clinical practice (version 2012): The Fifth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of nine societies and by invited experts). Atherosclerosis 2012; 223(1): 1–68.
14. Kushi LH, Doyle C, McCullough M et al. American Cancer Society Guidelines on nutrition and physical activity for cancer prevention: reducing the risk of cancer with healthy food choices and physical activity. CA Cancer J Clin 2012; 62(1): 30–67.
15. NCCN Clinical Practice Guidelines in Oncology. Survivorship V1.2014.Dostupné z WWW: <http://www.nccn.org/professionals/physician_gls/pdf/survivorship.pdf>.
16. Nešpor K. Jaké je „zdravé“ množství alkoholu? Interní Med 2008; 10(4): 200.
17. Buchler T, Kubankova P, Boublikova L et al. Detection of second malignancies during long-term follow-up of testicular cancer survivors. Cancer 2011; 117(18): 4212–4218.
18. VanderWalde AM, Hurria A. Second malignancies among elderly survivors of cancer. Oncologist 2011; 16(11): 1572–1581.
19. Vyhláška Ministerstva zdravotnictví ČR ze dne 17. prosince 2009 o stanovení obsahu a časového rozmezí preventivních prohlídek. Sbírka zákonů č 3/2010. Dostupné na www: <http://www.sagit.cz/pages/sbirkatxt.asp?zdroj=sb10003&cd=76&typ=r>.
20. Calandrino R, Ardu V, Corletto D et al. Evaluation of second cancer induction risk by CT follow-up in oncological long-surviving patients. Health Phys 2013; 104(1): 1–8.
21. Watson EK, Rose PW, Neal RD et al. Personalised cancer follow-up: risk stratification, needs assessment or both? Br J Cancer 2012; 106(1): 1–5.
22. Vorlíček J, Abrahámová J, Büchler T. Kapitola II: Novotvary. Promítnutí pokroků lékařské vědy do funkčního hodnocení zdravotního stavu a pracovní schopnosti ve vztahu k zdravotním postižením podle Mezinárodní klasifikace nemocí a s přihlédnutím k Mezinárodní klasifikaci funkčních schopností. Závěrečná zpráva projektu výzkumu MPSV ČR HR 163/07. MP SV ČR, Praha 2008. Dostupné z WWW: <http://www.mpsv.cz/files/clanky/6131/MPSV_A3.pdf>.
23. Česká správa sociálního zabezpečení. Statistické ročenky. Dostupné z WWW: <http://www.cssz.cz/cz/o-cssz/informace/informacni-materialy/statisticke-rocenky.htm>.
24. van Harten WH, van Noort O, Warmerdam R et al. Assessment of rehabilitation needs in cancer patients. Int J Rehabil Res 1998; 21(3): 247–257.
25. Black JF, Kishner S, Yadav RR et al. Cancer and rehabilitation, 2013. Dostupné z WWW: <http://emedicine.medscape.com/article/320261-overview>.
26. Grant M, Economou D, Ferrell BR. Oncology nurse participation in survivorship care. Clin J Oncol Nurs 2010; 14(6): 709–715.
27. Hudson SV, Miller SM, Hemler J et al. Adult cancer survivors discuss follow-up in primary care: 'not what i want, but maybe what i need'. Ann Fam Med 2012; 10(5): 418–427.
28. From Cancer Patient to Cancer Survivor: Lost in Transition. Institue of Medicine of the National Academies (IOM). Dostupné z WWW: <http://www.iom.edu/Reports/2005/From-Cancer-Patient-to-Cancer-Survivor-Lost-in-Transition.aspx>.
29. Salz T, Oeffinger KC, McCabe MS et al. Survivorship care plans in research and practice. CA Cancer J Clin 2012; 62(2): 101–117. Dostupné z DOI: <http://onlinelibrary.wiley.com/doi/10.3322/caac.20142/pdf>.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2014 Issue Suppl 2-
All articles in this issue
- Testicular malignit tumors – are we in the end of the road?
- Patient follow-up after treatment of breast, colorectal and prostate cancer
- Differential diagnostics of hypereosinophilia
- Clinical evaluation of new drugs against orphan diseases in oncology – the current situation in Europe and in our country
- Palliative care and chronic heart failure
- Development and current utility of infobases in Czech cancer care
- About pain – otherwise
- New antibiotics: do we need new molecules or new strategies?
- Geriatric patient in oncology
- New aspects of impact of papillomavirus status in the therapy of head/neck cancer
- Ph-negative myeloproliferative diseases with thrombocythemia in the context of Thromboreductin® treatment, data from registry 2013
- Diabetes mellitus and malignancies
- Palliative medicine and the „good death“
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Differential diagnostics of hypereosinophilia
- Palliative medicine and the „good death“
- Patient follow-up after treatment of breast, colorectal and prostate cancer
- Ph-negative myeloproliferative diseases with thrombocythemia in the context of Thromboreductin® treatment, data from registry 2013
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

