-
Medical journals
- Career
Terapie inzulinem glargin v režimu bazál/bolus v klinické praxi: observační neintervenční multicentrický projekt LINDA (Lantus in daily practice – safety and efficacy in basal bolus regimen)
Authors: Denisa Janíčková Žďárská 1; Jan Brož 1; Bohumila Křivská 2; Zdeněk Rušavý 3; Milan Kvapil 1
Authors‘ workplace: Interní klinika 2. LF UK a FN Motol Praha, přednosta prof. MUDr. Milan Kvapil, CSc., MBA 1; Sanofi-Aventis, s. r. o., Praha 2; I. interní klinika LF UK a FN Plzeň, přednosta prof. MUDr. Martin Matějovič, Ph. D. 3
Published in: Vnitř Lék 2014; 60(9): 712-719
Category:
Overview
Cíl práce:
Zhodnotit bezpečnost a účinnost léčby bazálním inzulinem glargin v režimu bazál/bolus v podmínkách běžné klinické praxe v České republice.Soubor a metodika:
Projekt LINDA byl neintervenční, multicentrický (n = 255), národní observační projekt, který probíhal v podmínkách běžné klinické praxe. Do sledování bylo zařazeno celkem 4 998 pacientů s diabetes mellitus 1. a 2. typu (DM1T, DM2T) s převážně inzulinovou terapií (99,7 %), po následném zahájení léčby inzulinem glargin v režimu bazál/bolus. Pacienti byli sledováni po dobu 6 měsíců od zahájení této terapie. Primárním cílem projektu bylo sledování četnosti výskytu závažných hypoglykemických příhod při léčbě bazálním inzulinovým analogem glargin (Lantus®) v podmínkách běžné klinické praxe. Sekundárními sledovanými parametry byla změna glykovaného hemoglobinu (HbA1c), glykemie nalačno (FPG), změna tělesné hmotnosti, změna dávek inzulinu, změna počtu hypoglykemických příhod ve srovnání s předchozí léčbou a sledování četnosti nežádoucích účinků.Výsledky:
Závažné hypoglykemie byly pozorovány během léčby inzulinem glargin u 0,8 % pacientů. Při srovnání výskytu hypoglykemií s předchozí terapií bylo prokázáno klinicky a statisticky významné snížení jejich četnosti. Procento pacientů s hypoglykemickou příhodou (17,6 %), závažnou (0,8 %) a závažnou noční hypoglykemií (0,3 %) bylo za poslední měsíc léčby s inzulinem glargin v režimu bazál/bolus konzistentně menší ve srovnání s posledním měsícem léčby před zahájením této terapie (42,5 %; 17,6 %; 13,8 % pacientů). U pacientů s DM1T došlo k poklesu všech hypoglykemií z hodnoty 37,80 ± 15,95 příhod/pacient/rok na 8,76 ± 4,38 příhod/pacient/rok (p < 0,001), závažných hypoglykemií z hodnoty 5,64 ± 3,27 příhod/pacient/rok na 0,0396 ± 0,012 příhod/pacient/rok (p < 0,001) a závažných nočních hypoglykemií z hodnoty 3,84 ± 2,04 příhod/pacient/rok na 0,0096 ± 0,003 příhod/pacient/rok (p < 0,001). U pacientů s DM2T poklesla četnost všech hypoglykemií z hodnoty 12,48 ± 7,57 příhod/pacient/rok na 1,68 ± 0,78 příhod/pacient/rok (p < 0,001), závažných hypoglykemií z hodnoty 2,04 ± 0,94 příhod/pacient/rok na 0,0132 ± 0,005 příhod/pacient/rok (p < 0,001) a závažných nočních hypoglykemií z hodnoty 1,32 ± 0,77 příhod/pacient/rok na 0,0048 ± 0,0008 příhod/pacient/rok (p < 0,001). Bylo prokázáno statisticky významné zlepšení metabolické kompenzace při užití inzulinu glargin. U DM1T došlo ke snížení hladiny glykovaného hemoglobinu (HbA1c) z hodnoty 7,74 ± 1,71 % na 6,43 ± 1,39 % (∆ -1,31 ± 0,32 %; p < 0,001) a u DM2T z hodnoty 8,13 ± 1,56 % na 6,72 ± 1,40 % (∆ -1,41 ± 0,28 %; p < 0,001). Statisticky významně (p < 0,001) se zvýšil počet pacientů s hodnotami HbA1c < 5,4 %. Statisticky významný byl také pokles glykemie nalačno (FBG) a hodnot 6bodového glykemického profilu, a to u obou typů diabetu (p < 0,001). Změna terapie a následná léčba inzulinem glargin byla lékaři a pacienty vnímána pozitivně.Závěr:
Za podmínek běžné klinické praxe zahájení léčby inzulinem glargin v režimu bazál/bolus u pacientů s předchozí inzulinovou terapií vedlo ke snížení četnosti výskytu hypoglykemických příhod včetně závažných a závažných nočních hypoglykemií a ke zlepšení metabolické kompenzace pacientů s diabetem (snížení glykovaného hemoglobinu, glykemie nalačno a hodnot 6bodového glykemického profilu). Byla zaznamenána větší spokojenost se stávající léčbou ze strany pacientů a lékařů.Klíčová slova:
diabetes mellitus – inzulin glargin - observační projekt – režim bazál/bolusÚvod
Inzulin glargin je dlouhodobě účinkující analog inzulinu s bezvrcholovým průběhem efektu a nízkou intraindividuální variabilitou. Podle metaanalýz je u pacientů s diabetes mellitus 1. typu (DM1T) převod z NPH inzulinu (neutral protamine Hagedorn insuline) na dlouhodobě účinkující analoga následován mírným zlepšením kompenzace a snížením rizika hypoglykemie [1,2]. Obdobné výsledky přinášejí studie realizované u pacientů s diabetes mellitus 2. typu (DM2T) [1–7].
Výhody inzulinu glargin vyniknou v kombinacích s krátkodobě účinnými analogy, v nichž vzájemná kombinace umožní přiblížit se principům fyziologické inzulinové produkce. Plného využití pak lze dosáhnout za podmínek titrace obou inzulinů. Studie AT.LANTUS přinesla důkaz o významu aktivní spolupráce pacienta s DM2T při léčbě inzulinem [8]. Prokázala, že pokud je pacient podrobně edukován a je-li mu dána možnost upravovat si dávku bazálního inzulinu (inzulin glargin) podle aktuální glykemie nalačno, může dosáhnout i lepší kompenzace diabetu bez zvýšení rizika závažných hypoglykemií než při úpravě dávky vedené lékařem.
Studie ORIGIN stanovila dlouhodobý kardiovaskulární bezpečnostní profil inzulinu glargin [9,10]. Léčba inzulinem glargin vedená k cílové glykemii nalačno v časných stadiích diabetu nevedla k navýšení makroangiopatických komplikací či případů rakoviny, a to vše s minimálním nárůstem hmotnosti. Další analýzy studie ORIGIN prokázaly benefit z časné inzulinové léčby u nemocných s HbA1c ≥ 6,4 % (46,4 mmol/mol) ve smyslu snížení rizika mikrovaskulárních komplikací [11]. Zda časná inzulinoterapie povede ke snížení kardiovaskulárního rizika, musíme vyčkat výsledků follow-up studie ORIGIN (ORIGINALE).
Ze všech výše uvedených důvodů se jeví inzulin glargin jako vhodný inzulin pro většinu pacientů s DM1 a DM2T.
Soubor a metody
Projekt LINDA byl neintervenční, multicentrický, národní observační projekt, na kterém spolupracovalo 255 diabetologů z celého území České republiky.
Hlavním cílem práce bylo sledování četnosti výskytu závažných hypoglykemických příhod při léčbě bazálním inzulinovým analogem glargin (Lantus®) v podmínkách běžné klinické praxe v České republice u pacientů s DM1T a DM2T léčených v režimu bazál/bolus. Hlavní sekundární cíle zahrnovaly srovnání výskytu hypoglykemických příhod za období 4 týdnů před zahájením léčby inzulinem glargin s obdobím 4 týdnů před kontrolou při léčbě inzulinem glargin, sledování změn parametrů kompenzace diabetu (HbA1c, glykemie nalačno, glykemický profil, hmotnost, dávky inzulinů) a sledování nežádoucích účinků během léčby.
Délka sledování byla stanovena na 6 měsíců od zahájení terapie inzulinem glargin. Lékaři zaznamenávali údaje při zařazení pacientů do projektu a dále v nejbližším termínu po 6 měsících od zahájení léčby inzulinem glargin. Údaje byly získány retrospektivně výpisem dat ze zdravotní dokumentace pacienta a následujícím prospektivním sledováním. Hodnocení spokojenosti s léčbou inzulinem glargin lékařem bylo hodnoceno pomocí 6stupňové škály jako „mnohem lepší, lepší, stejné, horší, mnohem horší a nelze hodnotit“ z hlediska bezpečnosti a účinnosti na konci sledování. Spokojenost pacientů s léčbou byla zaznamenána lékařem na základě rozhovoru s pacientem a k jejímu hodnocení byla použita stejná 6stupňová škála. Shromažďovány byly pouze výsledky vyšetření prováděných v rámci standardních terapeutických postupů. Každý pacient před zahájením sběru dat podepsal informovaný souhlas.
Hypoglykemická příhoda byla definována jako událost s charakteristickými příznaky hypoglykemie, které ustoupily po jídle nebo po perorálním podání cukru, a byla potvrzena měřením glykemie < 3 mmol/l, nebo jako asymptomatická hypoglykemie potvrzená měřením glykemie < 3 mmol/l. Jako závažná hypoglykemická příhoda byla definována událost s charakteristickými příznaky hypoglykemie, jejíž zvládnutí vyžadovalo asistenci jiné osoby, a byla spojena s hladinou glykemie < 3 mmol/l nebo s ústupem příznaků po perorálním příjmu jídla nebo nitrožilní aplikaci glukózy nebo po aplikaci glukagonu. Jako noční závažná hypoglykemie byla definována závažná hypoglykemická událost, která se vyskytla v čase spánku pacienta od večerního ulehnutí k rannímu vstávání a splňovala kritéria závažné hypoglykemické příhody.
Ke statistickému vyhodnocení byl použit program NCSS 2004. Výsledky jsou prezentovány jako průměrné hodnoty ± směrodatná odchylka.
Projekt byl v souladu s Českou legislativou ohlášen před svým zahájením Státnímu ústavu pro kontrolu léčiv (SÚKL).
Výsledky
Do projektu bylo zařazeno celkem 4 998 pacientů s diabetem, u kterých byla zahájena léčba inzulinem glargin v režimu bazál/bolus. Ve 40,3 % se jednalo o pacienty s DM1T a v 59,7 % o pacienty s DM2T.
Výskyt hypoglykemických příhod a účinnost byly hodnoceny u skupiny 4 819 pacientů, kteří splnili kritéria pro zařazení do projektu a kteří byli sledováni po dobu 6 měsíců. Výskyt nežádoucích účinků byl hodnocen u všech pacientů zařazených do projektu.
Základní údaje o hodnoceném souboru shrnuje tab. 1. Průměrná doba trvání diabetu byla při zahájení léčby inzulinem glargin u pacientů s DM1T 14,72 ± 10,90 roku a u pacientů s DM2T 12,57 ± 6,64 roku (p < 0,001). Při vstupu do projektu byly u pacientů s DM1T zaznamenány nižší průměrné hodnoty HbA1c a glykemie nalačno než u pacientů s DM2T (p < 0,001). Mikrovaskulární komplikace udávalo 54,08 % pacientů s DM1T a 66,63 % pacientů s DM2T, makrovaskulární komplikace pak 14,06 % pacientů s DM1T a 37,7 % pacientů s DM2T. V obou případech byl rozdíl ve výskytu komplikací diabetu statisticky významný (p < 0,001).
Table 1. Základní charakteristiky hodnocených pacientů před zahájením aplikace inzulinu glargin 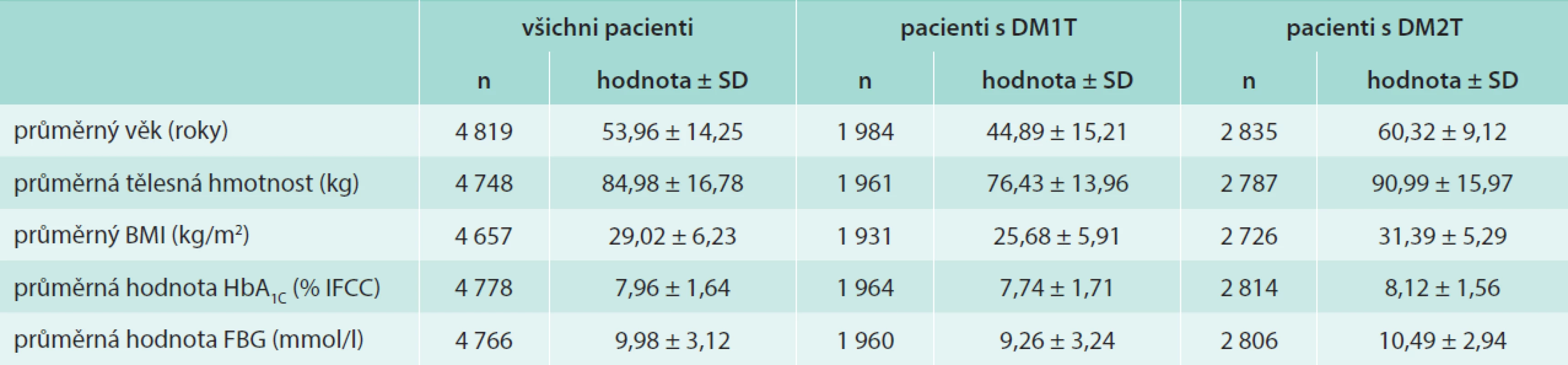
Před zahájením léčby inzulinem glargin bylo již 99,65 % pacientů léčeno inzulinem (n = 4 802), a to obvykle v intenzifikovaném inzulinovém režimu (n = 4 395, tj. 91,2 %). Bazální inzulin byl v 60,9 % pacientům aplikován 1krát denně a ve 36 % aplikován 2krát denně. V 87,23 % byl pacientům aplikován střednědobě působící inzulin typu NPH a ve 4,81 % inzulinový analog detemir. Jako prandiální inzulin byl aplikován 3 143 pacientům (tj. 65,22 %) humánní inzulin (RHI) a 1 525 pacientům (tj. 31,65 %) krátkodobě působící inzulinová analoga. Premixovaným inzulinem bylo léčeno 5,62 % pacientů.
Průměrná dávka inzulinu glargin byla při zahájení terapie u pacientů s DM1T 19,24 ± 7,84 U a u pacientů s DM2T 23,37 ± 9,58 U. Rozdíl průměrných dávek mezi jednotlivými typy diabetu byl statisticky významný (p < 0,001).
U 97,82 % pacientů (n = 4 714) byla zahájena aplikace inzulinu glargin 1krát denně, u 2,18 % pacientů 2krát denně.
Hypoglykemie
Během 6měsíčního sledování při terapii inzulinem glargin v režimu bazál/bolus se závažné hypoglykemie vyskytly celkem u 0,81 % pacientů (1,31 % pacientů s DM1T a 0,46 % pacientů s DM2T).
Při porovnání s jejich výskytem při předchozí terapii a při léčbě s inzulinem glargin došlo ke klinicky i statisticky významnému snížení jejich četnosti, a to jak při vyjádření v počtu příhod na pacienta a rok léčby, tak i při vyjádření v počtu osob (%) se zaznamenanou hypoglykemickou příhodou.
Při předchozí léčbě zaznamenalo v posledních 4 týdnech terapie hypoglykemickou příhodu 42,5 % pacientů; závažnou hypoglykemii 17,4 % pacientů a závažnou noční hypoglykemii 13,8 % pacientů. V posledních 4 týdnech terapie inzulinem glargin zaznamenalo hypoglykemii 17,6 % pacientů; závažnou hypoglykemii 0,8 % pacientů a závažnou noční hypoglykemii jen 0,3 % pacientů.
Během léčby došlo k výraznému snížení četnosti všech hypoglykemických příhod, a to o 79,77 %. Výskyt všech hypoglykemií v přepočtu na pacienta/rok se snížil u pacientů s DM1T z 37,80 ± 15,95 příhody/pacient/rok na 8,76 ± 4,38 příhody/pacient/rok (p < 0,001) a u pacientů s DM2T z 12,48 ± 7,57 příhody/pacient/rok na 1,68 ± 0,78 příhody/pacient/rok (p < 0,001).
U pacientů s DM1T došlo ke snížení závažných hypoglykemií z 5,64 ± 3,27 příhody/pacient/rok na 0,0396 ± 0,012 příhody/pacient/rok (p < 0,001) a u pacientů s DM2T z 2,04 ± 0,94 příhody/pacient/rok na 0,0132 ± 0,005 příhody/pacient/rok (p < 0,001). U závažných nočních hypoglykemií došlo ke snížení jejich výskytu u pacientů s DM1T z 3,84 ± 2,04 příhody/pacient/rok na 0,0096 ± 0,003 příhody/pacient/rok (p < 0,001) a u pacientů s DM2T z 1,32 ± 0,77 příhody/pacient/rok na 0,0048 ± 0,0008 příhody/pacient/rok (p < 0,001). Výskyt hypoglykemií v přepočtu na pacienta/rok je uveden v tab. 2.
Table 2. Incidence závažných hypoglykemií celkem a závažných nočních hypoglykemií před a po zahájení terapie inzulenem glargin vyjádřená na pacienta/rok 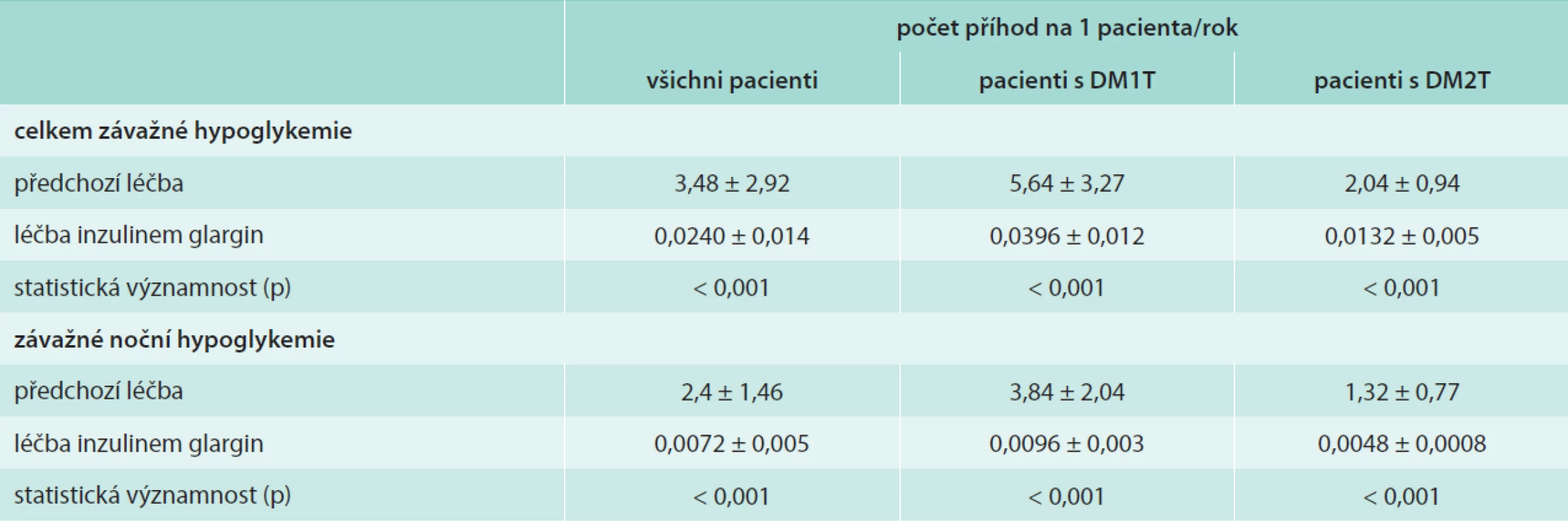
Metabolická kompenzace
Po 6měsíční terapii inzulinem glargin v režimu bazál/bolus došlo k výraznému poklesu HbA1c. U DM1T se snížil HbA1c z 7,74 ± 1,71 % na 6,43 ± 1,39 % (∆ -1,31 ± 0,32 %; p < 0,001) a u pacientů s DM2T poklesl HbA1c z 8,13 ± 1,56 % na 6,72 ± 1,40 (∆ -1,41 ± 0,28 %; p < 0,001). Změny HbA1c znázorňuje graf 1.
Graph 1. Změny průměrných hodnot HbA<sub>1c</sub> před zahájením a po 6 měsících aplikace inzulinu glargin 
Statisticky významně (p < 0,001) se zvýšil na konci sledování počet pacientů, kteří dosáhli doporučených cílových hodnot HbA1c pro kompenzaci diabetu dle ADA/EASD, tzn. HbA1c < 5,4 %. Hodnoty HbA1c < 5,4 % dosahovalo při zařazení do projektu pouze 6,73 % pacientů s DM1T a 2,13 % pacientů s DM2T. Po změně terapie cílové hodnoty HbA1c < 5,4 % dosáhlo 25,67 % pacientů s DM1T a 17,31 % pacientů s DM2T.
Statisticky významný byl i pokles glykemie nalačno (FBG – fasting blood glucose). U pacientů s DM1T došlo k poklesu FBG o 2,34 ± 2,51 mmol/l na hodnotu 6,83 ± 2,11 mmol/l (p < 0,001) a u pacientů s DM2T o 2,81 ± 3,12 mmol/l na hodnotu 7,68 ± 2,14 mmol/l (p < 0,001). Změny FPG jsou uvedeny v tab. 3.
Table 3. Průměrné hodnoty glykemie nalačno před zahájením aplikace inzulinu glargin a po 6 měsících jeho aplikace v mol/l 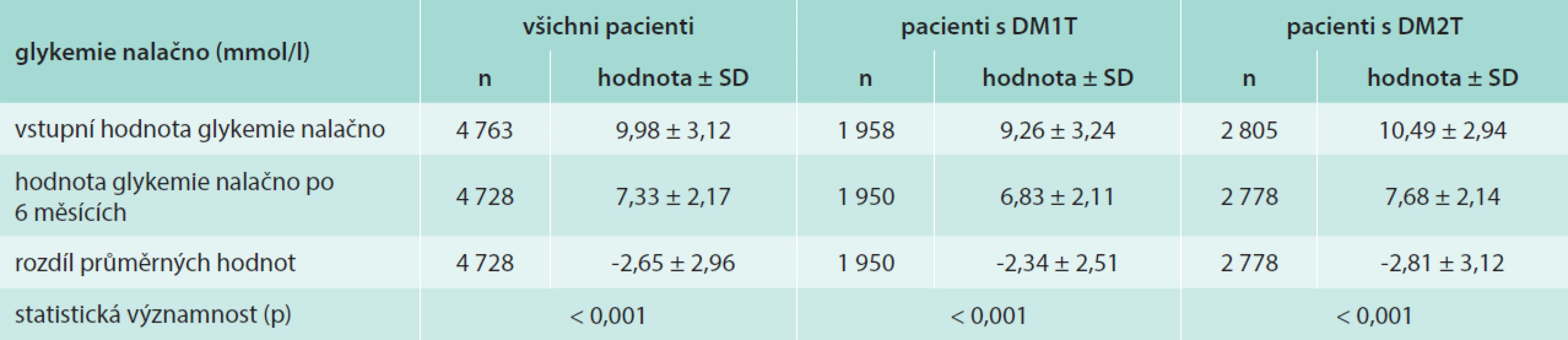
K výraznému poklesu došlo nejen u glykemie nalačno (p < 0,001), ale i u všech hodnot 6bodového glykemického profilu (graf 2 a 3). Tyto poklesy byly statisticky významné u obou typů diabetu (p < 0,001).
Graph 2. Průměrné hodnoty glykemie před a po jídle během dne před zahájením aplikace inzulinu glargin a po 6 měsících jeho aplikace v mmol/l - 6bodový glykemický profil pacientů s DM1T 
Graph 3. Průměrné hodnoty glykemie před a po jídle během dne před zahájením aplikace inzulinu glargin a po 6 měsících jeho aplikace v mmol/l – 6bodový glykemický profil pacientů s DM2T 
Tělesná hmotnost a BMI
Údaje o tělesné hmotnosti pacientů před zahájením aplikace inzulinu glargin byly dostupné pro 98,5 % hodnocených pacientů. U pacientů s DM1T došlo během 6 měsíců k mírnému zvýšení průměrné hmotnosti o 0,12 kg a u pacientů s DM2T byl zaznamenán průměrný pokles hmotnosti o 0,41 kg. Uvedené změny byly statisticky významné (p < 0,001) jak u pacientů s DM1T, tak u pacientů s DM2T.
Změny hmotnosti nevedly ke statisticky významné změně BMI během sledování.
Dávka inzulinu
Celková denní dávka inzulinu se během 6měsíčního sledování u pacientů s DM1T zvýšila ze 49,96 ± 17,21 IU na 52,06 ± 14,91 IU (p < 0,001). U pacientů s DM2T se celková denní dávka inzulinu naopak snížila z 62,36 ± 23,32 IU na 61,52 ± 18,01 IU (p < 0,001). Během sledování se mírně zvýšil podíl bazálního inzulinu v celkové denní dávce inzulinu ze 40,5 % na 42,0 %. Zároveň se zvýšil počet pacientů, kterým byl na konci sledování aplikován prandiální inzulinový analog (59,4 %) a poklesl počet pacientů s humánním prandiálním inzulinem (40,6 %).
Průměrná dávka bazálního analoga glargin byla na konci sledování u pacientů s DM1T 21,01 ± 8,41 U (zvýšení průměrné dávky inzulinu glargin během sledování o 1,77 U) a u pacientů s DM2T 26,45 ± 10,37 U (zvýšení průměrné dávky inzulinu glargin během sledování o 3,08 U). Vývoj dávek aplikovaných inzulinů během sledování je uvádí graf 4.
Graph 4. Změna dávek inzulinu během sledování u DM1T a DM2T 
Nežádoucí účinky
Během 6měsíčního sledování byly u pacientů zaznamenány 3 nežádoucí účinky. Jeden účinek byl hodnocen jako závažný. Jednalo se o závažnou hypoglykemickou příhodu u pacienta s DM1T, která vznikla pravděpodobně v důsledku porušení dietních návyků. Zbylé 2 účinky byly hodnoceny jako nezávažné a očekávané (mírná alergická reakce a váhový přírůstek).
Hodnocení léčby
Změna terapie a následná léčba inzulinem glargin byla lékaři a pacienty vnímána pozitivně. Lékaři označili léčbu inzulinu glargin z hlediska bezpečnosti jako mnohem lepší a lepší u 92,93 % pacientů a z hlediska účinnosti pak jako mnohem lepší a lepší u 94,94 % pacientů ve srovnání s předchozí léčbou. 96,05 % pacientů označilo svoji spokojenost s léčbou inzulinem glargin jako mnohem lepší a lepší.
Diskuse
Neintervenční observační projekt LINDA přináší výsledky, které dokumentují účinnost a bezpečnostní profil inzulinu glargin. Data byla získána sledováním téměř 5 000 nemocných za podmínek běžné klinické praxe, což činí projekt dosud nejrozsáhlejším svého druhu.
U pacientů s předchozí inzulinovou terapií převážně inzulinem NPH v režimu bazál/bolus (91,2 %) po změně bazálního inzulinu na bazální analog glargin došlo k významnému zlepšení metabolické kompenzace současně s významným snížením výskytu hypoglykemických příhod oproti předchozímu období, a to u obou typů diabetu. K výraznému snížení výskytu došlo jak u všech hypoglykemií (o 77 %), tak i u závažných a závažných nočních hypoglykemií. Hypoglykemie jistě představují největší překážku k dosažení uspokojivé metabolické kompenzace diabetu. Výsledky našeho sledování jsou v souladu s výsledky klinických studií, které prokazují snížení rizika hypoglykemických příhod s inzulinem glargin při srovnání s NPH inzulinem, a to především v nočních hodinách [1–4], i s výsledky observačních projektů realizovaných s inzulinem glargin [12,13]. Výše uvedené potvrzuje výhody bezvrcholového působení inzulinu glargin, protože u tohoto inzulinu můžeme titrovat dávku. Během léčby inzulinem glargin došlo k poklesu FBG a současně celého 6bodového glykemického profilu pacientů. Toto pozorování dokumentuje princip teorie tzv. fix fasting first/treat to target, podle něhož klesají vyšší hodnoty glykemií během dne, neboť jsou jen relativním navýšením v důsledku ranní hyperglykemie [14]. Statisticky významný pokles hodnot HbA1c u DM1T (-1,31%) i u DM2T (-1,41%) je v souladu s řadou publikovaných klinických studií, v nichž byl inzulin glargin srovnáván s NPH inzulinem [12,15–20]. Procento nemocných, kteří dosáhli cílového HbA1c < 5,4 % – DM1T (25,67 %) a DM2T (17,31 %) – je v porovnání s ostatními studiemi spíše nižší [20], což může být důsledkem nízkých konečných dávek inzulinu. U DM1T došlo k navýšení glarginu pouze o 1,77 U, u DM2T o 3,08 U, přičemž celková denní dávka u DM1T mírně stoupla (současně také více nemocných s HbA1c < 5,4 % než u DM2T), u DM2T celková denní dávka inzulinu dokonce klesla. Pro porovnání uveďme průměrné dávky inzulinu glargin v klinických studiích: DM2T 41–68 U [14,21–23], DM1T 29,6 u ve studii ATLANTUS [24].
Plného využití potenciálu dlouhodobě účinných analog, a to zejména v terapii DM1T, lze dosáhnout v kombinaci s analogy krátkodobě účinnými. U většiny pacientů by měla být celková denní dávka inzulinu rozdělena přibližně v poměru 1 : 1 mezi bolusový a bazální inzulin, což odpovídá fyziologické sekreci inzulinu (50 % bazální sekrece, 50 % sekrece postprandiální). Vysoké dávky prandiálního inzulinu (s cílem snížit preprandiální glykemie) mohou vést k rozkolísanosti a nestabilitě glykemických profilů. Naopak nízké dávky dlouhodobého inzulinového analoga nemohou zajistit dosažení požadovaných glykemií nalačno. V projektu LINDA se podařilo navýšit poměr bazálního inzulinu ze 40,5 % na 42,0 % a také více pacientů bylo na konci sledování léčeno krátkodobými inzulinovými analogy (59,4 % pacientů). Tento vývoj je v souladu s výše uvedenými principy.
Při zlepšení metabolické kompenzace bychom očekávali vzestup tělesné hmotnosti. Během sledování v projektu LINDA došlo k mírnému, nicméně statisticky významnému snížení hmotnosti v celém souboru pacientů (-0,22 kg). Pokles hmotnosti byl nejvíce vyjádřen u pacientů s DM2T (-0,41 kg), u pacientů s DM1T došlo k mírnému nárůstu hmotnosti (+0,12 kg). Změny hmotnosti se v průřezu klinickými studiemi různí: nacházíme výsledky hmotnostně neutrální [20,25], pozitivní [22,23] i negativní [26,27]. Během 6letého sledování ve studii ORIGIN přibrali pacienti v aktivní větvi (terapie inzulinem glargin) 1,6 kg (na rozdíl od standardní větvě, v níž nemocní zredukovali svoji hmotnost 0,5 kg) [28]. Léčba inzulinem glargin byla pozitivně vnímána jak lékaři, tak pacienty. Tento výsledek je v souladu s výsledky klinických studií, v nichž byl inzulin glargin srovnáván s NPH inzulinem [17,29] či s léčbou jinými léčebnými režimy [30]. Tento moment je zásadní pro akceptování terapeutických cílů a léčebných režimů pacientem a zajištění dlouhodobé kompliance pacientů s lékařem. Souhrnně lze léčbu inzulinem glargin v režimu bazál/bolus v tomto projektu hodnotit jako efektivní terapii. Celkově nízký výskyt nežádoucích účinků je v souladu s výsledky z obdobných observačních projektů z klinické praxe [31,32].
Závěr
Minimální výskyt nežádoucích účinků a prokazatelně nižší zatížení nemocných rizikem hypoglykemie při současném zlepšení HbA1c včetně minimálního ovlivnění tělesné hmotnosti, které byly zjištěny v observačním projektu LINDA, potvrzují, že inzulin glargin je v běžné klinické praxi efektivním inzulinem pro náhradu bazální sekrece inzulinu u nemocných s DM1T i DM2T.
Projekt byl sponzorován společností Sanofi-Aventis, s.r.o. Česká republika.
Prohlášení o střetu zájmů
D. Janíčková Žďárská obdržela honorář za přednáškovou činnost od společnosti Sanofi-Aventis, Johnson a Johnson, MSD. J. Brož obdržel honorář za přednáškovou činnost od společnosti Sanofi-Aventis. B. Křivská je zaměstnancem společnosti Sanofi-Aventis. Z. Rušavý obdržel honorář za konzultační a přednáškovou činnost od společností Sanofi-Aventis, Novartis, NovoNordisk, Eli Lilly, Astra Zeneca, Johnson a Johnson, Jansen Cilag, MSD, Merk. M. Kvapil obdržel honorář za konzultační a přednáškovou činnost od společností NovoNordisk, Sanofi-Aventis, Novartis, Eli Lilly, Astra Zeneca, ZAT, Johnson a Johnson, Takeda, Jansen Cilag, MSD, Merck.
MUDr. Denisa Janíčková Žďárská
denisa.janickova.zdarska@email.cz
Interní klinika 2. LF UK a FN Motol, Praha
www.fnmotol.cz
Doručeno do redakce 25. 6. 2014
Přijato po recenzi 17. 7. 2014
Sources
1. Monami M, Marchionni N, Mannucci E. Long-acting insulin analogues vs. NPH human insulin type 1 diabetes. A meta-analysis. Diabetes Obes Metab 2009; 11(4): 372–378.
2. Singh SR, Ahmad F, Lal A et al. Efficacy and safety of insulin analogues for the management of diabetes mellitus: a meta analysis. CMAJ 2009; 180(4): 385–395.
3. Bazzano LA, Lee LJ, Shi L et al. Safety and efficacy of glargine compared with NPH insulin for the treatment of Type 2 diabetes: a meta-analysis of randomized controlled trials. Diabet Med 2008; 25(8): 924–932.
4. Monami M, Marchionni N, Mannucci E. Long-acting insulin analogues versus NPH human insulin in type 2 diabetes: a meta-analysis. Diabetes Res Clin Pract 2008; 81(2): 184–189.
5. Sharplin P, Gordon J, Peters JR et al. Improved glycaemic control by switching from insulin NPH to insulin glargine: a retrospective observational study. Cardiovasc Diabetol 2009; 8 : 3. Dostupné z DOI: <http://doi: 10.1186/1475–2840–8-3>.
6. Yki-Järvinen H, Dressler A, Zieman M Less nocturnal hypoglycemia and better post-dinner glucose control with bedtime insulin glargine compared with bedtime NPH insulin combination therapy in type 2 diabetes. HOE 901/3002 Study Group. Diabetes Care 2000; 23(8): 1130–1136.
7. Zdarska DJ, Kvapil M, Rusavy Z et al. Comparison of glucose variability assessed by a continuous glucose-monitoring system in patients with type 2 diabetes mellitus switched from NPH insulin to insulin glargine: The COBIN2 study. Wien Klin Wochenschr 2014; 126(7–8): 228–237.
8. Davies M, Lavalle-Gonza F, Stormset F et al. Initiation of insulin glargine therapy in type 2 diabetes subjects suboptimally controlled on oral antidiabetic agents: results from the AT.LANTUS trial. Diabetes Obes Metab 2008; 10(5): 387–399.
9. Hanefeld M, Bramlage P. Insulin use early in the course of type 2 diabetes mellitus: the ORIGIN trial. Curr Diab Rep 2013; 13(3): 342–349.
10. Rusavý Z, Lacigová S, Kvapil M. What has the largest study in the history of diabetology brought us? Vnitř Lék 2013; 59(3): 160–164.
11. Gilbert RE, Mann JF, Hanefeld M et al (The ORIGIN trial investigators). Basal insulin glargine and microvascular outcomes in dysglycaemic individuals: results of the Outcome Reduction with an Initial Glargine Intervention (ORIGIN) trial. Diabetologia 2014; 57(7): 1325–1331.
12. Siegmund T, Weber S, Blankenfeld H et al. Comparison of insulin glargine versus NPH insulin in people with Type 2 diabetes mellitus under outpatient-clinic conditions for 18 months using a basal-bolus regimen with a rapid-acting insulin analogue as mealtime insulin. Exp Clin Endocrinol Diabetes 2007; 115(6): 349–353.
13. Maia FF, Melo FJ, Araujo IM et al. Switching of NPH insulin to glargine therapy in a cohort of poorly controlled diabetic patients: observational study. Arq Bras Endocrinol Metab 2007; 51(3): 426–430.
14. Riddle MC, Rosenstock J, Gerich J. The treat-to-target trial: randomized addition of glargine or human NPH insulin to oral therapy of type 2 diabetic patients. Diabetes Care 2003; 26(11): 3080–3086.
15. Porcellati F, Rossetti P, Pampanelli S et al. Better long-term glycemic control with the basal insulin glargine as compared with NPH in patients with type 1 diabetes mellitus given meal-time lispro insulin. Diabet Med 2004; 21 : 1213–1220.
16. Fulcher GR, Gilbert RE, Yue DK. Glargine is superior to neutral protamine Hagedorn for improving glycated haemoglobin and fasting blood glucose levels during intensive insulin therapy. Intern Med J 2005; 35(9): 536–542.
17. Chatterjee S, Jarvis-Kay J, Rengarajan T et al. Glargine versus NPH insulin: efficacy in comparison with insulin aspart in a basal bolus regimen in type 1 diabetes-the glargine and aspart study (GLASS) a randomized cross-over study. Diabetes Res Clin Pract 2007; 77(2): 215–222.
18. Pieber TS, Eugenie-Jolchine I, Derobert E Efficacy and Safety of HOE 901 Versus NPH insulin in Patients With Type1 Diabetes. Diabetes Care 2000; 23(2): 157–162.
19. Rossetti P, Pampanelli S, Fanelli C et al. Intensive replacement of basal insulin in patients with type 1 diabetes given rapid-acting insulin analog at mealtime: a 3-month comparison between administration of NPH insulin four times daily and Glargine insulin at dinner or bedtime. Diabetes Care 2003; 26(5): 1490–1496.
20. Sharplin P, Gordon J, Peters JR et al. Improved glycaemic control by switching from insulin NPH to insulin glargine: a retrospective observational study. Cardiovasc Diabetol 2009; 8 : 3. Dostupné z DOI: <http://doi: 10.1186/1475–2840–8-3>.
21. Yki-Järvinen H, Kauppinen-Makelin R, Tiikkainen M et al. Insulin glargine or NPH combined with metformin in type 2 diabetes: the LANMET study. Diabetologia 2006; 49(3): 442–451.
22. Davies M, Evans R, Storms F et al. Initiation of insulin glargine in suboptimally controlled patients with type 2 diabetes: sub-analysis of the AT.LANTUS trial comparing treatment outcomes in subjects from primary and secondary care in the UK. Diabetes Obes Metab 2007; 9(5): 706–713.
23. Yki-Järvinen H, Juurinen L, Alvarsson M et al. Initiate Insulin by Aggressive Titration and Education (INITIATE): a randomized study to compare initiation of insulin combination therapy in type 2 diabetic patients individually and in groups. Diabetes Care 2007; 30(6): 1364–1369.
24. Gomis R, Storms F, Conget I et al (AT.LANTUS Study Group). Improving metabolic control in sub-optimally controlled subjects with Type 1 diabetes: comparison of two treatment algorithms using insulin glargine. Diabetes Res Clin Pract 2007; 77(1): 84–91.
25. Schreiber S, Landgraf W, Bohler S. Efficacy and tolerability of insulin glargine in ICT. Diabetes, Stoffwechsel und Herz 2009; 18(8): 91–98.
26. Raskin P, Klaff L, Bergenstal R et al. A 16-week comparison of the novel insulin analog insulin glargine (HOE 901) and NPH human insulin used with insulin lispro in patients with type 1 diabetes. Diabetes Care 2000; 23(11): 1666–1671.
27. Rosenstock J, Schwarz SL, Clark JR CH et al. Basal insulin therapy in type 2 diabetes: 28-week comparison of insulin glargine (HOE901) and NPH insulin. Diabetes Care 2001; 24(4): 631–636.
28. 28., Gerstein HC, Bosch J, Dagenais GR et al (ORIGIN Trial Investigators). Basal insulin and cardiovascular and other outcomes in dysglycemia. N Engl J Med 2012; 367(4): 319–328.
29. Witthaus E, Stewart J, Bradley C. Treatment satisfaction and psychological well-being with insulin glargine compared with NPH in patients with type 1 diabetes. Diabet Med 2001; 18(8): 619–625.
30. Bradley C, Gilbride CJB. Improving treatment satisfaction and other patient-reported outcomes in people with type 2 diabetes: the role of once-daily insulin glargine. Diabetes Obes Metab 2008; 10(Suppl 2): 50–65.
31. Schreiber SA, Ferlinz K, Haak T. The Long-Term Efficacy of Insulin Glargine Plus Oral Antidiabetic Agents in a 32-Month Observational Study of Everyday Clinical Practice. Diabetes Technol Ther 2008; 10(2): 121–127.
32. Hammer H, Klinge A. Patients with type 2 diabetes inadequately controlled on premixed insulin: effect of initiating insulin glargine plus oral antidiabetic agents on glycaemic control in daily practice. Int J Clin Pract 2007; 61(12): 2009–2018.
33. SPC inzulin Lantus. Dostupné z WWW: <http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_-_Product_Information/human/000284/WC500036082.pdf>.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2014 Issue 9-
All articles in this issue
- Terapie inzulinem glargin v režimu bazál/bolus v klinické praxi: observační neintervenční multicentrický projekt LINDA (Lantus in daily practice – safety and efficacy in basal bolus regimen)
- AGEs a RAGE – konečné produkty pokročilé glykace a jejich receptor v otázkách a odpovědích
- Játra, ledviny a diabetes: tři tváře deficitu genu HNF1B
- Problematika diferenciálnej diagnostiky paraneoplastickej hypoglykémie
- Hypoglykemie jako limitace léčby diabetes mellitus
- Změny kostního metabolizmu u diabetiků
- Inzulinová rezistence – příčiny a možnosti ovlivnění
- Glykemická variabilita a kontinuální monitorace glykemie
- Životní prognóza osob s diabetem 1. typu dříve a dnes
- Gliptiny: bezpečná a účinná léčba diabetu
- Jak dnes indikujeme perorální antidiabetika (od metforminu ke gliptinům a gliflozinům)
- Receptor pro konečné produkty pokročilé glykace (RAGE) – klíčový hráč diabetické angiopatie?
- Diabetes mellitus a karcinom pankreatu – příčina nebo následek?
- Inkretinová mimetika v léčbě diabetu 2. typu
- Retrospektívy a perspektívy personalizovanej liečby cukrovky
- První fixní trojkombinace perindopril arginin-indapamid-amlodipin: nový přístup v kombinační léčbě hypertenze
- Dlouhodobě působící inzulinová analoga a riziko hypoglykemických příhod
- Faktory vedoucí k poškození a destrukci B-buněk Langerhansových ostrůvků pankreatu
- Kalcium, vitamin D a zdraví
- Studie SOLOSTAR prokázala vysoký stupeň spokojenosti pacientů s používáním inzulinového pera SoloStar® v České republice
- Novinky a perspektivy v léčbě inzulinem
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Životní prognóza osob s diabetem 1. typu dříve a dnes
- Gliptiny: bezpečná a účinná léčba diabetu
- Inzulinová rezistence – příčiny a možnosti ovlivnění
- AGEs a RAGE – konečné produkty pokročilé glykace a jejich receptor v otázkách a odpovědích
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

