-
Medical journals
- Career
Co je nového v srdečním selhání se zachovalou ejekční frakcí levé komory za posledních pět let?
Authors: Zdeňka Gregorová 1,2; Jaroslav Meluzín 1,2; Lenka Špinarová 1,2
Authors‘ workplace: I. interní kardio-angiologická klinika LF MU a FN u sv. Anny Brno, přednostka prof. MUDr. Lenka Špinarová, Ph. D., FESC 1; Mezinárodní centrum klinického výzkumu FN u sv. Anny Brno, ředitel Gorazd B. Stonkin, M. D., MSc., Ph. D. 2
Published in: Vnitř Lék 2014; 60(7-8): 586-594
Category: Reviews
Overview
Srdeční selhání se zachovalou ejekční frakcí levé komory (heart failure with preserved ejection fraction – HFPEF, heart failure with normal ejection fraction – HFNEF) je epidemiologicky závažným onemocněním, jehož výskyt v populaci postupně narůstá. Etiologie jeho vzniku není ještě zcela objasněna. Nově bylo zjištěno, že prozánětlivý stav spojený s řadou komorbidit, jako např. obezita či diabetes, potencuje rozvoj HFPEF. Také sérové koncentrace některých působků, jako např. adiponektin, mají souvislost s tímto onemocněním. Hlavním znakem HFPEF je diastolická dysfunkce, která je ale doprovázena řadou dalších kardiálních i nekardiálních poruch organizmu. Prognóza se i přes dlouhodobě užívané, ale i nově zavedené terapeutické postupy nemění. Zlatým standardem v diagnostice HFPEF zůstává katetrizace srdce. K ozřejmění základní choroby vedoucí k srdečnímu selhání jsou využívána další vyšetření, jako elektrokardiografie (EKG), RTG srdce a plic, laboratorní odběry včetně markerů srdečního selhání a hlavně echokardiografie včetně pulzního dopplerovského měření.
Klíčová slova:
diastolická dysfunkce – levá komora – srdeční selhání – zachovalá ejekční frakce levé komoryÚvod
Srdeční selhání se zachovalou ejekční frakcí levé komory (HFPEF) je častým onemocněním, jehož morbidita i mortalita se výrazněji neliší od srdečního selhání s depresí funkce levé komory (heart failure with reduced ejection fraction – HFREF) [1]. Ještě nedávno se odborná veřejnost domnívala, že hlavním znakem HFPEF je kromě klinických známek srdečního selhání se zachovalou ejekční frakcí levé komory (EF LK) diastolická dysfunkce (DD). Novější studie ale odhalily, že k tomuto typu srdečního selhání přispívají i jiné četné srdeční a nesrdeční abnormity. To způsobilo nové přehodnocení zařazení pacientů k této diagnóze [2,3]. Diastolická dysfunkce levé komory (LK) je častěji spojena s hypertrofickou kardiomyopatií, aortální stenózou a hypertenzní chorobou [4–6]. Srdeční selhání se zachovalou ejekční frakcí levé komory může být také charakterizováno jako spojení DD a vaskulární nepoddajnosti. Dříve se srdeční selhání dělilo na systolické a diastolické. Od termínu diastolické srdeční selhání se upustilo, protože i tito nemocní měli poruchu systolické funkce (především longitudinální funkce) levé komory přes normální EF LK [7].
Prevalence
HFPEF je pozorováno u 30–50 % pacientů se srdečním selháním. Incidence tohoto onemocnění roste každým rokem, v současné době se v evropské populaci pohybuje okolo 1 % ročně [8]. Je to dáno souvislostí výskytu HFPEF s vyšším věkem, proto je nárůst podmíněn i stárnutím populace.
Studie I PREFER [9] se zabývala prevalencí HFPEF v Latinské Americe, na Středním Východě a v regionech severní Afriky. Pacienti byli rozděleni dle EF LK na ty, kteří měli EF LK > 45 %, a tudíž byli klasifikováni jako pacienti se HFPEF, a na ty, kteří měli EF LK < 45 % a spadali do skupiny HFREF. Prevalence pacientů s HFPEF byla celkově 65 %. Populace s HFPEF byla signifikantně starší a zahrnovala více žen, měla signifikantně vyšší systolický i diastolický krevní tlak, byla obéznější a anamnesticky v ní bylo více hypertoniků nebo pacientů s onemocněním chlopní, a také u ní byla častěji přítomna fibrilace síní. Naopak onemocnění koronárních tepen, infarkt myokardu nebo koronární revaskularizace byla běžnější u pacientů s HFREF.
Existují též rasové a etnické rozdíly v diastolické funkci LK. Horší diastolickou funkci mají obecně běloši oproti černochům. Rozdíly jsou pravděpodobně dány odlišnými sociodemografickými poměry a vystavení kardiovaskulárním rizikovým faktorům [10].
Autoři Kelly et al [11] se zabývali prevalencí HFPEF u pacientů poprvé hospitalizovaných s cévní mozkovou příhodou, tranzitorní ischemickou atakou a onemocněním periferních cév. Srdeční selhání se zachovalou ejekční frakcí levé komory bylo přítomno u více než 40 % pacientů, u kterých se za hospitalizace rozvinulo srdeční selhání. Pacienti s periferním vaskulárním onemocněním měli vyšší prevalenci onemocnění než pacienti s cévním onemocněním mozku a zároveň HFPEF bylo až 3krát častější oproti HFREF. Studie PROTEGER [12] se zabývala prevalencí DD LK ve stáří ve srovnání se systolickou dysfunkcí. Ze studie vyplynulo, že těžká DD měla stejnou prevalenci a celkovou i kardiovaskulární mortalitu jako systolická dysfunkce.
Rizikové faktory
Nejvýznamnější rizikové faktory HFPEF jsou vyšší věk, hypertenze, diabetes mellitus, anémie, chronická obstrukční plicní nemoc, obezita a renální insuficience [13,14]. Renální insuficience je často spojena s anémií. Rizikové faktory jako vysoký systolický tlak, tachykardie a těžké renální selhání či dialýza v anamnéze jsou též vysoce prediktivním faktorem smrti u obou pohlaví [15]. Dle studie autorů El Shaer et al [16] se HFPEF častěji vyskytuje u starších žen s esenciální hypertenzí. Jedním z hlavních rizikových faktorů, který je často spojený se HFPEF, je diabetes mellitus. Dle studie autorů Aguilar et al [17] byli diabetici ve srovnání s pacienty s HFPEF bez diabetu mladší, měli vyšší body mass index (BMI), vyšší tepovou frekvenci a vyšší tlak a častěji ischemickou srdeční příhodu. Srdeční selhání se zachovalou ejekční frakcí levé komory mělo horší prognózu u diabetiků než u pacientů, kteří tímto přídatným onemocněním netrpěli. U HFPEF je často zjišťován vyšší systolický krevní tlak, ale normální diastolický krevní tlak [18–20].
Laboratorní parametry mající souvislost s HFPEF
Existuje celá řada laboratorních parametrů, které jsou spojovány s HFPEF. Natriuretické peptidy jsou v souvislosti s HFPEF dobře známy. V posledních letech jsou ale nově zmiňovány trijodtyronin a adiponektin. Souvislost hladiny trijodtyroninu (T3), brain natriuretic peptidu (BNP) a těžké DD LK hledala studie autorů Selvaraj et al [21]. 22 % pacientů s HFPEF mělo sníženou hladinu T3. Pacienti s nižší hladinou T3 byli starší, měli těžší formu srdečního selhání a častěji trpěli diabetem a hyperlipidemií, také měli vyšší hladinu BNP. Dalším laboratorním parametrem souvisejícím s HFPEF je adiponektin. Jedná se o cytokin spojovaný s obezitou a následnými kardiovaskulárními komplikacemi. Vazbou mezi hladinou adiponektinu a časnou diastolickou dysfunkcí se zabývala práce autorů Negi et al [22]. Zjistili, že pacienti s DD měli nižší hladinu adiponektinu. Nižší hladina adiponektinu byla spojena s vyšším BMI.
Patofyziologie
Patofyziologické mechanizmy HFPEF zůstávají i přes veškerý výzkum ještě nedostatečně objasněné na rozdíl od HFREF [13]. Obecně lze říci, že HFPEF a s ním spojené subjektivní i objektivní fyzické omezení není pouze výsledkem jedné komponenty, ale spíše souborem celkových limitací kardiovaskulární funkce, jako je chronotropie, inotropie, vazodilatace, luzitropie a snížený srdeční výdej [23].
Pravděpodobně hlavní příčinou HFPEF je DD zahrnující poruchu relaxace LK a zvýšenou tuhost stěny LK. Nicméně klinicky se u tohoto typu srdečního selhání objevuje dysfunkce dalších orgánů, jako jsou ledviny, cévy atd. Abnormální relaxace LK je časným znakem rozvoje HFPEF a tuhost či nepoddajnost LK hraje hlavní roli v přechodu z asymptomatické DD k HFPEF. Jednou z příčin nepoddajnosti LK je intersticiální fibróza [24]. Změny v extracelulární matrix jsou indukovány působením řady autokrinních, parakrinních a endokrinních faktorů [25,26]. Jinou příčinou může být hypertrofie kardiomyocytů, ale rozhodně jako samostatná jednotka nestačí k rozvoji onemocnění [27,28]. Hypertrofie je kompenzatorním mechanizmem v důsledku zvýšení napětí stěny komory způsobeného tlakovým přetížením, ale následná nadměrná hypertrofie vede k rozvoji HFPEF. Kompenzatorní hypertrofie je ovlivňována různými působky, jako jsou např. kalcineurin a renin-angiotenzin-aldosteronový systém [25,29]. Tuhost myokardu spojená s nadměrnou hypertrofií je také vysvětlována přesmykem exprese izoformy N2BA titinu na izoformu N2B titinu a snížením fosforylace titinu [28].
Myokardiální remodelace při systémové prozánětlivé reakci
Komorbitidy, především obezita, indukují systémovou prozánětlivou reakci. Tuková tkáň je u viscerální obezity infiltrována makrofágy vyvolávajícími systémovou zánětlivou odpověď a sekreci prozánětlivých cytokinů [30–32]. Při zánětlivé reakci produkují mikrovaskulární endotelie koronárních cév kyslíkové radikály snižující dostupnost oxidu dusného (NO) pro okolní kardiomyocyty. Sníženou dostupností NO klesá produkce cyklického guanosin monofosfátu (cGMP) [33]. Dále je snížená produkce proteinkinázy G (PKG) v kardiomyocytech, a tím je snížená fosforylace proteinu titinu, jak již bylo řečeno výše. PKG funguje jako brzda rozvoje hypertrofie. Proto dochází k progresi hypertrofie kardiomyocytů a koncentrické remodelaci LK [34]. Nižší aktivita myokardiální PKG u pacientů s HFPEF oproti pacientům s HFREF koreluje s větším průměrem kardiomyocytu u pacientů s HFPEF [35]. Celý mechanizmus NO-cGMP-PKG ovlivňuje myokardiální relaxaci [36]. Jako důsledek zánětu v mikrovaskulárních koronárních endoteliích též klesá vazodilatační odpověď, což způsobí sníženou toleranci zátěže u pacientů s HFPEF [23]. Zánětlivá reakce je způsobena především vysokou sérovou hladinou interleukinu 6 IL6) a tumor nekrotizujícího faktoru alfa (TNFα) [37]. Dále bývá přítomna vysoká hladina dalších zánětlivých markerů, jako např. solubilního ST2 nebo pentraxinu 3 [38,39]. U pacientů s HFPEF je dále zvýšena především produkce kolagenu typu I a častější cross-link kolagenu, což přispívá k DD [40].
Mechanizmus přechodu z hypertenzního onemocnění srdce k HFPEF je také málo objasněn. Hypertenzní nemoc srdce zvyšuje oxidativní stres a tudíž vnímavost srdce k mineralokortikoidům. Mineralokortikoidy podporují fibrózu a zhoršují DD, a tak vedou k rychlejšímu rozvoji HFPEF [41]. Dále je oxidativní stres u na sůl citlivé hypertenze zvýšen při vyšším příjmu soli, pravděpodobně kvůli produkci prozánětlivých cytokinů ledvinami [42,43]. K rozvoji oxidativního stresu přispívá také nedostatek železa u HFPEF [44].
Diabetes mellitus a stárnutí mohou také přímo zvýšit produkci volných radikálů. Vysoká hladina glukózy způsobuje poškození mitochondrií. Rozvoj dysfunkce mitochondrií je též popsán při stárnutí [45,46]. Dále bylo zjištěno, že sérová hladina „digitalis-like“ faktorů roste u pacientů s hypertenzí a také u pacientů s HFPEF. Tyto faktory (např. oabain a marinobufagenin) inhibují funkci Na+/K+ATP-ázy jako iontové pumpy a aktivují vstup Ca2+ do buňky pomocí Na+/Ca+ výměníku a dále podporují tvorbu kolagenu ve fibroblastech. Inhibice „digitalis-like“ faktorů může zpomalit rozvoj HFPEF a být novým terapeutickým směrem v budoucnosti [47].
Systolická funkce LK a velikost levé síně (LS) u HFPEF
Echokardiografickými parametry se zabývala studie CARRY-IN-HFpEF [48], přesněji analýzou cirkumferenciálního a longitudinálního zkracování a jejich vztahu k HFPEF. Bylo měřeno „stress-corrected midwall shortening“ (zatížením korigované zkrácení střední stěny – sc-MS) a „mitral annular peak systolic velocity“ (vrcholová systolická rychlost pohybu mitrálního anulu – S´). Nízké sc-MS bylo stanoveno < 89 % a S´ < 8,5 cm/s. Izolovaně nízké sc-MS bylo detekováno u 46 % pacientů, izolovaně nízké S´ bylo detekováno u 11 % pacientů a oba nízké parametry byly zjištěny u 26 % pacientů. Alterace systolické funkce byla tedy zjištěna u 83 % pacientů s HFPEF, z čehož vyplývá, že cirkumferenciální či longitudinální systolické dysfunkce byla přítomna u většiny pacientů se HFPEF. Byla hledána také souvislost mezi parametry LK a zvětšením LS charakterizovaným pomocí „LA volume index“ (index objemu levé síně – LAVi) ≥ 29 ml/m2. Zvětšení LS bylo signifikantně spojeno se zvýšením hodnoty „LV mass index“ (index hmoty LK) a „relative wall thickness“ (relativní šířka stěny) [49]. Přechodem z asymptomatické DD do HFPEF se zabývala práce autorů Aizawa et al [50]. Studie zahrnula pacienty se HFPEF a asymptomatické pacienty s hypertenzí. Rychlost S´ a „mitral annular early diastolic velocity“ (vrcholová rychlost pohybu mitrálního anulu v časné diastole – E´) byly sníženy u obou skupin oproti kontrole, a to přibližně stejně významně. „Diastolic wall strain“ (diastolické zatížení stěny) byl signifikantně snížen u skupiny s HFPEF oproti hypertonikům.
Diagnostika
Diagnostika HFPEF je založena na fyzikálním vyšetření, na přítomnosti symptomů srdeční slabosti, na laboratorním vyšetření včetně „N-terminal fragment of pro-brain natriuretic peptide“ (NT-proBNP) nebo BNP, a dále především na průkazu DD [51,52]. Diagnostický algoritmus HFPEF přináší Paulusova práce [2]. Pokud má pacient známky srdečního selhání, EF LK > 50 % a enddiastolický objem levé komory < 97 ml/m2, můžeme diagnózu stanovit neinvazivně pomocí echokardiografických parametrů včetně dopplerovských měření. Prokazujeme poruchu relaxace, plnění, distenzibility a tuhosti LK (tedy DD LK). Pokud je poměr E/E´(E – vrcholná rychlost plnění LK v časné diastole) > 15, k určení diagnózy nepotřebujeme již další parametry. Pokud se poměr E/E´ nachází mezi hodnotami 8–15, musí být hodnota NT-proBNP > 220 pg/ml nebo BNP > 200 pg/ml nebo splněny další echokardiografické parametry, a to poměr E/A (A – vrcholná rychlost plnění LK při síňové kontrakci) < 0,5 a decelerační čas vlny E (DT) > 280 ms u jedinců starších 50 let nebo rozdíl Ard-Ad (Ad – doba trvání vlny A transmitrálního plnění LK, Ard – doba trvání reverzního toku plicními žilami v době síňové kontrakce) > 30 ms nebo LAVi > 40 ml/m2 nebo index hmoty LK u žen > 122 g/m2, u mužů > 149 g/m2 nebo přítomnost fibrilace síní (FS). Pokud jsou zvýšeny natriuretické peptidy, stačí pro průkaz HFPEF jeden z následujících nálezů: E/E´ > 8, E/A < 0,5 v kombinaci s DT > 280 ms u jedinců nad 50 let, Ard – Ad > 30 ms, LAVi > 40 ml/m2, index hmoty LK u žen > 122 g/m2, u mužů > 149 g/m2 nebo přítomnost FS.
K průkazu DD je využíváno především echokardiografické vyšetření, přesnější závěry o DD je však možno získat z katetrizačního vyšetření srdce. K ozřejmění základní choroby vedoucí k srdečnímu selhání jsou nutná další neinvazivní a invazivní vyšetření (RTG srdce a plic, EKG, často i koronarografie a spirometrie). Obtížná může být diagnostika časné fáze onemocnění. Dušnost při zátěži není specifická a biomarkery jako BNP, NT-proBNP či hemodynamické známky zvýšeného plnícího tlaku LK mohou chybět u pacientů s normální klidovou funkcí s abnormální hemodynamickou odpovědí na zátěž. Studie autorů Borlaug et al [53] se zabývala touto problematikou pomocí invazivního měření hemodynamických parametrů při zátěži. 58 % pacientů s normálním BNP a normálními klidovými parametry vykazovalo během zátěže nárůst plnících tlaků LK odpovídající HFPEF. Dřívější diagnóza HFPEF pomocí zátěžového testu a průkazu zátěží navozeného vzestupu plnícího tlaku LK by mohla být nápomocna v léčení a prevenci progrese onemocnění.
Diagnostika HFPEF je obtížná také na základě nedostatku zavedených diagnostických nástrojů do klinické praxe na rozdíl od diagnostiky HFREF, při níž je tímto hlavním parametrem EF LK [13]. Diagnostika na základě klinických symptomů je nedostatečná. Je dobře známo, že plazmatická hladina BNP roste při srdečním selhání, nicméně BNP roste také při progresi hypertrofie levé komory bez srdečního selhání [54,55]. Dalším možným diagnostickým markerem je NT-proBNP, respektive poměr BNP/NT-proBNP. Nicméně i tento poměr roste s věkem, je vyšší u žen a u pacientů s renální dysfunkcí či FS, a naopak je snížen u obézních pacientů [56–59]. Zlatým standardem k vyhodnocení DD je invazivní měření diastolických tlaků v LK, bohužel poněkud nepraktickým. Nejužívanější neinvazivní metodou v diagnostice HFPEF je echokardiografie využívající především pulzní dopplerovské měření transmitrálních tokových rychlostí a měření rychlosti pohybu mitrálního anulu, avšak i takto získané výsledky mají své nedostatky. Nicméně poměr E/E´ nejlépe koreluje s plnícími tlaky levé komory zjištěnými invazivně, proto byl tento poměr schválen Evropskou kardiologickou společností jako hlavní marker diagnostiky HFPEF [2]. V hodnocení DD může být též použita magnetická rezonance (MRI) srdce. Použití tohoto vyšetření je ovšem limitováno obtížnější dostupností, délkou vyšetření a řadou kontraindikací v porovnání s echokardiografickým zobrazením. Nicméně parametry E, A, E/A, E´, E/E´, DT či Ard-Ad mohou být vedle echokardiografie měřeny pomocí MRI. Studie s malými skupinami pacientů, které srovnávaly echokardiografii a magnetickou rezonanci pro diagnostiku DD, měly obdobné výsledky [60].
Včasné zjištění DD může být nápomocné v odhalení některých závažných onemocnění, jako např. β-thalasemia major. Βeta-thalasemia major je onemocnění spojené s DD pro depozita železa v myokardu. NT-proBNP a BNP jsou senzitivní ukazatele dysfunkce levé komory, proto mohou pomoci detekovat ještě asymptomatickou DD při tomto onemocnění. NT-proBNP se zdá mít lepší prediktivní hodnotu při detekci latentní DD. Pokud je již DD spojena se symptomy srdečního selhání, jsou oba parametry již signifikantně zvýšeny [61].
Prognóza
Na rozdíl od HFREF nebylo při zavedené léčbě včetně nových metod pozorováno žádné zlepšení prognózy pacientů [8]. V obecném hodnocení prognózy pacientů jsou užívány 2 základní parametry, a to morbidita a mortalita. Mortalita pacientů s HFPEF a srovnání s mortalitou u pacientů s HFREF v následujících pracích je shrnuta v tab. 1.
Table 1. Morbidita a mortalita pacientů s HFPEF dle rizikových faktorů nebo ve srovnání s pacienty s HFREF 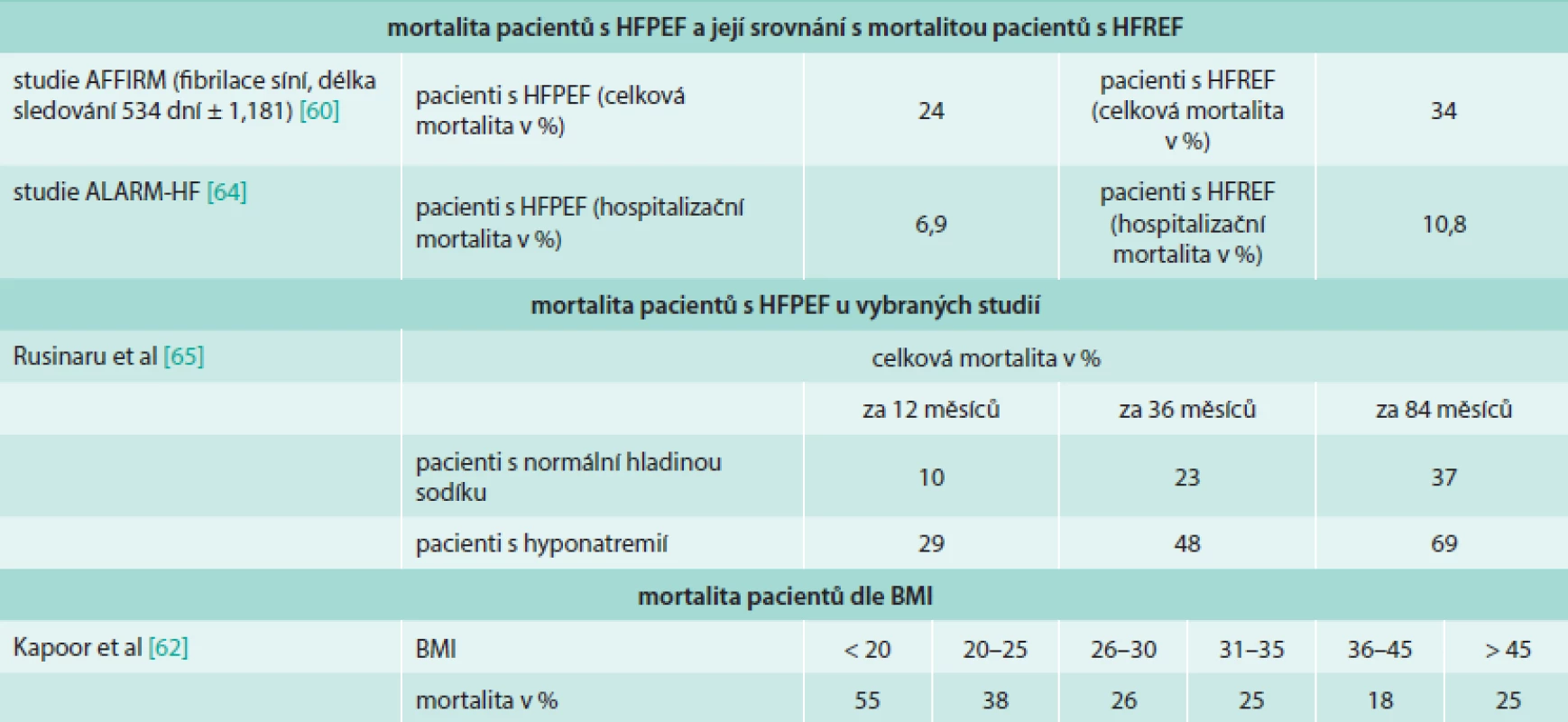
Prognóza HFPEF se odvíjí od multiorgánového poškození tkání souvisejícího se srdečním selháním, jako je svalová dysfunkce při kardiální kachektizaci, cévní dysfunkce, plicní hypertenze, anémie, FS a s ní spojená onemocnění (cévní onemocnění mozku, embolizace do velkého oběhu a další) [62]. Morbidita a mortalita pacientů s FS a HFPEF byla zkoumána oproti skupině se HFREF ve studii AFFIRM [63]. Nemocní s FS a HFPEF byli častěji starší ženy s hypertenzí. Pacienti s HFPEF a FS měli menší rozměry LS oproti skupině HFREF a nižší prevalenci mitrální insuficience. U pacientů s HFPEF byla zjištěna nižší celková i kardiovaskulární mortalita, morbidita u obou skupin nebyla signifikantně rozdílná. Pulmonální hypertenze je dobře známou komplikací HFPEF a zároveň známkou špatné prognózy. Pacienti s plicní hypertenzí bývají častěji starší a obézní, častěji se u nich vyskytuje diabetes, chronická obstrukční plicní nemoc a FS. Dle autorů Leunga et al nebyla zároveň prokázána přímá souvislost přítomnosti plicní hypertenze s onemocněním koronárních tepen, bolestí na hrudi či synkopou v minulosti [64]. Obezitou se zabývali autoři Kapoor et al [65], kteří zjistili, že nízký BMI byl spojen s rostoucí mortalitou u pacientů s HFPEF, nicméně při BMI > 45 mortalita opět vzrostla. Dle studie DIAST-CHF [66] se kvalita života pacientů s HFPEF zhoršovala s rozvojem DD. Hospitalizační mortalita akutního HFPEF byla hodnocena dle registru ALARM-HF [67]. Výsledkem bylo, že pacienti se HFPEF měli nižší hospitalizační mortalitu než pacienti se HFREF a byli také rychleji propuštěni. Akutní srdeční selhání u pacientů se HFPEF také méně často přecházelo v kardiogenní šok, předhospitalizační NYHA klasifikace byla též lepší. Laboratorně u nich byly také méně často zjištěny pozitivní troponin a CK-MB, renální dysfunkce a hyponatremie. Nebyl ale zjištěn rozdíl v prevalenci FS, diabetu či anémie. Hladina sodíku v séru může mít negativní prognostický vliv na přežití pacientů s HFPEF. Přežití pacientů s hyponatremií bylo nižší než u pacientů s normální sérovou hladinou natria [68]. Prognózou pacientů s ventrikulární dyssynchronií způsobenou idiopatickým blokem levého raménka Tawarova (LBBB) nebo dyssynchronií vyvolanou stimulací z pravé komory se zabývala studie autorů Park et al [69]. Dyssynchronie levé komory byla mnohem běžnější u pacientů s idiopatickým LBBB. Nebyla ale prokázána souvislost mezi rozsahem dyssynchronie levé komory při idiopatickém LBBB a prognózou, na rozdíl od LBBB vyvolaného stimulací z pravé komory.
Léčba
V léčbě srdečního selhání se vedle tradičních a osvědčených metod objevují metody nové. Některé jsou ještě ve fázi experimentu, zatímco jiné se pomalu propracovávají do klinické praxe [70]. Avšak i přes různé přístupy v medikamentózní terapii se prognóza tohoto onemocnění nemění již 20 let, jak již bylo zmíněno [24]. Neexistují žádné osvědčené terapeutické postupy, které by dokázaly snížit morbiditu a mortalitu u pacientů s HFPEF [71]. Tím se HFPEF výrazně liší od HFREF [8]. Srovnání léčby pacientů dle ejekční frakce levé komory je shrnuto v tab. 2 [9]. Následující text shrnuje některé nové poznatky a jejich význam v léčbě HFPEF.
Table 2. Léčba srdečního selhání dle ejekční frakce levé komory. Upraveno podle [9]. ![Léčba srdečního selhání dle ejekční frakce levé komory. Upraveno podle [9].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/fd0a05e08c8b4b3687346a6ce1a4a8d9.png)
Aldosteron, jako potencionální stimulátor myokardiální a vaskulární fibrózy, může být klíčem k progresi srdečního selhání. Jeho vyřazení by mohlo být účinným terapeutickým cílem. Rozsáhlá studie TOPCAT [72,73] se zabývala efektem spironolaktonu jako antagonisty aldosteronu na morbiditu, mortalitu a kvalitu života u pacientů s HFPEF. Pacienti léčení spironolaktonem byli méně často hospitalizovaní a měli menší kardiovaskulární mortalitu oproti placebu, rozdíl ale nebyl statisticky významný. Počet hospitalizací pro srdeční selhání u pacientů léčených spironolaktonem byl nižší, a to hraničně významně. Výsledky studie přehledně shrnuje tab. 3. Efektem inhibice aldosteronu na toleranci zátěže, dopplerovsky zjištěnou diastolickou funkci a kvalitu života u starších žen se také zabývala studie autorů Daniela et al [74]. Při terapii inhibitory aldosteronu signifikantně vzrostl „peak oxygen uptake“ (vrcholová spotřeba kyslíku – VO2 peak), zlepšila se tolerance zátěže, vzrostl ventilační anaerobní práh. Co se týče echokardiografických parametrů, vzrostla hodnota E´ a zároveň se nezměnila hodnota E, tudíž poměr E/E´ poklesl, vzrostla také hodnota „late diastolic mitral annulus velocity“ (pozdní diastolická rychlost pohybu mitrálního anulu – A´). Všechny tyto parametry poukázaly na zlepšení diastolické funkce levé komory. Užití inhibitorů aldosteronu v léčbě HFPEF tedy přineslo jistý benefit.
Table 3. Souhrnné výsledky studie TOPCAT (spironolakton vs placebo) 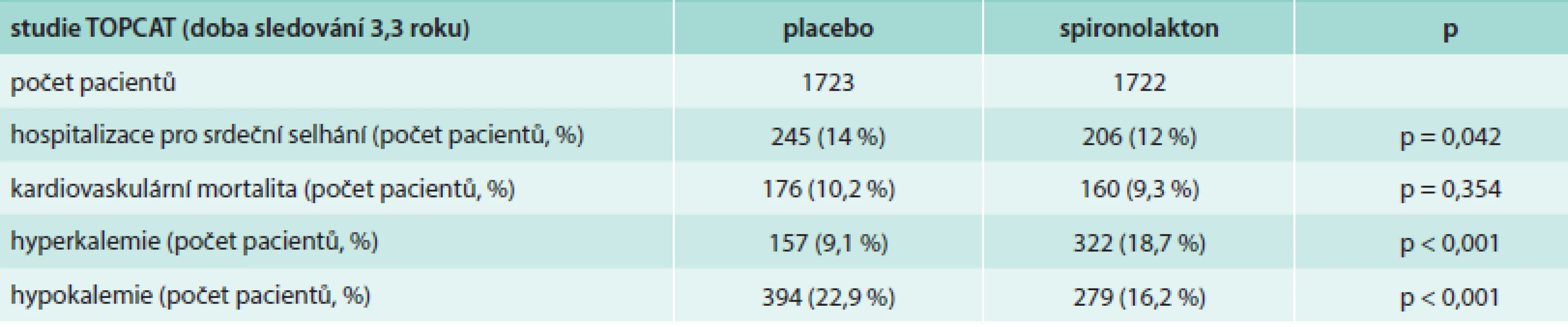
Efekt valsartanu na toleranci zátěže u pacientů s HFPEF byl zjišťován v randomizované studii autorů Parthasarathy et al [75]. Valsartan nedokázal prodloužit dobu fyzického cvičení, ale zlepšil subjektivní vnímání zátěže, dobře reguloval krevní tlak a celkově byl velmi dobře tolerován. U pacientů s HFPEF starších 80 let bylo sledováno přežití při užívání běžných medikamentů srdečního selhání (inhibitory angiotenzin konvertujícího enzymu – ACEI, antagonisté angiotenzinu II – AT II, diuretika, betablokátory, digoxin). U žádného z nich nebyl prokázán statisticky významný pozitivní vliv na přežití starých pacientů. Nicméně u diuretik a digoxinu byla pozorována statisticky nevýznamná tendence snížit přežívání pacientů [76]. Již dříve byly provedeny studie CHARM-Preserved, PEP-CHF a I PRESERVE s kandesartanem, perindoprilem a irbesartanem, ale zklamaly v průkazu zlepšení morbidity a mortality [18,77–80].
Betablokátory (BB) jsou hojně užívaným lékem v léčbě pacientů s HFREF. BB zpomalují klidovou srdeční frekvenci, zlepšují plnění levé komory, a tím i diastolickou funkci. Nicméně dle autorů Farasat et al [81] negativně chronotropní účinek a nedostatečná vazodilatace při zátěži u pacientů s HFPEF užívajících BB jsou nažádoucí. Dle jejich práce nemělo zavedení terapie BB po dekompenzaci HFPEF pravděpodobně žádný vliv, u žen ale signifikantně zvýšilo pravděpodobnost rehospitalizace. Také studie SENIORS zabývající se efektem nebivololu na mortalitu mimo jiné u pacientů se HFPEF nezjistila výraznější benefit [82].
Je všeobecně známo, že u pacientů s významnou systolickou dysfunkcí LK se rozvíjí plicní hypertenze, narůstá plicní vaskulární rezistence a zhoršuje se systolická dysfunkce pravé komory. Nicméně i u pacientů se HFPEF se může rozvinout postkapilární plicní hypertenze a systolická dysfunkce pravé komory. Neexistují randomizované studie a guidelines zabývající se péčí o pacienty se HFPEF s výsledným selháním pravé komory. Při pokročilém selhání pravé komory nejsou vhodné betablokátory vzhledem k jejich negativně inotropnímu a chronotropnímu účinku a dalšímu poklesu tlaku [83].
Injekční podávání erytropoetinu u pacientů s anémií a HFPEF má kromě postupného vzestupu hemoglobinu i další pozitiva. Dle práce autorů Cohen et al [84] došlo k postupnému poklesu diastolického srdečního tlaku. Také se u pacientů s HFPEF se zvýšil VO2 peak a prodloužila se tolerance zátěže. Sildenafil zvyšuje myokardiální aktivitu PKG tak, že inhibuje fosfodiesterázu 5 (PDE-5), a tak brání odbourávání cGMP. Tímto mechanizmem funguje jako prevence rozvoje hypertrofie kardiomyocytů a intersticiální fibrózy [85]. Sildenafil zlepšuje diastolickou funkci LK a redukuje plicní hypertenzi u obou typů srdečního selhání [86,87].
V budoucnosti by mohly mít přínos v léčbě HFPEF NO donory a substance s antioxidačním účinkem jako statiny nebo resveratrol [46,88]. Pacienti užívající statiny mají vyšší PKG aktivitu a menší hypertrofii kardiomyocytů [35]. Posílení NO syntázy pomocí AVE3085 užitém na zvířecím modelu snížilo DD a zmenšilo stupeň fibrózy ve srovnání s neléčenými zvířaty [89,90]. Dalším potencionálním lékem budoucnosti v terapii HFPEF by mohl být duální inhibitor neprilyzinu a receptoru pro angiotenzin II, označovaný pracovním názvem LCZ 696. Tento lék je zatím ve fázi farmakologických a klinických zkoušek. Účinkem LCZ 696 u pacientů s HFPEF se zabývala studie PARAMOUNT [91,92]. Byl srovnáván efekt valsartanu proti LCZ 696. Ve skupině užívající LCZ 696 došlo k výraznějšímu poklesu plazmatické koncentrace Nt-proBNP a také ke snížení objemu levé síně.
Ischemická choroba srdeční je po hypertenzi častou skrytou kardiovaskulární komorbiditou u pacientů s HFPEF, revaskularizace je proto doporučovaným postupem k potlačení potíží vyplývajících z ischemie myokardu, ale očekávané snížení mortality u těchto pacientů není všeobecně prokázáno [93]. U pacientů s nově vzniklým HFPEF rostou plnící tlaky LK při fyzickém cvičení ve spojení s nedostatečným zvýšením relaxace a rychle stoupá tuhost levé komory. Terapie, která zlepší diastolickou funkční rezervu, může zlepšit toleranci zátěže u pacientů s hypertenzí a s nově vzniklým HFPEF [94]. Fyzický trénink může být pro starší pacienty se HFPEF prospěšný. Dle autorů Kitzman et al se po 16 týdnech pravidelné fyzické aktivity zvýšil výkon pacientů, stoupla hodnota VO2 peak, prodloužila se tolerovaná doba cvičení a zvýšil se ventilační anaerobní práh, čímž se zlepšila kvalita života [95].
Závěr
Srdeční selhání se zachovalou ejekční frakcí levé komory je epidemiologicky závažným onemocněním, jehož výskyt v populaci postupně narůstá. Etiologie jeho vzniku není ještě zcela objasněna. Hlavním znakem tohoto typu srdečního selhání je diastolická dysfunkce, která je ale doprovázena řadou dalších kardiálních i nekardiálních poruch organizmu. Prognóza se i přes dlouhodobě užívané, ale i nově zavedené terapeutické postupy nemění.
Diagnostika HFPEF je založena na pečlivém odběru anamnézy, na kardiálních symptomech, na laboratorním vyšetření včetně NT-proBNP nebo BNP a echokardiografickém vyšetření včetně pulzního dopplerovského měření. Zlatým standardem v diagnostice však je srdeční katetrizace.
Práce byla podpořena prostředky „European Regional Development Fund – Project FNUSA-ICRC (No. CZ. 1.05/1.1.00/02.0123)“
MUDr. Zdeňka Gregorová
gregorovaz@fnusa.cz
I. interní kardio-angiologická klinika LF MU a FN u sv. Anny, Brno
www.fnusa.cz
Doručeno do redakce 11. 3. 2014
Přijato po recenzi 13. 5. 2014
Sources
1. Borlaug BA, Walter JP. Heart failure with preserved ejection fraction: patophysiology, diagnosis and treatment. Eur Heart J 2011; 32(6): 670–679.
2. Paulus WJ, Tschope C, Sanderson JE et al. How To Diagnose Diastolic Heart Failure: A Consensus Statement on the Diagnosis of Heart Failure and Echocardiography Associations of The European Society of Cardiology. Eur Heart J 2007; 28(12): 2539–2550.
3. Nagueh SF, Appleton CP, Gillebert TC et al. Recommendations for The Evaluation of Left Ventricular Diastolic Function by Echocardiography. J Am Soc Echocardiogr 2009; 22(2): 107–133.
4. Hanrath P, Mathey DG, Siegert R et al. Left ventricular Relaxation and Filling Pattern in Different Forms of Left Ventricular Hypertrophy: An Echocardiographic Study. Am J Cardiol 1980; 45(1): 15–23.
5. Hess OM, Grimm J, Krayenbuehl HP. Diastolic simple elastic and viscoelastic properties of the left ventricle in man. Circulation 1979; 59(6): 1178–1187.
6. Soufer R, Wohlgelernter D, Vita NA et al. Intact Systolic Left Ventricular Function in Clinical Congestive Heart Failure. Am J Cardiol 1985; 55(8): 1032–1036.
7. McMurray J, Pfeffer MA. New Therapeutic Options in Congestive Heart Failure: Part II. Circulation 2002; 105(18): 2223–2228.
8. Owan TE, Hodge DO, Herges RM et al. Trends in Prevalence and Outcome of Heart Failure With Preserved Ejection Fraction. N Engl J Med 2006; 355(3): 251–259.
9. Magana-Serrano JA, Almahmeed W, Gomez E et al. Prevalence of heart failure with preserved ejection fraction in Latin American, Middle Eastern, and North African Regions in the I PREFER Study (Identification of Patients With Heart Failure and PREserved Systolic Function: and epidemiological regional study). Am J Cardiol 2011; 108(9): 1289–1296.
10. Russo C, Jin Z, Homma S et al. Race/ethnic Disparities in Left Ventricular Diastolic Function in a Triethnic Community Cohort. Am Heart J 2010; 160(1): 152–158.
11. Kelly RV, Tan WA, Cho H et al. Prevalence of Symptomatic Diastolic Heart Failure in Patients Hospitalized With Cerebral or Peripherial Vascular Disease. Congest Heart Fail 2005; 11(5): 256–261.
12. Zhang Y, Safar ME, Iaria P et al. Prevalence and Prognosis of Left Ventricular Diastolic Dysfunkcion in The Elderly: The PROTEGER Study. Am Heart J 2010; 160(3): 471–478.
13. Kazuhiro Y, Sakata Q, Ohtani T et al. Heart Failure With Preserved Ejection Fraction. What is Known and Unknown. Circ J 2009; 73(3): 404–410.
14. Hradec J. Anémie při chronickém srdečním selhání. Vnitř Lék 2010; 56(8): 854–859.
15. Hsich EM, Grau-Sepulveda V, Hernandez AF et al. Sex differences in in-hospital mortality in acute decompensated heart failure with reduced and preserved ejection fraction. Am Heart J 2012; 163(3): 430–437.
16. Elshaer F, Hassan W, Fawzy ME et al. The prevalence, clinical characteristics, and prognosis of diastolic heart failure: a clinical study in elderly saudi patients with up to 5 years follow-up. Congest Heart Fail 2009; 15(3): 117–122.
17. Aguilar D, Deswal A, Ramasubbu K et al. Comparison of patients with heart failure and preserved left ventricular ejection fraction among those with versus without diabetes mellitus. Am J Cardiol 2010; 105(3): 373–377.
18. McMurray J, Komajda M, McKelvie R et al. Heart failure with preserved ejection fraction: clinical characteristics of 4133 patients enrolled in the I-PRESERVE trial. Eur J Heart Fail 2008; 10(2): 149–156.
19. Yancy CW, Lopatin M, Stevenson LW et al. Clinical presentation, management, and in-hospital outcomes of patients admitted with acute decompensated heart failure with preserved systolic function: a report from the Acute Decompensated Heart Failure National Registry (ADHERE) Database. J Am Coll Cardiol 2006; 47(1): 76–84.
20. Steinberg BA, Zhao X, Heidenreich PA et al. Trends in patients hospitalized with heart failure and preserved left ventricular ejection fraction: prevalence, therapies, and outcomes. Circulation 2012; 126(1): 65–75.
21. Selvaraj S, Klein I, Danzi S et al. Association of serum triiodthyronine with B-type natriuretic peptide and severe left ventricular diastolic dysfunktion in heart failure with preserved ejection fraction. Am J Cardiol 2012; 110(2): 234–239.
22. Negi SI, Jeong E, Shukrullah I et al. Association of Low Plasma Adiponectin With Early Diastolic Dysfunction. Congest Heart Fail 2012; 18(4): 187–191.
23. Borlaug BA, Olson TP, Lam CSP et al. Global Cardiovascular Reserve Dysfunction in Heart Failure With Preserved Ejection Fraction. J Am Coll Cardiol 2010; 56 : 845–854.
24. Owan TE, Hodge DO, Herges RM et al. Trends in prevalence and outcome of heart failure with preserved ejection fraction. N Eng J Med 2006; 355 : 251–259.
25. Yamamoto K, Masuyama T, Sakata Y et al. Role of renin-angiotensin and endothelin systems in development of diastolic heart failure in hypertensive hearts. Cardiovasc Res 2000; 47(2): 274–283.
26. Koitabashi N, Arai M, Kogure S et al. Increased connective tissue growth factor relative to brain natriuretic peptide as a determinant of myocardial fibrosis. Hypertension 2007; 49(5): 1120–1127.
27. Borbely A, van der Velden J, Papp Z et al. Cardiomyocyte stiffness in diastolic heart failure. Circulation 2005; 111(6): 774–781.
28. Van Heerebeek L, Borbely A, Niessen HWM et al. Myocardial structure and function differ in systolic and diastolic heart failure. Circulation 2006; 113(16): 1966–1973.
29. Sakata Y, Masuyama T, Yamamoto K et al. Calcineurin inhibitor attenuates left ventricular hypertrophy leading to prevention of heart failure in hypertensive rats. Circulation 2000; 102(18): 2269–2275.
30. Taube A, Schlich R, Sell H et al. Inflammation and metabolic dysfunction: links to cardiovascular diseases. Am J Physiol Heart Circ Physiol 2012; 302(11): H2148-H2165.
31. Jelic S, Lederer DJ, Adams T et al. Vascular inflammation in obesity and sleep apnea. Circulation 2010; 121(8): 1014–1021.
32. Apovian CM, Gokce N. Obesity and cardiovascular disease. Circulation 2012; 125(9): 1178–1182.
33. Schulz E, Jansen T, Wenzel P et al. Nitric oxide, tetrahydrobiopterin, oxidative stress and endothelial dysfunction in hypertension. Antioxid Redox Signal 2008; 10(6): 1115–1126.
34. Paulus WJ, Tschoepe C. A Novel Paradigm for Heart Failure With Preserved Ejection Fraction. J Am Coll Cardiol 2013; 62(4): 263–271.
35. Van Heerebeek L, Hamdani N, Falcao-Pires I et al. Low myocardial protein kinase G activity in heart failure with preserved ejection fraction. Circulation 2012; 126(7): 830–839.
36. Brutsaert DL. Cardiac endothelial-myocardial signaling: its role in cardiac growth, contractile performance and rhythmicity. Physiol Rev 2003; 83(1): 59–115.
37. Kalogeropoulos A, Georgiopoulou V, Psaty BM et al. Inflammatory markers and incident heart failure risk in older adults: the Health ABC (Health, Aging, and Body Composition) study. J Am Coll Cardiol 2010; 55(19): 2129–2137.
38. Shah KB, Kop WJ, Christenson RH et al. Prognostic utility of ST2 in patients with acute dyspnea and preserved left ventricular ejection fraction. Clin Chem 2011; 57(6): 874–882.
39. Matsubara J, Sugiyama S, Nozaki T et al. Pentraxin 3 is a new inflammatory marker correlated with left ventricular diastolic dysfunction and heart failure with normal ejection fraction. J Am Coll Cardiol 2011; 57(7): 861–869.
40. Kasner M, Westermann D, Lopez B et al. Diastolic tissue Doppler indexes correlate with the degree of collagen expression and cross-linking in heart failure and normal ejection fraction. J Am Coll Cardiol 2011; 57(8): 977–985.
41. Mohammed SF, Ohtani T, Korinek J et al. Mineralocorticoid Accelerates Transition to Heart Failure with Preserved Ejection Fraction Via „Non-genomic Effects“. Circulation 2010; 122(4): 370–378.
42. Hummel SL, Seymour EM, Brook RD et al. Low-sodium dietary approaches to stop hypertension diet reduces blood pressure, arterial stiffness and oxidative stress in hypertensive heart failure with preserved ejection fraction. Hypertension 2012; 60(5): 1200–1206.
43. Tian N, Moore RS, Braddy S et al. Interactions between oxidative stress and inflammation in salt-sensitive hypertension. Am J Physiol Heart Circ Physiol 2007; 293(6): H3388-H3395.
44. Macdougall IC, Canaud B, de Francisco AL et al. Beyond the cardiorenal anaemia syndrome: recognizing the role of iron deficiency. Eur J Heart Fail 2012; 14(8): 882–886.
45. Shenouda SM, Widlansky ME, Chen K et al. Altered mitochondrial dynamics contributes to endothelial dysfunction in diabetes mellitus. Circulation 2011; 124(4): 444–453.
46. Rajapakse AG, Yepuri G, Carvas JM et al. Hyperactive S6K1 mediates oxidative stress and endothelial dysfunction in aging: inhibition by resveratrol. PLoS One 2011; 6(4): e19237.
47. Kamimura D, Ohtani T, Sakata Y et al. Ca2+ Reentry Mode of Na+/Ca2+ Exchanger As a New Therapeutic Target for Heart Failure With Preserved Ejection Fraction. Eur Heart J 2012; 33(11): 1408–1416.
48. Cioffi G, Senni M, Tarantini L et al. Analysis of Circumferencial and Longitudinal Left Ventricular Systolic Function in Patients with Non-Ischemic Chronic Heart Failure and Preserved Ejection Fraction (from the CARRY-IN HFpEF Study). Am J Cardiol 2012; 109(3): 383–389.
49. Patel DA, Lavie CJ, Milani RV et al. Association of Left Ventricular Geometry With Left Atrial Enlargement in Patient with Preserved Ejection Fraction. Congest Heart Fail 2011. Dostupné z DOI: <http://doi: 10.1111/j.1751–7133.2011.00264.x>.
50. Aizawa Y, Sakata Y, Mano T et al. Transition From Asymptomatic Diastolic Dysfunction to Heart Failure With Preserved Ejection Fraction. Circ J 2011; 75(3): 596–602.
51. McMurray JJM, Adamopoulos S, Anker SD et al. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012. The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association (HFA) of the ESC. Eur Heart J 2012; 33(14): 1787–1847.
52. Hradec, J. Vítovec, J. Špinar, Summary of the ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012. Prepared by the Czech Society of Cardiology, Cor et Vasa 55 (2013) e25–e40. Dostupné z DOI: <http://doi:10.1016/j.crvasa.2013.01.002>.
53. Borlaug BA, Nishimuta PS, Lam CSP et al. Exercise hemodynamics enhance diagnosis of early heart failure with preserved ejection fraction. Circ Heart Fail 2010; 3(5): 588–595.
54. Nakagawa O, Ogawa Y, Itoh H et al. Rapid transcriptional activation and early mRNA turnover of brain natriuretic peptide in cardiocyte hypertrophy: Evidence for brain natriuretic peptide as an “emergency” cardiac hormone against ventricular overload. J Clin Invest 1995; 96(3): 1280–1287.
55. Yamamoto K, Burnett jr. JC, Jougasaki M et al. Superiority of brain natriuretic peptide as a hormonal marker of ventricular systolic and diastolic dysfunction and ventricular hypertrophy. Hypertension 1996; 28(6): 988–994.
56. Redfield MM, Rodeheffer RJ, Jacobsen SJ et al. Plasma brain natriuretic peptide concentration: Impact of age and gender. J Am Coll Cardiol 2002; 40(5): 976–982.
57. Tsutamoto T, Wada A, Sakai H et al. Relationship between renal function and plasma brain natriuretic peptide in patients with heart failure. J Am Coll Cardiol 2006; 47(3): 582–586.
58. Knudsen CW, Omland T, Clopton P et al. Impact of atrial fibrillation on the diagnostic performance of B-type natriuretic peptide concentration in dyspneic patients: An analysis from the Breathing Not Properly Multinational Study. J Am Coll Cardiol 2005; 46(5): 838–844.
59. Wang TJ, Larson MG, Levy D et al. Impact of obesity on plasma natriuretic peptide levels. Circulation 2004; 109(5): 594–600.
60. Daneshvar D, Wei J, Tolstrup K et al. Diastolic Dysfunction: Improved Understanding Using Emerging Imaging Techniques. Am Heart J 2010; 160(3): 394–404.
61. Kremastinos DT, Hamodraka E, Parissis J et al. Predictive value of B-type natriuretic peptides in detecting latent left ventricular diastolic dysfunction in beta-thalasemia major. Am Heart J 2010; 159(1): 68–74.
62. Maeder MT, Kaye DM. Heart failure with normal left ventricular ejection fraction. J Am Coll Cardiol 2009; 53(11): 905–918.
63. Badheka AO, Rathod A, Kizilbash MA et al. Comparison of Mortality and Morbidity in Patients with Atrial Fibrillation and Heart Failure with Preserved Versus Decreased Left Ventricular Ejection Fraction. Am J Cardiol 2011; 108(9): 1283–1288.
64. Leung CC, Moondra V, Catherwood E et al. Prevalence and risk factors of pulmonary hypertension in patients with elevated pulmonary venous pressure and preserved ejection fraction. Am J Cardiol 2010; 106(2): 284–286.
65. Kappor JR, Heidenreich PA. Obesity and survival in patients with heart failure and preserved ejection systolic function: a U-shaped relationship. Am Heart J 2010; 159(1): 75–80.
66. Edelmann F, Stahrenberg R, Polzin F et al. impaired physical quality of life in patients with diastolic dysfunction associates more strongly with neurohumoral activation than with echocardiographic parameters: quality of life in diastolic dysfunction. Am Heart J 2011; 161(4): 797–804.
67. Parissis JT, Ikonomidis I, Rafouli-Stergiou P et al. Clinical characteristics and predictors of in-hospital mortality in acute heart failure with preserved left ventricular ejection fraction. Am J Cardiol 2011; 107(1): 79–84.
68. Rusinaru D, Buiciuc O, Leborgne L et al. Relation of serum sodium level to long-term outcome after a first hospitalization for heart failure with preserved ejection fraction. Am J Cardiol 2009; 103(3): 405–410.
69. Park HE, Kim J, Kim H. Ventricular dyssynchrony of idiopathic versus pacing-induced left bundle branch block and its prognostic effect in patients with preserved left ventricular systolic function. Am J Cardiol 2012; 109(4): 556–562.
70. Vítovec J, Špinarová L, Špinar J Léčba chronického srdečního selhání v interní ambulanci. Vnitř Lék 2009; 55(Suppl 1): 9–12.
71. Bhuiyan T, Maurer MS Heart Failure With Preserved Ejection Fraction: Persistent Diagnosis, Therapeutic Enigma. Curr Cardiovasc Risc Rep 2011; 5(5): 440–449.
72. Desai AS, Lewis EF, Li R et al. Rationale and design of the treatment of preserved cardiac function heart failure with an aldosterone antagonist trial: a randomized, controlled study of spironolactone in patients with symptomatic heart failure and preserved ejection fraction. Am Heart J 2011; 162(6): 966–972.
73. Špinar J, Vítovec J. Zasnouben se špičkovou kočkou aneb ENGAGEd to TOPCAT. Kardiol Rev 2013; 15(4): 252–253.
74. Daniel KE, Wells G, Stewart K et al. Effect of aldosterone antagonism on exercise tolerance, doppler diastolic function, and quality of life in older woman with diastolic heart failure. Congest Heart Fail 2009; 15(2): 68–74.
75. Parthasarathy HK, Pieske B, Weisskopf M et al. A randomized, double-blind, placebo-controlled study to determine the effects of valsartan on exercise time in patients with symptomatic heart failure with preserved ejection fraction. Eur J Heart Fail 2009; 11(10): 980–989.
76. Tehrani F, Phan A, Chien CHV et al. Value of medical therapy in patients older than 80 years of age with heart failure and preserved ejection fraction. Am J Cardiol 2009; 103(6): 829–833.
77. Miller AB, Pina IL. Understanding heart failure with preserved ejection fraction: clinical importance and future outlook. Congest Heart Failure 2009; 15(4): 186–192.
78. Yusuf S, Pfeffer MA, Swedberg K et al. Effects of candesartan in patients with chronic heart failure and preserved left-ventricular ejection fraction: the CHARM-Preserved Trial. Lancet 2003; 362(9386): 777–781.
79. Cleland JG, Tendera M, Adamus J et al. The perindopril in elderly people with chronic heart failure (PEP-CHF) study. Eur Heart J 2006; 27(19): 2338–2345.
80. Paulus WJ, van Ballegoij JJM. Treatment of heart failure with normal ejection fraction. An inconvenient truth! J Am Coll Cardiol 2010; 55(6): 526–537.
81. Farasat SM, Bolger DT, Shetty V et al. Effect of Beta-Blocker Therapy on rehospitalization rates in women versus men with heart failure and preserved ejection fraction. Am J Cardiol 2010; 105(2): 229–234.
82. Flather MD, Shibata MC, Coats AJ et al. Randomized trial to determine the effect of nebivolol on mortality and cardiovascular hospital admission in elderly patients with heart failure (SENIORS). Eur Heart J 2005; 26(3): 215–225.
83. Zakir RM, Al-Dehneh A, Maher J et al. Right ventricular failure in patients with preserved ejection fraction and diastolic dysfunction: an underrecognized clinical entity. Congest Heart Fail 2007; 13(3): 164–169.
84. Cohen RS, Karlin P, Yushak M et al. The effect of erythropoietin on exercise capacity, left ventricular remodeling, pressure-volume relationships, and quality of life in older adult patients with anemia and heart failure with a preserved ejection fraction. Congest Heart Fail 2010; 16(3): 96–103.
85. Takimoto E, Champion HC, Li M et al. Chronic inhibition of cyclic GMP phosphodiesterase 5A prevents and reverses cardiac hypertrophy. Nat Med 2005; 11(2): 214–222.
86. Guazzi M, Vicenzi M, Arena R et al. PDE5 inhibition with sildenafil improves left ventricular diastolic function, cardiac geometry, and clinical status in patients with stable systolic heart failure: results of a 1-year, prospective, randomized, placebo-controlled study. Circ Heart Fail 2011; 4(1): 8–17.
87. Guazzi M, Vicenzi M, Arena R et al. Pulmonary hypertension in heart failure with preserved ejection fraction: a target of phosphodiesterase-5 inhibition in a 1-year study. Circulation 2011; 124(2): 164–174.
88. Antoniades C, Bakogiannis C, Leeson P et al. Rapid, direct effects of statin treatment on arterial redox state and nitric oxide bioavailability in human atherosclerosis via tetrahydrobiopterin-mediated endothelial nitric oxide synthase coupling. Circulation 2011; 124(3): 335–345.
89. Westermann D, Riad A, Richter U et al. Enhancement of the endothelial NO synthase attenuates experimental diastolic heart failure. Basic Res Cardiol 2009; 104(5): 499–509.
90. Heusch G. Diastolic heart failure: a misNOmer. Basic Res Cardiol 2009; 104 : 465–467.
91. Solomon SD, Zile M, Pieske B et al. The angiotensin receptor neprilysin inhibitor LCZ696 in heart failure with preserved ejection fraction: a phase 2 double-blind randomised controlled trial. Prospective comparison of ARNI with ARB on Management Of heart FailUre with preserved ejectioN fracTion (PARAMOUNT) Investigators. Lancet 2012; 380(9851): 1387–1395.
92. Vítovec J, Špinarová L, Špinar J. Nové možnosti léčby srdečního selhání a hypertenze. Kardiol Rev Int Med 2013, 15(2): 113–117.
93. Hunt SA, Abraham WT, Chin MH et al. ACC/AHA 2005 Guideline Update for the Diagnosis and Management of Chronic Heart Failure in the Adult – Summary Article: A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Update the 2001 Guidelines for the Evaluation and Management of Heart Failure). J Am Coll Cardiol 2005; 46(6): 1116–1143.
94. Borlaug BA, Jaber WA, Ommen SR et al. Diastolic Relaxation and Compliance Reserve during Dynamic Exercise in Heart Failure With Preserved Ejection Fraction. Heart 2011; 97(12): 964–969.
95. Kitzman DW, Brubaker PH, Morgan TM et al. Exercise Training in Older Patients with Heart Failure and Preserved Ejection Fraction: A Randomized, Controlled, Single-Blind Trial. Circ Heart Fail 2010; 3(6): 659–667.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2014 Issue 7-8-
All articles in this issue
- Vliv podávání tekutého mléčného nutričního doplňku se zvýšeným obsahem syrovátkových bílkovin na nutriční stav seniorů
- Celiakie u pacientů s diabetes mellitus 1. typu
- Akutní pankreatitida – validace nové klasifikace na souboru 159 nemocných a prognostické faktory
- Genetika a farmakogenetika osteoporózy
- Význam lymfangiogenézy a ultraštruktúry lymfatických kapilár pri metastázovaní malígneho melanómu
- Co je nového v srdečním selhání se zachovalou ejekční frakcí levé komory za posledních pět let?
- Specifika diabetes mellitus u žen
- Osteoporóza a metabolické kostní změny u celiakie v dospělosti
- Model vzdělávání sekundáře na Interní klinice FN Motol Praha Naše naše zkušenosti s lokálním projektem vzdělávání mladých lékařů v rámci jejich povinné postgraduální výuky
-
Zdeněk Mařatka a jeho podíl na založení České gastroenterologické společnosti a jejího časopisu.
Gastroenterologická společnost v Čechách a na Slovensku - Chirurgická léčba Crohnovy choroby
- Pokroky v diagnostice a léčbě nespecifických střevních zánětů
- Biologická terapie u pacientek s idiopatickými střevními záněty v graviditě
- Crohnova nemoc – genetické faktory z pohledu etiopatogeneze
- Etiologie a patogeneze idiopatických střevních zánětů
- Historie chirurgické léčby nespecifických zánětů střevních
- Epidemiologie dyspepsie
- Manažment pacientov s horným typom dyspepsie
- Endoskopická klasifikace neoplazií tlustého střeva a konečníku
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Endoskopická klasifikace neoplazií tlustého střeva a konečníku
- Akutní pankreatitida – validace nové klasifikace na souboru 159 nemocných a prognostické faktory
- Chirurgická léčba Crohnovy choroby
- Manažment pacientov s horným typom dyspepsie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

