-
Medical journals
- Career
Co mají společného žilní a tepenná onemocnění?
Authors: Jan Piťha 1; Ondřej Auzký 1; Karel Roztočil 2
Authors‘ workplace: Laboratoř pro výzkum aterosklerózy Centra experimentální medicíny IKEM Praha, přednosta prof. MUDr. Luděk Červenka, CSc., MBA 1; Klinika transplantační chirurgie IKEM Praha, přednosta MUDr. Jiří Froněk, Ph. D., FRCS 2
Published in: Vnitř Lék 2014; 60(11): 985-989
Category: Reviews
Overview
Žilní a arteriální onemocnění zřejmě mohou mít řadu společných rizikových faktorů. Z hlediska patofyziologického se zřejmě jedná o podobný mechanizmus poškození cévní stěny, na jehož počátku jsou subklinické zánětlivé změny. Mechanizmus vzniku život ohrožujících trombotických příhod může být také podobný u obou skupin onemocnění, a to zejména selháním regulačních vlastností endotelu. Výsledky dosud publikovaných klinických a epidemiologických studií však zatím jednoznačné důkazy o společných faktorech vzniku a komplikací tepenných a žilních onemocnění nepřinesly. V našich studiích jsme zjistili častější výskyt nižšího poměru tlaků kotník/paže u žen s chronickým žilním onemocněním dolních končetin, nenalezli jsme však přímou souvislost mezi známkami preklinické aterosklerózy a výskytem žilních trombóz u pacientů s trombofilními stavy; u této skupiny však jsme však nalezli souvislost mezi tromboembolickými příhodami a hypertenzí. Tepenná i žilní onemocnění mohou tedy být příznivě ovlivněna již zavedenými léčebnými postupy zaměřenými na prevenci kardiovaskulárních onemocnění aterosklerotického původu. Důkazem možného společného ovlivnění tepenných a žilních onemocnění farmaky jsou výsledky rozsáhlé klinické studie, ve které došlo k významnému poklesu nejen kardiovaskulárních příhod, ale i tromboembolických žilních příhod při podávání rosuvastatinu. Dalším slibným lékem pro terapii jak žilních, tak tepenných onemocnění by mohl být glykosaminoglykan sulodexid.
Klíčová slova:
aterosklerotická kardiovaskulární onemocnění – chronická žilní onemocnění – rizikové faktory – trombotické příhodyÚvod
Co si myslíte, že zobrazuje obrázek, na kterém proniká monocyt mezi buňkami endotelu do cévní stěny? Jste-li kardiologové, angiologové, lipidologové, diabetologové či z jiné lékařské profese zaměřené především na léčbu tepenných onemocnění a aterosklerózy, budete přesvědčeni, že se jedná o tepnu a o počátek aterosklerotického procesu, při němž monocyty, potažmo jejich aktivované formy, makrofágy, pohlcují v subintimálním prostoru LDL částice, mění se v pěnové buňky, znehybní, hynou a rozpadají se. Jejich produkty typu metaloproteináz a dalších „útočných“ enzymů pak dále poškozují tepennou stěnu s její následnou dysfunkcí a vznikem aterosklerotických plátů, následně částečně či zcela obturujících tepenné lumen. Nicméně jste-li angiolog/flebolog, s jistotou označíte tento obrázek za ilustraci vstupu monocytu do žilní stěny, jeho aktivaci na makrofág, který svými produkty, opět především metaloproteinázami, poškozuje tentokrát stěnu žíly s následnou dysfunkcí žilní stěny a chlopenního aparátu, žilní insuficiencí, vznikem varikozit, pigmentací, ulcerací, vzácněji trombotických komplikací. Trombotické žilní komplikace navíc mohou vzniknout v žilním systému zcela samostatně a nezávisle na chronických žilních změnách, a to zřejmě při poruše funkce endotelu opět zánětlivými mechanizmy, jsou-li navíc přítomné další rizikové faktory trombózy jako oblenění žilního toku a hyperkoagulační stav cirkulující krve.
Image 1. Monocyt pronikající do cévní stěny – počátek aterosklerózy nebo žilního onemocnění? 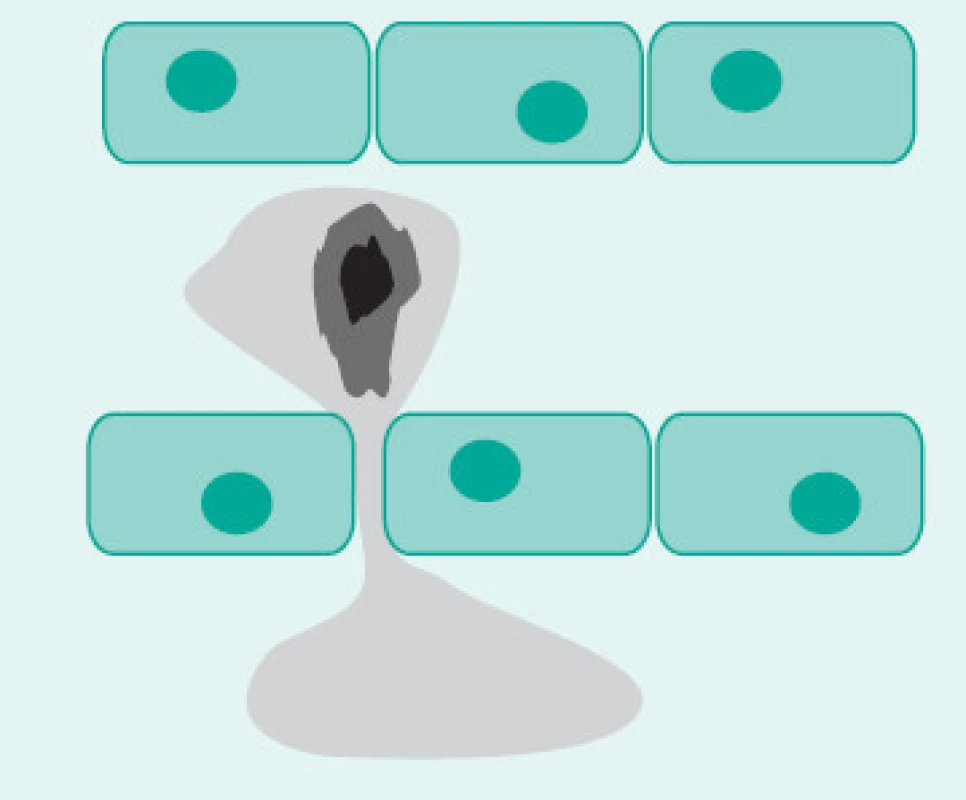
V populaci se uvedená tepenná i žilní onemocnění vyskytují doslova masově. Přitom snižují kvalitu života nebo jej přímo ohrožují. Jedná se tedy o jedna z nejzávažnějších onemocnění naší populace. K jejich léčbě a prevenci je však nutné znát co nejlépe mechanizmy jejich vzniku; řadu z nich přitom mohou obě skupiny onemocnění sdílet a identifikace těchto znaků by mohla pomoci vytipovat nejvíce ohrožené jedince a stanovit u nich optimální léčebný přístup. Znalosti v této oblasti sice nejsou zdaleka vyčerpávající, přesto je velmi pravděpodobné, že tepenná a žilní onemocnění skutečně sdílejí daleko více společných rysů než často matoucí společnou zkratku v angličtině: CVD (CardioVascular Disease × Chronic Venous Disease). Cílem tohoto článku je stručně shrnout dosavadní znalosti o možných společných rysech tepenných/aterosklerotických a žilních onemocnění.
Patofyziologické mechanizmy
Pokud bychom měli zjednodušeně odpovědět, co mají společného ateroskleróza a chronická žilní onemocnění, bylo by v tuto chvíli nejsprávnější odpovědí, že chronické a subklinické zánětlivé změny cévní stěny popsané v úvodu. V případě aterosklerózy postihuje zánět stěnu tepny na základě průniku monocytů/makrofágů a jejich interakce s modifikovanými LDL částicemi, které se do tepenné stěny dostávají z krevního oběhu při jejich nadměrném počtu v cirkulaci [1]. V případě chronického žilního onemocnění není provokující moment vstupu monocytů/makrofágů zcela objasněn, nejčastěji je uváděna žilní hypertenze, i když stále není jasné, v jakém kauzálním vztahu se zánět žilní stěny a žilní hypertenze nalézají [2]. Nelze vyloučit, že provokujícím faktorem postižení žilní stěny by mohly být i některé dyslipidemie [3].
Epidemiologie a klinické studie
Jak již bylo uvedeno, výskyt tepenných a žilních onemocnění je velice častý. Kardiovaskulární onemocnění aterosklerotického původu jsou stále hlavní příčinou úmrtnosti v našich zemích a zodpovídají za 45–50 % všech úmrtí mužů i žen [4]. V absolutních číslech zemřelo v naší zemi v roce 2011 (poslední dostupná data) jenom na ischemickou chorobu srdeční 13 000 mužů a 14 000 žen. Oficiální mortalitní data u tromboembolické choroby nemáme, ze stejného zdroje však vyplývá, že byla příčinou hospitalizace v přibližně 22 000 případů (z celkových 319 000 případů hospitalizací) [4]. Výskyt chronických žilních onemocnění také není v oficiálních statistikách dostupný. V řadě epidemiologických studií se výskyt v populaci odhaduje mezi 8–80 %, nejčastěji se udává číslo 25 %. Výrazný rozptyl je dán poměrně obtížnou klinickou definicí chronických žilních onemocnění [5–7].
Z hlediska souvislosti aterosklerotických změn a chronické žilní nedostatečnosti je k dispozici velmi málo studií zaměřených na neselektované populace. Jednou z největších je naše studie na populaci žen Prague Pre - and Postmenopausal Female Study (3PMFs), u kterých jsme analyzovali vztah poměru systolických tlaků kotník/paže ke známkám chronické žilní nedostatečnosti vyjádřeným jako subjektivní obtíže u téměř 1 000 žen z Prahy 4 [8]. Všechny účastnice vyplňovaly standardizovaný dotazník hodnocení příznaků chronického žilního onemocnění dolních končetin [9]. U žen se závažnými žilními příznaky byla oproti ženám bez příznaků nalezena významně vyšší prevalence patologických hodnot poměrů systolických tlaků na kotnících a pažích < 0,91. Ženy s příznaky byly oproti ženám bez příznaků starší, měly významně vyšší výskyt ischemické choroby srdeční, vyšší index tělesné hmotnosti, větší obvod pasu, vyšší hodnotu sérových triglyceridů, vyšší hodnotu sérového C-reaktivního proteinu a nižší hodnotu HDL-cholesterolu. Po standardizaci na věk přetrvával u symptomatických žen významně vyšší výskyt ischemické choroby srdeční, vyšší index tělesné hmotnosti, větší obvod pasu a vyšší sérové triglyceridy. Ženy se závažnými příznaky pak byly oproti ženám zcela bez příznaků starší, měly významně vyšší výskyt ischemické choroby srdeční a jiných onemocnění na podkladě aterosklerózy a byly častěji léčeny hypolipidemiky. Tyto rozdíly zůstaly významné i po standardizaci na věk. Prokázali jsme tedy, že příznaky chronických žilních onemocnění jsou spojeny s nepříznivými výsledky tlakového indexu kotník/paže, s vyšší incidencí rizikových faktorů aterosklerózy a s vyšší incidencí aterotrombotických komplikací. Možná souvislost chronického žilního onemocnění s nadváhou byla v naší populaci již popsána, a to jako primární a hlavní příčina vzniku žilních varixů i jako součást dalších onemocnění s těmito stavy spojenými [10].
Daleko větší pozornost než souvislosti tepenných a chronických žilních onemocnění je věnována souvislosti akutních forem aterosklerotického procesu typu infarktu myokardu a tromboembolické choroby. Je to logické, neboť tato onemocnění přímo ohrožují životy. Potřebu hledání nových netradičních rizikových faktorů jak tepenných, tak především žilních onemocnění podporuje skutečnost, že až 50 % případů žilních trombóz a plicních embolií nemá jasně definovanou příčinu [11–13]. Podobné procento se udává i pro kardiovaskulární příhody aterosklerotického původu, i když např. ve studii INTER-HEART bylo toto procento v případě infarktů myokardu pouze 10 % [14], pokud byla sledována poměrně rozsáhlá skupina rizikových faktorů. V prevenci žilních chorob a zvláště v prevenci tromboembolických příhod mohou hrát významnou roli právě klasické kardiovaskulární rizikové faktory, které jsou tradičně spojovány výhradně se vznikem aterosklerózy. K nim se v posledních letech přidala i především mírná forma renálních onemocnění; i u nich byla nedávno v 5 spojených prospektivních studiích zjištěna souvislost s žilními tromboembolickými příhodami [15].
Ovlivnění těchto rizikových faktorů, především obezity a hypertenze, může (např. u nemocných s trombofilními stavy) snížit riziko žilní tromboembolické příhody. Ačkoliv má hodnocení vlivu preklinické aterosklerózy na zvýšení prokoagulačních mechanizmů a následně na zvýšení rizika žilní trombózy jistě patofyziologické opodstatnění, je nutné k definitivnímu potvrzení či vyloučení přítomnosti vztahu preklinické aterosklerózy a tromboembolických příhod a ke zlepšení rizikové stratifikace nemocných s trombofiliemi získat další informace především z rozsáhlejších prospektivních studií zaměřených i na specifické vysoce rizikové skupiny pacientů a na odpovídající spektrum rizikových faktorů. Data v této oblasti nejsou však stále zdaleka jednoznačná. V řadě studií byla prokázána souvislost kardiovaskulárních onemocnění aterosklerotického původu nebo jejich rizikových faktorů s tromboembolickými komplikacemi [16–21], v dalších však toto prokázáno nebylo [22–25]. V rozsáhlé metaanalýze však vztah některých kardiovaskulárních faktorů a žilní trombózy nalezen byl, jak zobrazuje tab. 1 dle Ageno W et al [18]. Téměř všechny tyto práce vycházely z obecné populace. V našich vlastních studiích jsme se zaměřili na (z hlediska tromboembolických komplikací) vysoce rizikové pacienty s trombofilními stavy a známky preklinické aterosklerózy sledované ultrazvukem. Ani v této skupině jsme sice nenašli výraznou souvislost tromboembolických příhod s preklinickými známkami aterosklerózy – na rozdíl od podobné studie slovinských autorů [26,27] – nalezli jsme ale souvislosti s klasickými rizikovými faktory: hypertenzí a nadváhou [28]. Ani v následné longitudinální studii jsme však souvislost tromboembolických příhod s progresí preklinických známek aterosklerózy, změnami v prevalenci hypertenze, s podáváním inhibitorů 3-hydroxy-3-metylglutarylkoenzym A-redukázy (statinů) ani se změnami dalších hlavních rizikových faktorů kardiovaskulárních onemocnění neprokázali [29].
Table 1. Asociace rizikových faktorů aterosklerózy a rizika žilního tromboembolizmu. Upraveno podle Ageno W et al [18] ![Asociace rizikových faktorů aterosklerózy a rizika žilního tromboembolizmu. Upraveno podle Ageno W et al [18]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/b3c2ec7859f5c242544885b9c2a63707.jpg)
Nepřímým, ale poměrně silným důkazem je současné ovlivnění obou onemocnění v placebem kontrolovaných intervenčních studiích. Tento důkaz máme nyní u statinů, konkrétně u rosuvastatinu použitého ve studii JUPITER (Justification for the Use of Statin in Prevention: An Intervention Trial Evaluating Rosuvastatin), v níž kromě redukce kardiovaskulárních příhod došlo i k redukci výskytu tromboembolických komplikací [30]. Tento účinek nebyl závislý na hypolipemických účincích, a proto se nabízí v této skupině léků popsaný účinek převážně protizánětlivý. To dále podporuje hypotézu zmíněnou na počátku tohoto článku o subklinickém difuzním cévním zánětu jako společném jmenovateli aterosklerotických tepenných a žilních onemocnění.
Mezi léky používané s úspěchem u chronických žilních onemocnění a zároveň zvažované i k léčbě tepenných onemocnění aterosklerotického původu patří i glykosaminoglykan sulodexid [31,32], který zlepšuje reologické vlastnosti krve, má i antitrombotické účinky a dle některých studií by mohl snižovat i celkový výskyt kardiovaskulárních příhod. Nejspolehlivější data máme zatím pro tento lék především u léčby venózních onemocnění. Nicméně byl popsán i jeho příznivý účinek např. na klaudikační interval u pacientů s ischemickou chorobou dolních končetin [32]. Z hlediska dalších léčebných postupů pro tepenná i žilní onemocnění jsou k dispozici i práce na menším počtu pacientů, které prokazují příznivý efekt perkutánní intervence u stenotických tepen dolních končetin na hojení ulcerací způsobených chronickou žilní insuficiencí [33]. Na opačném konci spektra léčebných metod pak stojí režimová opatření; na větším počtu osob bylo prokázáno, že dieta doporučovaná k prevenci kardiovaskulárních onemocnění snižuje i výskyt tromboembolických příhod [34].
Závěr
I když jsou choroby tepen a žil často vnímány jako dvě zcela oddělené entity bez vzájemných souvislostí, ukazuje se, že vykazují řadu společných patofyziologických mechanizmů a sdílejí řadu společných rizikových faktorů. Na počátku obou onemocnění stojí zřejmě subklinický zánět, při kterém dochází k poškození tepenné či žilní stěny monocyty/makrofágy a jejich produkty, především metaloproteinázami. Pro tepenná i pro žilní onemocnění je dále charakteristická narušená funkce endotelu a přítomnost rizikových faktorů, jako je nadváha, hypertenze, kouření, diabetes mellitus a dyslipidemie. Některé z uvedených rizikových faktorů byly dříve zmiňovány výhradně v souvislosti s aterosklerózou, nověji se však ukazuje, že představují riziko i pro onemocnění žilní.
Z hlediska klinického využití by tedy mohly být obě skupiny onemocnění příznivě ovlivněny již zavedenými léčebnými postupy zaměřenými na prevenci kardiovaskulárních onemocnění – redukcí váhy, vhodnou fyzickou aktivitou, dietou s dostatečným množstvím zeleniny, kontrolou krevního tlaku a dyslipidemie. Navíc máme k dispozici zajímavá data z hlediska účinnosti jedné skupiny hypolipemik – statinů, která by také mohla zásadně ovlivnit jak proces aterosklerózy, tak patologické změny v žilní stěně vedoucí k tromboembolickým příhodám. V případě žilních onemocnění se však zřejmě u statinů uplatňují především jejich účinky protizánětlivé. Nově diskutovaným lékem, který by mohl příznivě ovlivnit jak tepenné, tak žilní onemocnění, je sulodexid, který má zřejmě výrazné protektivní účinky na endotel jak v tepenných, tak v žilních řečištích. Na úplný závěr si dovoluje přehledně shrnout možné společné mechanizmy a vývoj tepenných a žilních onemocnění na schématu.
Schéma. Společné mechanizmy vzniku aterosklerotického procesu a žilních onemocnění 
ICHS – ischemická choroba srdeční ICHDK – ischemická choroba dolních končetin ICMP – ischemické cévní mozkové příhody TEN – tromboembolická nemoc Tato práce byla podpořena grantem NT/12185–5/2011 a prostředky z Evropské komise – program „CEVKOON“ (č. CZ.2.16/3.1.00/22126).
MUDr. Jan Piťha, CSc.
japi@ikem.cz
Laboratoř pro výzkum aterosklerózy Centra experimentální medicíny IKEM, Praha
www.ikem.cz
Doručeno do redakce: 6. 10. 2014
Přijato po recenzi: 14. 10. 2014
Sources
1. Libby P. Inflammation in atherosclerosis. Arterioscler Thromb Vasc Biol 2012; 32(9): 2045–2051.
2. Raffetto JD, Mannello F. Pathophysiology of chronic venous disease. Int Angiol 2014; 33(3): 212–221.
3. Vaya A, Mira Y, Ferrando F et al. Hyperlipidaemia and venous thromboembolism in patients lacking thrombophilic risk factors. Br J Haematol 2002; 118(1): 255–259.
4. Zdravotnická ročenka České republiky. UZIS ČR: Praha. ISSN 1210–9991. Dostupné z WWW: <http://www.uzis.cz/katalog/rocenky/zdravotnicka-rocenka-ceske-republiky>.
5. Lattimer CR. CVD: a condition of underestimated severity. Int Angiol 2014; 33(3): 222–228.
6. Eberhardt RT, Raffetto JD. Chronic venous insufficiency. Circulation 2014; 130(4): 333–346.
7. Rabe E, Guex JJ, Puskas A et al. Coordinators: Epidemiology of chronic venous disorders in geographically diverse populations: Results from the Vein Consult Program. Int Angiol 2012; 31(2): 105–115.
8. Auzky O, Lanska V, Pitha J et al. Association between symptoms of chronic venous disease in the lower extremities and cardiovascular risk factors in middle-aged women. Int Angiol 2011; 30(4): 335–341.
9. Erevnidou K, Launois R, Katsamouris A et al. Translation and validation of a quality of life questionnaire for chronic lower limb venous insufficiency into greek. Int Angiol 2004; 23(4): 394–399.
10. Musil D, Herman J. Příčina klinických projevů chronické žilní nedostatečnosti u pacientů s nadváhou a obezitou. Vnitř Lék 2005; 51(5): 523–528.
11. White RH, Zhou H, Romano PS. Incidence of idiopathic deep venous thrombosis and secondary thromboembolism among ethnic groups in California. Ann Intern Med 1998; 128(9): 737–740.
12. Nordstrom M, Lindblat B, Bergquist D et al. A prospective study of the incidence of deep-vein thrombosis within a defined urban population. J Intern Med 1992; 232(2): 155–160.
13. Cushman M, Tsai AW, White RH et al. Deep vein thrombosis and pulmonary embolism in two cohorts: the longitudinal investigation of thromboembolism etiology. Am J Med 2004; 117(1): 19–25.
14. Yusuf S, Hawken S, Ounpuu S et al. INTERHEART Study Investigators. Effect of potentially modifiable risk factors associated with myocardial infarction in 52 countries (the INTERHEART study): case-control study. Lancet 2004; 364(9438): 937–952.
15. Mahmoodi BK, Gansevoort RT, Næss IA et al. Association of mild to moderate chronic kidney disease with venous thromboembolism: pooled analysis of five prospective general population cohorts. Circulation 2012; 126(16): 1964–1971.
16. Bova C, Marchiori A, Noto A et al. Incidence of arterial cardiovascular events in patients with idiopathic venous thromboembolism. A retrospective cohort study. Thromb Haemost 2006; 96(2): 132–136.
17. Prandoni P, Bilora F, Marchiori A et al. An association between atherosclerosis and venous thrombosis. N Engl J Med 2003; 348(15): 1435–1441.
18. Ageno W, Becattini C, Brighton T et al. Cardiovascular risk factors and venous thromboembolism: a meta-analysis. Circulation 2008; 117(1): 93–102.
19. Hong C, Zhu F, Du D et al. Coronary artery calcification and risk factors for atherosclerosis in patients with venous thromboembolism. Atherosclerosis 2005; 183(1): 169–174.
20. Migliacci R, Becattini C, Pesavento R et al. Endothelial dysfunction in patients with spontaneous venous thromboembolism. Haematologica 2007; 92(6): 812–818.
21. Bova C, Marchiori A, Noto A et al. Incidence of arterial cardiovascular events in patients with idiopathic venous thromboembolism. A retrospective cohort study. Thromb Haemost 2006; 96(2): 132–136.
22. van der Hagen PB, Folsom AR, Jenny NS et al. Subclinical atherosclerosis and the risk of future venous thrombosis in the Cardiovascular Health Study. J Thromb Haemost 2006; 4(9): 1903–1908.
23. Reich LM, Folsom AR, Key NS et al. Prospective study of subclinical atherosclerosis as a risk factor for venous thromboembolism. J Thromb Haemost 2006; 4(9): 1909–1913.
24. Bilora F, Boccioletti V, Petrobelli F et al. Atherosclerosis and secondary deep vein thrombosis: a difficult correlation. Clin Appl Thromb Hemost 2003; 9(2): 121–124.
25. Tsai AW, Cushman M, Rosamond WD et al. Cardiovascular risk factors and venous thromboembolism incidence: the longitudinal investigation of thromboembolism etiology. Arch Intern Med 2002; 162(10): 1182–1189.
26. Jezovnik MK, Poredos P, Stalc M. Impairment of the vasodilatation capability of the brachial artery in patients with idiopathic venous thrombosis. J Atheroscler Thromb 2010; 17(11): 1190–1198.
27. Jezovnik MK, Poredos P, Lusa L. Idiopathic venous thrombosis is associated with preclinical atherosclerosis. J Atheroscler Thromb 2010; 17(3): 304–311.
28. Auzký O, Pagáčová L, Sejda T et al. Preclinical atherosclerosis and other determinants of venous thromboembolism in patients with thrombophilias. Physiol Res 2010; 59(5): 721–728.
29. Auzký O, Dembovská R, Mrázková J. Relation between preclinical atherosclerosis and venous thromboembolism in patients with thrombophilias – longitudinal study. Physiol Res 2014; 63. Přijato do tisku 2014.
30. Glynn RJ, Danielson E, Fonseca FA et al. A randomized trial of rosuvastatin in the prevention of venous thromboembolism. N Engl J Med 2009; 360(18): 1851–1861.
31. Roztocil K, Antignani PL. Sulodexide: it is time for a program against chronic venous disease. Int Angiol 2014; 33(3): 209–211.
32. Coccheri S, Mannello F. Development and use of sulodexide in vascular diseases: implications for treatment. Drug Des Devel Ther 2013; 8 : 49–65.
33. Lantis JC 2nd, Boone D, Lee L et al. The effect of percutaneous intervention on wound healing in patients with mixed arterial venous disease. Ann Vasc Surg 2011; 25(1): 79–86.
34. Steffen LM, Folsom AR, Cushman M et al. Greater fish, fruit, and vegetable intakes are related to lower incidence of venous thromboembolism: the Longitudinal Investigation of Thromboembolism Etiology. Circulation 2007; 115(2): 188–195.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2014 Issue 11-
All articles in this issue
- Nový SGLT2 inhibitor empagliflozin: moderní a bezpečná léčba diabetu
- Prevence kardiovaskulárních onemocnění v běžné klinické praxi: lze dosáhnout zlepšení?
- Markery reziduálního kardiovaskulárního rizika
- Nové pohledy na hormonální substituční terapii
- Novinky v oblasti hypolipidemické léčby
- Nefarmakologická léčba – výsledky z Poděbrad
-
Familiární hypercholesterolemie včera a dnes.
Vlastní zkušenosti a nálezy u našeho souboru nemocných s familiární hypercholesterolemií - LDL-aferéza v léčbě familiárních hyperlipoproteinemií
- Rozšiřující se možnosti antikoagulační léčby tromboembolické nemoci
- Co mají společného žilní a tepenná onemocnění?
- Kardiovaskulární rizikový profil u 40letých mužů a 50letých žen v České republice: výsledky průřezové studie
-
Adherence pacientů s diabetem 2. typu k aplikaci inzulinových analog: vynechávání, časový posun a snižování dávek
Výsledky průzkumu GAPP2TM (Global Attitudes of Patient and Physicians) v České republice
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Nové pohledy na hormonální substituční terapii
- LDL-aferéza v léčbě familiárních hyperlipoproteinemií
- Nový SGLT2 inhibitor empagliflozin: moderní a bezpečná léčba diabetu
- Rozšiřující se možnosti antikoagulační léčby tromboembolické nemoci
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

