-
Medical journals
- Career
Goodův syndrom (s thymomem spojená hypogamaglobulinemie) – 2 kazuistiky
Authors: P. Králíčková 1; R. Slezák 2; M. Vošmik 3; P. Malá 3; H. Hornychová 4; J. Brožík 5; B. Melichar 6
Authors‘ workplace: Ústav klinické imunologie a alergologie Lékařské fakulty UK a FN Hradec Králové, přednosta prof. RNDr. Jan Krejsek, CSc. 1; Stomatologická klinika Lékařské fakulty UK a FN Hradec Králové, přednosta doc. MUDr. Radovan Slezák, CSc. 2; Klinika onkologie a radioterapie Lékařské fakulty UK a FN Hradec Králové, přednosta prof. MUDr. Jiří Petera, Ph. D. 3; Fingerlandův ústav patologie Lékařské fakulty UK a FN Hradec Králové, přednosta prof. MUDr. Aleš Ryška, Ph. D. 4; Radiologická klinika, Fakultní nemocnice a Lékařská fakulta UK v Hradci Králové, prof. MUDr. Pavel Eliáš, CSc. 5; Onkologická klinika, Fakultní nemocnice a Lékařská fakulta Olomouc, prof. MUDr. Bohuslav Melichar, Ph. D. 6
Published in: Vnitř Lék 2012; 58(2): 154-161
Category: Case Reports
Overview
Ačkoli jsou nádory thymu vzácné, zaujímají významné postavení mezi nádory postihující horní přední mediastinum. Obvykle vykazují indolentní chování, mohou však prorůstat do okolních struktur, metastazují jen raritně. Klinicky významné jsou jejich paraneoplastické projevy často se manifestující jako autoimunitní komplikace (nejčastěji myastenie či cytopenie) anebo jako kombinovaný imunodeficit. Článek popisuje 2 případy nemocných s thymomem spojené se sekundární imunodeficiencí neboli Goodovým syndromem. První případ se primárně manifestoval symptomatickým kombinovaným imunodeficitem s orálním lichen planus. Nález thymomu byl náhodný. Imunodeficit vyžadoval dlouhodobou substituční léčbu intravenózními imunoglobuliny, a to i po úspěšném chirurgickém odstranění vlastního nádoru. Druhý případ byl naopak diagnostikován na základě klinických projevů lokálního růstu nádoru. Druhotně zjištěný imunodeficit vyžadoval profylaktické podávání antibiotik.
Klíčová slova:
thymom – kombinovaný imunodeficit – Goodův syndrom – lichen planusÚvod
Thymomy jsou nádory vzniklé neoplastickou transformací epiteliálních buněk thymu. Objevují se nejčastěji v horním předním mediastinu, ale mohou se vyskytnout též na krku či dalších regionech mediastina. Jde obvykle o pomalu rostoucí nádory, které většinou netvoří vzdálené metastázy. Typicky se onemocnění objevuje až po 40. roce věku, u dětí a adolescentů se vyskytuje vzácně [1,2].
Asi u 1/2 nemocných bývá thymom zcela asymptomatický a je náhodně nalezen při vyšetřeních zobrazovacími metodami, nejčastěji výpočetní tomografií (CT). U části pacientů na sebe nádor upozorní lokálními komplikacemi, jako jsou kašel, bolesti na hrudi, dysfagické obtíže, dyspnoe, chrapot, syndrom horní duté žíly či Hornerův syndrom (mióza, ptóza, enoftalmus) [3–5]. Poměrně často je však diagnostikován na základě projevů svého paraneoplastického působení (myasthenia gravis, hypogamaglobulinemie, tzv. Goodův syndrom, čistá aplazie červené řady atd.) [6].
Popis případu č. 1
Šedesátiletá žena s anamnézou arteriální hypertenze, hyperlipoproteinemie a ischemické choroby srdeční byla vyšetřena na stomatologické klinice pro několik měsíců trvající výrazné potíže v dutině ústní ve smyslu bolestí ústní sliznice při příjmu potravy, provázených výrazným váhovým úbytkem (asi 9 kg během posledních 6 měsíců). V této době byla léčena v místě bydliště bez jakéhokoli efektu lokálně antiseptiky (chlorhexidin, genciánová violeť), antiflogistiky (benzydamin) a bakteriálním lyzátem. Při vyšetření byl v dutině ústní nalezen nekompletní sanovaný chrup a zcela mírná plakem podmíněná gingivitida. Na sliznici hřbetu i spodní plochy jazyka a na bukání sliznici byl dobře patrný erytém, různě rozsáhlé, bolestivé eroze v různém stupni hojení a jen nevýrazné bělavé retikulární formace (obr. 1). Klinický nález svědčil pro diagnózu orálního lichen planus (OLP). Tato diagnóza byla verifikována histologickým vyšetřením vzorku ústní sliznice (obr. 2). Pacientka byla léčena lokálně kortikosteroidy. V pozdější době však opakovaně docházelo k atakám stomatitidy, pro něž bylo nutné podávat kortikosteroidy v depotní formě do měkkých tkání (triamcinolon, betametason) i celkově (metylprednisolon), a to v nárazových dávkách 24–32 mg/den po dobu několika týdnů, s následnou dlouhodobou udržovací terapií 8–4 mg/den. Období remisí trvalo několik týdnů až měsíců. Opakovaně byly rovněž léčeny recidivy orální kandidózy (hexetidin, chlorhexidin, itrakonazol).
Image 1. Orální lichen planus (kazuistika 1). Pohled na pravou stranu jazyka pacientky s projevy orálního lichen planus v podobě depapilované sliznice, erytému a vícečetných erozí. Na hřbetu jazyka a na červeni dolního rtu viditelné diskrétní bělavé hyperkeratózy. 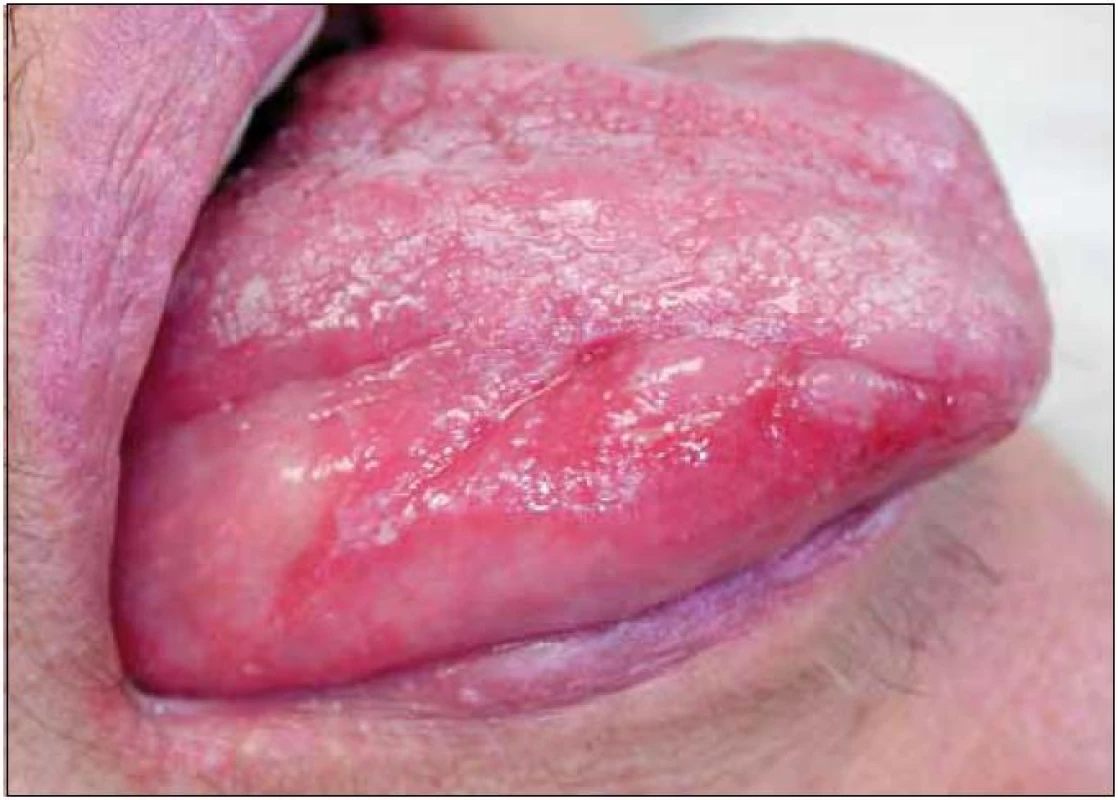
Image 2. Histologický nález kompatibilní s diagnózou orální lichen planus (kazuistika 1). 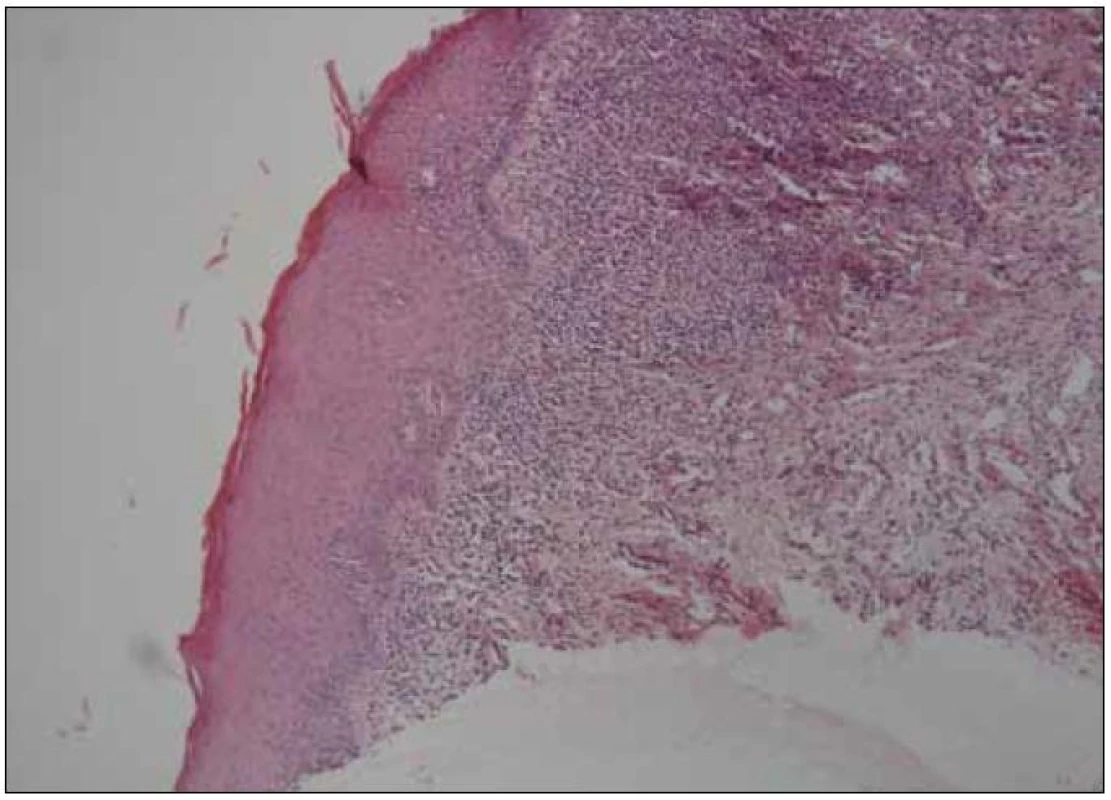
Současně se u pacientky postupně začala zvyšovat frekvence infekcí horních cest dýchacích a průdušek, a proto byla odeslána k imunologickému vyšetření. Při somatickém vyšetření byl, až na obezitu (BMI 32,3), konstatován fyziologický nález. Provedené laboratorní testy potvrdily přítomnost imunodeficitu. Byla zjištěna snížená sérová hladina imunoglobulinů ve všech třídách: IgG 2,63 g/l (norma 7,3–19,5 g/l), IgA 0,76 g/l (norma 0,80–4,80 g/l), IgM 0,24 g/l (norma 0,40–3,0 g/l). Byla zaznamenána i snížená tvorba izohemaglutininů (při krevní skupině 0 byl titr anti-A 1 : 8 a titr anti-B pouze 1 : 2). Následně doplněné očkování pomocí vakcín Pneumo23 (Sanofi Pasteur S. A, Francie) a Altanea (SEVAPHARMA, a. s., Česká republika) potvrdilo i neschopnost tvorby specifických protilátek. Při hodnocení buněčných subpopulací byl prokázán významně nízký absolutní počet B-lymfocytů 0,04 × 109/l (norma 0,13–0,33 × 109/l) a současně pak i snížen absolutní počet CD8+ T-lymfocytů 0,18 × 109/l (norma 0,30–1,00 × 109/l). Doplněné funkční testy prokázaly sníženou odpovídavost T-lymfocytů na mitogen fytohemaglutinin: časná aktivace za 24 hod 30,9 % (norma 42,0–67,9 %), pozdní aktivace za 48 hod 13,2 % (norma 32,9–49,9 %). Krevní obraz vylučoval cytopenii: celkový počet leukocytů 6,1 × 109/l (norma 3,9–9,4 × 109/l), erytrocyty 4,64 × 1012/l (norma 3,9–5,1 × 1012/l), hemoglobin 127 g/l (norma 120–162 g/l), trombocyty 307 × 109/l (norma 150–396 × 109/l). Nebyla zachycena autoimunitní reaktivita – antinukleární protilátky (ANA), autoprotilátky proti extrahovatelným nukleárním antigenům (ENA), autoprotilátky proti antigenům cytoplazmatických granulí (ANCA), protilátky proti tyreoglobulinu či tyreoperoxidáze byly všechny negativní. Následně doplněné CT hrudníku po intravenózní aplikaci kontrastní látky prokázalo přítomnost dobře ohraničeného útvaru v horním předním mediastinu o velikosti 40 × 27 × 20 mm (obr. 3).
Image 3. CT hrudníku v arteriální fázi po intravenózní aplikaci kontrastní látky: laločnatá dobře ohraničená expanze v předním mediastinu s lehce nehomogenní opacifikací po aplikaci o velikosti 40 × 27 × 20 mm (kazuistika 1). 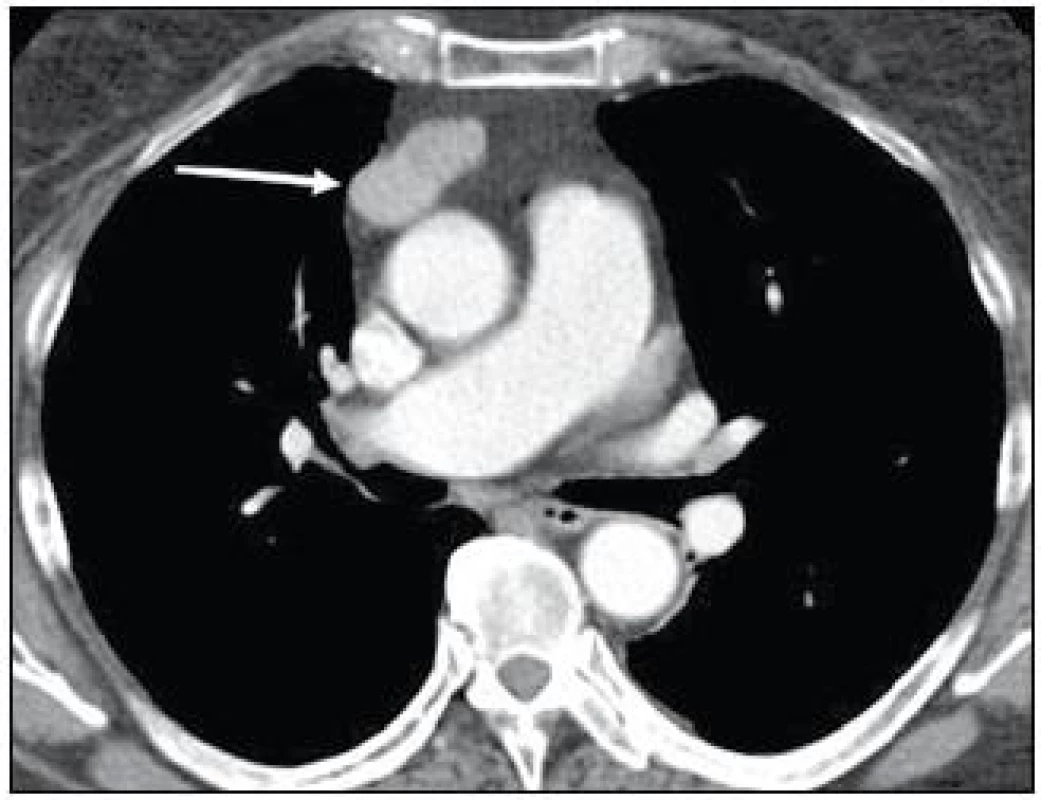
Pro symptomatický imunodeficit byla zahájena substituční terapie i.v. imunoglobuliny v dávce 200 mg/kg/měsíc s dobrou klinickou odezvou. S odstupem času se pacientka podrobila nekomplikovanému chirurgickému odstranění útvaru předního mediastina. Histologické vyšetření prokázalo, že se jednalo o metaplastický thymom (vyšší podíl vřetenobuněčné složky s vyšší mitotickou aktivitou, tedy s hraničním maligním potenciálem) (obr. 4), stadium I dle Masaoky.
Image 4. Metaplastický thymom, vpravo dole detail (kazuistika 1). 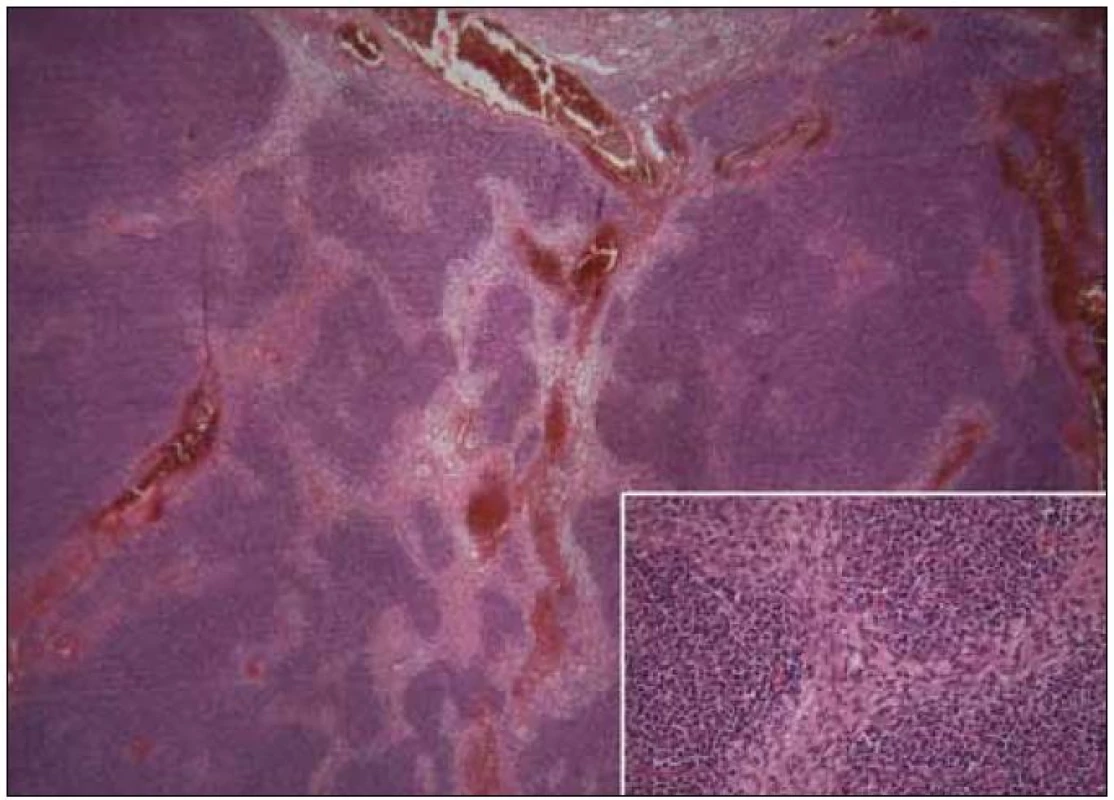
Rok po provedené thymektomii je pacientka ve velmi dobré zdravotní kondici, bez četnějších infekcí. K úpravě přítomného imunodeficitu však nedošlo, naopak se v periferní krvi prohloubila lymfopenie s poklesem relativního zastoupení lymfocytů z 18 % na 5 % (norma 25–45 %), v absolutních počtech z 1,3 × 109/l na 0,52 × 109/l (norma 1,0–4,0 × 109/l). S tím je úzce spjat i pokles absolutního počtu CD8+ T-lymfocytů z předoperačních 0,16 × 109/l na 0,08 × 109/l po operaci a CD4+ T-lymfocytů z 0,55 × 109/l na 0,18 × 109/l (norma 0,5–1,5 × 109/l). Z těchto důvodů pacientka i nadále podstupuje pravidelnou substituční léčbu i.v. imunoglobuliny a je nově indikována dlouhodobá profylaxe kombinací sulfamethoxazol/trimethoprim. Stejně tak nedošlo ani k plnému zhojení orálního lichenu. Intermitentní mírné potíže spojené s exacerbacemi slizničního postižení v podobě erytému a drobných erozí vyžadují trvalé podávání udržovací dávky kortikosteroidu.
Popis případu č. 2
V druhém případě se jednalo o 78letou ženu léčenou na onkologické klinice pro thymom. V posledním roce byla opakovaně léčena antibiotiky pro infekce horních cest dýchacích a opakující se infekce močových cest.
Jednalo se rovněž o obézní pacientku (BMI v úvodu 34,4) léčenou pro arteriální hypertenzi a ischemickou chorobu srdeční (arytmickou formu s paroxyzmálním flutrem síní), dlouhodobě zajištěnou amiodaronem a digoxinem.
Primárně byla tato žena urgentně vyšetřena na interním oddělení pro rychle progredující námahovou dušnost. Na RTG snímku hrudníku bylo patrné ovoidní zastínění v oblasti pravého plicního hilu a rozšíření horního mediastina (obr. 5). CT hrudníku po intravenózní aplikaci kontrastní látky prokázalo objemnou laločnatou expanzi v předním mediastinu vyklenutou doprava, s těsným vztahem (a velmi pravděpodobnou invazí) k pleuře pravé plíce, přednímu perikardiálnímu recesu, ascendentní aortě a kmeni plicnice o celkové velikosti 80 × 40 × 65 mm (obr. 6a a 6b). Nemocná podstoupila chirurgický výkon s odstraněním nádorové masy za současné perikardektomie. Histologicky se jednalo o thymom typu B1 (obr. 7), stadia III dle Masaoky. Pooperačně byla doplněna adjuvantní radioterapie 50 Gy. Kontrolní CT vyšetření břicha po 2 letech neprokázalo lokální recidivu, byly však nalezeny cystické formace v oblasti pankreatu a solidní ložisko v játrech o velikosti 60 mm. Bylo vysloveno podezření na nádorovou duplicitu, či méně pravděpodobně, metastatické postižení při thymomu. V té době byl stav komplikován vznikem ileofemorální trombózy se současnou plicní embolizací. Následně bylo rozhodnuto s ohledem na věk a celkový stav nemocné od dalšího vyšetřování upustit a zahájit symptomatickou léčbu.
Image 5. RTG hrudníku: ovoidní zastínění v oblasti pravého plicního hilu o velikosti 57 × 39 mm a rozšíření horního mediastina. CT hrudníku viz obr. 6a a 6b (kazuistika 2). 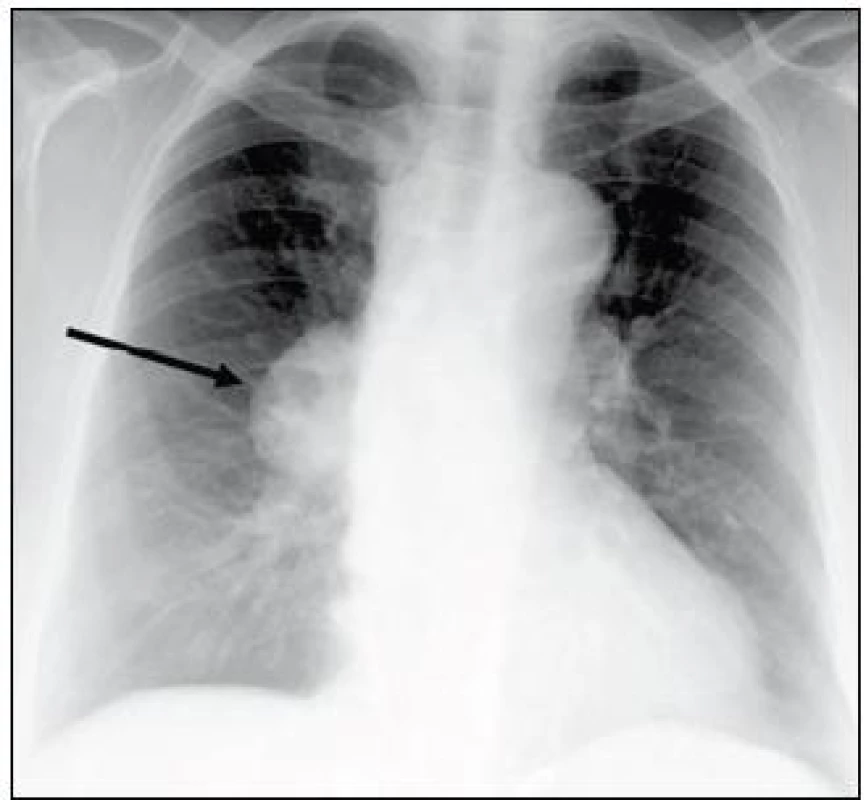
Obr. 6a, 6b. CT hrudníku: objemná laločnatá expanze v předním mediastinu vyklenující se doprava s těsným vztahem k pleuře pravé plíce, přednímu perikardiálnímu recesu, ascendentní aortě a kmeni plicnice o velikosti 80 × 40 × 65 mm (kazuistika 2). 
Image 6. Thymom B1, vlevo dole detail struktury, vpravo dole imunohistochemický průkaz cytokeratinů směsi ukazující epiteliální nádorovou složku (kazuistika 2). 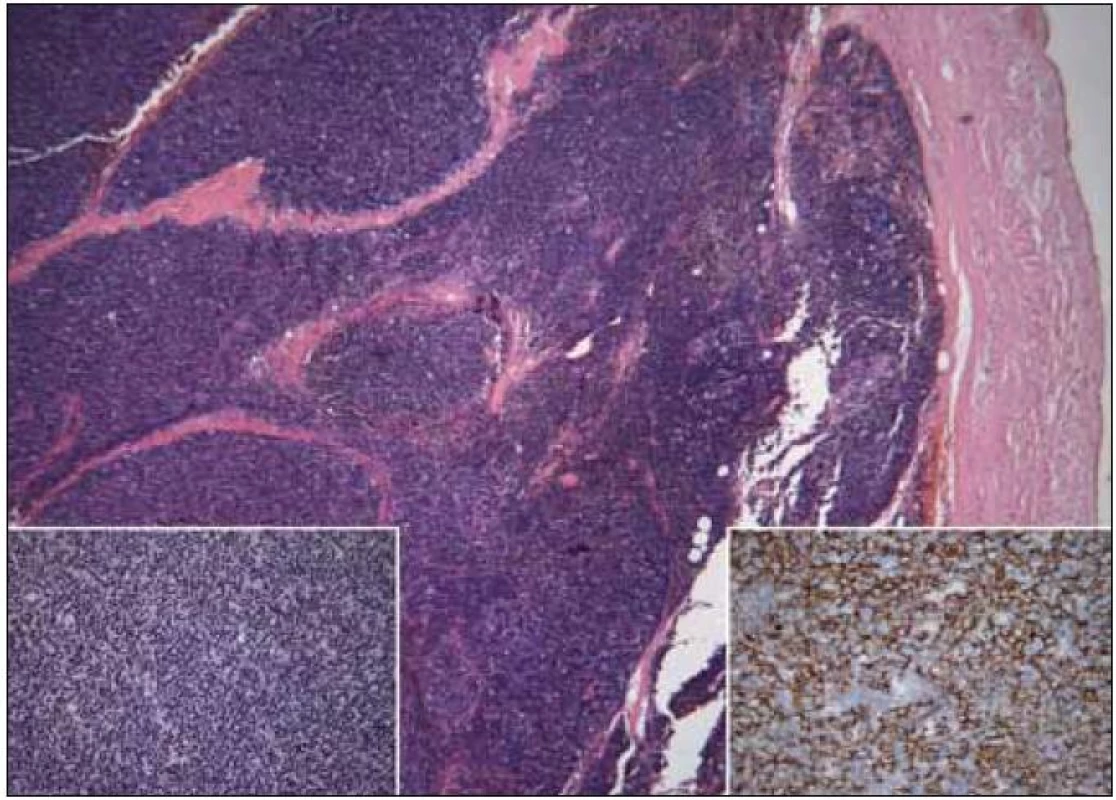
Pro výše zmíněné opakující se infekce byla nemocná konziliárně vyšetřena rovněž na imunologickém pracovišti. Laboratorní vyšetření prokázalo v periferní krvi významně nízký absolutní počet B-lymfocytů 0,01 × 109/l, beze změn v distribuci CD4+ či CD8+ T-lymfocytů, doprovázený lehkým snížení sérové hladiny imunoglobulinů ve 2 třídách (IgG 6,64 g/l a IgM 0,38 g/l). Krevní obraz stejně jako u prvního případu nepotvrdil přítomnost cytopenie (celkové leukocyty 8,25 × 109/l, erytrocyty 4,79 × 1012/l, hemoglobin 147 g/l, trombocyty 326 × 109/l). V normálních rozmezích byl zachován anamnestický titr specifických protilátek proti tetanickému toxoidu a pneumokokovému pouzdernému polysacharidu. Jako vedlejší nález, který neměl klinický korelát, byla zjištěna při vyšetření zvýšená hladina protilátek proti Saccharomyces cerevisiae (ASCA) ve třídě IgG 41,2 U/ml (norma 0–18 U/ml). Vyšetření ANA, ENA, ANCA, protilátek proti kardiolipinu, tyreoglobulinu a tyreoperoxidáze byla negativní.
S ohledem na celkový klinický stav a symptomatickou léčbu onkologického onemocnění byla z pohledu imunologa doporučena dlouhodobá profylaktická léčba antibiotiky.
Orální lichen planus (OLP)
OLP je relativně častým postižením ústní sliznice nejasného původu, jehož výskyt v současné populaci velmi pravděpodobně rychle vzrůstá. Většinou autorů je považován za uniformní slizniční reakci objevující se v dutině ústní jako součást dermatózy lichen ruber planus, projev chronické formy gaft versus host disease (GVHD), slizniční reakce na její lokální iritaci či senzibilizaci různými dentálními materiály, zejména stříbrným amalgamem (tzv. lichenoidní reakce). Může být rovněž projevem léky indukované slizniční reakce, vznikající nejspíše jako důsledek lékových interakcí na úrovni jaterního cytochromu P450 (např. tzv. Grinspanův syndrom zahrnuje orální lichen planus doprovázející diabetes mellitus a arteriální hypertenzi). Široce diskutovaný je v současné době možný imunopatologický podklad OLP. Erozivní forma lichenu patří společně s tzv. deskvamativní gingivitidou mezi terapeuticky nejobtížněji ovlivnitelné formy této chronické stomatitidy [7]. Asociace orálního lichen planus s Goodovým syndromem byla již opakovaně popsána [8–13]. Jistě se může jednat i o koincidenci obou těchto chorobných jednotek s přispěním lékových interakcí užívané medikace [14,15]. Naše nemocná v době diagnózy užívala pro arteriální hypertenzi nefedipin v kombinaci s amiloridem, tento vztah k OLP byl rovněž popsán [16]. Kombinovanou léčbu pro ischemickou chorobu srdeční pacientka užívá doposud (ramipril, metoprolol, trimetazid, isosorbit mononitras, acidum acetylsalicylicum, atorvastatin).
Diferenciální diagnóza lézí předního mediastina
Přední mediastinum je definováno jako prostor mezi sternem, perikardem, ascendentní aortou a větvemi oblouku aorty. Většinu lézí v této oblasti představují lymfadenopatie, nádory ze zárodečných buněk a útvary vycházející z thymu nebo štítné žlázy. Procesy související se štítnou žlázou a lymfadenopatie obvykle lze pomocí zobrazovacích metod dobře odlišit, a nepředstavují tak větší diagnostické obtíže. Nádory thymu a tumory ze zárodečných buněk mohou mít obdobný vzhled a jejich bližší diferenciaci pomáhá znalost klinických a laboratorních nálezů, jako je např. myasthenia gravis nebo zvýšená hladina α1-fetoproteinu a β podjednotky humánního choriového gonadotropinu (bHCG). Mezi méně obvyklé útvary v předním mediastinu patří adenom příštítných tělísek, lymfangiom (cystický hygrom), perikardiální cysta, aneuryzma, paragangliom, lipom, liposarkom a další mezenchymální nádory. Řada těchto útvarů může být odlišena na podkladě specifického CT nálezu. V případě pochybností je možné provést perkutánní biopsii z předního mediastina, optimálně pod CT kontrolou. V rámci diferenciální diagnostiky může být i užitečné PET nebo PET/CT vyšetření.
Histologická klasifikace nádorů thymu
Nádorové afekce thymu jsou relativně vzácné, patří však mezi nejčetnější nádory v oblasti mediastina. Představují kolem 20 % všech mediastinálních nádorů a více než 50 % všech nádorů předního mediastina u dospělých [4]. Jedná se o poměrně různorodou skupinu tumorů. WHO klasifikace z roku 2004 [17] rozděluje nádorové afekce na epiteliální, lymfomy a germinální tumory (seminom, neseminom). K paraneoplastickým příznakům popisovaným v tomto článku má vztah převážně skupina epiteliálních tumorů, které tvoří:
- thymom A (vřetenité epiteliální buňky bez lymfoidní komponenty),
- thymom B (lymfoidní komponenta jako u normální korové oblasti thymu, rozdělují se dále podle množství lymfoidní komponenty na thymomy B1 s převahou lymfoidní komponenty, thymomy B2 s vyrovnaným množstvím epiteliální i lymfoidní složky a thymomy B3 s převažující epiteliální komponentou),
- thymomy tvořené kombinací některých předcházejících variant (nejčastější z nich je AB thymom) nebo vzácné varianty jako metaplastický nebo mikronodulární thymom,
- skupina thymických karcinomů, nejčastější z nich je karcinom dlaždicobuněčný [17].
Na základě histologického obrazu mají dobrou prognózu thymomy skupiny A a B1 následované thymomem B2. Významně horší prognózu má thymom B3 a thymický karcinom [17]. Prognosticky se však větší váha přičítá spíše kompletnosti odstranění nádoru a stadiu dle Masaoky (tab. 1) než jeho histologickému subtypu [18].
Table 1. Stadium thymomu – klasifikace dle Masaoky, prognóza adekvátně léčených nemocných [3]. ![Stadium thymomu – klasifikace dle Masaoky, prognóza adekvátně léčených nemocných [3].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/9d4b298278635655598c2c07d0b26aef.png)
Léčba thymomu
Zásadní léčebnou modalitou pro nemocné ve stadiu I–III dle Masaoky je chirurgická resekce tumoru doplněná kompletní resekcí thymu za současného odstranění veškeré okolní tukové tkáně. Pokud to vyžaduje situace, je výkon navíc doplněn en block resekcí perikardu či pleury. Operace v tomto rozsahu dává potenciální možnost úplného uzdravení. V případě nedostatečných bezpečnostních okrajů či nemožnosti kompletní resekce je chirurgický výkon doplněn radioterapií. V případě stadia III při současně přítomné velké nádorové mase, která pravděpodobně adheruje k okolním orgánům, je vhodné uvážit možnost neoadjuvantní chemoterapie. Multimodální léčba pokročilých stadií zahrnuje kombinovanou chemoterapii. V léčbě thymomu se uplatňuje i hormonální léčba, která v tomto případě spočívá v podání kortikoidů. Klíčovou úlohu zde hrají léčebné režimy obsahující cisplatinu. Z dalších cytotoxických léků jsou to doxorubicin, vinkristin, cyklofosfamid. Nověji bývá cyklofosfamid nahrazován ifosfamidem a doxorubicin etoposidem (vzhledem k možné kardiotoxicitě antracyklinů). Vzhledem k relativně vzácnému výskytu thymomu se však léčebné postupy opírají většinou o menší studie s jedním ramenem a prakticky nemáme k dispozici randomizované studie. První zkušenosti s použitím cílené léčby zatím bohužel nesplnily očekávání [1,3,4,19].
Autoimunitní komplikace spojené s thymomem
Nejčastějším paraneoplastickým projevem vyskytujícím se ve spojitosti s existencí thymomu je myastenia gravis (MG) s frekvencí výskytu 30–50 % [20]. Pokud naopak hodnotíme procento výskytu thymomu u nemocných s MG, činí jeho podíl pouze 15 % [21]. Ve všech případech spojení MG s thymomem byla nalezena přítomnost protilátek proti acetylcholinovým receptorům [22]. U 80 % těchto nemocných byla navíc objevena sérová pozitivita protilátek proti tininu (velkému vláknitému svalovému proteinu) [23]. U části nemocných může být prokázána přítomnost sérových protilátek proti ryanodinovým receptorům na vápníkových kanálech sarkoplazmatického retikula [24].
Léčebně je v těchto případech primární metodou volby thymektomie. Ta však ve většině případů nevede k plnému vyléčení. Perioperačně je vhodné nemocného zajistit plazmaferézou či podáním imunoglobulinů s cílem minimalizovat riziko vzniku myastenické krize [25]. Z dlouhodobě podávaných léčiv jsou lékem první volby inhibitory acetylcholinesterázy. Ty je však často nutné kombinovat s imunosupresivy – kortikosteroidy, azathioprinem, cyklosporinem A, metotrexatem, mykofenolátem mofetilem, takrolimem či rituximabem [20,26]. Prognóza nemocných s MG ve spojitosti s thymomem je obecně považována za horší, avšak po provedení thymektomie se srovnává s nemocnými bez thymomu [24,27].
Nečetně bývá thymom doprovázen i dalšími neurologickými onemocněními, jimiž jsou neuromyotonie [28], limbická či kortikální encefalitida [28–30], subakutní ztráta sluchu, psychóza (ve spojení s anti-Hu protilátkami), poruchy spánku [22], Devicova choroba [31]. Akutní projevy neurologických komplikací dobře reagují na léčbu plazmaferézou.
Celé spektrum popsaných autoimunitních paraneoplazií může být však velmi široké. Z hematologických onemocnění byly popsány různé typy cytopenií s převahou čisté aplazie červené řady v 10–50 % [32]. Z dalších autoimunitních chorob byly popsány polymyozitida, nespecifické střevní záněty, systémový lupus erytematodes, různé formy glomerulonefritid. Histologicky se v případě nefropatie převážně jedná o onemocnění minimálních změn či fokálně segmentální glomerulosklerózu [33]. Byly zaznamenány i kožní a slizniční komplikace ve formě lichen planus [8–13], pemphigus, vitiligo, alopecie [6,22]. Publikován byl i kazuistický případ rozvoje multiorgánového postižení charakteru reakce štěpu proti hostiteli (GVHD) [34].
Imunodeficience spojená s thymomem (Goodův syndrom)
Goodův syndrom představuje kombinovanou (tedy buněčnou a zároveň i humorální) imunodeficienci postihující B - i T-lymfocyty. Jeho výskyt činí mezi nemocnými s thymomem asi 6–11 % [6,35].
Klinické projevy imunodeficitu
Klinicky se syndrom obvykle manifestuje mezi 4.–6. dekádou. Výskyt u mužů i žen je rovnocenný. Bývá přítomno poměrně významné zpoždění mezi počátkem klinických příznaků a diagnózou. Klinicky se manifestuje opakujícími se respiračními infekty, které jsou s ohledem na humorální imunodeficit způsobeny opouzdřenými mikroorganizmy (Haemophilus influanzae, Streptoccocus pneumoniae, Staphyloccocus aureus, Pseudomonas spp.) [6,35]. Díky poruše T-lymfocytárních funkcí se můžeme setkat i s infekcemi oportunními, zejména cytomegalovirovými [32,36–38] či kandidovými [39]. Byla popsána i komplikovaná postižení způsobená viry herpes simplex, herpes virus 6, varicella-zoster, herpes virus 8 (následně komplikováno vznikem Kaposiho sarkomu) [40] či parazitárním onemocněním vyvolanými Pneumocystis carini [41] a babeziózou [40].
Imunologické nálezy
Imunologické nálezy bývají poměrně variabilní. S ohledem na skutečnost, že se jedná o kombinovaný imunodeficit, změny zaznamenáváme jak ve složce buněčné, tak i humorální. Nejčastěji se setkáváme s hypogamaglobulinemií. Nekonstantně bývá přítomna i chabá vakcinační odpověď a snížená tvorba přirozených protilátek – izohemaglutininů. Typické, jak tomu bylo i u obou našich pacientek, jsou velmi nízké počty B-lymfocytů v periferní krvi. Četně se setkáváme i s abnormálním poměrem CD4+/CD8+ T-lymfocytů či se snížením podílu CD4+ T-lymfocytů, v některých případech provázených i funkčními odchylkami [6,35,42,43].
Patogeneze komplikací
V patogenezi vazby thymomu a hypogamaglobulinemie existuje stále mnoho nejasností. Možným vysvětlením může být abnormní cytokinová sekrece stromálními buňkami kostní dřeně, která ovlivňuje růst a vývoj thymických i B-lymfocytárních prekurzorů [44]. Druhým možným vysvětlením je vlastní paraneoplastické působení thymomu. Bylo zjištěno, že izolované T-lymfocyty nemocných s thymomem jsou in vitro schopny inhibovat produkci imunoglobulinů B-lymfocyty a růst preB-lymfocytů u zdravých jedinců [45]. V patogenezi autoimunitních komplikací se pravděpodobně uplatňuje přímá či nepřímá produkce autoprotilátek thymomem v kombinaci s poruchou vyzrávání T regulačních lymfocytů. Buňky thymomu jsou schopny produkovat protilátky proti cytokinům (anti IFNγ, anti IL-12) [46]. V této souvislosti si je vhodné uvědomit, že i po odstranění thymomu u řady nemocných nedochází k úpravě imunodeficitu (stejně jako u naší první nemocné). Ke vzniku imunodeficitu může naopak dojít i řadu let po provedené thymektomii (i přes vyloučení recidivy thymomu) [39,47]. Stejně tak se během let mohou přidat další autoimunitní komplikace. Příčinu je možné hledat v dlouhodobém přežívání autoreaktivních T-lymfocytů vzniklých v neoplastickém thymu [48].
Léčba nemocných s Goodovým syndromem
U nemocných s poruchou tvorby specifických protilátek a četnějším výskytem infekcí je indikována substituční léčba imunoglobuliny. Při snížení počtu CD4+ T-lymfocytů pod 200/µl je na místě profylaktické podání trimethoprimu či kombinace sulfamethoxazol//trimethoprim.
Prognóza nemocných s Goodovým syndromem
Obecně se zdá být prognóza nemocných s Goodovým syndromem horší ve srovnání s nemocnými s běžnou variabilní imunodeficiencí (CVID) či X-vázanou agamaglobulinemií. Dle studie jednoho centra za období 20letého sledování se 5 let od diagnózy dožívá pouze 70 % nemocných a po 10 letech žije pouze 33 % nemocných (ve srovnání se 100 %, resp. 95 % pacienty s CVID či X-vázanou agamaglobulinemií) [49]. Tato významná mortalita je především důsledkem infekčních, autoimunitních či hematologických komplikací. Obecně není přičítána thymomu samotnému.
Závěr
První případ ženy typického věku s nadváhou poukazuje na skutečnost, že paraneoplastické působení thymomu může předcházet vlastní diagnózu thymomu i o několik let. V našem případě byl thymom diagnostikován druhotně, až při pátrání po možných příčinách či komplikacích přítomného imunodeficitu. Imunodeficit vykazoval některé charakteristické rysy kombinovaného typu. Klinicky pacientka, kromě zvýšené frekvence infekcí horních cest dýchacích bakteriálního původu, trpěla četnou orální kandidózou, vyskytující se i bez souvislosti s předchozí léčbou antibiotiky, vyžadující kromě léčby místní i celkovou léčbu antimykotiky. Laboratorně je buněčný deficit podporován snížením podílu CD8+ T-lymfocytů, zachycenou sníženou sérovou hladinou specifických protilátek proti tetanickému toxoidu a nízkými výsledky aktivačních testů T-lymfocytů. Naše kazuistika dále upozorňuje na možnost, že ani úspěšné odstranění thymomu nemusí vést k úpravě imunodeficitu. Orální lichen planus považujeme spíše za další paraneoplastickou komplikaci základního onemocnění.
V druhém případě se jednalo o ženu trpící taktéž obezitou. Zde byl primárně diagnostikován thymom na podkladě obtíží z lokálního růstu. Na základě poučení z prvního případu byl imunodeficit zachycen již časně od začátku klinických projevů v rámci cíleného vyšetření, které bylo v naší nemocnici u nemocných s diagnózou thymomu zavedeno. Zde však s ohledem na věk a biologický stav nemocné byla zvolena cesta profylaktického podávání antibiotik.
Uvedenými popisy případů upozorňujeme na různorodost paraneoplastických projevů u nemocných postižených thymomy. Následná péče o ně pak vyžaduje úzkou mezioborovou spolupráci nejen mezi interními obory, chirurgií a neurologií, ale i stomatologií či kožním lékařstvím.
MUDr. Pavlína Králíčková
www.fnhk.cz
e-mail: kralickova.pavlina@fnhk.cz
Doručeno do redakce: 30. 6. 2011
Přijato po recenzi: 23. 9. 2011
Sources
1. Babičková L, Skřičková J. Thymom. In: Adam Z, Vorlíček J, Vaníček J et al. Diagnostické a léčebné postupy u maligních chorob. Praha: Grada 2004; 69–73.
2. Tomaszek S, Wigle DA, Keshavjee S et al. Thymomas: Review of current clinical practice. Ann Thorac Surg 2009; 87 : 1973–1980.
3. Wright CD. Management of thymomas. Crit Rev Oncol Hematol 2008; 65 : 109–120.
4. Rajan A, Giaccone G. Treatment of advanced thymoma and thymic carcinoma. Curr Treat Options Oncol 2008; 9 : 277–287.
5. Slováček L, Jebavý L, Kačerovský J. Thymom v klinické praxi. Interní medicína pro praxi 2005; 5 : 410–411.
6. Kelesidis T, Yang O. Goods syndrome remains a mystery after 55 years: A systemic review of scientific evidence. Clin Immunol 2010; 135 : 347–363.
7. Dřízhal I, Paulusová V. Orální lichen planus – současné poznatky. Čes Stom 2008; 108 : 35–38.
8. Kaku Y, Shimamoto N, Matsunaga H et al. Oral erosive lichen planus and alopecia areata with Good’s syndrome (thymoma with hypogammaglobulinaemia). Eur J Dermatol 2011; 21 : 124–125.
9. Hayashi A, Shiono H, Okumura M. Thymoma accompanied by lichen planus. Interact Cardiovasc Thorac Surg 2008; 7 : 347–347.
10. Bobbio A, Vescovi P, Ampollini L et al. Oral erosive lichen planus regression after thymoma resection. Ann Thorac Surg 2007; 83 : 1197–1199.
11. Seneschal J, Orlandini V, Duffau P et al. Oral erosive lichen planus and Good’s syndrome: just a coincidence or a direct link between two diseases. J Eur Acad Dermatol Venerol 2008; 22 : 506–507.
12. Moutasim KA, Poate TW, Setterfield JF et al. A case of vulvovaginal gingival lichen planus in association with Good’s syndrome. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2008; 105 : 57–60.
13. Lolis M, Levitt J. A case of oral lichen planus with Good syndrome. Dermatol Online J 2006; 12 : 28.
14. Bajaj DR, Khoso NA, Devrajani BR et al. Oral lichen planus: a clinical study. J Coll Physicians Surg Pak 2010; 20 : 154–157.
15. Habbab KM, Moles DR, Porter SR. Potential oral manifestations of cardiovascular drugs. Oral Dis 2010; 16 : 769–773.
16. Leibovici V, Zlotogorski A, Heyman A et al. Polymorphous drug eruption due to nefedipine. Cutis 1988; 41 : 367.
17. Travis WD, Brambilla E, Müller-Hermelink HK et al. Pathology and genetics of tumors of the lung, pleura, Thymus and heart. In: Travis WD, Brambilla E, Müller-Hermelink HK et al (eds). World Health Organization Classification of Tumours. Lyon: IARC Press 2004.
18. Masaoka A, Monden Y, Nakahara K et al. Follow-up study of thymomas with special reference to their clinical stages. Cancer 1981; 48 : 2485–2492.
19. Ciernik IF, Meier U, Lütolf UM. Prognostic factors and outcome of incompletely resected invasive thymoma following radiation therapy. J Clin Oncol 1994; 12 : 1484–1490.
20. Skeie GO, Romi F. Paraneoplastic myastenia gravis: immunological and clinical aspects. Eur J Neurol 2008; 15 : 1029–1033.
21. Keesey JC. Clinical evaluation and management of myastenia gravis. Muscle Nerve 2004; 29 : 484–505.
22. Evoli A, Minicuci GM, Vitaliani R et al. Paraneoplastic diseases associated with thymoma. J Neurol 2007; 254 : 756–762.
23. Yamamoto AM, Gajdos P, Eymard B et al. Anti-tinin antibodies in myastenia gravis: tight association with thymoma and heterogenity of nonthymoma patients. Arch Neurol 2001; 58 : 885–890.
24. Romi F, Skeie GO, Aarli JA et al. The sverity of myastenia gravis correlates with the serum concentration of tinin and ryanodine receptor antibodies. Arch Neurol 2000; 57 : 1596–1600.
25. Okumura M, Inoue M, Kadota Y et al. Biological implications of thymectomy for myastenia gravis. Surg Today 2010; 40 : 102–107.
26. Gold R, Schneider-Gold C. Current and future stabdards in treatment of myastenia gravis. Neurotherapeutics 2008; 5 : 535–541.
27. Bril V, Kojic J, Dhanani A. The long-term clinical outcome of myastenia gravis in patients with thymoma. Neurology 1998; 51 : 1198–1200.
28. Evoli A, Lo Monaco M, Marra R et al. Multiple paraneoplastic disease associated with thymoma. Neuromuscul Disord 1999; 9 : 601–603.
29. Khella SL, Souyah N, Dalmau J. Thymoma, myastenia gravis, encephalitis, and a novel anticytoplasmic neuronal antibody. Neurology 2007; 69 : 1302–1303.
30. Hammaoud K, Kandimala G, Warnack W et al. Multifocal paraneoplastic cortical encephalitis associated with myastenia gravis and thymoma. Arch Neurol 2009; 66 : 1407–1409.
31. Antoine JC, Camdessanché JP, Absi L et al. Devic disease and thymoma with anti-central nervous system and antithymus antibodies. Neurology 2004; 62 : 978–980.
32. Shiraishi J, Tsugata M, Masuda R et al. Type AB thymoma accompanied by pure red cell aplasia and Good syndrome with CMV infection of tumor cells. Pathol Int 2008; 58 : 489–493.
33. Karras A, deMontpreville V, Fakhouri F et al. Groupe d‘Etudes des Néphropathies Associées aux Thymomes. Renal and thymic pathology in thymoma-associated nephropathy: report of 21 cases and review of the literature. Nephrol Dial Transplant 2005; 20 : 1075–1082.
34. Wadhera A, Maverakis E, Mitsiades N et al. Thymoma-associated multiorgan autoimmunity: A graft-versus-host-like disease. J Am Acad Dermatol 2007; 57 : 683–689.
35. Kelleher P, Misbah SA. What is Good’s syndome? Immunological abnormalities in patients with thymoma. J Clin Pathol 2003; 56 : 12–16.
36. Koriyama N, Fukumoto O, Fukudome M et al. Successful treatment of Good syndrome with cytomegalovirus duaodenoenteritis using a combination of ganciclovir and immunoglobuin with high anti-cytomegaovirus antibody titer. Am J Med Sci 2004; 327 : 49–54.
37. Sen HN, Robinson MR, Fisher SH. CMV retinitis in patient with Good syndrome. Ocul Immunol Inflamm 2005; 13 : 475–478.
38. Striano P, Tortora F, Evoli A et al. Periodic myoclonus due to cytomegalovirus encephalitis in patient with good syndrome. Arch Neurol 2007; 64 : 277–279.
39. Lai WH, Lu SY, Eng HL. Levamisole aid in treatment of refractory oral candidiasis in two patients with thymoma associated with myastenia gravis: report of two cases. Chang Gung Med J 2002; 25 : 606–611.
40. Agarwal S, Cunningham-Rundles C. Thymoma and immunodeficiency (Good syndrome): a report of 2 unusual cases and review of literature. Ann Allergy Asthma Immunol 2007; 98 : 185–190.
41. Tarr PE, Sneller MC, Mechanic LJ et al. Infections in patients with immunodeficiency with thymoma (Good syndrome). Report of 5 cases and review of the literature. Medicine (Baltimore) 2001; 80 : 123–133.
42. Montela L, Masci AM, Merkabaoui G et al. B-cell lymphopenia and hypogammaglobulinaemia in thymoma patients. Ann Hematol 2003; 82 : 343–347.
43. Krawczyk P, Adamcyk-Korbel M, Kieszko R et al. Immunological system status and the appearance of respiratory system disturbances in thymectomized patients. Arch Immunol Ther Exp 2007; 55 : 49–56.
44. Oritani K, Medina KL, Tomiyama Y et al. Limitin: an interferon-like cytokine that preferentially influences B-lymphocyte precursors. Nat Med 2000; 6 : 659–699.
45. Litwin SD, Zanjani ED. Lymphocyte suppressing both immunoglobulin and erythroid differentiation in hypogammaglobulinaemia. Nature 1977; 266 : 57–58.
46. Shiono H, Wong YL, Matthews I et al. Spontaneous production of anti-IFN-alfa and anti-IL-12 autoantibodies by thymoma cells from myastenia gravis patients suggests autoimmunisation in the tumor. Inter Immunol 2003; 15 : 903–913.
47. Raschal S, Siegel JN, Huml J et al. Hypogammaglobulinaemia and anemia 18 years after thymoma resection. J Allergy Clin Immunol 1997; 100 : 846–848.
48. Vincent A, Willcox N. The role of T-cells in the initiation of autoantibody response in thymoma patients. Pathol Res Pract 1999; 195 : 535–540.
49. Hermaszewski RA, Webster AD. Primary hypogammaglobulinaemia: a survay of clinical manifestations and complications. Q J Med 1993; 86 : 31–42.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2012 Issue 2-
All articles in this issue
- Přehled dosud publikovaných analýz srovnávajících efektivitu léčby inzulinovou pumpou a režimu několika injekcí inzulinu denně u diabetiků 1. typu
- Léčba hypertyreózy radiojodem 131I v ambulantním režimu – bezpečná, účinná a ekonomická varianta
- Celiakie – opomíjená diagnóza
- Trvalá virologická odpoveď kombinovanej imunomodulačnej liečby pegylovaným interferónom-α a ribavirínom u bývalých intravenóznych drogovo závislých jedincov s chronickou vírusovou hepatitídou C
- Příznaky bažení po jídle u dětí staršího školního věku a jejich vztah k body-mass indexu
- Klinické dôsledky zväčšenia ľavej predsiene
- Hemokoagulační mechanizmy v procesu aterotrombózy
- Význam urokinázy a jejích inhibitorů pro invazi a metastazování zhoubných nádorů
- Měkké tkáně, hormony a skelet
- Lieky a štítna žľaza
- Vývoj koagulačních markerů chronické diseminované intravaskulární koagulace (DIK) u pacienta s mnohočetnou angiomatózou v průběhu léčby antiangiogenními léky: interferonem α, thalidomidem a lenalidomidem
- Goodův syndrom (s thymomem spojená hypogamaglobulinemie) – 2 kazuistiky
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Klinické dôsledky zväčšenia ľavej predsiene
- Lieky a štítna žľaza
- Léčba hypertyreózy radiojodem 131I v ambulantním režimu – bezpečná, účinná a ekonomická varianta
- Goodův syndrom (s thymomem spojená hypogamaglobulinemie) – 2 kazuistiky
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

