-
Medical journals
- Career
Primární jaterní karcinoid
: J. Plášek 1; M. Vybíralová 2; J. Dvořáčková 3; A. Petrušková 4; J. Sagan 5; M. Golián 6; V. Hrabovský 1; N. Petejová 1; Arnošt Martínek 1
: Interní klinika Lékařské fakulty Ostravské Univerzity a FN Ostrava, přednosta doc. MUDr. Arnošt Martínek, CSc. 1; Onkologická klinika Lékařské fakulty Ostravské Univerzity a FN Ostrava, přednosta prim. MUDr. David Feltl, Ph. D., MBA 2; Ústav patologie Lékařské fakulty Ostravské Univerzity a FN Ostrava, přednostka prim. MUDr. Jana Dvořáčková, Ph. D. 3; Klinika nukleární medicíny Lékařské fakulty Ostravské Univerzity a FN Ostrava, přednosta prim. MUDr. Otakar Kraft, Ph. D., MBA 4; Klinika infekčního lékařství Lékařské fakulty Ostravské Univerzity a FN Ostrava, přednosta prim. MUDr. Luděk Rožnovský, CSc. 5; Radiodiagnostický ústav Lékařské fakulty Ostravské Univerzity a FN Ostrava, přednostka prim. MUDr. Alena Jahodová 6
: Vnitř Lék 2011; 57(6): 590-594
: Case Reports
V případě primárních karcinoidů jater (PJK) se jedná o zvlášť raritní diagnózu, ve světové odborné literatuře nebylo popsáno více než 60 případů. Nejčastějšími klinickými příznaky jsou bolesti břicha, průjmy, ikterus, flush, váhový úbytek, nechutenství spojené s progredující kachexií či respirační obtíže; stejně tak však může být průběh po dlouhou dobu zcela asymptomatický. V úvodu prezentujeme názorný příklad, oligosymptomatického 65letého pacienta, kterému byl po rozsáhlém vyšetřování na základě octreoscanu a histologické verifikace diagnostikován generalizovaný PJK. Následovala paliativní léčba somatostatinovými analogy. Klinická diagnóza byla po 8 měsících potvrzena pitvou. Průkaznost PJK je náročná pro radiologickou podobnost s ostatními jaterními lézemi a obtížnou možnost vyloučení jiných primárních ložisek. Diagnóza PJK se zakládá na negativitě výsledků zobrazovacích metod v ostatních možných lokalizacích. Na předkládaném případu je zajímavá minimální symptomatologie ve stavu generalizace onemocnění, atypické primární ložisko a rychlá klinická progrese.
Klíčová slova:
karcinoid – octreoscan – 5-HIOK – Sandostatin LARÚvod
Karcinoid je poměrně vzácný, většinou pomalu rostoucí nádor s různým stupněm diferenciace vycházející z neuroendokrinní tkáně [1,2]; do stejné skupiny maligních neuroendokrinních nádorů gastroenteropankreatické lokalizace bývají řazeny také VIPom, gastrinom, inzulinom či somatostatinom. Dle ontogeneticky pojaté patologicko-anatomické klasifikace dělíme karcinoidy s ohledem na lokalitu postižení na tumory předního (,,foregut”), středního (,,midgut”) a dolního úseku (,,hindgut”) [3]. V širším slova smyslu se pak jedná o neuroendokrinní nádory různých lokalizací a úrovní diferenciace, jejichž souhrnnou klasifikaci vytvořila nově WHO [4]. Závazná, ač klinicky ne příliš praktická, je histologická klasifikace neuroendokrinních tumorů autorů Solcia et al [5]. V přibližně 90% případů se karcinoid vyskytuje v trávicím traktu, a to predilekčně buď v terminálním ileu, či apendixu [6,7]; menší množství nádorů se nachází v ostatních orgánech, nejčastěji pak v bronchách [8]. V kontextu sekrece různých neuroendokrinních mediátorů (serotonin, substance P, kininy, prostaglandiny) a v závislosti na množství produkovaných výše uvedených působků se karcinoidy projevují celou řadou symptomů souhrnně vyjádřených tzv. karcinoidovým syndromem: vazomotorické projevy (flush, rinitida, teleangiektázie), zvýšená intestinální motilita (bolesti břicha, průjmy, borborygmy), pravostranné srdeční selhání či bronchokonstrikce [9]. Játra jsou poměrně často postižena metastaticky, naopak primární jaterní karcinoidy jsou raritní, ve světové odborné literatuře bylo popsáno kolem 60 případů označovaných jako velmi pravděpodobné [10], s jistými pochybnostmi v diagnostické jistotě by mohlo jít o 95 případů [11]. Autor si je vědom nesprávnosti názvu karcinoid, ale jak množství citací pod tímto klíčovým slovem, tak přetrvávající užívání v klinické praxi a konsenzus užívání pro „midgut“ tumory vedlo k preferenci tohoto pojmu před pojmem neuroendokrinní tumor i na řádcích předkládané práce.
Popis případu
Dvaasedmdesátiletý pacient byl přijat na naši Interní kliniku pro nejméně 2 měsíce trvající průjmovité stolice, 5–6krát denně, většinou po ránu, s difuzní kolikovitou bolestí břicha, po zbytek dne takřka bez obtíží. V posledních 2 měsících pozoroval nechutenství bez zřejmého vztahu ke specifickým potravinám a váhový úbytek 4kg, také byl občas nauzeózní, opět bez časového vztahu k příjmu potravy, nezvracel. Dlouhodobě se pacient léčí pro hypertenzi, nyní na dvojkombinaci antihypertenziv, 8 let se léčí s hypertrofií prostaty, posledních 5 let pro vestibulární syndrom a rok se syndromem rotátorové manžety. Po většinu produktivního věku pracoval jako vysokoškolský pedagog, práci přerušil až s nástupem k hospitalizaci. Jedná se o nekuřáka, alkohol pije pouze příležitostně. Rodinná anamnéza je zcela bez souvislostí, rodiče zemřeli v pokročilém věku. Alergologická anamnéza je taktéž negativní. Začátek pacientových obtíží navazuje na dvoutýdenní pobyt v Dominikánské republice. Vstupní laboratorní vyšetření prokazuje leukocytózu 12 × 109/l s posunem doleva, CRP 102mg/l a elevaci obstrukčních jaterních enzymů (ALP 2,88 μkat/l, GMT 4,44 μkat/l). Výsledkem ultrazvuku břicha je nález mnohočetného ložiskového postižení (obr. 1 a 2), je provedeno doplňující vyšetření s podáním UZ kontrastní látky, které vede k došetření trávicího traktu. S ohledem na zánětlivou aktivitu a ložiskové postižení jater je odebrána stolice ke kultivaci a parazitologickému vyšetření s negativním nálezem, klostridiový toxin není prokázán, sérologická virologie je taktéž negativní. Pro údaj v epidemiologické anamnéze o pobytu v zahraničí jsou vyšetřeny i helmintózy (Entamoeba histolytica, hydatidóza, cysticerkóza a echinokokóza), které jsou sérologicky negativní. V dalším sledu je tedy provedena gastroskopie s obrazem dolíčkovatění žaludku, ale jinak normálním obrazem horního GIT, koloskopie pak prokazuje divertikulózu sigmoidea. V rámci diferenciální diagnostiky průjmu jsou odebrány i parametry štítné žlázy, sérologie na coeliakii a potravinové intolerance, vše vychází v rozmezí normálních hodnot. Pro ložiskové postižení jater nejasné etiologie jsou odebrány onkomarkery (AFP 2,8 μg/l, CA 19–9 31,3 μg/l, CEA 1,03 μg/l, PSA 1,23 μg/l), ani urologické vyšetření s cystoskopií a UZ ledvin nenalézá neoplastické změny. Morfologicky je ložiskové postižení verifikováno pomocí CT břicha (obr. 3 a 4), navíc je zjištěna pomocí MRI paraaortální lymfadenopatie a mnohočetné ložiskové postižení obratlů (obr. 5). Doplněná scintigrafie skeletu rozšiřuje informaci o postižení pánve, lbi a dlouhých kostí. Je zvažována hematologická příčina, pro kterou pacient podstoupil trepanobiopsii s normálním nálezem v dřeni; bez patologické odchylky byla i elektroforéza bílkovin, Bence-Jonesova bílkovina a volné lehké řetězce v moči. Mezitím byl v rámci diagnostických rozpaků vylučován i specifický proces, mykobakterióza byla sérologicky nepravděpodobná. Na správnou stopu nás přivádí až mnohonásobně zvýšený odpad kyseliny hydroxyindoloctové do moči (273 μmol/24 hod), na základě čehož byla provedena aspirační tenkojehlová biopsie (FNAB) největšího dostupného ložiska. Z biopsie vychází kulatobuněčný PAS pozitivní dobře diferencovaný neuroendokrinní tumor s imunohistochemickou pozitivitou CD56, chromograninu v barvení dle Grimelia (obr. 6–8), mezi kliniky známý jako karcinoid. Ke zjištění origa karcinoidu byla provedena somatostatinová receptorová scintigrafie pomocí 111In-pentetreotidu (firemní název OctreoScan), která prokazuje zvýšenou denzitu somatostatinových receptorů v již zmíněných obratlích, kostech, lbi, játrech, ale i fyziologicky v močovém traktu a slezině. Překvapivě nedošlo k depozici radiofarmaka ani v oblasti dýchacího stromu ani v oblasti tenkého střeva (obr. 9). Na základě všech dostupných metod případ uzavíráme jako primární jaterní karcinoid generalizovaný do skeletu. Na onkologické klinice byla, vzhledem k velmi dobrému vstupnímu klinickému stavu pacienta (Karnofského index 100%), indikována léčba somatostatinovými analogy v počáteční dávce octreotid acetát (Sandostatin, Novartis) 0,1mg s.c. denně. Po úvodních 3 aplikacích této dávky dochází k částečné regresi frekvence průjmovité stolice, vzhledem k tomu byla navýšena terapeutická dávka na octreotid acetát s prodlouženým uvolňováním (Sandostatin LAR, Novartis) 30mg s.c. s aplikací jednou za 4 týdny. Pro bolesti skeletu v oblasti pravé lopatky a ramene, které byly dle scintigrafie skeletu a 111In-Octreoscanem objektivizovány jako pozitivní nádorové lokality, byla indikována paliativní radioterapie (10 × 3 Gy, X/6MeV, 2 tangenciální pole) s velmi dobrým analgetickým efektem s možností redukce dávky anodyn na polovinu. Pacient absolvoval 6 aplikací Sandostatin LAR 30mg s.c. bez nutnosti redukce dávky či časové prodlevy, pro opět progredující bolesti, recidivu průjmovité stolice, slabosti, difuzní kolikovité bolesti břicha a progredující kachexii byl proveden CT restaging s nálezem jednoznačné progrese v oblasti jater, a to jak do velikosti, tak četnosti ložisek, a dále metastatické postižení prakticky celého osového skeletu. Pro progredující bolesti skeletu v oblasti páteře L1-2 a levé klavikuly byla provedena paliativní radioterapie v dávce 1 × 8 Gy na obě lokality s částečným analgetickým efektem. Vzhledem k výše zmíněné progresi byla ukončena onkologická terapie a pacient byl předán do péče mobilní hospicové jednotky. Pacient necelý měsíc po ukončení onkologické terapie umírá pod obrazem generalizace neuroendokrinního tumoru. Dle pitvy není prokázáno postižení tenkého střeva, bronchů, ledvin, sleziny, je potvrzeno postižení jater a skeletu; nález potvrzuje diagnózu primárního jaterního karcinoidu generalizovaného do skeletu.
1. UZ břicha, vpravo s podáním kontrastní látky v portální fázi, písmeno m označuje ložisko. 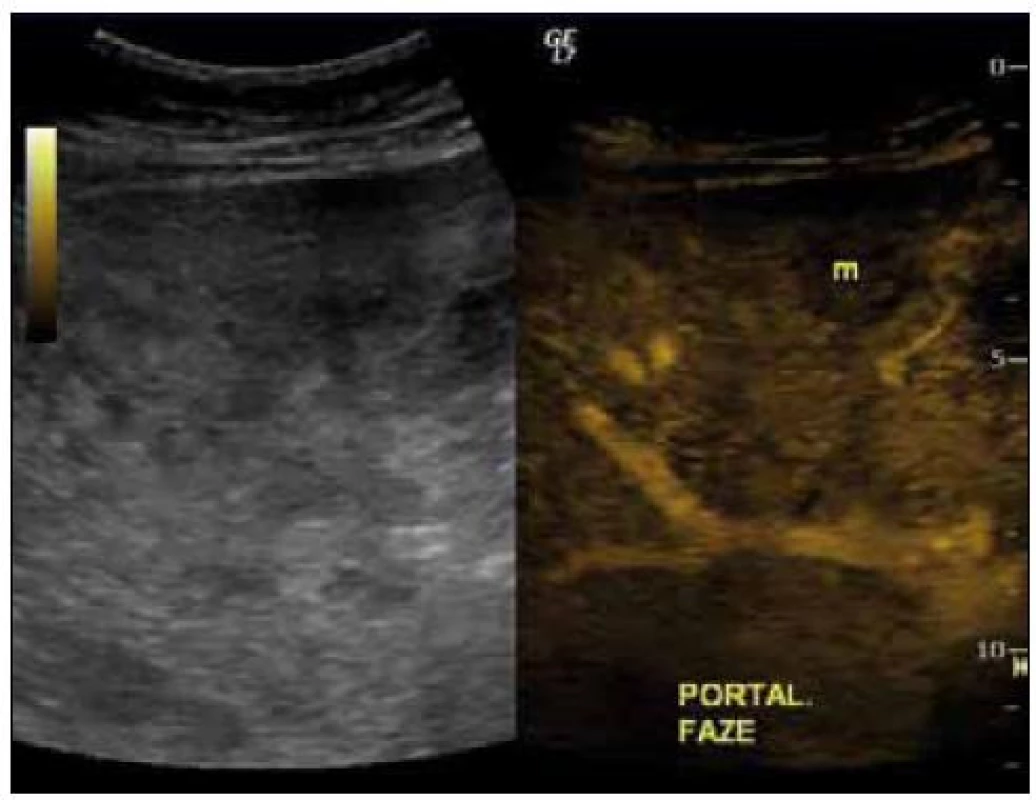
2. UZ břicha, vpravo s podáním kontrastu v arteriální fázi se sycením ložisek označených písmenem M. 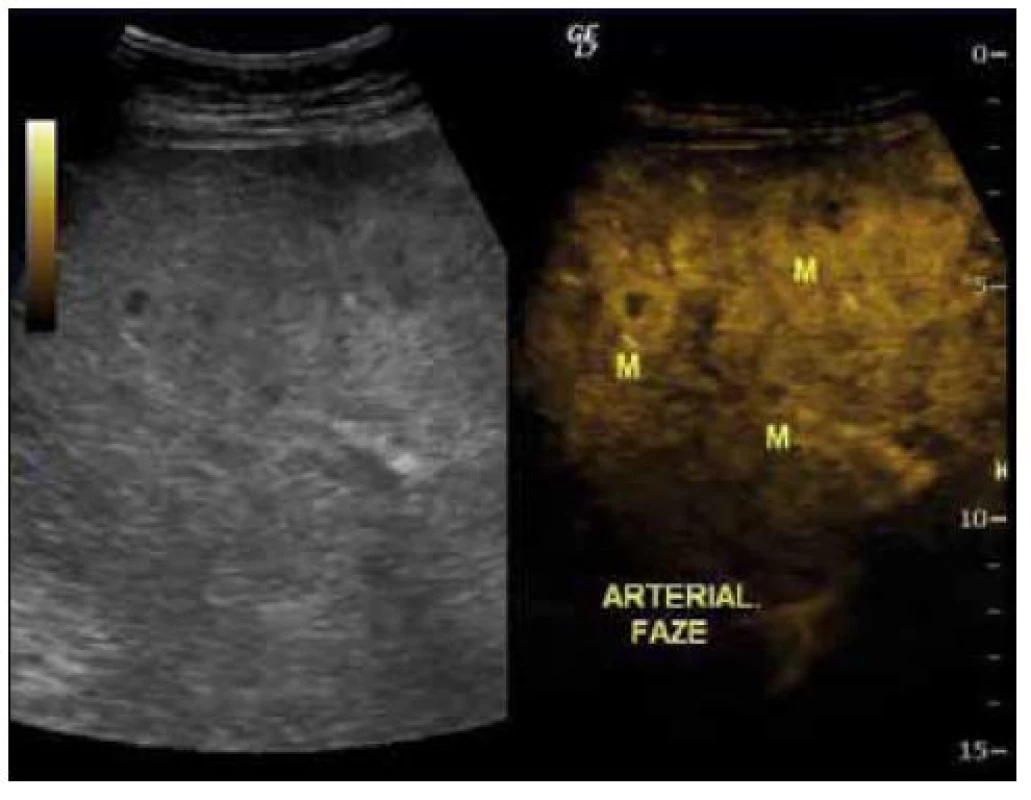
3. Transverzální řez z CT břicha, šipky označují ložiskové postižení jater. 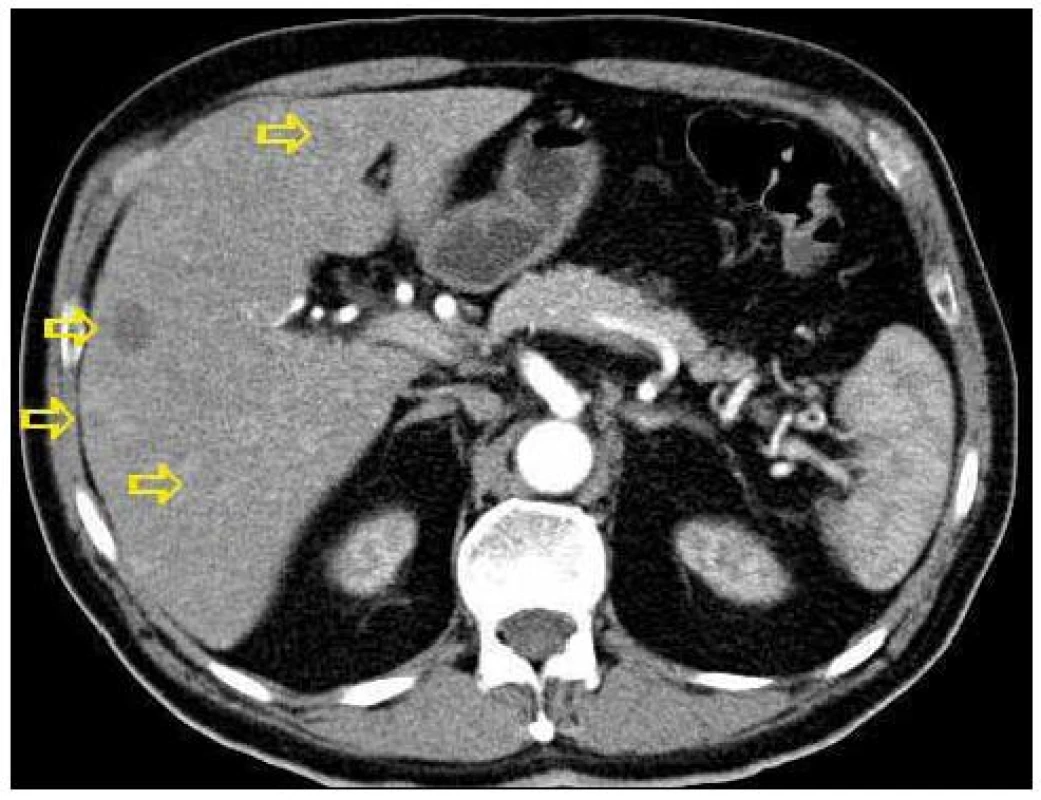
4. Transverzální řez z CT břicha v nižší etáži než obr. 3, šipky označuji ložiskové postižení jater. 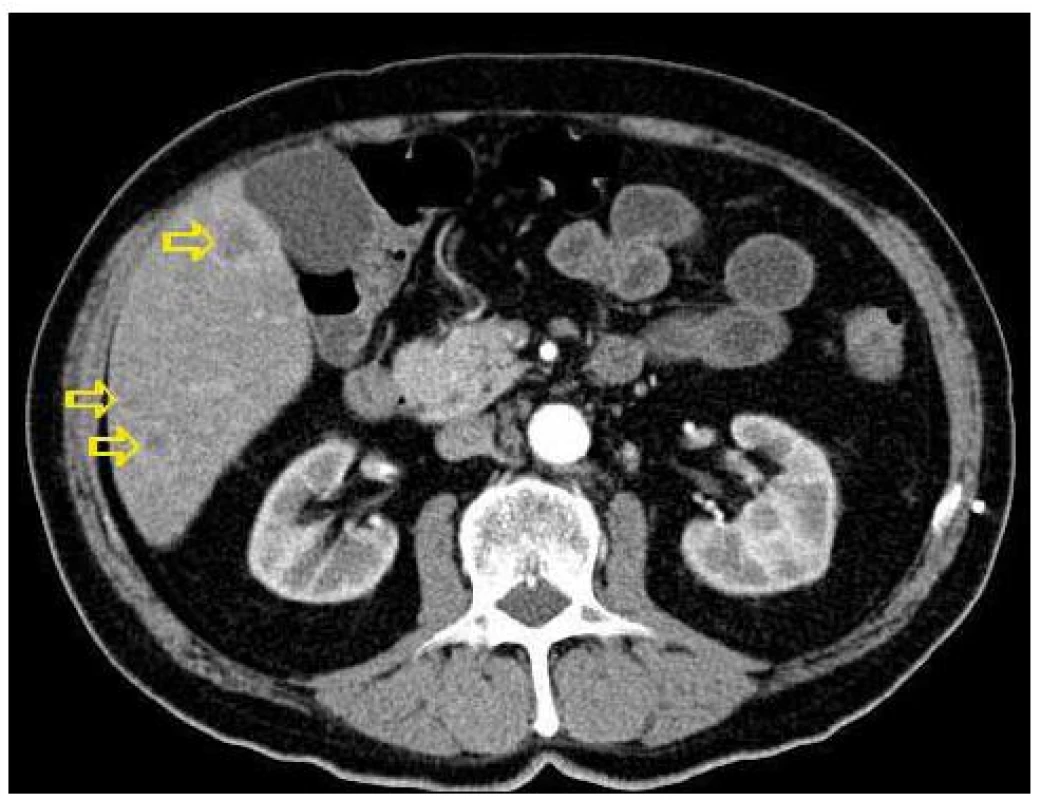
5. Sagitální řez z MRI (T2 STIR), šipky označují ložiskové postižení obratlů. 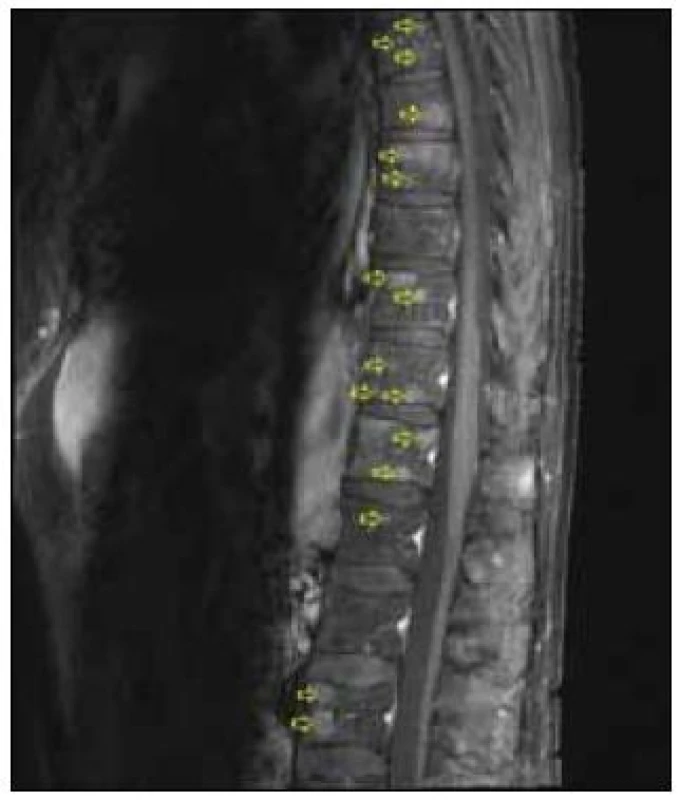
6. Bioptický vzorek jater v barvení hematoxylin-eozin, je patrna kulatobuněčná infiltrace s buněčnými atypiemi a dezorganizace jaterní architektury. 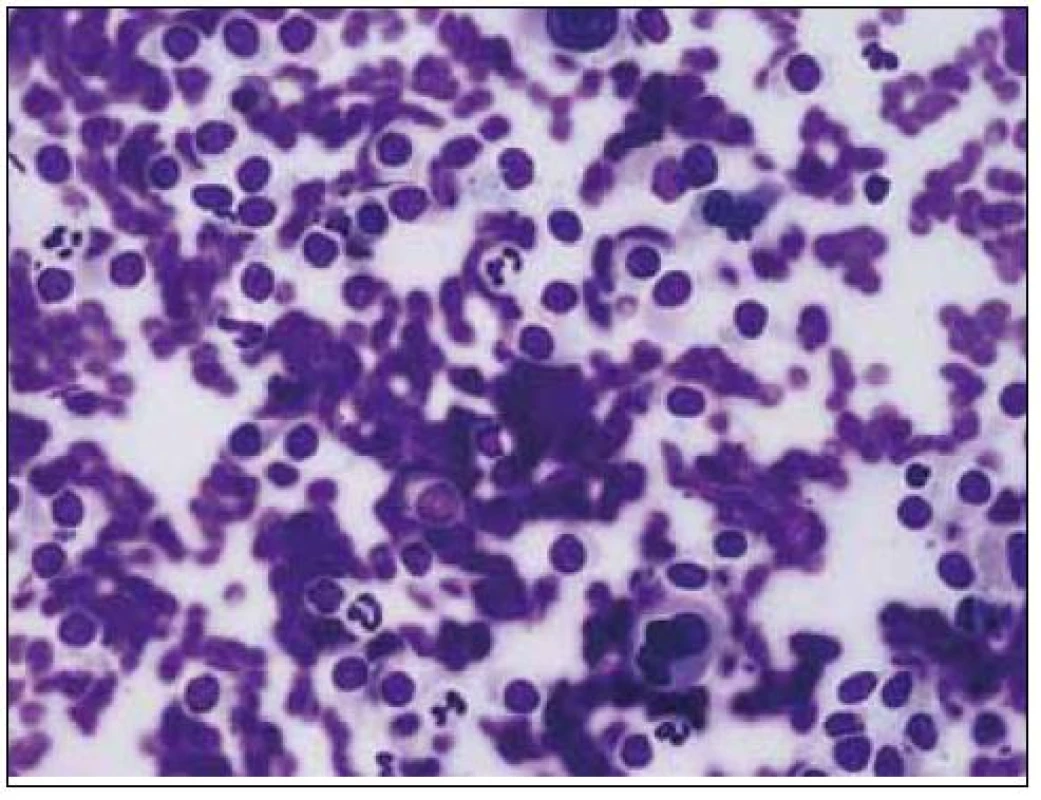
7. Imunohistochemické vyšetření jaterního parenchymu, pozitivita antigenu CD 56. 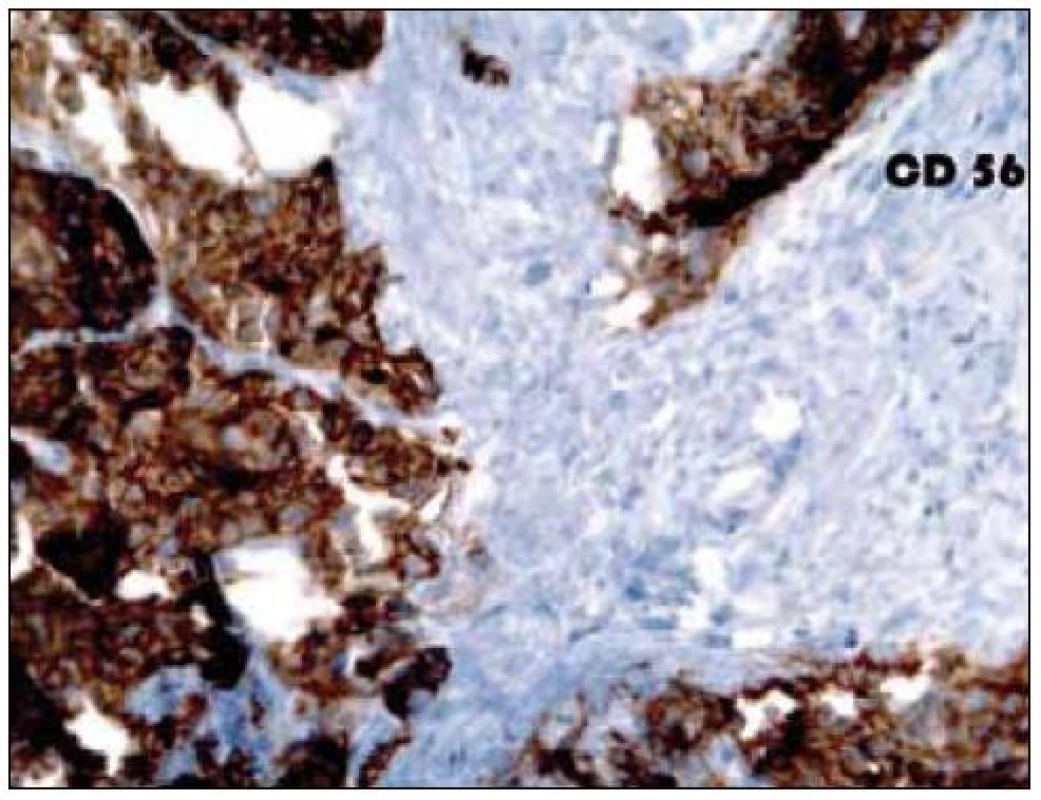
8. Imunohistochemické vyšetření jaterního parenchymu, pozitivita chromograninu. 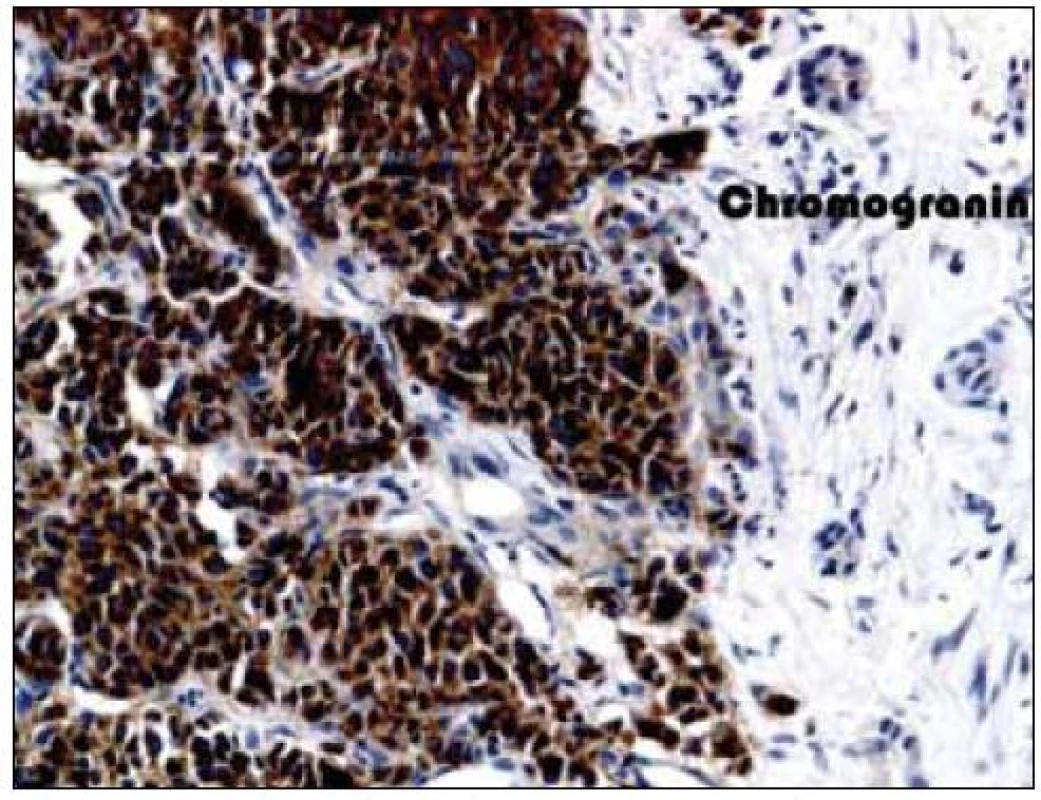
9. Celotělový <sup>111</sup>In-octresocan demonstrující maximum denzity somatostatinových receptorů 2. typu v játrech. 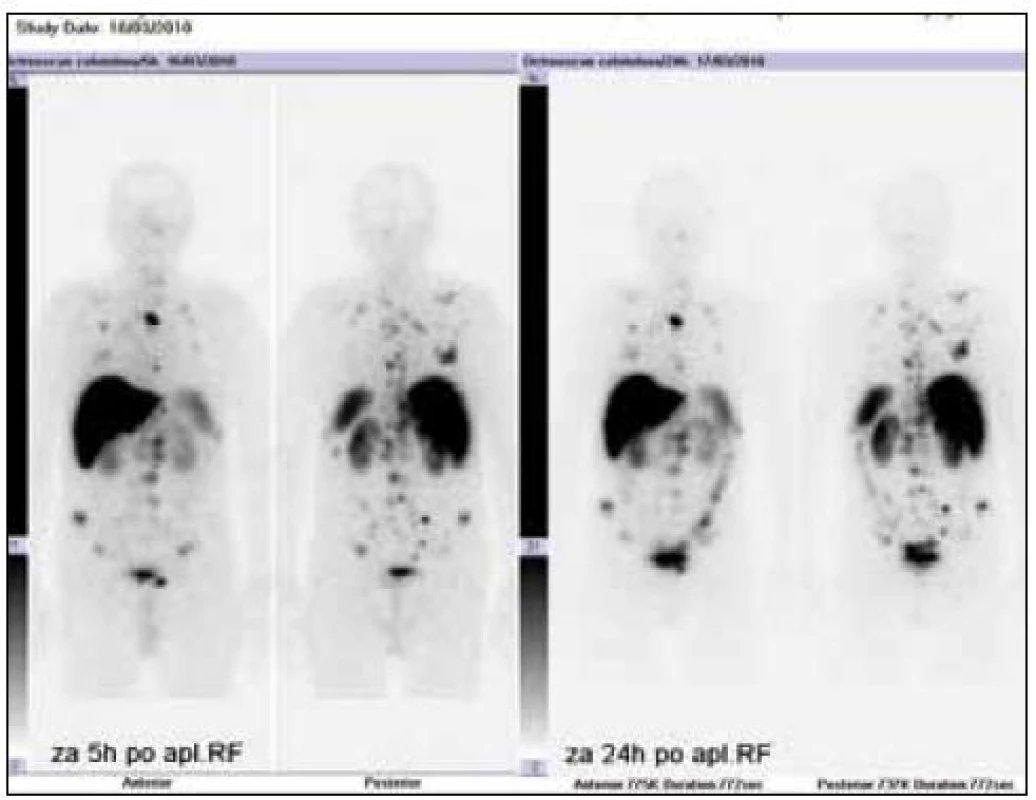
Diskuze
Neuroendokrinní tumory jsou širokou skupinou nádorů s dnes již převážně akceptovanou společnou histogenezí, ale rozličným biologickým chováním a na základě lokalizace též velmi různorodou klinickou prezentací. V případě extraapendikálních tumorů představují karcinoidy většinou nádory s metastatickým potenciálem [12]. Primární jaterní karcinoid byl popsán poprvé v roce 1958 Edmondsonem [13] a má incidenci pouhých 0,3% [11]. V zanedbatelných 5% se projevuje jako karcinoidový syndrom (flush, záchvatovité průjmy, bolesti břicha), většinou si pacienti stěžují na nevýrazné bolesti břicha, eventuálně ztrátu váhy [14]. Játra jsou nejčastější lokalizaci metastáz karcinoidu, ale jen zřídka primárním ložiskem [14]. Buňky vhodné pro vznik karcinoidu mohou být ektopická ložiska adrenální či pankreatické tkáně, jiná teorie mluví o možném přispění chronického zánětu biliárních cest či intestinální metaplazie [15].
V diagnostickém algoritmu by neměla chybět somatostatinová receptorová scintigrafie – třeba jako v našem případě pomocí 111In-pentetreotidu (firemní název OctreoScan), který má vysokou afinitu k somatostatinovým receptorům 2. a 5. typu, méně 3. typu, a je senzitivnější než MRI i CT jak pro diagnostiku primárního ložiska, tak distančních metastáz [16]. Ke sledování pacienta s karcinoidem slouží odpad močového chromograninu, případně kyseliny hydroxyindoloctové a kontrolní octreoscan [17]. Klasický PET s fluordeoxyglukózou se k zobrazování neuroendokrinních tumorů nezdá vhodný [18]. Hybridní metody jako SPECT/CT zatím hledají místo v diagnostickém algoritmu a re-stagingu neuroendokrinních tumorů. Prognózu s ohledem na malé množství pacientů, heterogenitu biologického chování a různé léčebné modality (chirurgická léčba, radiofrekvenční ablace, embolizace, chemoembolizace, systémová chemoterapie, biologická léčba) prakticky nelze odhadnout.
V předkládané kazuistice bychom chtěli zdůraznit oligosymptomatickou prezentaci i přes pokročilý metastatický rozsev zachycený již vstupně; u pacienta se klasické projevy karcinoidového syndromu manifestovaly až po 7 měsících sledování, kdy došlo i ke kachektizaci a celkové deterioraci. Doba od rozvoje onemocnění k diagnóze se kvůli nevýznamným symptomům může výrazně prodloužit a je třeba na tuto raritní diagnózu myslet zejména v případech nevysvětlitelných atak průjmů, váhovém úbytku a i mírných abdominalgií, které bychom po základním vyšetření hodnotili nejspíše jako funkční. Problematická je rovněž biochemická průkaznost, jelikož metabolické produkty jako chromogranin A a hydroxyindoloctová kyselina mohou být rychle metabolizovány játry a do moči se pak nedostanou v dostatečné koncentraci, případně se může jednat o oligosekreční tumor.
I přes velmi důkladnou diagnostiku (CT, MRI, scintigrafie skeletu, octreoscan, biochemické vyšetření) a následné bioptické potvrzení nelze ve většině případů zodpovědět otázku, zda se jedná o primární jaterní karcinoid, či metastatické postižení. Primární tumor může být totiž pod úrovní rozlišovacích schopností jak CT, PET a MRI, tak somatostatinové scintigrafie a my zachytíme pouze jaterní metastázy. V našem případě diagnostickou jistotu primárního jaterního karcinoidu potvrdila bohužel až pitva. Přesto nevylučujeme potenciální přítomnost primárního mikroskopického nádoru, jeho možné nekrózy či destrukce z jiné příčiny.
Závěr
Primární jaterní karcinoid je raritní a zajímavá diagnóza, která je v případě solitárního ložiska i dobře chirurgicky řešitelná. S ohledem na oligosymptomatičnost není však vždy diagnostikován v chirurgicky řešitelném stavu, pak přichází na řadu, stejně jako v našem případě, paliativní léčba v podobě somatostatinových analog, léčba radioizotopy navázanými na somatostatinová analoga či systémové chemoterapie. Jednou z limitací léčby je naše neschopnost zcela vyloučit primární mikroložisko, které může mít i přes malé rozměry dobré cévní zásobení a vysoký metastatický potenciál. Primární jaterní karcinoid tak asi i přes velmi progresivní vývoj zobrazovacích metod i jiných modalit zůstane zatím diagnostickým dilematem.
MUDr. Jiří Plášek
www.fnol.cz
e-mail: jiri_plasek@centrum.cz
Sources
1. Zamrazil V. Neuroendokrinní (difuzní endokrinní) systém a nádory, které z něho vycházejí. In: Stárka L et al (eds). Pokroky v endokrinologii. Praha: Maxdorf 2007.
2. Cempírková V, Havránek P. Karcinoid. Vnitř Lék 2005; 51 : 1011–1018.
3. Louthan O. Neuroendokrinní nádory, klinické pohledy. 1. vyd. Praha: Grada publishing 2006.
4. Klöppel G, Perren A, Heitz PU. The gastroenteropancreatic neuroendocrine cell system and its tumors: the WHO classification. Ann NY Acad Sci 2004; 1014 : 13–27.
5. Solcia E, Kloeppel G, Sobin LH. Histological Typing of Endocrine Tumors. 2nd ed. Berlin, Heidelberg, Germany: Springer-Verlag 2000.
6. Caplin ME, Buscombe JR, Hilson AJ et al. Carcinoid tumor. Lancet 1998; 352 : 799–805.
7. Modlin IM, Sandor A. An analysis of 8,305 cases of carcinoid tumors. Cancer 1997; 79 : 813–829.
8. Rea F, Binda R, Spreafico G et al. Bronchial carcinoids. A review of 60 patients. Ann Thorac Surg 1989; 47 : 412–414.
9. Vítek P, Rozina J, Pála M. Terapie karcinoidu a karcionoidnho syndromu. Farmakoterapie 2005; 4 : 356–365.
10. Touloumis Z, Delis SG, Triantopoulou CH et al. Primary hepatic carcinoid; a diagnostic dilemma: a case report. Cases J 2008; 1 : 314.
11. Modlin IM, Lye KD, Kidd M. A 5-decade analysis of 13,715 carcinoid tumors. Cancer 2003; 97 : 934–959.
12. Jager RM, Polk HC Jr. Carcinoid apudomas. Curr Probl Cancer 1977; 1 : 1–53.
13. Edmondson HA. Carcinoid tumor. In: Edmondson HA (ed.). Tumors of the liver and intrahepatic bile ducts (Atlas of Tumor Pathology). Washington: Armed Forces Institute of Pathology 1958 : 105–111.
14. Modlin IM, Shapiro MD, Kidd M. An analysis of rare carcinoid tumors: clarifying these clinical conundrums. World J Surg 2005; 29 : 92–101.
15. Gravante G, De Liguori Carino N, Overton J et al. Primary carcinoids of the liver: a review of symptoms, diagnosis and treatments. Dig Sur 2008; 25 : 364–368.
16. Shi W, Johnston CF, Buchanan KD et al. Localization of neuroendocrine tumours with [111In] DTPA-octreotide scintigraphy (Octreoscan): a comparative study with CT and MR imaging. QJM 1998; 91 : 295–301.
17. Modlin IM, Kidd M, Latich I et al. Current status of gastrointestinal carcinoids. Gastroenterology 2005; 128 : 1717–1751.
18. Oberg K, Eriksson B. Nuclear medicine in the detection, staging and treatment of gastrointestinal carcinoid tumours. Best Pract Res Clin Endocrinol Metab 2005; 19 : 265–276.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2011 Issue 6-
All articles in this issue
- Impact of long-term glycemic control on changes of lipid profile in children and adolescents with 1 type diabetes mellitus
- The efficacy and safety of moxonidine in patients with metabolic syndrome (the O.B.E.Z.I.T.A. trial)
- Long-term outcome of catheter ablation therapy of supraventricular tachyarrhythmias
- Brugada syndrome
- Seniors and cardiovascular medications
- Infective endocarditis – crucial early diagnosis
- Treatment of Erdheim-Chester disease with 2-chlorodeoxyadenozine, cyclophosphamide a dexamethasone led to partial remission in one patient. Two case studies and literature review
- Primary hepatic carcinoid
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Brugada syndrome
- Primary hepatic carcinoid
- Seniors and cardiovascular medications
- Long-term outcome of catheter ablation therapy of supraventricular tachyarrhythmias
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

