-
Medical journals
- Career
Pharmacotherapy of chronic heart failure after the first decade of 21st century
Authors: J. Špinar 1; J. Vítovec 2; L. Špinarová 2
Authors‘ workplace: Interní kardiologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jindřich Špinar, CSc., FESC 1; I. interní kardioangiologická klinika Lékařské fakulty MU a FN u sv. Anny Brno, přednosta prof. MUDr. Jiří Vítovec, CSc., FESC 2
Published in: Vnitř Lék 2011; 57(11): 959-965
Category: Birthday
Overview
Podáváme přehled zásad farmakologické léčby chronického srdečního selhání. Chronické srdeční selhání je nazýváno epidemií 21. století a v České republice jím trpí asi 200 000 osob. Farmakologická i nefarmakologická léčba udělaly za poslední desetiletí obrovský pokrok a nové poznatky přicházejí každým rokem. Mezi všeobecně uznávané farmakologické léčebné kroky patří podávání ACE inhibitorů, AII antagonistů (ARB) či beta-blokátorů, diskuze se vedou o indikacích digoxinu, diuretik či hypolipidemik, ale i o významu kombinace ACEI a ARB. Nejasné je postavení antiarytmik a roky 2009–2011 přinesly i zcela nové lékové skupiny – blokátory If kanálu, blokátory faktoru Xa, blokátory trombinu a další.
Klíčová slova:
srdeční selhání – ACE inhibitory – beta-blokátory – digoxin – ivabradinÚvod
Chronické srdeční selhání (CHSS) se v evropských zemích vyskytuje u 0,4–2 % populace s výrazným nárůstem ve vyšších věkových skupinách. Na základě výsledků průzkumu EUROHEART Survey je pro východní Evropu udávána prevalence 1,3 % [1]. Zlepšená léčba akutních stavů (hlavně akutního infarktu myokardu) umožňuje, aby více nemocných dospělo do chronického srdečního selhání. Onemocnění má špatnou prognózu, diagnostika i léčba jsou náročné, a to nejen medicínsky, ale i ekonomicky [2].
Přístup k nemocnému se srdeční insuficiencí se během posledních desetiletí výrazně změnil. Současná terapie je zaměřena nejen na ovlivnění symptomů, ale především na ovlivnění výskytu a progrese srdečního selhání a na snížení úmrtnosti.
Zásady léčby srdečního selhání
Léčba srdečního selhání zahrnuje:
- primární a sekundární prevenci, včetně životosprávy,
- farmakoterapii,
- přístrojovou léčbu – kardiovertery-defibrilátory, stimulátory, levostranné podpory,
- intervenční nechirurgickou léčbu (především revaskularizace, ale i zákroky na chlopních, ablace atd.),
- chirurgickou léčbu (především revaskularizace a zákroky na chlopních),
- ortotopickou transplantaci srdce.
V úpravě životního stylu hraje základní roli edukace pacienta: nemocný musí své chorobě a jejímu léčení rozumět, aby jeho adherence ke všem postupům byla co nejvyšší. Edukace i duševní podpora mu mají být poskytovány při každé příležitosti zdravotníky i příbuznými. Pacient se má každý den vážit ve stejnou dobu, nejlépe ráno po vyprázdnění. Přírůstek o 1,0 kg ze dne na den již svědčí pro retenci tekutin. Při náhlém vzestupu tělesné hmotnosti o > 2 kg/3 dny si může dobře spolupracující nemocný sám zvýšit dávku diuretika nebo kontaktovat svého ošetřujícího lékaře. Nemocný by měl být informován o tom, jaké léky užívá, jaké mohou mít nežádoucí účinky a proč. Měl by být také informován o lécích, které jsou pro něj nevhodné. Jsou to především:
- nesteroidní antirevmatika (pozor na volně prodejná, jako je ibalgin, brufen, voltaren, diclofenac, veral) včetně coxibů, u těžkého srdečního selhání jsou pro dlouhodobé podání kontraindikována;
- některé blokátory vápníkových kanálů (verapamil, diltiazem, krátkodobě působící dihydropyridiny);
- tricyklická antidepresiva;
- kortikosteroidy.
Cílem léčby srdečního selhání je zlepšit kvalitu života, tj. zmenšit nebo úplně odstranit symptomy, zvýšit toleranci zátěže, snížit mortalitu a prodloužit nemocným život. Pro každého nemocného však mohou být pořadí a důležitost těchto cílů rozdílné. Pro málo symptomatické nemocné je prioritní snížení mortality a zpomalení progrese onemocnění. Pro těžce symptomatické nemocné je však důležitější, aby jim léčba především ulevila od jejich potíží a zlepšila kvalitu života. Současné léčebné možnosti, vždy individualizované pro každého nemocného, mohou přinést pozoruhodné výsledky. Kauzální léčení srdečního selhání může být realizováno jen u části nemocných, např. chirurgickou rekonstrukcí nebo nahrazením poškozených chlopní, účinným léčením těžké hypertenze, revaskularizačními výkony atd.
Významné kroky ve farmakologické léčbě srdečního selhání ukazuje tab. 1.
Table 1. Hlavní kroky ve farmakologické léčbě srdečního selhání. 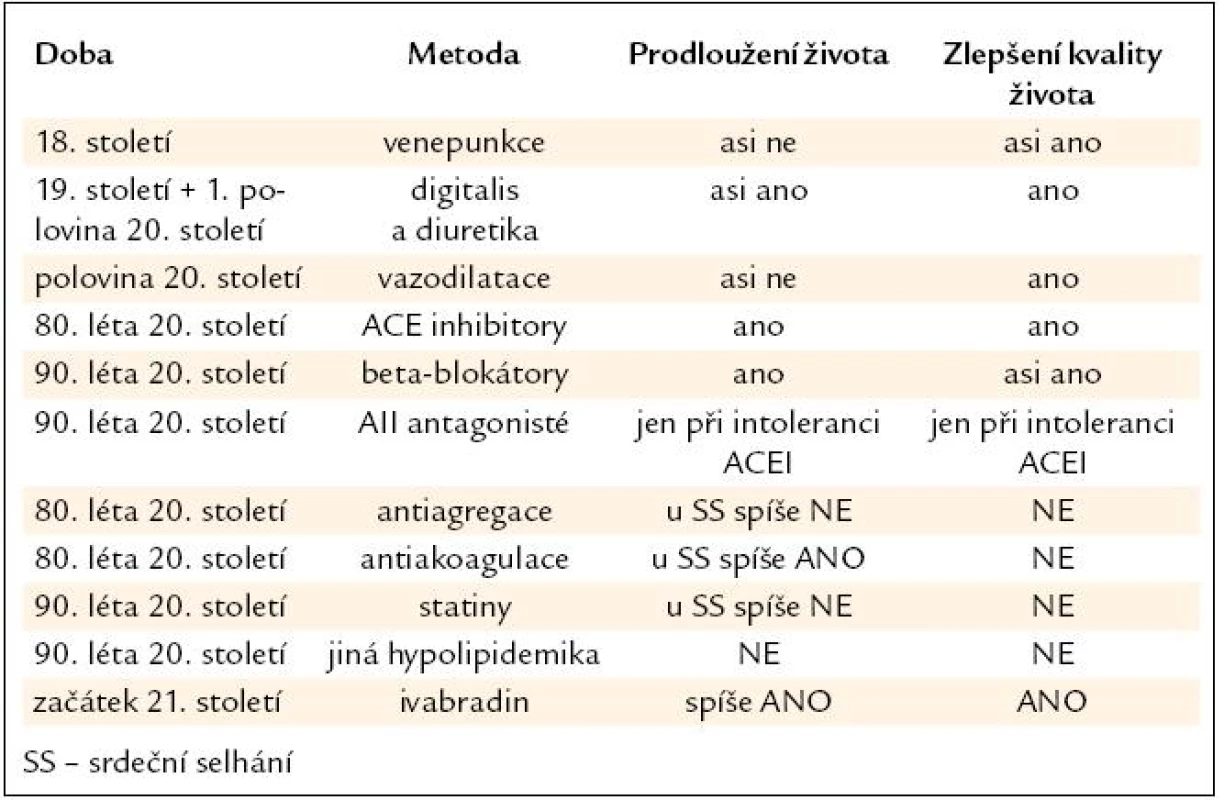
Inhibitory ACE
Inhibitory ACE (ACEI) nepochybně představují největší pokrok v léčbě chronického srdečního selhání na přelomu 20. a 21. století [3]. Dnes jsou při chronickém srdečním selhání i při asymptomatické systolické dysfunkci levé komory léky první volby. Pro málokterou skupinu léků existují tak jednoznačné a přesvědčivé důkazy prospěšnosti jako pro inhibitory ACE v léčbě srdečního selhání. Metaanalýza klinických studií ukázala, že průměrný pokles mortality je o 23 % a součtu mortality a morbidity (vyjádřené počtem hospitalizací) dokonce o 35 %. Vyjádříme-li to jinak, pak léčením 1 000 nemocných se srdečním selháním inhibitory ACE po dobu jednoho roku se zabrání 13 úmrtím, 65 hospitalizacím pro zhoršení srdečního selhání, 99 hospitalizacím z jakéhokoli důvodu a zvyšování tolerance zátěže [4–6].
Na našem trhu je k dispozici řada inhibitorů ACE, lišících se především farmakokinetickými vlastnostmi. Tak např. captopril má krátkodobý účinek a je ho třeba podávat 3krát denně, enalapril a quinapril se podávají 2krát denně, ostatní se podávají většinou 1krát denně. Rozdíly v jejich účincích a ve výskytu nežádoucích účinků jsou však nepodstatné. Vzhledem k individuální hypotenzní odpovědi nemocných a možnému zhoršení renálních funkcí (zejména u starších nemocných s preexistující chronickou renální insuficiencí) je nutné léčbu zahajovat malou, tzv. testovací dávkou a dávku postupně zvyšovat až do maximální tolerované. Přehled inhibitorů ACE a jejich doporučené dávkování při chronickém srdečním selhání jsou uvedeny v tab. 2 (uvádíme jen ty inhibitory ACE, které mají prokázaný účinek v mortalitních studiích a dávkování 1krát denně).
Table 2. Doporučené denní dávky inhibitorů ACE při chronickém srdečním selhání. 
Blokátory receptoru 1 pro angiotenzin II
Blokáda renin-angiotenzinového systému inhibitory ACE má několik limitací. Především je to častý výskyt suchého dráždivého kašle jako důsledku zpomalené degradace bradykininu, který je v 5–10 % případů příčinou nutnosti ukončit léčbu inhibitory ACE. Další nevýhodou je možná aktivace non-ACE cest konverze angiotenzinu I na angiotenzin II (chymázová cesta a další), což může vést k poklesu účinku inhibitorů ACE. Tyto cesty jsou aktivovány především při dlouhodobém podávání ACEI. Některé inhibitory ACE navíc blokují aktivitu především plazmatického ACE, mnohem méně již tkáňového ACE. V poslední době se dále zdůrazňuje význam jednotlivých receptorů pro angiotenzin II.
První klinické studie s blokátory receptoru 1 pro angiotenzin II (angiotensin receptor blocker – ARB) u chronického srdečního selhání prokázaly zlepšení hemodynamických parametrů a zlepšení tolerance zátěže. Další studie prokázaly srovnatelný efekt ARB na mortalitu a morbiditu nemocných jako ACEI. Přidání ARB k ACEI již k dalšímu snížení mortality nevedlo, ve studii VALIANT po infarktu myokardu vedlo dokonce ke zvýšení nežádoucích účinků, ve studii CHARM added naopak ke snížení hospitalizací.
Dosavadní poznatky o blokátorech receptoru 1 pro angiotenzin II u srdečního selhání a po infarktu myokardu můžeme shrnout:
- indikace ARB jsou shodné s indikacemi pro ACEI. ARB jsou jednoznačně indikovány při intoleranci ACEI;
- nemáme důkaz, že ARB jsou lepší než ACEI, proto jsou lékem volby u srdečního selhání jen při intoleranci ACEI;
- výhody kombinační léčby ACEI a ARB na úmrtnost nebyly potvrzeny. Vhodná je tato kombinace u nemocných s nedostatečně kontrolovanou hypertenzí nebo s výraznější proteinurií. Kombinační léčba snižuje počet hospitalizací pro srdeční selhání a vyžaduje pečlivé kontroly.
Doporučené úvodní a cílové dávky ARB (uvádíme pouze ARB, u nichž existují mortalitní studie u srdečního selhání) ukazuje tab. 3.
Table 3. Doporučené denní dávky ARB při chronickém srdečním selhání. 
Studie HEAAL sledovala účinek nižší a vyšší dávky losartanu: 50 mg vs 150 mg. Prokázala snížení úmrtí nebo hospitalizace pro srdeční selhání u vyšší dávky. Dále došlo k častějšímu subjektivnímu zlepšení klinického stavu s malým rizikem nežádoucích účinků [7]. Dávka 150 mg losartanu není v ČR schválena.
Beta-blokátory
Beta-blokátory (BB) jsou doporučeny všem symptomatickým nemocným se srdečním selháním (NYHA II–IV) ve stabilizovaném stavu jak ischemické, tak neischemické etiologie a sníženou ejekční frakcí (EF), pokud nemají kontraindikace podávání [8,9]. Jejich příznivý vliv na mortalitu, funkční zlepšení a oddálení progrese srdečního selhání byl pozorován bez ohledu na pohlaví, věk, funkční klasifikaci a hodnotu ejekční frakce.
Ovlivnění mortality beta-blokátory je aditivní k účinkům inhibitorů ACE [6]. Nejde tedy o konkurenční skupiny léků, optimální je jejich kombinace. Příznivý účinek beta-blokátorů je vysvětlován především snížením aktivace sympatoadrenálního systému, snížením srdeční frekvence, prodloužením diastolické periody a účinkem antiarytmickým.
Jak ukázala studie CIBIS III, je možné začít léčbu srdečního selhání buď beta-blokátorem a přidat inhibitor ACE, anebo naopak [10]. Nejvhodnější je u lehčích forem selhání se známkami sympatikotonie začít beta-blokátory a po skončení titrace přidat inhibitory ACE či sartany, u těžších forem stabilizovat nemocného ACEI/ARB, event. s diuretiky, a poté zahájit titraci beta-blokátory. Důležité je podávat vždy obě lékové skupiny, pokud nejsou přítomny kontraindikace.
Zhruba u 25 % nemocných dochází v prvních týdnech k přechodnému hemodynamickému a symptomatickému zhoršení. Může se zhoršit dušnost, otoky, výkonnost nemocného apod. Na to je třeba reagovat úpravou medikace, např. zintenzivněním diuretické léčby, event. přidáním digoxinu. Léčba se musí zahajovat u klinicky stabilizovaného nemocného bez inotropní podpory nízkými dávkami a dávka se pak zvolna a opatrně titruje, obvykle tak, že se zdvojnásobuje každé 2 týdny až do dosažení cílové udržovací dávky. Doporučené dávky beta-blokátorů jsou v tab. 4 (uvádíme pouze BB, u nichž existují mortalitní studie u srdečního selhání).
Table 4. Doporučené denní dávky beta-blokátorů při chronickém srdečním selhání. 
Musíme respektovat absolutní kontraindikace beta-blokátorů: astma bronchiale, těžké formy chronické obstrukční choroby bronchopulmonální (CHOPN), symptomatické bradykardie a hypotenze. U relativních kontraindikací vždy zvažujeme riziko vs prospěch: diabetes mellitus s možnými hypoglykemickými stavy, lehčí formy CHOPN (zde před nasazením provést spirometrické vyšetření s následným otestováním BB), ischemická choroba dolních končetin (ICHDK).
Diuretika
Diuretika představují symptomatický základ léčby nemocného s městnáním v plicním nebo systémovém oběhu, ovšem v kombinaci s inhibitorem ACE a beta-blokátorem. Diuretika nepodáváme u nemocných asymptomatických, bez otoků a bez dušnosti. Při mírném stupni selhání jsou lékem volby thiazidová diuretika, při těžším stupni diuretika kličková (u nás nejčastěji furosemid). Při nedostatečné odpovědi lze léky z těchto skupin kombinovat [11,12].
Diuretika jako léky u plicního městnání nebo periferních otoků s ústupem dušnosti a zvýšením tolerance zátěže jsou indikována jednoznačně.
Diuretika však nemají dvojitě slepou, mortalitní studii, jsou podávána ve většině případů v kombinaci s léky ovlivňujícími renin-angiotenzinový systém a beta-blokátory.
Dávkování diuretik je uvedeno v tab. 5.
Table 5. Doporučené denní dávky diuretik při chronickém srdečním selhání. 
Nyní jsou v klinických studiích ověřována aquaretika – antagonisté vazopresinu (tolvaptan, conivaptan, lixivaptan), která se jeví jako velmi nadějná u nemocných s hyponatremií a zhoršeným srdečním selháním, i když studie EVEREST zatím jejich prospěch oproti kličkovým diuretikům neprokázala.
Blokátory aldosteronu
Hyperaldosteronizmus, který jako součást neuroendokrinní aktivace provází srdeční selhání, způsobuje depleci draslíku a hořčíku, v myokardu způsobuje fibrózu a blokuje zpětné vychytávání noradrenalinu. Zhoršuje tak funkci myokardu a zvyšuje sklon k arytmiím. V cévním řečišti zhoršuje funkci endotelu, zhoršuje poddajnost tepen zvýšením obsahu kolagenu a poškozuje mikrocirkulaci (změny až charakteru vaskulitidy). Zvýšená hladina aldosteronu je jen omezeně a dočasně ovlivněna podáním inhibitorů ACE nebo antagonistů angiotenzinových receptorů („aldosterone escape“).
Na základě výsledků studie RALES (Randomized Aldactone Evaluation Study), která prokázala příznivé ovlivnění prognózy (redukce mortality o 30 %) a symptomatologie, je indikována léčba nízkými dávkami spironolaktonu u nemocných s ejekční frakcí levé komory (EF LK) < 35 %, kteří jsou ve funkční třídě NYHA III–IV nebo měli recentně epizodu oběhové dekompenzace a jsou léčeni kličkovým diuretikem. I recentní studie EMPHASIS-HF s novým antagonistou aldosteronu eplerenonem ukázala jeho příznivý vliv i na lehčí formy srdečního selhání [13].
Základní dávkování obou preparátů je 25 mg denně. V případě tendence k hyperkalemii při této dávce má být dávka snížena na polovinu, případně upravena ostatní medikace, vysazení blokátorů aldosteronu (BRA) je až poslední volbou. V případě refrakterního srdečního selhání bez hyperkalemie při základní dávce lze případně zvýšit dávku na 50 mg denně za pečlivé monitorace draslíku, neboť hrozí nebezpečí hyperkalemie (tab. 6).
Table 6. Doporučené denní dávky blokátorů aldosteronu při chronickém srdečním selhání. 
Digoxin
Z digitalisových glykosidů se v současnosti u nás používá výhradně digoxin. U nemocných s fibrilací síní je vždy indikován, není-li kontraindikace. U nemocných se sinusovým rytmem s ním byla provedena jedna mortalitně/morbiditní studie (DIG), a to ještě předtím, než se v léčbě chronického srdečního selhání začaly rutinně používat beta-blokátory [14]. Podle výsledků této studie neovlivňuje digoxin při srdečním selhání celkovou mortalitu, ale snižuje počet hospitalizací pro zhoršení srdečního selhání a mortalitu na srdeční selhání. Naopak nevýznamně zvyšuje ostatní kardiovaskulární mortalitu.
Jednoznačnou indikací k chronickému podávání digoxinu je symptomatické chronické srdeční selhání při systolické dysfunkci levé komory při současné fibrilaci síní s rychlou odpovědí komor. Při asymptomatické systolické dysfunkci levé komory spojené s fibrilací síní může být digoxin použit ke kontrole srdeční frekvence. Digoxin ale kontroluje srdeční frekvenci pouze v klidu, nikoli při zátěži. Proto mají dnes v této indikaci přednost beta-blokátory, event. jejich kombinace s digoxinem.
Současný konsenzus je, že digoxin může být při sinusovém rytmu symptomaticky prospěšný u nemocných s manifestním srdečním selháním a těžší systolickou dysfunkcí levé komory. U těchto nemocných by měl být vyzkoušen, a pokud vede ke klinickému zlepšení, měl by být podáván chronicky. Pokud ke klinickému zlepšení nevede, mělo by být jeho podávání ukončeno.
Před zahájením léčby digoxinem je třeba stanovit renální funkce a kalemii. Obvyklá denní dávka je 0,125–0,25 mg per os, u starších lidí 0,0625–0,125 mg, jen výjimečně 0,25 mg. Pro chronickou léčbu není třeba počáteční vysycovací dávka. Digoxin se vylučuje téměř úplně ledvinami, jeho clearence je podobná clearence kreatininu. Při renální insuficienci je proto nutné denní dávku redukovat.
Blokátory If kanálu – ivabradin
Klidová srdeční frekvence nad 70 te-pů/min u nemocných se srdečním selháním a sinusovým rytmem je považována za nepříznivý prognostický ukazatel. Studie BEAUTIFUL, a hlavně SHIFT prokázaly příznivý vliv ivabradinu, léku, který inhibuje If kanály v sinusovém uzlu, a zpomaluje tak srdeční frekvenci, bez dalších negativních vlivů na myokard [15]. Studie SHIFT prokázala významný pokles výskytu rizika primárního cíle – kardiovaskulární úmrtnosti a hospitalizací pro srdeční selhání – o 18 % ve skupině léčené ivabradinem [16]. Také pokles rizika úmrtí pro srdeční selhání byl nižší o 26 % v aktivní léčené skupině. Ivabradin byl dobře snášen s minimálními vedlejšími účinky. Podstudie studie SHIFT prezentovaná na Evropském kardiologickém kongresu v Paříži koncem srpna roku 2011 ukázala navíc významné zlepšení kvality života u nemocných v aktivní větvi oproti placebu.
Ivabradin je indikován u nemocných s kompenzovaným srdečním selháním a sinusovým rytmem, kteří při maximálně tolerované dávce beta-blokátorů mají klidovou srdeční frekvenci nad 70 tepů/min. Je třeba odlišit, kdy je tachykardie kompenzačním mechanizmem u nemocných s nízkým srdečním výdejem. Doporučená úvodní dávka je 2krát 5 mg, cílová denní dávka je 2krát 7,5 mg.
Antiagregace, antikoagulace
Klinická data z observačních studií ukazují, že nemocní se srdečním selháním mají vyšší riziko cévního tromboembolizmu (hluboká žilní trombóza, plicní embolie, periferní arteriální embolizace a cévní mozková příhoda) [17–19].
Tromboembolické příhody jsou 3. nejčastější příčinou úmrtí u nemocných se srdečním selháním [18,20]. Příčinou je kromě velmi časté fibrilace síní [21] také aktivace koagulace v důsledku porušené funkce destiček, endotelové dysfunkce a prozánětlivé aktivace nejen u nemocných s fibrilací síní, ale i u nemocných se sinusovým rytmem a tyto poruchy jsou úměrné stupni levokomorové dysfunkce a závažnosti příznaků.
Nemáme důkazy o tom, že by chronická antitrombotická léčba vedla k snížení mortality nebo výskytu cévních příhod u nemocných se srdečním selháním, a všechna data jsou získána jen z retrospektivních sledování. V klinické praxi dosud neumíme dostatečně přesně vybrat nemocné ohrožené trombotickými komplikacemi.
O účinnosti antiagregační léčby u nemocných se srdečním selháním a sinusovým rytmem se vedou spory, protože kyselina acetylsalicylová (ASA) může oslabovat účinek inhibitorů ACE z důvodů snížení syntézy prostaglandinů v ledvinách a tato nepříznivá interakce může vést k vyšší četnosti zhoršení srdečního selhání.
Dnes doporučujeme léčbu kyselinou acetylsalicylovou všem nemocným, u kterých je příčinou srdečního selhání prokázaná ischemická choroba srdeční, a to v dávce mezi 75 mg až 160 mg/den, opatrnosti je třeba u osob s refrakterním srdečním selháním s častým opakováním dekompenzací, zde zvažujeme prospěch vs riziko.
Srovnání kyseliny acetylsalicylové a warfarinu u nemocných se srdečním selháním ischemické etiologie ve studii HELLAS neukázalo rozdíl mezi skupinami, obdobně nebyl nalezen rozdíl mezi warfarinem a placebem u nemocných s dilatující kardiomyopatií.
Antikoagulační léčba je indikovaná u nemocných s chronickým srdečním selháním (CHSS) [18,21] a:
- s anamnézou systémové nebo plicní embolizace,
- s fibrilací síní,
- s intrakardiálním trombem,
- po rozsáhlém Q infarktu myokardu přední stěny s aneuryzmatem,
- s výraznou dilatací levé komory neischemické etiologie,
- s ejekční frakcí pod 20 %.
Účinná antikoagulace je při INR 2,0–3,5, neúplná antikoagulační léčba s INR < 2,0 je neúčinná.
Nové antikoagulační léky – blokátory trombinu či faktoru Xa (dabigatran, rivaroxaban, apixaban), i antiagregační léky (prasugrel, ticagrelor) by měly být schváleny v zemích Evropské unie již v letošním roce (2011) [21].
Hypolipidemická léčba
Příčinou srdečního selhání je přibližně u 2/3 nemocných ICHS a přibližně 1/2 nemocných prodělala infarkt myokardu. Na tyto nemocné se aplikovaly výsledky statinových studií a na jejich základě se jim podávaly statiny. Doklad o tom, že hypolipidemická léčba statiny zlepšuje prognózu nemocných s chronickým srdečním selháním, však chyběl, protože prakticky ze všech statinových studií byli nemocní s manifestním srdečním selháním vyloučeni [22]. Teprve klinické studie CORONA a GISSI-HF, které byly navrženy specificky k tomu, aby zhodnotily význam statinů u srdečního selhání, přinesly dosud chybějící odpovědi [23–26]. Výsledky obou studií však byly prakticky stejné. Rosuvastatin v nich sice snížil počet kardiovaskulárních hospitalizací, ale neovlivnil výskyt velkých kardiovaskulárních příhod ani kardiovaskulární mortalitu.
Není důvod k tomu, aby se u nemocných s chronickým srdečním selháním, kteří statin již užívají, např. po prodělaném infarktu myokardu v rámci sekundární prevence, statin vysazoval. Na druhé straně neexistuje důvod, aby se nemocnému s chronickým srdečním selháním, který dosud statin neužívá, nově nasazoval.
Zásady léčby chronického systolického srdečního selhání shrnuje tab. 7 [27,28].
Table 7. Zásady léčby srdečního selhání. 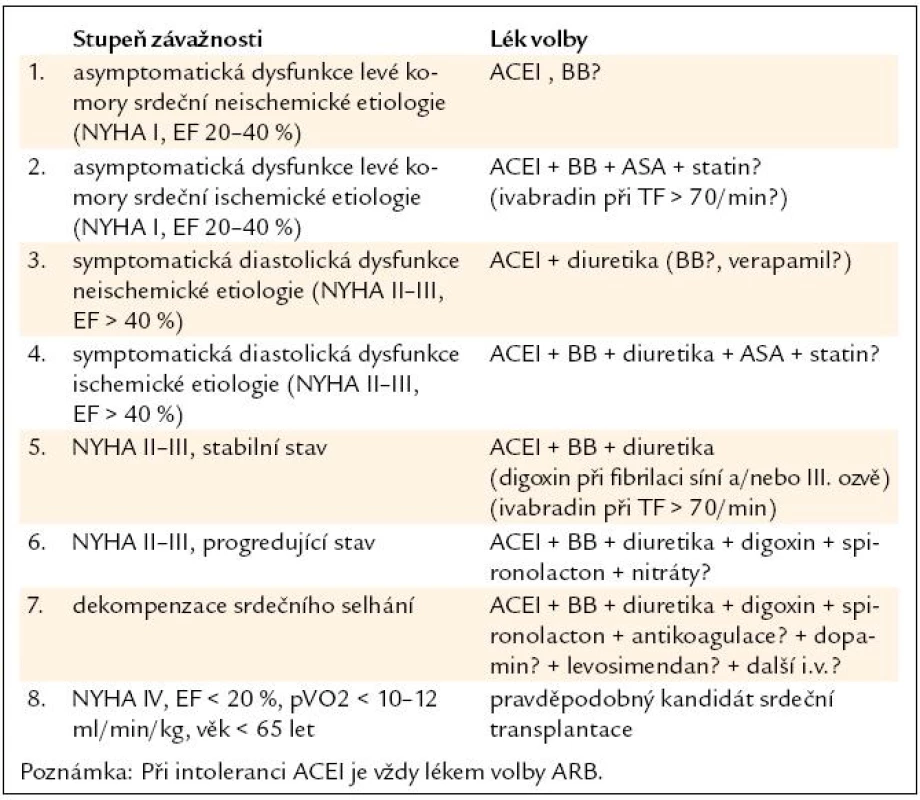
Pro diastolické srdeční selhání (srdeční selhání se zachovanou ejekční frakcí – HFPEF) ještě doplňujeme, že je potřeba:
- důsledně kontrolovat hypertenzi: všechna antihypertenziva, zejména pak inhibitory ACE a blokátory receptorů pro angiotenzin II (ARB), které mohou zlepšit relaxaci a navodit regresi hypertrofie a fibrózy myokardu;
- předcházet a léčit ischemii myokardu: co nejúplnější revaskularizace; z antiischemických léků jsou nejvhodnější beta-blokátory, které zlepšují diastolickou funkci také svým bradykardizujícím účinkem s prodloužením diastoly; inhibitory ACE pro zabránění nežádoucí remodelace;
- obnovit a udržet sinusový rytmus u vhodných nemocných, resp. koordinovanou kontrakci síní a komor: antiarytmika, elektrická kardioverze, katetrová ablace, dvoudutinová kardiostimulace; u nemocných, u kterých není reálné obnovení sinusového rytmu, je nutná kontrola srdeční frekvence ideálně kolem 60 tepů/min;
- zabránit tachykardii a navodit bradykardii: beta-blokátory, bradykardizující blokátory vápníkových kanálů, event. jejich opatrná kombinace s digoxinem, ivabradin;
- zvážit dávkování diuretik. Diuretika mohou být při retenci tekutin nezbytná [11]. Je ale nutné je opatrně dávkovat, aby nevznikla hypovolemie, která by zhoršila plnění levé komory a tím i diastolickou dysfunkci [12].
Tato práce vznikla s podporou výzkumného záměru MŠMT 0021622402 a grantu IGA MZ 9880-3 a je věnována k významnému jubileu prof. MUDr. Jaroslava Rybky, DrSc., jehož rukopis se nesmazatelně zapsal do historie české diabetologie a kardiologie 2. poloviny 20. a začátku 21. století.
prof. MUDr Jindřich Špinar, CSc, FESC
www.fnbrno.cz
e-mail: jspinar@fnbrno.cz
Doručeno do redakce: 6. 9. 2011
Sources
1. Cleland JG, Swedberg K, Follath F et al. Study Group on Diagnosis of the Working Group on Heart Failure of the European Society of Cardiology. The Euro Heart Failure Survey Programme – a survey on the quality of care among patients with heart failure in Europe. Part 1: patient characteristics and diagnosis. Eur Heart J 2003; 24 : 442–463.
2. Dickstein K, Cohen-Solal A, Fillipatos G. ESC Committee for Practice Guidelines (CPG). ESC guidelines for the diagnosis and treatment of acute and chronic heart failure 2008: the Task Force for the diagnosis and treatment of acute and chronic heart failure 2008 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association of the ESC (HFA) and endorsed by the European Society of Intensive Care Medicine (ESICM). Eur J Heart Fail 2008; 10 : 933–989.
3. The CONSENSUS Trial Study Group. Effects of enalapril on mortality in severe congestive heart failure. Results of the Cooperative North Scandinavian Enalapril Survival Study (CONSENSUS). N Engl J Med 1987; 316 : 1429–1435.
4. McMurray J, Cohen-Solal A, Dietz R et al. Practical recommendations for the use of ACE inhibitors, beta-blockers, aldosterone antagonists and angiotensin receptor blockers in heart failure: putting guidelines into practice. Eur J Heart Fail 2005; 7 : 710–721.
5. Packer M, Poole-Wilson PA, Armstrong PW et al. Comparative effects of low and high doses of the angiotensin-converting enzyme inhibitor, lisinopril, on morbidity and mortality in chronic heart failure. ATLAS Study Group. Circulation 1999; 100 : 2312–2318.
6. Remme WJ. Should ACE inhibitors Always be First-Line Therapy in Heart Failure? Lessons from the CARMEN Study. Cardiovasc Drugs Ther 2003; 17 : 107–109.
7. Konstam M, Neaton JD, Drexler H et al. HEAAL Investigators. Effects of high-dose versus low-dose losartan on clinical outcomes in patients with heart failure (HEAAL study): a randomised, double-blind trial. Lancet 2009 : 374 : 1840–1848.
8. The Capricorn Investigators. Effect of carvedilol on outcome after myocardial infarction in patients with left-ventricular dysfunction: the CAPRICORN randomised trial. Lancet 2001; 357 : 1385–1390.
9. Vitovec J, Špinar J. Beta-blokátory v léčbě chronického srdečního selhání. Vnitř Lék 2000; 46 : 161–165.
10. Willenheimer R, van Veldhuisen DJ, Silke B et al. CIBIS III Investigators. Effect on Survival and Hospitalization of Initiating Treatment for Chronic Heart Failure With Bisoprolol Followed by Enalapril, as Compared With the Opposite Sequence Results of the Randomized Cardiac Insufficiency Bisoprolol Study (CIBIS) III. Circulation 2005; 112 : 2426–2435.
11. Anand IS, Florea VG. Diuretics in chronic heart failure – benefits and hazards. Europ Heart J 2001; 3 (Suppl G): G8–G18.
12. Haller C. Diuretics in congestive heart failure: new evidence for old problems. Nephrol Dial Transplant 1999; 14 : 1358–1360.
13. Zannad F, McMurray JJ, V Krum H et al. EMPHASIS-HF Study Group. Eplerenone in Patients with Systolic Heart Failure and Mild Symptoms. N Engl J Med 2011; 364 : 11–21.
14. The Digitalis Investigation Group: The effect of digoxin on mortality and morbidity in patients with heart failure. N Engl J Med 1997; 336 : 525–533.
15. Fox K, Ford I, Steg PG et al. BEAUTIFUL Investigators. Ivabradine for patients with stable coronary artery disease and left-ventricular systolic dysfunction (BEAUTIFUL): a randomised, double-blind, placebo-controlled trial. Lancet 2008; 372 : 807–816.
16. Swedberg K, Komajda M, Böhm M et al. SHIFT Investigators. Ivabradine and outcomes in chronic heart failure (SHIFT): a randomised placebo-controlled study. Lancet 2010; 376 : 886–894.
17. Beemath A, Stein PD, Skaf E et al. Risk of venous thromboembolism in patients hospitalized with heart failure. Am J Cardiol 2006; 98 : 793–795.
18. Bettari L, Fiuzat M, Becker R et al. Thromboembolism and Antithrombotic Therapy in Patients With Heart Failure in Sinus Rhythm Current Status and Future Directions. Circ Heart Fail 2011; 4 : 361–368.
19. Witt BJ, Gami AS, Ballman KV et al. The incidence of ischemic stroke in chronic heart failure: a meta-analysis. J Card Fail 2007; 13 : 489–496.
20. de Peuter OR, Kok WE, Torp-Pedersen C et al. Systolic heart failure: a prothrombotic state. Semin Thromb Hemost 2009; 35 : 497–504.
21. Camm AJ, Kirchhof P, Lip GYH et al. European Heart Rhythm Association; European Association for Cardio-Thoracic Surgery. Guidelines for the management of atrial fibrillation : the Task Force for the Management of Atrial Fibrillation of the European Society of Cardiology (ESC). Eur Heart J 2010; 31 : 2369–2429.
22. Hradec J. Má význam podávání statinů u nemocných se srdečním selháním? Interní Med 2008; 10 : 216–218.
23. Cleland J, McMurray J, Kjekshus J et al. CORONA Study Group. Plasma concentration of amino-terminal pro-brain natriuretic peptide in chronic heart failure: Prediction of cardiovascular events and interaction with the effects of rosuvastatin: A report from CORONA (Controlled Rosuvastatin Multinational trial in Heart Failure). J Am Coll Cardiol 2009; 54 : 1850–1859.
24. GISSI-HF Investigators. Tavazzi L, Maggioni AP, Marchioli R et al. Effect of rosuvastatin in patients with chronic heart failure (the GISSI-HF trial): a randomised, double-blind, placebo-controlled trial. Lancet 2008; 372 : 1231–1239.
25. Kjekshus J, Apetrei E, Barrios V et al. CORONA Group. Rosuvastatin in older patients with systolic heart failure. N Engl J Med 2007; 357 : 2248–2261.
26. McMurray JJ, Kjekshus J, Gullestad L et al. CORONA Study Group. Effects of statin therapy according to plasma high sensitivity C-reactive protein concentration in the Controlled Rosuvastatin Multinational Trial in Heart Failure trial (CORONA): a retrospective analysis. Circulation 2009; 120 : 2188–2196.
27. Špinar J, Hradec J, Meluzín J et al. Doporučení pro diagnostiku a léčbu srdečního selhání ČKS 2006. Cor et Vasa 2007; 49: K5–K33.
28. Špinar J, Vítovec J, Hradec J et al. Doporučení pro diagnostiku a léčbu srdečního selhání ČKS 2011. Cor et Vasa 2012; v tisku.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2011 Issue 11-
All articles in this issue
- Aktuální a budoucí možnosti léčby osteoporózy
- Chronická pankreatitida v roce 2011
- Patofyziologické podklady inkretinové léčby: dokáže ještě více, než si myslíme?
- Jak se dívat na psychosomatickou medicínu
- Možnosti plnění mezinárodních doporučení terapie syndromu diabetické nohy v České republice
- Antibiotická léčba akutních bakteriálních infekcí
- Inkretiny změnily a dále mění strategii léčby diabetu 2. typu
- Moderní technologie v diabetologii. CSII (kontinuální subkutánní infuze inzulinu) a CGM (kontinuální glykemický monitoring) v klinické praxi
- Lze zpomalit rentgenovou progresi ankylozující spondylitidy?
- Inzulinová léčba v roce 2011
- Genetika monogénových foriem diabetu
- Terapie obezity – postupy, účinnost a perspektivy
- Patogeneze diabetes mellitus 1. a 2. typu v roce 2011 – jednotící model poruchy glykoregulace
- Nahlédnutí do budoucnosti farmakoterapie diabetes mellitus 2. typu
- Pharmacotherapy of chronic heart failure after the first decade of 21st century
- Farmakoterapie po srdečním infarktu
- Pokroky v metabolizmu a výživě 2011 a cesta k personalizované léčbě
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Antibiotická léčba akutních bakteriálních infekcí
- Moderní technologie v diabetologii. CSII (kontinuální subkutánní infuze inzulinu) a CGM (kontinuální glykemický monitoring) v klinické praxi
- Terapie obezity – postupy, účinnost a perspektivy
- Genetika monogénových foriem diabetu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

