-
Medical journals
- Career
Vplyv bazálnej koncentrácie prolaktínu na výskyt komplikácií a na prognózu pacientov s cirhózou pečene
Authors: T. Koller; J. Kollerová; M. Huorka; T. Hlavatý; J. Payer
Authors‘ workplace: V. interná klinika Lekárskej fakulty UK a FNsP Bratislava, Slovenská republika, prednosta prof. MUDr. Juraj Payer, CSc.
Published in: Vnitř Lék 2009; 55(5): 468-473
Category: Original Contributions
Overview
Úvod:
Koncentrácia prolaktínu (PRL) u pacientov s cirhózou pečene bola dokázateľne asociovaná s jej komplikáciami.Metódy:
Skúmali sme tento vzťah na súbore 90 pacientov s cirhózou najmä alkoholovej etiológie s prevahou mužov. Na začiatku sledovania sme zaznamenali základné klinické a biochemické parametre ako aj prítomnosť komplikácií cirhózy. Súbor sme sledovali priemerne 434 dní a zaznamenali sme výskyt krvácania z varixov, hepatorenálneho syndrómu a úmrtia.Výsledky:
Zistili sme, že zvýšenú koncentráciu PRL malo 16,7 % pacientov, ktorí mali vyššie prognostické indexy Child-Pugh a MELD a vyššie štádium ascitu a encefalopatie. Porovnaním kvartilov koncentrácie PRL sme potvrdili, že so stúpajúcou koncentráciou sa častejšie objavovali komplikácie cirhózy ako ascites, vyššie INR, ikterus ako aj vyššie skóre Child-Pugh a MELD. Najvýraznejší bol vzťah ku hepatálnej encefalopatii (0 % vs 31 % medzi 1. a 4. kvartilom, p < 0,05), pre ktorú mala koncentrácia PRL > 10,5 μg/l senzitivitu 92,9 % a negatívnu prediktívnu hodnotu 97 %. Podľa Kaplan-Meierovej krivky signifikantne dlhšie prežívali pacienti v 1. kvartile prolaktínu oproti 4. (85,2 vs 50 %, p = 0,046, hazard ratio = 0,2881). Pri prahu koncentrácie PRL > 11,91 μg/l sme zistili 80,8% senzitivitu a 87,8% negatívnu prediktívnu hodnotu predikcie úmrtia počas sledovaného obdobia.Záver:
Koncentrácia bazálneho prolaktínu by preto mohla slúžiť ako alternatívny marker hepatálnej encefalopatie a úmrtia u vybranej podskupiny pacientov s cirhózou.Kľúčové slová:
prolaktín – cirhóza – hepatálna encefalopatia – prognózaÚvod
Prolaktín je hormón produkovaný laktrotrofnými bunkami hypofýzy. Sekrécia prebieha v pulzoch raz za 2–3 hod a je inhibovaná pôsobením dopamínu prostredníctvom D2 receptorov na laktotrofných bunkách. Za fyziologických okolností je prítomnosť dopamínu zabezpečená dopaminergnými neurónmi tuberoinfundibulárnych (TIDA) buniek tzv. tuberohypofyzálneho dopaminergného systému. Dopamín je transportovaný do hypofýzy tzv. hypotalamohypofyzárnym portálnym systémom. Samotný prolaktín potom negatívnou spätnou väzbou inhibuje vylučovanie dopamínu z TIDA neurónov. Medzi faktory, ktoré fyziologicky zvyšujú sekréciu prolaktínu, patrí napr. oxytocín, estrogény, tyreotropín uvoľňujúci hormón (TRH) alebo serotonín [1]. Prolaktínové receptory sa v pečeni za fyziologických okolností nachádzajú najmä okolo centrálnej vény a v epiteli žlčovodov a sú homogénne distribuované. U pacientov s fibrózou pečene bola táto fyziologická distribúcia narušená a dominovala prítomnosť prolaktínoveho receptora v poškodených hepatocytoch. Keďže v pečeni nebola nájdená expresia mRNA pre prolaktín, tento nepôsobí parakrinne ani autokrinne [2]. V nedávnej práci na hepatocytoch samičích potkanov sa dokázal aj vplyv prolaktínu na proliferáciu cholangiocytov [3]. Z týchto dôvodov sa preto u pacientov s chorobami pečene dajú očakávať zmeny v koncentrácii prolaktínu. Existujú nepriame dôkazy o tom, že zvýšená hladina prolaktínu po stimulácii TRH vedie u niektorých pacientov s cirhózou prechodne ku zníženiu natriurézy [4]. V minulosti bola opakovane popísaná zvýšená hladina prolaktínu u pacientov s cirhózou a portosystémovou encefalopatiou [5,6], vyššia hladina prolaktínu pozitívne korelovala s mortalitou a prognostickým indexom Child-Pugh [7]. Po transplantácii pečene dochádzalo ku poklesu koncentrácie prolaktínu [8]. Práce venované sledovaniu vzťahu medzi koncentráciou prolaktínu a komplikáciami cirhózy sú v literatúre zvyčajne popísané na malých súboroch pacientov a nemajú prospektívny charakter. Málo údajov je aj o vzťahu koncentrácie prolaktínu ku cirkulačnej dysfunkcii pri portálnej hypertenzii, ktorá sa prejavuje retenciou nátria, ascitom, renálnym zlyhaním až hepatorenálnym syndrómom a úmrtím.
Ciele práce
- Stanoviť koncentráciu bazálneho prolaktínu u pacientov s cirhózou.
- Porovnať základné klinické, biochemické a prognostické ukazovatele medzi skupinami s normálnou a zvýšenou koncentráciou prolaktínu.
- Zistiť súvislosť medzi koncentráciou prolaktínu a prítomnosťou klinických komplikácií cirhózy, ako sú ascites, ikterus, encefalopatia.
- Zistiť, či stanovenie koncentrácie prolaktínu má prognostický význam a súvisí s objavením sa krvácania z varixov a hepatorenálneho syndrómu počas prospektívneho sledovania.
Charakteristika súboru a metódy
Sledovali sme pacientov s cirhózou, ktorí boli hospitalizovaní alebo ambulantne dispenzarizovaní na V. internej klinike LF UK a FNsP Bratislava. Diagnóza cirhózy bola stanovená na základe klinických, biochemických a zobrazovacích kritérií. Nutná bola prítomnosť ezofageálnych varixov pri endoskopickom vyšetrení pažeráka a/alebo prítomnosť ascitu s albumínovým gradientom viac ako 11 g/l (albumínový gradient = albumín v sére – albumín v ascite). Na začiatku sledovania sme zaznamenali demografické parametre (vek, pohlavie), predpokladanú etiológiu cirhózy, prítomnosť ezofageálnych varixov, štádium ascitu (1, 2 alebo 3 podľa definície Child-Pugh skóre), prítomnosť encefalopatie (aspoň 1. štádium hepatálnej encefalopatie), biochemické a hematologické parametre (počet trombocytov, INR – international normalized ratio, koncentráciu bilirubínu, kreatinínu, albumínu, nátria), bazálnu vstupnú koncentráciu prolaktínu. Stanovili sme aj prognostické indexy Child-Pugh a MELD a štádium portálnej hypertenzie (štádium 1. – bez prítomnosti pažerákových varixov, štádium 2. – prítomnosť pažerákových varixov, štádium 3. – prítomnosť ascitu, štádium 4. – krvácanie z pažerákových varixov). Prospektívne sme sledovali objavenie sa krvácania z pažerákových varixov, hepatorenálneho syndrómu a úmrtie.
Zo súboru sme vylúčili pacientov, ktorí užívali lieky pôsobiace cez dopamínové receptory, ktoré by mohli umelo zvyšovať koncentráciu prolaktínu.
Odber na stanovenia koncentrácie prolaktínu sme vykonali za štandardných podmienok po 15minutovom kľude ráno nalačno zo zavedenej intravenóznej kanyly. Laboratórne parametre boli vyšetrované automatizovanými analyzátormi, koncentrácia prolaktínu bola vyšetrovaná zo séra pomocou imunochemiluminometrickej (ICMA) metódy. Normálne hodnoty bazálnej koncentrácie prolaktínu ako aj ostatných parametrov sú uvedené v tabuľkách.
Alkoholovú etiológiu cirhózy sme potvrdili vtedy, ak bol v anamnéze (vrátane objektívnej) údaj o viac ako 10-ročnej konzumácii etanolu viac ako 20 g u žien a 30 g u mužov. Kryptogénnu etiológiu sme stanovili po vylúčení signifikantnej konzumácie alkoholu, vírusovej etiológie (negativita na anti‑HBc, HbS, anti‑HCV),autoimúnnej etiológie (negativita autoprotilátok, normálne IgG) a metabolických príčin (feritín menej ako 1 000 pmol/l, normálna hladina ceruloplazmínu a α-1-antitrypsínu). Vírusovú etiológiu cirhózy sme stanovili testami na HBs antigén, anti‑HBc IgG protilátky, anti‑HBs a anti‑HCV protilátky. V tabuľkách uvádzame priemerné hodnoty uvedené aj s 95% intervalom spoľahlivosti, pri porovnávaní priemerných hodnôt pre jednotlivé podskupiny sú uvedené len štatisticky významné rozdiely, ak v štatistických testoch bolo p < 0,05. Parametrické dáta pre spojité premenné sme analyzovali pomocou jednocestného ANOVA testu, neparametrické dáta pomocou Mann‑Whitneyho testu a kategorické premenné pomocou χ2 testu. Senzitivitu a špecificitu ako aj prediktívne hodnoty sme zisťovali pomocou ROC krivky po dosadení prevalencie sledovaného stavu v súbore pomocou štatistického programu Medcalc.
Výsledky
Popisnú štatistiku súboru uvádzame v tab. 1. Cirhóza bola u 71 pacientov alkoholovej, u 11 pacientov kryptogénnej a u 8 pacientov vírusovej etiológie.
Priemerná hladina bazálneho prolaktínu bola 14,79 μg/l. Zvýšenú ako normálnu koncentráciu prolaktínu malo 15 pacientov (3 ženy, 12 mužov), t.j. 16,7 % pacientov (19,7 % mužov, 10,3 % žien).
Porovnanie skupiny pacientov s normálnou a vyššou koncentráciou prolaktínu je uvedené v tab. 2. Pacienti so zvýšenou koncentráciou prolaktínu mali priemerne signifikantne vyššie štádium ascitu, ako aj vyššie prognostické skórovacie indexy Child-Pugh a MELD. Zaznamenali sme aj trend ku zvýšenému výskytu encefalopatie v skupine so zvýšenou hladinou prolaktínu (12 % vs 33 %), ale rozdiel nebol štatisticky významný (p = 0,09).
Pacienti bez ascitu mali signifikantne nižšiu koncentráciu bazálneho prolaktínu ako pacienti s 2. a 3. štádiom ascitu (11,97 vs 15,56, resp. 19,99, p = 0,028). Pacienti so známkami encefalopatie v porovnaní s pacientmi bez známok encefalopatie mali signifikantne vyššie koncentrácie prolaktínu (13,93 vs 19,4 μg/l, p = 0,017).
Rozdelením súboru do 4 kvartilov koncentrácie prolaktínu sme analyzovali výskyt komplikácií cirhózy v závislosti od jeho zvyšujúcej sa hladiny. Bližšie v tab. 3. Počas vstupného vyšetrenia sme zaznamenali so zvyšujúcou sa koncentráciou prolaktínu aj signifikantne zvyšujúcu sa koncentráciu bilirubínu a INR (p < 0,05 medzi 1. a 4. kvartilom), albumínu (p < 0,05 medzi 1. a 3. kvartilom) a z nich odvodené prognostické skóre Child-Pugh a MELD (p < 0,05 medzi 1. a 4. kvartilom pre oboje skóre), ako aj signifikantne sa zvyšujúci stupeň ascitu (1,522 vs 2).
Najvýraznejšie však so stúpajúcou koncentráciou prolaktínu rástol aj výskyt hepatálnej encefalopatie (0 vs 31,8 %) (p < 0,05 medzi 1. a 4. kvartilom). Analýzou pacientov s hepatálnou encefalopatiou sme zistili, že koncentráciu prolaktínu nižšiu ako 10,5 μg/l mal len jeden z 13 pacientov. Senzitivita koncentrácie prolaktínu nad 10,5 μg/l pre diagnózu hepatálnej encefalopatie bola 92,9 % pri špecificite 42,1 % a negatívnej prediktívnej hodnote 97 %.
V prospektívnom sledovaní sme zaznamenali rozdiel v miere úmrtnosti medzi 1. a 4. kvartilom (13 vs 40,9 %), ktorý bol nad hranicou štatistickej signifikancie (p = 0,0758). Zostrojením Kaplan-Meierovej krivky prežitia sme však dokázali signifikantne vyššiu mieru prežitia u pacientov v prvom kvartile (85,2 % vs 50 %, p = 0,046, hazard ratio = 0,2881) (obr. 1). Analýzou pacientov, ktorí počas sledovaného obdobia zomreli, sme zistili, že koncentráciu prolaktínu nad prah 11,91 μg/l malo až 21 z 26 pacientov, teda senzitivita koncentrácie prolaktínu nad 11,91 μg/l na predikciu úmrtia bola 80,8 % pri špecificite 56,3 % a negatívnej prediktívnej hodnote 87,8 %. Pre porovnanie sme uviedli senzitivitu a špecificitu zaužívaných prognostických markerov cirhózy (bilirubín, albumín, INR, Child-Pugh, MELD) pre náš súbor, ktoré uvádzame v tab. 4.
Image 1. Kaplan-Meierova krivka prežitia u 1. a 4. kvartilu koncentácie prolaktínu v sére. 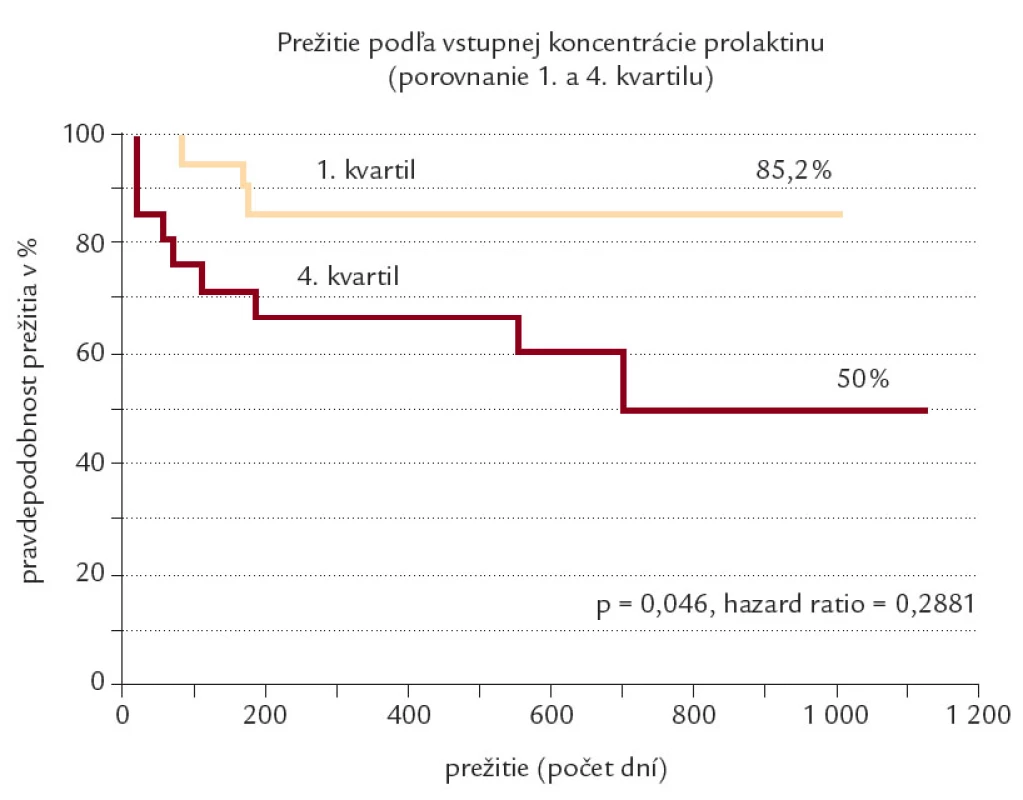
Zistili sme paradoxný trend ku zníženému výskytu krvácania z pažerákových varixov so stúpajúcou koncentráciou prolaktínu (p < 0,05 medzi 1. a 3. kvartilom), rozdiel medzi 1. a 4. kvartilom nebol štatisticky signifikantný. Porovnaním skupín pacientov, ktorí absolvovali endoskopickú sklerotizáciu alebo ligáciu varixov (n = 12) s tými, ktorí túto liečbu nepodstúpili (n = 66), sme zistili, že pacienti po eradikácii varixov mali signifikantne nižšie koncentrácie prolaktínu (9,21 vs 16,14 μg/l, p = 0,005).
Počas sledovaného obdobia sme rozdiely vo výskyte hepatorenálneho syndrómu medzi 1. a 4. kvartilom prolaktínu nezaznamenali a podobne ani medzi ostatnými sledovanými parametrami.
Diskusia
Cirhóza pečene a jej komplikácie patria medzi závažné celospoločenské problémy. Naša krajina patrí medzi štáty s najvyššou úmrtnosťou na cirhózu spomedzi štátov Európskej únie [9]. Súbor pacientov početnosťou prevyšoval doposiaľ publikované práce na túto tému. Jednalo sa o reprezentatívnu vzorku cirhotických pacientov v stredných rokoch s prevahou mužov, etiologicky dominovala alkoholová etiológia a jednalo sa priemerne o stredne závažný stupeň ochorenia s primeraným výskytom komplikácií. V literatúre sa výskyt hyperprolaktinémie u pacientov s cirhózou uvádza na úrovni 8 % mužov a 17 % žien [10]. V našom súbore bola tendencia opačná, ale rozdiel výskytu hyperprolaktinémie medzi pohlaviami nebol štatisticky významný. Signifikantný rozdiel bol len v zastúpení alkoholovej etiológie (90 vs 55 %, u mužov, resp. žien), ostatné parametre neboli štatisticky významné. Alkoholici mali ľahko zvýšenú priemernú koncentráciu prolaktínu oproti ostatným etiológiám, ale ani tam rozdiel nebol štatisticky významný (12,0 vs 15,5 μg/l, p = 0,092).
V súlade s údajmi z literatúry mali pacienti s abnormálnou koncentráciou prolaktínu vyššie štádium ascitu a vyššie prognostické indexy cirhózy [7]. Najmä ascites a encefalopatia boli komplikáciami, ktoré signifikantne ovplyvňovali koncentráciu prolaktínu. V minulosti sa uvažovalo o tom, že vyššia koncentrácia prolaktínu u pacientov s encefalopatiou by mohla mať patogeneticky vplyv. V súčasnosti sa však patogenéza encefalopatie vysvetľuje aj bez úlohy prolaktínu. Pravdepodobnou príčinou elevácie prolaktínu je zrejme vyššia hladina estrogénov, ktoré pri edéme astrocytov zvýšene prechádzajú cez hematoencefalickú bariéru a ovplyvňujú dopaminergné neuróny hypotalamu, ktoré znižujú svoju inhibičnú aktivitu na laktotrofné bunky [10]. Vyššia hladina prolaktínu sa preto skôr javí ako takzvaný „nevinný svedok“ a marker encefalopatie. Ako marker je však pomerne senzitívny a jeho senzitivita a negatívna prediktívna hodnota nami zistených prahov sú na úrovni takých zaužívaných prognostických markerov cirhózy, ako sú INR a albumín. Špecificita a pozitívna prediktívna hodnota sú nízke, ale koncentrácia prolaktínu by mohla pomôcť pri diferenciálnej diagnóze encefalopatie a iných porúch vedomia u pacientov s cirhózou. Pri koncentrácii menšej ako 10,5 μg/l by sa v našom súbore dalo na 97 % vylúčiť, že sa jedná o hepatálnu encefalopatiu.
Súvislosť koncentrácie prolaktínu s progresiou ascitu je taktiež pomerne málo preskúmaná. V našom súbore s narastajúcim stupňom ascitu narastala signifikantne aj priemerná koncentrácia prolaktínu. V minulosti sa uvažovalo aj o možnej úlohe prolaktínu v retencii nátria, pretože prolaktín u niektorých zvierat fyziologicky spôsobuje retenciu sodíka. Jediná štúdia u pacientov s cirhózou dokázala signifikantne zníženú natriurézu po stimulovanej hyperprolaktinémii pomocou TRH [4]. V našom súbore pacienti s akýmkoľvek ascitom (2., 3. štádium) v porovnaní s pacientmi bez ascitu mali signifikantne vyššiu koncentráciu prolaktínu (16,06 vs 11,97 μg/l, p = 0,023). Tieto naše zistenia by mohli podporovať túto teóriu, aj keď v našom súbore sme natriurézu nesledovali. Naopak, pacienti s hepatorenálnym syndrómom vzniknutým počas sledovania nemali vstupnú koncentráciu prolaktínu signifikantne odlišnú od ostatných. Koncentrácia prolaktínu teda súvisí so stupňom ascitu, ale z nášho sledovania nie je možné zistiť, čo je príčina a čo následok.
V našom súbore bola hladina prolaktínu asociovaná s prognostickými markermi ako INR, albumín, bilirubín a skóre Child-Pugh a MELD. Nie je preto prekvapením, že korelovala aj s mierou úmrtnosti počas sledovaného obdobia. Podobná súvislosť bola už aj v minulosti popisovaná v literatúre a uvažovalo sa o použití prolaktínu ako prognostického markera [5]. Senzitivita nami určeného prahu koncentrácie prolaktínu (11,91 μg/l) bola v našom súbore na stredne vysokej úrovni (80 %), o niečo vyššia bola negatívna prediktívna hodnota (87,8 %). Z našich zistení vyplýva, že prolaktín patrí medzi pomerne senzitívne, ale menej špecifické markery úmrtia, akými sú prakticky aj všetky ostatné typické biochemické údaje a skórovacie systémy, bližšie údaje sú v tab. 4. Naše výsledky sa neodlišovali ani od spoľahlivosti týchto markerov u iných autorov [11]. V praxi by mohlo stanovenie koncentrácie prolaktínu pomôcť u podskupiny pacientov, kedy sú tradičné markery modifikované stavom pacienta (vyššia hodnota INR pri deficite vitamínu K, abnormálne nízky albumín pri podvýžive alebo krvácaní, ikterus pri alkoholovej hepatitíde).
Súvislosť medzi objavením sa krvácania z pažerákových varixov a koncentráciou prolaktínu nebola doposiaľ takmer vôbec preskúmaná. Najsilnejším známym prediktorom objavenia sa krvácania z varixov je stupeň portálnej hypertenzie stanovený meraním hepato-portálneho venózneho gradientu. Interpretácia nášho zistenia, keď sme našli tendenciu ku zvýšenému výskytu krvácania z varixov u pacientov so znižujúcou sa hladinou prolaktínu, je otvorená, keďže sme venózny gradient systematicky nestanovovali. V našom súbore sme nenašli žiaden sledovaný parameter, ktorý by signifikantne ovplyvňoval mieru krvácania z varixov. Možné vysvetlenie by mohlo prísť z prípadov, kedy po implantácii TIPSS dochádza ku zníženiu venózneho gradientu, ale ku zvýšenému riziku výskytu hepatálnej encefalopatie, kedy by sme očakávali aj vyššie koncentrácie prolaktínu. To by mohlo znamenať, že krvácajúci pacienti, u ktorých predpokladáme vysoký venózny gradient, majú malý prietok cez portokaválne skraty, a tým aj nižšie riziko encefalopatie pred vypuknutím krvácania. Ani znížená extrakcia prolaktínu pečeňou pri cirhóze pravdepodobne nehrá veľkú rolu, pretože pečeň sa významne nezúčastňuje vylučovania prolaktínu z cirkulácie [12]. Ďalej by to mohlo byť dané pomerne malým množstvom pacientov s krvácaním v jednotlivých kvartiloch prolaktínu, čo by znamenalo chybu malých čísel.
V našom súbore pacientov bola stanovená koncentrácia prolaktínu len na začiatku sledovania, a preto jej dynamiku nebolo možné posúdiť ani po zavedení TIPSS (1 pacient) alebo po objavení sa spontánnej bakteriálnej peritonitídy v rámci sledovania. Zistili sme len signifikantne nižšiu koncentráciu prolaktínu u pacientov po endoskopickej skleortizácii alebo ligácii varixov (n = 12), čo je v kontexte vyššie uvedených úvah o vzťahu koncentrácie prolaktínu a krvácania pri portálnej hypertenzii. Toto zistenie si vysvetľujeme tým, že krvácajúci pacienti v súbore mali signifikantne ľahšie štádium cirhózy podľa Child-Pugh a MELD skóre.
V práci sme stanovovali bazálnu koncentráciu prolaktínu, nie je zatiaľ jasné, či by stanovenie stimulovenj koncentrácie prolaktínu bolo o niečo prínosnejšie.
Záver
Naše zistenia potvrdzujú asociáciu koncentrácie prolaktínu so závažnosťou hepatálneho poškodenia u pacientov s cirhózou. Najvýraznejšie bola v našom súbore jeho koncentrácia asociovaná s prítomnosťou ascitu a hepatálnej encefalopatie. U vybranej skupiny pacientov s cirhózou by preto mohla slúžiť ako alternatívny marker hepatálnej encefalopatie. Dokázali sme aj vzťah koncetrácie prolaktínu ku miere úmrtnosti v prospektívnom sledovaní. Z toho dôvodu je možné prolaktín považovať za alternatívny marker prognózy pri nemožnosti použitia zaužívaných ukazovateľov. Táto práca nesledovala dostatok údajov na to, aby sme objasnili presné patogenetické vzťahy našich pozorovaní, avšak ponúka doposiaľ najväčší súbor pacientov k tejto problematike.
Doručeno do redakce: 16. 9. 2008
Přijato po recenzi: 21. 12. 2008
MUDr. Tomáš Koller, Ph.D.
www.nspr.sk
e‑mail: koller.tomas@gmail.com
Sources
1. DeGroot LJ, Jameson JL. Endocrinology. 5th ed. Philadelphia: Elsevier-Sauders 2005 : 309–319.
2. Simon-Holtorf J, Mönig H, Klomp HJ et al. Expression and distribution of prolactin receptor in normal, fibrotic, and cirrhotic human liver. Exp Clin Endocrinol Diabetes 2006; 114 : 584–589.
3. Taffetani S, Glaser S, Francis H et al. Prolactin stimulates the proliferation of normal female cholangiocytes by differential regulation of Ca2+-dependent PKC isoforms. BMC Physiol 2007; 7 : 6.
4. Soupart A, Buisson L, Prospert F et al. Indirect evidence to suggest that prolactin induces salt retention in cirrhosis. J Hepatol 1994; 21 : 347–352.
5. Mukherjee S, Kar M, Dutta S. Observation on serum prolactin in hepatic cirrhosis. J Indian Med Assoc 1991; 89 : 307–308.
6. Ardizzi A, Saglietti G, Grugni G et al. Blood prolactin patterns in hepatic cirrhosis. Minerva Med 1994; 85 : 511–513.
7. Zietz B, Lock G, Plach B et al. Dysfunction of the hypothalamic-pituitary-glandular axes and relation to Child-Pugh classification in male patients with alcoholic and virus‑related cirrhosis. Eur J Gastroenterol Hepatol 2003; 15 : 495–501.
8. Seehofer D, Steinmueller T, Graef KJ et al. Pituitary function test and endocrine status in patient with cirrhosis of the liver before and after hepatic transplantation. Ann Transplant 2002; 7 : 32–37.
9. Bosetti C, Levi F, Lucchini F et al. Worldwide mortality from cirrhosis: an update to 2002. J Hepatol 2007; 46 : 827–839.
10. Rodés J, Benhamou JP, Blei AT et al. Textbook of Hepatology. 3rd ed. Oxford: Blackwell Publishing 2007 : 1757–1758.
11. Fejfar T, Safka V, Hůlek P et al. MELD score in prediction of early mortality in patients suffering refractory ascites treated by TIPS. Vnitř Lék 2006; 52 : 771–776.
12. Bratusch-Marrain P, Björkman O, Waldhäusl W et al. Hepatic disposal of endogenous growth hormone and prolactin in man. Eur J Clin Invest 1979; 9 : 257–260.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2009 Issue 5-
All articles in this issue
- Algoritmus léčby glukokortikoidy indukované osteoporózy – hledání východisek – editorial
- Srovnání různých metod pro stanovení množství tuku v těle u žen s nadváhou a obezitou
- Srovnání tělesného složení diabetiků 1. typu, obézních jedinců a zdravých dobrovolníků metodou bioelektrické impedanční analýzy
- Vplyv bazálnej koncentrácie prolaktínu na výskyt komplikácií a na prognózu pacientov s cirhózou pečene
- Účinnost terapie pegylovaným interferonem a ribavirinem u pacientů s chronickou HCV infekcí
- Exogénna alergická alveolitída – zriedkavo diagnostikovaná choroba
- Turnerův syndrom vyžaduje multidisciplinární přístup
- Algoritmus liečby glukokortikoidmi indukovanej osteoporózy
- Ivabradin u nemocných se stabilní ischemickou chorobou srdeční a systolickou dysfunkcí levé srdeční komory: výsledky studie BEAUTIFUL
- Je farmakologická léčba chronické tromboembolické plicní hypertenze nadějná?
- Infarkt myokardu – příčina předčasné smrti u Turnerova syndromu
-
CORD: COmparsi on of Recommended Doses of ACE inhibitors and angi otensin II receptor blockers.
Porovnání doporučených dávek ACE inhibitorů a antagonistů receptoru angi otensinu II.
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Exogénna alergická alveolitída – zriedkavo diagnostikovaná choroba
- Turnerův syndrom vyžaduje multidisciplinární přístup
- Srovnání různých metod pro stanovení množství tuku v těle u žen s nadváhou a obezitou
- Infarkt myokardu – příčina předčasné smrti u Turnerova syndromu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career





