-
Medical journals
- Career
Exogénna alergická alveolitída – zriedkavo diagnostikovaná choroba
Authors: D. Lauková; I. Marget; J. Plutinský
Authors‘ workplace: II. oddelenie pneumológie a ftizeológie Špecializovanej nemocnice sv. Svorada Zobor, n. o., Nitra, Slovenská republika, prednosta doc. MUDr. Ján Plutinský, CSc.
Published in: Vnitř Lék 2009; 55(5): 489-500
Category: Reviews
Overview
Exogénna alergická alveolitída (EAA), známa aj ako hypersenzitívna pneumonitída, spôsobuje postihnutie interstícia pľúcneho parenchýmu inhaláciou antigénu. Choroba môže prebiehať akútne, subakútne a chronicky. Akútna forma EAA sa prejavuje najčastejšie symptómami „nádchy“, dýchavicou a kašľom, ktoré vznikajú po období latencie 3–12 hod od expozície antigénu. Chronická forma EAA je charakteristická najmä progredujúcim dyspnoe, zhoršujúcim sa aj pri banálnom infekte dýchacích ciest alebo reexpozíciou antigénu. Zdá sa preto, že diagnostika by mala byť ľahká a prevalencia tejto choroby pomerne vysoká. Realita však poukazuje, že sa toto ochorenie patriace do skupiny intersticiálnych ochorení pľúc podceňuje. Klinický, radiologický, laboratórny a histopatologický obraz vznikajúci po kontakte s inhalačným antigénom napomáha diagnostike EAA. Určenie špecifických protilátok v triede IgG proti očakávanému antigénu sa považuje spolu s ním za dôkaz EAA.
Kľúčové slová:
exogénna alergická alveolitída – typy EAA – klinické prejavy – diagnostika – liečbaÚvod
V súčasnosti sa kladie veľký dôraz na prevenciu, ktorá má zabrániť vzniku ochorení. Respiračný systém je neustále atakovaný množstvom škodlivín. A práve tu môžu pneumológovia uplatniť svoju nezastupiteľnú úlohu – upozorniť na nežiaduce škodliviny v domácom alebo pracovnom prostredí, spolupracovať s kolegami z Úradu pre dohľad nad zdravotnou starostlivosťou, či s kolegami v odbore pracovného lekárstva na znížení incidencie a prevalencie ochorení. Postihnutie pľúc nielen zhoršuje kvalitu života jedinca, ale môže ho aj invalidizovať, alebo nakoniec spôsobí aj jeho zbytočnú smrť.
Jedná sa o množstvo ochorení, na ktoré by mali pneumológovia permanentne poukazovať. Určite k ním patrí aj exogénna alergická alveolitída, ktorá pre relatívne obmedzené možnosti diagnostiky sa ťažko odhaľuje. No v prvom rade je potrebné na ňu myslieť a odlíšiť ju od iných podobne sa prejavujúcich ochorení.
Exogénna alergická alveolitída (EAA),známa aj ako hypersenzitívna pneumonitída, patrí do skupiny intersticiálnych granulomatóznych zápalových pľúcnych ochorení spôsobených expozíciou inhalačných antigénov organického pôvodu. V roku 1713 bola opísaná Ramazinim u osievačov a meračov obilia. Dával ju so súvislosti s rozkladaním obilia, moľami obilnými a plesňou v obilí. Pojem farmárske pľúca sa objavil prvýkrát v anglickej literatúre v roku 1932. Neskôr boli publikované kazuistiky hypersenzitívnych pľúcnych ochorení spôsobených rôznymi antigénmi [5].
Epidemiológia
Exogénna alergická alveolitída je ochorenie, ktoré pre rôznorodosť inhalačných antigénov nemá dostatočne vypracovanú databázu. Vo Veľkej Británii, kde je EAA dlhodobo známa, bola v rokoch 1991–2003 incidencia 0,9 diagnostikovaných prípadov na 100 000 obyvateľov. V Nemecku sa ročne diagnostikuje približne 2,5 prípadov na 100 000 obyvateľov.
Podľa Národného centra zdravotníckych informácií na Slovensku bolohospitalizovaných 2,34 pacientov//100 000 obyvateľov pre EAA v roku 2006, kým v roku 2002 to bolo len 1,88/100 000. Presná incidencia alebo prevalencia výskytu EAA neexistuje.
Pozorované sú rozdiely vo výskyte EAA podľa lokalít. Sú známe oblasti vo Francúzsku (Rougemont, Clerval, Levier, Montbenoit, Mouthe), kde je pomerne vysoká prevalencia (43,7/1 000) prípadov EAA typu farmárskych pľúc, pričom potvrdila prevahu výskytu u mužov (zo 77 prípadov farmárskych pľúc bolo 53 mužov) v strednom veku [26,31]. Epidemiologická štúdia Depierrea et al zistila protektívny vplyv chladu pred vzniku tohto ochorenia. Zvýšená vlhkosť podporuje jej zvýšený výskyt, najmä typu farmárskych pľúc [26]. Toto sa potvrdilo i v prácach Terhoa a Malmberga, ktoré popisujú vo Fínsku priemernú ročnú incidenciu farmárskych pľúc vedúcich ku potrebe hospitalizácie v roku 1980 5/10 000 farmárov a vo Švédsku 2–3/10 000 farmárov ročne [27,28].
Takisto sa potvrdil predilekčný výskyt určitých foriem EAA podľa inhalačného antigénu v pracovnom alebo životnom prostredí (tab. 1). Napr. v automobilovom priemysle, najmä u lakovačov vystavených účinku inhalačne pôsobiaceho diizocyanátu sa tento typ EAA vyskytuje od 1 do 4,7 % [24,25]. V Japonsku prevažuje tzv. letná hypersenzitívna pneumonitída (až 75 % prípadov). V rokov 1980–1989 tu pomocou celonárodného dotazníka zistili 835 prípadov hypersenzitívnej pneumonitídy [31].
Etiológia
Exogénna alergická alveolitída, čiže hypersenzitívna pneumonitída, je vyvolaná množstvom inhalačných alergénov (tab. 1). Antigény môžu byť organické vysokomolekulárne kompletné antigény (veľkosti partikúl do 5 μm), ale aj nízkomolekulárne haptény, ktoré reagujú s bielkovinami v dýchacích cestách, kde utvoria kompletný antigén [5].
Rastlinné prachy vznikajúce pri kosení alebo pri manipulácii s ryžou, obilím, ovsom, pšenicou, senom, slamou, drevom a kompostom môžu spôsobiť nežiaduce pľúcne reakcie. Podobné reakcie nastanú u senzibilných jedincov po expozícii prachu v ošipárňach, maštaliach, hydinárskych halách, ale aj pri prácach súvisiacich s činnosťou v nich. Tomuto riziku môžu byť vystavení farmári, obchodníci s obilím, potravinári, lesníci, murári, pracovníci na čističkách odpadových vôd, v laboratóriách, aj osoby pracujúce v miestnostiach s ventilátorovým vybavením. Rozvoj EAA sa pozoruje aj pri používaní domácich víriviek, bazénov, zvlhčovačov, fontán, ale aj pri saunovaní [30] (tab. 2).
Rizikové faktory a kofaktory
Vznik EAA ovplyvňujú viaceré faktory, a to klimatické, sezónne, geografické vplyvy, miestne zvyky, fajčenie, rôzne pracovné postupy a metódy. Najlepšie sú opísané vplyvy expozičných faktorov u EAA typu farmárskych pľúc. Výskyt tohto typu EAA je vyšší v neskoršom zimnom období pri práci s uskladneným senom používaným na kŕmenie dobytka v oblastiach so zvýšenou vlhkosťou a častými dažďami. Sezónna závislosť sa pozorovala aj u pľúc chovateľov holubov. Vrchol produkcie protilátok u predisponovaných jedincov sa zaznamenal v neskoršom letnom období a dáva sa do vzťahu so sezónnym sťahovaním holubov [38,39].
Vzťah k latencii, prevalencii, stupňa a priebehu EAA má aj antigénová koncentrácia, dĺžka expozície, frekvencia, či intermitentnosť expozície, veľkosť partikúl, solubilita antigénu, použitie respiračnej ochrany a pracovnej metódy.
EAA postihuje väčšinou nefajčiarov, čo sa dáva do súvislosti s imunitnou odpoveďou. Sú rôzne vysvetlenia, napr., že fajčenie utlmuje odpoveď imunoglobulínu G (IgG) na inhalované antigény, tvorbu cytokínov a funkciu makrofágov [31].
Niektoré kazuistiky poukazujú na dlhodobú expozíciu antigénov bez symptomatiky EAA, ktorá mohla prebiehať aj inaparentne. Symptomatika EAA sa rozvinula po respiračnej infekcii, napr. Mycoplasma pneumoniae (farmárske pľúca), Chlamydia psittaci, Chlamydia pneumoniae, Cryptococcus neoformans (pľúca chovateľov holubov), Influenza virus A, BCG (Bacil Calmette Guérin) [31].
Patogenéza
Imunitná reakcia spôsobená antigénom závisí od individuálnej vnímavosti jedinca a množstva antigénu, či sa rozvinie imunokomplexový zápal (III. typ podľa Coombsa a Gella) na úrovni alveolov pri akútnej forme EAA alebo oneskorený typ precitlivelosti sprostredkovaný T‑lymfocytmi (IV. typ alergickej reakcie podľa Coombsa a Gella) pri jej chronickom priebehu. Na poškodení pľúcneho tkaniva sa podieľa humorálna aj bunková imunitná reakcia [4].
Zápalová reakcia alveolárnej steny a interstícia nastáva po niekoľkých hodinách po inhalácii antigénov.
Odpoveď organizmu na expozíciu uvedených antigénov v tab. 1 nie je ešte úplne objasnená. Je zrejmé, že existuje určitá individuálna senzibilita (genetická predispozícia). Len u 5–15 % ľudí s možnou predispozíciou vystavených antigénom sa vyvinie exogénna alergická alveolitída, napr. asi u 3,4 % chovateľov anduliek a papagájov, u 8 % chovateľov holubov a asi u 4,3 % farmárov [26,32,33]. Expozícia antigénom vedie k senzibilizácii s humorálnou alebo celulárnou imunitnou odpoveďou, ale neprogreduje do zjavného ochorenia [31].
Niekoľko štúdií poukázalo na vzťah typu HLA (human leukocyte antigen) a EAA. Pri EAA typu chovateľov holubov sa pozoroval vyšší výskyt HLA‑DR7 u mexickej populácie, u belochov s farmárskymi pľúcami HLA‑B8 a u Japoncov s letnou hypersenzitívnou pneumonitídou HLA‑DQw3 [34–37].
Bola dokázaná súvislosť medzi niektorými polymorfizmami génu pre HLA II. triedy a génu pre TNF ‑ a rozvojom EAA. Ďalším uľahčujúcim faktorom pre rozvoj EAA je aj porucha funkcie regulačných T‑lymfocytov. K ďalším promotorom patrí infekčný agens, inhalácia chemikálií, tehotenstvo a popôrodné obdobie [2,9].
Na regresii choroby sa podieľajú zrejme T‑lymfocyty sprostredkovanou desenzitizáciou, tvorba protizápalových látok vrátane antiproteáz a antioxidačných látok. Progresiu zapríčiní pokračujúca expozícia inhalačného antigénu, čím dochádza k rozvoju chronického priebehu EAA. Vtedy zaznamenávame vyššiu produkciu kolagénu pľúcnymi fibroblastami, zníženú kolagenolytickú aktivitu a exscesívnu produkciu inhibítorov kolagenáz v pľúcach [2].
Antigény spôsobujúce vznik EAA aktivujú komplement alternatívnou cestou. Stimulujú alveolárne makrofágy s následnou bunkovou odpoveďou. Napr. bunková stena viacerých plesní a spór húb obsahuje β-1(1-3)-D-glukán, ktorý môže aktivovať alveolárne makrofágy interakciou so špecifickým receptorom, a tým spôsobí uvoľnenie IL‑1 (interleukín 1) a TNF‑α (tumor necrosis factor α). Väčšina antigénov EAA sú rezistentné na degradáciu. Alveolárne makrofágy tvoria rôzne proinflamačné (zápal podporujúce) mediátory (cytokíny, chemokíny). IL‑8 spôsobuje prenikanie neutrofilov do alveolov, teda vznik neutrofilnej alveolitídy v prvých 48 hod po antigénovej expozícii. Ďalšia antigénová stimulácia alveolárnych makrofágov vedie ku sekrécii IL‑12, čím dochádza ku diferenciácii CD4+ Th0‑lymfocytov na Th1‑lymfocyty. Proinflamačné cytokíny IL‑1 a TNF‑α stimulujú Th1‑lymfocyty ku tvorbe INF-γ (interferón γ). Chemokíny IL‑8 a MCP-1 (monocyty-chemo‑attractant-protein‑1) spôsobujú lymfocytovú infiltráciu a tvorbu granulómov. Prenikajú sem CD8+ lymfocyty. Aktivované alveolárne makrofágy a CD8+ lymfocyty produkujú MIP‑1 α (macrophagy inflammatory protein‑1 α), ktorý uľahčuje diferenciáciu alveolárnych makrofágov na epiteloidné bunky a viacjadrové obrovské bunky a vedie ku tvorbe granulómov. Významnú úlohu pri vzniku chronického štádia exogénnej alergickej alveolitídy s progredujúcou parenchýmovou prestavbou do ireverzibilnej pľúcnej fibrózy môže mať sekrécia TNF‑α a TGF‑β (transforming-growth-factor-β) aktivovanými alveolárnymi makrofágmi [5,20,31].
Klinické prejavy
Symptómy EAA závisia od priebehu ochorenia (tab. 3 a 4). Choroba má akútnu, subakútnu a chronickú formu. Pri akútnom priebehu EAA je dôležitý časový interval od senzibilizácie a začiatku ťažkostí. Príznaky sa vtedy objavujú po latentnom období 3–12 hod a trvajú najviac 48 hod po expozícii. U pacientov s bronchiálnou astmou respiračné ťažkosti vznikajú hneď po inhalácii alergénu. Viac ako 95 % pacientov s EAA má najčastejšie prejavy „chrípky“ („flu‑like“), náhleho dyspnoe a kašľa.
Naopak pri chronickom priebehu EAA dominuje pretrvávajúce dyspnoe, pričom úplne chýbajú „flu‑like“ symptómy.
Diferenciálne-diagnosticky je veľmi dôležitý auskultačný nález koncovo-inspiračných krepitov až chropkov, ktoré sa naopak nevyskytujú pri toxickej alveolitíde (napr. organic dust toxic syndrome) [4,5].
Pri dlhšej expozícii antigénu alebo opakovaných atakoch pôsobenia antigénu sa môže vyvinúť subakútna forma EAA, ktorá po odstránení antigénu buď odoznie, alebo dôjde k rozvoju chronickej formy EAA s pretrvávaním symptómov niekoľko mesiacov až rokov [4].
Diagnostika
Stanovenie diagnózy EAA nie je ľahké. Cielená anamnéza pacienta (pracovná, voľnočasová, sociálna, bytová, epidemiologická – kontakt so zvieratami, lieková) má veľký prínos pri dokazovaní EAA. Je potrebný dôkaz presného antigénu z domáceho alebo pracovného prostredia, ako aj meranie presnej koncentrácie substancií vo vzduchu na určenie expozície jedinca antigénom. Detekujeme tiež špecifické protilátky v triede IgG proti danému antigénu. Na ich dôkaz používame techniku ELISA alebo imunofluorescenčný test, pričom zistíme ich vysokú koncentráciu najmä po predchádzajúcej expozícii inhalovaného antigénu. Po dlhšom období bez expozície antigénu (6–12 mesiacov) pozorujeme ich pokles. Nízke koncentrácie špecifických IgG protilátok môžeme zaznamenať aj u zdravých ľudí. Ak sa však ich koncentrácia zvýši po kontakte s antigénom a vyvolá aj ostatné príznaky, je nepochybné, že sa jedná o exogénnu alergickú alveolitídu. Zriedkavo sa vyskytuje aj séronegatívna EAA (tab. 5) [4,16]. Pri séronegatívnej EAA sa môže jednať o ochorenie s nízkou, zle detekovateľnou hladinou špecifických protilátok pri použití nevhodnej diagnostickej metodiky (Ouchterlonyho metóda). Preto sa zlatým štandardom diagnostiky stali vyššie uvedené techniky (senzitivita a špecificita viac ako 90 %) [23]. No aj pri ich použití sa môže stať, že nemusíme detekovať nízku hladinu špecifických protilátok aj u pokročilej chronickej progredujúcej formy exogénnej alergickej alveolitídy (tab. 5) [15]. Na Slovensku (NÚTaRCH a HCH Vyšné Hágy) sa zatiaľ na diagnostiku používa dvojitá imunodifúzia a aglutinácia na agarovom géle podľa Ouchterlonyho.
Existujú pracoviská (Japonsko, USA), ktoré používajú na diagnostiku aj detekciu špecifických protilátok v triede IgM v sére, prípadne aj detekciu špecifických protilátok v triedach IgG, IgM, IgA aj v bronchoalveolárnej lavážnej tekutine. Tu je podiel zvýšených hodnôt špecifických protilátok opačný ako v sére, a to IgA > IgM > IgG [17].
V laboratórnych výsledkoch pozorujeme pri akútnom priebehu alebo akútnej exacerbácii chronickej EAA leukocytózu (76 % prípadov), zvýšené CRP (C‑reaktívny proteín) (72 %), zvýšený imunoglobulín (Ig) G (65 %) a zvýšenú sedimentáciu erytrocytov (46 %) [4], ako aj zvýšené sérové IgA, IgM a LDH (laktát-dehydrogenáza), ale nie IgE a eozinofíliu. U 50 % pacientov sa vyskytuje aj falošne zvýšený reumatoidný faktor, a to v triede IgM v prípadoch pozitívnej sérológie na Pertussis a Mycoplasma pneumoniae, pričom nie sú prítomné artralgie [11,19].
RTG nález. Pri akútnej EAA má 38 % pacientov normálny RTG nález na konvenčnej snímke hrudníka. U ostatných nachádzame najčastejšie bilaterálny nález mliečneho skla v stredných a dolných pľúcnych poliach (obr. 1). Je to spôsobené pľúcnym nodulárnym a miliárnym rozsevom. Zriedkavo aj okrúhle a lineárne opacity, zhrubnuté septálne línie, zhrubnutie pleury, pozorujeme malú hílovú alebo mediastinálnu lymfadenopatiu. Pri karencii antigénu a vplyvom imunosupresívnej liečby dochádza ku regresii pľúcneho nálezu (obr. 2). Pri chronickom priebehu EAA sa stretávame s obrazom retikulonodulárnej infiltrácie najmä v stredných a horných pľúcnych poliach. Bývajú prítomné aj známky pľúcneho emfyzému a cor pulmonale (obr. 3) [4].
Image 1. RTG obraz akútneho štádia EAA typu chovateľov holubov u 29-ročného pacienta [40]. ![RTG obraz akútneho štádia EAA typu chovateľov holubov u 29-ročného pacienta [40].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/e10c555447fc18faab75b1e63136b816.jpeg)
Image 2. RTG obraz po odoznení akútneho štádia EAA typu chovateľov holubov pri karencii antigénu u 29-ročného pacienta [40]. ![RTG obraz po odoznení akútneho štádia EAA typu chovateľov holubov pri karencii antigénu u 29-ročného pacienta [40].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/5a65bd47f4c7aa18c536434b76fced2e.jpeg)
Image 3. RTG obraz chronického štádia EAA typu pľúc chovateľov holubov u 63-ročného pacienta. 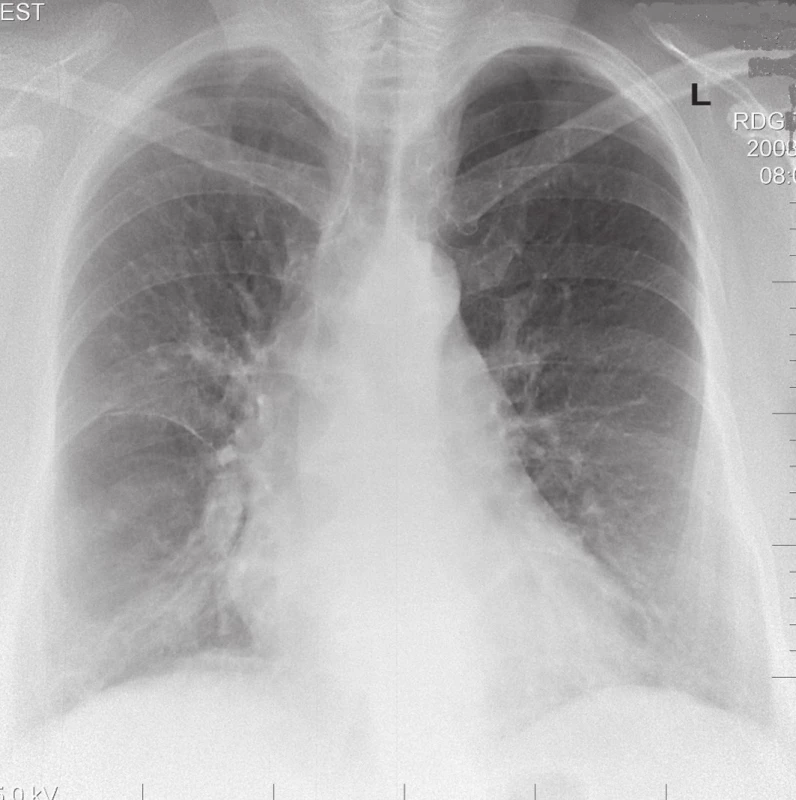
CT a HRCT. Senzitivita CT (počítačová tomografia) a obzvlášť HRCT hrudníka (počítačová tomografia s vysokou rozlišovacou schopnosťou) sa výrazne zvyšuje, ale negatívne HRCT pľúc nález EAA nevylučuje. Typický obraz akútnej EAA pri HRCT vyšetrení pľúc je obraz mliečneho skla vo všetkých pľúcnych poliach. Pri subakútnej EAA sú charakteristické centrilobulárne mikronoduly, neostro ohraničené infiltráty mliečnosklenej hustoty a následkom air-trappingu na expiračných skenoch aj mozaikovité vzory (obr. 4). Môžeme nájsť aj „tree-in‑bud“ fenomén spojený s bronchiolitídou. „Tree-in‑bud“ je výraz pre HRCT obraz centrilobulárnych opacít zložených z mikronodulov spojených líniami, pričom sa podobajú na pučiaci strom. Pri chronickej EAA je prítomný obraz mliečneho skla a centrilobulárne nodulárne infiltráty, ale nie v popredí. Charakteristický je obraz retikulonodulácie až plástových pľúc. Tieto pri idiopatickej pľúcnej fibróze (IPF) sú uložené subpleurálne. Chorí na farmárske pľúca môžu mať na HRCT pľúc skôr obraz pľúcneho emfyzému než postihnutie interstícia [4,6]. Naopak chorí na pľúca chovateľov holubov sa prevažne diagnostikujú až v pokročilom štádiu pľúcnej fibrózy [2]. Táto vôbec nevzniká u pacientov s bysinózou [6].
Image 4. HRCT obraz akútneho až subakútneho štádia EAA typu chovateľov holubov u 29-ročného pacienta. Prítomné difúzne intersticiálne zmeny fibrotického charakteru, čerstvé ložiskové zmeny neprítomné, mediastinálna LAP do 15 mm [40]. ![HRCT obraz akútneho až subakútneho štádia EAA typu chovateľov holubov u 29-ročného pacienta. Prítomné difúzne intersticiálne zmeny fibrotického charakteru, čerstvé ložiskové zmeny neprítomné, mediastinálna LAP do 15 mm [40].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/edc66cdf43fc904f71b4425a5aa93362.jpeg)
Bolo dokázané, že oblasti charakteru mliečneho skla na HRCT hrudníka korelujú s histopatologickým obrazom alveolitídy a reverzibilných zápalových zmien. Naopak RTG obraz plástových pľúc predstavuje progresívne prebiehajúcu EAA so zlou prognózou.
V súčasnosti môžeme uplatniť aj výhodu HRCT vyšetrenia pľúc s kvantitatívnou histogramovou analýzou. Táto RTG metóda, nazývaná aj kvantitatívna počítačová tomografia pľúc (QCT pľúc) alebo pľúcna denzitometria, vyvinutá Kalenderom (1994) zahŕňa nielen samotné HRCT vyšetrenie pľúc so zobrazením pľúcneho parenchýmu, ale aj následné kvantitatívne vyhodnotenie obrazu (kvantitatívna analýza denzít s určením percentuálneho výskytu denzít pri definovaných intervaloch) pomocou špeciálneho softvérového programu. HRCT obraz pľúc v štádiu subklinickej alveolitídy môže byť vizuálne negatívny, ale pri softvérovej kvantifikácii sa zistí zvýšený C index (viskózny index). Tento býva zvýšený pri obraze ground glass opacity (obraz mliečneho skla – GGO) ako prejave skorej fázy i aktivity choroby. Ak je obraz GGO spojený s dilatovanými bronchiolami, prezentuje to nález progredujúcej fibrotickej prestavby pľúc. Vtedy je zvýšený D index (fibrózny index), ktorý signalizuje prechod do fibrotického štádia ochorenia, ktoré už odhalí aj HRCT bez QCT. Podľa Moczovej relevantné výsledky v C indexe pri korelácii HRCT/QCT a analýza BAL (bronchoalveolárna laváž) majú prínos v diagnostike ochorenia, jeho štádia a aktivity [13]. HRCT/QCT je reprodukovateľná, objektívna a vysokosenzitívna metóda [7,13].
Funkčné vyšetrenie pľúc neodlíši diagnosticky EAA. V akútnom štádiu exogénnej alergickej alveolitídy zaznamenávame hypoxemickú respiračnú poruchu s reštrikčnou ventilačnou poruchou (spirometricky). Hypoxémia sa môže prejaviť aj pri záťažovom funkčnom vyšetrení pľúc. Spiroergometrickým vyšetrením zisťujeme aj vyšší arterioalveolárny gradient pO2 (parciálny tlak kyslíka), zvýšenú ventiláciu mŕtveho priestoru. Spirometricky asi u 10 % prípadov chronického štádia EAA zaznamenáme obštrukčnú ventilačnú poruchu [20]. Stupeň ventilačného postihnutia nekoreluje s prognózou EAA. U pokročilej chronickej EAA sa vytvára pľúcny emfyzém. Pozorujeme taktiež bronchiálnu hyperreaktivitu u 20–40 % prípadov. Vyšetrením difúznej kapacity pľúc pre CO (oxid uhoľnatý) môžeme odhaliť postihnutie pľúcneho interstícia znížením jeho hodnoty, najmä v prepočte na alveolárny objem (DLCO SB/VA) [4]. V akútnom štádiu exogénnej alergickej alveolitídy môžeme zistiť aj bronchiálnu hyperreaktivitu, ktorá býva skÔr patognomická pre bronchiálnu astmu (tab. 8).
Bronchoalveolárna laváž (BAL). Bronchoalveolárna laváž je štandardizovaná metodika používaná v pneumológii. Pomocou bronchoskopického vyšetrenia sa instiluje do bronchu vedúceho do postihnutého pľúcneho parenchýmu (verifikovaného HRCT vyšetrením pľúc, najčastejšie to býva pravý stredný lobárny bronchus) fyziologický roztok, pričom následnou aspiráciou sa získa bronchoalveolárna lavážna tekutina. Je vhodná na diagnostiku vybraných intersticiálnych a granulomatóznych pľúcnych chorôb. Intrabronchiálne pomocou bronchoskopie sa zistí často len katarálny zápal bronchov. V BAL tekutine (BALT) zisťujeme najčastejšie (až v 60 %) lymfocytózu (norma do 15 %), najmä pri subakútnej EAA [11]. Táto neurčuje prognózu, naopak býva aj u zdravých ľudí, u ktorých sa môže rozvinúť EAA. Imunoregulačný index (IRI – pomer subpopulácií T‑lymfocytov CD4+/CD8+, norma u nefajčiarov 2,6 ± 0,2, u fajčiarov 1,3 ± 0,1) je vo väčšine prípadov znížený (pod 1,3), normálny alebo zvýšený index tiež EAA nevylučuje [5,16].
V BALT-e môžu byť prítomné mastocyty, plazmatické bunky a penovité makrofágy.
BAL sa má realizovať do 48 hod od expozície antigénu. Vtedy zisťujeme (v prvých hodinách po kontakte s antigénom) zvýšený podiel neutrofilov [4]. Pri EAA hladina špecifických imunoglobulínov (Ig), ako aj pomer IgA, IgM, a IgG ku albumínu v BAL tekutine je zvýšená. Súvisí to s lokálnou produkciou Ig plazmatickými bunkami [11].
Histológia. Histologický obraz sa vyznačuje intersticiálnou, často centroacinárnou lymfocytovou infiltráciou. Polovica prípadov má necharakteristické epiteloidné, v pľúcnom parenchýme sa vyskytujúce granulómy ako pri BOOP reakcii. Trias zostavený z lymfocytárnej intersticiálnej alveolitídy v kombinácii s granulómami a BOOP reakciou zodpovedá plnému histologickému obrazu EAA.
V pokročilých prípadoch pri chronickom priebehu môže vzniknúť intersticiálna fibróza, ktorá sa ťažko diferenciálno-diagnosticky odlišuje od usual interstitial pneumonitis (UIP) a fibrotickej formy nonspecific interstitial pneumonitis (NSIP). Celulárna varianta NSIP môže znázorniť vlastný histologický obraz EAA, a preto ju tiež musíme oddiferencovať.
Epiteloidné granulómy v popredí histologického obrazu môžu napodobniť sarkoidózu.
BOOP (bronchiolitis obliterans organising pneumonia) reakcia pri chronickom štádiu EAA sa musí odlíšiť od kryptogénnej organizujúcej pneumónie.
Pľúcna biopsia nie je potrebná pri stanovení diagnózy exogénnej alergickej alveolitídy (hypersenzitívnej pneumonitídy), ale pri diferenciálno-diagnostickom probléme by sa mala zvážiť jej realizácia buď bronchoskopicky (transbronchiálnou biopsiou), alebo videotorakoskopicky podľa klinického stavu pacienta (riziko/benefit).
Ak neobjasníme diagnózu EAA dostatočne reprezentatívnou bronchoskopicky získanou vzorkou (transbronchiálna biopsia) (obr. 5,6), má význam vyšetrenie väčšej vzorky získanej tzv. otvorenou pľúcnou biopsiou (napr. videoasistovanou torakoskopiou – VATS). Ak sa nájde histologicky nešpecifikovaná intersticiálna pneumónia bez fibrózy (NSIP) alebo BOOP podobný histologický obraz, predstavuje tu často klinicky akútnu formu EAA. Pri chronickej forme EAA so zlou prognózou nachádzame zväčša obraz UIP alebo NSIP s fibrózou (tab. 6) [10,14].
Obr. 5, 6. Histologický obraz EAA z materiálu získaného transbronschiálno u biopsiou pľúc. Rozšírené interalveolárne septá infiltrované lymfocytmi, histiocytmi v časti alveolov s obrazom nešpecifckého organizujúceho alveolárneho poškodeni a s organizáciou exsudátu s ojedinelou viacjadrovou bunkou [40]. ![Obr. 5, 6. Histologický obraz EAA z materiálu získaného transbronschiálno u biopsiou pľúc. Rozšírené interalveolárne septá infiltrované lymfocytmi, histiocytmi v časti alveolov s obrazom nešpecifckého organizujúceho alveolárneho poškodeni a s organizáciou exsudátu s ojedinelou viacjadrovou bunkou [40].](https://pl-master.mdcdn.cz/media/image/46baee8ab9b4b65e19855e88d681c927.jpeg?version=1537790297)
Karenčný test. Početné antigény, ako posteľné perie, perie z okrasných vtákov, antigény izbových zvlhčovačov a fontán apod., spôsobujú už vyššie uvedené ťažkosti. Vyhýbaním sa kontaktu s nimi nedôjde k rozvoju príznakov akútnej EAA. Tento mechanizmus sa využíva pri diagnostike EAA spôsobenej antigénom z domáceho alebo profesionálneho prostredia po pokojnom období. Bezpríznakové obdobie môže predstavovať dovolenka, víkend alebo aj pobyt v nemocnici, počas ktorého pri karencii antigénu ustúpia príznaky EAA. Reexpozíciou antigénu (napr. pondelkové zhoršenie v práci) sa naopak objavia alebo zhoršia symptómy EAA (tzv. karenčný reexpozičný test).
Inhalačné expozičné alebo provokačné testy. Diagnostické inhalácie antigénov, v zmysle napodobniť vyššie uvedený karenčný reexpozičný test, by sa mali realizovať v špeciálnych centrách. Tieto musia mať skúsenosti s testovaním inhalačných antigénov, ako aj s možnosťou intenzívnej liečby pre vznikajúcu závažnú hypoxémiu. Kontraindikáciou antigénovej expozície alebo provokácie sú hypoxémia (paO2 pod 60 mm Hg), zníženie vitálnej a totálnej kapacity pľúc pod 50 % náležitej hodnoty, akútny infekt alebo závažné sprievodné ochorenie (napr. bronchiálna obštrukcia s rezistenciou od ≥ 0,5 kPa.s/l alebo špecifickou rezistenciou ≥ 2,0 kPa.s). Relatívnou kontraindikáciou je imunosupresívna liečba, najmä systémovými kortikosteroidmi [4]. Pri expozičnom teste sa hodnotí dynamika parametrov funkčného vyšetrenia pľúc. V špecializovaných pracoviskách sa realizuje test in‑vitro proliferácie T‑lymfocytov z periférnej krvi alebo optimálne z BAL tekutiny [10].
Súhrn – diagnostické kritériá
Štyri silné neinvazívne EAA sú podľa Lacasse a spolupracovníkov:
- dôkaz antigénovej expozície
- závislosť vzniku klinických príznakov po 3–12 hod po expozícii s antigénom
- špecifické IgG protilátky v sére
- end‑inspiračný krepitus až chropky
Ďalšie dôležité diagnostické kritériá sú:
- RTG známky typické pre EAA na konvenčnej snímke hrudníka alebo na HRCT
- artériová hypoxémia v kľude a/alebo po záťaži, alebo znížená difúzna kapacita pľúc pre CO
Splnenie vyššie uvedených 6 kritérií stačí na stanovenie diagnózy EAA. Ak jedno z nich chýba, môže ho nahradiť ďalšie kritérium:
- lymfocytóza v BAL-e
- histopatologický dôkaz z pľúcnej biopsie
- pozitívny karenčný test
- pozitívny inhalačný expozičný alebo provokačný test [4]
Diferenciálna diagnostika
Akútnu EAA musíme odlíšiť najmä od toxickej alveolitídy, obzvlášť od ťažkostí spôsobených toxickým pôsobením organických prachov (organic dust toxic syndrom – ODTS, tab. 9), najčastejšie tzv. chorobu silážnikov zapríčinenú oxidom dusíka [8]. Pri ODTS nachádzame zväčša u poľnohospodárov len respiračné ťažkosti bez RTG a HRCT známok EAA. Nezistíme ani vysoké hladiny špecifických IgG v sére ako aj postihnutie interstícia funkčným vyšetrením pľúc. U 1–8 % zdravých ľudí potvrdíme nízke hladiny špecifických IgG protilátok v sére. Musíme oddiferencovať recidivujúce vírusové alebo baktériové infekcie dýchacích ciest, pneumónie, bronchitídy, alergické a imunologické pľúcne ochorenia (napr. bronchiálnu astmu – tab. 8, bronchopulmonálnu mykózu, beryliózu, autoimunitné choroby, vaskulitídy, granulomatózy – tab. 7, ďaľšie intersticiálne ochorenia pľúc, napr. pneumokoniózy, sarkoidózu a IPF alebo poliekové postihnutie pľúc) [4,18,22].
Liečba EAA
EAA je spôsobená inhaláciou organického antigénu, preto základom liečby EAA je vylúčenie expozície daného antigénu v domácom alebo profesionálnom prostredí. Klinickým vyšetrením ho musíme najprv presne identifikovať. V niektorých prípadoch je karencia antigénu ťažká [10]. Napr. chorí s pľúcami chovateľov holubov musia tiež odstrániť perové vankúše a prikrývky. Odporúčané je používanie masiek s filtrom a dostatočné vetranie pracoviska. Ideálna je zmena zamestnania. Úspešné sú aj zmeny technologického spracovania, použitie fungicídov, klimatizačných a ventilátorových zariadení so suchým systémom.
Následne musíme včas zvážiť medikamentóznu liečbu. Inhalačné a celkové bronchodilatanciá majú len symptomatický efekt. Zápalovú reakciu najlepšie ovplyvnia kortikoidy. Antihistaminiká a inhalačné kromoglykány sú neúčinné.
V praxi sa zväčša uplatňujú celkové, najmä perorálne kortikoidy. Ich dĺžka podávania je individuálna a závisí od klinického priebehu ochorenia. V akútnej fáze EAA s výraznou symptomatikou sa odporúčajú vysoké útočné dávky prednisonu až 1 mg/kg dospelého pacienta a deň v rannej dávke, u detí 4–5 mg/m2 denne [5,40]. Bežne v praxi používame 40 mg prednisonu per os počas 4–6 týždňov v subakútnej fáze až do klinickej odpovede (najmä úprava RTG a funkčných zmien). Podávanie kortikoidu s týmto dávkovaním sa predlžuje v chronickej fáze EAA na 6–8 týždňov. V tejto fáze prevažujú fibrotické zmeny v pľúcnom tkanive, ktoré už imunosupresívna liečba neovplyvní. Avšak dlhšie podávanie kortikoidov indikujeme, keď nedokážeme dostatočne eliminovať expozíciu antigénu z prostredia. V týchto prípadoch postupne znižujeme dávku prednisonu (každých 3–5 dní o 5 mg) na 10 mg denne.
Pri liečbe kortikoidmi musíme vysadiť liečbu estrogénmi, sledovať kaliémiu. Hypokaliémia navodzuje sekundárne digoxínovú toxicitu, zvyšuje metabolizmus fenobarbitalu, fenytoínu a rifampicínu, zhorší sa pri užívaní tzv. kľučkových diuretík. Pri liečbe kortikosteroidmi sledujeme glykémie (steroidný diabetes mellitus), hladiny amyláz pre možnosť pankreatitídy, osteodenzitometriu (sekundárna osteoporóza), neurologické zmeny (zhoršenie myasthenia gravis, vznik myopatie), vyšetríme pacienta gastroskopicky pre riziko vzniku erozívnej gastropatie až peptického vredu gastroduodéna. U niektorých pacientov pozorujeme aj zmeny psychiky (eufória, psychóza) a zvýšené riziko infekcií (imunosupresívny vplyv), vznik edémov pre kumuláciu nátria v organizme alebo vývoj katarakty. Indikácia prednisonu v gravidite musí prevážiť benefit nad rizikom.
V liečbe sa skúšajú aj lieky znižujúce produkciu cytokínov, ako napr. pentoxyfilín, infliximab a etanercept [2,5]. V praxi možno použiť podľa individuálneho zváženia aj azatrioprin, cyklofosfamid a iné imunosupresíva najmä pri intolerancii alebo nedostatočnej účinnosti steroidov [12].
Ireverzibilné postihnutie pľúc charakterizované pľúcnou fibrózou má závažnú prognózu bez efektu vyššie uvedených opatrení a medikamentóznej liečby. Dochádza k rozvoju cor pulmonale s potrebou liečby chronickej kardiopulmonálnej insuficiencie, vrátane oxygenoterapie.
Záver
Exogénna alergická alveolitída popísaná už v roku 1713 je pomerne zriedkavé alebo zriedkavo diagnostikované ochorenie. Presné údaje o prevalencii EAA nie sú známe. Aj napriek mnohým súčasným diagnostickým možnostiam zostáva často dlhodobo nepoznaná a zamieňa sa s iným ochorením. Musíme na ňu v prvom rade myslieť a odlíšiť ju od ostatných podobne sa prejavujúcich chorôb. Správnym odobratím anamnézy, nepodceňovaním najmä pracovnej súvislosti s recidivujúcimi príznakmi pri expozícii antigénu ju môžeme odhaliť pomerne rýchlo. Identifikácia antigénu, jeho včasná eliminácia a včas nasadená potrebná liečba kortikoidmi znižuje možnosť prechodu ochorenia do chronického ireverzibilného štádia. V praxi je často problematická práve eliminácia antigénu v domácom prostredí. Pacient musí byť adekvátne informovaný o riziku pokračujúcej expozície antigénu. Pri výskyte EAA na určitom pracovisku je potrebné na toto dôrazne upozorniť a realizovať opatrenia. Prognóza choroby závisí na závažnosti prvých atakov a času stáleho pôsobenia antigénu. Progresiu zhoršuje fajčenie. Asi 10 % prípadov vedie do ireverzibilnej fibrózy [8].
Doručeno do redakce: 10. 3. 2008
Přijato po recenzi: 10. 12. 2008
MUDr. Dana Lauková
www.snzobor.sk
e‑mail: laudana@zoznam.sk
Sources
1. Costabel V, du Bois RM, Egan JJ et al. Hypersensitivity Pneumonitis. In: Diffuse Parenchymal Lung Disease. Costabel V, du Bois RM, Egan JJ et al (eds). Prog Respir Res. Basel, Karger 2007 : 139–147.
2. Šterclová M, Vašáková M. Exogenní alergická alveolitida. Popelka mezi intersticiálními plicními procesy? Prakt Lék 2007; 87 : 470–473.
3. Bertonelli G, Bocchino V, Oliveri D. Hypersensitivity pneumonitis. Interstitial lung diseases. Eur Respir Monograph 2000; 14 : 120–136.
4. Sennekamp J, Müller-Wening D, Amthor M et al. Empfehlungen zur Diagnostik der exogen-allergischen Alveolitis. Pneumologie 2007; 61 : 52–56.
5. Kurup VP, Zacharisen MC, Fink JN. Hypersensitivity pneumonitis. Indian J Chest Dis Allied Sci 2006; 48 : 115–128.
6. Hurbánková M. Niektoré nové poznatky v oblasti profesionálnej prašnej expozície a pľúcnych ochorení. I. Vláknité prachy. Stud Pneumol Phtiseol 1999; 59 : 99–103.
7. Plutinský J, Moczová J, Magula D et al. Pilot study of quantitative computer tomography of lung and number of CD4+ and CD8+ in patients with sarcoidosis. Eur Resp J 2003; 22 (Suppl 45): 247.
8. Votava V. Exogenní alergická alveolitida. In: Homolka J, Votava V (eds). Intersticiální plicní procesy. Praha: Maxdorf 1999; 65–72.
9. Minárik L, Pokorná V, Votrubová V et al. Exogénne alergické alveolitídy pozorované v OLÚ TaRCH vo Vyšných Hágoch za posledných 10 rokov. Stud Pneumol Phtiseol Cechoslov 1986; 46 : 11–17 .
10. Vyšehradský R, Strapko P, Straková J et al. Akútna exacerbácia „farmárskych pľúc“ v zime v meste. Kazuistiky v pneumológii 2006; 3 : 9–14.
11. Majer I, Novosadová H, Chovan L. Bronchoalveolárna laváž a jej postavenie v diagnostike pľúcnych ochorení. Respiro 2006; 5 : 6–12.
12. Meřička O. Kortikoterapie u exogenní alergické alveolitis. Stud Pneumol Phtiseol Cechoslov 1984; 44 : 195–199.
13. Moczová J, Rin‑Müller R, Ševčíková Ľ et al. Kvantitatívna histologizácia. Analýza pľúc pomocou HRCT v diagnostike granulomatóz. Slov Radiol 2001; 1 : 51.
14. Ohtami Y, Saiki S, Kitaichi M et al. Chronic bird fancier’s lung: histopathological and clinical correlation. Thorax 2005; 60 : 665–671.
15. Ohtami Y, Saiki S, Sumi Y et al. Clinical features of reccurent and insidious chronic bird fancier’s lung. Ann Allergy Asthma Immunol 2003; 90 : 604–610.
16. Drent M, Jacobs JA, Wagenaar AS. Bronchoalveolar lavage. Eur Respir Mon 2000; 14 : 63–78.
17. Miyagawa T, Hamagami S, Tanigawa T. Cryptococcus albidus‑induced Summer type Hypersensitivity Pneumonitis. Am J Respir Crit Care Med 2000; 161 : 961–966.
18. Westhoff M, Welim B, Müller KM. Bronchozentrische Granulomatose. Pneumologie 2005; 59 : 804–810.
19. Sennekamp J, Joest M. Exogen-allergische Alveolitis-neue Erkentnisse. Pneumologie 2008; 62 : 51–54.
20. Koschel D. Exogen-allergische Alveolitis. Pneumologie 2007; 61 : 305–332.
21. Westhoff M, Welim B, Müller KM. Bronchozentrische Granulomatose. Pneumologie 2005; 59 : 804–810.
22. Lau S. Kompendium Pneumologie. 1 Jahrg. 2007; 1 : 20–21.
23. Tobas D, Aubert D, Villena I et al. Use of co-immunoelectrodiffusion to detect presumed disease-asociated precipitating antibodies, and time-course value of specific isotypes in bird-breeder’s disease. Jour Immunol Met 2003; 272 : 135–145.
24. Baur X. Hypersensitivity pneumonitis (extrinsic allergic alveolitis) induced by isocyanates. J Allergy Clin Immunol 1995; 95 : 197–205.
25. Vandenplas O, Leveque J, Cartier A et al. Hypersensitivity pneumonitis‑like reaction among workers exposed to diphenylmethane diisocyanate (MDI). Am Rev Respir 1993; 174 : 338–346.
26. Depierre A, Dalphin JC, Pernet D et al. Epidemiological study of farmer’s lung in five districts of the French Doubs province. Thorax 1988; 43 : 429–435.
27. Malmberg P, Rask A et al. Incidence of organic dust toxic syndrome and allergic alveolitis in Swedish farmers. Int Arch Allergy Appl Immunol 1988; 87 : 47–54.
28. Terho EO, Heinonen OP, Lami S. Incidence of farmer’s lung leading to hospitalisation and its relation to meteorological observations in Finland. Acta Med Scan 1983; 213 : 295–298.
29. Lodha S, Maria S, Sharma OP. Hypersensitivity pneumonitis in a saxophone player. Chest 1988; 93 : 1322.
30. Metzer WJ, Patterson R, Fink J et al. Sauna taker’s disease. JAMA 1976; 236 : 2209–2211.
31. Bourke SJ, Dalphin JC, Boyd G et al. Hypersensitivity pneumonitis: current concepts. Eur Respir J 2001; 18 (Suppl 32): 81–92.
32. Hendrick DJ, Faux JA, Marshall R. Budgerigar fancier’s lung: the commonest variety of allergic alveolitis in Britain. BMJ 1978; 1 : 81–84.
33. De Castro FR, Carrillo T, Castillo R et al. Relationships between characteristics of exposure to pigeon antigens, clinical manifestations and humoral immune response. Chest 1993; 103 : 1059–1063.
34. Ando M, Hirayama K, Soda K et al. HLA ‑ DQw3 in Japanese summer type hypersensitivity pneumonitis induced by Trichosporon cutaneum. Am rev Respir Dis 1989; 140 : 948–950.
35. Selman M, Teran L, Mendosa A et al. Increase of HLA‑DR7 in pigeon breeder’s lung in a Mexican population. Clin Immunol Immunopathology 1987; 44 : 63–70.
36. Flaherty DK, Iha T, Chmelik F et al. HLA‑B8 in farmer’s lung. Lancet 1975; 2 : 507.
37. Rittner C, Sennekamp J, Vogel F. HLA‑B8 in pigeon fancier’s lung. Lancet 1975; 2 : 1303.
38. Dalphin JC, Debieuvre D, Penet D et al. Prevalence and risk factors for chronic bronchitis and farmer’s lung in French dairy farmers. Br J Ind Med 1993; 50 : 941–944.
39. Mc Sharry C, Lynch PP, Banham SW et al. Seasonal variation of antibody levels among pigeon fanciers. Clin Allergy 1983; 13 : 293–299.
40. Lauková D, Marget I, Plutinský J et al. Exogénna alergická alveolitída – dokážeme ju včas rozpoznať? XIV. kongres ČaSPFS, Bardejov, 12.–15. 6. 2008.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2009 Issue 5-
All articles in this issue
- Algoritmus léčby glukokortikoidy indukované osteoporózy – hledání východisek – editorial
- Srovnání různých metod pro stanovení množství tuku v těle u žen s nadváhou a obezitou
- Srovnání tělesného složení diabetiků 1. typu, obézních jedinců a zdravých dobrovolníků metodou bioelektrické impedanční analýzy
- Vplyv bazálnej koncentrácie prolaktínu na výskyt komplikácií a na prognózu pacientov s cirhózou pečene
- Účinnost terapie pegylovaným interferonem a ribavirinem u pacientů s chronickou HCV infekcí
- Exogénna alergická alveolitída – zriedkavo diagnostikovaná choroba
- Turnerův syndrom vyžaduje multidisciplinární přístup
- Algoritmus liečby glukokortikoidmi indukovanej osteoporózy
- Ivabradin u nemocných se stabilní ischemickou chorobou srdeční a systolickou dysfunkcí levé srdeční komory: výsledky studie BEAUTIFUL
- Je farmakologická léčba chronické tromboembolické plicní hypertenze nadějná?
- Infarkt myokardu – příčina předčasné smrti u Turnerova syndromu
-
CORD: COmparsi on of Recommended Doses of ACE inhibitors and angi otensin II receptor blockers.
Porovnání doporučených dávek ACE inhibitorů a antagonistů receptoru angi otensinu II.
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Exogénna alergická alveolitída – zriedkavo diagnostikovaná choroba
- Turnerův syndrom vyžaduje multidisciplinární přístup
- Srovnání různých metod pro stanovení množství tuku v těle u žen s nadváhou a obezitou
- Infarkt myokardu – příčina předčasné smrti u Turnerova syndromu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career











