-
Medical journals
- Career
Nově diagnostikovaný syndrom Churga-Straussové u pacientky s podezřením na akutní koronární syndrom
Authors: R. Husár; J. Václavík; J. Lukl
Authors‘ workplace: I. interní klinika Lékařské fakulty UP a FN Olomouc, přednosta prof. MUDr. Jan Lukl, CSc.
Published in: Vnitř Lék 2008; 54(11): 1102-1105
Category: Case Report
Overview
V prezentované kazuistice 60leté pacientky s anamnézou opakovaných sinusitid a léčenou pro astma bronchiale došlo k manifestaci syndromu Churga‑Straussové (CSS) ve formě mononeuritis multiplex, kožních lézí na hlavě a akutní perimyokarditidy, která vedla k podezření na infarkt myokardu. Diagnóza CSS byla stanovena na základě klinických projevů, výrazné eozinofilie a provedené biopsie nosní sliznice. Následně nasazená imunosupresivní terapie vedla k regresi příznaků i zlepšení přechodně snížené funkce levé komory.
Klíčová slova:
syndrom Churga‑Straussové – myokarditida – hypereozinofílie – bronchiální astmaÚvod
Vaskulitidy tvoří heterogenní skupinu onemocnění, která jsou charakterizována zánětlivým postižením cév vedoucím k destrukci cévní stěny, proliferaci a uzávěru cév s následnou poruchou prokrvení v zásobované oblasti. Postižení cév v různých lokalizacích vede k nesmírně pestrému klinickému obrazu těchto onemocnění.
Syndrom Churga‑Straussové (CSS), někdy nazývaný i jako alergická granulomatózní angiitida, byl popsán v roce 1951 [1]. Jedná se o multisystémovou nekrotizující vaskulitidu cév malého a středního kalibru, nejčastěji postihující plíce a kůži, může se však projevit v jakémkoliv systému – kardiovaskulárním, gastrointestinálním, v ledvinách nebo CNS. Některé klinické manifestace se mohou vyskytovat u pacienta mnoho let před stanovením diagnózy CSS.
Onemocnění probíhá obvykle ve 3 stadiích [2,3]:
- alergická rinitida, polinóza nebo bronchiální astma
- rozvoj eozinofilie ve krvi a tkáních
- rozvoj systémové vaskulitidy
Roční incidence CSS je 2,4 případu na 1 000 000 obyvatel/rok [2] a postihuje děti i dospělé s maximem výskytu mezi 35. a 50. rokem života. Mortalita se pohybuje kolem 25–50 %. Histopatologicky je pro ni příznačná přítomnost eozinofilie a vaskulitidy s extravaskulárními nekrotizujícími granulomy. Etiologie CSS zatím zůstává nejasná, ale s největší pravděpodobností se na etiopatogenezi onemocnění podílejí autoimunitní procesy: zvýšená aktivita T-buněk, alterovaná humorální aktivita se zvýšením hladiny IgE, revmatoidního faktoru, hypergamaglobulinemií, zvýšená aktivita cirkulujících imunokomplexů [4]. Genetické faktory hrají rovněž důležitou roli, neboť byla nalezena korelace výskytu onemocnění s přítomností znaků HLA DRB1 a HLA DRB4 [5].
Popis případu
60letá žena se dostavila do naší nemocnice na vyšetření pro necitlivost 4. a 5. prstu levé horní končetiny s iradiací do lokte. Pro zjištěný obraz depresí ST v oblasti boční stěny na EKG a laboratorní pozitivitu troponinu T byla odeslána k hospitalizaci na naši kliniku s podezřením na akutní koronární syndrom. Kromě necitlivosti prstů neměla žádné další potíže – negovala bolesti na hrudi, palpitace, dušnost, nikdy neměla prekolapsové stavy nebo synkopu.
Anamnesticky se od mládí léčila pro opakované infekty horních cest dýchacích, prodělala operaci paranazálních dutin a byla dlouhodobě sledována ve spádové ORL ambulanci pro chronickou sinusitidu a rovněž v plicní ambulanci s diagnózou sinobronchiálního syndromu a CHOPN. V dokumentaci dále byly údaje o poruše glukózové tolerance a suspektním syndromu karpálního kanálu. V posledním roce měla pacientka opakované infekty horních cest dýchacích. Dlouhodobě užívala pouze kombinaci inhalačních bronchodilatancií (formoterol a ipratropium) a na této terapii byla bez námahové dušnosti. Asi měsíc před přijetím do nemocnice byla přeléčena antibiotiky, od té doby se cítila celkově slabá a malátná.
Vstupní fyzikální nález byl nález fyziologický, pacientka byla kardiopulmonálně kompenzovaná, normotenzní s tlakem 115/80 mm Hg, tepovou frekvencí 80/min. Ve fyzikálním obraze při přijetí byly nalezeny drobné podkožní uzlíky ve frontální oblasti hlavy. Na vstupním EKG byl sinusový rytmus o frekvenci 90/min, osa +30°, převodní intervaly v normě, obraz rS ve V1–4, negativní P ve V1–2, deprese ST do 3 mm ve V4–6, ploše negativní T diafragmaticky; EKG změny byly hodnoceny jako ischemie boční stěny (obr. 1).
Image 1. Vstupní EKG křivka. Sinusový rytmus, frekvence 90/min, osa +30°, převodní intervaly v normě, obraz rS ve V<sub>1–4</sub>, negativní P ve V<sub>1–2</sub>, descendentní deprese ST do 3 mm ve V<sub>4–6</sub>, ploše negativní vlna T diafragmaticky. 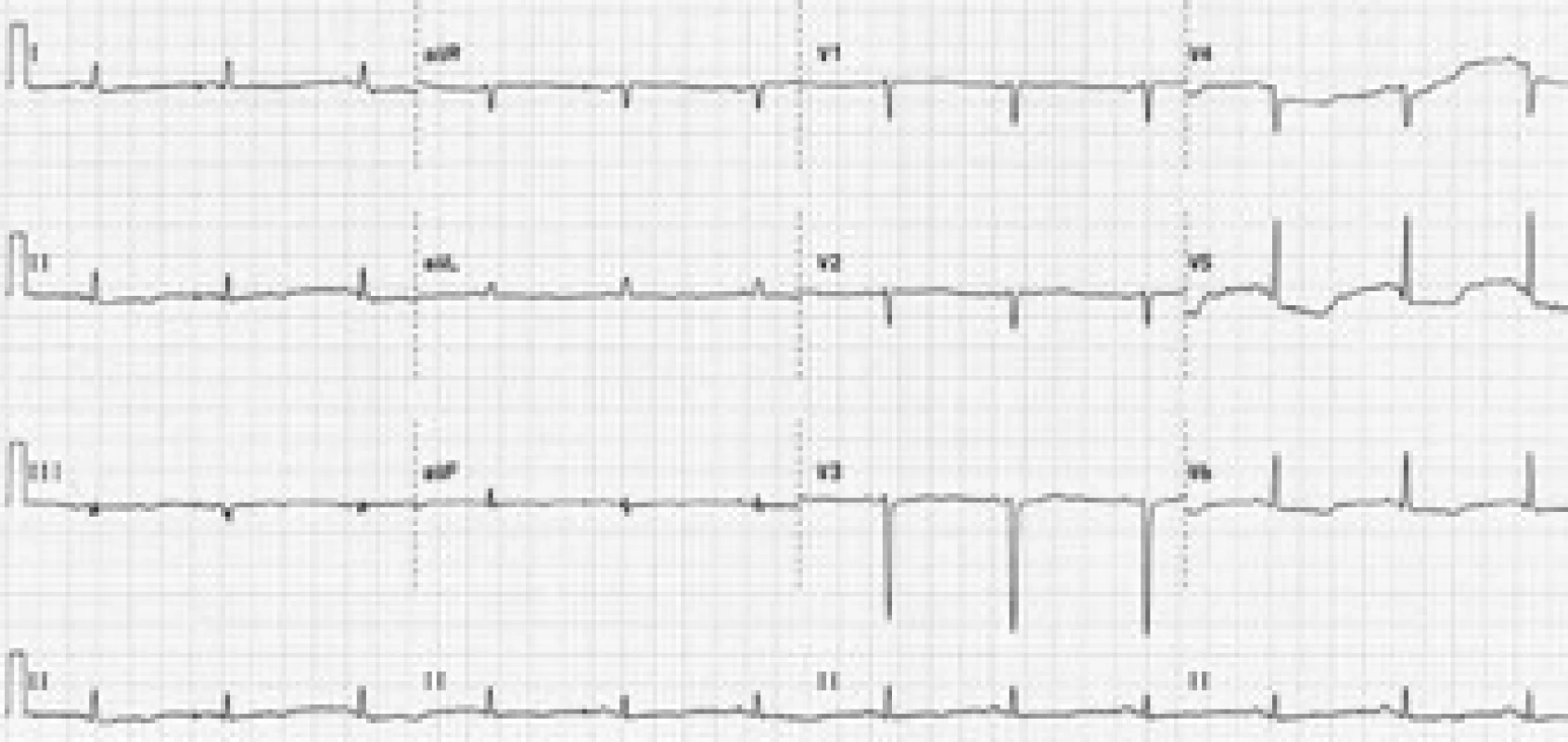
Laboratorní hodnota troponinu T narostla v průběhu hospitalizace ze vstupních 0,61 na maximum 1,54 μg/l (norma do 0,03 μg/l). Vývoj ostatních laboratorních hodnot v průběhu hospitalizace je zaznamenán v tab. 1.
Table 1. Laboratorní výsledky v průběhu hospitalizace. 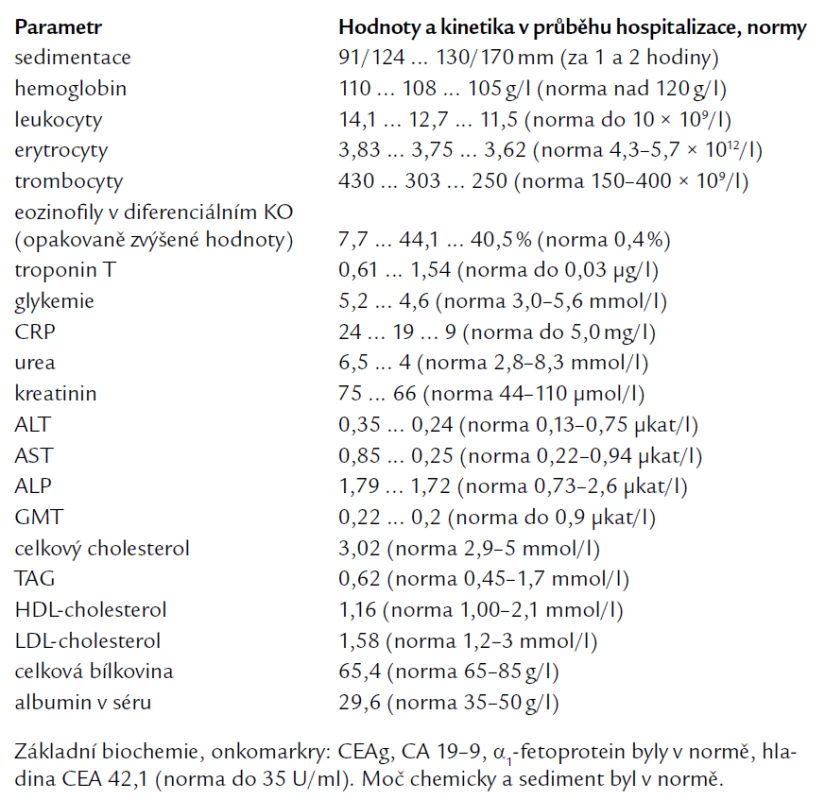
Pacientce byla provedena koronarografie s negativním nálezem na věnčitých tepnách, ventrikulograficky však byl přítomný obraz difuzní hypokinézy levé komory s ejekční frakcí (EF) kolem 40 %. RTG plic měl fyziologický nález (obr. 2).
Image 2. RTG plic při přijetí. 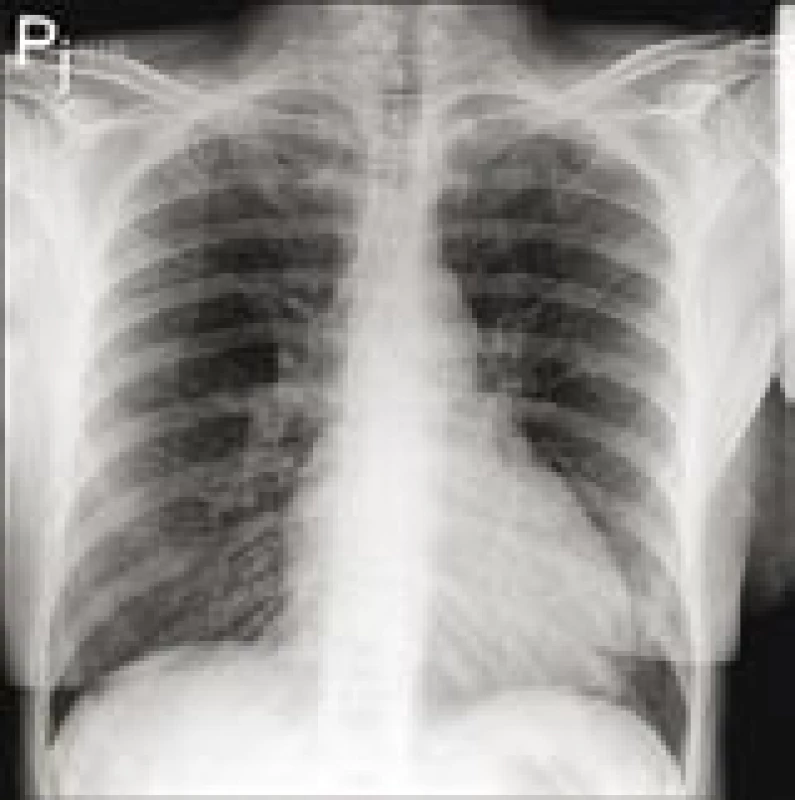
Plicní parenchym bez čerstvých ložisek či infiltrací, plicní cévní kresba akcentovaná. Bránice hladká, zevní úhly volné. Rozšíření srdečního stínu vleže, akcentace plicní cévní kresby. Následná transtorakální echokardiografie neprokázala dilataci ani hypertrofii levé komory (LK), potvrdila středně sníženou systolickou funkci LK s EF kolem 40–45 % s poruchou diastolické relaxace. Dále byl nalezen semicirkulární perikardiální výpotek (v diastole za zadní stěnou 3 mm, před pravou komorou 4 mm) bez známek tamponády. Nebyla přítomna chlopenní vada ani plicní hypertenze.
Na základě těchto nálezů byla stanovena pracovní diagnóza akutní perimyokarditidy a bylo započato vyšetřování její etiologie. Sérologická vyšetření běžných kardiotropních patogenů byla všechna s normálním nálezem (toxokaróza, borelie, tularémie, listerióza, mykoplazmata, chlamydie, CMV, EBV, lues, toxoplasma, virová hepatitis A, B, C). Odebrané onkomarkery byly rovněž v normě. Pro výraznou eozinofilní leukocytózu byla provedena trepanobiopsie kostní dřeně s nálezem lehce zmnožené erytropoézy, redukovanou granulopoézou a reaktivními změnami, bylo ale abnormálně zvýšené zastoupení eozinofilů v kostní dřeni.
Indikovali jsme proto další vyšetření za účelem vyloučení sekundární příčiny hypereozinofilie. Veškeré vyšetřované autoprotilátky, odběry na kultivaci moči a stolice i vyšetření stolice na parazity měly negativní nálezy [revmatoidní faktor, ASLO, antikardiolipinové protilátky (Ab), hladiny CIK, antinukleární Ab, antinukleozomální Ab, anti ENA, antiendomyziální protilátky, ANCA, antiSS B/La Ab, anti Sm Ab, anti Sm/RNP]. V elektroforéze bílkovin séra byla dokumentována zvýšená hladina gamaglobulinu, ostatní složky (alfa‑1, alfa‑2, betaglobulin a albumin) byly v normě. Vyšetření na paraprotein bylo negativní. Hladiny IgM a IgA byly v normě, hladina IgG byla 19,3 g/l (norma 7–16 g/l).
Spirometricky byla nalezena lehká obstrukční ventilační porucha v oblasti periferních dýchacích cest s lehkým zhoršením ventilačních parametrů v porovnání s minulými vyšetřeními. CT mozku, CT plic a mediastina, ultrazvuk břicha a gynekologické vyšetření měly normální nálezy. CT paranazálních dutin vyloučilo případné nádorové onemocnění paranazálních dutin, při ORL vyšetření byly odebrány vzorky tkáně z oblasti spodiny maxilární dutiny k histologickému vyšetření a posouzení infitrace eozinofily. Byl rovněž proveden odběr biopsie z kožní léze ve frontoparietální (FP) oblasti hlavy z místa drobného podkožního uzlíku. Histologický nález z kožní léze ve FP oblasti hlavy svědčil nejspíše pro necrobiosis lipoidica. Histologické vyšetření sliznice maxilárního sinu prokázalo četnější plazmocyty a eozinofily ve sliznici v poměru zhruba 3 : 2, epitel respiračního typu přecházející v úseky dlaždicobuněčné metaplazie. Ve slizničním stromatu byla výraznější zánětlivá celulizace tvořená malými lymfocyty a plazmocyty s asi 10 % eozinofilů.
V průběhu vyšetřování došlo na EKG k ústupu depresí ST boční stěny s vývojem negativních T vln v oblasti boční a spodní stěny (obr. 3 a 4).
Image 3. Postupný rozvoj negativních vln T v oblasti spodní a boční stěny. 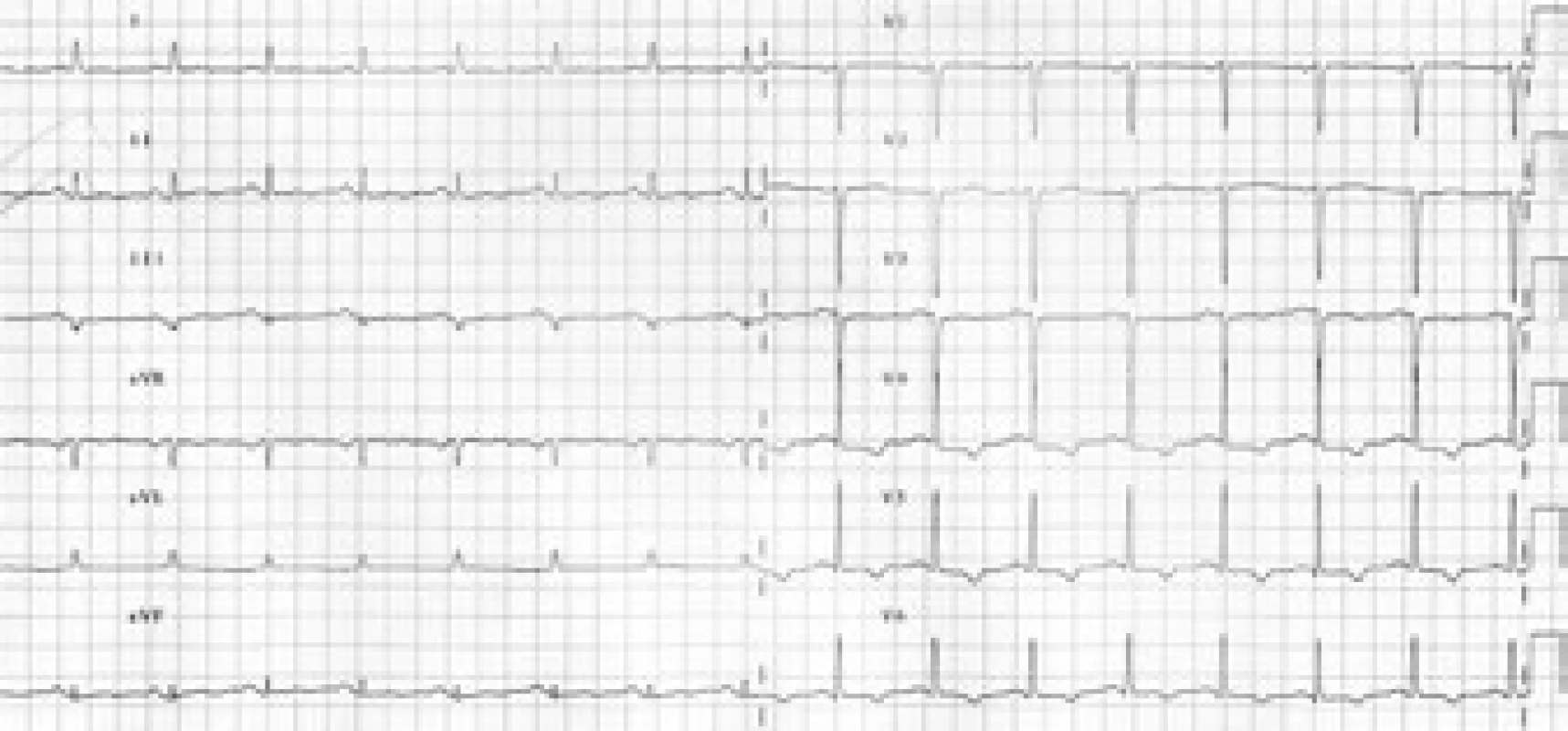
Image 4. Postupný rozvoj negativních vln T v oblasti spodní a boční stěny. 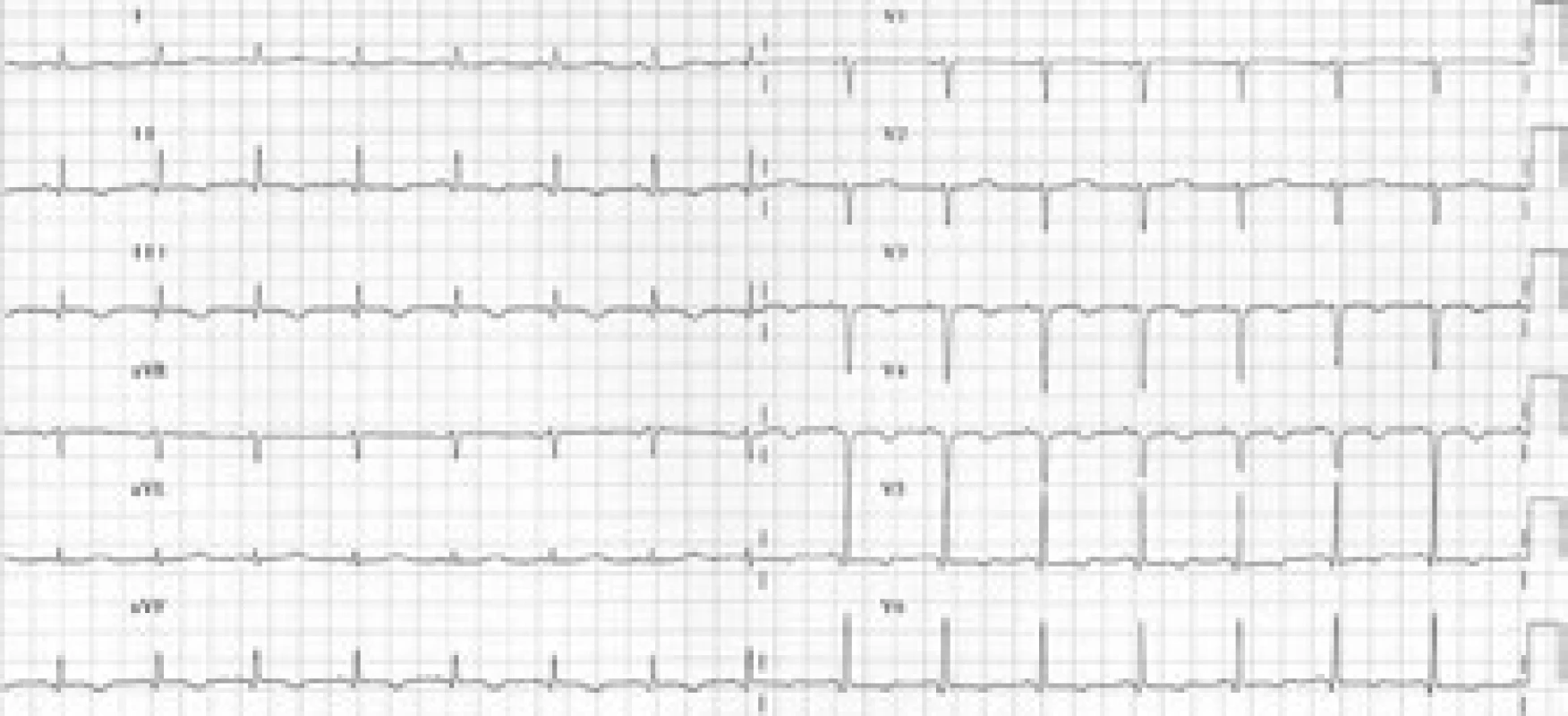
Na základě výše uvedených nálezů byla stanovena diagnóza syndromu Churga‑Straussové s obrazem vysoké sedimentace s eozinofilií v krevním obraze, chronickou pansinusitidou, obrazem mononeuritis multiplex [6] s klinickým korelátem poruchy citlivosti v oblasti 4. a 5. prstu LHK a myokarditidou v důsledku probíhající vaskulitidy. Nebyly zachyceny ledvinové ani oční projevy. Pacientka byla následně přeložena na III. interní kliniku k podání kombinované imunosupresivní terapie (1. pulzu cyklofosfamidu s kortikoidy – prednison v dávce 60 mg). Tuto terapii pacientka tolerovala bez obtíží, laboratorně byl dokumentován výrazný pokles eozinofilie v krevním obraze. Při kontrolním echokardiografickém vyšetření bylo dokumentováno zlepšení EF LK na 55–60 %, přetrvával hemodynamicky nevýznamný cirkulární perikardiální výpotek. Bez výraznějších potíží byla následně propuštěna do ambulantní péče.
Diskuze
Bronchiální astma je jedním z hlavních příznaků syndromu Churga‑Straussové [7] a vyskytuje se u asi 95 % pacientů a obvykle předchází vaskulitické postižení jedince o asi 8–10 let v rámci prodromální fáze onemocnění [8].
Asi v 70 % má pacient anamnézu maxilární sinusitidy, alergické rhinitidy nebo nazálního polypu jako naše pacientka. Častá bývá periferní neuropatie, postihující více než 2/3 pacientů, obvykle pod klinickým obrazem mononeuritis multiplex: někdy je provázena postižením kůže s purpurou. Ke stanovení diagnózy je zapotřebí přítomnost alespoň 4 ze 6 kritérií uvedených v tab. 2 [9].
Table 2. Diagnostická kritéria CSS dle Americké revmatologické společnosti. 
CSS reaguje dobře na systémovou kortikoterapii, na které se dosáhne remise u více než 80 % pacientů. Současné astma bronchiale bývá léčeno inhalačními kortikoidy. Refrakterní pacienti mohou zareagovat na imunosupresiva (cyklofosfamid, azathioprin, metotrexát nebo intravenózní imunoglobulin). Účinnost terapie se monitoruje sledováním eozinofilie, sedimentace, případně titru protilátek ANCA, které jsou přítomny asi ve 30–60 % případů. Snížení počtu eozinofilů v krvi bývá provázeno zlepšením klinických nálezů a svědčí pro dobrou účinnost terapie.
K relapsu onemocnění dochází asi ve 25 % případů, u asi 1/2 v průběhu 1. roku sledování, někdy však s latencí 5 nebo více let po vzniku onemocnění. Přítomnost zvýšené hladiny autoprotilátek ANCA je dokumentovaná v literatuře u asi 38–59 % pacientů [10].
Zvýšení titru ANCA, počtu eozinofilů v periferní krvi anebo proteinů akutní fáze může být předzvěstí klinické exacerbace.
V minulosti byl CSS bez výjimek fatálním onemocněním, vedoucím k úmrtí během několika měsíců; na současné terapii je pětileté přežívání vyšší než 70 %.
U naší pacientky byl důležitý anamnestický údaj rozvoje kožních eflorescencí v oblasti frontální krajiny hlavy před přijetím do nemocnice. Eozinofilie se objevila již před přijetím do nemocnice, dle dokumentace asi rok postupně narůstala! Postižení myokardu, které u naší pacientky dominovalo, se vyskytuje u 15–55 % případů CSS a bývá častou příčinou úmrtí. Perikarditida bývá přítomna asi ve 23 %, myokarditida ve 13 % případů, srdeční selhání vznikne u asi 15–30 % pacientů. CSS se může manifestovat i obrazem kardiogenního šoku s elevací troponinu a EKG obrazem akutního infarktu myokardu, někdy se může klinicky manifestovat jako chronická konstriktivní perikarditida [11]. V rámci probíhající vaskulopatie může dojít k rozvoji intrakardiální trombózy s embolizační komplikací, byla dokumentována i perikardiální tamponáda [11] s obrazem kongestivního selhání srdce. Vzácně jsou popsány i případy intracerebrální hemoragie [12]. Po imunosupresivní terapii dochází k regresi kardiálních projevů a zlepšení funkce levé komory, podobně jako u naší pacientky.
MUDr. Roman Husár
www.fnol.cz
e‑mail: dr.husar@gmail.com
Doručeno do redakce: 5. 5. 2008
Přijato po recenzi: 17. 7. 2008
Sources
1. Churg J, Strauss L. Allergic granulomatosis, allergic angiitis, and periarteritis nodosa. Am J Pathol 1951; 27 : 277–301.
2. Della Rossa A, Baldini C, Avoni A et al. Churg‑Strauss syndrome: clinical and serological featurs of 19 patients a single Italian centre. Rheumatology 2002; 41 : 1286–1294.
3. Goldberg L, Mekel J, Chita J. Acute myocarditis in patient with eosinophilia and pulmonary infiltrates. Cardiovas J South Arf 2002; 13 : 29–34.
4. Hellmich B, Ehlers S, Csernok E et al.Update on the pathogenesis of Churg‑Strauss syndrome. Clin Exp Rheumatol 2003; 21 (Supl 32): S69–S77.
5. Vaglio A, Martorana D, Maggiore U et al. HLA‑DRB4 as genetic risk factor for Churg‑Strauss Syndrome. Arthritis Rheum 2007; 56 : 3159–3166.
6. Uren NG, Hammond PJ. Myopeircarditis in Churg‑Strauss Syndrome. Texas Heart Instituce Journal 1991; 15 : 127–131.
7. Melvin D, Cheitin MS, Malcolm BM. Klinická kardiologie. 6. vyd. Praha: Nakladatelství H&H Vyšehradská 2005 : 782–784.
8. Guillevin L, Cohen P, Gayraud M et al. Churg‑Strauss syndrome, clinical study and long‑term follow‑up of 96 patients. Medicine (Baltimore) 1999; 78 : 26–37.
9. Masi AT, Hunder, GG, Liem JT et al. The American College of Rheumatology 1990 criteria for the classification of Churg‑Strauss syndrome (allergic granulomatosis and angiitis). Arthritis Rheum 1990; 33 : 1094–1100.
10. Sable-Fourtassou R, Cohen P, Mahr A et al. Antineutrophil cytoplasmis antibodies and the Churg‑Strauss syndrome. Ann Intern Med 2005; 143 : 632–635.
11. Baunwald’s Heart Disease. 7th ed. Elsevier Saunders 2005 : 2106–2107.
12. Liou HH, Liu HM, Chiang IP et al. Case report: Churg‑Strauss syndrome presented as multiple intracerebral hemorrhage. Lupus 1997; 6 : 279–282.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2008 Issue 11-
All articles in this issue
- Bezpečnost dlouhodobého podávání losartanu v běžné klinické praxi: neintervenční studie NCT-CZ 14/04/LOZ
- Prolaktín – marker aktivity systémových ochorení spojiva?
- Subklinické akutní rejekce v protokolárních biopsiích 3 měsíce po transplantaci ledviny
- Význam stanovování inhibinu B v klinické andrologické praxi
-
Histiocytóza z Langerhansových buněk u osob dospělého věku – nemoc s mnoha tvářemi.
Zkušenosti jednoho pracoviště a přehled projevů nemoci - Akutní embolizace do tepen splanchnického řečiště – přehled současných diagnostických přístupů a terapie
- Využití pozitronové emisní tomografie (18F‑FDG PET) v diagnostice chronických periaortitid
- Hypokalemická periodická paralýza u pacientů s hypertyreózou
- Nově diagnostikovaný syndrom Churga-Straussové u pacientky s podezřením na akutní koronární syndrom
- Perzistentní průjmy, hypotenze a polyneuropatie
- Vztah mezi familiární kombinovanou hyperlipidemií a inzulinovou rezistencí
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Hypokalemická periodická paralýza u pacientů s hypertyreózou
-
Histiocytóza z Langerhansových buněk u osob dospělého věku – nemoc s mnoha tvářemi.
Zkušenosti jednoho pracoviště a přehled projevů nemoci - Bezpečnost dlouhodobého podávání losartanu v běžné klinické praxi: neintervenční studie NCT-CZ 14/04/LOZ
- Význam stanovování inhibinu B v klinické andrologické praxi
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

