-
Medical journals
- Career
Kolorektální karcinom a diabetes mellitus
Authors: V. Procházka; R. Chlup
Authors‘ workplace: II. interní klinika Lékařské fakulty UP a FN Olomouc, přednosta doc. MUDr. Vlastimil Procházka, Ph. D.
Published in: Vnitř Lék 2008; 54(10): 979-984
Category: Reviews
Overview
Cílem tohoto přehledového sdělení je poukázat na rizikové faktory a příčiny kolorektálního karcinomu u diabetiků. Na základě recentních literárních poznatků se diabetes mellitus 2. typu začíná jevit jako potenciální rizikový faktor pro kolorektální karcinom. Práce se zaměřuje na vzájemné souvislosti a nastiňuje případné řešení této aktuální problematiky. Při sledování populace diabetiků se doporučuje důsledně dodržovat stávající depistážní program kolorektálního karcinomu, neopomíjet dispenzární programy, ve spolupráci s gastroenterologem se podílet na plánování a specifické přípravě diabetika k endoskopickým výkonům a dalším intervencím a při léčbě inzulinem dávat přednost malým komplementárním dávkám. Je navrženo vytvořit modifikovaný dispenzární program této malignity pro diabetiky.
Klíčová slova:
diabetes mellitus – kolorektální karcinom – dispenzarizace – depistáž – epidemiologieÚvod
V průběhu posledních let dochází k po-stupnému zvyšování incidence diabetu 2. typu. V České republice se v roce 2006 léčilo téměř 750 000 osob s dia-betem (7,5 % populace). Diabetes mellitus 2. typu se vyskytoval u více než 700 000 z nich.
Kolorektální karcinom je v České republice 2. nejčastější orgánovou malignitou. Jde o vůbec nejčastější zhoubné onemocnění zažívacího ústrojí. Ročně u nás onemocní asi 8 000 osob a zemře asi 5 000 osob na rakovinu tlustého střeva a konečníku.
Faktory, které ovlivňují výskyt diabetu a výskyt kolorektálního karcinomu, jsou shodné nebo velmi podobné včetně věkové kategorie postižených. Zvýšené riziko výskytu nádoru u diabetiků 2. typu bylo zjištěno nejen pro karcinom kolorekta, nýbrž i pro karcinom pankreatu [6,19,24]. U karcinomu pankreatu však není jasné, zda je diabetes příčinou nebo následkem malignity [7].
Intenzivní studium vzájemných souvislostí kolorektálního karcinomu a dia-betu přineslo v posledních 15 letech řadu nových poznatků, které by měly být stimulem pro objasnění dosud nezodpovězených otázek a k přenesení nových poznatků do klinické praxe.
Cílem tohoto sdělení je poukázat na rizikové faktory a příčiny kolorektálního karcinomu u diabetiků, hledat vzájemné souvislosti a nastínit případné řešení této aktuální problematiky.
Epidemiologie kolorektálního karcinomu a diabetu 1. a 2. typu
V roce 2002 byla incidence kolorektálního karcinomu v České republice u mužů 88 na 100 000. Česká republika tak stála za Japonskem na 2. místě světového žebříčku. U žen dosáhla incidence v témže roce 63 na 100 000. V přepočtu na světový standard (ASR-W) česká mužská populace v incidenci kolorektální rakoviny zaujímá světové prvenství. Poslední známé statistiky z roku 2005 uvádějí celkovou incidenci kolorektálního karcinomu v České republice 78 na 100 000 obyvatel a mortalitu 42 na 100 000 obyvatel. Je alarmující, že výskyt tohoto onemocnění se v posledních 30 letech zdvojnásobil a mortalita ztrojnásobila. Vysoká úmrtnost je způsobena především skutečností, že 1/2 všech nádorů je zjištěna až v pokročilém stadiu.
Výskyt onemocnění prudce stoupá od 50. roku života s vrcholem mezi 60. a 70. rokem. Nelze přehlédnout, že 5 % všech postižených nedosahuje věku 50 let.
Diabetes mellitus stojí v popředí zájmu Světové zdravotnické organizace i dalších institucí. Podle Mezinárodní diabetologické federace (IDF) bylo v roce 2003 na světě 194 milionů diabetiků. Ve středoevropských zemích se prevalence diabetu v současné době pohybuje mezi 6 a 8 %.
Poslední údaje Ústavu pro zdravotnické informace a statistiku [23] zaměřené na diabetes mellitus v České republice ukazují, že prevalence diabetu i zde narůstá a v roce 2006 dosáhla 6,8 % u mužů a 7,6 % u žen (graf 1). Na začátku roku 2006 bylo v ČR evidováno 728 000 mužů a žen s diabetem, z toho bylo 2 072 dětí a mladistvých do 19 let. V roce 2006 byl diabetes nově zjištěn u téměř 29 000 žen a 26 000 mužů, z toho 199 osob bylo ve věku do 19 let. Nejvyšší počet nově zjištěných případů na 1 000 obyvatel zaznamenaly kraje Plzeňský (6,7 případů) a Zlínský (6,6 případů), nejméně kraj Liberecký (4,3 případů) a Jihočeský (4,6 případů). Republikový průměr incidence činil 5,5 nově zjištěných případů na 1 tisíc obyvatel. Zřetelně převažuje 2. typ diabetu (tab. 1).
Graph 1. Vývoj prevalence diabetu u mužů a žen v ČR v letech 1996–2006 (ÚZIS). 
Table 1. Výskyt diabetu v ČR v roce 2006 (ÚZIS). 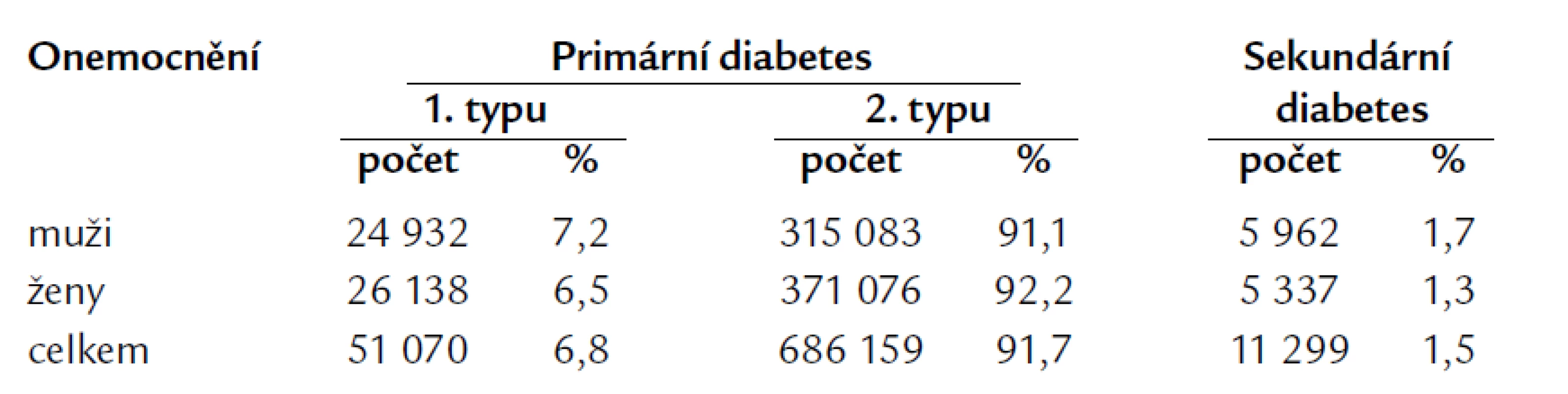
Zvýšené riziko kolorektálního karcinomu u diabetiků bylo prokázáno také ve studii na populaci téměř 240 000 obyvatel v ČR [21]. Ač v této studii nebyl u diabetiků rozlišen jejich typ, lze z epidemiologických údajů o jejich poměru usuzovat na zvýšené riziko právě u 2. typu. Epidemiologicky zajímavou informací z této studie je mimo jiné vznik kolorektálního karcinomu u pacientů s diabetem ve vyšším věku než u pacientů bez diabetu. Karcinom byl v tomto sledování zjištěn obvykle za 5–9 let po vzniku diabetu [20].
Rizikové faktory kolorektálního karcinomu
Mezi známé zevní rizikové faktory patří strava s vysokým obsahem živočišných tuků, vysoká spotřeba červeného masa upravovaného smažením, pečením, grilováním a uzením a strava s nízkým obsahem vlákniny. Epidemiologické studie zjistily vyšší riziko při nedostatečné fyzické aktivitě, při vzestupu BMI a faktorech zvyšujících proliferační aktivitu buněk. Deficit protektivních faktorů ve stravě, jako je kalcium, vitamin D, kyselina listová, selen, vitamin C, vedou rovněž k vyššímu riziku. Podobně je tomu u vyšší konzumace alkoholu, především piva, ve vztahu ke karcinomu rekta. V současné době je realizována dispenzarizace osob s těmito rizikovými faktory:
a) známé hereditární a familiární rizikové faktory:
- familiární polypóza
- Turcotův syndrom
- syndrom hereditárního nepolypózního karcinomu (Lynchův syndrom I., II.)
b) další vysoce rizikové faktory:
- kolorektální rakovina v rodinné anamnéze u příbuzných 1. stupně (rodiče, sourozenci, děti)
- nespecifické střevní záněty
- stav po kurativní resekci střeva pro karcinom
- stav po operaci karcinomu prsu, ovaria, endometria
- stav po ureteroileostomii
- stav po odstranění střevních adenomových polypů
Důsledně prováděná dispenzarizaceosob s výše uvedenými rizikovými faktory dává reálnou šanci na záchyt časné formy kolorektálního karcinomu. Tyto osoby však představují jen kolem 20 % všech nemocných s kolorektální rakovinou. Zbývajících 80 % všech diagnostikovaných nemá familiární ani hereditární charakter onemocnění a označuje se jako sporadický kolorektální karcinom.
Incidence sporadického kolorektálního karcinomu se v populaci zvyšuje od 50 let věku prakticky dvojnásobně na každých 10 let. Věk nad 50 let je tedy hlavním rizikovým faktorem sporadického kolorektálního karcinomu, který se nejčastěji vyvíjí na podkladě proliferace z adenomového polypu.
Vývoj kolorektálního karcinomu
Většina onemocnění vzniká postupným vývojem. Ve sliznici tlustého střeva a konečníku dochází ke změnám, které vedou ke vzniku polypu (obr. 1, 2). Podle histologického nálezu bývá polyp obvykle jasnou prekancerózou – adenomem (obr. 3). Tento vývoj trvá řádově roky a nečiní nositeli žádné potíže. Až další přeměny ve zhoubné bujení známou sekvencí adenom-karcinom vedou v odstupu několika měsíců i let k prvním obtížím a příznakům. V době svého zjištění je tedy karcinom onemocněním, které trvá již velmi dlouho (7–15 let).
Image 1. Přisedlý polyp v endoskopickém obraze během kolonoskopie (vlastní materiál). 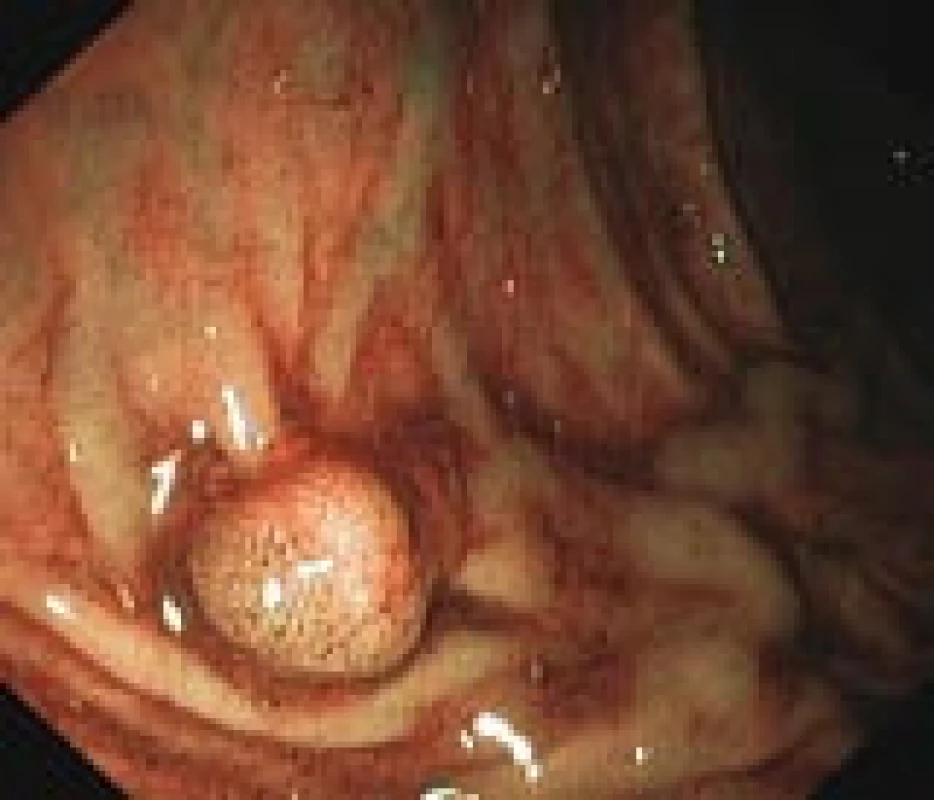
Image 2. Stopkatý polyp v endoskopickém obraze během kolonoskopie těsně před snesením kličkou (vlastní materiál). 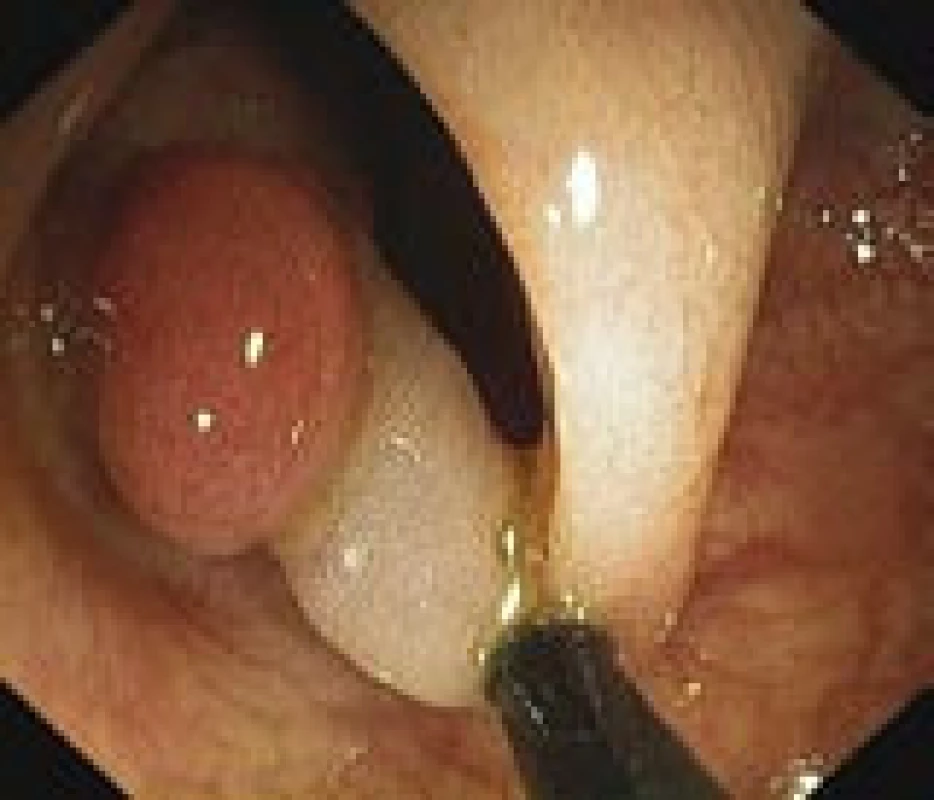
Image 3. Adematózní polyp s lehkou dysplazií, barvení hematoxylin-eozin, zvětšení 40krát (laskavostí prim. MUDr. Ladislavy Kučerové, Ústav patologie LF UP a FN Olomouc). 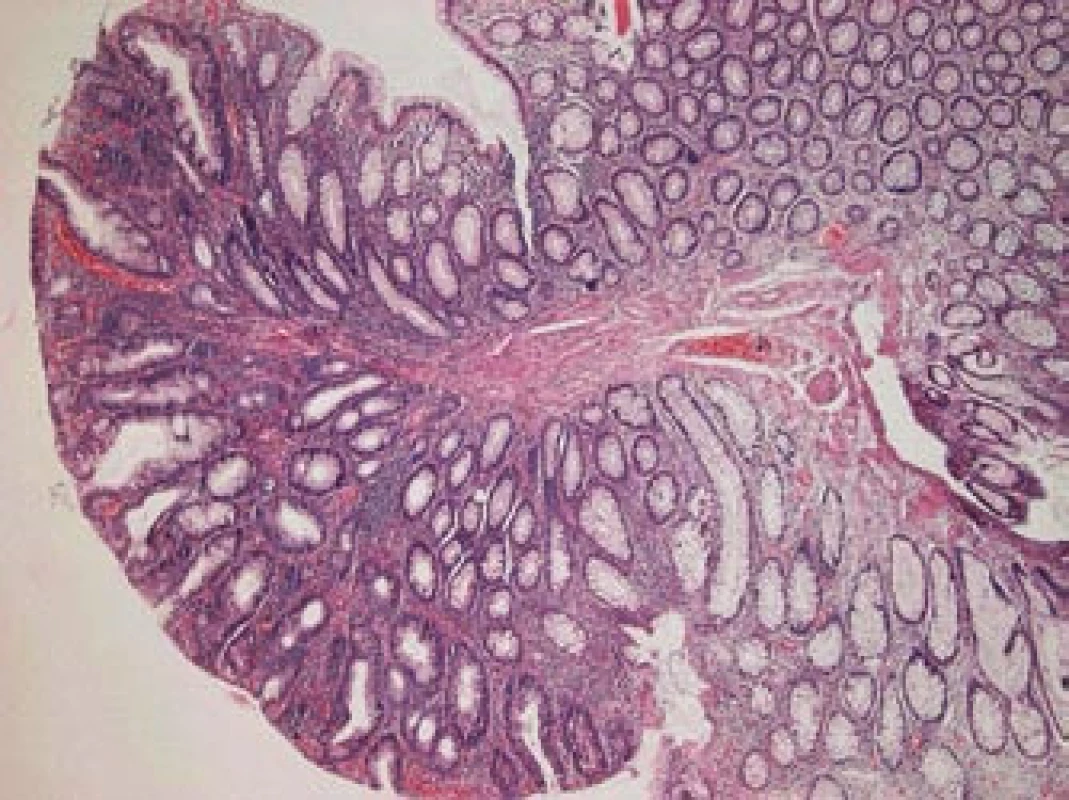
Poznatky molekulární biologie a genetiky v posledních letech pomohly charakterizovat změny, které se podílejí na procesu malignizace v kolorektální karcinom. Byly popsány poruchy buněčného cyklu, genetické výbavy a přirozeného zániku buněk – apoptózy. Z patogenetického pohledu byly na úrovni molekulární biologie odhaleny poruchy signálních drah ovlivňujících proliferaci a diferenciaci buněk, na nichž se podílí velký počet multifunkčních povrchových i jaderných receptorů a enzymů. Nelze opomenout, že v procesu kancerogeneze se uplatňují i další faktory, jako jsou např. PPAR (receptory aktivované proliferátory peroxizomů), multifunkční izoenzymy ze skupiny proteinkinázy C a enterohepatální recirkulace toxinů. Je známo, že některé z nich mají své místo i v patogenezi diabetu [3,20]. Tyto procesy způsobují nekontrolovanou buněčnou proliferaci a vznik maligního nádoru.
Zhoubná transformace adenomového polypu je proces probíhající velmi pomalu (7–10 let). Dysplastické změny v adenomu jsou přitom omezeny jen na sliznici, stejně jako neinvazivní karcinom, který nezasahuje přes svalovou slizniční vrstvu a nemůže metastazovat. Teprve překročením této vrstvy vzniká metastazující invazivní karcinom (obr. 4, 5). Histologicky převažuje adenokarcinom, který je nejčastěji tubulární (90 %) nebo silně hlenotvorný (10 %). Zřídka jde o karcinom z prstenčitých buněk.
Image 4. Pokročilý karcinom tračníku v endoskopickém obraze během kolonoskopie (vlastní materiál). 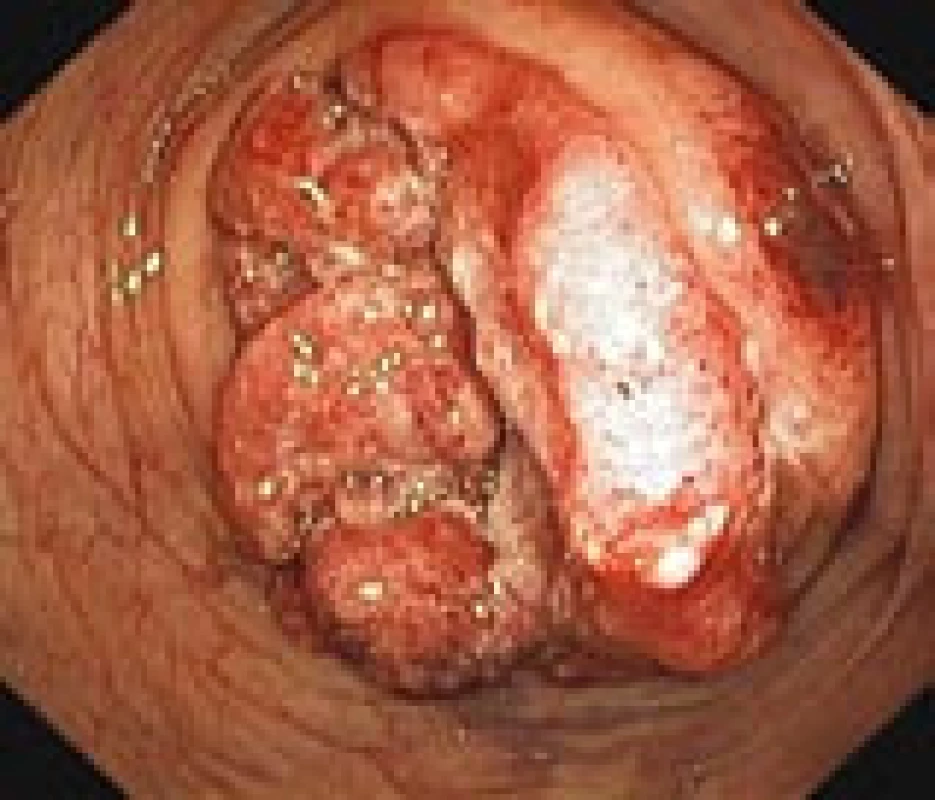
Image 5. Invazivní adenokarcinom, barvení hematoxylin-eozin, zvětšení 200krát (laskavostí prim. MUDr. Ladislavy Kučerové, Ústav patologie LF UP a FN Olomouc). 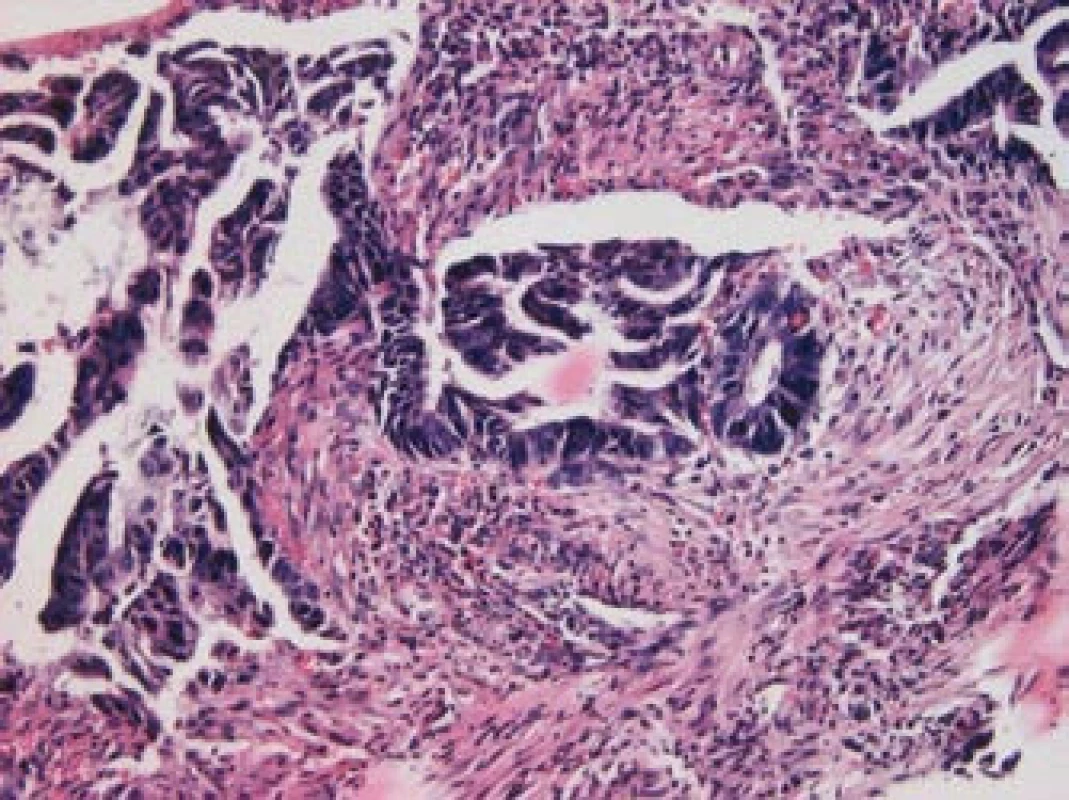
Histologická diferenciace karcinomu je významným prognostickým faktorem, podobně jako stadium nádorového onemocnění. Stadia onemocnění popisuje TNM klasifikace vycházející z rozsahu postižení střevní stěny a přítomnosti regionálních uzlinových metastáz nebo metastáz vzdálených, při doplnění o histopatologické vyšetření potom klasifikace pTNM.
Klinický obraz kolorektálního karcinomu
Typické projevy onemocnění, jako je krev ve stolici, bolesti břicha, změny frekvence a konzistence stolice, anemický syndrom, váhový úbytek a nejasné subfebrilie jsou až pozdními příznaky, které vedou k odhalení obvykle pokročilého onemocnění. Choroba v podobě prekancerózy a časné formy rakoviny kolorekta může probíhat řadu let zcela asymptomaticky a prvním projevem může být až komplikace v podobě náhlé břišní příhody (ileus, perforace, známky peritoneálního dráždění).
Z klinického pohledu má největší prognostický význam délka trvání pří-znaků onemocnění. S délkou trvání symptomů rychle klesá naděje na 5leté přežití. Lepší prognózu mají osoby, u nichž je kolorektální karcinom diagnostikován v časném stadiu. Nejlepší prognózu mají osoby asymptomatické.
Depistáž a dispenzarizace
Důsledně odebraná osobní a rodinná anamnéza může odhalit rizikové jedince, které je nutné zařadit do dispenzárních programů, i když nemají žádné potíže a příznaky. Na osoby s diabetem však v souvislosti s dispenzárními programy doposud není pamatováno. Diagnostika časných forem a přednádorových stavů má největší úspěch právě u bezpříznakových jedinců. Ty lze nejlépe odhalit důsledným prováděním dispenzárních a depistážních programů.
V České republice probíhá od roku 2000 dvouetapový depistážní program u asymptomatické populace od 50 let věku [5]. Česká republika je v současné době jedinou zemí, která monitoruje a vyhodnocuje screeningový program na celém území státu [27]. Program zahrnuje v první fázi vyšetření stolice standardizovaným testem na okultní krvácení (OK). Druhá fáze zahrnuje při pozitivním testu kolonoskopii. Nelze‑li provést totální kolonoskopii, následuje dvoukontrastní irigografie.
U jedinců s pozitivním testem na OK je možné očekávat až ve 20 % kolorektální karcinom, ve 30 % polypy a v 50 % jiný zdroj krvácení. Při zjištění polypů je endoskopická polypektomie efektivním profylaktickým opatřením. Odstranění adenomového polypu snižuje riziko kolorektálního karcinomu až o 90 %, pokud je důsledně respektován následný dispenzární program.
Také rodiče i potomci pacientů s adenomovými polypy mají podle některých studií zvýšené riziko rakoviny kolorekta [2,25]. Tato skupina osob však dosud dispenzarizaci nepodléhá.
Souvisí diabetes mellitus s nádory kolorekta?
V roce 2007 byla publikována práce, která prokázala silnou asociaci mezi zvýšenou inzulinemií a rekurencí adenomů kolorekta. Tato souvislost byla ještě výraznější ve skupině diabetiků s vyšší glykemií. Nejtěsnější asociace byla zjištěna v kohortě s negativní rodinnou anamnézou kolorektální rakoviny [4].
Epidemiologické studie posledních let podávají řadu důkazů o zvýšeném riziku kolorektálního karcinomu v souvislosti se zvýšením inzulinové rezistence. S inzulinovou rezistencí zřejmě souvisí zvýšená inzulinemie, hyperglykemie, zvýšené hladiny neesterifikovaných mastných kyselin a některých růstových faktorů [9]. Úloha inzulinu a dalších faktorů na vývoj adenomů však není dosud zcela objasněna.
Jedna z recentních studií zjistila snížení schopnosti apoptózy v důsledku zvýšené inzulinemie a glykemie a s tím spojeného zvýšeného rizika vývoje a vzniku adenomových polypů [12]. Tento nález ukazuje na možnost, že by inzulin mohl hrát roli v časné fázi přeměny (sekvenci) adenom-karcinom snížením schopnosti apoptózy.
Některé studie prokázaly, že dlouhodobá léčba inzulinem u pacientů s diabetem 2. typu signifikantně zvyšuje riziko kolorektální rakoviny [8,26]. Zvýšené riziko bylo pozorováno rovněž v souvislosti se známkami nedostatečné léčby diabetu dokumentované zvýšenými hladinami glykozylovaného hemoglobinu HbA1c [17].
Za přímý rizikový faktor rakoviny tlustého střeva a konečníku bývá považována zvýšená hladina C-peptidu v séru, a to zcela nezávisle na BMI a dalších faktorech vztahujících se k inzulinové rezistenci a hladině růstových faktorů IGF‑1 a IGFB-3 [11,14,16].
Životní styl a dieta západní a středoevropské populace, českou nevyjímaje, patří mezi faktory zvyšující výskyt obezity, diabetu a inzulinové rezistence. Hyperinzulinemie může přímo nebo zprostředkovaně modulovat buněčnou proliferaci a apoptózu.
Řada studií prokázala, že hyperinzulinemie, determinovaná měřením hladiny C-peptidu, je faktorem významně zvyšujícím riziko kolorektálního karcinomu [10,11,14,16].
Zvýšení mortality na nádory bylo zjištěno v kohortě diabetiků 2. typu léčených sulfonylureou a ve skupině léčených inzulinem v porovnání s diabetiky 2. typu léčených metforminem. Není však jasné, zda rozdíl v riziku úmrtí na malignitu byl způsoben zhoubným efektem sufonylmočoviny a inzulinu nebo protektivním vlivem metforminu [1].
Studie JEVIN uvádí až téměř 10násobné riziko kolorektálního karcinomu v populaci diabetiků léčených inzulinem, a to bez závislosti na dávce, délce léčby a na kvalitě kompenzace diabetu [18]. Současně v této studii nebyla shledána žádná korelace diabetu s jinými sledovanými malignitami (prsu, plic, ledvin a pohlavních orgánů).
Zda je kolorektální karcinom další komplikací diabetu, není jasné [24]. Z klinického pohledu je vhodné respektovat některé zvláštnosti diagnostiky onemocnění trávicího ústrojí u diabetiků [22].
Ve snaze zodpovědět otázku, jaké je riziko kolorektálního karcinomu u diabetiků, provedli švédští autoři dosud nejrozsáhlejší metaanalýzu prací publikovaných v období od roku 1996 do poloviny roku 2005. Analýza zahrnovala 15 studií, celkem s více než 2,5 miliony pacientů. Tato metaanalýza ukázala jednoznačně zvýšené riziko kolorektálního karcinomu a vyšší mortalitu na toto nádorové onemocnění oproti populaci nediabetiků. Asociace mezi diabetem a incidencí kolorektální rakoviny nevykazovala statisticky signifikantní rozdíl u obou pohlaví [13].
Na podkladě dosud publikovaných epidemiologických a molekulárně biologických poznatků navrhl Nagel a Göke modifikovaný screeningový program kolorektálního karcinomu pro diabetiky 2. typu [15]. Ve srovnání s celou populací bylo u diabetů 2. typu léčených inzulinem pozorováno 3násobně vyšší riziko rozvoje kolorektálního karcinomu. Předpokládá se, že hyperinzulinemie a zvýšená koncentrace volného IGF‑1 podporují proliferaci buněk sliznice tlustého střeva a zvyšují přežívání transformovaných buněk nádoru. To se pak projevuje alterací biologie tumorů. U osob s diabetem 2. typu je progrese tumoru rychlejší, a mortalita v důsledku nádorového onemocnění je proto zvýšená. Autoři z těchto důvodů doporučují provádět kolonoskopii v 5letých intervalech u všech diabetiků 2. typu léčených inzulinem v rámci tzv. „modifikovaného screeningu“. Nicméně se domníváme, že před zavedením takového programu bude třeba řešit řadu problémů. Jedním z nich je změna stávajících pravidel dispenzarizace a depistáže. Podle našeho názoru by již nemělo jít jen o screening kolorektálního nádoru u dia-betiků, nýbrž o dispenzarizaci celé vysoce rizikové populace diabetiků 2. typu. Kromě toho bude třeba řešit i otázky ekonomického zajištění.
Závěr
Studie o výskytu malignit obecně v populaci diabetiků neuvádějí vždy jednoznačné výsledky. Převažují však práce ukazující zvýšené riziko rakoviny kolorekta a pankreatu právě u diabetiků 2. typu. Proč k tomuto zvýšení dochází, vyžaduje další studium. Odhalení neznámých mechanizmů by mohlo ovlivnit strategii prevence a časné diagnostiky. Podrobnější informace k tomuto problému však prakticky chybějí.
Diabetes mellitus 2. typu a kolorektální karcinom sdílejí společné rizikové faktory. Na základě nových poznatků se diabetes mellitus 2. typu začíná jevit jako nový nezávislý rizikový faktor pro rozvoj kolorektálního karcinomu.
Zatím není známo, jaký podíl nových onemocnění rakovinou tračníku a rekta připadá na diabetiky. V současné době totiž není nikde zaveden speciální dispenzární ani depistážní program kolorektálního karcinomu orientovaný na populaci diabetiků. Jinými slovy, osoby s diabetem tedy potenciálně zasluhují modifikovaný dispenzární program této malignity. V tomto směru chceme zaměřit i naše výzkumné úsilí.
V současné praxi lze při sledování populace diabetiků doporučit:
- důsledně dodržovat stávající depistážní program kolorektálního karcinomu
- neopomíjet dispenzární programy
- ve spolupráci s gastroenterologem se podílet na plánování a specifické přípravě diabetika k endoskopickým výkonům a dalším intervencím
- při léčbě inzulinem dávat přednost malým komplementárním dávkám
doc. MUDr. Vlastimil Procházka, Ph.D.
www.fnol.cz
e‑mail: vlastimil.prochazka@fnol.cz
Doručeno do redakce: 14. 4. 2008
Přijato po recenzi: 9. 6. 2008
Sources
1. Bowker SL, Majumdar SR, Veugelers P et al. Increased cancer‑related mortality for patients with type 2 diabetes who use sulfonyllureas or insulin. Diabetes Care 2006; 29 : 254–258.
2. Cottet V, Pariente A, Nalet B et al. Colonoscopic screening of first-degree relatives of patients with large adenomas: increased risk of colorectal tumors. Gastroenterology 2007; 133 : 1086–1092.
3. Ehrmann J Jr, Vavrušková N, Collan Y et al. Peorxisome proliferator‑activated receptors (PPARs) in health and disease. Biomed Pap Med Fac Univ Palacky Olomouc 2002; 146 : 11–14.
4. Flood A, Mai V, Pfeiffer R et al. Elevated serum concentrations of insulin glucose increase risk of recurrent colorectal adenomas. Gastroenterology 2007; 133 : 1423–1429.
5. Frič P, Zavoral M, Seifert B et al. Screening sporadického kolorektálního karcinomu v ČR. Interní Med 2007; 5 : 221–224.
6. Huxley R, Ansary-Moghaddam A, Berrington GA et al. Type II diabetes and pancreatic cancer: a meta‑analysis of 36 studies. Br J Cancer 2005; 92 : 2076–2083.
7. Chari ST, Leibon CL, Rabe KG et al. Pancreatic cancer‑associated diabetes mellitus: prevalence and temporal association with diagnosis of cancer. Gastroenterology 2008; 134 : 344–345.
8. Chung YW, Han DS, Park KH et al. Insulin therapy and colorectal adenoma risk among patients with type 2 diabetes mellitus: A case-control study in Korea. Dis Colon Rectum 2008; 25, v tisku.
9. Chung YW, Han DS, Park YK et al. Association of obesity, serum glucose and lipids with the risk of advanced colorectal adenoma and cancer: a case-control study in Korea. Dig Liver Dis 2006; 38 : 668–672.
10. Jenab M, Riboli E, Cleveland RJ et al. Serum C-peptid, IGFBP-1 and IGFBP-2 and risk of colon and rectal cancers in the European Prospective Investigation into Cancer and Nutrition. Int J Cancer 2007; 121 : 368–376.
11. Kaaks R, Toniolo P, Akhmedkhanov A et al. Serum C-peptide, insulin‑like growth factor (IGF)-I, IGF‑binding proteins, and colorectal cancer risk in women. J Natl Cancer Inst 2000; 92 : 1592–1600.
12. Keku TO, Lund PK, Galanko J et al. Insulin resistence, apoptosis, and colorectal adenoma. Cancer Epidemiol Biomarkers Rev 2005; 14 : 2076–2081.
13. Larson SC, Orsini N, Wolk A. Diabetes mellitus and risk of colorectal cancer: J Natl Cancer Inst 2005; 97 : 1679–1687.
14. Ma J, Giovannucci E, Pollak M et al. A prospective study of plasma C-peptide and colorectal cancer risk in men. J Natl Cancer Inst 2004; 96 : 546–553.
15. Nagel JM, Göke B. Colorectal carcinoma screening in patients with type 2 diabetes mellitus. J Gastroenterol 2006; 44 : 1153–1165.
16. Otani T, Iwasaki M, Sasazuki S et al. Plasma C-peptide, insulin‑like growth factor-I, insulin‑like growth factor bind-ing proteins and risk of colorectal cancer in a nested case-control study: the Japan public health center‑based prospective study. Int J Cancer 2007; 120 : 2007–2012.
17. Saydah SH, Platz EA, Rifai N et al. Association of markers of insulin and glucose control with subsequent colorectal cancer risk. Cancer Epidemiol Biomarkers Prev 2003; 12 : 412–418.
18. Schiel R, Müller UA, Braun A et al. Risk of malignancies in patients with insulin‑tread diabetes mellitus: results of a population‑based trial with 10-year follow‑up (JEVIN). Eur J Med Res 2005; 10 : 339–344.
19. Stevens RJ, Roddam AW, Beral V. Pancreatic cancer in type 1 and young-onset diabetes: systematic review and meta‑analysis. Br J Cancer 2007; 96 : 507–509.
20. Svačina Š, Matoušek M. Diabetes a kolorektální karcinom. In: Perušičová J. Trendy soudobé diabetologie, svazek 7, 1. vyd. Praha: Galén 2003 : 123–141.
21. Svačina Š, Matoulek M, Svobodová Š et al. Nádory trávicího traktu a diabetes mellitus. Vnitř Lék 2004; 50 : 386–391.
22. Urban O. Zvláštnosti diagnostiky onemocnění trávicího ústrojí u diabetiků. Praktický lékař 2003; 83 : 630–634.
23. Ústav zdravotnických informací a statistiky ČR. Péče o nemocné cukrovkou 2006. In: Zdravotnická statistika. http:/www.uzis.cz.
24. Will JC, Galuska DA, Vinicor F et al. Colorectal cancer: another complication of diabetes mellitus? Amer J Epidemiol 1998; 147 : 816–825.
25. Winawer SJ, Zaber AG, Gerdes H et al. Risk of colorectal cancer in the families of patients with adenomatous polyps. National Polyp Study Workgroup. N Engl J Med 1996; 334 : 1339–1340.
26. Yang YX, Hennessy S, Lewis JD. Insulin therapy and colorectal cancer risk among type 2 diabetes mellitus patients. Gastroenterology 2004; 127 : 1044–1050.
27. Zavoral M, Frič P. Screening kolorektálního karcinomu. Interní Med 2007; 3 : 149–150.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2008 Issue 10-
All articles in this issue
- Radiofrekvenční katetrová ablace paroxyzmální fibrilace síní konvenční metodou, bezprostřední a dlouhodobé výsledky
- Biomarkery ischemie a nekrózy myokardu v roce 2008
-
Zobrazovací metody v diagnostice viability myokardu.
Část 1. Interpretace nálezů při zobrazování viability myokardu pomocí SPECT a PET - Kolorektální karcinom a diabetes mellitus
- Duální protidestičková léčba
- Hemofilie
- Hemoeliminační metody v léčbě sepse: současný stav
- Izolovaná forma srdeční amyloidózy v podobě počínající infiltrativní kardiomyopatie bez restriktivní fyziologie
- Myopatie a smíšená hyperlipoproteinemie jako první projev systémové AL‑amyloidózy
- Srdeční arytmie při obstruktivní spánkové apnoe
- Zhodnotenie alternatívnych metód pre výpočet LDL cholesterolu
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Duální protidestičková léčba
- Srdeční arytmie při obstruktivní spánkové apnoe
- Hemoeliminační metody v léčbě sepse: současný stav
- Hemofilie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

