-
Medical journals
- Career
Využití detekce galaktomananu pro diagnostiku invazivní aspergilózy u hematoonkologických nemocných
Authors: Z. Ráčil 1; I. Kocmanová 2; B. Wagnerová 1; J. Winterová 1; M. Lengerová 1; M. Moulis 3; J. Mayer 1
Authors‘ workplace: Interní hematoonkologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jiří Vorlíček, CSc. 1; Oddělení klinické mikrobiologie FN Brno, pracoviště Bohunice, přednostka prim. MUDr. Alena Ševčíková 2; Ústav patologie Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jirka Mačák, CSc. 3
Published in: Vnitř Lék 2008; 54(1): 45-52
Category: Original Contributions
Overview
Východiska a cíle:
Pro prognózu nemocných s invazivní aspergilózou (IA) má zásadní význam včasně stanovená diagnóza. V posledních několika letech získala na významu v časné diagnostice IA detekce galaktomananu ELISA metodikou. Cílem této práce je analýza využitelnosti této metody v běžné klinické praxi hematoonkologického oddělení.Pacienti a metody:
V období od května roku 2003 do října roku 2006 byl u nemocných v riziku IA prováděn odběr krve pro detekci galaktomananu (GM) v séru ELISA metodikou. Vyšetření nemocní byli následně na základě výsledků konvenčních diagnostických metod a sekčních nálezů klasifikováni dle pravděpodobnosti přítomnosti IA.Výsledky:
Celkem bylo vyšetřeno na přítomnost GM 11 360 vzorků séra od 911 dospělých pacientů. IA (pravděpodobná/prokázaná) byla diagnostikována u 42 (4,6 %) z nich. Souhrnně byla senzitivita, specificita, pozitivní a negativní prediktivní hodnota detekce galaktomananu pro diagnostiku IA na našem pracovišti 95,2 %, 90,0 %, 31,5 % a 99,7 %. Jako hlavní příčiny omezené pozitivní prediktivní hodnoty testu byly identifikovány jednak velké procento falešných pozitivit testu (především způsobené současným podáváním některých penicilinových antibiotik nebo infuzního roztoku Plasma-Lyte) a jednak fakt, že velké procento námi vyšetřovaných nemocných spadá do skupiny pacientů s hematologickou malignitou, u nichž je prevalence IA velmi nízká.Závěr:
Detekce GM v séru je spojena s vysokou senzitivitou a excelentní negativní prediktivní hodnotou v diagnostice IA u hematoonkologických nemocných. Pro ještě vyšší výtěžnost testu je nezbytná znalost a eliminace možných příčin falešných pozitivit, stejně tak jako zacílení screeningu na nemocné nejvíce ohrožené touto infekcí.Klíčová slova:
invazivní aspergilóza - sérologické metody - aspergilový antigen - galaktomanan - časná diagnóza - hematologické malignityÚvod
Invazivní aspergilóza (IA) je v současné době nejčastější invazivní mykózou u hematoonkologických nemocných, a to především u pacientů podstupujících intenzivní chemoterapii pro akutní leukemii nebo alogenní transplantaci krvetvorné tkáně (HSCT - hematopoietic stem cell transplantation) [1-4]. I přes to, že jsou v současné době k dispozici nová, velmi účinná systémová antimykotika, zůstává mortalita IA u hematoonkologických pacientů velmi vysoká a přesahuje 50 % [5]. Jedním z hlavních faktorů ovlivňujících mortalitu nemocných s IA je včasnost zahájení účinné antimykotické léčby, která však vyžaduje včasné stanovení diagnózy [6]. Bohužel právě časné stanovení přesné diagnózy je u IA velice komplikované. Klinické příznaky infekce jsou nespecifické, konvenční mikrobiologické metody málo senzitivní a dávají opožděný výsledek. Konečně histologický průkaz hyf ve sterilní tkáni vyžaduje biopsii, která je však často u kritických nemocných s trombocytopenií a koagulopatií neproveditelná. Přestože má pro časnou diagnostiku IA velký význam pravidelně prováděné vysoce rozlišovací CT plic (HRCT - High Resolution CT), má toto vyšetření své limity. Obraz „halo sign“, který je velice často popisován u neutropenických nemocných s IA, není specifický pouze pro IA [7], je pozorovatelný jen krátkodobě, ale především pravidelné a rutinní provádění HRCT není na všech pracovištích schůdné. Obtížnost časné diagnostiky IA vedla k rozvoji tzv. nekultivačních diagnostických metod využívajících detekci mykotických antigenů (galaktomanan, 1,3 β-D glukan) a nebo fungálních nukleových kyselin (různé varianty PCR) [8,9].
S detekcí 1,3 β-D glukanu v diagnostice IA je dosud jen relativně málo zkušeností a různé varianty PCR (vzhledem k heterogenitě používaných metod) nemohou být dosud v žádném případě použity jako kritérium IA [10]. Naopak jednoznačně zásadního významu pro časnou diagnostiku IA doznala sérologická metoda využívající detekci antigenu specifického pro buněčnou stěnu Aspergillus sp. - galaktomananu (GM) - a to pomocí komerčně dostupného testu Platelia® Aspergillus (Bio-Rad, Francie), se kterou jsou rovněž nejrozsáhlejší zkušenosti. Jedná se o sandwichovou ELISu (Enzyme Linked Immunosorbent Assay), která využívá vazby krysích monoklonálních protilátek EB-A2 s β-1,5-galaktofuranosylovými konci galaktomananu. V posledních několika letech celá řada prací prokázala její velmi dobrou senzitivitu, negativní prediktivní hodnotu a schopnost zkrátit dobu do stanovení diagnózy IA, a to i o řadu dní ve srovnání s konvenčními diagnostickými metodami [11-14]. Z druhé strany však existuje řada faktorů, které mohou využitelnost metody ovlivnit: cut-off index pozitivity (hodnota indexu pozitivity, od kterého je vzorek označen jako pozitivní), frekvence odběrů, izolovaná nebo konzekutivní pozitivita jako požadavek pro označení nemocného za GM pozitivní, možnost falešných pozitivit testu a další [15].
Cílem naší práce je retrospektivní analýza využitelnosti detekce galaktomananu v séru pomocí Platelia® Aspergillus testu pro časnou diagnostiku invazivní aspergilózy, a to po 3,5letém extenzivním používání metody v běžné klinické praxi na hematoonkologickém oddělení.
Pacienti a metody
Sledovaná populace a design
V období května roku 2003 do září roku 2006 byla u všech dospělých léčených na našem pracovišti především z důvodů hematologické malignity při současném riziku rozvoje IA prováděn rutinní monitoring detekce GM v krvi. Odběry krve pro záchyt GM byly u pacientů podstupujících indukční a reindukční léčbu akutní leukemie anebo alogenní transplantaci krvetvorné tkáně prováděny pravidelně 2-3krát týdně, ev. častěji, a to od začátku chemoterapie do propuštění. U ostatních nemocných byl monitoring zahájen v případě vzniku klinické pravděpodobnosti nebo rizika invazivní mykotické infekce (nejčastěji v případě febrilní neutropenie nereagující na 5denní podávání širokospektrých antibiotik anebo v případě rozvoje abnormalit na HRCT nebo konvečním RTG snímku plic) a prováděn opět 2-3krát týdně po dobu trvání rizika.
Nemocní byli obvykle hospitalizováni na standardním třílůžkovém pokoji s centrální úpravou vzduchu, ovšem kromě pacientů podstupujících alogenní transplantaci krvetvorné tkáně, kteří byli ve většině případů umístěni na jednolůžkovém pokoji s úpravou vzduchu pomocí HEPA filtru až do doby přihojení štěpu (absolutní počet neutrofilních granulocytů > 1,0 × 109/l). Po dobu neutropenie, respektive u pacientů po alogenní transplantaci krvetvorné tkáně také po dobu intenzivní imunosuprese pro reaktivaci štěpu proti hostiteli (Graft Versus Host Disease - GvHD) byla podávána antimykotická profylaxe flukonazolem v dávce 400 mg/den.
Během hospitalizace byli pacienti sledování z hlediska rozvoje příznaků invazivní mykotické infekce. Denně bylo prováděno klinické vyšetření lékařem. Konveční snímek srdce a plic byl indikován vstupně a následně v průběhu febrilní neutropenie minimálně 1krát týdně, ev. častěji. V týdenním intervalu byla prováděna surveillance bakteriologického a mykologického osídlení v moči, stěru z rekta a dutiny ústní. Odběr hemokultur a kultivační a mikroskopické vyšetření ostatních klinických materiálů (především sputum) bylo prováděno v případě rozvoje febrilií, respektive klinických příznaků infekce.
V případě zvýšené pravděpodobnosti vzniku invazivní mykotické infekce (febrilní neutropenie nereagující na 5 dnů antibiotické léčby, rozvoj plicních infiltrátů na konvenčním RTG snímku plic, pozitivní kultivace s průkazem vláknité houby z materiálu z dýchacích cest) nastoupila série vyšetření s cílem maximálního možného průkazu vyvolávajícího agens. Bylo provedeno HRCT plic a v případě pozitivity pak bronchoalveolární laváž (lavážní tekutina byla vyšetřována kultivačně, cytologicky, imunofluorescenčně pro průkaz Pneumocystis jiroveci a molekulárně biologicky pro průkaz virových patogenů, mykoplazmat, chlamydií a Pneumocystis jiroveci).
Empirická antibiotická léčba febrilní neutropenie zahrnovala monoterapii cefepimem, piperacilin/tazobaktamem, výjimečně meropenemem. V případě klinické indikace byl do kombinace přidán vankomycin nebo aminoglykosid. Pro empirickou antimykotickou léčbu byl v absolutní většině případů zvolen konvenční amfotericin B, výjimečně kaspofungin nebo vorikonazol.
V případě úmrtí nemocného byla v maximálně možné míře a v případě souhlasu rodiny provedena patologicko anatomická pitva. Ve sledovaných letech byla sekce provedena průměrně u 56 % nemocných zemřelých na našem pracovišti.
Retrospektivně byla analyzována zdravotnická dokumentace vyšetřovaných pacientů s cílem určit pravděpodobnost invazivní aspergilózy a zjistit možnou jinou příčinu pozitivity GM v séru.
Detekce galaktomananu
Srážlivá krev odebraná nemocným byla ihned (při provedení odběru v pracovní dobu) nebo nejpozději následující den ráno (byl-li odběr proveden v nočních hodinách) transportována na mikrobiologické oddělení ke zpracování. Do odeslání byla srážlivá krev na hematoonkologickém pracovišti uchovávána na vyčleněném místě při pokojové teplotě. Na mikrobiologickém oddělení bylo po centrifugaci vzorku (3 min/3 000 otáček) odděleno sérum a přeneseno po 300 µl do 2 sterilních Ependorfových zkumavek. V případě, že se materiál nevyšetřoval tentýž den, byly zkumavky zmraženy na -20 °C, a takto uchovávány do okamžiku zpracování (maximálně 72 hod).
Galaktomanan byl detekován pomocí komerční soupravy Platelia® Aspergillus (BioRad, France). Vzorky byly v laboratoři zpracovány podle doporučení výrobce tohoto setu.
Výsledek testu byl vydáván jako bezrozměrný index pozitivity (IP), který odpovídá poměru naměřené optické denzity (OD) vzorku a OD kontrolního séra o koncentraci 1 ng GM/ml. Jako pozitivní byly označeny séra s IP > 0,5. Pro označení nemocného za „galaktomanan pozitivního“ bylo zvoleno kritérium IP > 0,5, a to ve 2 po sobě jdoucích (konzekutivních) vzorcích. Pro vyloučení laboratorní kontaminace byl vždy první pozitivní vzorek u každého pacienta retestován. Při pozitivitě retestu byl vyžádán a následně otestován další vzorek séra od nemocného.
Definice pravděpodobnosti invazivní aspergilózy
Jako pacienti s prokázanou IA byli označeni nemocní s pozitivním histologickým/kultivačním průkazem Aspergillus sp. ze sterilního místa nebo ze sekce. Nemocným byla závěrem stanovena klinická diagnóza - vysoce pravděpodobná IA a na základě této diagnózy byli také tak léčeni; byli zahrnuti do skupiny pravděpodobné IA (nejčastěji kombinace rizikových faktorů, febrilií nereagujících na antibiotika a vysoce pravděpodobného nálezu na zobrazovacích metodách - nejčastěji HRCT). Ostatní nemocní byli označeni jako pacienti s možnou IA (většinou pacienti s rizikovými faktory a febriliemi nereagujícími na antibiotika, ale se zcela nespecifickým nálezem na zobrazovacích metodách) a nebo bez IA (jedinci zcela asymptomatičtí bez nálezu na zobrazovacích metodách, kteří nebyli léčeni antimykotiky, a to ani empiricky).
Vzhledem k charakteru analýzy, která zcela vychází z každodenní reálné praxe na hematoonkologickém oddělení, nebyla použita pro klasifikaci nemocných EORTC/MSG kritéria. Tato kritéria mají v rutinní praxi jen omezené použití a většina nemocných by při jejich aplikaci byla v analýze označena za pacienty s maximálně možnou invazivní mykotickou infekcí [16,17].
Statistická analýza
Statistické zpracování bylo provedeno na úrovní pacienta (per pacient analysis). Pacienti s prokázanou a pravděpodobnou IA byli označeni jako skutečně pozitivní. Ostatní nemocní pak jako skutečně negativní. Senzitivita, specificita, pozitivní a negativní prediktivní hodnota byly vypočítány pomocí 2 × 2 tabulky.
Výsledky
Souhrnná analýza
Od května roku 2003 do října roku 2006 bylo celkem odebráno a na přítomnost GM vyšetřeno 11 360 vzorků séra od 911 dospělých nemocných léčených na našem pracovišti (průměr 12,5 vzorků/pacienta).
IA byla diagnostikována u 42 (4,6 %) pacientů z našeho souboru - z toho prokázaná IA u 7 (17 %) pacientů a pravděpodobná IA u 35 (83 %) nemocných.
Graph 1. Rozdělení GM pozitivních pacientů dle správnosti pozitivity Platelia<sup>®</sup> Aspergillus testu a procentuální zastoupení jednotlivých příčin falešných pozitivit. 
Z celkového počtu vyšetřených vzorků sér byl index pozitivity vyšší než 0,5 naměřen u 890 (7,8 %) z nich.
Kritéria pro označení za GM pozitivní (IP > 0,5 v minimálně 2 konzekutivních vzorcích) splnilo 127 (13,9 %) nemocných.
Základní onemocnění a typ protinádorové léčby GM pozitivních pacientů ukazuje tab. 1.
Table 1. Základní onemocnění a typ protinádorové léčby GM pozitivních pacientů. 
Souhrnně byla senzitivita, specificita, pozitivní a negativní prediktivní hodnota detekce GM pro diagnostiku IA na našem pracovišti 95,2 %, 90,0 %, 31,5 % a 99,7 % (tab. 2).
Table 2. Souhrnná analýza přínosnosti detekce GM pomocí Platelia<sup>®</sup> Aspergillus testu. 
Detekce GM pomocí Platelia® Aspergillus testu díky vynikající senzitivitě umožnila zachytit 40 ze 42 případů pravděpodobné/prokázané invazivní aspergilové infekce, ke kterým došlo ve sledovaném období. U obou GM negativních nemocných s IA byl výsledek GM testu sice také pozitivní, ale pouze v 1 vzorku séra, a tak nebyla splněna kritéria pro označení pacientů za GM pozitivní.
782 pacientů ze 784 označených testem za GM negativní nemělo invazivní aspergilovou infekci a tedy díky excelentní NPV dokázal Platelia® Aspergillus test s vysokou pravděpodobností IA vyloučit.
Určitým limitem metody však byla její nízká pozitivní prediktivní hodnota. Tato skutečnost má několik hlavních příčin - jednak velké procento falešných pozitivit testu a rovněž fakt, že velké procento námi vyšetřovaných nemocných spadá do skupiny pacientů s velmi nízkou prevalencí IA.
Falešné pozitivity Platelia® Aspergillus testu
Z celkového počtu 127 GM pozitivních pacientů byla pravděpodobná nebo prokázaná IA dle výše popsaných kritérií stanovena u 40 z nich (31,5 %). V 68,5 % případů (87 pacientů) byla pozitivita testu falešná, a to i přesto, že pro označení nemocného za GM pozitivní byla vyžadována konsekutivní pozitivita.
39 % (n = 34) případů falešné pozitivity bylo způsobeno podáváním penicilinových antibiotik. Testováním jednotlivých penicilinových antibiotik byly jako příčina identifikovány některé šarže piperacilinu/tazobaktamu, ampicilinu a konečně amoxicilin/klavulanátu (a to pouze od některých výrobců), tab. 3. Falešné pozitivity při detekci GM u hematoonkologických nemocných kumulovaly v obdobích, kdy zmíněná antibiotika, respektive jejich nekontrolované šarže, byly na našem pracovišti podávány (do poloviny roku 2004), graf 2. Od druhé poloviny roku 2004 byl z používání vyloučen ampicilin. GM pozitivní amoxicilin/klavulanát byl nahrazen GM negativním preparátem od jiného výrobce. Konečně všechny šarže piperacilin/tazobaktamu jsou před distribucí testovány pomocí Platelia® Aspergillus testu a použity jsou výlučně šarže GM negativní, tzn. takové, které nejlépe v koncentrované podobě a nebo alespoň v naředění na koncentraci odpovídající dosažené koncentraci antibiotika v séru mají IP < 0,5. Tato opatření (s výjimkou krátkého období v roce 2005, kdy nebyly k dispozici GM negativní šarže piperacilin/tazobaktamu) vedla k eliminaci falešných pozitivit Platelia® Aspergillus testu způsobených penicilinovými antibiotiky (graf 2).
Table 3. Testování přítomnosti GM (pozitivity Platelia<sup>®</sup> Aspergillus testu) v jednotlivých šaržích penicilinových antibiotik v koncentrované podobě a po naředění na plazmatickou koncentraci. 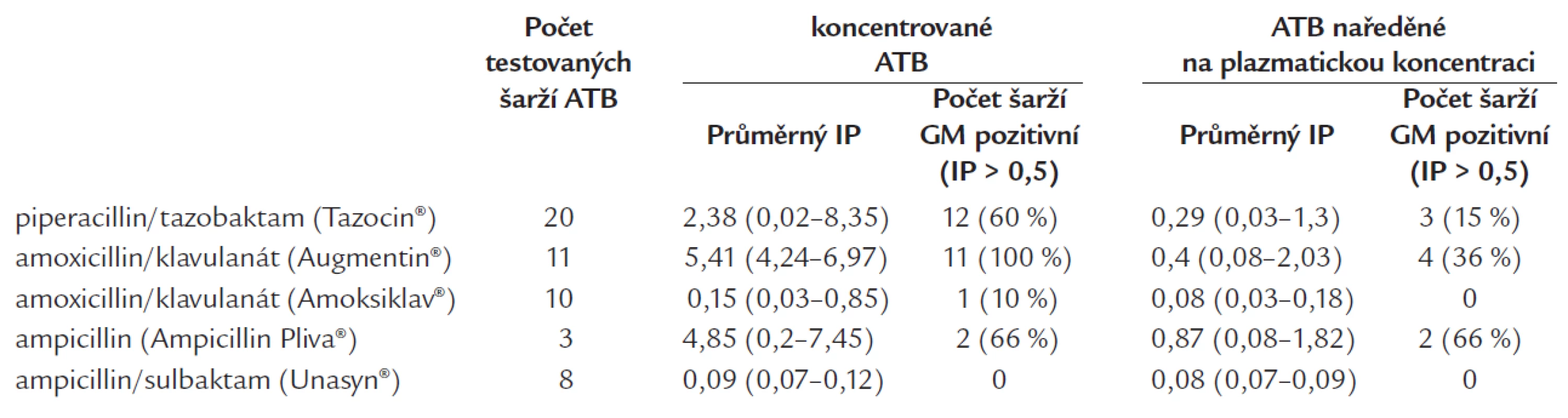
Graph 2. Počet a časování výskytu falešných pozitivit Platelia<sup>®</sup> Aspergillus testu dle jednotlivých příčin. 
52 % (n = 45) případů falešných pozitivit bylo způsobeno podáváním infuzního roztoku Plasma-Lyte a jejich výskyt a počet koreloval se zvyšující se spotřebou tohoto infuzního roztoku na našem pracovišti (graf 2).
U 9 % (n = 8) případů falešné pozitivity Platelia® Aspergillus testu nelze příčinu přesně identifikovat. U 2 pacientů z této skupiny lze zvažovat jako příčinu těžkou mukozitidu s následným průchodem antigenu ze zažívacího traktu, u ostatních nemocných je však falešná pozitivita testu zcela nevysvětlena.
Testování nemocných s nízkou prevalencí IA
Pouze 33 % GM pozitivních nemocných z našeho souboru spadalo do skupiny s vysokým výskytem IA (alogenní HSCT a léčba akutní leukemie). Ostatní GM pozitivní pacienti tedy patří do skupiny s nízkou prevalencí IA. Tento fakt je také jednou z příčin nízké PPV Platelia® Aspergillus testu. Jestliže PPV testu v celém souboru nemocných byla 31,5 %, u nejvíce rizikových pacientů byla výrazně vyšší (alogenní HSCT - 73 %, indukce akutní leukemie 46 %), a naopak u nejméně rizikových nemocných ještě nižší (autologní HSCT - 14 %, ostatní léčba 29 %), tab. 4.
Table 4. Pozitivní prediktivní hodnota (PPV) Platelia<sup>®</sup> Aspergillus testu u jednotlivých skupin hematoonkologických nemocných s odlišnou prevalencí IA. 
Detekce galaktomananu a vztah k HRCT
U 30 ze 40 (75 %) GM pozitivních nemocných s IA bylo provedeno HRCT. První pozitivita GM předcházela pozitivitu na HRCT průměrně o 2 dny (minimum -20 dní; maximum +14 dní) a velice často právě pozitivita GM byla u rizikových nemocných indikací k provedení HRCT.
Vedle schopnosti GM předcházet pozitivitu na HRCT měla v našem souboru pozitivita GM v séru zásadní význam pro diferenciální diagnostiku abnormalit identifikovaných na HRCT. Pouze u 3 nemocných (10 %) byl obraz na HRCT považován za „charakteristický“ pro angioinvazivní formu mykózy (air crescent nebo halo). U zbývajících 27 pacientů (90 %) byl nález na HRCT nespecifický, a právě současná pozitivita GM v séru umožnila označit tyto nálezy za abnormality vyvolané invazivní aspergilovou infekcí (tab. 5).
Table 5. Charakter postižení u nemocných s pravděpodobnou/prokázanou IA u kterých bylo provedeno HRCT a byli označeni za GM pozitivní (n = 30). 
Diskuse
Správná a časná diagnostika invazivní aspergilózy, nejčastější invazivní mykózy hematoonkologických nemocných současné doby, je velice obtížná. Konvenční diagnostika je málo senzitivní a dává opožděný výsledek. Nezřídka je diagnóza stanovena až ante mortem [18].
V posledních letech došlo ke 2 zásadním pokrokům v diagnostice této život ohrožující infekce - rutinnímu používání HRCT a zavedení detekce antigenu buněčné stěny aspergilů (galaktomananu) pomocí Platelia® Aspergillus testu.
V literatuře existuje několik prací poukazujících na velmi dobrou senzitivitu a časnost pozitivity galaktomananu (GM) v séru ve skupině hematoonkologických nemocných, a to, je-li používán jako cut-off indexu pozitivity (IP) 0,5 a odběry krve jsou prováděny 2-3krát týdně [14,19].
Cílem námi předkládané práce bylo zhodnocení využitelnosti detekce GM v séru pro diagnózu invazivní aspergilózy při použití v běžné rutinní praxi na hematoonkologickém oddělení. Velikostí souboru s více jak 11 000 odběry od 900 nemocnými je tato práce podle našich znalostí největší dosud publikovanou na toto téma.
Při hodnocení výsledků jsme vycházeli z klinických kritérií pravděpodobnosti invazivní aspergilózy, a nikoliv z velice často používaných EORTC/MSG kritérií [16], která jsou doporučována jako referenční pro klinické studie. Bohužel však většinou neodpovídají běžné rutinní praxi. Ve stanovení diagnózy prokázané IA se EORTC/MSG a námi použitá klinická kritéria neliší, rozdílné však bylo hodnocení pravděpodobné IA. Pacienti označeni v našem souboru za nemocné s pravděpodobnou IA nemuseli vždy splňovat kritéria EORTC/MSG. Tento přístup k hodnocení, přestože může být určitým limitem naší analýzy, však daleko více odpovídá běžné klinické praxi.
Výsledek naší studie prokázal vysokou senzitivitu testu pro diagnostiku IA u hematoonkologických nemocných a zachytil 40 ze 42 případů IA (senzitivita 95 %). U jednoho z GM negativních nemocných z našeho souboru vznikla IA při profylaktickém podávání vorikonazolu - u pacientů léčených antimykotiky s efektem na kmeny aspergilů mohou být vzhledem k nižší mykotické náloži hodnoty GM v séru hraniční [19]. Předpokládáme, že právě tento jev byl příčinou pouze jednorázové a nikoliv již opakované pozitivity GM v séru u našeho pacienta, který tak musel být označen za GM negativního (díky zvolenému kritériu 2 pozitivních konsekutivních vzorků séra).
Dalším velkým přínosem testu, který vyplynul z naší analýzy, je jeho velmi vysoká negativní prediktivní hodnota. S pravděpodobností 99,7 % dokázal při negativitě test vyloučit přítomnosti IA. V klinické praxi je právě schopnost s vysokou pravděpodobností vyloučit IA u rizikových skupin nemocných velmi přínosná a umožňuje zacílit diagnostické a léčebné postupy dalšími směry.
Naše analýza také prokázala velký význam kombinace detekce GM a včasně provedeného HRCT plic u nemocných v riziku IA. Pozitivita GM v séru sice v průměru předcházela pozitivitu HRCT plic o 2 dny a byla ve většině případů signálem k provedení HRCT, na druhou stranu u 9 nemocných (30 %) naopak abnormalita na HRCT předcházela pozitivitu GM v séru. Kombinace obou metod tedy umožní rozšířit počet pacientů, u kterých bude diagnóza IA stanovena časně.
Jednou z nejdůležitějších výhod kombinace obou dvou zmíněných metod je však možnost pomocí GM odlišit etiologii infiltrátů na HRCT plic. V našem souboru pouze 10 % pacientů mělo na HRCT obraz „specifický“ pro IA. Ve všech ostatních případech to byla právě pozitivita GM v séru, která etiologii nespecifických plicních nálezů odlišila, respektive umožnila stanovit diagnózu IA (tab. 5).
Slabým místem detekce GM v séru je podle našich zkušeností velmi nízká pozitivní prediktivní hodnota (PPV) - tedy pravděpodobnost, že pozitivní výsledek testu bude odpovídat přítomnosti invazivní aspergilózy. Při PPV 31,5 % tedy téměř 70 % pozitivit Platelia® Aspergillus testu nebyla způsobena IA.
PPV každého testu závisí na prevalenci hodnoceného onemocnění ve sledované populaci [20]. A právě vysoké zastoupení pacientů s nízkým rizikem IA v našem souboru (2/3 GM pozitivních pacientů představovali nemocní s nízkou pravděpodobností IA) je jedním z důležitých faktorů, který vedl k tak nízké PPV. Zacílení pravidelného screeningu GM pouze na nemocné s nejvyšším rizikem IA (alogenní HSCT, indukční a reindukční léčba AML) pak jednoznačně zvýší přínosnost testu, respektive zvýší jeho PPV. PPV testu ve skupině nemocných po alogenní HSCT v našem souboru byla 73 % (tab. 4).
Hlavní příčinou tak nízké PPV Platelia® Aspergillus testu však bylo vysoké procento falešně pozitivních výsledků.
Izolované falešné pozitivity testu (způsobené především kontaminací vzorku aspergilovými, ev. penicilinovými vlákny při odběru nebo zpracování vzorku) lze eliminovat opakováním odběru a vyžadováním konzekutivní pozitivity pro to, aby byl nemocný označen jako GM pozitivní. Velký problém představují opakované falešné pozitivity, které lze u rizikových nemocných často jen velmi obtížně odlišit od pozitivit skutečných.
Podobně jako je popisováno v literatuře, i v našem souboru bylo jednou z hlavních příčin podávání některých penicilinových antibiotik. 39 % všech falešných pozitivit testu v našem souboru bylo způsobeno podáváním těchto antibiotik. Penicilinová antibiotika (piperacilin/tazobaktam, amoxicilin/klavulanát a ampicilin) jsou vyráběna semisynteticky s pomocí Penicillium sp. GM ze stěn penicilií následně kontaminuje vlastní výrobek a vede k falešné pozitivitě Platelia® Aspergillus testu při vyšetřování séra nemocných léčených zmíněnými preparáty [8]. Množství kontaminujícího GM je v jednotlivých šaržích antibiotik různé. Proto řešením, které vedlo k eliminaci falešných pozitivit způsobených podáváním penicilinových antibiotik na našem pracovišti, bylo:
- a) ukončení podávání ampicilinu;
- b) náhrada amoxicilin/klavulanátu za GM negativní přípravek od jiného výrobce;
- c) pravidelné měření množství GM ve všech nových šaržích piperacilin/tazobaktamu určených pro naše pracoviště a použití pouze šarží „GM negativních“ (IP < 0,5), a to nejlépe již v koncentrované podobě antibiotika, ev. pokud není jiná volba, alespoň po naředění na obvyklou plazmatickou koncentraci léku (tab. 3 a graf 2).
Nově byl identifikován jako zdroj falešné pozitivity Platelia® Aspergillus testu infuzní roztok Plasma-Lyte (Baxter, USA) [21-23]. Tento infuzní roztok obsahuje kalcium glukonát, který je vyráběn fermentací na kmenech aspergilů, a GM pak opět kontaminuje finální výrobek. Index pozitivity při testování jednotlivých šarží přípravku v Platelia® Aspergillus testu je obvykle vysoký [22]. Spotřeba infuzního roztoku Plasma-Lyte na našem pracovišti od konce roku 2004 velmi prudce stoupala a s navyšující se spotřebou následně koreloval i prudký vzestup počtu falešných pozitivit při detekci GM v séru u nemocných hydratovaných tímto roztokem. 68,5 % případů všech falešných pozitivit v našem souboru byla způsobena podáváním výše zmíněného roztoku. Falešné pozitivity při detekci GM v séru způsobené podáváním roztoku Plasma-Lyte lze velice snadno eliminovat vyloučením používání Plasma-Lyte k hydrataci u hematoonkologických nemocných s předpokladem vyšetřování GM v séru.
Pokud bychom vyloučili z analýzy falešné pozitivity při detekci GM způsobené podáváním penicilinových antibiotik a roztoku Plasma-Lyte (neboť obě příčiny jsou pomocí výše zmíněných opatření eliminovatelné), počet GM falešně pozitivních pacientů by klesl z 87 na 8 a pozitivní prediktivní hodnota testu (PPV) by stoupla z 31,5 % na 83,3 %.
Závěr
Výsledky naší práce představují největší dosud publikovanou analýzu sledující význam detekce GM u hematoonkologických nemocných pomocí sandwichové ELISy (Platelia® Aspergillus, Bio-Rad, Francie) v diagnostice invazivní aspergilové infekce. Prokázali jsme její excelentní senzitivitu a negativní prediktivní hodnotu stejně tak jako velký význam její kombinace s HRCT plic. V běžné klinické praxi je však nutno myslet na možnost falešně pozitivních výsledků a tak omezenou pozitivní prediktivní hodnotu testu. Znalost a eliminace dvou hlavních příčin těchto falešných pozitivit - podávání některých penicilinových antibiotik a aplikace infuzního roztoku Plasma-Lyte - však umožňuje tyto falešné pozitivity testu významnou měrou minimalizovat.
Poděkování
Práce byla podpořena IGA MZ ČR NR8452-3/2005 a VZ MSM6198959223.
MUDr. Zdeněk Ráčil
www.fnbrno.cz
e-mail: zracil@fnbrno.cz
Doručeno do redakce: 22. 8. 2007
Přijato po recenzi: 3. 10. 2007
Sources
1. Pagano L, Caira M, Candoni A et al. The epidemiology of fungal infections in patients with hematologic malignancies: the SEIFEM-2004 study. Haematologica 2006; 91 : 1068-1075.
2. Fukuda T, Boeckh M, Carter RA et al. Risks and outcomes of invasive fungal infections in recipients of allogeneic hematopoietic stem cell transplants after nonmyeloablative conditioning. Blood 2003; 102 : 827-833.
3. Subira M, Martino R, Franquet T et al. Invasive pulmonary aspergillosis in patients with hematologic malignancies: survival and prognostic factors. Haematologica 2002; 87 : 528-534.
4. Mayer J. Nahradí transplantace periferních kmenových buněk krvetvorby definitivně transplantace kostní dřeně? Vnitř Lék 2000; 46 : 785-793.
5. Lin SJ, Schranz J, Teutsch SM. Aspergillosis case-fatality rate: systematic review of the literature. Clin Infect Dis 2001; 32 : 358-366.
6. von Eiff M, Roos N, Schulten R et al. Pulmonary aspergillosis: early diagnosis improves survival. Respiration 1995; 62 : 341-347.
7. Brodoefel H, Vogel M, Hebart H et al. Long-term CT follow-up in 40 non-HIV immunocompromised patients with invasive pulmonary aspergillosis: kinetics of CT morphology and correlation with clinical findings and outcome. AJR Am J Roentgenol 2006; 187 : 404-413.
8. Aquino VR, Goldani LZ, Pasqualotto AC. Update on the contribution of galactomannan for the diagnosis of invasive aspergillosis. Mycopathologia 2007; 163 : 191-202.
9. Ráčil Z, Kocmanová I, Wagnerová B et al. Časná diagnostika invazivních mykotických infekcí u hematoonkologických nemocných pomocí sérologických metod. Vnitř Lék 2007; 53 : 645-654.
10. Donnelly JP Polymerase Chain Reaction for Diagnosing Invasive Aspergillosis: Getting Closer but Still a Ways to Go. Clin Infect Dis 2006; 42 : 487-489.
11. Maertens J, Verhaegen J, Demuynck H et al. Autopsy-controlled prospective evaluation of serial screening for circulating galactomannan by a sandwich enzyme-linked immunosorbent assay for hematological patients at risk for invasive Aspergillosis. J Clin Microbiol 1999; 37 : 3223-3228.
12. Maertens J, Verhaegen J, Lagrou K et al. Screening for circulating galactomannan as a noninvasive diagnostic tool for invasive aspergillosis in prolonged neutropenic patients and stem cell transplantation recipients: a prospective validation. Blood 2001; 97 : 1604-1610.
13. Maertens J, Van Eldere J, Verhaegen J et al. Use of circulating galactomannan screening for early diagnosis of invasive aspergillosis in allogeneic stem cell transplant recipients. J Infect Dis 2002; 186 : 1297-1306.
14. Maertens J, Theunissen K, Verbeken E et al. Prospective clinical evaluation of lower cut-offs for galactomannan detection in adult neutropenic cancer patients and haematological stem cell transplant recipients. Br J Haematol 2004; 126 : 852-860.
15. Pfeiffer CD, Fine JP, Safdar N Diagnosis of invasive aspergillosis using a galactomannan assay: a meta-analysis. Clin Infect Dis 2006; 42 : 1417-1427.
16. Ascioglu S, Rex JH, de Pauw B et al. Defining opportunistic invasive fungal infections in immunocompromised patients with cancer and hematopoietic stem cell transplants: an international consensus. Clin Infect Dis 2002; 34 : 7-14.
17. Subira M, Martino R, Rovira M et al. Clinical applicability of the new EORTC/MSG classification for invasive pulmonary aspergillosis in patients with hematological malignancies and autopsy-confirmed invasive aspergillosis. Ann Hematol 2003; 82 : 80-82.
18. Ráčil Z, Kocmanová I, Wagnerová B et al. Invazivní mykotické infekce u onkologických nemocných: změny v epidemiologii a diagnostice. Postgrad Med 2007; 9 : 240-252.
19. Marr KA, Balajee SA, McLaughlin L et al. Detection of galactomannan antigenemia by enzyme immunoassay for the diagnosis of invasive aspergillosis: variables that affect performance. J Infect Dis 2004; 190 : 641-649.
20. Loong TW. Understanding sensitivity and specificity with the right side of the brain. BMJ 2003; 327 : 716-719.
21. Hage CA, Reynolds JM, Durkin M et al. Plasmalyte as a cause of false-positive results for Aspergillus galactomannan in bronchoalveolar lavage fluid. J Clin Microbiol 2007; 45 : 676-677.
22. Racil Z, Kocmanova I, Lengerova M et al. Intravenous PLASMA-LYTE as a Major Cause of False-Positive Results of Platelia Aspergillus Test for Galactomannan Detection in Serum. J Clin Microbiol 2007; 45 : 3141-3142.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2008 Issue 1-
All articles in this issue
- Sledování účinnosti antikoagulační léčby u nemocných s fibrilací síní v závislosti na věku
- Pozitivita sérových protilátok proti endomýziu, jejunu a histopatologická diagnostika celiakie u detí
- Hodnocení proliferačního a apoptotického indexu plazmatických buněk v průběhu mnohočetného myelomu
- Konvenční léčba fibrilace síní řízená ambulantními kardiology v ČR: přehled diagnostických a léčebných výkonů, medikamentózní léčby a hospitalizací
- Využití detekce galaktomananu pro diagnostiku invazivní aspergilózy u hematoonkologických nemocných
- Diferencovaný přístup k preskripci fyzické aktivity u nemocných s dysfunkcí levé komory srdeční
- Farmakogenetika léčby statiny
- Léčba Waldenströmovy makroglobulinemie a léčba nemocí způsobených monoklonálním IgM gamaglobulinem
- Doporučení České revmatologické společnosti pro léčbu revmatoidní artritidy. Účinnost a strategie léčby
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Využití detekce galaktomananu pro diagnostiku invazivní aspergilózy u hematoonkologických nemocných
- Hodnocení proliferačního a apoptotického indexu plazmatických buněk v průběhu mnohočetného myelomu
- Farmakogenetika léčby statiny
- Doporučení České revmatologické společnosti pro léčbu revmatoidní artritidy. Účinnost a strategie léčby
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

