-
Medical journals
- Career
Farmakogenetika léčby statiny
Authors: J. A. Hubáček 1,2; V. Adámková 1; K. Zídková 3; R. Češka 3; L. Zlatohlávek 3; T. Štulc 3; A. Hořínek 3; M. Vráblík 3
Authors‘ workplace: Institut klinické a experimentální medicíny Praha, ředitel doc. MUDr. Jan Malý, CSc. 1; Centrum výzkumu chorob srdce a cév IKKEM Praha, ředitel prof. MUDr. Bohuslav Ošťádal, DrSc. 2; III. interní klinika 1. lékařské fakulty UK a VFN Praha, přednosta prof. MUDr. Štěpán Svačina, DrSc., MBA 3
Published in: Vnitř Lék 2008; 54(1): 62-67
Category: Review
Overview
Snížení vysokých hladin plazmatických lipidů (LDL-cholesterolu a triglyceridů) je jedním z nejdůležitějších kroků v prevenci a léčbě kardiovaskulárních onemocnění. U většiny případů je však léčba změnou životního stylu (úpravou dietních zvyklostí, zvýšenou fyzickou aktivitou) nedostatečná a je nutné přistoupit k farmakologické terapii. Statiny, inhibitory 3-hydroxy-3-methylglutaryl koenzym-A reduktázy, jsou dobře tolerovaným lékem první volby u pacientů s dyslipidemií. U různých pacientů se stejnou terapií je však prokázána značná variabilita účinku statinů a je jasné, že příčinou jsou z velké části odlišné genetické předpoklady každého jedince ovlivňující účinnost farmakoterapie. Jsou popsány vlivy jednotlivých genetických variant, ale regulace odezvy na hypolipidemickou léčbu je velmi pravděpodobně pod polygenní kontrolou. Analýza kombinací více genů může pomoci detekovat existenci hyper - a hyporesponderů, tj. jedinců, kteří na léčbu reagují dobře (a je možno začít s nižší dávkou medikamentu), nebo naopak nedostatečně (zde nebude statin lékem první volby), případně může napomoci identifikovat nemocné náchylné ke vzácným závažným nežádoucím účinkům. Ve studiích s různým designem bylo popsáno, že např. geny (a jejich varianty) pro cytochromy, apolipoproteiny E a A1 a cholesterol 7-α hydroxylázu mohou být důležitým genetickým determinantem účinnosti farmakologické léčby dyslipidemií a hrát roli v individualizaci léčby.
Klíčová slova:
statiny - dyslipidemie - genová variabilita - farmakogenetikaÚvod
Kardiovaskulární onemocnění (KVO) jsou v průmyslových zemích nejčastější příčinou úmrtí (v ČR představují více než 50 % úmrtí dospělých osob). Rizikové faktory KVO lze rozdělit na neovlivnitelné (věk, pohlaví, genetická informace) a ovlivnitelné (dyslipidemie, kouření, nadváha, hypertenze). Mezi nejzávažnější z těch, které lze ovlivnit, patří vysoká hladina celkového cholesterolu (total cholesterol - TC) a triglyceridů (TG) v krevní plazmě. Přestože výskyt dyslipidemií v české populaci pozvolna klesá [1], stále zůstávají jedním z nejdůležitějších rizikových faktorů [2].
Hladinu krevních lipidů určují vedle faktorů genetických i faktory vnější, např. množství fyzické aktivity, ale především složení diety. Redukce příjmu živočišných tuků a cholesterolu dietou je tak prvním a nutným doporučením pro pacienty se zvýšenou hladinou lipidů.
U většiny pacientů, u nichž dietní intervence nepřinese žádoucí účinky či u nichž jsou iniciální hladiny plazmatických lipidů příliš vysoké, je však nutno přistoupit k farmakologické léčbě. U nemocných s dyslipidemií jsou lékem první volby blokátory (inhibitory) 3-hydroxy-3-methylglutaryl koenzym-A reduktázy (HMG-CoA) - statiny. Jejich hlavním účinkem je snížení syntézy cholesterolu v játrech. Pokles cholesterolu v jaterních buňkách vede ke zvýšené hustotě LDL-receptorů na povrchu buněk a tak ke zvýšenému vychytávání LDL částic z plazmy. Statiny snižují i syntézu apolipoproteinu B v játrech a tím i sekreci VLDL částic. Statiny příznivě ovlivňují celé lipoproteinové spektrum a mají další antiaterogenní účinky [3-6]. Řada intervenčních studií prokázala jejich účinnost v primární i v sekundární prevenci KVO. Kromě příznivého účinku na hladiny krevních lipidů mají statiny další vlastnosti, které se podílejí na snižování kardiovaskulárního rizika. Je třeba říci, že odlišení lipidových a nelipidových účinků je někdy obtížné, protože oba efekty se vzájemně doplňují a často jde o současné působení snížených hladin lipidů a aditivní přímé působení statinů.
Mezi nejdůležitější nelipidové účinky statinů patří modulace endoteliální funkce, antioxidační, antiinflamační, antiproliferační a antitrombogenní účinky. Zajímavá je i otázka působení statinů na kostní metabolizmus [7-11].
U různých pacientů se stejnou terapií je prokázána značná variabilita účinku statinů (pokles LDL-cholesterolu o 8 – 55 % a triglyceridů o 7 – 30 %, nárůst HDL-cholesterolu o 0 - 10 %) [3,4]. Rovněž rychlost nástupu účinku léčiva se významně liší. U každého jedince je ale odpověď na léčbu hypolipidemiky v čase relativně stabilní a je nepochybné, že je regulována geneticky.
V posledních letech se objevily práce týkající se genetické determinace účinnosti hypolipidemické léčby ukazující na některé geny, jejichž varianty mohou být důležité pro určení účinnosti hypolipidemické léčby [12-14]. Rovněž tak je pravděpodobné, že i výskyt nežádoucích vedlejších účinků této léčby bude mít i svůj genetický základ.
Genetická rozmanitost
V lidském genomu se předpokládá existence až několika milionů genetických variant. Tyto varianty jsou představovány většinou záměnami jednotlivých nukleotidů (single nucleotide polymorphisms - SNP). Záměny vyskytující se s alespoň 1 % frekvencí (tzn. minimálně jedna alela u 50 sledovaných jedinců) se nazývají polymorfizmy, varianty s nižší frekvencí pak mutacemi. Další změny v DNA jsou inzerce/delece, charakterizované přítomností/nepřítomností jednoho až několika set nukleotidů. Ty mohou mít na funkci genu fatální dopad - mění se čtecí rámec, a tím aminokyselinové složení proteinu. Možný je i výskyt předčasných stop-kodonů, vedoucích ke vzniku zkrácených forem proteinů. Repetitivní varianty představují poslední velkou skupinu genetických polymorfizmů. Jsou charakterizovány různým počtem opakujících se sekvencí. Ty mohou být 2, 3 i více nukleotidové a počty opakování jsou velice variabilní. Sekvence se může opakovat 3krát, ale i více než 20krát.
Velká většina DNA variant nemá funkční vliv (nebo nejsme prozatím schopni ho rozpoznat) na kódovaný protein. Stále však existují tisíce variant, které jsou v regulačních částech genů a mají za následek ovlivnění koncentrace daného proteinu nebo se nacházejí v kódujících částech genů a ovlivňují aminokyselinové složení, důležité pro funkci proteinu.
Protokoly prozatím dostupných intervenčně/asociačních studií vycházejí z podrobné analýzy jednoho (nebo několika) předem zvoleného „kandidátního“ genu (genů), u kterého se předpokládá příčinná souvislost s účinkem statinů.
Z dosud publikovaných (byť ne příliš četných) výsledků je jasné, že genetická determinace účinku hypolipidemické léčby je polygenní tzn, že je ovlivněna běžnými variantami několika různých, na sobě nezávislých genů a analýza jednoho z nich poskytne „pouze“ dílčí výsledek. Jednotlivé geny vstupují do interakcí nejen s ostatními geny, ale i s řadou faktorů vnějšího prostředí (v případě léčby dyslipidemie především s dietními zvyklostmi a fyzickou aktivitou). Studium těchto komplexních vztahů v oblasti genetiky (interakce gen-gen, farmakogenetika [12-14] a nutrigenetika [15] je na počátku, ale jednoznačně se ukazuje, že právě tudy vede cesta k rozpletení složitých vztahů genetických dispozic ovlivňujících účinnost farmakologické léčby dyslipidemií.
Farmakokinetika a farmakodynamika
Genetické varianty ovlivňují účinek (efektivitu) léčiv prostřednictvím dvou základních „mechanizmů“ [16] (obr. 1). Prvním z nich je farmakokinetika, kdy genetické varianty ovlivňují absorpci, transport xenobiotika (v našem případě léčiva) organizmem, jeho metabolizmus (degradaci), transport a eliminaci katabolitů léku z organizmu. Příkladem mohou být varianty v genech pro ABC transportéry, enzymatické složky cytochromu P450 či transmembránové transportní systémy.
Image 1. Schematické znázornění farmakokinetiky a farmakodynamiky hypolipidemické léčby. Genetické varianty mohou ovlivnit všechny jednotlivé kroky. 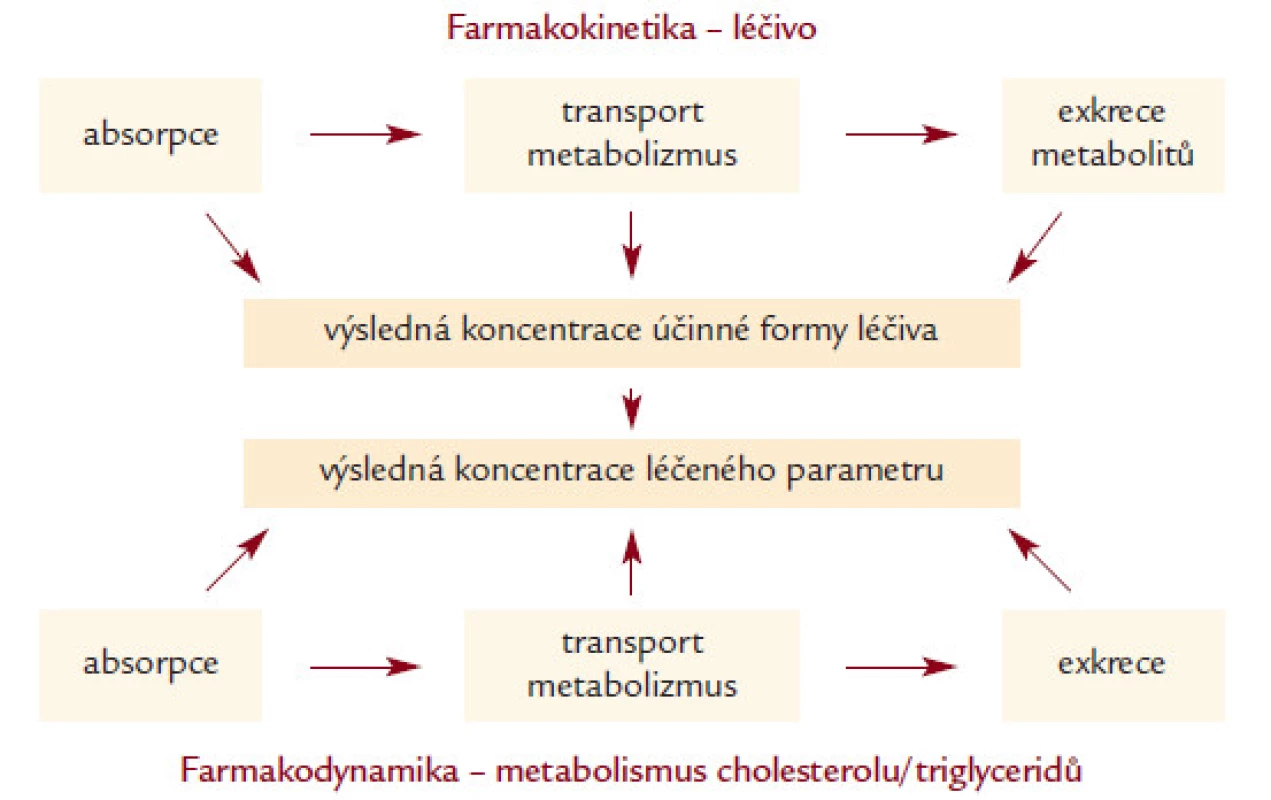
Genetické varianty ovlivňují i farmakodynamiku léčby. Zde je nutné znát, jakým způsobem látka působí a které molekuly/biochemické procesy jsou látkou ovlivněny. V případě účinku statinů se přímo nabízejí např. varianty v genech pro HMG-CoA reduktázu, LDL receptor, cholesterol 7-α hydroxylázu či apolipoproteiny E a A1.
Dnes je známa řada polymorfizmů v různých genech, ovlivňujících obě kategorie účinku, které byly dány do spojitosti s poklesem hladin celkového či LDL-cholesterolu při léčbě statiny. Ve většině případů se však jedná o jednotlivé, nepříliš rozsáhlé studie a naše znalosti o genetické determinaci odezvy na léčbu dyslipidemie nejsou prozatím dostatečné ke klinické aplikaci v podobě individualizace léčby statiny.
Genetické faktory ve farmakokinetice účinku statinů
CYP3A4 je klíčový enzym ovlivňující metabolizmus lovastatinu, simvastatinu a atorvastatinu. V regulující části genu byla popsána -290G>A varianta a v pilotní studii bylo naznačeno, že GG homozygoti mají lepší odezvu na léčbu statiny [17].
Fluvastatin je naproti tomu z 50 - 80 % metabolizován enzymem CYP2C9 [18]. Záměna aminokyseliny Ile359>Leu byla u heterozygotů spojena s poklesem efektivity odbourávání fluvastatinu na 40 - 75 % a v homozygotním stavu dokonce na necelých 25 % v porovnání s Leu359Leu homozygoty [19].
ABCB-1 (známý rovněž jako MDR-1 - multidrug resistance-1 protein nebo P-glykoprotein) je membránově asociovaný protein s významnou úlohou při navození lékové rezistence. Protein působí jako ATPdependentní pumpa pro řadu xenobiotik. Pilotní studie odhalily vliv 3435C>T, 2677G>A/T a 1236C>T variant na úspěšnost léčby simvastatinem [20].
Dalšími kandidátními geny farmakogenetiky hypolipidemické léčby jsou např. geny kódující OATP (organic anion transporting polypeptides), OCT (organic cation transporters), PEPT (dipeptide transporters), CNT (nucleoside transporters), MCT (monocarboxylate carriers). Jedná se o různé membránové transportní systémy, které se podílejí na absorpci, distribuci a vylučování léků.
Table 1. Příklady kandidátních genů dosud sledovaných v souvislosti s farmakogenetikou hypolipidemické léčby (www adresa OMIM databáze – http://www.ncbi.nlm.nih.gov/sites/entrez). 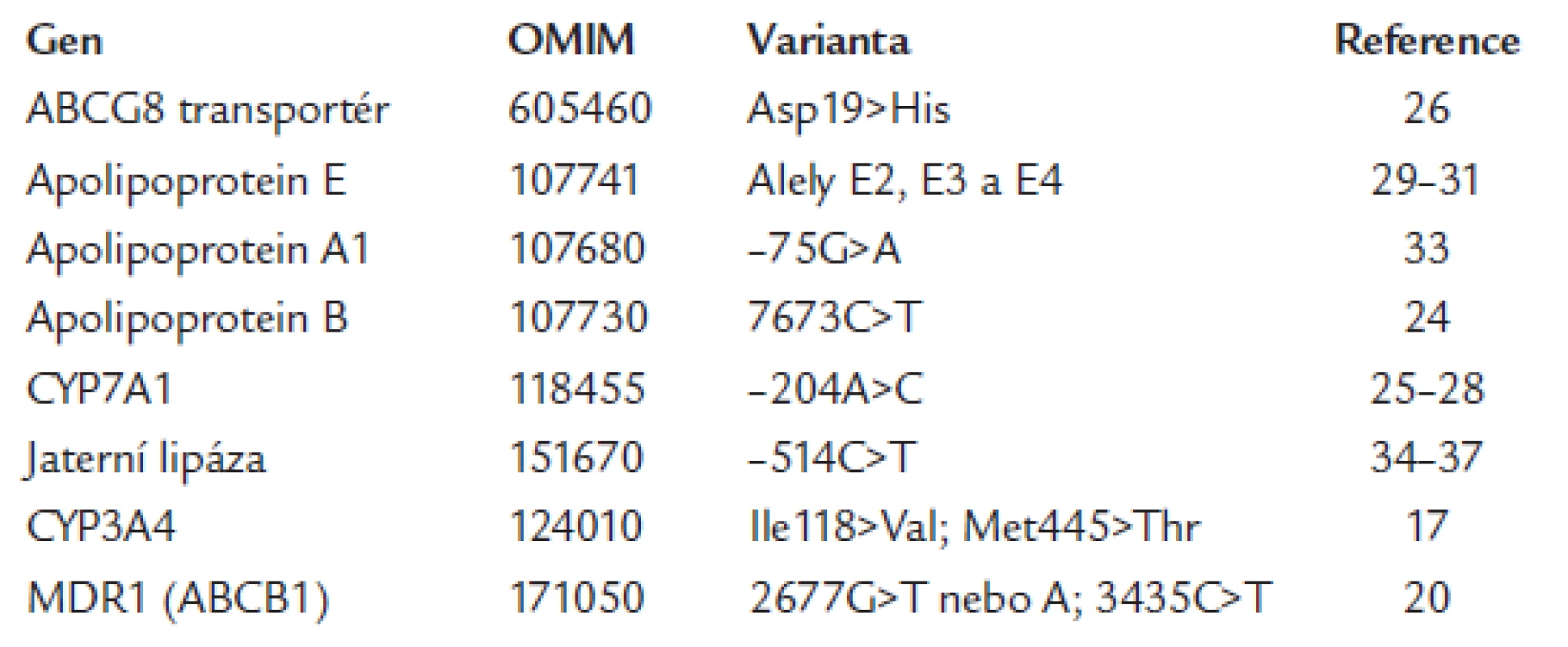
Genetické faktory ve farmakodynamice účinku statinů
Počet kandidátních genů analyzovaných ve vztahu k farmakodynamice účinku statinů je podstatně vyšší. Patří sem především geny kódující enzymy metabolizmu cholesterolu, geny kódující apolipoproteiny jako stavební kameny plazmatických lipoproteinů a geny pro buněčné receptory.
Logickým kandidátem ovlivňujícím účinek statinů je gen pro HMG-CoA reduktázu a jeho varianty.
Analýzou tohoto (mimo jiných) genu se zabývala prozatím nejrozsáhlejší publikovaná studie, zahrnující 1 536 jedinců (avšak různého etnického původu) léčených pravastatinem [21]. Studie detekovala 2 varianty v 5. (A > T) a 15. (T > G) intronu (z celkem 33 analyzovaných) genu pro HMG-CoA reduktázu, které ovlivnily významně pokles cholesterolu. Obě varianty byly v silné vazebné nerovnováze, v obou případech byl výraznější pokles jak celkového (asi o 22 %), tak LDL-cholesterolu (asi o 20 %) pozorován u nositelů méně četných alel T a G.
Překvapivě, minimum studií je publikováno o 2 genech kódující další klíčové proteiny metabolizmu cholesterolu - o genech pro LDL receptor a apolipoprotein B. Je pochopitelné, že přítomnost defektního LDL receptoru snižuje efektivitu léčby statiny [22]. Odlišné třídy mutací v LDL receptoru mohou mít na účinnost léčby různý vliv. Ve studii porovnávající pacienty s familiární hypercholesterolemií vyvolanou mutacemi způsobujícími poruchy transportu LDL receptoru na plazmatickou membránu (n = 28) s pacienty s defektní recyklací LDL receptoru (n = 21) byl pozorován významný (p = 0,001) rozdíl v efektivitě účinku léčby atorvastatinem na pokles hladin LDL-C a apoB [23].
V případě polymorfizmů v genu pro APOB je zatím jedinou dostupnou prací studie provedená na 88 pacientech čínského etnika s dyslipidemií, kterým byl podáván simvastatin. Autoři sledovali změny hladin celkového cholesterolu, LDL-cholesterolu, triglyceridů a apoB po 4, 8 a 12 týdnech léčby v závislosti na přítomnosti XbaI polymorfizmu (záměna 7673C>T ve 3. bázi kodonu pro Thr2488) genu pro APOB. Pokles hladiny celkového cholesterolu byl významně (p < 0,05) snížen u pacientů nesoucích alelu T7673 [24].
Cholesterol 7-α hydroxyláza (CYP7A1) řídí syntézu žlučových kyselin, a hraje tak důležitou roli v udržení rovnováhy metabolizmu cholesterolu. C-204C homozygoti mají po dietních změnách nejvyšší pokles cholesterolu [25,26]. Recentně byly popsány vlivy interakcí mezi variantami v genu pro CYP7A1 a v genech pro APOE a ABCG8 transportér na efekt léčby statiny [27,28].
Obě studie analyzovaly 337 hypercholesterolemických pacientů (202 mužů a 135 žen) léčených 52 týdnů 10 mg atorvastatinu denně.
V první řadě, varianta -204A > C v genu pro CYP7A1 ovlivnila nezávisle a významně snížení LDL-cholesterolu. LDL-cholesterol poklesl u AA homozygotů o 39 %, u CA heterozygotů o 37 % a u CC homozygotů o 34 % (p < 0,0001 pro trend). Rozdíly byly patrnější u mužů než u žen. Navíc tato varianta významně interagovala s variantami v genech pro apolipoprotein E (E2, E3 a E4 alely) nebo pro ABCG8 transportér (Asp19 > His).
U mužů s kombinací genotypů A-204A a APOE3E3 byl průměrný pokles LDL-cholesterolu 41 % (n = 29), zatímco u mužů s genotypy C-204C a APOE2 nebo APOE4 (n = 18) pouze 28 % (p < 0,001). U žen nebylo snížení plazmatického LDL-cholesterolu ovlivněno interakcí mezi geny pro CYP7A1 a APOE.
Podobným způsobem interaguje -204A>C varianta v genu pro CYP7A1 s ABCG8 Asp19>His polymorfizmem. ABCG8 transportér je exprimován ve střevní stěně a reguluje jednak absorpci rostlinných sterolů a jednak exkreci sterolů obecně. Přítomnost alespoň jedné alely His19 byla spojena s větším poklesem LDL-cholesterolu (Δ -3,0 %), v porovnání s Asp19Asp homozygoty. Redukce je ještě vyšší v případě, že je přítomen i CYP7A1 A-204A genotyp (Δ -4,5 %). V ostatních případech je redukce významně (p < 0,05) nižší (Δ -1,8 % pro A-204C heterozygoty a Δ -0,2 % pro C-204C homozygoty). Rozdíly mezi muži a ženami nebyly zjištěny.
Gen pro apolipoprotein E (APOE) se vyskytuje ve 3 základních variantách (E2, E3 a E4) a alela E4 je spojena se zvýšenou a alela E2 se sníženou hladinou cholesterolu [29]. APOE polymorfizmus je patrně nejčastěji sledovaným genetickým determinantem analyzovaným ve vztahu k cholesterol snižujícímu efektu statinů [30]. Z dostupných studií [31] je patrné, že k největšímu poklesu hladin plazmatického cholesterolu dochází u nositelů alely E4 a k nejmenšímu poklesu pak u nositelů alely E2. Nicméně, přibližně polovina studií analyzujících tento gen nenalezla žádné významné rozdíly. Zdá se, že tento gen hraje důležitější roli v populacích s obecně vysokou hladinou plazmatického cholesterolu a v populacích s vysokou dietní spotřebou nasycených tuků a cholesterolu.
MTP (microsomal triglyceride transfer protein) je lokalizován v endoplazmatickém retikulu, kde zprostředkovává přenos lipidů na apoB ve vznikajících lipoproteinových částicích. V promotoru MTP genu byl detekován -493G>T polymorfizmus. U mužů s familiární hypercholesterolemií tento polymorfizmus ovlivnil pokles hladiny triglyceridů po 6týdenním podávání atorvastatinu, u žen tento efekt pozorován nebyl [32].
APOA1 je hlavní součástí HDL částic. V promotoru genu je popsána funkční varianta -75G>A. U jedinců s genotypem AA se neprokázal vliv na hladiny HDL-cholesterolu po podání statinů, u pacientů s GG genotypem byl pozorován vzestup o 5 % [33].
Hepatická lipáza je syntetizována buňkami jaterní tkáně a hydrolyzuje triglyceridy v lipoproteinových částicích IDL a HDL. Řada studií odhalila asociaci 514T>C polymorfizmu s hladinami a složením plazmatických lipoproteinů [34-36]. Pilotní studie upozornila na významně vyšší hodnoty HDLcholesterolu po léčbě pravastatinem u nositelů alely T514 [37].
V jednotlivých studiích byly dále sledovány např. varianty v genech pro CETP (cholesteryl ester tranfer protein) [38], SREBP (sterol regulatory element-binding factor) [39] či pro SCAP (SREBP cleavage-activating protein) [40].
Rizika spojená s terapií statiny a genetika
Statiny patří mezi léky s velmi nízkým rizikem nežádoucích účinků. To potvrdila rozsáhlá metaanalýza zahrnující výsledky pozorování téměř 80 000 pacientů léčených statiny v 35 studiích [41].
Nicméně i při léčbě statiny je nutno sledovat některé bezpečnostní laboratorní parametry (kreatinkinázu - CK, transaminázy). Po zahájení léčby je vhodná kontrola do 8 týdnů, při nekomplikované léčbě je možné interval monitoringu prodloužit na 6 měsíců. Sledování hodnot CK umožňuje (do určité míry) objektivizovat svalové komplikace léčby (myopatie). Z praxe víme, že i při normálních hodnotách CK se mohou objevit bolesti svalů (myalgie), které mizí po přerušení léčby. Potvrzením diagnózy myozitidy (svalová bolest s mikroskopickými známkami svalového poškození v bioptickém vzorku) by byla svalová biopsie, ke které se však uchylujeme až v těžších a nejasných případech. Nejzávažnější a naštěstí velmi vzácnou komplikací léčby statiny je rabdomyolýza, jejíž frekvence výskytu je odhadována na maximálně 0,5 % léčených. Zejména u osob s disponujícími faktory pro myotoxicitu (přidružená onemocnění, nutnost konkomitantní medikace atd) by screening náchylnosti k nežádoucím reakcím byl cennou pomůckou při rozhodování o vedení terapie. Znalost genetických předpokladů k nežádoucím účinkům léčby statiny v budoucnosti napomůže k větší individualizaci léčby a lze předpokládat, že i k dalšímu snížení výskytu (už tak vzácných) komplikací terapie hypolipidemiky.
Příkladem budiž studie Fiegenbauma et al [40] sledující 116 pacientů s hypercholesterolemií, léčených simvastatinem po dobu 6 měsíců. U 17 z nich byla léčba předčasně ukončena z důvodu nežádoucích účinků. Nejčastějším nežádoucím účinkem byla svalová bolest a slabost při normálních nebo mírně zvýšených hladinách CK, která se vyskytla u 15 ze 17 pacientů. Studie sledovala 3 polymorfizmy v genu pro ABCB1 (3435C>T, 2677G>A/T a 1236C>T) a jejich vztah k bezpečnosti simvastatinové léčby. Analýza odhalila statisticky významně nižší (p < 0,05) frekvenci méně četných alel sledovaných polymorfizmů ve skupině pacientů, u nichž musela být léčba předčasně ukončena oproti skupině pacientů, kteří absolvovali celou léčbu.
Závěr
Výsledky (vyjma, ale i zde s určitými výhradami, variant v genu pro apolipoprotein E) nebyly opakovaně potvrzeny ve více nezávislých studiích, podobně až na několik výjimek dosud nebyly publikovány komplexní analýzy, kombinující více genotypů/alel různých genů.
Obtížná reprodukovatelnost dosud publikovaných studií má několik zřejmých důvodů. V první řadě je jím nízký počet analyzovaných jedinců (v některých případech bylo analyzováno pouze okolo 50 jedinců). Výběr pacientů (např. pacienti s FH, „běžná“ hypercholesterolemická populace apod) a odlišné interakce gen - prostředí (kuřák/nekuřák, současná dietní intervence apod) hrají bezpochyby důležitou roli, stejně jako ji může hrát etnický původ sledovaných jedinců/pacientů.
Je dobře možné, že genetická determinace účinku statinů na snížení LDL-cholesterolu bude v některých případech sex-specifická podobně, jako jsou mezi muži a ženami patrné rozdíly ve snížení cholesterolu v odezvě na dietní změny [42].
Na základě dosud publikovaných výsledků je jasné, že odlišné „genetické pozadí“ každého jedince hraje důležitou roli i v ovlivnění účinku farmakologické léčby dyslipidemií. I když jsou detekovatelné vlivy jednotlivých variant, především komplexní analýza kombinací více genů může ukázat na podstatnější rozdíly - na existenci tzv. hyper - a hyporesponderů, tj. jedinců, kteří na léčbu budou reagovat dobře (a tedy bude možno začít s nižší dávkou medikamentu), nebo naopak špatně (u kterých pak nebude statin lékem první volby), či dokonce pomoci detekovat jedince ohrožené nežádoucími vedlejšími účinky.
Genetická analýza vhodných variant povede k individualizaci léčby statiny, která bude pro pacienta šetrnější, účinnější a v neposlední řadě i ekonomičtější.
Tato práce byla podpořena projektem IGA ČR MZ č. NR/9411-3.
Ing. Jaroslav A. Hubáček, CSc.
www.ikem.cz
e-mail: jaroslav.hubacek@ikem.cz
Doručeno do redakce: 23. 4. 2007
Přijato po recenzi: 24. 9. 2007
Sources
1. Poledne R, Škodová Z. Changes in nutrition, cholesterol concentration, and cardiovascular disease mortality in the Czech population in the past decade. Nutrition 2000; 16 : 785-786.
2. Cífková R. Prevence ischemické choroby srdeční v dospělém věku. Kapitoly z kardiologie 2002; 2 : 122-139.
3. Sever PS, Dahlof B, Poulter NR et al. Prevention of coronary and stroke events with atorvastatin in hypertensive patients who have average or lower-than-average cholesterol concentrations, in the Anglo-Scandinavian Cardiac Outcomes Trial-Lipid Lowering Arm (ASCOT-LLA): a multicentre randomised controlled trial. Lancet 2003; 361 : 1149-1158.
4. Shepherd J, Blauw GJ, Murphy MB et al. Pravastatin in elderly individuals at risk of vascular disease (PROSPER): a randomised controlled trial. Lancet 2002; 360 : 1623-1630.
5. Adámková V. Farmakologická léčba hyperlipoproteinemií. Practicus 2004; 3 : 189-192.
6. Adámková V. Nejnovější trendy léčby závažné dyslipidemie v praxi. Practicus 2007; 6 : 12-14.
7. Shovman O, Levy Y, Gilburd B et al. Antiinflammatory and immunomodulatory properties of statins. Immunol Res 2002; 25 : 271-285.
8. Browning DR, Martin RM. Statins and risk of cancer: A systematic review and metaanalysis. Int J Cancer 2007; 120 : 833-843.
9. Švejda P. Statiny a osteoporóza. Vnitř Lék 2006; 52 : 1190-1193.
10. Vrablík M, Češka R. Statiny: od lipidologii ke kardiologii. Klinická farmakologie 2005; 8 : 47-49.
11. Vrablík M. Statiny. Practicus 2006; 6 : 219-222.
12. Siest G, Ferrari L, Accaoui MJ et al. Pharmacogenomics of drugs affecting the cardiovascular system. Clin Chem Lab Med 2003; 41 : 590-599.
13. Siest G, Jeannesson E, Berrahmoune H et al. Pharmacogenomics and drug response in cardiovascular disorders. Pharmacogenomics 2004; 5 : 779-802.
14. Takane H, Miyata M, Burioka N et al. Pharmacogenetic determinants of variability in lipid-lowering response to pravastatin therapy. J Hum Genet 2006; 51 : 822-826.
15. Talmud PJ Gene-environment interaction and its impact on coronary heart disease risk. Nutr Metab Cardiovasc Dis 2007; 17 : 148-152.
16. Schmitz G, Langmann T. Pharmacogenomics of cholesterol-lowering therapy. Vascul Pharmacol 2006; 44 : 75-89.
17. Kajinami K, Brousseau ME, Ordovas JM et al. CYP3A4 genotypes and plasma lipoprotein levels before and after treatment with atorvastatin in primary hypercholesterolemia. Am J Cardiol 2004; 93 : 104-107.
18. Fischer V, Johanson L, Heitz F et al. The 3-hydroxy-3-methylglutaryl coenzyme A reductase inhibitor fluvastatin: effect on human cytochrome P-450 and implications for metabolic drug interactions. Drug Metab Dispos 1999; 27 : 410-416.
19. Kirchheiner J, Brockmoller J. Clinical consequences of cytochrome P450 2C9 polymorphisms. Clin Pharmacol Ther 2005; 77 : 1-16.
20. Fiegenbaum M, da Silveira FR, Van derSand CR et al. The role of common variants of ABCB1, CYP3A4, and CYP3A5 genes in lipid-lowering efficacy and safety of simvastatin treatment. Clin Pharmacol Ther 2005; 78 : 551-558.
21. Chasman DI, Posada D, Subrahmanzan L et al. Pharmacogenetic study of statin therapy and cholesterol reduction. JAMA 2004; 291 : 2821-2827.
22. Heath KE, Gudnason V, Humphries SE et al. The type of mutation in the low density lipoprotein receptor gene influences the cholesterol-lowering response of the HMG-CoA reductase inhibitor simvastatin in patients with heterozygous familial hypercholesterolaemia. Atherosclerosis 1999; 143 : 41-54.
23. Miltiadous G, Xenophontos S, Bairaktari E et al. Genetic and environmental factors affecting the response to statin therapy in patients with molecularly defined familial hypercholesterolaemia. Pharmacogenet Genomics 2005; 15 : 219-225.
24. Ye P, Shang Y, Ding X. The influence of apolipoprotein B and E gene polymorphisms on the response to simvastatin therapy in patients with hyperlipidemia. Chin Med Sci J 2003; 18 : 9-13.
25. Hubacek JA, Pitha J, Skodova Z et al. Polymorphisms in CYP-7A1, nor APOE, influence the change in plasma lipids in response to population dietary change in an 8-year follow-up; results from the Czech MONICA study. Clin Biochem 2003; 36 : 263-267.
26. Hubacek JA, Bobkova D Role of cholesterol 7 alpha-hydroxylase (CYP7A1) in nutrigenetics and pharmacogenetics of cholesterol lowering. Mol Diagn Ther 2006; 10 : 93-100.
27. Kajinami K, Brousseau ME, Ordovas JM et al. Interaction between common genetic polymorphisms in ABCG5/G8 and CYP7A1 on LDL cholesterol lowering response to atorvastatin. Atherosclerosis 2004; 175 : 287-293.
28. Kajinami K, Brousseau ME, Ordovas JM et al. A promoter polymorphism in cholesterol 7alpha-hydroxylase interacts with apolipoprotein E genotype in the LDL-lowering response to atorvastatin. Atherosclerosis 2005; 180 : 407-415.
29. Hubacek JA, Poledne R. Apolipoprotein E a jeho role v lipidovém metabolismu, kardiovaskulárních onemocněních a Alzheimerově chorobě. Prakt Lék 1998; 78 : 162-165.
30. Ordovas JM, Mooser V. The APOE locus and the pharmacogenetics of lipid response. Curr Opin Lipidol 2002; 13 : 113-117.
31. Kajinami K, Takehoshi N, Brousseau ME et al. Pharmacognetics of HMG-CoA reductase inhibitors: exploring the potential for genotype-based individualization of coronary heart disease management. Atherosclerosis 2004; 177 : 219-234.
32. Garcia-Garcia AB, Gonzalez C, Real JT et al. Influence of microsomal triglyceride transfer protein promoter polymorphism -493 GT on fasting plasma triglyceride values and interaction with treatment response to atorvastatin in subjects with heterozygous familial hypercholesterolaemia. Pharmacogenet Genomics 2005; 15 : 211-218.
33. Lahoz C, Pena R, Mostaza JM et al. Apo A-I promoter polymorphism influences basal HDL-cholesterol and its response to pravastatin therapy. Atherosclerosis 2003; 168 : 289-295.
34. Hubacek JA, Waterworth DM, Pitha J et al. Polymorphisms in the lipoprotein lipase and hepatic lipase genes and plasma lipid values in the Czech population. Physiol Res 2001; 50 : 345-351.
35. Jansen H, Verhoeven AJ, Weeks L et al. Common C-to-T substitution at position -480 of the hepatic lipase promoter associated with a lowered lipase activity in coronary artery disease patients. Arterioscler Thromb Vasc Biol 1997; 17 : 2837-2842.
36. Murtomaki S, Tahvanainen E, Antikainen M et al. Hepatic lipase gene polymorphisms influence plasma HDL levels. Results from Finnish EARS participants. European Atherosclerosis Research Study. Arterioscler Thromb Vasc Biol 1997; 17 : 1879-1884.
37. Lahoz C, Pena R, Mostaza JM et al. The -514C/T polymorphism of the hepatic lipase gene significantly modulates the HDL-cholesterol response to statin treatment. Atherosclerosis 2005; 182 : 129-134.
38. Harada LM, Carrilho AJ, Oliveira HC et al. Regulation of hepatic cholesterol metabolism in CETP/LDLr mice by cholesterol feeding and by drugs (cholestyramine and lovastatin) that lower plasma cholesterol. Clin Exp Pharmacol Physiol 2006; 33 : 1209-1215.
39. Salek L, Lutucuta S, Ballantyne CM et al. Effects of SREBF-1a and SCAP polymorphisms on plasma levels of lipids, severity, progression and regression of coronary atherosclerosis and response to therapy with fluvastatin. J Mol Med 2002; 80 : 737-744.
40. Fiegenbaum M, Silveira FR, Van der Sand CR et al. Determinants of variable response to simvastatin treatment: the role of common variants of SCAP, SREBF-1a and SREBF-2 genes. Pharmacogenomics J 2005; 5 : 359-364.
41. Kashani A, Phillips CO, Foody JM et al. Risks associated with statin therapy. Circulation 2006; 114 : 2788-2797.
42. Weggemans RM, Zock PL, Urgent R et al. Differences between men and women in the response of serum cholesterol to dietary changes. Eur J Clin Invest 1999; 29 : 827-834.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2008 Issue 1-
All articles in this issue
- Sledování účinnosti antikoagulační léčby u nemocných s fibrilací síní v závislosti na věku
- Pozitivita sérových protilátok proti endomýziu, jejunu a histopatologická diagnostika celiakie u detí
- Hodnocení proliferačního a apoptotického indexu plazmatických buněk v průběhu mnohočetného myelomu
- Konvenční léčba fibrilace síní řízená ambulantními kardiology v ČR: přehled diagnostických a léčebných výkonů, medikamentózní léčby a hospitalizací
- Využití detekce galaktomananu pro diagnostiku invazivní aspergilózy u hematoonkologických nemocných
- Diferencovaný přístup k preskripci fyzické aktivity u nemocných s dysfunkcí levé komory srdeční
- Farmakogenetika léčby statiny
- Léčba Waldenströmovy makroglobulinemie a léčba nemocí způsobených monoklonálním IgM gamaglobulinem
- Doporučení České revmatologické společnosti pro léčbu revmatoidní artritidy. Účinnost a strategie léčby
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Využití detekce galaktomananu pro diagnostiku invazivní aspergilózy u hematoonkologických nemocných
- Hodnocení proliferačního a apoptotického indexu plazmatických buněk v průběhu mnohočetného myelomu
- Farmakogenetika léčby statiny
- Doporučení České revmatologické společnosti pro léčbu revmatoidní artritidy. Účinnost a strategie léčby
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

