-
Medical journals
- Career
Transplantace v léčbě diabetu
Authors: F. Saudek
Authors‘ workplace: Klinika diabetologie IKEM Praha, přednostka prof. MUDr. Terezie Pelikánová, DrSc.
Published in: Vnitř Lék 2007; 53(7-8): 859-864
Category:
Overview
Diabetes mellitus zůstává nejčastější příčinou chronického selhání ledvin, slepoty získané v dospělosti, netraumatických amputací a těžkých forem neuropatie. Je proto nezbytné hledat nové formy terapie, které by dokázaly dosáhnout dlouhodobé normalizace hladin krevního cukru. Jedinou standardní metodu zatím představuje orgánová transplantace pankreatu. Provádí se nejčastěji v kombinaci s transplantací ledviny a jen výjimečně jako samostatný výkon. Novou, podstatně méně invazivní možnost dnes již představuje transplantace izolovaných Langerhansových ostrůvků. Zatímco počet transplantací pankreatu v IKEM již přesáhl 300, program ostrůvkové transplantace se teprve rozvíjí a do května 2007 bylo provedeno 10 klinických výkonů. Počet vhodných pacientů, kteří by z tohoto způsobu léčby mohli profitovat, však mnohonásobně převyšuje dostupnost vhodných orgánů k transplantaci. Hledají se proto nové možnosti získání buněčných linií produkujících inzulin, a to buď z tkáně zvířecí, ale zejména z embryonálních či dospělých kmenových buněk. Nově se studuje také možnost in vivo regenerace endogenních či transplantovaných β buněk pankreatu. Kombinovaná transplantace ledviny a pankreatu představuje stále optimální možnost léčby uremických diabetiků 1. typu a její dlouhodobé výsledky jsou nyní velmi dobré, i když se dále zlepšují jen málo. Izolovaná transplantace pankreatu zůstává vyhrazena pro úzkou skupinu pacientů s velmi labilním diabetem. Transplantace izolovaných Langerhansových ostrůvků představuje alternativu, jež je pro pacienta podstatně bezpečnější, ale dlouhodobé výsledky jsou zatím horší. V Institutu klinické a experimentální medicíny (IKEM) je v současné době zavedena metoda orgánové transplantace pankreatu, byl zahájen program transplantace izolovaných ostrůvků a studuje se možnost propagace buněčných linií produkujících inzulin.
Klíčová slova:
diabetes mellitus - transplantace - pankreas - Langerhansovy ostrůvkyÚvod
Diabetes mellitus představuje jedno z nejčastějších a společensky nejzávažnějších onemocnění. Vzniká tehdy, jestliže endogenní produkce inzulinu β buňkami Langerhansových ostrůvků nestačí čelit metabolickým nárokům, a to buď jen relativně, jak je tomu ve většině případů diabetu 2. typu, nebo absolutně, což je typické zejména pro diabetes mellitus 1. typu. Chybějící inzulinovou sekreci je možné standardně léčit farmakologickou substitucí, a to nejčastěji formou podkožních injekcí. Moderní inzulinová léčba záhy odstraní většinu příznaků, ale z dlouhodobého hlediska naopak pravidelně selhává, neboť nedokáže předejít vzniku pozdních orgánových komplikací způsobených dlouhodobou hyperglykemií. Ty lze po 15letém trvání v určité formě zjistit téměř u všech pacientů s diabetem 1. typu (1,2), z nichž u mnohých se později stávají příčinou předčasného úmrtí. Navíc trvalé úsilí, spojené s udržováním přijatelných hodnot glykemie, narušuje kvalitu každodenního života a u řady nemocných není úspěšné. To je také důvodem, proč se dnes se substitučními způsoby inzulinové léčby nelze spokojit a je nutné hledat nové léčebné možnosti. V případě diabetu 1. typu mezi ně patří zejména:
- vývoj uzavřeného systému dávkování inzulinu, založeného na kontinuální neinvazivní monitoraci glykemií
- imunitní intervence v časném stádiu onemocnění, která by dokázala snaha zabránit destrukci β buněk, nebo ji alespoň zpomalit
- dosažení endogenní regenerace β buněk
- transplantace inzulin produkující tkáně.
V přehledu se budeme věnovat poslední možnosti, která již v některých indikacích nachází léčebné uplatnění a která také s metodami imunitní intervence a regenerace β buněk souvisí.
V principu existují 2 základní možnosti: transplantace pankreatu jako vaskularizovaného orgánu a transplantace izolovaných Langerhansových ostrůvků. I když klinického uplatnění dosáhla v současné době zejména transplantace orgánová, obě metody se ukázaly principiálně schůdné a dále se rozvíjejí. β buňky transplantátu produkují inzulin v závislosti na aktuální hladině glukózy v prostředí na principu uzavřeného zpětnovazebního systému. Nedochází k výrazným výkyvům glykemie, nehrozí hypoglykemie a pravidelně bývá dosaženo normálních hodnot glykovaného hemoglobinu (3). Jak ukázala např. studie DCCT (4), obdobnou metabolickou kompenzaci nezajistila ani intenzifikovaná inzulinová léčba, při níž v průběhu několikaletého sledování byla hodnota glykovaného hemoglobinu nižší než 6 % (stále více než norma) zaznamenána alespoň 1krát během sledování pouze u 44 % intenzivně léčených osob. Dlouhodobá normoglykemie pak představuje ideální předpoklad pro prevenci mikrovaskulárních komplikací diabetu a dává naději i na určitou regresi již rozvinutých změn (5). Protektivní význam je nově připisován také C-peptidu, který se v ekvimolárním množství uvolňuje spolu s inzulinem. Metabolická stabilizace spolu s přerušením inzulinové léčby, dietních omezení a monitorování glykemií po úspěšné transplantaci znamenají pochopitelně pro nemocného zásadní úlevu. Důležitý význam má pro mnoho osob eliminace těžkých hypoglykemických stavů, které v mnoha případech dlouho trvající diabetes provázejí.
Přehled současných možností ukazuje tab. 1.
Table 1. Přehled možností transplantační léčby diabetu. 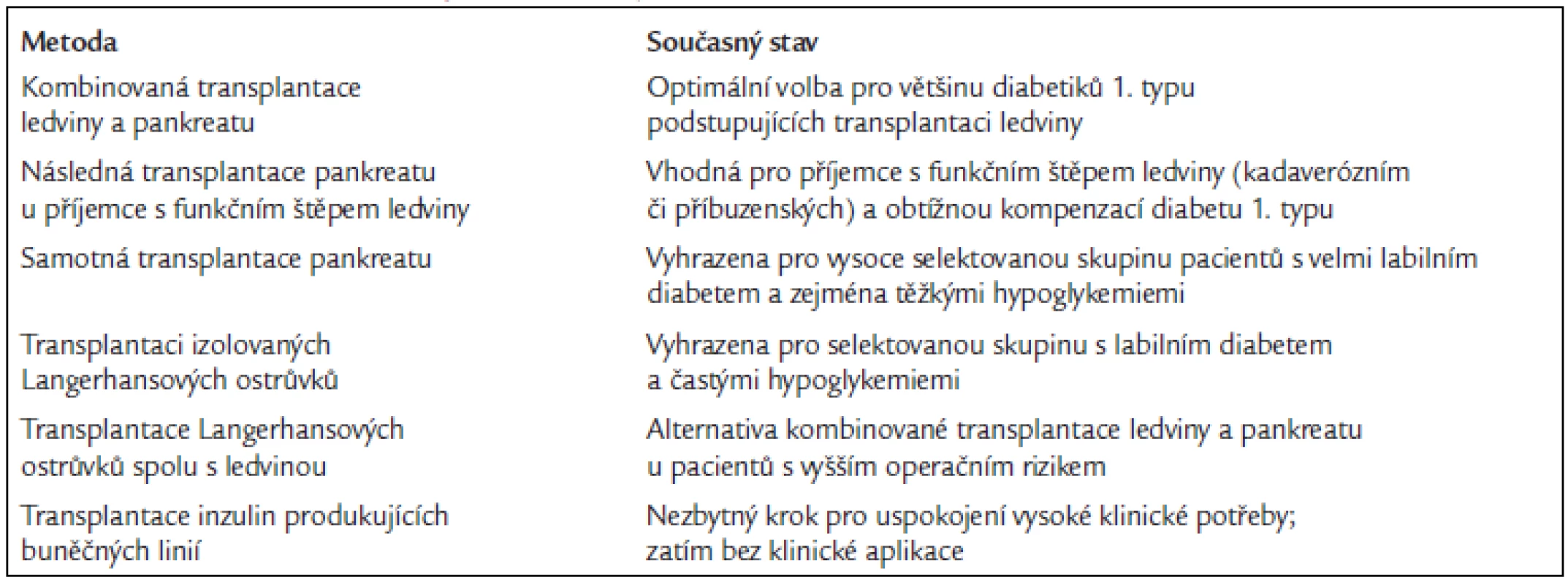
Kombinovaná transplantace ledviny a pankreatu
Diabetická nefropatie je nečastější příčinou chronické nedostatečnosti ledvin v západní společnosti i u nás a vyvine se asi u 1/3 nemocných s diabetem 1. typu. I když díky moderní léčbě zdaleka ne ve všech případech pokročí do konečného stadia, představují diabetici 1. typu významný podíl pacientů podstupujících náhradu funkce ledvin schopných transplantace. Kromě hemodialýzy či peritoneální dialýzy připadá pak v úvahu provedení transplantace samotné ledviny. Dlouhodobé výsledky jsou však dnes podstatně horší, než je-li provedena kombinovaná transplantace ledviny a pankreatu (s výjimkou příbuzenské transplantace ledviny, jež přináší výsledky obdobné a navíc je možné ji kombinovat s následnou transplantací kadaverózního pankreatu). Po izolované transplantaci ledviny mají diabetici srovnatelné přežívání funkce štěpu ledviny jako nemocní bez diabetu, ale celkovou mortalitu mají 3krát vyšší (6). Příčinou jsou především urychlený průběh aterosklerózy, náhlá smrt spojená s autonomní neuropatií a infekce.
Současná transplantace pankreatu spolu s ledvinou se začala pravidelně provádět v průběhu 80. let minulého století u pacientů s diabetem 1. typu již léčených nebo připravovaných k léčbě dialýzou. Kromě eliminace uremie byla tak navozována normoglykemie, přerušena léčba inzulinem, odstraněno riziko hypoglykemií a zlepšena kvalita života. Výsledky se v průběhu 80. let 20. století postupně zlepšovaly s rozvojem nových chirurgických metod, rozšiřováním spektra imunosupresivních léků a s rostoucími zkušenostmi v jednotlivých centrech.
Celosvětově přesáhl počet kombinovaných transplantací již číslo 20 000. V Institutu klinické a experimentální medicíny jich do dubna roku 2007 bylo provedeno 280. Jednoroční a pětileté přežívání pacientů, štěpů pankreatu a štěpů ledviny je obdobné jako v předních světových centrech a je uvedeno v tab. 2. Problematice transplantací pankreatu v IKEM byl nedávno věnován publikovaný přehled (7).
Table 2. Jedno- a pětileté necenzorované kumulativní přežívání pacientů a štěpů po kombinované transplantaci ledviny a pankreatu v IKEM provedených od roku 1994 (%). 
Počet vhodných příjemců, za něž považujeme většinu nemocných s diabetickou nefropatií s diabetem 1. typu s hladinou endogenního kreatininu nad 250 µmol/l či již léčených dialýzou, v ČR zatím neklesá. Ročně je provedeno v IKEM asi 20-25 kombinovaných transplantací, ale počet osob každoročně nově zařazených do čekací listiny toto číslo převyšuje. I když zůstává transplantační léčba zatížena častým výskytem zejména chirurgických komplikací, je dlouhodobé přežívání osob, které byly do čekací listiny sice zařazeny, ale transplantaci se nepodařilo uskutečnit, horší než u osob transplantací léčených. Ukazuje to graf 1, který porovnává křivky přežívání pacientů léčených v IKEM v různých érách vývoje transplantačního programu s přežíváním netransplantovaných čekatelů, zařazených do listiny od roku 1994.
Graph 1. Kumulativní přežívání pacientů po kombinovaných transplantacích ledviny pankreatu provedených v IKEM v různých obdobích vývoje transplantačních programu v porovnání s přežíváním čekatelů, u nichž se transplantaci nepodařilo uskutečnit. Přežívání čekatelů transplantace je hodnoceno v období let 1994–2006. 
Transplantace pankreatu u neuremických příjemců
Indikace izolované transplantace pankreatu zůstává stále nejednoznačná. Především je nutno posoudit, zda riziko dalšího průběhu diabetu a jeho komplikací skutečně převyšuje riziko chirurgického výkonu a dlouhodobé imunosupresivní léčby. Podle světového registru představuje tato kategorie asi 7 % všech transplantací pankreatu a většinou jsou pro ni vybíráni nemocní s objektivně prokázaným syndromem porušeného vnímání hypoglykemie, který se vyvíjí u části osob dlouhodobě léčených inzulinem a který výrazně narušuje kvalitu života a přináší riziko náhlého úmrtí (8). Úspěšná transplantace pankreatu nejenže hypoglykemické stavy odstraní, ale navíc vede ke zlepšení kontraregulačních reakcí při hypoglykemii uměle vyvolané (9). Odhaduje se, že porušeným vnímáním hypoglykemie trpí až 2-5 % diabetiků, takže potenciálních kandidátů transplantace, kteří by měli být k léčbě vybíráni dříve, než se vyvinou závažné orgánové komplikace, existuje pravděpodobně relativně hodně. Se zlepšujícími výsledky chirurgické léčby a s vývojem bezpečnějších imunosupresivních kombinací by tedy mohla být izolovaná transplantace prováděna častěji. Provedena by rovněž měla být rozsáhlejší multicentrická prospektivní studie, která by výsledky porovnala s přežíváním pacientů randomizovaných pro léčbu intenzifikovaným inzulinovým režimem. Širšímu rozšíření tohoto způsobu léčby však brání nedostatek vhodných pankreatů k transplantaci a také rozvoj programu transplantací ostrůvků. Ostrůvková transplantace je na jedné straně podstatně bezpečnější, ale na druhé straně její dlouhodobá úspěšnost je zatím proti orgánové transplantaci podstatně nižší. V IKEM bylo izolovanou transplantací pankreatu léčeno zatím 24 osob. Bez potřeby inzulinů zůstává zatím 60 % operovaných. Tento výsledek je zatím horší než při transplantaci kombinované.
Transplantace Langerhansových ostrůvků
Alternativním přístupem náhrady endokrinní funkce pankreatu je dnes již transplantace izolovaných Langerhansových ostrůvků. Proti orgánové transplantaci je jen minimálně invazivní a připouští možnosti navození specifické imunologické tolerance a neomezené dostupnosti tkáně k transplantaci s použitím metod xenotransplantace a genetického inženýrství. Mohla by tak v budoucnu být dostupná pro velké množství pacientů a díky své bezpečnosti by mohla být použita jako metoda preventivní již v časném stadiu diabetu.
V roce 2000 kanadská skupina z Edmontonu publikovala výsledky série transplantací ostrůvků u 7 příjemců, kteří všichni mohli ukončit dlouhodobou léčbu inzulinem alespoň na 1 rok. Ve srovnání s předchozími údaji 8% nezávislosti na inzulinu znamenalo mimořádný úspěch, který byl připisován zlepšené izolační technice, infuzi velkého množství čerstvě připravených ostrůvků, vynechání terapie kortikoidy, použití jen malých dávek takrolimu (který může tlumit sekreci inzulinu) a použití sirolimu jako základního imunosupresiva (10). Protože celosvětově se transplantací ostrůvků provádí zatím málo, vyhodnocuje od roku 2001 výsledky transplantací provedených v USA a Kanadě tzv. Collaborative Islet Transplant Registry (CITR), který zatím ukázal, že transplantace ostrůvků může být přínosná pro vybrané pacienty s labilním diabetem, kteří trpí výraznou poruchou rozpoznávání hypoglykemie a mají značně sníženou kvalitu života, i když úspěšnost je všeobecně nižší než v původní edmontonské sérii. V roce 2005 bylo v Edmontonu léčeno již více než 65 příjemců, kteří podstoupili 1-3 ostrůvkové transplantace. Nezávislosti na inzulinu se podařilo dosáhnout po 1 roce u 44 z nich (68 %). Bohužel většina příjemců potřebovala v následujících letech určitou dávku inzulinu a po 5 letech se bez něho obešlo jen 5 % léčených (11). Klinicky významná produkce C-peptidu však byla zachována u 80 % léčených, což se projevilo stabilizací diabetu s téměř normálními hodnotami glykovaného hemoglobinu, eliminaci hypoglykemických stavů a zlepšení kvality života.
S použitím tzv. „edmontonského protokolu“ a jeho modifikací bylo do současné doby léčeno již více než 650 osob na celém světě a i když v mnoha případech není možné ukončit léčbu inzulinem, výsledky lze považovat za velký úspěch, a to navzdory možným komplikacím.
Ty podle CITR stále nejsou vzácné, i když většinou nemají dlouhodobé následky a jejich závažnost není srovnatelná s komplikacemi orgánové transplantace. Zlepšení implantační techniky vedlo téměř k eliminaci významnějšího krvácení či trombózy portálních větví, ale dlouhodobá imunosuprese stále představuje riziko. Nejzávažnější mohou být progrese nedostatečnosti ledvin, vyvolané podáváním kalcineurinových inhibitorů, a infekce způsobené trvalou imunosupresí. V sérii 36 pacientů léčených v rámci ověřování edmontonského protokolu v 9 předních světových centrech byl zaznamenán průměrný pokles glomerulární filtrace o 5 ml/min ročně, což vede zejména k úvahám o změně imunosupresivního schématu s vyloučením neurotoxických látek (12). Neoplastická onemocnění po transplantaci ostrůvků nebyla zatím zaznamenána, ale je nutné s touto možností počítat. Proto je nyní v centrech, která jsou schopna kvalitně izolovat ostrůvky, transplantace ostrůvků indikována jen u vysoce selektovaných pacientů, u nichž riziko dalšího průběhu diabetu převažuje nad riziky transplantace, nebo kteří již imunosupresivní léčbu z důvodu jiné současné transplantace stejně užívají. Protože izolace ostrůvků je techniky náročná a vyžaduje náročné vybavení a zkušenost, existují nyní v USA i v Evropě sítě pracovišť, která zajišťují zpracování pankreatu a samotné ostrůvky pak zasílají zpět do jednotlivých center.
V celosvětovém měřítku sleduje výsledky transplantací ostrůvků registr při univerzitě v Giessenu. Hodnoceny jsou jen plně dokumentované případy s dobou sledování delší než 1 rok. Kumulativní křivky přežívání ostrůvků v různých obdobích (úplná nezávislost na zevním inzulinu) ukazuje graf 2 (podle výroční konference AIDPIT, Montpellier, leden 2007).
Graph 2. Kumulativní přežívání transplantovaných ostrůvků (plná funkce) provedených různých obdobích. Data poskytl M. Brendel, Světový registr transplantací ostrůvků, Giessen. 
Data poskytl M. Brendel, Světový registr transplantací ostrůvků, Giessen. V pražském IKEM je nyní na čekací listině 10 osob a transplantace ostrůvků již byla provedena 10krát u 7 osob. U 4 z 6 léčených pacientů s diabetem 1. typu se podařilo významně snížit dávky inzulinu na 30-20 % původní dávky a dosáhnout téměř normálních hodnot glykovaného hemoglobinu, další pacientka v současné době inzulin nepotřebuje. V jednom případě byla provedena kombinovaná transplantace jater a ostrůvků od téhož dárce. Ostrůvky byly izolovány v průběhu operace příjemce a před uzavřením dutiny břišní byly jednoduchým způsobem infundovány přímo do vena portae. V ostatních případech byl pod radiologickou kontrolou bez celkové anestezie zaveden katétr do portálního řečiště. Provedena byla také autotransplantace ostrůvků, izolovaných z těla a kaudy pankreatu pacienta, který podstoupil totální pankreatektomii pro benigní nádor dvanáctníku. V tomto případě není potřebná imunosupresivní léčba. Dosavadní výsledky jsou shrnuty v tab. 3.
Table 3. Přehled transplantací ostrůvků provedených v IKEM. 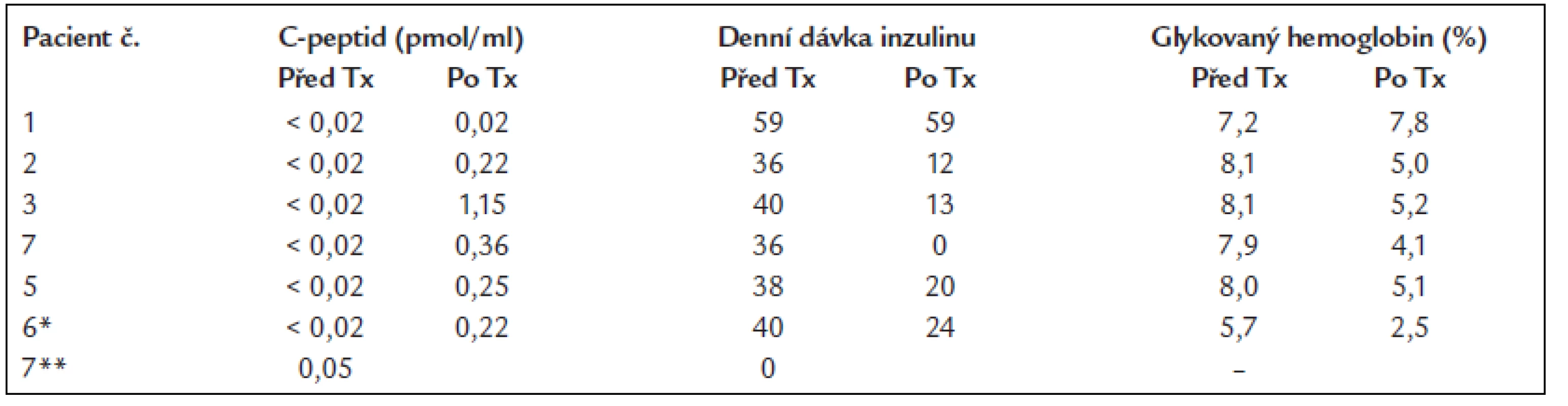
* Současná transplantace jater a ostrůvků ** Autotransplantace ostrůvků izolovaných z vlastního pankreatu Pozitivní zkušenosti s transplantacemi ostrůvků však přinesly také nové otázky. Izolační proces je totiž stále málo efektivní a získat se podaří většinou méně než 1/3 ostrůvků přítomných v pankreatu. Ostrůvky navíc mohou být funkčně poškozené, jsou vystaveny nefyziologickému prostředí v jaterní tkáni, kam se implantují, mají omezené nebo žádné regenerační schopnosti a působí na ně toxicky většina používaných imunosupresivních léků. Potvrdí-li tedy úspěšnost ostrůvkové transplantace v širším měřítku, zůstane tento způsob léčby nadále nedostupný pro většinu osob, které by z ní mohly mít prospěch. Zpravidla je k navození normoglykemie nutno zpracovat 2-3 slinivky a zatím jsou k transplantaci užívány ostrůvky z každého 3.-4. orgánu, který je zpracován.
Náhradní zdroje ostrůvkové tkáně
Dostatek ostrůvků nebo čistých beta buněk by mohl být získán z pankreatu zvířat, nejspíše prasat. I když genetické inženýrství dovolilo modifikovat některé hemokoagulační a imunogenetické vlastnosti vyvolávající hyperakutní rejekci a izolované ostrůvky je možné ukládat do semipermeabilních kapslí, zůstává transplantační bariéra mezi člověkem a prasetem zatím nepřekonaná (13).
Nadějnější se proto zatím zdá příprava tkáně z definovaných buněčných linií, které by bylo možné produkovat in vitro. Jako možný zdroj se testují embryonální kmenové buňky, dospělé kmenové buňky pankreatu, hematopoetické kmenové buňky a buňky jiných tkání, schopné transdiferenciace (14). V řadě laboratoří včetně naší (15) se podařilo v samotných ostrůvcích a tkáni pankreatických vývodů identifikovat buňky, které po příslušené modifikaci a stimulaci v tkáňové kultuře jsou schopné v určité míře produkovat inzulin v závislosti na okolní koncentraci glukózy. Tato schopnost je však ve srovnání s nativními β buňkami malá, po transplantaci se často ztrácí a navíc existuje riziko jejich maligní přeměny. Působením růstových faktorů je také možné dosáhnout určité míry transdiferenciace jaterních buněčných linií, které jsou schopné produkovat inzulin. Pro experimenty in vitro a u hlodavců byly získány i komplexně modifikované linie s umělým genetickým konstruktem produkce inzulinu, jež jsou potenciálně imortalizované a je možné jich získat větší množství. Žádný z těchto uvedených postupů však nebyl zatím testován u člověka a nelze v nejbližších několika letech očekávat jejich klinické uplatnění. Nedostatkem ve srovnání s β buňkou zůstává relativně malá produkce inzulinu, její nedostatečná kontrola a postupné vyhasínání. Získané buňky mohou také in vivo ztrácet svoji genotypickou stabilitu a měnit se v buňky maligní. Pokud by se jednalo o tkáň allogenní, budou nadále potřebné další modifikace, které by zabránily odhojení nebo transplantaci doprovázet imunosupresivní léčbou (16).
Zda se některá z uvedených metod přípravy inzulin produkující tkáně in vitro bude užitečná v klinické praxi nelze ještě říci. V krátkodobé perspektivě buněčné terapie diabetu lze očekávat vývoj šetrnějších metod izolace lidských Langerhansových ostrůvků, lepší uchování jejich vitality a dosažení jejich regenerace po transplantaci.
doc. MUDr. František Saudek, DrSc.
www.ikem.cz
e-mail: frsa@medicon.cz
Doručeno do redakce: 15. 5. 2007
Sources
1. Nathan DM. Long-term complications of diabetes mellitus. N Engl J Med 1993; 10 : 1676-1685.
2. Marshall SM, Flyvbjerg A. Prevention and early detection of vascular complications of diabetes. BMJ 2006; 333 : 475-480.
3. Saudek F, Adamec M, Ekberg H et al. First experience with combined pancreatic-renal transplantation with extraperitoneal placement of the whole pancreatic graft. Transplant Proc 1995; 27 : 3080-3081.
4. The Diabetes Control and Complications Trial Research Group. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med 1993; 329 : 977-986.
5. Landgraf R. Impact of pancreas transplantation on diabetic secondary complications and quality of life. Diabetologia 1996; 39 : 1415-1424.
6. Hirata M, Cho YW, Cecka JM et al. Patient death after renal transplantation - an analysis of its role in graft outcome. Transplantation 1996; 61 : 1479-1483.
7. Saudek F, Adamec M, Bouček P et al. Tři sta transplantací pankreatu v Institutu klinické a experimentální medicíny v Praze. Prakt Lék 2007; 87 : 76-81.
8. Mindlová M, Saudek F. Autonomní selhání způsobené recidivujícími hypoglykémiemi, jeho klinické hodnocení a terapie. Prakt Lék 2007; 87 : 52-57.
9. Sutherland DER, Najarian JS et al. Solitary pancreas transplantation for nonuremic patients with labile insulin-dependent diabetes mellitus. Transplantation 1997; 64 : 1572-1577.
10. Shapiro AM, Lakey JR, Ryan EA et al. Islet transplantation in seven patients with type 1 diabetes mellitus using a glucocorticoid-free immunosuppressive regimen. N Engl J Med 2000; 343 : 230-238.
11. Ryan EA, Paty BW, Senior PA et al. Five-year follow-up after clinical islet transplantation. Diabetes 2005; 54 : 2060-2069.
12. Shapiro AM, Ricordi C, Hering BJ et al. International trial of the Edmonton protocol for islet transplantation. N Engl J Med. 2006; 355 : 1318-1330.
13. Ibrahim Z, Busch J, Awwad M et al. Selected physiologic compatibilities and incompatibilities between human and porcine organ systems. Xenotransplantation 2006; 13 : 488-499.
14. Koblas T, Harman SM, Saudek F. The application of umbilical cord blood cells in the treatment of diabetes mellitus. Rev Diabet Stud 2005; 2 : 228-234.
15. Koblas T , Zacharovová K, Berková Z et al. Isolation and characterisation of human Cxcr4 positive pancreatic cells. Folia Biologica 2007; 53 : 13-22.
16. Ouziel-Yahalom L, Zalzman M, Anker-Kitai L et al. Expansion and redifferentiation of adult human pancreatic islet cells. Biochem Biophys Res Commun 2006; 341 : 291-298.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2007 Issue 7-8-
All articles in this issue
- Kam kráčíš, hypofýzo? Hrst novinek a perspektiv
- Subklinické tyreopatie
- Aspirační cytologie štítné žlázy
- Autoimunitní polyglandulární syndromy: klinické aspekty
- Endokrinologicko-nukleárně medicínské aspekty v léčbě nádorů štítné žlázy
- Hypopituitarizmus: substituční terapie
- Náhodně zjištěné expanze v selární oblasti
- Incidentalomy nadledvin
- Diferenciální diagnostika hyperkalcemií
- Glukokortikoidy a osteoporóza
- Minerálově-kostní porucha při chronickém onemocnění ledvin
- Perorální léčba diabetes mellitus 2. typu
- Transplantace v léčbě diabetu
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Hypopituitarizmus: substituční terapie
- Autoimunitní polyglandulární syndromy: klinické aspekty
- Aspirační cytologie štítné žlázy
- Náhodně zjištěné expanze v selární oblasti
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

