-
Medical journals
- Career
Léčba hyperglykemie u kriticky nemocných pacientů: srovnání standardního protokolu a počítačového algoritmu
Authors: J. Křemen 1; J. Bláha 2; P. Kopecký 2; L. Bošanská 1; E. Kotrlíková 1; T. Roubíček 1; Kateřina Anderlová 1; Š. Svačina 1; M. Matias 2; J. Rulíšek 2; R. Hovorka 3; M. Haluzík 1
Authors‘ workplace: III. interní klinika 1. lékařské fakulty UK a VFN Praha, přednosta prof. MUDr. Štěpán Svačina, DrSc., MBA 1; Klinika anesteziologie, resuscitace a intenzivní medicíny 1. lékařské fakulty UK a VFN Praha, přednosta MUDr. Martin Stříteský, CSc. 2; Department of Paediatrics, School of Clinical Medicine, University of Cambridge, Velká Británie, přednosta prof. Ieuan Hughes, MD, Ph. D. 3
Published in: Vnitř Lék 2007; 53(12): 1269-1273
Category: Original Contributions
Overview
Úvod:
U kriticky nemocných pacientů hospitalizovaných na jednotkách intenzivní péče se velmi často vyskytuje hyperglykemie. Bylo prokázáno, že udržení euglykemie pomocí intenzivní inzulinové terapie výrazně zlepšuje prognózu těchto pacientů. Cílem naší studie bylo porovnat standardní protokol intenzifikované inzulinové terapie používaný na pooperační JIP kardiochirurgické kliniky VFN a počítačový algoritmus pro kontrolu glykemie MPC (Model Predictive Control).Soubor nemocných a metodika:
Do studie bylo zařazeno 20 pacientů s glykemií při příjmu na JIP vyšší než 6,7 mmol/l. 10 pacientů bylo randomizováno pro léčbu podle standardního protokolu, 10 pro léčbu pomocí MPC algoritmu. Glykemie byly měřeny v hodinovém intervalu po dobu 48 hod, u MPC algoritmu byla rychlost inzulinové infuze upravována po 1 hod, u standardního protokolu po 1-2 hod.Výsledky:
MPC algoritmus udržel glykemii v cílových mezích (4,4-6,1 mmol/l) déle než standardní protokol (26,3 ± 2,1 vs 20,3 ± 2,5 hod), rovněž průměrná glykemie byla při použití počítačového algoritmu nižší (6,47 ± 0,11 vs 6,72 ± 0,23 mmol/l). Použití standardního algoritmu umožnilo rychlejší dosažení cílových hodnot glykemie (8,9 ± 1,2 vs 10,3 ± 0,9 hod). Doba v hyperglykemii se u obou skupin výrazněji nelišila (7,3 ± 1,9 vs 7,3 ± 1,3). Průměrná spotřeba inzulinu byla vyšší při použití MPC algoritmu (230,2 ± 38,8 vs 199,1 ± 27,8 IU/48 hod). U 2 pacientů léčených podle standardního protokolu se vyskytla 1 hypoglykemická epizoda.Závěr:
Naše výsledky ukazují, že použití počítačového algoritmu vede k lepší kontrole glykemie u kriticky nemocných pacientů než standardní protokol.Klíčová slova:
těsná kontrola glykemie - kriticky nemocní - počítačový algoritmusÚvod
Hyperglykemie je velmi častým jevem u kriticky nemocných pacientů hospitalizovaných na jednotkách intenzivní péče [5,10,18]. Bývá též často nazývána „diabetes z poškození“ a vyskytuje se jak u diabetiků, tak u pacientů bez předchozí anamnézy diabetu, neboť bývá způsobena poněkud odlišnými mechanizmy než diabetes mellitus 1. či 2. typu [22]. Hlavní příčinou hyperglykemie u kriticky nemocných pacientů bývá vzestup hladin stresových hormonů (katecholaminy, kortizol, glukagon, růstový hormon) a prozánětlivých cytokinů, které zvyšují hladinu glykemie a některé z nich také na postreceptorové úrovni významně ovlivňují inzulinovou signalizační kaskádu [7,16]. Hyperglykemie kriticky nemocných má řadu nežádoucích účinků, jakými jsou například predispozice k infekčním komplikacím [4], negativní vliv na funkci kardiovaskulárního systému [13,14], podíl na vzniku endoteliální dysfunkce [3,21,26], renálního selhání [2], zvýšený oxidační stres [1,15,17], protrombogenní efekt [12] a další [23].
Mnohé klinické studie prokázaly, že léčba hyperglykemie pomocí intenzivní inzulinové terapie zlepšuje prognózu a snižuje výskyt komplikací u kriticky nemocných pacientů [19]. Zásadní v tomto ohledu je tzv. Leuvenská studie [25] provedená na téměř 1 600 pacientech po kardiochirurgickém výkonu, ve které byla srovnávána léčba pomocí intenzivní inzulinové terapie (cílové rozmezí glykemie bylo 4,4-6,1 mmol/l) s dosud používanou konvenční léčbou, kdy byla tolerována mírná hyperglykemie a terapie inzulinem byla zahajována po překročení koncentrace glukózy v krvi 11,1 mmol/l. Těsná kontrola glykemie vedla k významnému snížení nemocniční mortality (až o 42 %), dále k poklesu další morbidity a orgánového postižení, stejně jako ke zkrácení pobytu na jednotce intenzivní péče. Významné snížení morbidity a zlepšení prognózy pacientů potvrdila i novější studie prováděná v belgickém Leuvenu na interně orientované jednotce intenzivní péče, během níž byl pozorován nižší výskyt nově vzniklého renálního selhání a urychlení odvykání od umělé plicní ventilace. V této studii však nedošlo k významnému poklesu mortality [24].
Na základě výsledků těchto studií začalo mnoho jednotek intenzivní péče využívat různé protokoly pro těsnou kontrolu glykémie [6,20]. Udržení glykemie v cílovém rozmezí je však velmi náročné, vyžaduje velice časté krevní odběry, čímž se značně zvyšuje jak zátěž pacienta, tak i ošetřujícího personálu. Jisté nebezpečí přináší i zvýšené riziko hypoglykemie a chybování ve výpočtu rychlosti inzulinové infuze. Proto je v současné době snaha o vývoj systémů, které by byly schopny samostatně a bezpečně zajistit těsnou kontrolu glykemie. Cílem projektu CLINICIP (Closed Loop INsulin Infusion in Critically III Patients) je vývoj systému, který bude schopen samostatně kontinuálně měřit glykemii [11], vyhodnocovat ji a adekvátně dávkovat inzulin tak, aby bylo dosaženo cílového rozmezí glykemie. Součástí tohoto systému je i MPC (Model Predictive Control) algoritmus pro vyhodnocování změn glykemie a dávkování inzulinu. Hlavní komponentou MPC algoritmu [8,9] je model napodobující glukoregulační systém umožňující postupnou optimalizaci dávky inzulinu. Tento algoritmus rovněž umožňuje kalkulovat i s příjmem enterální i parenterální výživy. Vstupními parametry pro MPC algoritmus jsou hodnota glykemie a množství podávané výživy a inzulinu v zadaném čase, dále pak hmotnost pacienta a jednoduchá diabetická anamnéza. Na základě těchto údajů generuje algoritmus požadovanou rychlost inzulinové infuze. Všechny tyto parametry jsou poté zobrazeny v přehledném grafu a ukládány na paměťové médium.
Cílem naší randomizované pilotní studie bylo porovnání tohoto algoritmu s protokolem pro těsnou kontrolou glykemie používaným na pooperační jednotce intenzivní péče (JIP) II. kliniky kardiovaskulární chirurgie 1. LF UK a VFN (tab. 1). Tento standardní protokol je svoji koncepcí velmi podobný protokolu použitému ve výše popsané Leuvenské studii.
Table 1. Standardní protokol pro těsnou kontrolu glykemie. 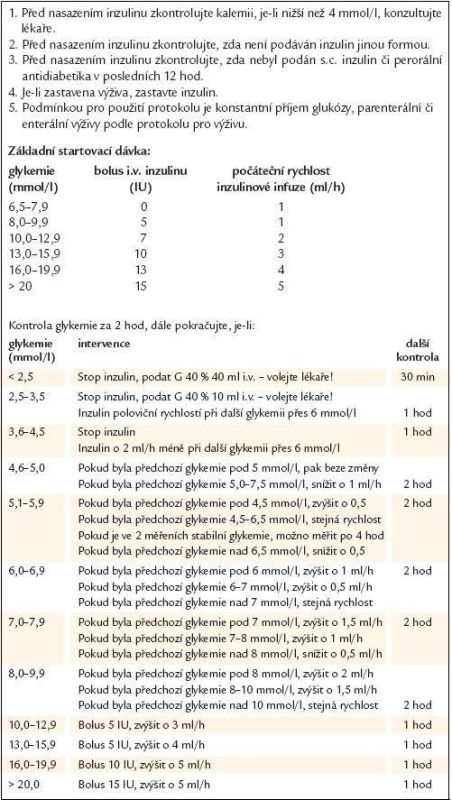
Při poklesu glykemie o více než 1/3 mezi 2 měřeními, snížit rychlost o 1/3! Při poklesu glykemie o více než 1/2 mezi 2 měřeními, snížit rychlost na 1/2 a kontaktovat lékaře! Soubor nemocných a metodika
Do studie bylo zařazeno 20 pacientů, kteří podstoupili plánovaný kardiochirurgický výkon (aortokoronární bypass či chlopenní náhradu) a u nichž vstupní glykemie při přijetí na JIP byla vyšší než 6,7 mmol/l, v naší studii splnili toto kritérium všichni pacienti. 10 pacientů bylo randomizováno k léčbě pomocí počítačového algoritmu, 10 k léčbě podle standardního protokolu. Mezi pacienty bylo 14 mužů a 6 žen, 6 pacientů bylo diabetiků (2 ve skupině léčených pomocí standardního protokolu, 4 ve skupině léčených pomocí počítačového algoritmu). Podrobnější charakteristika pacientů je uvedena v tab. 2. Všichni účastníci před vstupem do studie podepsali informovaný souhlas, byla od nich odebrána demografická data, anamnéza a provedeno fyzikální a laboratorní předoperační vyšetření. Vylučovacími kritérii byla alergie na inzulin, mentální omezení respektive neschopnost porozumět a podepsat informovaný souhlas. Studie byla schválena etickou komisí 1. LF UK.
Table 2. Charakteristika pacientů (*p > 0,05). 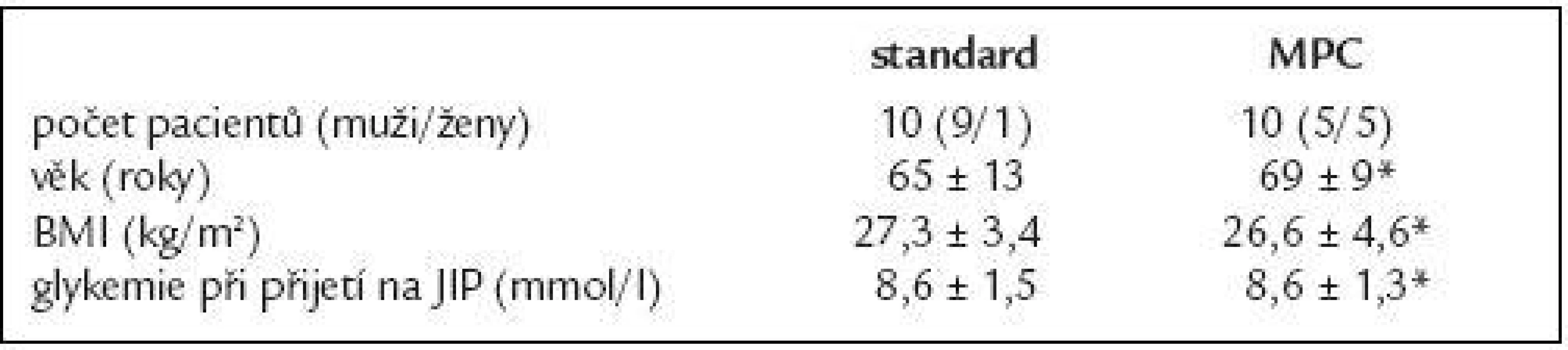
Průměrný věk pacientů byl 67 ± 11 let, průměrné BMI bylo 27,0 ± 4,0 kg/m2, průměrná glykemie při přijetí na JIP byla 9 ± 2,4 mmol/l. Délka studie byla 48 hod, cílová glykemie byla 4,4-6,1 mmol/l v souladu s Leuvenskou studií.
Bezprostředně po přijetí pacienta z operačního sálu na jednotku intenzivní péče mu byla změřena arteriální glykemie a zahájena intenzivní inzulinová terapie dle protokolu, resp. počítačového algoritmu. Arteriální glykemie byla měřena v hodinových intervalech na přístroji ABL 700 analyzér (Radiometer Medical A/S, Copenhagen, Dánsko), dále bylo na stejném přístroji provedeno vyšetření základního mineralogramu, krevních plynů a červeného krevního obrazu. Zaznamenávány byly dále vitální funkce, bilance tekutin, tělesná teplota, saturace hemoglobinu, medikace, výživa, ev. další podstatné klinické údaje. MPC algoritmus byl provozován na komerčně dostupném přenosném PC. Rychlost inzulinové infuze byla měněna v hodinových intervalech u počítačového algoritmu , resp. v 1-2hodinových intervalech dle požadavku standardního protokolu. Inzulin Actrapid HM (NovoNordisk, Beahsvard, Dánsko) v ředění 50 IU v 50 ml fyziologického roztoku byl podáván intravenózní cestou centrálním žilním katétrem.
Statistická analýza byla provedena pomocí programu SigmaStat software (Jandel Scientific, USA), výsledky jsou vyjádřeny jako průměrné hodnoty ± směrodatná odchylka (SD). Skupiny byly porovnávány pomocí t-testu nebo pomocí Mann-Whitney Rank Sum testu.
Byla hodnocena doba, po kterou byli pacienti v cílovém rozmezí, průměrná glykemie, doba potřebná k dosažení cílového rozmezí, doba v závažnější hyperglykemii (glykemie > 8,3 mmol/l), celková spotřeba inzulinu a počet závažných hypoglykemických epizod (glykemie < 2,9 mmol/l).
Výsledky
Srovnání sledovaných parametrů je shrnuto v tab. 3 a znázorněno v grafech 1 a 2. MPC algoritmus byl schopen udržet glykemii v cílovém rozmezí po delší dobu než standardní protokol, rovněž průměrná glykemie byla při použití tohoto algoritmu nižší. Standardní protokol se ukázal jako efektivnější v rychlejším dosažení cílových hodnot glykemie. Doba, po kterou byli pacienti v hyperglykemii nad 8,3 mmol/l, se u obou algoritmů výrazněji nelišila. Byly zaznamenány 2 hypoglykemické epizody u pacientů léčených pomocí standardního protokolu na rozdíl od MPC algoritmu, u nichž nebyla zaznamenána žádná epizoda hypoglykemie. Spotřeba inzulinu byla vyšší při použití MPC algoritmu.
Graph 1. Srovnání průměrné glykemie v čase při použití standardního protokolu a počítačového algoritmu. Vyjádřeno jako průměry ± směrodatná odchylka (SD). 
Graph 2. Srovnání průměrné rychlosti inzulinové infuze v čase při použití standardního protokolu a počítačového algoritmu. Vyjádřeno jako průměry ± směrodatná odchylka (SD). 
Table 3. Srovnání sledovaných parametrů těsné kontroly glykemie při použití standardního protokolu a počítačového algoritmu (*p = 0,02, +p > 0,05) 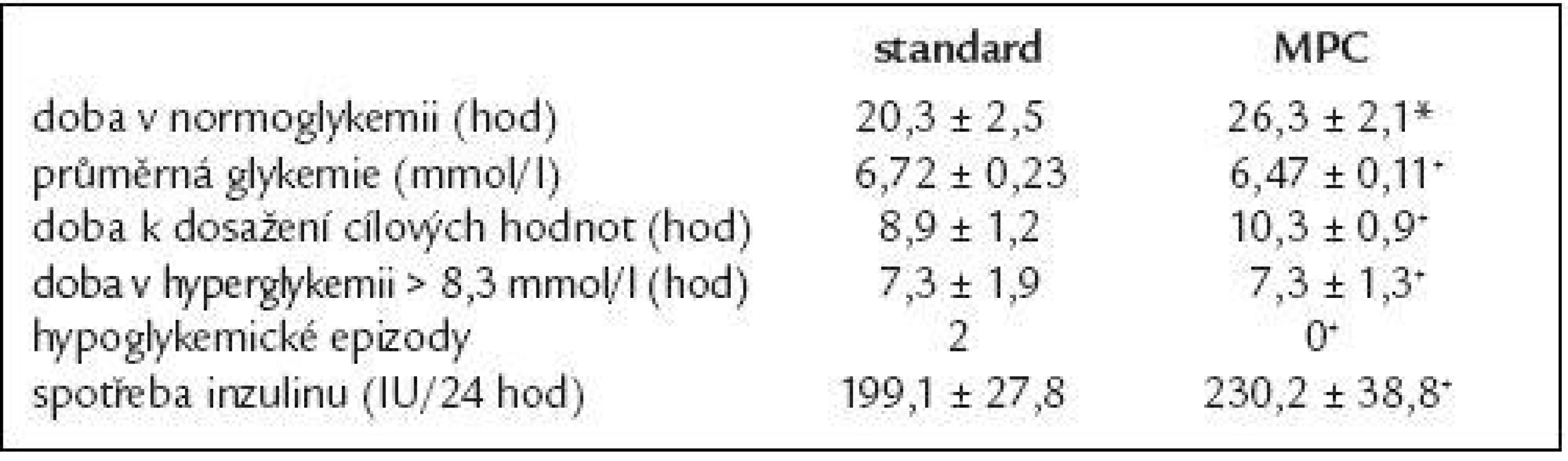
Diskuse
Počítačový algoritmus použitý v naší studii umožnil efektivnější kontrolu glykemie než běžně používaný standardní protokol. Tento velmi příznivý výsledek může být částečně způsoben kratším intervalem mezi jednotlivými odběry glykemie při použití MPC algoritmu (standardní protokol užívá v případě stabilní glykemie 2hodinový interval). Je ovšem nutné vzít v úvahu, že MPC algoritmus je primárně určený pro automatizovaný systém, který umožňuje častější, prakticky kontinuální monitorování glykemie. Přesto nelze opomenout hlavní výhody počítačového algoritmu, jakými jsou flexibilní přizpůsobení výpočtu rychlosti inzulinu danému pacientovi (sledováním vývoje jeho inzulinové rezistence, přesnější kalkulací s energetickým příjmem) a významně vyšší bezpečnost. Použití MPC algoritmu umožňuje přesněji dokumentovat průběh vlastní inzulinové terapie, jednoduchým ovládáním významně zvyšuje komfort uživatele a snižuje riziko chyby ošetřujícího personálu, neboť odpadá poměrně složitý „manuální“ výpočet. Přesto byla vyvinuta verze počítačového algoritmu s variabilním intervalem měření glykemie (eMPC), která je testována v současné době a jejíž pilotní výsledky dávají naději, že efektivita algoritmu zůstane zachována, či se dokonce zlepší i při delším časovém úseku mezi jednotlivými odběry. Využití algoritmu lze vidět rovněž v jeho možné implementaci do „polouzavřeného“ systému, který by umožňoval přímou integraci funkce algoritmu a infuzní pumpy v jednom přístroji a podstatně tak zjednodušil práci ošetřujícího personálu.
Závěr
Naše studie prokázala, že použití MPC počítačového algoritmu umožňuje efektivní a bezpečnou kontrolu glykemie u kriticky nemocných pacientů. Jeho hlavní výhody spočívají v jednoduché použitelnosti, bezpečnosti a zvýšení komfortu pro ošetřující personál. Cílem jeho využití je však implementace v automatizovaném uzavřeném systému.
Studie byla podporována 6. rámcovým projektem EU CLINICIP a MZO 000064165.
MUDr. Jaromír Křemen
www.vfn.cz
e-mail: jkrem@lf1.cuni.cz
Doručeno do redakce: 23. 4. 2007
Přijato po recenzi: 31. 8. 2007
Sources
1. Aulak KS, Koeck T, Crabb JW et al. Dynamics of protein nitration in cells and mitochondria. Am J Physiol Heart Circ Physiol 2004; 286: H30-H38.
2. Basi S, Pupim LB, Simmons EM et al. Insulin resistance in critically ill patients with acute renal failure. Am J Physiol Renal Physiol 2005; 289: F259-F264.
3. Beckman JA, Goldfine AB, Gordon MB et al. Ascorbate restores endothelium-dependent vasodilation impaired by acute hyperglycemia in humans. Circulation 2001; 103 : 1618-1623.
4. Butler SO, Btaiche IF, Alaniz C. Relationship between hyperglycemia and infection in critically ill patients. Pharmacotherapy 2005; 25 : 963-976.
5. Furnary AP, Wu Y, Bookin SO. Effect of hyperglycemia and continuous intravenous insulin infusions on outcomes of cardiac surgical procedures: the Portland Diabetic Project. Endocr Pract 2004; 10(Suppl 2): 21-33.
6. Goldberg PA, Siegel MD, Sherwin RS et al. Implementation of a safe and effective insulin infusion protocol in a medical intensive care unit. Diabetes Care 2004; 27 : 461-467.
7. Grimble RF. Inflammatory status and insulin resistance. Curr Opin Clin Nutr Metab Care 2002; 5 : 551-559.
8. Hovorka R, Canonico V, Chassin LJ et al. Nonlinear model predictive control of glucose concentration in subjects with type 1 diabetes. Physiol Meas 2004; 25 : 905-920.
9. Hovorka R, Chassin LJ, Wilinska ME et al. Closing the loop: the adicol experience. Diabetes Technol Ther 2004; 6 : 307-318.
10. Johan Groeneveld AB, Beishuizen A, Visser FC. Insulin: a wonder drug in the critically ill? Crit Care 2002; 6 : 102-105.
11. Křemen J, Bláha J, Matias M et al. Monitorování glykemie u kriticky nemocných pacientů: srovnání arteriálních a intersticiálních hladin glukózy měřených pomocí mikrodialýzy tukové tkáně. Vnitř Lék 2006; 52 : 777-781.
12. Levi M, ten Cate H. Disseminated intravascular coagulation. N Engl J Med 1999; 341 : 586-592.
13. Marfella R, Nappo F, De Angelis L et al. Hemodynamic effects of acute hyperglycemia in type 2 diabetic patients. Diabetes Care 2000; 23 : 658-663.
14. Marfella R, Nappo F, De Angelis L et al. The effect of acute hyperglycaemia on QTc duration in healthy man. Diabetologia 2000; 43 : 571-575.
15. Marik PE, Raghavan M. Stress-hyperglycemia, insulin and immunomodulation in sepsis. Intensive Care Med 2004; 30 : 748-756.
16. McCowen KC, Malhotra A, Bistrian BR. Stress-induced hyperglycemia. Crit Care Clin 2001; 17 : 107-124.
17. Mechanick JI. Metabolic mechanisms of stress hyperglycemia. JPEN J Parenter Enteral Nutr 2006; 30 : 157-163.
18. Mizock BA. Alterations in carbohydrate metabolism during stress: a review of the literature. Am J Med 1995; 98 : 75-84.
19. Pittas AG, Siegel RD, Lau J. Insulin therapy for critically ill hospitalized patients: a meta-analysis of randomized controlled trials. Arch Intern Med 2004; 164 : 2005-2011.
20. Scott JF, Robinson GM, French JM et al. Glucose potassium insulin infusions in the treatment of acute stroke patients with mild to moderate hyperglycemia: the Glucose Insulin in Stroke Trial (GIST). Stroke 1999; 30 : 793-799.
21. Title LM, Cummings PM, Giddens K et al. Oral glucose loading acutely attenuates endothelium-dependent vasodilation in healthy adults without diabetes: an effect prevented by vitamins C and E. J Am Coll Cardiol 2000; 36 : 2185-2191.
22. Van den Berghe G. How does blood glucose control with insulin save lives in intensive care? J Clin Invest 2004; 114 : 1187-1195.
23. Van den Berghe G. Neuroendocrine pathobiology of chronic critical illness. Crit Care Clin 2002; 18 : 509-528.
24. Van den Berghe G, Wilmer A, Hermans G et al. Intensive insulin therapy in the medical ICU. N Engl J Med 2006; 354 : 449-461.
25. Van den Berghe G, Wouters P, Weekers F et al. Intensive insulin therapy in the critically ill patients. N Engl J Med 2001; 345 : 1359-1367.
26. Williams SB, Goldfine AB, Timimi FK et al. Acute hyperglycemia attenuates endothelium-dependent vasodilation in humans in vivo. Circulation 1998; 97 : 1695-1701.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2007 Issue 12-
All articles in this issue
- Recidivující arytmie po katetrové ablaci původně paroxyzmální fibrilace síní a výsledky opakované ablace
- Bakteriální infekce ve vztahu ke vzniku a průběhu varikózního krvácení
- Stresová odezva prolaktinu u nemocných se systémovým lupus erythematodes (SLE), revmatoidní artritidou (RA) a u zdravých kontrol
- Léčba hyperglykemie u kriticky nemocných pacientů: srovnání standardního protokolu a počítačového algoritmu
- Příčiny akutního krvácení do horního trávicího traktu u pacientů s jaterní cirhózou
- Vliv etiologie syndromu diabetické nohy na lokalizaci defektů
- Sledování funkčních poruch mikrocirkulace laser dopplerem u pacientů s chronickou žilní nedostatečností třídy 2 dle CEAP klasifikace před a po operaci varixů
- Celiakia - častá príčina „idiopatickej osteoporózy“ premenopauzálnych a včasne postmenopauzálnych žien
- Dobutamínová záťažová echokardiografia vs SPECT pri diagnostikovaní ischemickej choroby srdca
- Diabetes mellitus a mikroalbuminurie
- Dnešný pohľad na riziká umelej pľúcnej ventilácie
- Waldenströmova makroglobulinemie - klinické projevy a diferenciální diagnostika a prognóza nemoci
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Dnešný pohľad na riziká umelej pľúcnej ventilácie
- Recidivující arytmie po katetrové ablaci původně paroxyzmální fibrilace síní a výsledky opakované ablace
- Waldenströmova makroglobulinemie - klinické projevy a diferenciální diagnostika a prognóza nemoci
- Diabetes mellitus a mikroalbuminurie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

